Карбонат натрия: хим. свойства и получение
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
Na2O + CO2 = Na2CO3
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3↓ + H2O
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
NaHCO3 + NaOH = Na2CO3 + H2O
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Na2CO3 + H2SO4 = 2Na2SO4 + CO2↑ +H2O.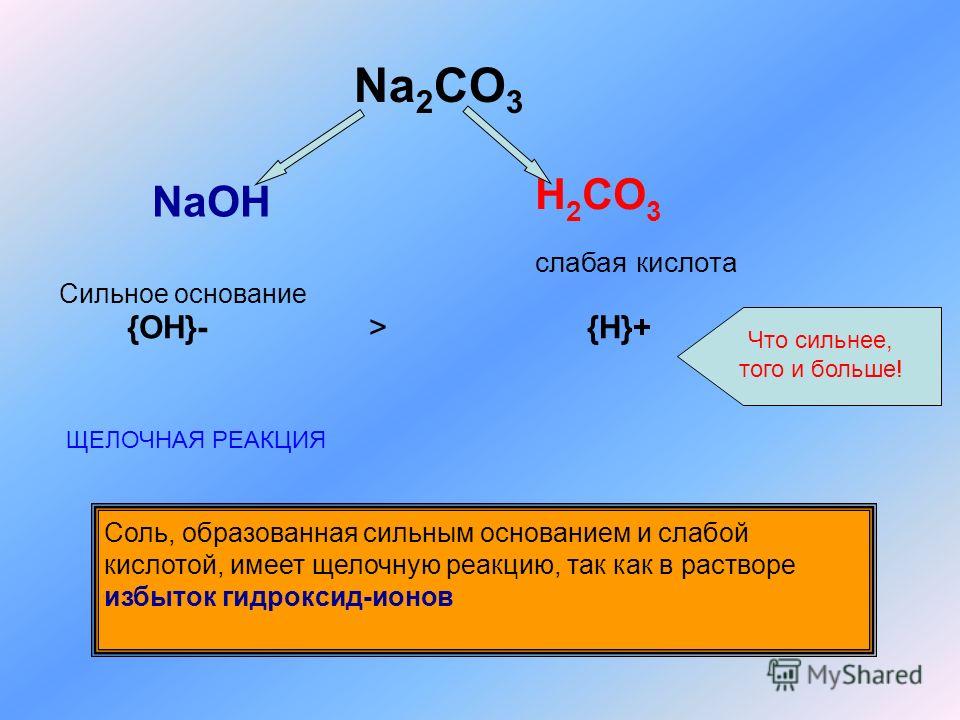
1. Карбонат натрия может реагировать с простыми веществами:
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом. При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
Na2CO3 + 3Cl2 = 5NaCl + NaClO3 + 3CO2↑
2. Карбонат натрия вступает в реакцию со многими сложными веществами:
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
Na2CO3 + H2O + CO2 ↔ 2NaHCO3↓
2. 2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
Na2CO3 + 2HCl = 2NaCl + CO2↑ +H2O
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой. Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
Na2CO3 + 2HF = 2NaF + H2O + CO2↑
2. 5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы. При этом образуются карбонат натрия и углекислый газ:
5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы. При этом образуются карбонат натрия и углекислый газ:
Na2CO3 + SO2 = Na2SO3 + CO2↑.
Понравилось это:
Нравится Загрузка…
ЩЕЛОЧЕЙ ПРОИЗВОДСТВО | это… Что такое ЩЕЛОЧЕЙ ПРОИЗВОДСТВО?
Толкование
- ЩЕЛОЧЕЙ ПРОИЗВОДСТВО
содовая промышленность, производство кальцинированной соды (карбоната натрия Na2CO3) и ряда аналогичных продуктов. В широком смысле слово «щелочь» относится к большому числу химических соединений, хорошо растворимых в воде и создающих в водном растворе высокую концентрацию гидроксид-ионов, например аммиаку, гидроксиду аммония и гашеной извести (гидроксиду кальция), которые были побочными продуктами устаревшего технологического процесса производства синтетической кальцинированной соды. Щелочи — растворимые активные вещества из более широкого класса оснований.
Щелочи — растворимые активные вещества из более широкого класса оснований.
Кальцинированная сода. Технический карбонат натрия Na2CO3 (кальцинированную соду) применяют главным образом в производстве стекла и химикатов. Около половины кальцинированной соды идет на изготовление стекла, около четверти — химикатов, 13% — мыла и моющих средств, 11% употребляется на такие цели, как изготовление целлюлозы и бумаги, рафинирование металлов и нефти, дубление кожи и очистка воды, а остальное поступает в продажу.
Процесс Сольве. Осуществленный в конце 1860-х годов двумя бельгийцами, братьями Эрнестом и Альфредом Сольве, аммиачный способ получения кальцинированной соды основан на реакции взаимодействия гидрокарбоната аммония с хлоридом натрия, в результате которой получаются хлорид аммония и гидрокарбонат натрия. На практике процесс проводят, вводя в почти насыщенный раствор хлорида натрия сначала аммиак, а потом диоксид углерода. Гидрокарбонат натрия выпадает в осадок, когда диоксид углерода вводится в раствор: Прокаливая отфильтрованный гидрокарбонат натрия, получают карбонат натрия и диоксид углерода, который используют повторно:
На практике процесс проводят, вводя в почти насыщенный раствор хлорида натрия сначала аммиак, а потом диоксид углерода. Гидрокарбонат натрия выпадает в осадок, когда диоксид углерода вводится в раствор: Прокаливая отфильтрованный гидрокарбонат натрия, получают карбонат натрия и диоксид углерода, который используют повторно:Экономичность процесса Сольве связана с тем, что аммиак регенерируется путем обработки раствора хлорида аммония оксидом кальция, который получают из карбоната кальция путем нагрева (при этом одновременно образуется также используемый в процессе диоксид углерода):
Хлорид кальция, образующийся в процессе извлечения аммиака, является важным побочным продуктом.
Электролизный процесс. Карбонат натрия можно также получить посредством электролизного процесса. Водяной пар и диоксид углерода запускаются в катодное отделение установки с камерой диафрагменного типа для электролиза растворов солей, где, взаимодействуя с едким натром, они превращают его в карбонат натрия.
Щелок. Наименование «щелок» (K2CO3, Na2CO3, NaOH) было присвоено продуктам, получаемым путем выщелачивания древесной золы. Она содержит приблизительно 70% карбоната калия (поташа), используемого в основном для изготовления мыла и стекла. Карбонат натрия (кальцинированная сода) — главный компонент золы некоторых растений (солянок). Путем обработки гашеной известью (гидроксидом кальция) карбонат натрия превращают в каустическую соду (гидроксид натрия), которая применяется для бытовых и промышленных целей под названием «щелок» или «каустик».
Поташ. Хотя в химической промышленности поташем называют главным образом карбонат калия (K2CO3), в сельском хозяйстве это наименование охватывает все соли калия, идущие на изготовление удобрений, но в основном хлорид калия (KCl) с небольшой примесью сульфата калия (K2SO4). Обычные способы получения поташа — электролизный процесс с участием гидроксида калия и более распространенный процесс на основе химического взаимодействия смеси хлорида калия и карбоната магния с диоксидом углерода. В результате этой реакции образуется нерастворимая двойная соль гидрокарбоната калия и карбоната магния, которая при нагревании разлагается на карбонаты калия и магния, воду и диоксид углерода. Карбонат калия применяется в производстве стекла, солей калия, красителей и чернил. Карбонат калия — важный компонент специальных стекол, например оптических и лабораторных.
В результате этой реакции образуется нерастворимая двойная соль гидрокарбоната калия и карбоната магния, которая при нагревании разлагается на карбонаты калия и магния, воду и диоксид углерода. Карбонат калия применяется в производстве стекла, солей калия, красителей и чернил. Карбонат калия — важный компонент специальных стекол, например оптических и лабораторных.
Каустическая сода (едкий натр). Гидроксид натрия NaOH получил свое название по причине сильного разъедающего действия на животные и растительные ткани. Каустическую соду получают либо путем электролиза раствора хлорида натрия (NaCl) с образованием гидроксида натрия и хлора, либо, реже, с помощью более старого способа, основанного на взаимодействии раствора кальцинированной соды с гашеной известью. Большое количество производимой в мире кальцинированной соды используется для получения каустической соды. Взаимодействие раствора кальцинированной соды с гашеной известью. Каустическую соду получают из кальцинированной на установке периодического или непрерывного действия.
Карбонат кальция выпадает в осадок, а раствор гидроксида натрия отводится в коллектор.
Существуют установки двух типов: с погруженной или непогруженной диафрагмой. Камера установки с погруженной диафрагмой целиком заполняется электролитом. Соляной раствор втекает в анодное отделение, где из него выделяется хлор, а раствор каустической соды заполняет катодное отделение. В установке с непогруженной диафрагмой раствор каустической соды отводится из катодного отделения по мере образования, так что камера оказывается пустой. В некоторых установках с непогруженной диафрагмой в пустое катодное отделение напускается водяной пар, чтобы облегчить удаление каустической соды и поднять температуру. В диафрагменных установках получается раствор, содержащий как каустическую соду, так и соль. Большая часть соли выкристаллизовывается, когда концентрация каустической соды в растворе доводится до стандартного значения 50%. Такой «стандартный» электролизный раствор содержит 1% хлорида натрия. Продукт электролиза пригоден для многих применений, например для производства мыла и чистящих препаратов.
Электролизные методы. Когда концентрированный раствор хлорида натрия подвергается электролизу, образуются хлор и гидроксид натрия, но они реагируют друг с другом с образованием гипохлорита натрия — отбеливающего вещества. Этот продукт, в свою очередь, особенно в кислых растворах при повышенных температурах, окисляется в электролизной камере до перхлората натрия. Чтобы избежать этих нежелательных реакций, электролизный хлор должен быть пространственно отделен от гидроксида натрия. В большинстве промышленных установок, используемых для получения электролизной каустической соды, это осуществляется с помощью диафрагмы, помещенной вблизи анода, на котором образуется хлор.
 Однако для производства искусственного волокна и пленки требуется каустическая сода высокой степени очистки, содержащая менее 1% хлорида натрия (соли). «Стандартный» жидкий каустик можно надлежащим образом очистить методами кристаллизации и осаждения. Непрерывное разделение хлора и каустика можно также осуществить в установке с ртутным катодом. Металлический натрий образует с ртутью амальгаму, которая отводится во вторую камеру, где натрий выделяется и реагирует с водой, образуя каустик и водород. Хотя концентрация и чистота соляного раствора для установки с ртутным катодом более важны, чем для установки с диафрагмой, в первой получается каустическая сода, пригодная для производства искусственного волокна. Ее концентрация в растворе составляет 50-70%. Более высокие затраты на установку с ртутным катодом оправдываются получаемой выгодой.
Однако для производства искусственного волокна и пленки требуется каустическая сода высокой степени очистки, содержащая менее 1% хлорида натрия (соли). «Стандартный» жидкий каустик можно надлежащим образом очистить методами кристаллизации и осаждения. Непрерывное разделение хлора и каустика можно также осуществить в установке с ртутным катодом. Металлический натрий образует с ртутью амальгаму, которая отводится во вторую камеру, где натрий выделяется и реагирует с водой, образуя каустик и водород. Хотя концентрация и чистота соляного раствора для установки с ртутным катодом более важны, чем для установки с диафрагмой, в первой получается каустическая сода, пригодная для производства искусственного волокна. Ее концентрация в растворе составляет 50-70%. Более высокие затраты на установку с ртутным катодом оправдываются получаемой выгодой.
Применение. Наиболее важные области потребления каустической соды (перечислены в порядке уменьшения потребляемого количества) — химическое производство; переработка нефти; производство искусственного волокна и пленки, целлюлозы и бумаги, алюминия, моющих средств и мыла; обработка тканей; рафинирование растительного масла; регенерация резины.
Каустический поташ (едкое кали). Соединения калия менее распространены и поэтому более дороги, чем соответствующие соединения натрия. Они применяются только в тех случаях, когда необходим присущий им комплекс физико-химических свойств, не обеспечиваемый соединениями натрия. Гидроксид калия KOH, в обиходе называемый каустическим поташем, не является исключением из этого правила. Подобно каустической соде, каустический поташ можно получить путем обработки раствора карбоната калия K2CO3 гашеной известью Ca(OH)2 или электролизом раствора хлорида калия. Этот материал продается в виде массивных блоков, хлопьевидной массы, гранул или небольших кусков, а также 40 и 50%-х растворов.
Применение. Главная область применения гидроксида калия — производство мягкого мыла. Смеси калиевых и натриевых мыл используются для получения жидких мыл, моющих средств, шампуней, кремов для бритья, отбеливателей и некоторых фармацевтических препаратов. Другая важная область применения каустического поташа — производство различных солей калия. Например, перманганат калия получают путем сплавления диоксида марганца с каустическим поташем и последующего окисления образовавшегося манганата калия в электролизной камере. Дихромат калия можно получить аналогичным способом, хотя чаще его изготовляют сплавлением тонко измельченной хромитной руды (FeOЧCr2O3) с карбонатом или гидроксидом калия и воздействием на полученный хромат кислотой с образованием дихромата калия. Каустический поташ также применяют вместе с каустической содой в производстве многих красителей и других органических соединений.
Например, перманганат калия получают путем сплавления диоксида марганца с каустическим поташем и последующего окисления образовавшегося манганата калия в электролизной камере. Дихромат калия можно получить аналогичным способом, хотя чаще его изготовляют сплавлением тонко измельченной хромитной руды (FeOЧCr2O3) с карбонатом или гидроксидом калия и воздействием на полученный хромат кислотой с образованием дихромата калия. Каустический поташ также применяют вместе с каустической содой в производстве многих красителей и других органических соединений.
См. также
МЫЛО;
МОЮЩИЕ СРЕДСТВА;
ЦЕЛЛЮЛОЗА;
ЦЕЛЛЮЛОЗНО-БУМАЖНАЯ ПРОМЫШЛЕННОСТЬ.
ЛИТЕРАТУРА
Танабе К. Твердые кислоты и основания. М., 1973 Позина М.Б., Балабанович Я.К. Технология глинозема и щелочей. Л., 1979Энциклопедия Кольера. — Открытое общество. 2000.
Игры ⚽ Поможем решить контрольную работу
- НЕПРЕРЫВНЫЕ ДРОБИ
- СПЛАВЫ
Полезное
очистка — Как отделить карбонат натрия от гидроксида натрия?
$\begingroup$
Мне достался очиститель канализации в виде пыли, состоящей из $\ce{Na2CO3}$ и $\ce{NaOH}$. Я хотел извлечь $\ce{NaOH}$, поэтому попытался нагреть смесь, чтобы просто расплавить гидроксид натрия, но это не сработало, как ожидалось. Есть ли простой способ сделать это?
Я хотел извлечь $\ce{NaOH}$, поэтому попытался нагреть смесь, чтобы просто расплавить гидроксид натрия, но это не сработало, как ожидалось. Есть ли простой способ сделать это?
- очистка
- методы разделения
$\endgroup$
1
$\begingroup$
Есть форум, на котором обсуждается похожая проблема выделения гидроксида натрия и карбоната натрия из очистителя канализации. Решение взято оттуда (немного отредактировано):
Это относительно легко, потому что карбонат натрия практически нерастворим в 50% растворе гидроксида натрия, поэтому фильтр типа стеклянной фритты необходим для удаления нерастворимого карбоната натрия. Самый коммерческий гидроксид натрия содержит лишь небольшое количество карбоната натрия из поглощение атмосферного $\ce{CO2}$. Так, для безкарбонатного натрия раствора гидроксида, приготовьте один литр за раз, скажем, 60% раствора.
Для этого добавьте около 300 г гранул гидроксида натрия в хлопья. 500 мл ледяной воды в большом стакане и перемешайте до практически растворяются, накрывают и оставляют остывать. Дать остыть примерно до 20-25 С. и добавьте еще 300 г гидроксида натрия и перемешайте, пока большая часть не растворится. растворяется (при втором добавлении выделяется гораздо меньше тепла), разбавляется до 1 литра, перелейте в толстостенную полиэтиленовую бутылку емкостью 1 л и оставьте выдержать около 1 месяца в прохладном месте, а затем сцедить прозрачный раствор гидроксида натрия.
Если материал содержит, скажем, 50 % карбоната натрия, выполните следующие действия:
Добавьте 500 г смеси солей натрия в 500 мл ледяной воды, перемешайте. взвеси периодически в течение нескольких часов, а затем фильтровать через воронку из стеклянной фритты (необходима установка для вакуумной фильтрации) и промойте торт с небольшим количеством воды, скажем, 50-100 мл, чтобы удалить большую часть оставшаяся каустическая сода; некоторое количество карбоната натрия растворится, но это выпадет в осадок при следующем добавлении.
Торт будет почти чистым карбонат натрия, но вы всегда можете обработать его насыщенным натрием раствор бикарбоната, чтобы убедиться, что он есть.
Прозрачный фильтрат следует поместить в калиброванный сосуд, а другой Добавляют 500 г материала и снова периодически перемешивают в течение пары ч., затем фильтруют и промывают, как и раньше. Надеюсь, должно быть около 700-800 мл очень крепкого раствора гидроксида натрия. Поместите его в полиэтиленовую бутылку и дайте постоять месяц, чтобы карбонат натрия может выкристаллизовываться, декантируйте прозрачный раствор и разбавляйте по мере необходимости.
ПРИМЕЧАНИЕ:
60% раствор едкого натра довольно вязкий и не фильтр без всасывания даже на довольно крупной фритте, 50% все равно довольно вязкий и трудно фильтруемый.
Карбонат натрия, кристаллизуется, тонет очень медленно, следовательно, длительное время стояния.
Карбонат натрия довольно медленно растворяется в воде по некоторым причинам при вакуумной фильтрации время пребывания промывочной воды будет на самом деле растворяет очень мало карбоната натрия, слишком много промывочной воды разбавит раствор ниже 50% и сделает карбонат более растворимый.
Горячий 50% раствор едкого натра чрезвычайно агрессивен к коже! При работе с крепкими растворами гидроксида натрия соблюдайте осторожность. миску, полную разбавленного лимонного сока, на всякий случай.
Существуют и другие методы, такие как обработка более разбавленного раствора гашеная известь, фильтрация (сложно, так как осадок мелкий зернистый) и испаряющийся вниз.
$\endgroup$
2
Зарегистрируйтесь или войдите
Зарегистрироваться через Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Как правильно контролировать концентрацию повторно используемого каустика
Переработка и повторное использование каустика (гидроксида натрия) является обычным явлением в пищевой промышленности, производстве напитков и молочной промышленности, поскольку это снижает нагрузку на сточные воды, является более устойчивым и экологически безопасным, а также снижает затраты.
Свежий гидроксид натрия добавляется к восстановленному раствору до тех пор, пока не будет достигнута необходимая сила чистящего химического состава. Типичный метод определения крепости заключается в титровании образца используемого раствора кислотой известной концентрации, например Серная или соляная кислота с использованием фенолфталеина в качестве индикатора. Крепость гидроксида натрия выражается в процентах гидроксида натрия (% NaOH) или в граммах гидроксида натрия на 100 мл.
В процессе регенерации каустика раствор может подвергаться воздействию углекислого газа в воздухе.
Когда это происходит, раствор гидроксида натрия превращается в карбонат натрия, что делает раствор неэффективным в качестве чистящего средства.
2NaOH + CO2 —> Na2CO3 + h3O
К сожалению, простое титрование фенолфталеином не различает карбонат натрия и гидроксид натрия и может дать ложные результаты теста, что повлияет на эффективность очищающего раствора.
В ситуациях, когда подозревается присутствие карбонатов, очень важно различать, какая часть раствора на самом деле представляет собой гидроксид натрия (свободный каустик), а какая часть — на самом деле карбоната натрия. Простую модификацию титрования фенолфталеина можно внести, введя второй индикатор: бромкрезоловый зеленый.
Метод тестирования восстановленного каустика
Приведенный ниже метод, взятый из базы данных Diversey Application Methods, точно описывает, как использовать эти индикаторы и титрующую кислоту.
Специалисты сектора Diversey могут выполнить описанную ниже процедуру или обучить персонал на месте различать концентрации гидроксида натрия (каустика) и карбоната натрия в используемом растворе.
- Получите 10 мл образца раствора.
- Добавьте 3 капли индикатора фенолфталеина и перемешайте. Раствор должен быть розовым.
- Добавляйте 2,56N серную кислоту по каплям, перемешивая после каждого добавления и подсчитывая количество капель, пока цвет не изменится с розового на бесцветный.
- Запишите объем, когда раствор станет бесцветным (А).
- Добавьте 3 капли бромкрезолового зеленого и перемешайте. Теперь раствор станет синим, если в нем присутствуют карбонаты.
- Начиная отсчет с нуля, добавляйте 2,56N серную кислоту по каплям при перемешивании, пока цвет раствора не изменится с синего на желтый.
- Запишите объем (B)
Расчет:
% свободной щелочи (в пересчете на NaOH) вес/объем = (A — B) x 1,024
Карбонат % (в пересчете на Na2CO3) вес/объем = (B) x 2,714
Другие варианты этого теста могут встречаться в полевых условиях. Одним из наиболее распространенных является использование хлорида бария.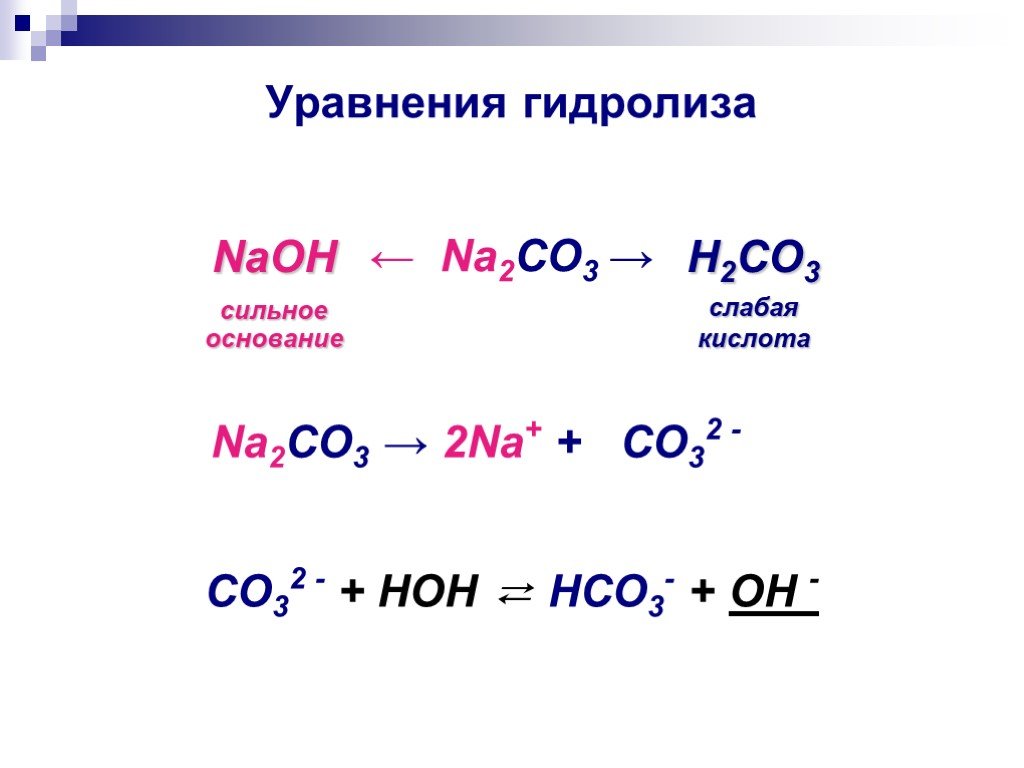 В этом методе берутся две пробы, обозначенные буквами А и В, по 10,0 мл каждая. К образцу А добавляют хлорид бария. Если присутствует какой-либо карбонат, он выпадет в осадок в виде карбоната бария, оставив после себя любую свободную щелочь.
В этом методе берутся две пробы, обозначенные буквами А и В, по 10,0 мл каждая. К образцу А добавляют хлорид бария. Если присутствует какой-либо карбонат, он выпадет в осадок в виде карбоната бария, оставив после себя любую свободную щелочь.
Образец А титруют стандартной кислотой с использованием фенолфталеина в качестве индикатора, определяя содержание гидроксида. Образец В титруют стандартной кислотой с использованием бромфенолового синего в качестве индикатора. Вычитая объем кислоты титрования A из объема кислоты B, можно получить карбонат.
Измерение концентрации гидроксида натрия с помощью электропроводности
В полевых условиях концентрацию гидроксида натрия (свободной щелочи) можно измерить косвенно с помощью электропроводности.
Использование электропроводности для записи концентрации свободной щелочи допустимо, если используемый раствор в основном представляет собой гидроксид натрия с небольшим количеством карбоната натрия, например, используется раствор 3% гидроксида натрия (NaOH) и 1% карбоната натрия.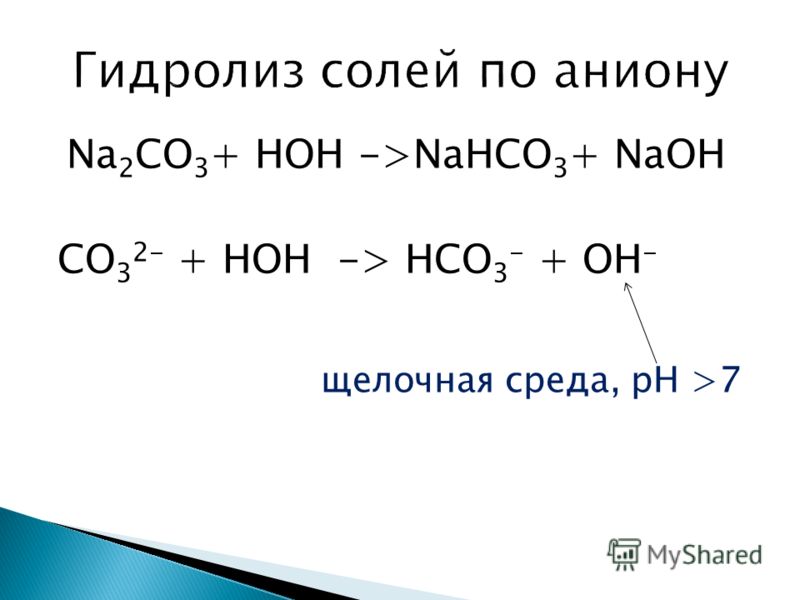

 Щелочи — растворимые активные вещества из более широкого класса оснований.
Щелочи — растворимые активные вещества из более широкого класса оснований. На практике процесс проводят, вводя в почти насыщенный раствор хлорида натрия сначала аммиак, а потом диоксид углерода. Гидрокарбонат натрия выпадает в осадок, когда диоксид углерода вводится в раствор: Прокаливая отфильтрованный гидрокарбонат натрия, получают карбонат натрия и диоксид углерода, который используют повторно:
На практике процесс проводят, вводя в почти насыщенный раствор хлорида натрия сначала аммиак, а потом диоксид углерода. Гидрокарбонат натрия выпадает в осадок, когда диоксид углерода вводится в раствор: Прокаливая отфильтрованный гидрокарбонат натрия, получают карбонат натрия и диоксид углерода, который используют повторно:
 В результате этой реакции образуется нерастворимая двойная соль гидрокарбоната калия и карбоната магния, которая при нагревании разлагается на карбонаты калия и магния, воду и диоксид углерода. Карбонат калия применяется в производстве стекла, солей калия, красителей и чернил. Карбонат калия — важный компонент специальных стекол, например оптических и лабораторных.
В результате этой реакции образуется нерастворимая двойная соль гидрокарбоната калия и карбоната магния, которая при нагревании разлагается на карбонаты калия и магния, воду и диоксид углерода. Карбонат калия применяется в производстве стекла, солей калия, красителей и чернил. Карбонат калия — важный компонент специальных стекол, например оптических и лабораторных.

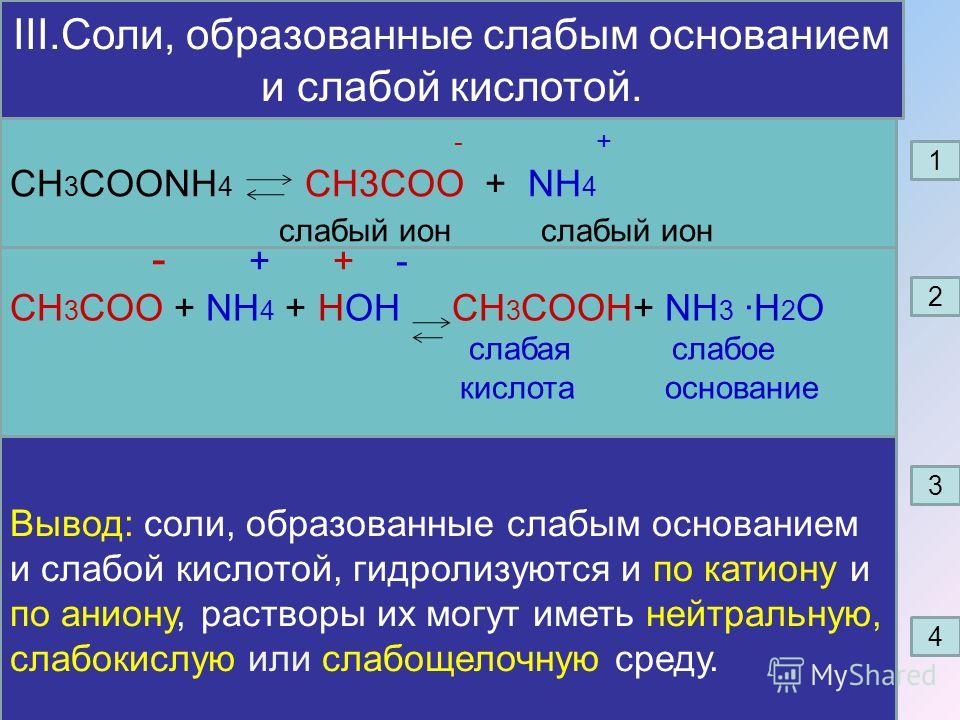

 Например, перманганат калия получают путем сплавления диоксида марганца с каустическим поташем и последующего окисления образовавшегося манганата калия в электролизной камере. Дихромат калия можно получить аналогичным способом, хотя чаще его изготовляют сплавлением тонко измельченной хромитной руды (FeOЧCr2O3) с карбонатом или гидроксидом калия и воздействием на полученный хромат кислотой с образованием дихромата калия. Каустический поташ также применяют вместе с каустической содой в производстве многих красителей и других органических соединений.
Например, перманганат калия получают путем сплавления диоксида марганца с каустическим поташем и последующего окисления образовавшегося манганата калия в электролизной камере. Дихромат калия можно получить аналогичным способом, хотя чаще его изготовляют сплавлением тонко измельченной хромитной руды (FeOЧCr2O3) с карбонатом или гидроксидом калия и воздействием на полученный хромат кислотой с образованием дихромата калия. Каустический поташ также применяют вместе с каустической содой в производстве многих красителей и других органических соединений. Для этого добавьте около 300 г гранул гидроксида натрия в хлопья.
500 мл ледяной воды в большом стакане и перемешайте до практически
растворяются, накрывают и оставляют остывать. Дать остыть примерно до 20-25 С.
и добавьте еще 300 г гидроксида натрия и перемешайте, пока большая часть не растворится.
растворяется (при втором добавлении выделяется гораздо меньше тепла), разбавляется
до 1 литра, перелейте в толстостенную полиэтиленовую бутылку емкостью 1 л и оставьте
выдержать около 1 месяца в прохладном месте, а затем сцедить
прозрачный раствор гидроксида натрия.
Для этого добавьте около 300 г гранул гидроксида натрия в хлопья.
500 мл ледяной воды в большом стакане и перемешайте до практически
растворяются, накрывают и оставляют остывать. Дать остыть примерно до 20-25 С.
и добавьте еще 300 г гидроксида натрия и перемешайте, пока большая часть не растворится.
растворяется (при втором добавлении выделяется гораздо меньше тепла), разбавляется
до 1 литра, перелейте в толстостенную полиэтиленовую бутылку емкостью 1 л и оставьте
выдержать около 1 месяца в прохладном месте, а затем сцедить
прозрачный раствор гидроксида натрия. Торт будет почти чистым
карбонат натрия, но вы всегда можете обработать его насыщенным натрием
раствор бикарбоната, чтобы убедиться, что он есть.
Торт будет почти чистым
карбонат натрия, но вы всегда можете обработать его насыщенным натрием
раствор бикарбоната, чтобы убедиться, что он есть.
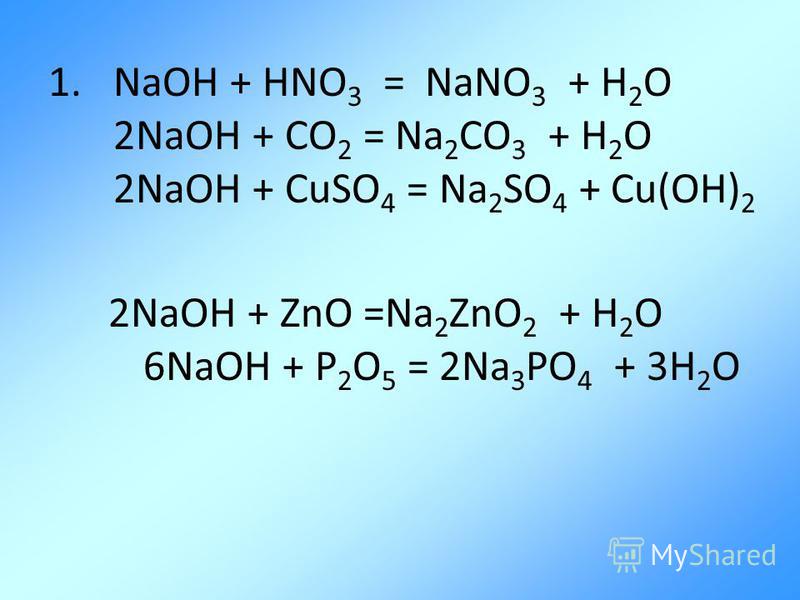 Когда это происходит, раствор гидроксида натрия превращается в карбонат натрия, что делает раствор неэффективным в качестве чистящего средства.
Когда это происходит, раствор гидроксида натрия превращается в карбонат натрия, что делает раствор неэффективным в качестве чистящего средства.