Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
В каком году была сформулирована теория — предшественница кислородной теории горения.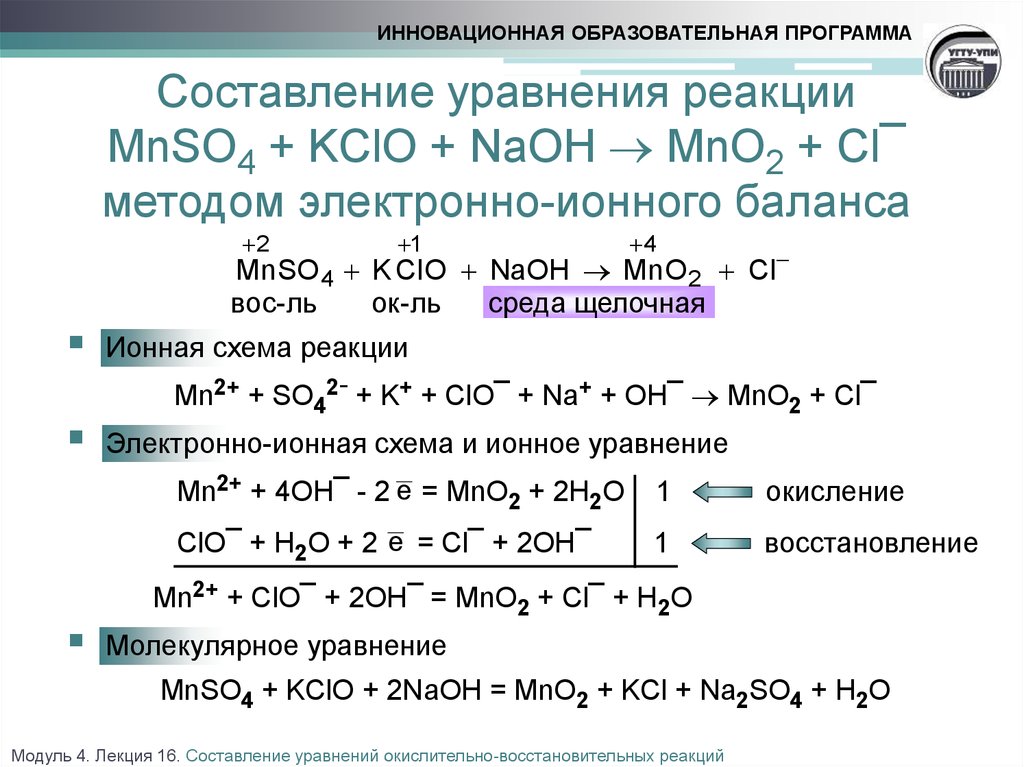
Смесь нитратов натрия и серебра прокалили. При обработке твердого остатка водой объемом 124,2 мл часть его растворилась и был получен 10% раствор с…
В чем ошибся Джон Дальтон?
NaHCO3 NaOH напишите пожалуйста молекулярные,…
Пользуйтесь нашим приложением
Классификация и номенклатура неорганических соединений (лекция № 2)
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Лекция № 2 Классификация и номенклатура неорганических соединений
Неорганическиевещества
Простые
Металлы
Сложные
Неметаллы
Сложные Вещества
(по составу)
Бинарные
соединения
Гидриды
Соли
Бориды
Гидроксиды
Карбиды
Кислоты
Силициды
Нитриды
Фосфиды
Оксиды
Пероксиды
Озониды
Халькогениды
Сульфиды
Селениды
Теллуриды
Галогениды
Фториды
Трехэлементные
соединения
Хлориды
Бромиды
Йодиды
Основания
Амфотерные
гидроксиды
Интерметаллические
соединения
Комплексные
соединения
Сложные вещества
(по функциональным признакам)
Оксиды
Кислоты
Основания
Соли
5.
 ОксидыОксиды – это сложные вещества, состоящие из двух элементов,
ОксидыОксиды – это сложные вещества, состоящие из двух элементов,одним из которых является кислород, причем атомы кислорода
не связаны между собой.
BaO – оксид бария
BaO2 – пероксид
бария
O
Ba = O
Ba
O
Графическая формула
Алгоритм
1.
2.
3.
4.
Определить валентность всех элементов.
Если число атомов кислорода нечетное,
записать один атом кислорода между атомами
элементов.
Дописать недостающие атомы кислорода.
Проверить правильность составления
графической формулы – число черточек должно
соответствовать валентности элемента.
Ca+2O-2
Ca = O
Na+12O-2
Na – O — Na
S+4O-22
O = S = O
Al+32O-23
O = Al – O – Al = O
O
P+52O-25
O
P – O – P
O
O
Оксиды
Солеобразующие
Основные оксиды
Оксиды щелочных
и щелочноземельных
Металлов (Na2O, CaO, BaO),
а также металлов с
переменной валентностью
в низшей степени
окисления.

Несолеобразующие
(СО, NO)
Амфотерные оксиды Кислотные оксиды
BeO, ZnO, Al2O3, Cr2O3,
а также оксиды металлов с
переменной валентностью
в промежуточной
степени окисления.
Оксиды неметаллов
(CO2, SO3, P2O5),
а также металлов с
переменной валентностью
в высшей степени
окисления.
Cr
0
+2
+3
+4
+5
+6
CrO
Cr2O3
CrO2
Cr2O5
CrO3
Основной
оксид
Амфотерные
оксиды
Кислотный
оксид
Если неметалл проявляет переменную валентность, то все его оксиды – кислотные.
9. Генетический ряд
В генетическом ряду оксиды занимают второе место послеметалла и неметалла.
Генетические ряды
Na
Al
Металл
Na2O
S
Неметалл
Амфотерный металл
Al2O3
SO3
Основной оксид
Амфотерный оксид
Кислотный оксид
NaOH
Основание
Al(OH)3
Амфотерный гидроксид
h3SO4
NaCl
AlCl3
Na2SO4
Соль
Соль
Кислота
Соль
10.
 Способы получения оксидовПолучить оксид можно из веществ его генетического ряда.
Способы получения оксидовПолучить оксид можно из веществ его генетического ряда.S
1. S + O2 SO2
2. h3SO3 SO2 + h3O
3. CaSO3 + h3SO4 CaSO4 + SO2 + h3O
SO2
h3SO3
CaSO3
1. Ca + O2 CaO
2. Ca(OH)2 CaO + h3O
3. CaCO3 CaO + CO2
Ca
CaO
Ca(OH)2
CaCO3
12. Химические свойства оксидов
Все неорганические вещества испытывают превращения двух видов:I.
Превращения внутри генетического ряда (разложение, реакция с водой, восстановление,
реакция с кислородом).
II. Взаимодействие с веществами противоположного генетического ряда.
Na
I. 1) Na2O + h3O NaOH
II. 1) Na2O + SO3 Na2SO4
2) Na2O + h3SO4 Na2SO4 + h3O
Na2O
SO3
NaOH
h3SO4
Na2CO3
CuSO4
S
13. Амфотерные оксиды Амфотерные оксиды обладают свойствами и кислотных и основных оксидов.
NaS
Al
Na2O
Al2O3
NaOH
Al(OH)3
(h4AlO3)
Na2CO3
AlCl3
(Na3AlO3)
SO3
h3SO4
CuSO4
14.
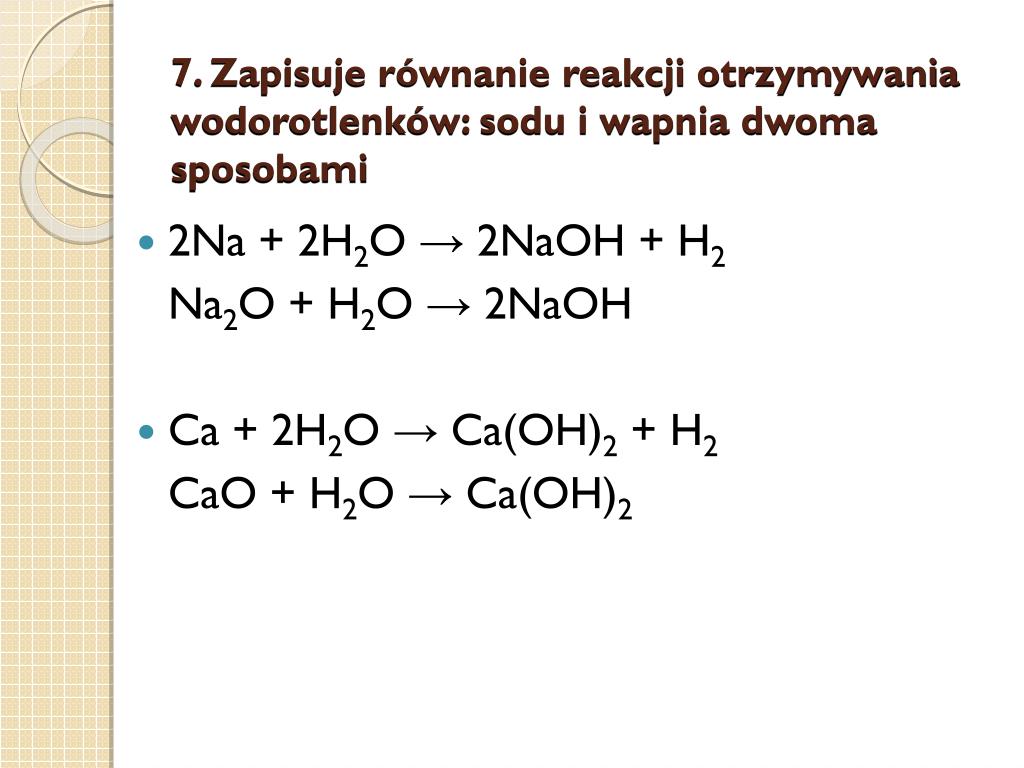 КислотыКислоты – это сложные вещества, диссоциирующие на
КислотыКислоты – это сложные вещества, диссоциирующие накатионы водорода и анионы кислотного остатка.
Графическая формула
Алгоритм
1.
2.
3.
4.
5.
Определить валентность всех элементов.
Друг под другом записать атомы
водорода, способные замещаться на
металл.
Через
кислород
соединить
атомы
водорода
с
кислотообразующим
элементом.
Дописать недостающие атомы
кислорода.
Проверить правильность составления
графической формулы – число черточек
должно соответствовать валентности
элемента.
h3CO3
H+12C+4O-23
H – O
C = O
H — O
h4PO4
H+13P+5O-24
H – O
H – O — P = O
H — O
HMnO4
H+1Mn+7O-24
O
H – O – Mn = O
O
16. Правила наименования кислот
1.2.
3.
К корню русского названия кислотообразующего элемента
добавляется окончание «-ная», «-вая», если степень
окисления максимальна (равна номеру группы) или
окончание «-истая», если степень окисления минимальная.

НCl+1O – хлорноватистая кислота
HCl+7O4 – хлорная кислота
Если при одной степени окисления элемент образует две
кислоты, то к названию кислоты, содержащей большее
число атомов кислорода добавляется приставка «орто»,
содержащей меньшее число атомов кислорода – «мета».
h4P+5O4 – ортофосфорная кислота
HP+5O3 – метафосфорная кислота
Если в состав кислоты входит два и более
кислотообразующих элементов, то число их указывается с
помощью русского числительного.
h5P2O7 — двуфосфорная кислота
Кислоты
(по числу атомов
водорода)
(по числу атомов
кислорода)
(по силе)
(по летучести)
(по растворимости)
Одноосновные
HCl
HNO3
HF
Бескислородные
H 2S
HCl
HI
Cильные
HCl
HNO3
h3SO4
Летучие
HCl
HBr
HI
Растворимые
HCl
h3SO4
HNO3
Многоосновные
h4PO4
h3SO4
h4BO3
Кислородсодержащие
h3CO3
HNO2
Средние
h3SO3
h4PO4
Нелетучие
h4PO4
h3SO4
h3SiO3
Малорастворимые
h4BO3
h3SiO3
Слабые
H 2S
h3CO3
HNO2
18.
 Способы получения кислотКислоты входят в генетический ряд неметалла. Получить их
Способы получения кислотКислоты входят в генетический ряд неметалла. Получить ихможно из веществ своего генетического ряда.
С
1. CO2 + h3O h3CO3
2. CaCO3 + HCl CaCl2 + CO2 + h3O
CO2
h3CO3
CaCO3
1. h3 + Cl2 HCl
2. NaCl + h3SO4 HCl + Na2SO4
Сl
HCl
NaCl
20. Химические свойства кислот
NaI. 1) h3SO4 SO3 + h3O
II. 1) Na + h3SO4 Na2SO4 + h3
2) Na2O + h3SO4 Na2SO4 + h3O
3) NaOH + h3SO4 Na2SO4 + h3O
4) Na2CO3 + h3SO4 Na2SO4 + CO2 + h3O
Na2O
SO3
NaOH
h3SO4
Na2CO3
CuSO4
S
21. Основания
Основания – это сложные вещества, диссоциирующие накатионы металла и гидроксид — ионы.
Графическая формула
Алгоритм
1.
2.
3.
4.
По числу гидроксид – ионов определить
валентность металла.
Записать символ металла с числом
черточек соответствующих валентности.
Дописать гидроксид — ионы.
Проверить правильность составления
графической формулы – число черточек
должно соответствовать валентности
элемента.

NaOH
Na+1OH
Cu(OH)2
Cu+2(OH)2
Al(OH)3
Al+3(OH)3
Na – O — H
O – H
Cu
O — H
O – H
Al – O – H
O — H
Основания
(по растворимости)
(по силе)
Растворимые
(по числу
гидроксид – ионов)
(гидроксиды щелочных
и щелочноземельных
Металлов)
Сильные
(растворимые)
Однокислотные
NaOH, KOH
Нерастворимые
Слабые
Многокислотные
Fe(OH)3, Cu(OH)2
24. Способы получения оснований а) растворимые основания
Na1. Na + h3O NaOH + h3
2. Na2O + h3O NaOH
3. Na2CO3 + Ba(OH)2 NaOH + BaCO3
Na2O
NaOH
Na2CO3
25. б) нерастворимые основания
1. CuSO4 + NaOH Cu(OH)2 + Na2SO4Cu
CuO
Cu(OH)2
CuSO4
26. Химические свойства оснований а) растворимые основания
NaI. 1) NaOH Na2O + h3O
II. 1) NaOH + S Na2SO4 + Na2S + h3O
2) NaOH + SO3 Na2SO4 + h3O
3) NaOH + h3SO4 Na2SO4 + h3O
4) NaOH + CuSO4 Na2SO4 + Cu(OH)2
Na2O
SO3
NaOH
h3SO4
Na2CO3
CuSO4
S
27.
 б) нерастворимые основанияI. 1) Cu(OH)2 CuO + h3O
б) нерастворимые основанияI. 1) Cu(OH)2 CuO + h3OII. 1) Cu(OH)2 + SO3 CuSO4 + h3O
2) Cu(OH)2 + h3SO4 CuSO4 + h3O
Cu
S
CuO
SO3
Cu(OH)2
h3SO4
CuSO4
Na2SO4
28. Амфотерные гидроксиды
I. 1) Al(OH)3 Al2O3 + h3OII. 1) Al(OH)3 + SO3 Al2(SO4)3 + h3O
2) Al(OH)3 + h3SO4 Al2(SO4)3 + h3O
3) Al(OH)3 + NaOH NaAlO2 + h3O (сплавление)
4) Al(OH)3 + NaOH Na3AlO3 + h3O (в растворе)
5) Al(OH)3 + NaOH Na3[Al(OH)6] (в растворе)
Na
S
Al
Na2O
Al2O3
NaOH
Al(OH)3
(h4AlO3)
h3SO4
Na2CO3
AlCl3
(Na3AlO3)
CuSO4
SO3
Соли
Средние
Na2CO3
Кислые
NaHSO4
Основные
СuOHCl
Двойные
KAl(SO4)2
Комплексные
K3[Fe(CN)6]
Графическая формула
Алгоритм
1.
2.
3.
4.
5.
Определить валентность всех элементов.
Друг под другом записать графические
формулы кислотных остатков.
Слева дописать атомы металла.
Атомы металла соединить с кислотными
остатками с учетом валентности.

Проверить правильность составления
графической формулы – число черточек
должно соответствовать валентности
элемента.
31. Средние соли
Средние соли – это продукты полного замещения гидроксид – ионовв молекуле основания кислотными остатками, или продукты
полного замещения катионов водорода в молекуле кислоты
атомами металла.
1.
2.
3.
4.
Правила наименования
Названия солей бескислородных кислот составляется по правилам
наименования бинарных соединений.
Соли, содержащие остатки кислородсодержащих кислот называют по
следующему правилу: к корню латинского названия кислотообразующего
элемента добавляют окончание «-ат», если степень окисления
максимальна и окончание «-ит», если степень окисления ниже
максимальной.
Na2Se+6O4 – селенат натрия
Na2Se+4O3 – селенит натрия
Если в составе соли несколько кислотообразующих элементов, то число
их указывается с помощью греческого числительного.
Na2Cr2O7 – дихромат натрия
По международной номенклатуре сначала с помощью греческого
числительного называется число атомов кислорода («оксо»), затем
называют кислотообразующий элемент с окончанием «-ат» не зависимо
от степени окисления.

NaClO – оксохлорат натрия (гипохлорит натрия)
NaClO2 – диоксохлорат натрия (хлорит натрия)
NaClO3 – триоксохлорат натрия (хлорат натрия)
NaClO4 – тетраоксохлорат натрия (перхлорат натрия)
Na2CO3
Na+12C+4O-23
Fe2(SO4)3
Fe+32 (S+6O-24)3
Na – O
C = O
Na — O
O
O
Fe – O — S = O
O
O
O – S = O
Fe – O
O
O – S = O
33. Способы получения средних солей
NaNO3Na
Na2O
N2
N2O5
NaOH
HNO3
Na2CO3
Cu(NO3)2
1) Na2O + N2O5 NaNO3
2) NaOH + HNO3 NaNO3 + h3O
3) Na2CO3 + Cu(NO3)2 NaNO3 + CuCO3
4) Na2CO3 + HNO3 NaNO3 + h3CO3
5) Cu(NO3)2 + NaOH NaNO3 + Cu(OH)2
6) NaOH + N2O5 NaNO3 + h3O
7) HNO3 + Na2O NaNO3 + h3O
8) Na + HNO3 NaNO3 + N2 + h3O
9) Na + Cu(NO3)2 NaNO3 + Cu
35. Химические свойства средних солей
I. 1) CaCl2 + NaOH CaOHCl + NaClII. 1) CaCl2 + h3SO4 CaSO4 + HCl
2) CaCl2 + CuSO4 CaSO4 + CuCl2
Ca
CaO
SO3
Ca(OH)2
h3SO4
CaOHCl
Cu(HSO4)2
CaCl2
CuSO4
S
36.
 Кислые солиКислые соли – это продукты неполного замещения атомов
Кислые солиКислые соли – это продукты неполного замещения атомовводорода в молекуле кислоты атомами металла.
Правила наименования
1. По международной номенклатуре сначала с помощью греческого
числительного указывается число атомов водорода («гидро»),
затем называется анион и называется катион.
Nah3PO4 – дигидрофосфат натрия
Na2HPO4 – гидрофосфат натрия
NaHCO3
Na+1H+1C+4O-23
H – O
C = O
Na — O
H – O
O – P = O
Fe — O
O
Fe2(HPO4)3
H — O – P = O
Fe+32(H+1P+5O-24)3
O
Fe — O
O – P = O
H — O
38. Способы получения кислых солей
PP2O5
1) h4PO4 + Na Nah3PO4 + h3
2) h4PO4 + Na2O Nah3PO4 + h3O
3) h4PO4 + NaOH Nah3PO4 + h3O
4) Na3PO4 + h4PO4 Nah3PO4
h4PO4
Nah3PO4
Na3PO4
39. Химические свойства кислых солей
PP2O5
1) Nah3PO4 + h3SO4 Na2SO4 + h4PO4
2) Nah3PO4 + NaOH Na3PO4 + h3O
h4PO4
Nah3PO4
Na3PO4
40. Основные соли
Основные соли – это продукты неполного замещениягидроксид – ионов в молекуле основания кислотными
остатками.

Правила наименования
1. По международной номенклатуре сначала с помощью греческого
числительного указывается число гидроксид — ионов
(«гидроксо»), затем называется анион и называется катион.
Fe(OH)2NO3 – дигидроксонитрат железа (III)
(нитратдигидроксид железа (III) )
FeOH(NO3)2 – гидроксонитрат железа (III)
(нитратгидроксид железа (III))
CuOHCl
Cu+2O-2H+1Cl-1
H – O – Cu — Cl
(FeOH)3(PO4)2
(Fe+3O-2H+1)3(P+5O2 )
4 2
H – O – Fe – O
O – P = O
O
H – O – Fe – O
O – P = O
H – O – Fe — O
AlOHSO4
Al+3O-2H+1S+6O-24
H – O – Al – O
O
S
O
O
42. Способы получения основных солей
FeFe2O3
1) Fe(OH)3 + HCl FeOHCl2 + h3O
2) FeCl3 + NaOH FeOHCl2 + NaCl
Fe(OH)3
FeOHCl2
FeCl3
43. Химические свойства основных солей
FeFe2O3
1) FeOHCl2 + NaOH Fe(OH)3 + NaCl
2) FeOHCl2 + HCl FeCl3 + h3O
Fe(OH)3
FeOHCl2
FeCl3
Спасибо за внимание!
English Русский Правила
Видео с вопросами: определение уравнения, описывающего термическое разложение нитрата натрия
Стенограмма видео
Какое из следующих уравнений
правильно показывает термическое разложение нитрата натрия? (A) Четыре твердых вещества NaNO3 реагируют на
производят два твердых вещества Na2O плюс четыре газообразных NO и три газообразных O2. (B) Три твердых вещества NaNO3 реагируют на
производят три твердых вещества Na3N плюс два газообразных NO2 плюс 2,5 газообразного O2. (C) Два твердых вещества NaNO3 реагируют на
производят два твердых вещества Na плюс два газообразных NO2 плюс газообразный O2. (D) Два твердых вещества NaNO3 реагируют на
производят два твердых вещества NaNO2 плюс газообразный O2.
(B) Три твердых вещества NaNO3 реагируют на
производят три твердых вещества Na3N плюс два газообразных NO2 плюс 2,5 газообразного O2. (C) Два твердых вещества NaNO3 реагируют на
производят два твердых вещества Na плюс два газообразных NO2 плюс газообразный O2. (D) Два твердых вещества NaNO3 реагируют на
производят два твердых вещества NaNO2 плюс газообразный O2.
Для определения правильного уравнение термического разложения нитрата натрия, проясним некоторые пространство. Чтобы представить эту химическую реакцию как химическое уравнение, правильная химическая формула реагентов написана на с левой стороны следует стрелка, указывающая вправо. И правильная химическая формула продукты написаны справа от стрелки.
В этой задаче реагент
нитрат натрия. Для того, чтобы идентифицировать продукты,
нам нужно обсудить, что нитрат натрия распадается на твердый нитрит натрия и
кислородный газ. Теперь, когда мы знаем реагент и
продукты для этой реакции разложения, мы можем начать писать сбалансированную
химическое уравнение. Начнем с написания
химическая формула нитрата натрия.
Теперь, когда мы знаем реагент и
продукты для этой реакции разложения, мы можем начать писать сбалансированную
химическое уравнение. Начнем с написания
химическая формула нитрата натрия.
Ион натрия имеет заряд один плюс, а нитрат-ион — это многоатомный ион, представляющий собой NO3 с зарядом один минус. Для создания нейтрального соединения, для на каждый ион натрия приходится один нитрат-ион. Итак, формула будет NaNO3. Это твердое соединение, поэтому мы добавит символ состояния s. Теперь мы добавим стрелку в наш химическое уравнение для отделения реагентов от продуктов.
Теперь запишем формулу для
нитрат натрия. Ион натрия имеет заряд 1
плюс, а нитрит-ион это NO2 с зарядом один минус. Для создания нейтрального соединения для
нитрит натрия, на каждый ион натрия приходится один нитрит-ион.
Другой продукт, кислород, имеют формулу O2, так как он двухатомный, с символом состояния g, так как он является газом.
Поскольку мы создали химическое
уравнение, давайте сбалансируем его. При взгляде на хим.
уравнение, мы должны отметить, что кислород не уравновешен. На атоме кислорода три атома.
сторона реагента. А со стороны продукта есть
два атома кислорода в нитрите натрия и два атома кислорода в O2, всего четыре
присутствуют атомы кислорода. Чтобы сбалансировать атомы кислорода, если
коэффициент два ставится перед нитратом натрия и нитритом натрия, шесть
атомы кислорода теперь будут присутствовать как на стороне реагента, так и на стороне продукта.
химическое уравнение. Добавляя эти коэффициенты также
позволяет уравновешивать атомы натрия и азота.
Поскольку теперь у нас есть сбалансированный химическое уравнение, давайте вернемся к нашему выбору ответов с самого начала проблема. Рассматривая варианты ответов, мы должны заметить, что вариант ответа (D) соответствует реакции, которую мы создали в видео. Следовательно, уравнение, которое правильно показывает термическое разложение нитрата натрия — выбор ответа (Д). Два твердых вещества NaNO3 реагируют с образованием два твердых вещества NaNO2 плюс газообразный O2.
Сбалансированное уравнение реакции между оксидом натрия и водой:
Химия Химические реакции Кислотно-основные реакции Кислотно-основные
Маталина С.
спросил 03.08.15
A. Na2O + h3O → 2NaOH
C. Na2O + h3O → 2Na + h3O2
D. Na2O + h3O → 2Na + h3 +O2
9000 будет реакция?
Подписаться І 2
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: ЛучшиеНовыеСамыеСтарые
Дена А. ответил 03.08.15
ответил 03.08.15
Репетитор
4.9 (136)
Бывший заведующий кафедрой химии с более чем 10-летним опытом преподавания
Смотрите таких репетиторов
Смотрите таких репетиторов
ШАГ 1:
Натрий — это щелочной МЕТАЛЛ с зарядом +1.
ОКСИД представляет собой анион с зарядом -2.
Вы должны запомнить заряды (общие степени окисления), глядя на семейства в периодической таблице. (:
Итак, если это Na+1 с O-2, мы пересекаем заряды, чтобы получить индексы. Таким образом, мы получаем Na2O.
ШАГ 2:
Я уверен, вы знаете, что вода – это вода. Итак, мы закончили со стороной реагента: Na2O + h3O
ШАГ 3:
Итак, вот где начинается самое интересное. Вам нужно запомнить различные типы реакций. Первый тип – ЛЮБОЙ ОКСИД МЕТАЛЛА, ДОБАВЛЕННЫЙ В ВОДУ, ДЕЛАЕТ ПРОЧНУЮ ОСНОВУ. В тот момент, когда вы увидели МЕТАЛЛ натрия и анион ОКСИДА, ваш мозг должен был «динь! динь!» (Я предлагаю сделать карточки с различными типами реакций в вашей книге) и вы должны подумать… ЭТО СОСТАВЛЯЕТ ПРОЧНУЮ ОСНОВУ!
Первый тип – ЛЮБОЙ ОКСИД МЕТАЛЛА, ДОБАВЛЕННЫЙ В ВОДУ, ДЕЛАЕТ ПРОЧНУЮ ОСНОВУ. В тот момент, когда вы увидели МЕТАЛЛ натрия и анион ОКСИДА, ваш мозг должен был «динь! динь!» (Я предлагаю сделать карточки с различными типами реакций в вашей книге) и вы должны подумать… ЭТО СОСТАВЛЯЕТ ПРОЧНУЮ ОСНОВУ!
ШАГ 4:
Чтобы записать основание, вы кладете Na+1 с анионом ГИДРОКСИДА (ОН-), который также необходимо запомнить.
Итак, Na+ и OH- отменяют свои заряды, и вы просто получаете NaOH.
ШАГ 5:
Мы еще не закончили. Вы должны БАЛАНСИРОВАТЬ последнее уравнение. У нас есть Na2O + h3O —> NaOH. У нас есть 2 натрия, 2 кислорода и 2 водорода на левой стороне, но только по одному на правой стороне. Таким образом, мы должны умножить все правильные виды на коэффициент 2.
КОНЕЧНЫЙ ОТВЕТ:
Na2O + h3O —> 2NaOH
Надеюсь, это поможет!! Я постоянно помогал своим ученикам онлайн.

 03.16
03.16