Что можно получить из бензойной кислоты: разбираем варианты и способы
Бензойная кислота (химическая формула С6Н5СООН) – органическое соединение, которое представляет собой карбоновую кислоту из ряда ароматических соединений (аренов). В каталоге нашего сайта её можно найти по ссылке: https://teh-impex.ru/katalog/raw-material/benzoic-acid/ .
Сегодня промышленная бензойная кислота широко применяется в лакокрасочной индустрии, производстве шин. Но она известна науке ещё с 16 века, тогда удалось её выделить из бензойной смолы. В 19 веке активно использовалась в консервации фруктов из-за её противогрибковых свойств. Физически бензойная кислота представляет собой белые кристаллы, плохо растворимые в воде, но при этом хорошо растворимые в эфире, спиртах и хлороформе. В химической промышленности из данного органического соединения получают много важных химических веществ, которые используют в химическом производстве:
- Бензол;
- Бензоилхлорид;
- Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры;
- Фенол;
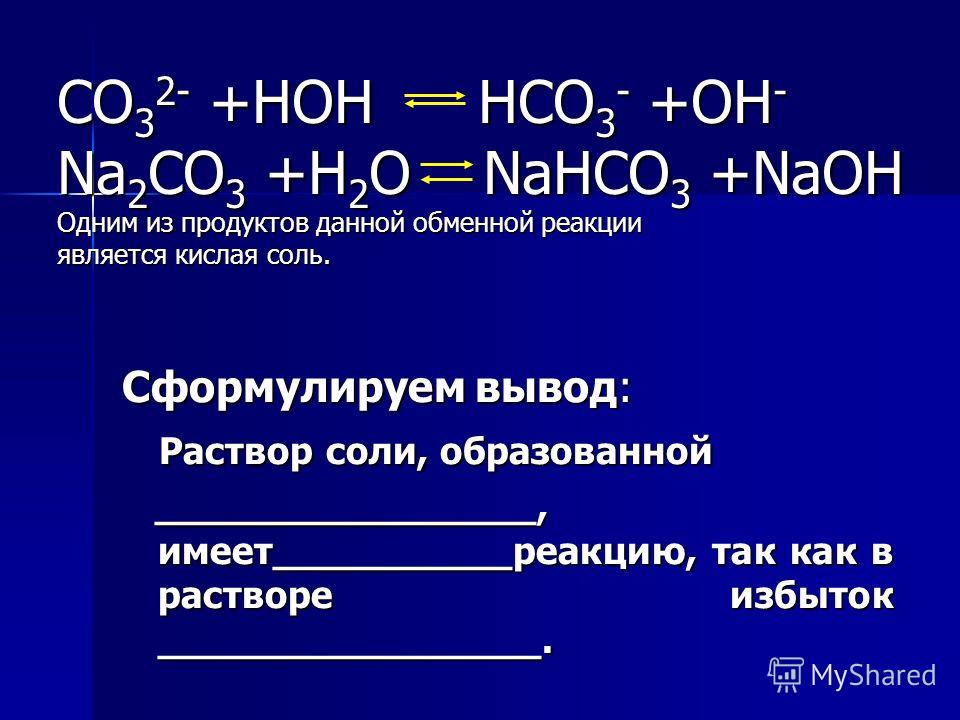
- Соли бензойной кислоты: бензоаты натрия, калия, кальция и т.
 д.
д.
Получение бензола из бензойной кислоты.
Бензол (C6H6) из бензойной кислоты получают её взаимодействием с гидроксидом натрия (при этом надёжнее использовать натронную известь – смесь NaOH и Ca(OH)2)). Реакция начнётся только при прокаливании смеси данных веществ. Формула реакции выглядит следующим образом:
C6H5-COOH + 2NaOH—>C6H6 + Na2CO3 + h3O.
Получение бензоилхлорида из бензойной кислоты.
В лабораторных условиях бензоилхлорид (C7H5CIO) становится продуктом реакции раствора бензойной кислоты и пентахлорида фосфора:
С6Н5СООН + РСI5 → C7H5CIO + POCI3 + HCI.
В промышленном производстве используется другая технология. Там проводят фосгенирование, то есть взаимодействие соединения с фосгеном (дихлорангрдридом угольной кислоты – СОСI2), в качестве катализатора реакции выступает хлорид железа (III), химическая формула FeCI3:
С6Н5СООН + СОСI2 → C7H5CIO + CO2 + HCI.
Получение бензоатных пластификаторов из бензойной кислоты.

В качестве бензоатных пластификаторов чаще всего выступают эфиры, такие как гликоль, диэтиленгликоль или триэтиленгликоль. Получают их в два этапа. Сначала из бензойной кислоты путём конденсации с метанолом (Ch4OH) в кислой среде выводят метилбензоат (C6H5COOCh4), то есть её метиловый эфир:
С6H5COOH + Ch4OH → C6H5COOCh4 + h3O.
Затем с помощью реакции переэтерификации, то есть обмена структурными единицами между сложными эфирами и гидоксильными группами спиртов, с подходящим гликолем (двухатомным спиртом) на выходе имеем бензоатный пластификатор.
Получение фенола из бензойной кислоты.
На производстве фенол получают путём окисления бензойной кислоты в газообразном состоянии при температуре в 200 – 400°С и твердых катализаторов (к примеру сульфата меди (II), CuSO4). Продуктами реакции являются помимо фенола ещё и бензол, и дифенилоксид. Фенол же, в свою очередь, может быть синтезирован в циклогексанол, который является отправной точкой в производстве нейлона.
Получение бензоатов из бензойной кислоты.
Соли бензойной кислоты нашли своё широкое применение в качестве пищевых и косметических консервантов, а также ингибиторов коррозии. Получение бензоатов происходит однотипно, так как является типовой реакцией взаимодействия карбоновых кислот с основаниями. Бензойная кислота смешивается с каким-нибудь основанием, на выходе имеем её соль и воду. Вот пример реакции этой кислоты с гидроксидом натрия:
C6H5-COOH + NaOH—> C7H5O2Na + h3O.
Подводя итог всему вышесказанному, можно смело утверждать, что бензойная кислота является одним из важнейших сырьевых компонентом в химической и нефтехимической промышленности.
Сода каустическая
Главная / Химическое сырье / Сода каустическая (натр едкий, гидрооксид натрия NaOH)
%D
%d.%M.%y
%h~:~%m
Едкий натр (гидроокись натрия, NaOH), известный в технике также под названием сода каустическая (или каустик), представляет собой в чистом виде белую непрозраную массу, расплывающуюся на воздухе. Существуют две модификации соды каустической а (кристалы ромбической системы) и b (кристалы кубической системы).
Существуют две модификации соды каустической а (кристалы ромбической системы) и b (кристалы кубической системы).
Сода каустическая, независимо от способа производства, всегда содержит примеси: соду кальцинированную Na2CO3, хлористый натрий NaCL, окислы железа и алюминия Fe2O3 и Al2O3, соединения кремния и т.п.
Молекулярный вес соды каустической (NaOH)
Едкий натр (соду каустическую) получают в промышленности электрохимическим и химическим способами.
Электрохимический способ получения соды каустической
Электрохимический способ производства каустической соды основан на электролизе в специальных ваннах) водных растворов поваренной соли.
В водном растворе NaCL (натрий хлористый) вследствие электролитической диссоциации вода и хлористый натрий распадаются на ионы:
При пропускании постоянного электрического тока через раствор на аноде выделяется газообразный хлор, а на катоде водород:
Одновременно происходит накопление в растворе ионов Na(+) и OH (-), в результате чего получается едкий натр (сода каустическая).
Химические способы производства соды каустической
Из многообразия химических способов получения соды каустической в промышленности нашли применение только известковый и ферритный.
Производство каустической соды известковым способом началась в России на заводе Ю.А. Пранта в Барнаульской губерни.
По данным Д.И. Менделеева, в 1897г. в России 10 заводов вырабатывали каустическую соду известковым способом.
Едкий натр (сода каустическая) получается при взаимодействии раствора соды кальцинированной с гашенной известью по следующей реакции:
Это процесс называется каустификацией.
Раствор едкого натра (соды каустической) упаривают, после чего его можно перерабатывать в твердый плавленный продукт, углекислый кальций является отбросом производства.
Ферритный способ производства соды каустической применяется в настоящее время только в России его начали применять в 90-х годах 19 века. Принципиальная схема производства по этому способу протекает в две стадии. При прокаливании смеси углекислого натрия с окисью железа образуется феррит натрия:
Феррит натрия разлагают водой:
Полученный раствор едкого натра упаривают из упаренного раствора получают твердый продукт. Окись железа возвращается в производственный цикл.
Едкий натр (сода каустическую) широко применяют во многих отраслях промышленности и народного хозяйства: в производстве бумаги, искуственного волокна, органических красителей, мыла хозяйственного, мыла туалетного, мыла жидкого, для отчистки минеральных масел, нефти и продуктов ее переработки, текстильной, металлургической, основной химической промышленности и промышленности органического синтеза.
Качество соды каустической (едкого натра)
Завды выпускают твердый и жидкий едкий натр (соду каустическую). Каждый из продуктов должен удовлетворять требованиям ГОСТ, ТУ, СТО.
В соответствии с ГОСТ твердый едкий натр (сода каустическая) изготавливается в виде твердой массы или пластин-чешуек двух марок: марка А «Химический» и марка Б «Диафрагменный». В табл. 3 приводится состав едкого натра перечисленных марок.
В едком натре марки А 1-го сорта, применяемом для получения металлического натрия, должно быть (в %) не более:
Жидкий едкий натр (сода каустическая) выпускают пяти марок: марка А «Ртутный», марка Б «Диафрагменный улучшенный», марка В «Диафрагменный», марки Г и Д «Химический».
В табл. 4 приводится состав жидкого едкого натра (соды каустической) перечисленных марок.
Кроме перечисленных марок, выпускается жидкий едкий натр чистый (электролитический) с содержание NaOH не менее 40% и жидкий едкий натр отход (жидкий каустик) с содержанием NaOH не менее 230 г/л.
При плавке твердого едкого натра получается отход (расплавленного каустика в плавильных котлах), так называемый красный каустик (сода каустическая), который отгружается отдельным потребителям.
Твердый едкий натр (соду каустическую) упаковывают в полипропиленовые мешки и стальные барабаны. Жидкий едкий натр (сода каустическая) отгружают в цистернах, металлических контейнерах или стальных бочках.
Производство гидроксида натрия из растворов карбоната и бикарбоната натрия с использованием мембранного электролиза: ТЭО
%PDF-1.7 % 1 0 объект > /Метаданные 2 0 R /Контуры 3 0 R /Страницы 4 0 Р /StructTreeRoot 5 0 R /Тип /Каталог /ViewerPreferences >
>> эндообъект 6 0 объект > эндообъект 2 0 объект > транслировать application/pdf 5 (www.princexml.com)AppendPDF Pro 6.3 Linux 64-разрядная 30 августа 2019 г. Библиотека 15.0.4Appligent AppendPDF Pro 6.32020-07-02T14:15:36-07:002020-07-02T14:15:36-07:002020- 07-02T14:15:36-07:001uuid:ddfd5d0f-aec4-11b2-0a00-60001a020000uuid:ddfd5d10-aec4-11b2-0a00-001f59d6fe7f конечный поток
эндообъект
3 0 объект
>
5 (www.princexml.com)AppendPDF Pro 6.3 Linux 64-разрядная 30 августа 2019 г. Библиотека 15.0.4Appligent AppendPDF Pro 6.32020-07-02T14:15:36-07:002020-07-02T14:15:36-07:002020- 07-02T14:15:36-07:001uuid:ddfd5d0f-aec4-11b2-0a00-60001a020000uuid:ddfd5d10-aec4-11b2-0a00-001f59d6fe7f конечный поток
эндообъект
3 0 объект
> 0 618.0547 261.0356 630.9453]
/StructParent 4
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
99 0 объект
>
/Граница [0 0 0]
/Содержание ()
/Rect [72.0 607.0547 194.5791 619.9453]
/StructParent 5
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
100 0 объект
>
/Граница [0 0 0]
/Содержание (Факультет инженерии и информатики)
/прямо [350,9644 618,0547 540,0 630,9453]
/StructParent 6
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
101 0 объект
>
/Граница [0 0 0]
/Содержание (Факультет инженерии и информатики)
/Rect [495,8926 607,0547 540,0 619,9453]
/StructParent 7
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
102 0 объект
>
/Граница [0 0 0]
/Содержание
/Rect [230.8867 235.3727 373.1768 247.0914]
/StructParent 8
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
103 0 объект
>
/Граница [0 0 0]
/Содержание (Инженерное достояние)
/Rect [137.2383 214.5406 238.1221 226.2594]
/StructParent 9
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
104 0 объект
>
/Граница [0 0 0]
/Contents (Общество научных и технических исследований)
/Rect [278.
0 618.0547 261.0356 630.9453]
/StructParent 4
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
99 0 объект
>
/Граница [0 0 0]
/Содержание ()
/Rect [72.0 607.0547 194.5791 619.9453]
/StructParent 5
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
100 0 объект
>
/Граница [0 0 0]
/Содержание (Факультет инженерии и информатики)
/прямо [350,9644 618,0547 540,0 630,9453]
/StructParent 6
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
101 0 объект
>
/Граница [0 0 0]
/Содержание (Факультет инженерии и информатики)
/Rect [495,8926 607,0547 540,0 619,9453]
/StructParent 7
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
102 0 объект
>
/Граница [0 0 0]
/Содержание
/Rect [230.8867 235.3727 373.1768 247.0914]
/StructParent 8
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
103 0 объект
>
/Граница [0 0 0]
/Содержание (Инженерное достояние)
/Rect [137.2383 214.5406 238.1221 226.2594]
/StructParent 9
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
104 0 объект
>
/Граница [0 0 0]
/Contents (Общество научных и технических исследований)
/Rect [278. 1807 214.5406 470.1875 226.2594]
/StructParent 10
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
105 0 объект
>
/Граница [0 0 0]
/Содержание
/Rect [72,0 120,4906 240,8721 132,2094]
/StructParent 11
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
106 0 объект
>
транслировать
xYێ7}WT+Rw`hh}䆴ȥ!
uoyfekIwۆI’1|
7+97M? B & S D: V7JR7N ‘*AN & 1%WW (/SA
1807 214.5406 470.1875 226.2594]
/StructParent 10
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
105 0 объект
>
/Граница [0 0 0]
/Содержание
/Rect [72,0 120,4906 240,8721 132,2094]
/StructParent 11
/Подтип /Ссылка
/Тип /Аннот
>>
эндообъект
106 0 объект
>
транслировать
xYێ7}WT+Rw`hh}䆴ȥ!
uoyfekIwۆI’1|
7+97M? B & S D: V7JR7N ‘*AN & 1%WW (/SA1. Оценить количество NAOH и NA2CO3 в данной смеси NaOH и NA2CO3
ПИСА . Требуется химическое вещество: ТЕОРИЯ: Метод определения силы данного неизвестного раствора с помощью известного стандартного раствора называется титрованием. Смесь NAOH и NA2CO3 анализируют методом двойного титрования. Участвуют следующие реакции: 2NAOH + H3SO4 → NA2SO4 + 2H3O 2NA2CO3 + H3SO4 → 2NAHC03 + NA2SO4 2NAHCO3 + H3SO4 → NA2SO4 + 2H3 + 2C02 . и фенолфталеин дает их конечную точку, но когда начинается реакция (iii), выделение СО2 снижает рН, что приводит к розовому цвету фенолфталеина до точки эквивалентности, поэтому для этой стадии используется метиловый оранжевый. Объем стандартного и израсходованного фенолфталеина соответствует всему количеству NAOH и половине количества NA2CO3, присутствующих в смеси. Дальнейший объем стандартной кислоты, потребляемой в метилоранже, соответствует оставшейся половине количества NA2CO3. Объем стандартной кислоты, израсходованной в фенолфталеине = X мл Объем стандартной кислоты, израсходованной в метилоранже = Y мл кислоты прореагировала с NA2CO3 смеси = 2Y мл Закон эквивалентности (химический) утверждает 1G equ кислоты = 1 г равенства основания или 100 мл 1n кислоты = 100 мл 1n NaOH = 100 мл 1n Na2CO3 = 40 г NAOH = 50 г NA2CO3 МЕТОДИКА Прежде всего данный аппарат, используемый для титрования, т. OBSERVATION TABLE: strength of h3SO4 solution = N/10(f=1.02) Burette reading standard h3SO4 In phenolphthalein Burette reading standard h3SO4 In methyl orange Расчет: Том фенолфталеина из конечной точки (x) = 11,5 мл Объем метильной оранжевой точки (y) = 4. Том H3SO4, потребляемый NaOH (x — y) = (11,5 — 4,5) мл = 7 мл Объем H3SO4, потребляемый Na2CO3 = 2y = 2 × 4,5 = 9 мл для NaOH Объем NAOH (V1) = 10 мл сила NAOH (N1) =? Объем H3SO4 (V2) = 7 мл прочности H3SO4 (N2) = f/10 = 0,102 Тогда N1V1 = N2V2 или, N1 = 0,102 × 7 мл 10 мл = 0,0714 и гм/литр = 0,0714 × 40 = 2,867 г/литр для NA2CO3 том NA2CO3 (V1) = 10 мл прочности NA2CO3 (N1) =? Объем H3SO4 (V2) = 9 мл прочности H3SO4 (N2) = f/10 = 0,102 Тогда N1V1 = N2V2 или, N1 = 0,102 × 9 мл 10 мл = 0,0918 и гм/литр = 0,0918 × 53 = 4,865 г/литр Результат: С начала наблюдения, количество NaOH и Na2CO3. г/л и 4,867 г/л соответственно. ЗАКЛЮЧЕНИЕ : Таким образом, количество NAOH и NA2CO3 можно определить методом двойного титрования. Раствор смеси титруют сначала фенолфталеином, а затем метилоранжем.
Раствор смеси титруют сначала фенолфталеином, а затем метилоранжем. е. бюретка, пипетка, коническая колба, должным образом очищались водой. Затем бюретку промывали стандартной кислотой h3SO4 N/10 (F=1,02) и заполняли стандартной кислотой. Пипетку промывали раствором смеси щелочей в конической колбе. После этого в коническую колбу добавляли 1-2 капли индикатора фенолфталеина, где появлялась розовая окраска при титровании до исчезновения розовой окраски. При анализе опыта методом двойного индикатора титрования в него добавляли 1-2 капли метилового оранжевого, при этом появлялась светло-желтая окраска, и снова титровали, после чего появлялась довольно розовая окраска. Наконец, процесс был повторен для одновременного чтения.
е. бюретка, пипетка, коническая колба, должным образом очищались водой. Затем бюретку промывали стандартной кислотой h3SO4 N/10 (F=1,02) и заполняли стандартной кислотой. Пипетку промывали раствором смеси щелочей в конической колбе. После этого в коническую колбу добавляли 1-2 капли индикатора фенолфталеина, где появлялась розовая окраска при титровании до исчезновения розовой окраски. При анализе опыта методом двойного индикатора титрования в него добавляли 1-2 капли метилового оранжевого, при этом появлялась светло-желтая окраска, и снова титровали, после чего появлялась довольно розовая окраска. Наконец, процесс был повторен для одновременного чтения. S. N. Volume of alkali initial final разница одновременный 1. 
10 мл 0 14 14 2. 2. .0106 18 29.5 11.5 11.5 ml 3. 10 ml 34 45.5 11.5 Серийный номер Объем щелочи начальный конечный разность одновременный 5 мл 6 1. 0106 14 18 4 2. 10 ml 29.5 34 4.5 11.5 ml 3. 10 ml 45.5 49.5 4,5  0007
0007

 д.
д.