Как рассчитать концентрацию раствора — Wiki How To Русский
‘).insertAfter(«#intro»),$(‘
‘).insertBefore(«.youmightalsolike»),$(‘
‘).insertBefore(«#quiz_container»),$(‘
‘).insertBefore(«#newsletter_block_main»),fa(! 0),b=document.getElementsByClassName(«scrolltomarker»),a=0;a
В этой статье:
Использование отношения массы к объему
Вычисление концентрации в процентах или миллионных долях
Вычисление молярности
Дополнительные статьи
Источники
В химии концентрация раствора показывает, как много растворенного вещества содержится в растворителе. Согласно стандартной формуле C = m/V, где C — концентрация, m — масса растворенного вещества и V — общий объем раствора. При малых концентрациях удобнее вычислять концентрацию в миллионных долях (ppm). Во время лабораторной работы вас могут попросить также вычислить молярность, или молярную концентрацию раствора.
Шаги
1
Найдите массу растворенного вещества. Это вещество добавляют в растворитель, чтобы получить раствор. Если в условии дана масса растворенного вещества, запишите ее и укажите соответствующие единицы измерения. Если эту массу необходимо найти, взвесьте то вещество, которое вы собираетесь растворить, на лабораторных весах и запишите результат измерений.[1] X Источник информации
- Если растворенное вещество имеет жидкую форму, можно вычислить массу с помощью формулы для плотности D = m/V, где m — масса жидкости и V — ее объем. Чтобы найти массу, умножьте плотность жидкости на объем.
Совет: если необходимо использовать весы, вычтите из общей массы массу емкости, в которой находится взвешиваемая жидкость, чтобы получить правильный результат.
2
Запишите общий объем раствора. Этот объем равен сумме объема растворителя и растворенного вещества. Если необходимо измерить объем в лаборатории, приготовьте раствор в мерной пробирке или мензурке и определите объем. Чтобы получить более точный результат, определите объем по верхнему краю поверхности раствора (мениска). Запишите найденную величину.[2]
X
Источник информации
Если необходимо измерить объем в лаборатории, приготовьте раствор в мерной пробирке или мензурке и определите объем. Чтобы получить более точный результат, определите объем по верхнему краю поверхности раствора (мениска). Запишите найденную величину.[2]
X
Источник информации - Если вы не измеряете объем раствора самостоятельно, возможно, потребуется вычислить его по массе и плотности.
- Например, если следует найти концентрацию 3,45 грамма соли, растворенной в 2 литрах воды, можно определить объем по формуле для плотности. Найдите плотность соли в справочнике или интернете и решите уравнение относительно массы m. В данном случае плотность соли составляет 2,16 г/мл (грамма на миллилитр). Получаем 2,16 г/мл = (3,45 г)/V. Умножим обе части равенства на V и получим V(2,16 г/мл) = 3,45 г. После этого поделим каждую часть на 2,16 и найдем объем: V = (3,45 г)/(2,16 г/мл) = 1,60 мл.
- Прибавьте к объему растворенного вещества объем растворителя.
 В нашем примере имеем 2 л + 1,6 мл = 2000 мл + 1,6 мл = 2001,6 мл. Можно оставить найденный объем в миллилитрах или перевести его в литры: 2,002 л.
В нашем примере имеем 2 л + 1,6 мл = 2000 мл + 1,6 мл = 2001,6 мл. Можно оставить найденный объем в миллилитрах или перевести его в литры: 2,002 л.
3
Поделите массу растворенного вещества на общий объем раствора. Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора. Не забудьте записать в ответе правильные единицы измерения.[3] X Источник информации
- В нашем примере для концентрации 3,45 грамма соли в 2 литрах воды имеем C = (3,45 г)/(2,002 л) = 1,723 г/л.
- В некоторых задачах требуется найти концентрацию в определенных величинах. Не забудьте перевести значения в соответствующие единицы измерения, прежде чем подставлять их в конечную формулу.
Реклама
1
Найдите массу растворенного вещества в граммах.
 Измерьте массу того вещества, которое вы собираетесь добавить в раствор. Не забудьте вычесть массу емкости, если вы используете ее при взвешивании, чтобы получить правильный результат.[4]
X
Источник информации
Измерьте массу того вещества, которое вы собираетесь добавить в раствор. Не забудьте вычесть массу емкости, если вы используете ее при взвешивании, чтобы получить правильный результат.[4]
X
Источник информации - Если растворяемое вещество находится в жидкой форме, можно вычислить его массу с помощью формулы D = m/V, где D — плотность жидкости, m — ее масса и V — объем. Найдите плотность жидкости в справочнике или интернете и решите уравнение относительно массы.
2
Определите общую массу раствора в граммах. Общая масса равна сумме масс растворенного вещества и растворителя. Измерьте эти массы с помощью лабораторных весов или переведите объем растворителя в массу с помощью формулы для плотности D = m/V. Сложите массы растворенного вещества и растворителя, чтобы найти общую массу.[5] X Источник информации
- Например, если вы хотите найти концентрацию 10 граммов порошка какао в 1,2 литра воды, определите массу воды по формуле для плотности.
 Плотность воды составляет 1000 г/л, поэтому получаем 1000 г/л = m/(1,2 л). Умножим обе стороны равенства на 1,2 литра и найдем массу в граммах: m = 1,2 л×1000 г/л = 1200 г. Прибавим массу порошка какао и получим 1210 г.
Плотность воды составляет 1000 г/л, поэтому получаем 1000 г/л = m/(1,2 л). Умножим обе стороны равенства на 1,2 литра и найдем массу в граммах: m = 1,2 л×1000 г/л = 1200 г. Прибавим массу порошка какао и получим 1210 г.
- Например, если вы хотите найти концентрацию 10 граммов порошка какао в 1,2 литра воды, определите массу воды по формуле для плотности.
3
Поделите массу растворенного вещества на общую массу раствора.
Определим концентрацию как C = масса растворенного вещества/общая масса раствора. Подставьте в это уравнение значения, чтобы найти концентрацию раствора.[6] X Источник информации- В нашем примере C = (10 г)/(1210 г) = 0,00826.
4
Умножьте ответ на 100, если хотите найти концентрацию в процентах. Если требуется определить концентрацию в процентах, умножьте найденный ответ на 100. Запишите полученный результат со знаком процентов.[7] X Источник информации
- В нашем примере концентрация в процентах составляет 0,00826×100 = 0,826 %.

- В нашем примере концентрация в процентах составляет 0,00826×100 = 0,826 %.
5
Умножьте концентрацию на 1000000, чтобы найти миллионные доли.
Возьмите найденное значение концентрации и умножьте его на 1000000, или 106. В результате вы найдете, сколько миллионных долей растворенного вещества содержится в растворе. Укажите в ответе единицы измерения в ppm.[8] X Источник информации- В нашем примере количество миллионных долей ppm = 0,00826×1000000 = 8260 ppm.
Совет: миллионные доли обычно используют для очень малых концентраций, когда легче записать и понять ответ в них, а не в процентах.
Реклама
1
Сложите атомные массы растворенного вещества, чтобы найти молярную массу. Посмотрите, из каких химических элементов состоит данное растворенное вещество. Выпишите атомную массу каждого элемента, поскольку атомная и молярная массы равны.
 Сложите все атомные массы элементов растворенного вещества, чтобы найти общую молярную массу. Укажите в полученном результате, что это г/моль (количество граммов на моль). [9]
X
Источник информации
Сложите все атомные массы элементов растворенного вещества, чтобы найти общую молярную массу. Укажите в полученном результате, что это г/моль (количество граммов на моль). [9]
X
Источник информации - Например, если в качестве растворенного вещества дан гидроксид калия, найдите атомные массы калия, кислорода и водорода и сложите их. В результате получится молярная масса = 39 +16 + 1 = 56 г/моль.
- Молярность используется в химии в основном тогда, когда известен химический состав растворенного вещества.
2
Поделите массу растворенного вещества на его молярную массу, чтобы определить количество молей. При необходимости измерьте массу растворенного вещества с помощью лабораторных весов. Не забудьте вычесть массу емкости, чтобы получить правильный результат. Поделите найденную массу на молярную массу, в результате вы узнаете количество молей. Укажите возле ответа «моль».

- К примеру, если вы хотите найти, сколько молей содержится в 25 граммах гидроксида калия (KOH), уравнение будет выглядеть следующим образом: число молей = (25 г)/(56 г/моль) = 0,45 моль.
- Переведите массу растворенного вещества в граммы, если она указана в других единицах измерения.
- Моли показывают количество молекул в растворе.
3
Переведите объем раствора в литры. Определите объем растворителя, прежде чем приготовить раствор. Если объем не дан в условии задачи, используйте мерную пробирку или мензурку. Если вы получите результат в миллилитрах, поделите его на 1000, чтобы перевести в литры.[11] X Источник информации
- В рассматриваемом примере если вы используете 400 миллилитров воды, поделите эту величину на 1000, и у вас получится 0,4 литра.
- Если объем растворителя уже указан в литрах, данный шаг можно пропустить.

Совет: обычно нет необходимости учитывать объем растворенного вещества, так как он, как правило, не сильно влияет на общий объем. Однако если объем заметно изменится после того, как вы добавите растворимое вещество, используйте общий объем раствора.
4
Поделите количество молей растворенного вещества на объем раствора в литрах. Запишите молярность следующим образом: M = mol/V, где mol — количество молей растворенного вещества и V — объем растворителя. Найдите ответ и поставьте возле него букву «M».[12] X Источник информации
- В нашем примере M = (0,45 моль)/(0,4 л) = 1,125 M.
Советы
- Если вы находитесь в лаборатории и не знаете, сколько растворенного вещества было добавлено, можно титровать раствор другими реактивами. При этом необходимо знать, как записывать химические уравнения в стехиометрическом виде.

Реклама
Источники
Об этой статье
На других языках
Как рассчитать концентрацию раствора — Wiki How Русский
В химии концентрация раствора показывает, как много растворенного вещества содержится в растворителе. Согласно стандартной формуле C = m/V, где C — концентрация, m — масса растворенного вещества и V — общий объем раствора. При малых концентрациях удобнее вычислять концентрацию в миллионных долях (ppm). Во время лабораторной работы вас могут попросить также вычислить молярность, или молярную концентрацию раствора.
Эту страницу просматривали 200 978 раз.
Реклама
Как рассчитать процентную концентрацию раствора?
Как рассчитать процентную концентрацию раствора?
Процентный состав по массе (%) Это масса растворенного вещества, деленная на массу раствора (масса растворенного вещества плюс масса растворителя), умноженная на 100.
Как рассчитать концентрацию вещества?
Поделите массу растворенного вещества на общий объем раствора. Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора.
Как сделать 5% раствор?
Чтобы приготовить 5% раствор нужно 5 г марганцовки и 100 мл воды. Первым делом наливаем воду в приготовленную ёмкость, следом добавляем кристаллы. Затем все это перемешать до равномерного и насыщенного фиолетового окраса жидкости.
Как определить процентное содержание вещества в растворе?
Если известно процентное содержание вещества, то его концентрация находится по формуле: К=р/100% к — концентрация вещества; р — процентное содержание вещества (в процентах).
Как определить скольки процентный раствор?
Процентная концентрация (С%) вещества в растворе численно равна массовой доле растворенного вещества, выраженной в процентах. Определяется по формуле: С% вещества = (m вещества/ m раствора.) * 100%. Величина процентной концентрации показывает, сколько грамм вещества содержится в 100 г раствора.
Определяется по формуле: С% вещества = (m вещества/ m раствора.) * 100%. Величина процентной концентрации показывает, сколько грамм вещества содержится в 100 г раствора.
Как определить концентрацию солевого раствора?
Солевой раствор. Солевой раствор –это количество соли в 100 г раствора или количество граммов соли на 100 г воды, но при этом концентрация будет разная. Например: если в 100 г солевого раствора содержится 25 г соли и 75 г воды, то концентрация соли равна 25 * 100 / 100 = 25 %;
Как сделать 10% раствор соли?
10—процентный раствор — это девять частей воды и одна часть соли. Например, на 10 граммов соли вам понадобится 90 граммов воды. Воду лучше брать чуть теплую, чтобы соль быстрее растворилась.
Как получить 3% раствор?
Для ранневесеннего опрыскивания (до распускания почек) готовят 3%-й раствор: 300 г медного купороса и 225 г гашеной извести-пушонки на 10 литров воды. Получается пропорция 1:0,75, хотя очень часто берут и 1:1 (300 г медного купороса и 300 г гашеной извести-пушонки на 10 литров воды).
Получается пропорция 1:0,75, хотя очень часто берут и 1:1 (300 г медного купороса и 300 г гашеной извести-пушонки на 10 литров воды).
Как определить плотность солевого раствора?
Ареометр общего назначения АОН-1 1360-1420 кг/м³ Ареометр АОН-1 подходит для измерения плотности любой жидкости (в том числе солевых растворов, кислот, солей, нефтепродуктов, химических соединений), а также растворов (например, цемент, бетон, строительные смеси и т. д.).
Как рассчитать количество вещества в растворе?
Количество растворенного вещества : = c•V, где c – молярная концентрация растворенного вещества в моль/л, V – объем раствора в л. где m(р-ра) – масса раствора в г, – массовая доля растворенного вещества.
Как можно найти массу раствора?
Масса раствора определяется по формуле m (раствора)= m (масса растворенного вещества)/ w (массовая доля растворенного вещества). Или m = r (плотность раствора — г/см3) * V (объем раствора). А как найти массу раствора, если изветны только массы воды и растворённого вещества?
А как найти массу раствора, если изветны только массы воды и растворённого вещества?
Как приготовить раствор с заданной концентрацией?
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ СМЕШИВАНИЕМ РАСТВОРОВ БОЛЕЕ ВЫСОКОЙ И БОЛЕЕ НИЗКОЙ КОНЦЕНТРАЦИИ. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Как сделать 1 процентный раствор?
Как приготовить раствор Если вы хотите получить 1—процентный раствор любого вещества, то растворяете 10 г вещества в литре воды (или 100 г в 10 литрах). Соответственно, 2-процентный раствор содержит 20 г вещества в литре воды (200 г в 10 литрах) и так далее.
Что называют насыщенным раствором?
Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется. Если же при этой температуре в 100 г воды растворить хлорида калия меньше, чем 34,4 г, то раствор будет ненасыщенным.
Если же при этой температуре в 100 г воды растворить хлорида калия меньше, чем 34,4 г, то раствор будет ненасыщенным.
Что необходимо для приготовления раствора?
Для приготовления раствора с определённой массовой долей растворённого вещества надо:
- вычислить массу растворённого вещества;
- вычислить массу (или объём) растворителя;
- взвесить вещество;
- отмерить растворитель;
- смешать вещества.
Как получить 10% раствор?
10-процентный раствор — это девять частей воды и одна часть соли. Например, на 10 граммов соли вам понадобится 90 граммов воды. Воду лучше брать чуть теплую, чтобы соль быстрее растворилась.
Что понимается под раствором?
Раство́р — однородная (гомогенная) система, в состав которой входят молекулы (атомы, ионы) двух или более типов, причём доля частиц каждого типа может непрерывно меняться в определённых пределах.
Какая система называется раствором?
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов). По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
Как изменяется растворимость веществ с изменением температуры?
При повышении температуры растворимость твердых веществ обычно увеличивается, а газов — уменьшается.
Что такое растворимость какая существует зависимость между изменением температуры?
Растворимость – максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре. С повышением температуры растворимость большинства твердых веществ увеличивается, а растворимость газов снижается.
Что такое растворимость От каких факторов зависит?
Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях.
Какой фактор увеличивает растворимость?
Растворимость большинства твердых веществ в воде увеличивается с повышением температуры, растворимость газов, наоборот растворимость газов, наоборот уменьшится. На растворимость жидкостей, как смешивающихся, так и не смешивающихся с водой, температура практически не влияет.
На растворимость жидкостей, как смешивающихся, так и не смешивающихся с водой, температура практически не влияет.
Как влияет температура на взаимную растворимость жидких веществ и нерастворимых веществ в воде?
На растворимость жидкостей температура практически не влияет.
Расчет концентрации ионов в растворе одного вещества
Концентрация ионов определяется степенью диссоциации () и молярной концентрацией вещества (См).
Случай А. Сильные электролиты
Здесь достаточно хорошим приближением является = 1, т.е. все молекулы полностью диссоциированы на ионы.
Пример 1
Рассчитать концентрацию всех ионов в 1 М растворе Al2(SO4)3.
Решение
Al2(SO4)3 — соль, т. е. сильный электролит. Она диссоциирует в одну ступень нацело и необратимо:
Al2(SO4)3
2Al3+ + 3SO42-.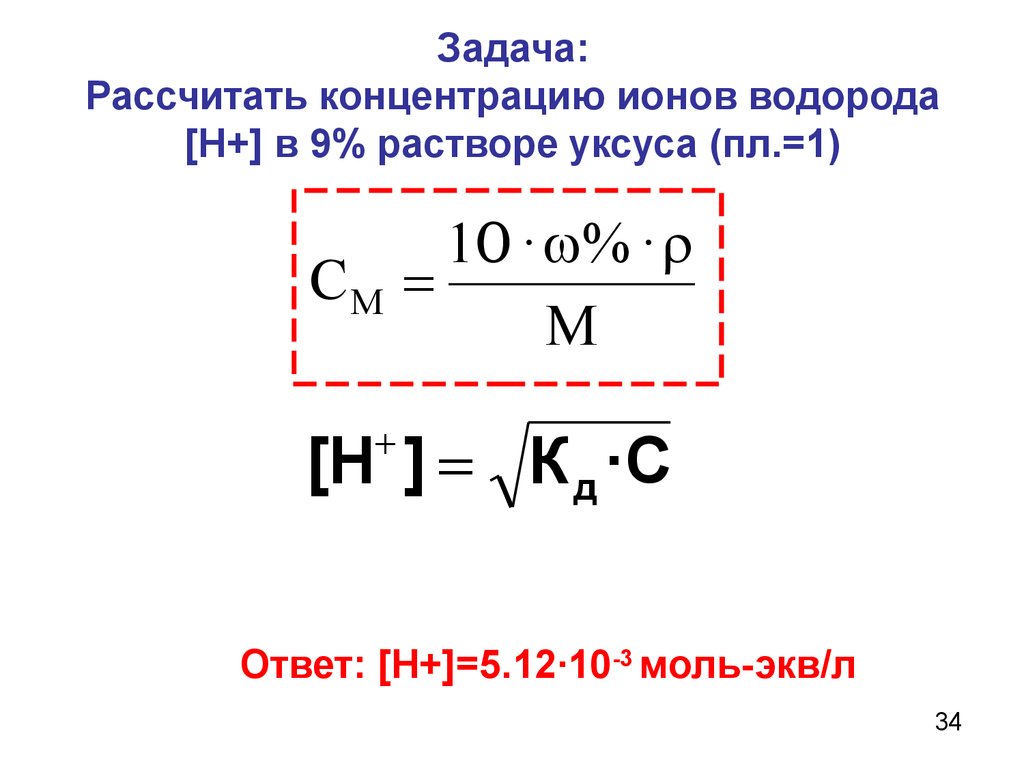
Из уравнения диссоциации видно, что из одной молекулы соли образуются 2 иона алюминия и 3 сульфат-иона
[Al3+]=2Cм = 2 моль/л; [SO42-]= 3См = 3 моль/л.
Пример 2
Рассчитать рН 0.1 М раствора NaOH.
Решение
Гидроксид натрия — щелочь (сильное основание), следовательно, диссоциирует необратимо и полностью:
NaOH Na++OH— ;
при диссоциации из его одной молекулы образуется один гидроксид-ион, следовательно,
[OH—]= См = 0.1 моль/л,
рОН = — lg [OH—]= 1,
pH= 14- рОН = 13.
Случай В. Несильные электролиты
Соли, как правило, являются сильными электролитами, поэтому этот случай относится к несильным кислотам и основаниям.
Пример 3
Рассчитать
концентрацию всех ионов в 0. 2 М растворе
сернистой кислоты и ее степень диссоциации
по первой и второй ступеням.
2 М растворе
сернистой кислоты и ее степень диссоциации
по первой и второй ступеням.
Решение
Здесь , диссоциация обратима:
первая ступень H2SO3 HSO3— + H+,
Ка1= [HSO3—][H+]/[H2SO3]= 1.610-2 ; (1)
вторая ступень HSO3— SO32- + H+,
Ka2= [SO32-][H+]/[HSO3—]= 6.310-8 . (2)
Из уравнений диссоциации следует, что образование одного иона HSO3— сопровождается образованием одного иона H+, а образование одного иона SO32- сопровождается образованием двух H+, следовательно, концентрации всех ионов связаны уравнением
[HSO3—]+ 2[SO32-]= [H+], (3)
а равновесная концентрация кислоты определяется уравнением
[H2SO3]=
Cм
— [HSO3—]-
[SO32-]. (4)
(4)
Решая систему уравнений (1)-(4) можно рассчитать концентрации всех ионов, однако следует обратить внимание на то, что Ka1Ka2. Отсюда следует, что концентрации ионов Н+ и HSO3— определяются, главным образом, диссоциацией по первой ступени. Вторая ступень диссоциации играет главную роль лишь в образовании ионов SO32-.
Расчет [Н+], [HSO3—] и [H2 SO3]
Из
уравнения (1) следует, что при распаде
одной молекулы кислоты образуется один
ион Н+ и один ион HSO3—,
следовательно, концентрации этих ионов
равны х = [Н+]
= [HSO3-2],
а равновесная концентрация [H2 SO3]=
См — х. . Подставляя эти выражения в закон
действия масс для первой ступени, получим
. Подставляя эти выражения в закон
действия масс для первой ступени, получим
Ка1= х2 /(См — х)= 1.610-2
или
х2 /(0.2- х)= 1.610-2,
откуда х1 = -6.510-2 и х2 = 4.910-2. Концентрация не может быть отрицательной величиной, поэтому решением является второй корень уравнения. Окончательно можно записать
[Н+] = [HSO3—] = 4.910-2 моль/л, [H2 SO3]= 0.151 моль/л,
1 = [Н+]/См = 4.910-2 моль/л/0.2 моль/л = 0.245, или 24.5%.
Расчет [SO32-]
Из равенства значений [Н+] и [HSO3—] в соответствии с уравнением (2) следует
[SO32-][H+]/[HSO3—]=
[SO32-]
= Ка2 = 6. 310-8 моль/л,
310-8 моль/л,
2 = [SO32-]/[HSO3—]= 6.310-8 моль/л./ 4.910-2 моль/л = 1.29 10-6.
ВЫВОД: при расчете рН растворов слабых электролитов достаточно рассмотреть первую ступень диссоциации.
Пример 4
Рассчитать степень диссоциации гидроксида аммония и рН его 5%- раствора (плотность раствора =0.97 г/мл).
Решение
1). Для решения задачи необходимо знать молярную концентрацию вещества. Для ее расчета удобно исходить из 1 литра раствора:
его масса mp= V = 1000 мл0.97 г/мл = 970 г;
масса растворенного вещества m= mp = 970 г0.05 = 48.5 г;
количество растворенного вещества = m/М = 48.5 г/35г/моль =1.39 моль;
молярная
концентрация См=/
V=
1. 39 моль/1 л = 1.39 моль/л.
39 моль/1 л = 1.39 моль/л.
2). Рассмотрим равновесие:
NH4OH NH4+ + OH—.
Кв= [NH4+][OH—]/[NH4OH]= 1.810-5 .
Воспользуемся законом разбавления Оствальда
= (К/См) = =(1.810-5 /1.39) = 3.6 10-3 ;
1, следовательно, применение этого закона допустимо. При диссоциации одной молекулы исходного вещества образуется 1 ион ОН—; в одном литре раствора диссоциирует См молекул, следовательно, образуется столько же ионов ОН—, тогда
[ОН—]= См =3.6 10-3 1.39 моль/л = 5.0010-3 моль/л,
рОН = — lg[ОН—] = — lg 5.0010-3 = 2.30,
pH = 14-pOH= 14 -2.30 = 11.70.
Замечание:
если результатом расчета по закону
разбавления оказывается, что 0. 1, то для расчета необходимо воспользоваться более точным
уравнением К=2См/(1-)
или сначала рассчитать равновесные
концентрации ионов (см. пример 3), а затем ..
1, то для расчета необходимо воспользоваться более точным
уравнением К=2См/(1-)
или сначала рассчитать равновесные
концентрации ионов (см. пример 3), а затем ..
Калькулятор концентрации
Создано Анной Павлик, кандидатом наук
Отредактировано Богной Шик и Аденой Бенн
Последнее обновление: 08 сентября 2022 г.
Содержание:- Что такое концентрация?
- Что такое формула массовой концентрации?
- Как рассчитать концентрацию – другие полезные уравнения
- Как заново рассчитать концентрацию?
- FAQ
Калькулятор концентрации представляет собой инструмент для перевода молярности в процентную концентрацию (или наоборот) при известной молярной массе растворенного вещества и плотности раствора. Кроме того, можно рассчитать массу вещества на 100 г воды, если известна процентная концентрация. Эта статья предоставит вам:
- Определение концентрации;
- Массовая процентная концентрация;
- Формула концентрации; и
- Краткое пошаговое руководство по пересчету концентрации.

Что такое концентрация?
Концентрация описывает состав раствора. Это фраза, которую мы обычно используем при обсуждении растворов на водной основе, но мы можем использовать ее для обозначения любой смеси.
Это также количество компонента (выраженное в массе, молях и т. д.), деленное на общую массу или объем раствора.
Существует несколько математических описаний, таких как молярность или массовая процентная концентрация . Более того, раствор можно описать соотношением растворенного вещества в растворе растворителя.
🙋 Если вы хотите узнать больше о молярности, посетите наш калькулятор молярности.
Раствор можно описать качественно, используя слова концентрированный и разбавленный. Концентрированный относится к раствору с более высоким содержанием растворенного вещества, в то время как разбавленный раствор имеет меньшее количество растворенного вещества. Если вы знаете концентрацию раствора и разбавляете его, вы можете использовать калькулятор разбавления раствора для расчета концентрации разбавленного раствора. У нас также есть инструмент, который поможет вам рассчитать концентрацию неизвестного образца с помощью калибровочной кривой!
Если вы знаете концентрацию раствора и разбавляете его, вы можете использовать калькулятор разбавления раствора для расчета концентрации разбавленного раствора. У нас также есть инструмент, который поможет вам рассчитать концентрацию неизвестного образца с помощью калибровочной кривой!
Что такое формула массовой концентрации в процентах?
Массовая процентная концентрация (мас.%) является одним из видов процентной концентрации. Он определяется как отношение массы растворенного вещества к общей массе раствора. Затем он умножается на 100%, чтобы получить процент. Написано в виде формулы, это:
вес.% = м₁ / м₂ × 100%
где:
- м₁ – масса растворенного вещества [г]; и
- м₂ – Общая масса раствора [г].
Как рассчитать концентрацию – другие полезные формулы
Если известны плотность (d [г/дм³]) и молярность (c [моль/дм³]) раствора, а также молярная масса (M [г/моль]) растворенного вещества, можно рассчитать концентрацию в процентах по массе с помощью заданное математическое уравнение (1):
% масс.
 = c × 100% × M/d
= c × 100% × M/d В качестве альтернативы, если вы знаете плотность (d) и концентрацию в процентах по массе (% по массе [%]) раствора и молярную массу (M) растворенного вещества, вы можете рассчитать молярность по этому математическому уравнению (2):
c = вес.% × d / 100% × M
Зная массовую процентную концентрацию (wt%), можно легко рассчитать массу растворенного вещества (м₁) (уравнение (3)):
м₁ = вес. % × м₂ / 100%
Если вы хотите рассчитать массу растворенного вещества на 100 г воды (H₂O), вы можете использовать это уравнение:
м = м₁ × 100/(м₂ — м₁)
где м – масса растворенного вещества на 100 г воды [г/100 г H₂O], м₁ – масса растворенного вещества, рассчитанная по уравнению (4) [г], м₂ – общая масса раствора [ грамм]. Чтобы упростить расчеты, предположим, что м₂ = 100 г .

Знаете ли вы, что мы также можем решить эту проблему, используя пропорции?
a / b = c / d
Массу вашего вещества можно поставить в числителе ( a ) и объем раствора в знаменателе ( b ) в левой части таблицы. уравнение. Затем мы можем установить знаменатель ( d ) в правой части уравнения как 1 . Рассчитав эту пропорцию, мы получим концентрацию – массу вещества на 1 единицу объема. Это можно сделать с помощью нашего калькулятора пропорций. Не забудьте выполнять расчеты, используя одни и те же единицы измерения!
Знание концентрации жидкостей очень полезно в повседневной жизни, и одним из таких применений является регулирование солености воды в бассейне!
Процесс восстановления также требует приготовления раствора с точными концентрациями разбавителя и сухого ингредиента.
Массовая доля представляет собой концентрацию компонента смеси или соединения.
Как пересчитать концентрацию?
Выберите свое вещество. Предположим, что это хлорид натрия (NaCl).
Найдите молярную массу хлорида натрия. Она равна 58,5 г/моль.
Найдите молярность вашего раствора и его плотность. Предположим, что у вас есть 3M NaCl плотностью 1,116 г/см³ = 1116 г/дм³ = 1116 г/л.
Преобразуйте концентрации, используя математическое выражение (1). Подставьте известные значения для расчета массовой процентной концентрации:
% масс. = 3 × 100% × 58,5/1116 = 15,7%
Предположим, что общая масса раствора (м₂) составляет 100 г. Используя уравнение (3), массу растворенного вещества рассчитывают по формуле:
м₁ = 15,7% × 100/100% = 15,7
Затем подставьте известные значения для расчета количества вещества на 100 г воды (уравнение (4)):
m = 15,7 × 100 /(100 – 15,7) = 1570/84,3 = 18,66 г/100 г H₂O
Вы также можете использовать этот калькулятор концентрации для массовой процентной концентрации или молярности и количества вещества на 100 г воды.
 Просто введите оставшиеся значения и посмотрите, как он сделает всю работу за вас.
Просто введите оставшиеся значения и посмотрите, как он сделает всю работу за вас.Кроме того, вы можете рассчитать молярность (с), используя этот расчет. Если известна массовая процентная концентрация (wt), плотность (d) и молярная масса (M), этот калькулятор рассчитает молярность (c) и количество вещества на 100 г воды (m).
Часто задаваемые вопросы
Как рассчитать концентрацию в процентах по массе с учетом молярности?
Для расчета концентрации в процентах по молярности раствора необходимо:
- Определить плотность (г/дм³) растворенного вещества.
- Найдите молярную массу растворенного вещества (г/моль).
- Умножьте молярную массу на молярность.
- Разделите результат шага 3 на плотность растворенного вещества.
- Умножьте на 100%, чтобы получить проценты.
Как найти массу растворенного вещества при заданной массовой процентной концентрации?
Масса растворенного вещества может быть легко получена из массовой процентной концентрации (wt%) при условии, что вы также знаете общую массу раствора (M). Вам нужно умножьте на эти два значения и разделите произведение на 100%. То есть масса растворенного вещества равна
Вам нужно умножьте на эти два значения и разделите произведение на 100%. То есть масса растворенного вещества равна вес.% × M/100% .
Что такое массовая процентная концентрация, если у меня есть 10 г растворенного вещества?
Ответ зависит от общей массы раствора . Вам нужно разделить 10 г на общую массу и умножить на 100% , чтобы получить ответ. Например, если у вас 1 кг в сумме, то массовая процентная концентрация равна 1 % , потому что 10 г / 1000 г × 100 % = 1 % .
Анна Паулрик, кандидат в докторскую степень
Плотность
Молярная масса
г/моль
Молярность
Концентрация
WT/WT %
МАССА на 100 G H3O
/100 G H3O
. подобные калькуляторы стехиометрии и растворов 🧪
Фактический выходAlligationAtom… Еще 36
3.
 4: Концентрации растворов — Химия LibreTexts
4: Концентрации растворов — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 221455
- Эллисон Сульт
- Университет Кентукки
Результаты обучения
- Определить концентрацию.
- Используйте термины «концентрированный» и «разбавленный» для описания относительной концентрации раствора.
- Рассчитайте молярность раствора.
- Расчет процентной концентрации (м/м, об/об, м/об).
- Опишите раствор с концентрацией в \(\text{ppm}\) или \(\text{ppb}\).
- Используйте единицы измерения концентрации в расчетах.
- Определите эквиваленты для иона.

- Завершите вычисления относительно эквивалентов молей, объемов или массы.
- Завершить расчет разбавления.
Существует несколько способов выражения количества растворенного вещества в растворе. Концентрация раствора является мерой количества растворенного вещества, растворенного в данном количестве растворителя или раствора . Концентрированный раствор содержит относительно большое количество растворенного вещества. Разбавленный раствор содержит относительно небольшое количество растворенного вещества 903:30 . Однако эти термины относительны, и нам нужно уметь выражать концентрацию более точным, количественным образом. Тем не менее, концентрированный и разбавленный полезны как термины для сравнения одного раствора с другим (см. рисунок ниже). Также имейте в виду, что термины «концентрировать» и «разбавлять» могут использоваться как глаголы. Если бы вы нагревали раствор, вызывая испарение растворителя, вы бы концентрировали его, потому что отношение растворенного вещества к растворителю увеличивалось бы. Если бы вы добавили больше воды в водный раствор, вы бы разбавили его, потому что отношение растворенного вещества к растворителю уменьшилось бы.
Если бы вы добавили больше воды в водный раствор, вы бы разбавили его, потому что отношение растворенного вещества к растворителю уменьшилось бы.
Концентрация в процентах
Одним из способов описания концентрации раствора является процентная доля раствора, состоящего из растворенного вещества. Этот процент может быть определен одним из трех способов: (1) масса растворенного вещества, деленная на массу раствора, (2) объем растворенного вещества, деленная на объем раствора, или (3) масса растворенного вещества. растворенного вещества разделить на объем раствора. Поскольку эти методы обычно дают немного разные значения, важно всегда указывать, как был рассчитан данный процент.
Массовый процент
Когда растворенное вещество в растворе является твердым, удобным способом выражения концентрации является массовый процент (масса/масса), который представляет собой граммы растворенного вещества на \(100 \: \text{g} \) решения.
\[\text{Проценты по массе} = \frac{\text{масса растворенного вещества}}{\text{масса раствора}} \times 100\%\]
Предположим, что раствор был приготовлен путем растворения \ (25,0 \: \text{г}\) сахара в \(125 \: \text{г}\) воды. Процент по массе будет рассчитываться следующим образом: 93 \: \text{g} \right)\), чтобы вычислить массу воды, которую необходимо добавить.
Объемный процент
Процентное содержание растворенного вещества в растворе легче определить по объему, когда растворяемое вещество и растворитель оба являются жидкостями. Объем растворенного вещества, разделенный на объем раствора, выраженный в процентах, дает процент по объему (объем/объем) раствора. Если раствор готовят, беря \(40. \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240. \: \text{мл}\) раствора, процент по объему равен:
\[\begin{align} \text{Проценты по объему} &= \frac{\text{объем растворенного вещества}}{\text{объем раствора}} \times 100\% \\ &= \frac{ 40 \: \text{мл этанола}}{240 \: \text{мл раствора}} \times 100\% \\ &= 16,7\% \: \text{этанол} \end{align}\]
Часто , на этикетках ингредиентов пищевых продуктов и лекарств количества указаны в процентах (см. рисунок ниже).
рисунок ниже).
Следует отметить, что, в отличие от массы, нельзя просто сложить объемы растворенного вещества и растворителя, чтобы получить окончательный объем раствора. При совместном добавлении растворенного вещества и растворителя масса сохраняется, но не всегда сохраняется объем. В некоторых случаях, как в приведенном выше примере, раствор готовили, начиная с \(40 \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240 \: \text{мл}\) этанола. решение. Простое смешивание \(40 \: \text{мл}\) этанола и \(200 \: \text{мл}\) воды не даст вам такого же результата, так как окончательный объем, вероятно, не будет точно \( 240 \: \text{мл}\).
Массово-объемный процент
Массово-объемный процент также используется в некоторых случаях и рассчитывается аналогично предыдущим двум процентам. Процент массы/объема рассчитывается путем деления массы растворенного вещества на объем раствора и выражения результата в процентах.
Например, если раствор готовится из \(10 \: \ce{NaCl}\) в воде, достаточной для приготовления раствора \(150 \: \text{мл}\), массовая концентрация будет равна
\[\begin{align} \text{Массо-объемная концентрация} & \frac{\text{масса растворенного вещества}}{\text{объем раствора}} \times 100\% \\ &= \frac{10 \: \text{g} \: \ce{NaCl}}{150 \: \text{мл раствора}} \times 100\% \\ &= 6,7\% \end{align}\]
Части на миллион и Части на миллиард
Двумя другими единицами концентрации являются части на миллион и части на миллиард. Эти единицы используются для очень малых концентраций растворенных веществ, таких как количество свинца в питьевой воде. Понять эти две единицы намного проще, если рассматривать процент как часть на сотню. Помните, что \(85\%\) эквивалентно 85 из ста. Раствор, который является \(15 \: \text{ppm}\), составляет 15 частей растворенного вещества на 1 миллион частей раствора. Раствор \(22 \: \text{ppb}\) содержит 22 части растворенного вещества на миллиард частей раствора. Хотя существует несколько способов выражения двух единиц \(\text{ppm}\) и \(\text{ppb}\), мы будем рассматривать их как \(\text{mg}\) или \(\mu \ text{g}\) растворенных веществ на \(\text{L}\) раствор соответственно.
Хотя существует несколько способов выражения двух единиц \(\text{ppm}\) и \(\text{ppb}\), мы будем рассматривать их как \(\text{mg}\) или \(\mu \ text{g}\) растворенных веществ на \(\text{L}\) раствор соответственно.
Например, \(32 \: \text{ppm}\) может быть записано как \(\frac{32 \: \text{мг растворенного вещества}}{1 \: \text{L раствор}}\), а \(59 \: \text{ppb}\) можно записать как \(\frac{59 \: \mu \text{g раствор}}{1 \: \text{L раствор}}\).
Молярность
Химикам в первую очередь необходимо, чтобы концентрация растворов выражалась таким образом, чтобы учитывалось количество присутствующих частиц, которые могут реагировать в соответствии с конкретным химическим уравнением. Поскольку процентные измерения основаны либо на массе, либо на объеме, они, как правило, бесполезны для химических реакций. Предпочтительной является единица концентрации, основанная на молях. молярность \(\left( \text{M} \right)\) раствора — число молей растворенного вещества, растворенного в одном литре раствора . Чтобы рассчитать молярность раствора, нужно количество молей растворенного вещества разделить на объем раствора, выраженный в литрах.
Чтобы рассчитать молярность раствора, нужно количество молей растворенного вещества разделить на объем раствора, выраженный в литрах.
\[\text{Молярность} \: \left( \text{M} \right) = \frac{\text{моли растворенного вещества}}{\text{литры раствора}} = \frac{\text{ mol}}{\text{L}}\]
Обратите внимание, что объем указан в литрах раствора, а не в литрах растворителя. Когда сообщается молярность, единицей измерения является символ \(\text{M}\), который читается как «молярность». Например, раствор, обозначенный как \(1,5 \: \text{M} \: \ce{NH_3}\), представляет собой «1,5 молярный раствор аммиака».
Пример 8.1.1
Раствор готовят путем растворения \(42,23 \: \text{g}\) \(\ce{NH_4Cl}\) в достаточном количестве воды, чтобы получить \(500,0 \: \text{мл }\) решения. Вычислите его молярность.
Решение:
Шаг 1: Перечислите известные количества и спланируйте задачу.
Известный
- Масса \(\ce{NH_4Cl} = 42,23 \: \text{g}\)
- Молярная масса \(\ce{NH_4Cl} = 53,50 \: \text{г/моль}\)
- Объем раствора \(= 500,0 \: \text{мл} = 0,5000 \: \text{л}\)
Неизвестно
- Молярность \(= ? \: \text{M}\)
Массу хлорида аммония сначала переводят в моли. Затем вычисляют молярность путем деления на литры. Обратите внимание, что данный объем был преобразован в литры.
Затем вычисляют молярность путем деления на литры. Обратите внимание, что данный объем был преобразован в литры.
Шаг 2: Решить.
\[42,23 \: \text{g} \: \ce{NH_4Cl} \times \frac{1 \: \text{моль} \: \ce{NH_4Cl}}{53,50 \: \text{g} \: \ce{NH_4Cl}} = 0,7893 \: \text{моль} \: \ce{NH_4Cl}\]
\[\frac{0,7893 \: \text{моль} \: \ce{NH_4Cl}}{0,5000 \: \text{L}} = 1,579 \: \text{M}\]
Шаг 3: Подумайте о своем результате .
Молярность равна \(1,579 \: \text{M}\), что означает, что литр раствора будет содержать 1,579 молей \(\ce{NH_4Cl}\). Уместно наличие четырех значащих цифр.
Рисунок 8.1.3: Мерные колбы бывают разных размеров, каждая из которых предназначена для приготовления разного объема раствора.Разведения
При добавлении дополнительного количества воды к водному раствору концентрация этого раствора уменьшается. Это связано с тем, что количество молей растворенного вещества не меняется, а общий объем раствора увеличивается. Мы можем установить равенство между молями растворенного вещества до разбавления (1) и молями растворенного вещества после разбавления (2).
Мы можем установить равенство между молями растворенного вещества до разбавления (1) и молями растворенного вещества после разбавления (2).
\[\text{моль}_1 = \text{моль}_2\]
Поскольку моль растворенного вещества в растворе равна молярности, умноженной на объем в литрах, мы можем установить их равными.
\[M_1 \times L_1 = M_2 \times L_2\]
Наконец, поскольку две части уравнения равны друг другу, объем может быть в любых выбранных нами единицах, если эта единица является одинаково с обеих сторон. Наше уравнение для расчета молярности разбавленного раствора принимает следующий вид:
\[M_1 \times V_1 = M_2 \times V_2\]
Кроме того, концентрация может быть выражена в любых других единицах, если \(M_1\) и \( M_2\) находятся в одном блоке.
Предположим, что у вас есть \(100. \: \text{mL}\) раствора \(2.0 \: \text{M}\) \(\ce{HCl}\). Вы разбавляете раствор, добавляя достаточное количество воды, чтобы сделать объем раствора \(500. \: \text{мл}\). Новую молярность можно легко рассчитать, используя приведенное выше уравнение и решив \(M_2\).
Новую молярность можно легко рассчитать, используя приведенное выше уравнение и решив \(M_2\).
\[M_2 = \frac{M_1 \times V_1}{V_2} = \frac{2.0 \: \text{M} \times 100. \: \text{mL}}{500. \: \text{мл}} = 0,40 \: \text{M} \: \ce{HCl}\]
Раствор разбавлен в пять раз, так как новый объем в пять раз больше исходного. оригинальный объем. Следовательно, молярность составляет одну пятую от первоначального значения. Другая распространенная проблема разбавления заключается в том, чтобы решить, сколько высококонцентрированного раствора требуется для получения желаемого количества раствора с более низкой концентрацией. Высококонцентрированный раствор обычно называют исходным раствором.
Пример 8.1.2
Азотная кислота \(\left( \ce{HNO_3} \right)\) является мощной и агрессивной кислотой. При заказе в компании-поставщике химикатов его молярность составляет \(16 \: \text{M}\). Сколько исходного раствора азотной кислоты нужно использовать, чтобы получить \(8,00 \: \text{L}\) из \(0,50 \: \text{M}\) раствора?
Решение:
Шаг 1: Перечислите известные количества и спланируйте задачу.
Известный
- Запас \(\ce{HNO_3} \: \left( M_1 \right) = 16 \: \text{M}\)
- \(V_2 = 8.00 \: \text{L}\)
- \(М_2 = 0,50 \: \текст{М}\)
Неизвестно
- Объем запаса \(\ce{HNO_3} \: \left( V_1 \right) = ? \: \text{L}\)
Неизвестным в уравнении является \(V_1\), необходимый объем концентрированного маточного раствора.
Шаг 2: Решить.
\[V_1 = \frac{M_2 \times V_2}{V_1} = \frac{0,50 \: \text{M} \times 8,00 \: \text{L}}{16 \: \text{M} } = 0,25 \: \text{L} = 250 \: \text{мл}\]
Шаг 3: Подумайте о своем результате.
\(250 \: \text{мл}\) исходного \(\ce{HNO_3}\) раствора необходимо разбавить водой до конечного объема \(8,00 \: \text{л}\ ). Разбавление от \(16 \: \text{M}\) до \(0,5 \: \text{M}\) равно 32.
Эквиваленты
много способов. Также очень важно использовать единицы с любыми значениями, чтобы обеспечить правильную дозировку лекарств или сообщать об уровнях веществ в крови, и это только два. 9{2-}} & 2 \end{array}\]
9{2-}} & 2 \end{array}\]
Эквиваленты используются, поскольку концентрация зарядов важнее, чем идентичность растворенных веществ. Например, стандартный раствор для внутривенного введения не содержит тех же растворенных веществ, что и кровь, но концентрация зарядов такая же.
Иногда концентрация ниже, и в этом случае миллиэквиваленты \(\left( \text{mEq} \right)\) являются более подходящими единицами измерения. Так же, как метрические префиксы, используемые с базовыми единицами, милли используются для изменения эквивалентов, поэтому \(1 \: \text{Eq} = 1000 \: \text{mEq}\). 9+}\]
Авторы
Эта страница под названием 3.4: Concentrations of Solutions распространяется по незаявленной лицензии и была создана, изменена и/или курирована Эллисон Сульт.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Эллисон Сульт
- Показать страницу Содержание
- нет на странице
- Теги
- концентрация
- частей на миллион
- источник[1]-chem-155677
- источник[2]-chem-58828
- источник[3]-chem-155677
- источник-хим-58828
Как рассчитать концентрацию химического раствора
Эта запись опубликована автором Anne Helmenstine (обновлено )
Химики часто работают с химическими растворами. (Keith Weller, USDA)
Концентрация химического раствора относится к количеству растворенного вещества, растворенного в растворителе. Хотя принято думать о растворенном веществе как о твердом веществе, которое добавляют к растворителю (например, при добавлении поваренной соли в воду), растворенное вещество может существовать в другой фазе. Если растворяемое вещество и растворитель находятся в одной фазе, то растворителем является присутствие вещества в наибольшем процентном соотношении. Например, если мы добавим небольшое количество этанола в воду, то этанол будет растворенным веществом, а вода — растворителем. Если мы добавим меньшее количество воды к большему количеству этанола, то вода будет растворенным веществом.
Единицы концентрации
После идентификации растворенного вещества и растворителя можно определить концентрацию раствора. Существует несколько способов выражения концентрации. Наиболее распространенными единицами являются процентов состава по массе , молярная доля , молярность , моляльность или нормальность .
Существует несколько способов выражения концентрации. Наиболее распространенными единицами являются процентов состава по массе , молярная доля , молярность , моляльность или нормальность .
Масса растворенного вещества, деленная на массу раствора (масса растворенного вещества плюс масса растворителя), умноженная на 100.
Пример:
Определите процентный состав по массе 100 г солевого раствора, содержащего 20 г соли.
20 г NaCl / 100 г раствора x 100 = 20% раствор NaCl решение. Сумма всех мольных долей в растворе должна равняться 1.
Пример:
Какие мольные доли компонентов раствора образуются при 92 г глицерина смешать с 90 г воды? (молекулярная масса воды = 18; молекулярная масса глицерина = 92)
90 г воды = 90 г x 1 моль / 18 г = 5 моль воды
92 г глицерина = 92 г x 1 моль / 92 г = 1 моль глицерина
всего моль = 5 + 1 = 6 моль
x вода = 5 моль / 6 моль = 0,833
x глицерин = 1 моль / 6 моль = 0,167
Это хорошая идея, чтобы проверить свои вычисления, убедившись, что мольные доли складываются до 1:
x вода + x глицерин = 0,833 + 0,167 = 1,000
Молярность (M)
Молярность, вероятно, является наиболее часто используемой единицей концентрации. Это количество молей растворенного вещества на литр раствора (а не объем растворителя).
Это количество молей растворенного вещества на литр раствора (а не объем растворителя).
Пример:
Какова молярность раствора, полученного при добавлении воды к 11 г CaCl 2 для получения 100 мл раствора?
11 г CaCl 2 / (110 г CaCl 2 / моль CaCl 2 ) = 0,10 моль CaCl 2
100 мл x 1 л / 1000 мл = 9,10 мл0646 молярность = 0,10 моль/0,10 л
молярность = 1,0 моль/л
моляльность (m)
моляльность – это количество молей растворенного вещества на килограмм растворителя. Поскольку плотность воды при 25 °C составляет около 1 кг на литр, моляльность примерно равна молярности разбавленных водных растворов при этой температуре. Это полезное приближение, но помните, что это всего лишь приближение, и оно не применяется, когда раствор находится при другой температуре, не разбавлен или используется другой растворитель, кроме воды.
Пример:
Какова моляльность раствора 10 г NaOH в 500 г воды?
10 г NaOH/(4 г NaOH/1 моль NaOH) = 0,25 моль NaOH
500 г воды x 1 кг/1000 г = 0,50 кг воды
моляльность = 0,25 моль/0,50 кг = 0,50 м
Нормальность (N)
Нормальность равна эквивалентной массе грамм растворенного вещества на литр раствора. Грамм эквивалентного веса или эквивалента является мерой реактивной способности данной молекулы. Нормальность — единственная единица концентрации, зависящая от реакции.
Грамм эквивалентного веса или эквивалента является мерой реактивной способности данной молекулы. Нормальность — единственная единица концентрации, зависящая от реакции.
Пример:
1 М серная кислота (H 2 SO 4 ) составляет 2 N для кислотно-основных реакций, поскольку каждый моль серной кислоты обеспечивает 2 моля ионов H + . С другой стороны, 1 М серной кислоты составляет 1 н. для осаждения сульфата, поскольку 1 моль серной кислоты дает 1 моль сульфат-ионов.
Приготовление разбавлений
Вы разбавляете раствор всякий раз, когда добавляете в раствор растворитель. Добавление растворителя приводит к раствору более низкой концентрации. Вы можете рассчитать концентрацию раствора после разбавления, применяя это уравнение:
M i V i = M f V f
где M — молярность, V — объем, а индексы i и f относятся к начальному и конечному значениям.
Пример:
Сколько миллилитров 5,5 М NaOH необходимо для приготовления 300 мл 1,2 М NaOH?
Решение:
5,5 м x v 1 = 1,2 м х 0,3 л
V 1 = 1,2 м х 0,3 л / 5,5 м
В 1 = 0,065 л
V 1 9064 = 65 = 65 мл 6 V 9063 1 9064 = 65 = 65 мл.

 Если необходимо измерить объем в лаборатории, приготовьте раствор в мерной пробирке или мензурке и определите объем. Чтобы получить более точный результат, определите объем по верхнему краю поверхности раствора (мениска). Запишите найденную величину.[2]
X
Источник информации
Если необходимо измерить объем в лаборатории, приготовьте раствор в мерной пробирке или мензурке и определите объем. Чтобы получить более точный результат, определите объем по верхнему краю поверхности раствора (мениска). Запишите найденную величину.[2]
X
Источник информации  В нашем примере имеем 2 л + 1,6 мл = 2000 мл + 1,6 мл = 2001,6 мл. Можно оставить найденный объем в миллилитрах или перевести его в литры: 2,002 л.
В нашем примере имеем 2 л + 1,6 мл = 2000 мл + 1,6 мл = 2001,6 мл. Можно оставить найденный объем в миллилитрах или перевести его в литры: 2,002 л. Измерьте массу того вещества, которое вы собираетесь добавить в раствор. Не забудьте вычесть массу емкости, если вы используете ее при взвешивании, чтобы получить правильный результат.[4]
X
Источник информации
Измерьте массу того вещества, которое вы собираетесь добавить в раствор. Не забудьте вычесть массу емкости, если вы используете ее при взвешивании, чтобы получить правильный результат.[4]
X
Источник информации  Плотность воды составляет 1000 г/л, поэтому получаем 1000 г/л = m/(1,2 л). Умножим обе стороны равенства на 1,2 литра и найдем массу в граммах: m = 1,2 л×1000 г/л = 1200 г. Прибавим массу порошка какао и получим 1210 г.
Плотность воды составляет 1000 г/л, поэтому получаем 1000 г/л = m/(1,2 л). Умножим обе стороны равенства на 1,2 литра и найдем массу в граммах: m = 1,2 л×1000 г/л = 1200 г. Прибавим массу порошка какао и получим 1210 г.
 Сложите все атомные массы элементов растворенного вещества, чтобы найти общую молярную массу. Укажите в полученном результате, что это г/моль (количество граммов на моль). [9]
X
Источник информации
Сложите все атомные массы элементов растворенного вещества, чтобы найти общую молярную массу. Укажите в полученном результате, что это г/моль (количество граммов на моль). [9]
X
Источник информации 



 = c × 100% × M/d
= c × 100% × M/d 
 Просто введите оставшиеся значения и посмотрите, как он сделает всю работу за вас.
Просто введите оставшиеся значения и посмотрите, как он сделает всю работу за вас.