10.5.2. Давление насыщенного пара растворов. Тонометрический закон Рауля.
Пример 1. Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11 в 45,05 г воды при 65 ºС, если давление паров воды при этой температуре равно 2,5·104 Па.
Решение: Давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
где p0 – давление пара над чистым растворителем;
p – давление пара растворителя над раствором;
n – количество растворенного вещества, моль;
N – количество растворителя, моль.
M (C12H22O11) = 342,30 г/моль;
M
(H
Количество растворенного вещества и растворителя: n=34,23/342,30=0,1 моль; N = 45,05/18,02= 2,5моль.
Давление пара над раствором:
Пример 2. Рассчитайте молекулярную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 40 °С. Давление водяного пара при этой температуре равно 7375,9 Па.
Решение: Относительное понижение давления пара растворителя над раствором равно
Находим:
здесь mx– масса нэлектролита, молярная масса которого Mx г/моль.
0,309Mx+ 0,202=28,5;
0,309Mx =28,298;
Mx=91,58
г/моль.
Молекулярная масса неэлектролита равна ~ 92 г/моль.
1 Давление пара эфира при 300С равно 8, 64∙104 Па. Сколько молей неэлектролита надо растворить в 50 молях эфира, чтобы понизить давление пара при данной температуре на 2666 Па? Ответ: 1,6 моля.
2 Понижение давления пара над раствором, содержащим 0,4 моля анилина в 3,04 кг сероуглерода, при некоторой температуре, равно 1003,7 Па. Давление пара сероуглерода при той же температуре 1,0133∙105 Па. Вычислите молекулярную массу сероуглерода. Ответ: 76,0.
3 При некоторой
температуре давление пара над раствором,
содержащим 62 г фенола С6H5ОН
в 60 молях эфира, равно 0,507∙105 Па. Найдите давление пара эфира при этой
температуре. Ответ: 0,513∙10
4 Давление пара
воды при 500С
равно 12334 Па. Вычислите давление пара
раствора, содержащего 50 г этиленгликоля
С2Н4(ОН)2 в 900 г воды.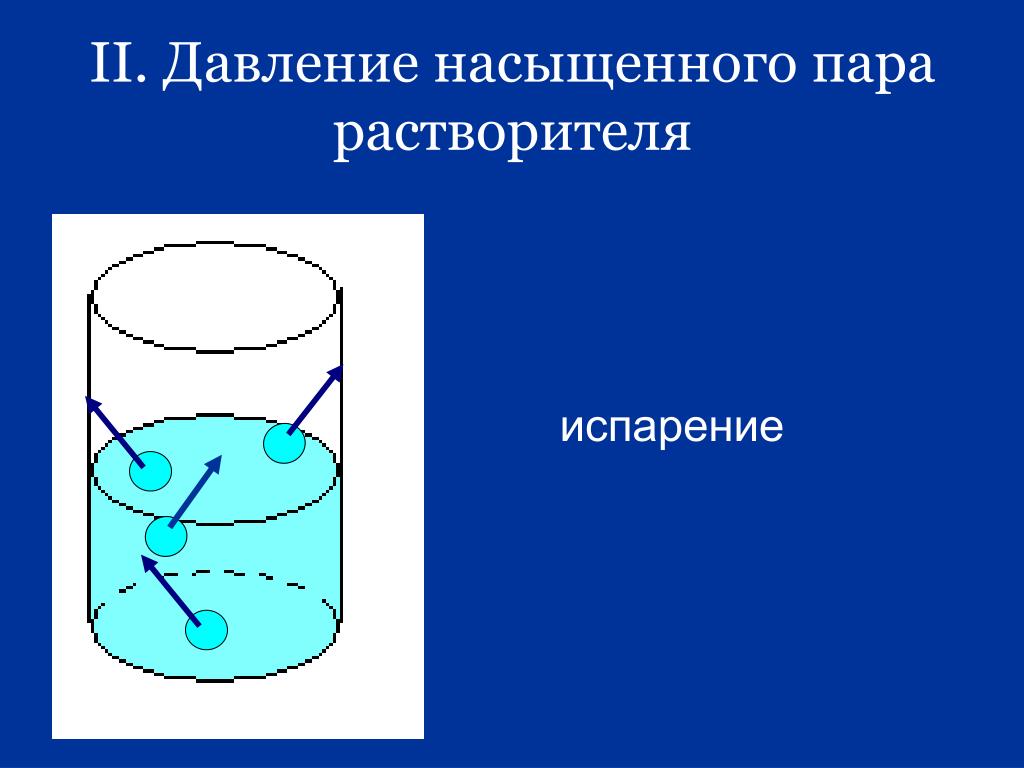 Ответ: 12140 Па.
Ответ: 12140 Па.
5 Определите давление пара над раствором, содержащим 1,212∙1023 молекул неэлектролита в 100 г воды при 1000С. Давление пара воды при 100 °С равно 1,0133∙105 Па. Ответ: 0,98∙105 Па.
6 Давление водяного пара при 650С равно 25003 Па. Определите давление пара над раствором, содержащим 34,2 г сахара С12H22O11 в 90 г воды при этой температуре. Ответ: 24512 Па.
7 Вычислите молекулярную массу глюкозы, если давление водяного пара над раствором 27 г глюкозы в 108 г воды при 100 0С равно 98775,3 Па. Ответ: 180.
8 Давление пара воды при 1000С равно 1,0133∙105 Па. Вычислите давление водяного пара над 10%-ным раствором мочевины СО(NН2)2 при этой температуре. Ответ: 0,98∙105 Па.
9 Давление пара
над раствором 10,5 г неэлектролита в 200 г
ацетона (СН3)2CO
равно 21854,4 Па. Давление пара ацетона при
этой температуре равно 23939,35 Па. Найдите
молекулярную массу неэлектролита.
Ответ:32,0.
Давление пара ацетона при
этой температуре равно 23939,35 Па. Найдите
молекулярную массу неэлектролита.
Ответ:32,0.
10 Рассчитайте молекулярную массу неэлектролита, если при 200С давление водяного пара над 63%-ным водным раствором этого неэлектролита равно 1399,40 Па. Давление паров воды при этой температуре равно 2335,42Па. Ответ: 46, 0.
11 Давление пара
воды при 250С
составляет 3167 Па. Вычислить для этой
температуры давление пара раствора, в
450 г которого содержится 90 г глюкозы
С
12 Давление пара воды при 200С составляет 2338 Па. Сколько граммов сахара C12H22O11 следует растворить в 720 г воды для получения раствора, давление пара которого на 18,7 Па меньше давления пара воды? Вычислить процентное содержание сахара в растворе. Oтвет: 109 г; 13,5%.
13 При 00С
давление пара эфира (C2H5)2O
составляет 2465 Па. Найдите для той же
температуры: а) давление пара 5%-ного
раствора анилина С6Н5NH2 в эфире; б) давление пара 10%-ного раствора
бензойной кислоты С6Н5СООН
в эфире. Ответ: а) 23,65 кПа; б) 23,09 Па.
Найдите для той же
температуры: а) давление пара 5%-ного
раствора анилина С6Н5NH2 в эфире; б) давление пара 10%-ного раствора
бензойной кислоты С6Н5СООН
в эфире. Ответ: а) 23,65 кПа; б) 23,09 Па.
14При 320С давление пара водного раствора некоторого неэлектролита составляет 4721 Па, а давление пара воды при той же температуре 4753 Па. Вычислить осмотическое давление при той же температуре, приняв плотность раствора равной единице. Ответ: 622 кПа.
15 Осмотическое давление водного раствора глицерина С3Н8О3 составляет при 00С 567,3 кПа. Приняв плотность раствора равной единице, вычислить давление пара раствора при 00С, если давление пара воды при той же температуре составляет 610,5 Па. Ответ: 608 Па.
16 Чему равно
давление пара раствора, содержащего 46
г глицерина С3Н803 в 900 г воды при 400С,
если давление пара воды при той же
температуре 55,32 мм рт. ст. Ответ: 55,1 мм
рт.ст.
ст. Ответ: 55,1 мм
рт.ст.
17 Давление пара
раствора 27 г неэлектролита в 108 г воды
при 75
18 Давление пара раствора 8,89 г неэлектролита в 100 г воды при 00С равно 4,54 мм рт.ст. Вычислить молекулярную массу неэлектролита, если давление пара воды при 00С равно 4,58 мм рт.ст. Ответ: 183,2.
19 Давление пара водного раствора глюкозы С6Н12О6 при 750С равно 250 мм рт.ст. Вычислить процентную концентрацию раствора, если давление пара воды при 75 °С равно 289,1 мм рт.ст. Ответ: 58,3%.
20 Давление пара
чистого ацетона (СН3)2СO
при 200С
равно 179,6 мм рт.ст. Вычислить давление
пара раствора 2,5 г камфоры С10Н16О в 100 г ацетона
при той же температуре.
21 Давление пара раствора глицерина С3Н8О3 в воде при 400С равно 50мм рт.ст. Сколько приблизительно молекул воды приходится на одну молекулу глицерина в указанном растворе? Давление пара воды при 400С равно 55,32 мм рт.ст. Ответ: ~11.
22 Давление пара эфира (С2Н5)2 O при 300С равно 647,9 мм рт.ст.; давление пара раствора 3,1 г анилина в 370 г эфира при той же температуре равно 643,58 мм рт.ст. Вычислить молекулярную массу анилина. Ответ: 93.
23 Давление пара воды при 400С равно 55,32 мм рт.ст. Вычислить понижение давления пара при растворении 0,2 моль вещества в 540 г воды. Ответ: 334 мм рт.ст.
24 Давление пара эфира при 300
 ст.? Ответ: 0,627
моль.
ст.? Ответ: 0,627
моль.25 Давление пара воды при 750С равно 289,1 мм рт. ст. В скольких молях воды нужно растворить 0,4 моль вещества, чтобы при данной температуре понизить давление пара на 9 мм рт.ст.? Ответ: 12,45 моль.
26 Давление пара воды при 550С равно 633,9 мм рт.ст. Вычислить давление пара раствора, содержащего 29 г фенола С6Н5ОH в 900 г воды. Ответ: 630,7 мм рт.ст.
27 Давление пара воды при 100 °С равно 760 мм рт.ст. Вычислить давление пара над 4%-ным раствором мочевины СО(NН2)2 при этой температуре. Ответ: 750,6 мм рт.ст.
28 При некоторой температуре давление пара над раствором, содержащим 31 г анилина С 6H5NH2 в 30 моль эфира, равно 540,8 мм рт.ст. Вычислить давление пара эфира при этой температуре. Ответ: 546,8 мм рт.ст.
29 Над раствором,
содержащим 5,59 маннозы в 180 г воды,
давление пара при 800С
равно 354 мм рт. ст., а давление пара воды
при этой температуре 355,1 мм рт.ст.
Вычислить молекулярную массу маннозы.
Ответ: 180.
ст., а давление пара воды
при этой температуре 355,1 мм рт.ст.
Вычислить молекулярную массу маннозы.
Ответ: 180.
30 При некоторой температуре давление пара над раствором, содержащим 2,44 г бензойной кислоты в 370,0 г эфира С4Н10О, равно 917,5 мм рт.ст. Давление пара эфира при этой температуре 921,2 мм рт.ст. Вычислить молекулярную массу бензойной кислоты. Ответ: 122.
Давление насыщенного пара температуре 20 градусов. C. Коллигативные свойства растворов
Пример 1. Вычисление осмотического давления растворов.
Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы С 6 Н 12 О 6 при 0°С.
Решение: Осмотическое давление раствора определяют согласно закону Вант-Гоффа:
π oc м = nRT / V ,
где п — количество растворенного вещества, моль;
V – объем раствора, м 3 ;
R — молярная
газовая постоянная, равная 8,3144
Дж/(моль-К).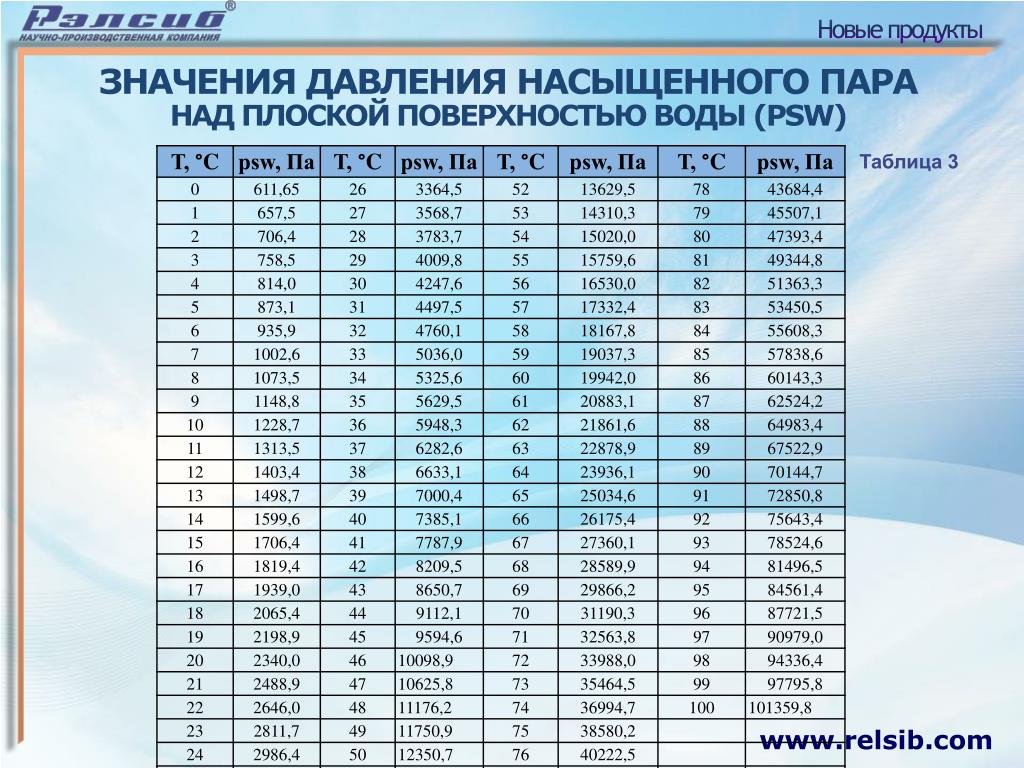
В 1,4 л раствора содержится 63 г глюкозы, молярная масса которой равна 180 г/моль. Следовательно, в 1,4л раствора содержится
n= 63/180=0,35моль глюкозы.
Осмотическое давление этого раствора глюкозы:
Пример 2. Определение молекулярной массы неэлектролита по осмотическому давлению раствора.
Рассчитайте молекулярную массу неэлектролита, если в 5л раствора содержится 2,5 г неэлектролита. Осмотическое давление этого раствора равно 0,23∙10 5 Па при 20°С.
Решение: Заменив п выражением m / M , где т — масса растворенного вещества, а М — его молярная масса, получим
π oc м = mRT /(MV ).
Отсюда молярная масса растворенного вещества равна
Следовательно, молекулярная масса неэлектролита равна 52,96.
Росм кПа: R=8,31 Дж/моль∙К;
Росм мм Hg ст.: R=62,32 л∙мм.рт.ст./град.∙моль;
Росм.
атм.: R=0,082
л∙атм../град. ∙моль;
∙моль;
Вычислите осмотическое давление раствора, содержащего 90,08 г глюкозы С 6 H 12 O 6 в 4 л раствора при 27 0 С. Ответ: 3,12∙10 5 Па.
Найдите осмотическое давление при 0 0 С для раствора, содержащего в 1 л 18,4 г глицерина С 3 Н 8 О 3 . Ответ: 4,54∙10 5 Па.
Рассчитайте осмотическое давление раствора неэлектролита, содержащего 1,52∙10 23 молекул в 0,5л раствора при 0 и при 30 0 С.
Ответ: 11,35∙10 5 Па; 12,60∙10 5 Па.
В 1 л раствора при 25°С содержится 6,84 г сахара C 12 H 22 O 11 и 1/38 г этилового спирта С 2 Н 5 ОН. Каково осмотическое давление раствора? Ответ:12,39∙10 4 Па.
При 0°С осмотическое давление раствора сахара C 12 H 22 O 11 и равно 3,55∙10 5 Па. Сколько граммов сахара содержится в 1 л раствора? Ответ:53,53г.
Осмотическое давление раствора, содержащего в 1л 3,2г неэлектролита, равно 2,42∙10 5 Па при 20 0 С. Вычислите молекулярную массу неэлектролита. Ответ: 32,2.
В 0,5л раствора
содержится 2г неэлектролита, и раствор
при 0 0 С
имеет осмотическое давление, равное
0,51∙10 5
Па. Какова молекулярная масса
неэлектролита? Ответ: 178.
Какова молекулярная масса
неэлектролита? Ответ: 178.
Найдите формулу вещества (маннита), содержащего 39,56% углерода, 7,69% водорода и 52,75% кислорода, если осмотическое давление раствора, содержащего в 1л 72 г маннита, равно 9,00∙10 5 Па при 0 0 С. Ответ: С 6 H 14 O 6 .
Раствор анилина С 6 H 5 NH 2 имеет такое же осмотическое давление, что и раствор, содержащий 3,2 г СН 3 ОН в 1 л воды при 18 0 С. Сколько граммов анилина содержится в 1 л раствора? Ответ: 9,30 г.
При какой температуре осмотическое давление раствора, содержащего в 1 л 45 г глюкозы С 6 Н 12 О 6 , достигнет 607,8 кПа? Ответ: 19,5 0 С.
Вычислить осмотическое давление 25%-ного раствора сахара С 12 H 22 O 11 при 15 0 С (плотность 1,105 г/мл). Ответ: 1935кПа.
Сколько граммов глюкозы С 6 H 12 О 6 содержится в 200 мл раствора, осмотическое давление которого при 37 0 C составляет 810,4 кПа? Ответ: 11,3г.
Осмотическое
давление раствора, в 250 мл которого
содержится 0,66 мочевины, равно 111,1 кПа
при 33 0 С. Вычислите молекулярную массу мочевины.
Ответ: 60,3.
Вычислите молекулярную массу мочевины.
Ответ: 60,3.
Сколько молекул растворенного вещества содержится в 1 мл раствора, осмотическое давление которого при 54 °С составляет 6065 Па? Ответ: 1,34∙ 10 18 .
1 мм 3 раствора содержит 10 15 молекул растворенного вещества. Вычислить осмотическое давление раствора при 0 0 С. В каком объеме раствора содержится 1 моль растворенного вещества? Ответ: 3772 Па; 602 л.
Из 342 г сахара С 12 Н 22 O 11 и воды приготовлено 22,4 л раствора. Чему равно осмотическое давление при 0 0 С?
Вычислите осмотическое давление 5%-ного раствора ацетона (СН 3) 2 СO в воде при 0 0 С. Плотность раствора 0,90 г/мл. Ответ: 19 атм.
Вычислить осмотическое давление раствора при 17 0 С, если 1 л его содержит 18,4 г глицерина С 3 Н 8 O 3 . Ответ: 4, 76 атм.
Опытным путем
найдено, что осмотическое давление
раствора, содержащего 5 г гемоглобина
(белковое вещество крови) на 100 мл
раствора, при 27 0 С
равно 13,65 мм рт. ст. Вычислить молекулярную
массу гемоглобина. Ответ: ~68500.
ст. Вычислить молекулярную
массу гемоглобина. Ответ: ~68500.
В 7 л раствора содержится 24,4 г неэлектролита. Осмотическое давление раствора при 0 0 С равно 1,3 атм. Вычислить молекулярную массу неэлектролита. Ответ: 60.
Раствор сахара С 12 H 12 О 11 при 0 0 С имеет осмотическое давление, равное 144 мм рт.ст. Сколько граммов сахара содержится в 1 л такого раствора? Ответ: 2,3 г.
Осмотическое давление раствора глюкозы С 6 Н 12 O 6 при 0 0 С равно 4,48 атм. Какова молярность такого раствора? Сколько граммов глюкозы содержит 1 л этого раствора? Ответ: 0,2 моль/л; 36г.
40 мл раствора, содержащего 0,2 г растворенного вещества, при 27,3 0 С обнаруживают осмотическое давление, равное 1,2 атм. Вычислить молекулярную массу растворенного вещества. Ответ: 102,75.
Выразить в мм рт.ст. осмотическое давление раствора при 0 0 С, содержащего 6,02∙10 17 молекул растворенного вещества в 1 мл раствора. Ответ: 680 мм рт.ст.
Выразить в мм
рт.ст. осмотическое давление раствора
при 10 0 С,
содержащего 0,736 г глицерина С 3 Н 8 0 3
в 400 мл раствора. Ответ: 553 мм рт.ст.
осмотическое давление раствора
при 10 0 С,
содержащего 0,736 г глицерина С 3 Н 8 0 3
в 400 мл раствора. Ответ: 553 мм рт.ст.
Вычислить молярную концентрацию раствора, осмотическое давление которого при 0 0 С равно 1,12 атм. Ответ: 0,05 моль/л.
При 0 0 С осмотическое давление раствора, содержащего 0,550 г гидрохинона в 500 мл раствора, равно 170,2 мм рт.ст. Вычислить молекулярную массу растворенного вещества. Ответ: 110.
При 0 0 С осмотическое давление раствора, содержащего 3,04 г дифениламина в 600 мл раствора, равно 510,7 мм рт.ст. Вычислить молярную массу дифениламина. Ответ: 169.
Сколько воды надо прибавить к 5 л раствора сахара С 12 Н 22 O 11 , чтобы понизить его осмотическое давление с 10,13∙10 5 до 1,013∙10 5 Па? Ответ: 45 л.
Во сколько раз повысится осмотическое давление раствора концентрации 0,1 моль/л при нагревании от 7 до 47 0 С? Ответ: в 1,14 раза.
«Физика — 10 класс»
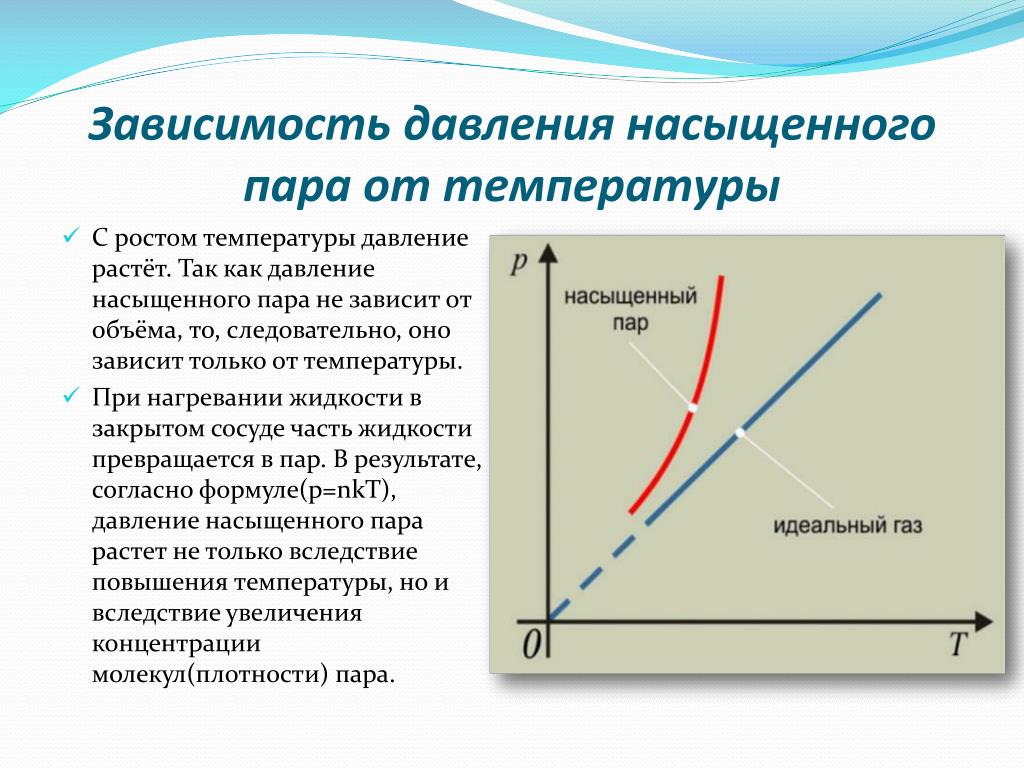
При решении задач надо иметь в виду, что давление и плотность насыщенного пара не зависят от его объёма, а зависят только от температуры. Уравнение состояния идеального газа приближённо применимо и для описания насыщенного пара. Но при сжатии или нагревании насыщенного пара его масса не остаётся постоянной.
Уравнение состояния идеального газа приближённо применимо и для описания насыщенного пара. Но при сжатии или нагревании насыщенного пара его масса не остаётся постоянной.
При решении некоторых задач могут понадобиться значения давления насыщенного пара при некоторых температурах. Эти данные нужно брать из таблицы.
Задача 1.
Закрытый сосуд объёмом V 1 = 0,5 м 3 содержит воду массой m = 0,5 кг. Сосуд нагрели до температуры t = 147 °С. На сколько следует изменить объём сосуда, чтобы в нём содержался только насыщенный пар? Давление насыщенного пара р н. п при температуре t = 147 °С равно 4,7 10 5 Па.
Р е ш е н и е.
Насыщенный пар при давлении р н. п занимает объём, равный где М = 0,018 кг/моль — молярная масса воды. Объём сосуда V 1 > V, а значит, пар не является насыщенным. Для того чтобы пар стал насыщенным, объём сосуда следует уменьшить на
Задача 2.
Относительная влажность воздуха в закрытом сосуде при температуре t 1 = 5 °С равна φ 1 = 84 %, а при температуре t 2 = 22 °С равна φ 2 = 30 %. Во сколько раз давление насыщенного пара воды при температуре t 2 больше, чем при температуре t 1 ?
Во сколько раз давление насыщенного пара воды при температуре t 2 больше, чем при температуре t 1 ?
Р е ш е н и е.
Давление водяного пара в сосуде при Т 1 = 278 К равно где р н. п1 — давление насыщенного пара при температуре Т 1 . При температуре Т 2 = 295 К давление
Так как объём постоянен, то по закону Шарля
Отсюда
Задача 3.
В комнате объёмом 40 м 3 температура воздуха 20 °С, его относительная влажность φ 1 = 20 %. Сколько надо испарить воды, чтобы относительная влажность φ 2 достигла 50 % ? Известно, что при 20 °С давление насыщающих паров р н п = 2330 Па.
Р е ш е н и е.
Относительная влажность отсюда
Давление пара при относительной влажности φ 1 и φ 2
Плотность связана с давлением равенством ρ = Mp/RT, откуда
Массы воды в комнате при влажности φ 1 и φ 2
Масса воды, которую надо испарить:
Задача 4.
В комнате с закрытыми окнами при температуре 15 °С относительная влажность φ = 10 %. Чему станет равна относительная влажность, если температура в комнате повысится на 10 °С? Давление насыщенного пара при 15 °С р н. п1 = 12,8 мм рт. ст., а при 25 °С р н п2 = 23,8 мм рт. ст.
Чему станет равна относительная влажность, если температура в комнате повысится на 10 °С? Давление насыщенного пара при 15 °С р н. п1 = 12,8 мм рт. ст., а при 25 °С р н п2 = 23,8 мм рт. ст.
Так как пар ненасыщенный, то парциальное давление пара изменяется по закону Шарля р 1 /Т 1 = р 2 /Т 2 . Из этого уравнения можно определить давление ненасыщенного пара р 2 при Т 2: р 2 = р 1 Т 2 /Т 1 . Относительная влажность при Т 1 равна:
Относительная влажность при Т 2 = 25 °С равна:
Из уравнения (1) получим следовательно,
Задача 5.
Относительная влажность воздуха в помещении 60% температура 18 °С. До какой температуры надо охладить металлический предмет, чтобы его поверхность запотела?
Р е ш е н и е.
Относительная влажность воздуха φ = (р/р н п)100%.
Для конденсации пара необходимо, чтобы он стал насыщенным, т. е. температура достигла точки росы. Давление пара при 18 °С должно стать равным давлению насыщенного пара при искомой температуре:
Давление насыщенного пара р н п = 1,23 10 4 Па при температуре t 2 = 10 °С (определяем по таблице). Следовательно, t 2 ≈ 10 °С.
Следовательно, t 2 ≈ 10 °С.
Давление насыщенного пара
1. Определите давление насыщенного пара воды при 25 °С над водным раствором сахарозы, моляльность которого 0,2 , зная, что давление насыщенного пара чистой воды при 25 °С равно 3167 Па.
Ответ: Р = 3156 Па.
2. При температуре 70 °С давление насыщенного пара чистого бензола 72968 Па, чистого толуола – 26927 Па. Определите общее давление пара и парциальные давления паров, равновесных при 70 °С с жидкой смесью бензола с толуолом. Мольная доля толуола в жидкой фазе N ж (С 6 Н 5 СН 3) = 0,2.
Ответ: Р = 63759 Па, Р(С 6 Н 6) = 58374 Па, Р(С 6 Н 5 СН 3) = 5385 Па.
3. Вычислите давление насыщенного пара над 2%-ным (по массе) водным раствором сахарозы (С 12 Н 22 О 11) при 373 К. Считайте этот раствор подчиняющимся законам предельно разбавленных растворов. Давление пара чистого растворителя при 373 К Р° = 1013 гПа.
Ответ: Р = 1012 гПа.
4. При 298 К давление водяного пара составляет 23,76 Торр, а давление пара морской воды 22,98 Торр. Полагая, что морская вода из всех солей содержит только хлорид натрия, оцените моляльную концентрацию соли.
Полагая, что морская вода из всех солей содержит только хлорид натрия, оцените моляльную концентрацию соли.
Ответ: С мл (NaCl) = 0,93 .
5. Давление пара чистой воды при 313 К равно 7375,4 Па. Вычислите при данной температуре давление пара над раствором, содержащим 0,9206×10 -2 кг глицерина в 0,36 кг воды. Формула глицерина: СН 2 ОН-СНОН-СН 2 ОН.
Ответ: Р = 7338,7 Па.
6. В 0,1 кг эфира (М = 74 ) содержится 0,01 кг нелетучего вещества. Давление пара этого раствора равно 426 Торр при 293 К, а давление пара чистого эфира при 293 К равно 442 Торр. Рассчитайте молярную массу растворённого вещества.
Ответ: М = 197,2 .
2. Понижение температуры замерзания и повышение температуры кипения
7. В водном растворе этилового спирта мольная доля спирта 0,042. Определите температуру замерзания этого раствора при Р = 1 атм.
Ответ: t з = -4,54 °С.
8. 55,16 г сахарозы растворено в 316,3 г воды. Рассчитайте точку кипения и точку замерзания этого раствора.
Ответ: Т к = 373,41 К; Т з = 272,2 К.
9. Широко применяемый антифриз для радиаторов автомобилей содержит этиленгликоль (СН 2 ОН – СН 2 ОН). Сколько этого вещества следует добавить в воду радиатора общим объёмом 7,5 л, если принять за самую низкую температуру эксплуатации –20 °С. Плотность этиленгликоля 1110 .
Ответ: m (СН 2 ОН – СН 2 ОН) = 3125 г.
10. К очень слабым водным растворам для предотвращения замерзания в зимнее время обычно прибавляют глицерин СН 2 ОН-СНОН-СН 2 ОН. Допустив, что закон Рауля применим для растворов такой концентрации, вычислите, сколько глицерина нужно прибавить, чтобы раствор, содержащий 0,1 кг воды, не замерзал до 268,16 К.
Ответ: m (СН 2 ОН-СНОН-СН 2 ОН) = 24,75 г.
11. 10 мг органического вещества растворено в 1 г камфоры. Понижение температуры замерзания камфоры составило 1,33 К; криоскопическая постоянная камфоры 40. Рассчитайте молярную массу растворённого вещества.
Ответ: М = 301 .
12. В 0,0106 кг раствора содержится 0,4×10 -3 кг салициловой кислоты, растворённой в этиловом спирте. Этот раствор кипит при температуре на 0,337 К выше температуры кипения чистого спирта. Определите молярную массу салициловой кислоты, учитывая, что эбулиоскопическая постоянная этилового спирта 1,19.
В 0,0106 кг раствора содержится 0,4×10 -3 кг салициловой кислоты, растворённой в этиловом спирте. Этот раствор кипит при температуре на 0,337 К выше температуры кипения чистого спирта. Определите молярную массу салициловой кислоты, учитывая, что эбулиоскопическая постоянная этилового спирта 1,19.
Ответ: М = 138,6 .
13. Вычислите температуру замерзания водного раствора мочевины, если её мольная доля в растворе 0,0032, а теплота плавления льда D m Н° = 6010 . Считайте раствор предельно разбавленным.
Ответ: Т з = 272,82 К.
14. Рассчитайте точку замерзания раствора, содержащего 5 г никотина С 10 Н 14 N 2 в 250 г этанола. Температура замерзания чистого этанола 156 К, а теплота плавления этанола D m Н°=5,02×10 3 .
Ответ: Т з = 155,77 К.
15. Температура кипения бензола равна 353,36 К, а теплота кипения 30795 . Рассчитайте эбулиоскопическую постоянную бензола.
Ответ: Э = 2,629.
Осмотическое давление
16. Вычислите осмотическое давление водного раствора сахарозы (С 12 Н 22 О 11) и давление насыщенного пара над раствором по следующим данным. Температура раствора 293 К; на 100г раствора приходится 6,84 г сахарозы; давление насыщенного пара чистой воды при 293 К Р°= 23,38 гПа.
Вычислите осмотическое давление водного раствора сахарозы (С 12 Н 22 О 11) и давление насыщенного пара над раствором по следующим данным. Температура раствора 293 К; на 100г раствора приходится 6,84 г сахарозы; давление насыщенного пара чистой воды при 293 К Р°= 23,38 гПа.
Ответ: P = 487 кПа; Р = 23,3 гПа.
17. Калифорнийская секвойя – самое высокое дерево в мире. Считая, что её высота 105,4 м, оцените осмотическое давление, необходимое для подъёма воды от корней до вершины.
Ответ: P = 10,2 атм.
18. Если трубу с полупроницаемой мембраной на одном конце поместить в морскую воду на достаточную глубину, гидростатическое давление воды должно привести к обратному осмосу – пресная вода потечёт в трубу. Морская вода имеет осмотическое давление 23 атмосферы и плотность 1,03 . На какую глубину необходимо опустить трубу для обратного осмоса?
Ответ: h = 235 м.
19. 20 мг белка растворено в 10 г воды. При температуре 25 °С осмотическое давление раствора составляет 0,3 Торр. Определите молярную массу белка, считая раствор идеальным.
Определите молярную массу белка, считая раствор идеальным.
Ответ: М = 1,24×10 5 .
D. Растворы электролитов
Давление насыщенного водяного пара
задача 596 Давление р насыщенного водяного пара при температуре T = 300 К равно 26,7 мм рт. ст. Определить плотность ρ водяного пара при этих условиях, принимая его за идеальный газ.
Решение задача 127 Пользуясь таблицей давлений насыщенных водяных паров, определить давление насыщенных паров, если вода закипела при 60 °С.
Решение задача 128 Вода закипела при 160 °С. Пользуясь таблицей давлений насыщенных водяных паров, определить внешнее давление над водой.
Решение задача 129 При какой температур закипит вода если внешнее давление над поверхностью окажется равным,76 кПа? При решении задач использовать таблиц давлений насыщенных водяных паров.
Решение
задача 134
Относительная влажность воздуха при 20 °С равна 58%. При какой максимальной температуре выпадет роса? Плотность насыщающего пара 17,3·10–3 кг/м3 при 20 °С.
Решение задача 135 Давление ненасыщенного водяного пара при температуре 300 К равно 1,5 кПа. Определить концентрацию молекул.
Решение задача 136 При температуре 300 K давление насыщенного водяного пара 3·104 Па. Пар отделили от жидкости и нагрели при постоянном объеме до 350 К. Определить давление пара при этой температуре.
Решение задача Масса m = 40 г сахара (С12Н22О11) растворена в объеме V = 0,5 л воды. Температура раствора t = 50 °С. Найти давление с насыщенного водяного пара над раствором.
задача Найти давление насыщенного пара над раствором при температуре 60 °С, если давление насыщенного пара над этим же раствором при температуре 30 °С равно 4,2 кПа.
задача Давление насыщенного пара над раствором меньше, чем давление насыщенного пара чистой воды в 1,02 раза. Вычислить число N молекул воды, приходящееся на одну молекулу растворенного вещества?
задача
Нелетучее вещество массой 100 г растворили в воде объемом 1 л. Температура раствора 90 °С. Давление насыщенного пара над раствором этого вещества 68,8 кПа. Найти молярную массу вещества, которое растворили.
Давление насыщенного пара над раствором этого вещества 68,8 кПа. Найти молярную массу вещества, которое растворили.
задача Нелетучее вещество, молярная масса которого μ = 60 г/моль, растворили в воде. Температура раствора 80 °C. Давление насыщенного пара над раствором 47,1 кПа. Найти осмотическое давление р0 раствора.
задача В запаянной трубке объемом V = 0,4 л находится водяной пар под давлением рп = 8,5 кПа при температуре Tп = 423 К. Сколько росы выпадает на стенках трубки при охлаждении воды до температуры Tн.п = 295 К? Давление насыщающих паров воды при температуре 295 К равно рн.п = 2,6 кПа.
Задача Влажный воздух объемом 1 м при относительной влажности φ = 60%, температуре T = 293 К и нормальном атмосферном давлении имеет массу m = 1,2004 кг. Определите давление насыщающего водяного пара при температуре Т.
задача
В сосуде находится воздух, температура которого T1 = 283 К и влажность φ = 60%. Как изменится влажность воздуха и его давление, если воздух нагреть до температуры T2 = 373 К и в три раза уменьшить объем? Начальное давление сухого воздуха р1 = 38,5 кПа, давление насыщающих паров воды при 283 К равно р1н = 1,2 кПа.
задача Относительная влажность воздуха в закрытом сосуде при температуре t1 = 20°С равна φ1 = 0,3. Определить относительную влажность воздуха при температуре t2 = 8°С. При t1 давление насыщенных паров воды рн1 = 2,33 кПа, при t2 оно равно рн2 = 1,07 кПа.
задача Сухой воздух заполняет закрытый сосуд объемом V = 25 л при давлении р1 = 105 Па и температуре t1 = –23 °С. В сосуд кладут кусок льда массой т = 9 г и нагревают сосуд до температуры t2 = 127 °С. Определите давление влажного воздуха в сосуде. Давление насыщенного водяного пара при температуре t = 127 °С равно рн = 250 кПа. Молярная масса воды р = 18·10–3 кг/моль.
задача В теплоизолированном сосуде, разделенном пополам перегородкой, находится насыщенный водяной пар: в левой части — при температуре t1 = 20°С, а в правой — при t2 = 50°С. Чему будут равны плотность, температура и давление пара в сосуде, если перегородку убрать? Будет ли этот пар насыщенным?
задача
При температуре = 3 °С давление насыщенного водяного пара р0 = 5,945 Па Влажный воздух при это температуре, относительно влажности φ = 8 % и давлении р = 101, кПа занимает объем = 1 м3. Определить его массу.
Определить его массу.
задача Вечером температура воздуха была t1 = 16 °С, относительная влажность 65%. Ночью температура воздуха понизилась до t2 = 4 °С. Была ли роса? При температуре 16 °С плотность насыщенного водяного пара p01 = 13,6 г/м3, а при 4 °С — p02 = 6,4 г/м3.
задача Найти абсолютную и относительную влажность воздуха в комнате при температуре t1 = 20 °С, если точка росы t2 = 9 °С. Как изменится относительная влажность при понижении температуры до t3 = 16 °С, если абсолютная влажность останется прежней? Плотности насыщенного водяного пара при температурах t1, t2 и t3 равны соответственно: p01 = 17,3·10–3 кг/м3, р02 = 8,8·10–3 кг/м3, р03 = 13,6·10–3 кг/м3.
задача Вычислить при температуре 100°С плотность насыщающего водяного пара?
задача
Таблицы показывают, что если давление насыщающего пара воды выражать в мм рт. ст., а его плотность — в г/м3 то при температурах, не сильно отличающихся от комнатной, эти величины близки друг к другу. Доказать это. (Использовать решение задачи 304.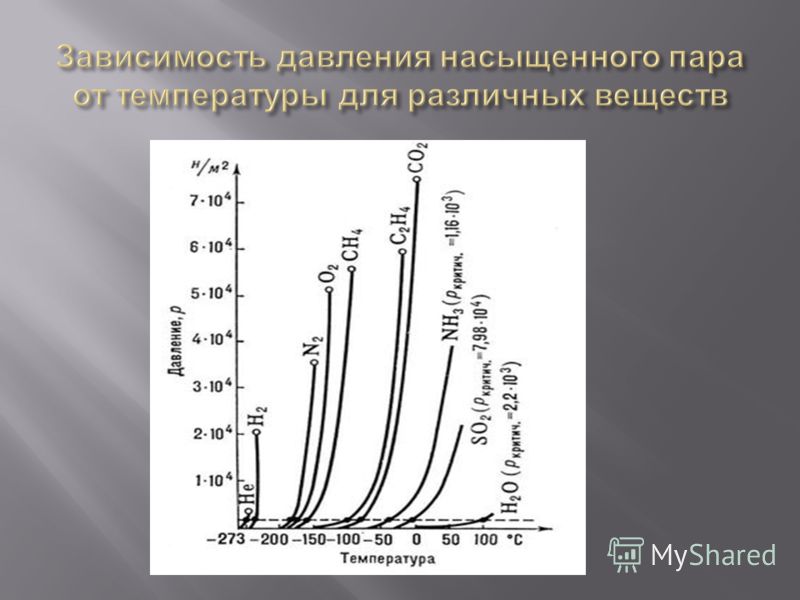 )
)
задача Воздух имеет температуру 60°С и абсолютную влажность 50 г/м3. Какой будет абсолютная влажность этого воздуха, если температура понизится до 10°С? Известно, что при 10° С давление насыщающего пара воды равно 1230 Н/м2.
задача В комнате объемом 40 м3 воздух имеет температуру 20°С и относительную влажность 20%. Сколько нужно испарить в этой комнате воды, чтобы относительная влажность достигла 50%? Известно, что при 20°С давление насыщающих паров воды равно 2330 Н/м2.
задача 382 При температуре t = 20°С и давлении р = 760 мм рт. cm ≈ 105 Н/м2 воздух имеет влажность 100%. На сколько процентов он легче сухого воздуха той же температуры и с тем же давлением? Молекулярная масса сухого воздуха равна 29 кг/кмоль, а давление насыщающего пара воды при 20°С, равно 2330 Н/м2.
задача 76
Колба объемом 100 см3 была заполнена при 100°С воздухом с относительной влажностью 40%. Как нужно изменить объем колбы, чтобы воздух внутри нее стал сухим при 20°С? Давление насыщающих паров воды при 20°С равно 2266 Н/м2.
задача В комнате объемом 120 м3 относительная влажность воздуха В = 60% при температуре 15°С. Определить массу паров воды, находящихся в комнате. Плотность D насыщающих паров воды при 15°С равна 12,8 г/м3.
задача Сосуд с малым отверстием, содержащий небольшое количество воды, находится при температуре 76°С и атмосферном давлении 750 мм рт. ст. Через некоторое время сосуд закупорили и погрузили в жидкий воздух, кипевший при температуре 80° К. Каково теперь давление в сосуде? Давление насыщающих паров воды при температуре 76°С равно 300 мм рт. ст. Давлением насыщающего пара льда при температуре 80°К можно пренебречь.
задача Найти плотность ρ насыщенного водяного пара в воздухе при температуре T=300 К. Давление р насыщенного водяного пара при этой температуре равно 3,55 кПа.
Глинка Н. Л. Задачи и упражнения по общей химии. Задачи 463-501
Глинка Н. Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В. А. Рабиновича и Х. М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
– 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
Задачи 463-501
463. Чему равно осмотическое давление 0,5 М раствора глюкозы C6H12O6 при 25 °С? Решение
464. Вычислить осмотическое давление раствора, содержащего 16 г сахарозы C12H22O11 в 350 г H2O при 293 K. Плотность раствора считать равной единице. Решение с ключом
465. Сколько граммов глюкозы C6H12O6 должно находиться в 0,5 л раствора, чтобы его осмотическое давление (при той же температуре) было таким же, как раствора, в 1 л которого содержится 9,2 г глицерина C3H5(OH)3? Решение с ключом
466. К 100 мл 0,5 М водного раствора сахарозы C12H22O11 добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25 °С? Решение с ключом
467. При 25 °С осмотическое давление некоторого водного раствора равно 1,24 МПа. Вычислить осмотическое давление раствора при 0 °С. Решение
Вычислить осмотическое давление раствора при 0 °С. Решение
468. При 25 °С осмотическое давление раствора, содержащего 2,80 г высокомолекулярного соединения в 200 мл раствора, равно 0,70 кПа. Найти молекулярную массу растворенного вещества. Решение
469. При 20 °С смешивают 1 л раствора неэлектролита, осмотическое давление которого 243,4 кПа, с 3 л раствора неэлектролита, осмотическое давление которого 486,8 кПа. Найти осмотическое давление смешанного раствора. Решение с ключом
470. Раствор, в 100 мл которого находится 2,30 г вещества, обладает при 298 K осмотическим давлением, равным 618,5 кПа. Определить молекулярную массу вещества. Решение с ключом
471. Сколько молей неэлектролита должен содержать 1 л раствора, чтобы его осмотическое давление при 25 °С было равно 2,47 кПа? Решение
472. В 1 мл раствора содержится 1018 молекул растворенного неэлектролита. вычислить осмотическое давление раствора при 298 K. Решение с ключом
473. Найти при 65 °С давление пара над раствором, содержащим 13,68 г сахарозы C12H22O11 в 90 г H2O, если давление насыщенного пара над водой при той же температуре равно 25,0 кПа (187,5 мм рт. ст.). Решение
ст.). Решение
474. Чему равно давление насыщенного пара над 10% раствором карбамида CO(NH2)2 при 100 °С? Решение с ключом
475. При 315 K давление насыщенного пара над водой равно 8,2 кПа (61,5 мм рт. ст.). На сколько понизится давление пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы C6H12O6? Решение
476. При 293 K давление насыщенного пара над водой равно 2,34 кПа (17,53 мм рт. ст.). Сколько граммов глицерина C3H5(OH)3 надо растворить в 180 г воды, чтобы понизить давление пара на 133,3 Па (1 мм рт. ст.). Решение с ключом
477. На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы C6H12O6? Решение
478. При какой приблизительно температуре будет кипеть 50%-ный (по массе) раствор сахарозы C12H22O11? Решение с ключом
479. При какой приблизительно температуре будет кристаллизоваться 40%-ный (по массе) раствор этилового спирта C2H5OH? Решение с ключом
480. Сколько граммов сахарозы C12H22O11 надо растворить в 100 г воды, чтобы: а) понизить температуру кристаллизации на 1 градус; б) повысить температуру кипения на 1 градус? Решение с ключом
Сколько граммов сахарозы C12H22O11 надо растворить в 100 г воды, чтобы: а) понизить температуру кристаллизации на 1 градус; б) повысить температуру кипения на 1 градус? Решение с ключом
481. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, кристаллизующийся при -20 °С? Решение с ключом
482. В радиатор автомобиля налили 9 л воды и прибавили 2 л метилового спирта (ρ=0,8 г/мл). При какой наинизшей температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет? Решение с ключом
483. При растворении 5,0 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при -1,45 °С. Определить молекулярную массу растворенного вещества. Решение с ключом
484. При растворении 13,0 г неэлектролита в 400 г диэтилового эфира (C2H5)2O температура кипения повысилась на 0,453 K. Определить молекулярную массу растворенного вещества. Решение с ключом
Решение с ключом
485. При растворении 3,24 г серы в 40 г бензола температура кипения последнего повысилась на 0,81 K. Из скольких атомов состоит молекула серы в растворе? Решение с ключом
486. В 60 г бензола растворено 2,09 г некоторого вещества, элементарный состав [в % (масс.)] которого: C – 50,69, H2 – 4,23 и O2 – 45,08. Раствор кристаллизуется при 4,25 °С. Установить молекулярную формулу вещества. Чистый бензол кристаллизуется при 5,5 °С. Решение с ключом
487. Водно-спиртовый раствор, содержащий 15% спирта (ρ=0,97 г/мл), кристаллизуется при -10,26 °С. Найти молекулярную массу спирта и осмотическое давление раствора при 293 K. Решение с ключом
488. В 100 г H2O содержится 4,57 г сахарозы C12H22O11. Найти: а) осмотическое давление при 293 K; б) температуру кристаллизации раствора; в) температуру кипения раствора; г) давление насыщенного пара над раствором при 293 K. Давление насыщенного пара над водой при 293 K равно 2,337 кПа (17,53 мм рт. ст.). Плотность раствора считать равной плотности воды. Решение с ключом
ст.). Плотность раствора считать равной плотности воды. Решение с ключом
489. Температура кипения водного раствора сахарозы C12H22O11 равна 101,4 °С. Вычислить моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор? Решение с ключом
490. Чему равно при 0 °С осмотическое давление раствора, содержащего 1 моль глицерина в 22,4 л H2O: а) 1,01·102 кПа; б) 1,01·105 кПа в) 760 мм рт. ст.? Решение
491. Чему равно при 273 K осмотическое давление раствора, содержащего одновременно 0,25 моля спирта и 0,25 моля глюкозы в 2 л H2O: а) 760 мм рт. ст.; б) 380 мм рт. ст.; в) 4256 мм рт. ст.? Решение
492. Как соотносятся осмотические давления при 273 K, если в 250 мл воды растворено 5 г спирта C2H5OH (P1), 5 г глюкозы C6H12O6 (P2), 5 г сахарозы C12H22O11 (P3): а) P3>P2>P1; б) P1>P2>P3? Решение с ключом
493. Чему равно отношение масс формалина HCHO и глюкозы C6H12O6, которые содержатся в равных объемах растворов, обладающих при данной температуре одинаковым осмотическим давлением: а) 1:1; б) MHCHO:MC6h22O6? Решение с ключом
Чему равно отношение масс формалина HCHO и глюкозы C6H12O6, которые содержатся в равных объемах растворов, обладающих при данной температуре одинаковым осмотическим давлением: а) 1:1; б) MHCHO:MC6h22O6? Решение с ключом
494. Сколько молей неэлектролита должен содержать 1 л раствора, чтобы его осмотическое давление при 0 °С было равно 2,27 кПа (17 мм рт. ст.): а) 0,001 моля; б) 0,01 моля; в) 0,1 моля? Решение
495. Какова молярность раствора неэлектролита, если при 0 °С его осмотическое давление равно 2,27 кПа: а) 0,1 моль/л; б) 0,01 моль/л; в) 0,001 моль/л? Решение
496. При какой температуре кристаллизуется водный раствор, содержащий 3·1023 молекул неэлектролита в 250 г H2O: а) 273 K; б) 269,28 K; в) 271,14 K? Решение с ключом
497. Как соотносятся температуры кристаллизации 0,1%-ных (по массе) растворов глюкозы (t1; M=180) и альбумина (t2; M=68000): а) t1>t2; б) t1=t2; в) t1<t2? Решение с ключом
498. Как соотносятся температуры кипения 10%-ных (по массе) растворов CH3OH (t1) и C2H5OH (t2): а) t1>t2; б) t1<t2; в) t1=t2? Решение с ключом
Как соотносятся температуры кипения 10%-ных (по массе) растворов CH3OH (t1) и C2H5OH (t2): а) t1>t2; б) t1<t2; в) t1=t2? Решение с ключом
499. В 200 г воды растворено: 1) 31 г карбамида CO(NH2)2; 2) 90 г глюкозы C6H12O6. Будет ли температура кипения этих растворов одинакова: а) да; б) нет? Решение с ключом
500. В 250 г органического растворителя содержатся g г растворенного неэлектролита с молекулярной массой M. Криоскопическая постоянная растворителя равна K. Какое выражение для Δtкрист правильно: а) Kg/M; б) 4Kg/M; в) Kg/4M? Решение
501. Некоторый водный раствор неэлектролита кипит при 373,52 K. Какова моляльная концентрация этого раствора: а) m=1; б) m=0,1; в) m=0,01 моль на 1000 г H2O? Решение
Закон Рауля — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1598
Закон Рауля гласит, что давление паров растворителя над раствором равно 9o_{растворитель} \label{RLaw} \]
Введение
В 1880-х годах французский химик Франсуа-Мари Рауль обнаружил, что при растворении вещества в растворе давление паров раствора обычно уменьшается. Это наблюдение зависит от двух переменных:
Это наблюдение зависит от двух переменных:
- мольной доли количества присутствующего растворенного вещества и
- исходное давление паров (чистый растворитель).
При любой заданной температуре для конкретного твердого вещества или жидкости существует давление, при котором пар, образующийся над веществом, находится в динамическом равновесии с его жидкой или твердой формой. Это давление паров вещества при данной температуре. В состоянии равновесия скорость испарения твердого вещества или жидкости равна скорости конденсации газа обратно в его первоначальную форму. У всех твердых и жидких тел есть давление пара, и это давление постоянно, независимо от того, сколько вещества присутствует.
Идеальные и неидеальные решения
Закон Рауля работает только для идеальных решений. «Идеальный раствор показывает термодинамические характеристики смешения, идентичные характеристикам идеальных газовых смесей, [за исключением] идеальных растворов, которые имеют межмолекулярные взаимодействия, равные взаимодействиям чистых компонентов». 2 Как и многие другие понятия, изучаемые в химии, закон Рауля применяется только в идеальных условиях в идеальном растворе. Тем не менее, он по-прежнему работает достаточно хорошо для растворителя в разбавленных растворах. Однако в действительности уменьшение давления пара будет больше, чем рассчитанное по закону Рауля для чрезвычайно разбавленных растворов. 3
2 Как и многие другие понятия, изучаемые в химии, закон Рауля применяется только в идеальных условиях в идеальном растворе. Тем не менее, он по-прежнему работает достаточно хорошо для растворителя в разбавленных растворах. Однако в действительности уменьшение давления пара будет больше, чем рассчитанное по закону Рауля для чрезвычайно разбавленных растворов. 3
Почему работает закон Рауля
Если вы просмотрите концепции коллигативных свойств, вы обнаружите, что добавление растворенного вещества снижает давление пара, поскольку дополнительные частицы растворенного вещества заполняют промежутки между частицами растворителя и занимают место. Это означает, что меньшее количество растворителя будет находиться на поверхности и меньшее количество растворителя сможет вырваться и перейти в газовую фазу, что приведет к более низкому давлению пара. Есть два способа объяснить, почему работает закон Рауля — простой визуальный способ и более сложный способ, основанный на энтропии. Ниже приведен простой подход.
Есть два способа объяснить, почему работает закон Рауля — простой визуальный способ и более сложный способ, основанный на энтропии. Ниже приведен простой подход.
Помните, что давление насыщенного пара — это то, что вы получаете, когда жидкость находится в герметичном контейнере. Равновесие устанавливается, когда число частиц, отрывающихся от поверхности, точно равно числу частиц, вновь прилипающих к поверхности.
Рисунок \(\PageIndex{2}\): Динамическое равновесие между летучими молекулами в жидкой и газовой фазах.Теперь предположим, что молекулы растворенного вещества были добавлены таким образом, что молекулы растворителя заняли только 50% поверхности раствора.
Рисунок \(\PageIndex{1}\). Определенная часть молекул растворителя будет иметь достаточную энергию, чтобы уйти с поверхности (например, 1 на 1000 или 1 на миллион). Если вы уменьшите количество молекул растворителя на поверхности, вы уменьшите количество молекул, которые могут ускользнуть за любой момент времени.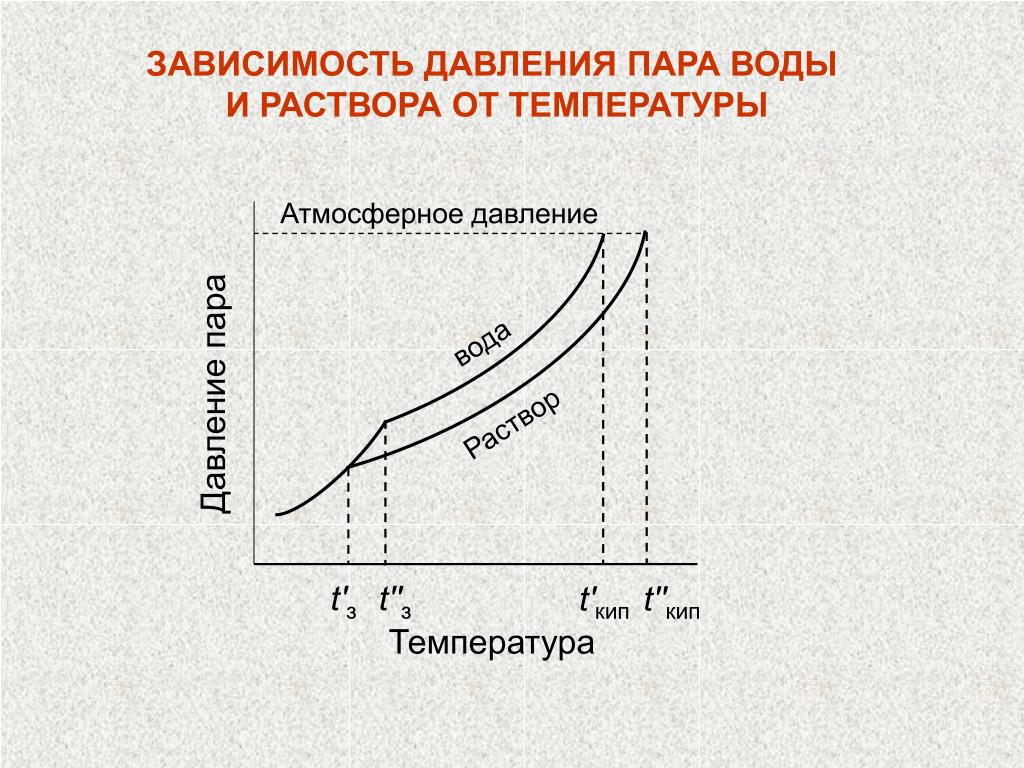 Но это не будет иметь никакого значения для способности молекул пара снова прилипать к поверхности. Если молекула растворителя в паре коснется части поверхности, занятой частицами растворенного вещества, она вполне может прилипнуть. Очевидно, что между растворителем и растворенным веществом существует притяжение, иначе у вас не было бы решения.
Но это не будет иметь никакого значения для способности молекул пара снова прилипать к поверхности. Если молекула растворителя в паре коснется части поверхности, занятой частицами растворенного вещества, она вполне может прилипнуть. Очевидно, что между растворителем и растворенным веществом существует притяжение, иначе у вас не было бы решения.
Чистый эффект этого заключается в том, что, когда установится равновесие, в паровой фазе будет на меньше молекул растворителя — менее вероятно, что они собираются отделиться, но нет никаких проблем с их возвращением. Однако, если в равновесном паре меньше частиц, давление насыщенного пара ниже.
Ограничения закона Рауля
На практике идеального решения не существует! Однако особенности одного включают:
- Идеальные решения удовлетворяют закону Рауля. Решение на последней диаграмме рисунка \(\PageIndex{3}\) выше на самом деле не подчинялось бы закону Рауля — оно слишком концентрированное, но оно было нарисовано настолько концентрированным, чтобы подчеркнуть суть.

- В идеальном растворе молекуле растворителя требуется точно такое же количество энергии, чтобы оторваться от поверхности раствора, как и в чистом растворителе. Силы притяжения между растворителем и растворенным веществом точно такие же, как и между исходными молекулами растворителя — маловероятно!
Предположим, что в чистом растворителе 1 из 1000 молекул обладает достаточной энергией, чтобы преодолеть межмолекулярные силы и оторваться от поверхности в любой момент времени. В идеальном растворе это все равно будет точно такой же пропорцией. Оторвалось бы, конечно, меньше, потому что теперь молекул растворителя на поверхности меньше, но из тех, что находятся на поверхности, отрывается еще та же пропорция. Если имело место сильное притяжение растворителя к растворенному, эта пропорция может быть уменьшена до 1 на 2000, или 1 на 5000, или чего-то подобного.
В любом реальном растворе, скажем, соли в воде существует сильное притяжение между молекулами воды и ионами. Это, как правило, замедляет потерю молекул воды с поверхности. Однако, если раствор достаточно разбавлен, на поверхности будут области хорошего размера, где у вас все еще есть молекулы воды. Тогда решение будет приближаться к идеальному поведению.
Это, как правило, замедляет потерю молекул воды с поверхности. Однако, если раствор достаточно разбавлен, на поверхности будут области хорошего размера, где у вас все еще есть молекулы воды. Тогда решение будет приближаться к идеальному поведению.
Природа растворенного вещества
Есть еще одна вещь, с которой вы должны быть осторожны, если собираетесь делать какие-либо расчеты по закону Рауля. Возможно, вы заметили в небольшом расчете молярной доли выше на странице, что сахар является растворенным веществом, а не солью. На самом деле важно не количество молей вещества, которое вы помещаете в раствор, а число молей образовавшихся частиц. На каждый моль растворенного хлорида натрия вы получаете 1 моль ионов натрия и 1 моль ионов хлора, другими словами, вы получаете вдвое больше молей частиц, чем исходной соли.
Итак, если вы добавите 0,1 моля хлорида натрия, в растворе будет фактически 0,2 моля частиц — и это значение вам придется использовать при расчете мольной доли. Если хорошенько не подумать, закон Рауля работает только для растворенных веществ, которые не меняют свою природу при растворении. Например, они не должны ионизироваться или ассоциироваться (например, если вы добавите вещество А, оно не должно образовывать в растворе А 2 ). Если он делает что-то из перечисленного, вам следует относиться к закону Рауля с большой осторожностью.
Если хорошенько не подумать, закон Рауля работает только для растворенных веществ, которые не меняют свою природу при растворении. Например, они не должны ионизироваться или ассоциироваться (например, если вы добавите вещество А, оно не должно образовывать в растворе А 2 ). Если он делает что-то из перечисленного, вам следует относиться к закону Рауля с большой осторожностью.
На самом деле имеет значение не количество молей вещества, которое вы поместили в раствор, а число молей образовавшихся частиц.
Закон Рауля и коллигативные свойства
Действие закона Рауля заключается в том, что давление насыщенного пара раствора будет ниже, чем у чистого растворителя при любой конкретной температуре. Это оказывает важное влияние на фазовую диаграмму растворителя. На следующей диаграмме показана фазовая диаграмма чистой воды в области ее нормальных температур плавления и кипения. Линия 1 атмосфера показывает условия для измерения нормальных температур плавления и кипения.
Линия, разделяющая области жидкости и пара, представляет собой набор условий, при которых жидкость и пар находятся в равновесии. Его можно рассматривать как влияние давления на температуру кипения воды, но это также и кривая, показывающая влияние температуры на давление насыщенного пара воды. Эти два способа взглянуть на одну и ту же линию кратко обсуждаются в примечании примерно на полпути вниз по странице о фазовых диаграммах (перейдите по последней ссылке выше).
Если построить кривую давления насыщенного пара для раствора нелетучего вещества в воде, она всегда будет ниже, чем кривая для чистой воды.
Рисунок \(\PageIndex{6}\): Если вы внимательно посмотрите на последнюю диаграмму, вы увидите, что точка, в которой кривая равновесия жидкость-пар встречается с кривой твердого тела-пар, сместилась. Эта точка является тройной точкой системы — уникальным набором условий температуры и давления, при которых возможно получить твердое, жидкое и парообразное состояние в равновесии друг с другом в одно и то же время. Поскольку в тройной точке присутствует равновесие твердого тела и жидкости (среди других равновесий), она также является точкой плавления системы, хотя и не нормальной точкой плавления, потому что давление не равно одной атмосфере.
Поскольку в тройной точке присутствует равновесие твердого тела и жидкости (среди других равновесий), она также является точкой плавления системы, хотя и не нормальной точкой плавления, потому что давление не равно одной атмосфере.
Кривые для чистой воды и для раствора часто проводят параллельно друг другу. Это должно быть неправильно! Предположим, у вас есть раствор, в котором молярная доля воды равна 0,99, а давление паров чистой воды при этой температуре равно 100 кПа. Давление паров раствора будет 99 кПа — падение на 1 кПа. При более низкой температуре, когда давление паров чистой воды составляет 10 кПа, падение составит всего 0,1 кПа. Чтобы кривые были параллельными, падения должны быть одинаковыми во всем диапазоне температур. Это не так!
Это должно означать, что на фазовой диаграмме нужна новая линия точки плавления (линия равновесия твердого тела и жидкости), проходящая через новую тройную точку. Это показано на следующей диаграмме.
Рисунок \(\PageIndex{7}\): Теперь мы, наконец, можем увидеть, какое влияние оказывает нелетучее растворенное вещество на точки плавления и замерзания раствора. Посмотрите, что происходит, когда вы проводите линию давления в 1 атмосферу, которая позволяет вам измерять точки плавления и кипения. Диаграмма также включает точки плавления и кипения чистой воды из исходной фазовой диаграммы для чистой воды (черные линии).
Посмотрите, что происходит, когда вы проводите линию давления в 1 атмосферу, которая позволяет вам измерять точки плавления и кипения. Диаграмма также включает точки плавления и кипения чистой воды из исходной фазовой диаграммы для чистой воды (черные линии).
Из-за изменений на фазовой диаграмме видно, что:
- температура кипения растворителя в растворе выше, чем у чистого растворителя;
- температура замерзания (плавления) растворителя в растворе ниже, чем у чистого растворителя.
Мы рассмотрели это с водой в качестве растворителя, но использование другого растворителя не изменило бы аргумент или выводы. Единственная разница заключается в наклоне линий равновесия твердой и жидкой фаз. Для большинства растворителей они наклонены вперед, тогда как ватерлиния наклонена назад. Вы можете доказать себе, что это не влияет на то, на что мы смотрели, перерисовав все эти диаграммы с изменением наклона этой конкретной линии. Вы обнаружите, что это не имеет никакого значения.
Вы обнаружите, что это не имеет никакого значения.
Как рассчитать давление паров раствора
Мы можем рассчитать давление паров раствора двумя способами, в зависимости от летучести растворенного вещества. Если растворенное вещество является летучим, оно будет создавать собственное давление паров, и это количество является значительным вкладом в общее давление паров раствора и, следовательно, должно быть включено в расчеты. С другой стороны, если это нелетучее вещество, растворенное вещество не будет создавать давление пара в растворе при этой температуре.
Нелетучие растворенные вещества
Эти расчеты довольно просты, если вы знакомы со стехиометрическими преобразованиями. Поскольку растворенное вещество нелетуче, вам нужно только определить изменение давления паров растворителя. Используя уравнение для закона Рауля, вам нужно будет найти мольную долю растворителя, и обычно дается давление паров чистого растворителя.
Пример \(\PageIndex{1}\): Kool-Aid
1,5 моля вишневого Kool-Aid добавляют в кувшин с 2 литрами воды в погожий день при 25°C. 0046 o C. Давление паров только воды составляет 23,8 мм рт.ст. при 25 o C. Каково новое давление паров Kool-Aid?
0046 o C. Давление паров только воды составляет 23,8 мм рт.ст. при 25 o C. Каково новое давление паров Kool-Aid?
Раствор
\(P_{H_2O}\) = 23,8 мм рт. ст.
Чтобы найти молярную долю, необходимо сначала преобразовать 2 л воды в моли:
1 л = 1000 мл = 1000 г
Зная это, можно перевести массу воды (2000 г) в моли:
2000 г / 18,02 г (молярная масса воды) = 110,9 моль H 2 O
Решите для молярной доли, \(\chi_{H_2O}\):
\(\chi_{H_2O}\) = моль H 2 O / общее количество молей
= 110,9 моль / 110,9 + 1,5 моль = 0,979
Наконец, примените закон Рауля
\(P_{Kool-Aid} = \chi_{H_2O} \, P_{H_2O}\) = (0,979)(23,8 мм рт.ст.) = 23,3 мм рт.ст.
Пример \(\PageIndex {2A}\): Неэлектролит
Рассчитайте давление паров раствора, полученного путем растворения 50,0 г глюкозы \(C_6H_{12}O_6\) в 500 г воды. Давление паров чистой воды 47,1 Торр при 37°С
Раствор
Чтобы использовать закон Рауля (уравнение \(\ref{RLaw}\)), нам нужно рассчитать молярную долю воды (растворителя) в этом сахарно-водном растворе.
\[ \chi_{растворитель} = \dfrac{ \text{моли воды}}{\text{моли растворенного вещества} + \text{моли растворителя}} \nonumber \]
\[ \chi_{растворитель } = \dfrac{ n_{вода}}{ n_{глюкоза} + n_{вода} } \nonumber\]
Молярная масса глюкозы 180,2 г/моль, а воды 18 г/моль. Итак,
\[n_{вода} = \dfrac{500\,g}{18\,g/mol} = 27,7 \,mol \nonnumber\]
и
\[n_{глюкоза} = \dfrac{50\,г}{180,2\,г/моль} = 0,277 \,моль \номер\]
и
\[ \chi_{растворитель} = \dfrac{ 27,7 \,mol}{ 0,277 \,mol + 27,7 \,mol } = 0,99 \nonumber\]
Обратите внимание, что это все еще относительно разбавленный.
\[ P_{раствор} = 0,99 \умножить на 47,1 = 46,63 \, торр \номер\]
совсем не большое изменение.
Пример \(\PageIndex{2B}\): Электролит
Рассчитайте давление паров раствора, полученного путем растворения 50,0 г CaCl 2 , \(C_6H_{12}O_6\), в 500 г воды. Давление паров чистой воды составляет 47,1 торр при 37°C.
Раствор
соляно-водный раствор.
\[ \chi_{растворитель} = \dfrac{ \text{моли воды}}{\text{моли растворенного вещества} + \text{моли растворителя}} \nonumber\]
\[ \chi_{растворитель } = \dfrac{ n_{вода}}{ n_{растворенные вещества} + n_{вода} } \nonumber\]
9-} = 0,9 \,моль\)и
\[ \chi_{растворитель} = \dfrac{ 27,7 \,mol}{ 0,45 \,mol + 0,9 \,mol + 27,7 \,mol } = 0,953 \nonnumber\]
Обратите внимание, что это все еще относительно разбавить.
\[ P_{раствор} = 0,953 \умножить на 47,1 = 44,88\, торр \нечисло\]
Большее изменение, чем в примере с глюкозой выше.
Летучие растворенные вещества
Единственная разница между летучими и нелетучими растворенными веществами заключается в том, что необходимо учитывать парциальное давление, создаваемое давлением пара летучего растворенного вещества, и давлением пара растворителя. Сумма двух даст вам общее давление паров раствора.
Пример \(\PageIndex{3}\)
Каково парциальное давление бензола и толуола в растворе, в котором мольная доля бензола равна 0,6? Каково общее давление пара? Давление паров чистого бензола равно 95,1 мм рт.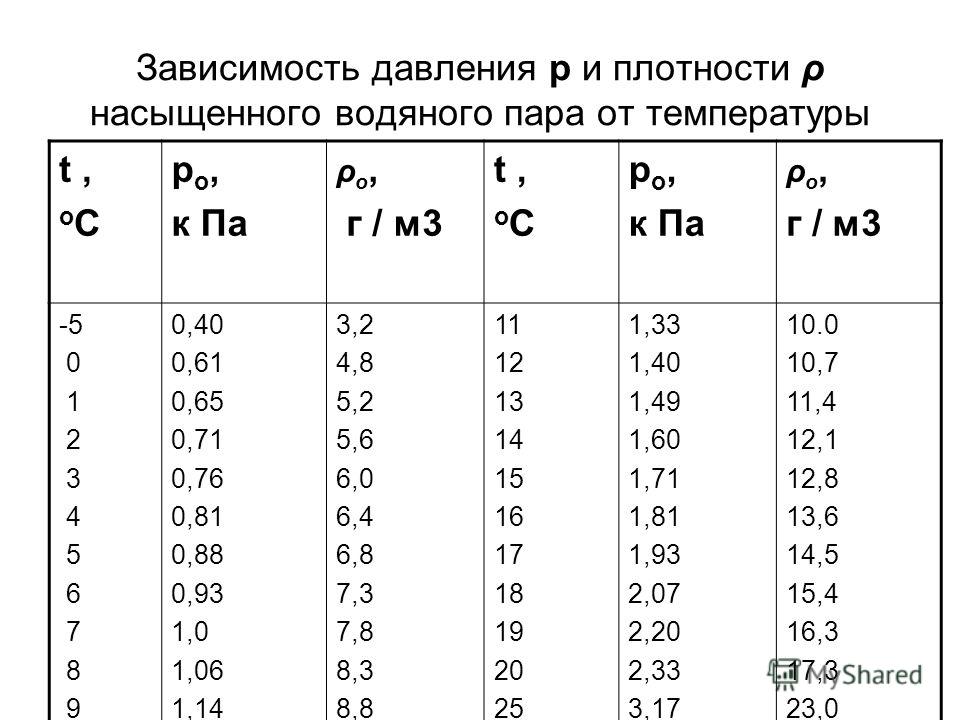 ст., а давление паров чистого толуола 28,4 мм рт.ст. при 25 o С. {толуол} = 0,4\), так как \(1 — 0,6 = 0,4\).
ст., а давление паров чистого толуола 28,4 мм рт.ст. при 25 o С. {толуол} = 0,4\), так как \(1 — 0,6 = 0,4\).
Теперь, когда мы знаем молярные доли и давления паров, решить эту задачу несложно.
P Бензол = x Бензол P Бензол = (0,6) (95,1 мм рт. ) = 11,4 мм рт.ст.
Общее давление паров представляет собой просто сумму парциальных давлений:
P всего = P бензол + P туол = 57,1 мм рт.ст. + 11,4 мм рт.ст. = 68,5 мм рт.ст. Упражнения
*MM = молярная масса
- Каково давление паров раствора при 25 o C, содержащий 78,0 г глюкозы (MM = 180,16 г/моль) в 500 г воды? Давление пара чистой воды при этой температуре равно 23,8 мм рт.
- 25 г циклогексана (P o = 80,5 торр, MM = 84,16 г/моль) и 30 г этанола (P o = 52,3 торр, MM = 92,14 г/моль) являются летучими компонентами, присутствующими в растворе . Каково парциальное давление этанола?
- Каково давление паров чистого бутана при 20 o С, если его парциальное давление равно 69о = (0,985)(23,8\; мм рт.
 ст.) = 23,4\; мм рт. ст.]
ст.) = 23,4\; мм рт. ст.]2.
Рассчитайте количество молей каждого компонента.
- Моли циклогексана: \(\dfrac{25\; г}{84,16\; г/моль} = 0,297 \; \text{моли циклогексана}\)
- Моль этанола: \(\dfrac{30\; г}{92,14 \;г/моль} = 0,326 \; \text{моль этанола}\)
Определите мольную долю этанола и примените закон Рауля.
Xэтанол = 0,326 моль / (0,326 + 0,297) моль = 0,523 9о = \dfrac{P}{X} = \dfrac{698\; мм рт.ст.}{0,423} = 1650\; мм рт. ст.]
Ссылки
- Petrucci, et al. Общие принципы химии и современные приложения. 9-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2007. .
- Кугель, Роджер В. «Закон Рауля: бинарные фазовые диаграммы жидкость-пар» Journal of Chemical Education 75.9 (1998): 1125.
- П. Циас, К. Трейнер и М. Чемла. «Применимость закона Рауля в неидеальных смешанных растворителях» Journal of Solution Chemistry 6.6 (1977): 393-402.

Закон Рауля распространяется по незадекларированной лицензии, авторами, ремиксами и/или кураторами являются Джим Кларк, Ирен Ли, Санна Хан и Санна Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- № на стр.
- Теги
- автор @ Ирэн Ли
- автор @ Джим Кларк
- автор @ Санна Хан
- идеальное решение
- Закон Рауля
Закон Рауля: давление паров и нелетучие растворенные вещества — задачи №1
Закон Рауля: давление паров и нелетучие растворенные вещества — Задачи №1 — 15Закон Рауля: влияние нелетучих растворенных веществ на давление паров
Задачи №1–15Вернуться к обсуждению влияния энергонезависимости на давление паров
Вернуться в меню решений
Задача №1: Каково давление паров водного раствора с мольной долей растворенного вещества 0,1000? Давление паров воды составляет 25,756 мм рт.
 ст. при 25 °C.
ст. при 25 °C.Решение:
χ solv = 1,0000 − 0,1000 = 0,9000 Используйте закон Рауля:
P раствор = (χ solv ) (Psolvo)
х = (0,9000) (25,756)
x = 23,18 мм рт. ст. (до четырех цифр)
Задача № 2: Давление паров водного раствора равно 24,90 мм рт. ст. при 25 °C. Какова молярная доля растворенного вещества в этом растворе? Давление паров воды составляет 25,756 мм ртутного столба при 25 °C.
Решение:
Используйте закон Рауля:
)P раствор = (χ solv ) (Psolvo)
24,90 = (х) (25,756)
x = 0,966765 (это мольная доля растворителя)
χ растворенное вещество = 1 − 0,966765 = 0,033235
х растворенного вещества = 0,03324 (до четырех знаков фиг.
Задача №3: Сколько граммов нелетучего соединения B (молярная масса = 97,80 г/моль) нужно добавить к 250,0 г воды, чтобы получить раствор с давлением паров 23,756 торр? Давление паров воды при этой температуре равно 42,362 торр.

Решение:
Будем считать, что B не ионизируется в растворе.
1) Определить мольную долю растворителя, при котором давление паров раствора составляет 23,756 торр:
P раствор = (χ solv ) (Psolvo)
23,756 торр = (х) (42,362 торр)
х = 0,5608
2) Определите количество молей соединения B, необходимое для получения вышеуказанной мольной доли растворителя:
0,5608 = 13,88 / (13,88 + В)
7,7839+ 0,5608В = 13,88
0,5608В = 6,0961
В = 10,87 моль
3) Определить массу B
(10,87 моль) (97,80 г/моль) = 1063 г
Комментарий: это совершенно смехотворное количество для растворения в 250,0 г воды, но не в этом дело. Суть в том, чтобы решить проблему.
Задача № 4: При температуре 29,6 °C давление паров чистой воды составляет 31,1 торр. Раствор готовят добавлением 86,8 г нелетучего неэлектролита «Y» к 350 г воды.
 Давление паров полученного раствора составляет 28,6 торр. Рассчитайте молярную массу Y.
Давление паров полученного раствора составляет 28,6 торр. Рассчитайте молярную массу Y.Решение:
1) Используйте закон Рауля для определения мольной доли растворителя:
P раствор = (χ solv ) (Psolvo)
28,6 торр = (χ раствор ) (31,1 торр)
χ реш = 28,6 торр / 31,1 торр
х решить = 0,91961415
2) Используйте молярную долю и моли воды для определения молей Y:
350 г / 18,015 г/моль = 19,428254 моль
0,91961415 = 19,428254 / (19,428254 + х) (0,91961415) (19,428254 + х) = 19,428254
17,8665 + 0,91961415x = 19,428254
0,91961415x = 1,561754
х = 1,69827 моль
3) Рассчитайте молярную массу Y:
86,8 г / 1,69827 моль = 51,1 г/моль (до трех цифр)
Задача №5: Давление паров чистой воды составляет 23,8 мм рт. ст. при 25,0 °C.
 Каково давление пара 2,50 моляля C 6 H 12 O 6
Каково давление пара 2,50 моляля C 6 H 12 O 6 Решение:
1) Преобразуйте моляльность в молярную долю. Сначала подсчитайте общее количество молей:
2,50 м C 6 H 12 O 6 = 2,50 моль/1,00 кг H 2 O
1000 г / 18,015 г/моль = 55,51 моль
55,51 моль + 2,50 моль = 58,01 моль
2) Нам нужна мольная доля воды:
55,51 / 58,01 = 0,9569
3) Используйте закон Рауля:
P раствор = (χ реш ) (Псольво)
P раствор = (0,9569) (23,8 мм рт.ст.) = 22,8 мм рт.ст.
Задача № 6: Сколько граммов тестостерона , C 19 H 28 O 2 , нелетучего неэлектролита (ММ = 288,4 г/моль), необходимо добавить к 207,8 г бензола для восстановления давление пара до 71,41 мм рт.ст.? (Бензол = C 6 H 6 = 78,12 г/моль.
 Давление паров бензола составляет 73,03 мм рт.ст. при 25,0 °C.)
Давление паров бензола составляет 73,03 мм рт.ст. при 25,0 °C.)Решение:
Используйте закон Рауля:
P раствор = (Psolvo) (χ solv )
71,41 = (73,03) (2,66 / (2,66 + х))
71,41 = 194,2598 / (2,66 + х)
71,41 = 194,2598 / (2,66 + х)
194,2598 = 189,9506 + 71,41х
71,41х = 4,3092
х = 0,0603445 моль
(288,4 г/моль) (0,0603445 моль) = 17,4 г (до трех цифр)
Задача №7: При 25,0 °C давление паров бензола (C 6 H 6 ) составляет 0,1252 атм. При растворении 10,00 г неизвестного нелетучего вещества в 100,0 г бензола давление паров раствора при 25,0 °С равно 0,1199 атм. Рассчитайте мольную долю растворенного вещества в растворе, не допуская диссоциации растворенным веществом.
Решение:
1) Поскольку растворенное вещество нелетуче, пары раствора содержат только бензол. Все неизвестное вещество остается в растворе.
 В предположении идеальной смеси давление паров раствора определяется законом Рауля:
В предположении идеальной смеси давление паров раствора определяется законом Рауля:P раствор = (Psolvo) (χ раствор )
2) Молярная доля бензола в этой смеси:
P раствор = (Pбензо) (χ бенз )
χ бенз = Р раствор / Рбензо
= 0,1199 атм / 0,1252 атм
= 0,9576677
3) Мольные доли компонентов в любой смеси в сумме равны единице. Итак, для этого решения:
χ бенз + χ раствор = 1 Следовательно:
χ раствор = 1 − χ бенз
= 1 − 0,9576677 = 0,04233 (до четырех цифр)
Задача № 8: Каково давление паров при 25,0 °С раствора, состоящего из 42,71 г нафталина (нелетучее соединение, ММ = 128 г/моль) и 40,65 г этанола (ММ = 46,02 г). /моль). (Давление паров чистого этанола при 25,0 °C составляет 96 торр.)
Решение:
1) Давление пара этого вида растворителя связано с мольной долей растворителя и давлением его чистого пара:
давление паров раствора = (молярная доля растворителя) (давление паров чистого растворителя)
Это известно как закон Рауля.

2) Расчет:
моль нафталина —> 42,71 г / 128 г/моль = 0,334 моль
моль этанола —> 40,65 г / 46,02 г/моль = 0,883 моль
молярная доля этанола —> 0,883 / (0,883 + 0,334) = 0,726
давление паров раствора —> (96 торр) (0,726) = 70 торр
Задача №9: Для приготовления раствора использовали нелетучее органическое соединение Z. Раствор А содержит 5,00 г Z, растворенных в 100 г воды, и имеет давление паров 754,5 мм рт. ст. при нормальной температуре кипения воды. Вычислите молярную массу Z.
Решение:
1) Используйте закон Рауля для определения мольной доли растворителя:
P раствор = (χ solv ) (Psolvo)
754,5 торр = (χ solv ) (760,0 торр)
Примечание: 760,0 торр — давление паров воды при нормальной температуре кипения, 100 °C.
χ реш = 754,5 торр / 760,0 торр
х решить = 0,99276316
2) Используйте молярную долю и моли воды для определения молей Z:
100 г / 18,015 г/моль = 5,55093 моль
0,99276316 = 5,55093 / (5,55093 + х) х = 0,040464 моль
3) Рассчитайте молярную массу Z:
5,00 г / 0,040464 моль = 124 г/моль (до трех цифр)
Задача № 10: Какова моляльность водного раствора мочевины CO(NH 2 ) 2 , если давление паров над раствором составляет 22,83 мм рт.
 ст. при 25 °C? Предположим, что мочевина является нелетучей. Давление пара чистой воды составляет 23,77 мм рт.ст. при 25 °C.
ст. при 25 °C? Предположим, что мочевина является нелетучей. Давление пара чистой воды составляет 23,77 мм рт.ст. при 25 °C.Решение:
P раствор = (Psolvo) (молярная доля растворителя)
22,83 = (23,77) (х)
х = 0,960 (это мольная доля воды)
мольная доля мочевины = 0,040
Предположим, что присутствует в общей сложности 1000 молей растворителя и растворенного вещества.
Преобразование 0,960 моля в граммы воды:
(0,960 моль) (18,015 г/моль) = 17,2944 г
Расчет моляльности:
0,040 моль/0,0172944 кг = 2,31 м
Задача № 11: Рассчитайте массу пропиленгликоля (C 3 H 8 O 2 ), которую необходимо добавить к 500 граммам воды, чтобы давление паров понизилось на 4,75 мм рт.ст. при 40,0 °C. .
Решение:
Найдите давление паров воды при 40,0 °C. Оно составляет 55,3 мм рт.ст.
Используйте закон Рауля, чтобы получить мольную долю растворителя:
50,55 мм рт.
 ст. = (55,3 мм рт.ст.) (х)
ст. = (55,3 мм рт.ст.) (х)х = 0,9141
50,55 получается из 55,3 минус 4,75.
Мольная доля растворенного вещества 0,0859
Настроим расчет мольной доли:
(х/76,0942) разделить на [(х/76,0942) + (500./18,0152)] = 0,0859
x / 76,0942 — это моль C 3 H 8 O 2 , 500. / 18,0152 — это моль воды, а сумма двух (в квадратных скобках) — это общая моль в решение.
Найдите x.
Задача №12: Каково давление паров воды над раствором, в котором 32,5 г глицерина (C 3 H 8 O 3 ) растворены в 125 г воды при 343 К? Давление паров чистой воды при 343 К составляет 233,7 Торр.
Решение:
Давление пара пропорционально мольной доле в растворе.
моль глицерина = 32,5 г / 92,19 г/моль = 0,3525 моль
молей воды = 125 г / 18,0 г/моль = 6,944всего молей = 7,2965 моль
мольных долей воды = 6,944 моль / 7,2965 моль = 0,9516(0,9516) (233,7 торр) = 222,4 торр
Задача №13: Раствор готовят растворением 396 г сахарозы в 624 г воды при 30,0 °С.
 Каково давление паров этого раствора? (Давление паров воды составляет 31,82 мм рт.ст. при 30,0 °C.)
Каково давление паров этого раствора? (Давление паров воды составляет 31,82 мм рт.ст. при 30,0 °C.)Решение:
1) Определить моль растворенного вещества и растворителя:
396 г / 342,2948 г/моль = 1,1569 моль
624 г / 18,015 г/моль = 34,6378 моль2) Определите мольную долю растворителя:
34,6378 моль / (34,6378 моль + 1,1569 моль) = 0,96768
3) Определить давление пара:
х = (31,82 мм рт. ст.) (0,96768) = 30,8 мм рт. ст. (до трех цифр)
Задача № 14: Рассчитайте давление паров раствора, полученного путем растворения 21,80 г глюкозы (молярная масса = 180,155 г/моль) в 460,0 г H 2 О при 30,0 °С. (Давление паров чистого растворителя составляет 31,82 мм рт.ст. при 30,0 °C.)
Решение:
1) Определить моль растворенного вещества и растворителя:
21,80 г / 180,155 г/моль = 0,1210 моль
460,0 г / 18,015 г/моль = 25,5343 моль2) Определите мольную долю растворителя:
25,5343 моль / (25,5343 моль + 0,1210 моль) = 0,9952836
3) Определить давление пара:
x = (31,82 мм рт.
 ст.) (0,9952836) = 31,67 мм рт. ст. (до четырех цифр)
ст.) (0,9952836) = 31,67 мм рт. ст. (до четырех цифр)Задача №15: Раствор хлорида натрия в воде имеет давление паров 18,5 торр при 25 °C. Каково будет давление паров этого раствора при 45 °С? Давление паров чистой воды составляет 23,8 торр при 25 °C и 71,9 торр при 45 °C.
Решение:
Закон Рауля гласит, что давление паров растворителя над раствором равно давлению паров чистого растворителя при той же температуре, умноженному на мольную долю присутствующего растворителя:
давление паров раствора = (молярная доля растворителя) (давление паров растворителя)
18,5 торр = (мольная доля) (23,8 торр)
мольная доля растворителя = 0,77731
При 45 °С,
давление паров раствора = (0,77731)(71,9 торр) = 55,9 торр (до трех SF)
Бонусная задача: При 300 °C давление паров ртути составляет 32,97 торр. Какую массу золота нужно растворить в 5000 г ртути, чтобы давление ее паров понизилось до 25,00 торр?
Решение №1:
Au растворяется в ртути с образованием раствора.
 При 300 ° C золото все еще находится в твердом состоянии, и его давление паров Au намного ниже, чем у Hg (который является жидким при 300 ° C. Следовательно, мы будем рассматривать растворенное вещество Au как нелетучее.
При 300 ° C золото все еще находится в твердом состоянии, и его давление паров Au намного ниже, чем у Hg (который является жидким при 300 ° C. Следовательно, мы будем рассматривать растворенное вещество Au как нелетучее.P раствор = PHgo · χHg 25,00 торр = (32,97 торр) (χHg)
χHg = 0,758265
моля Hg присутствует —> 5,00 г / 200,59 г/моль = 0,0249265 моль
Пусть M = моли растворенного золота.
моль ртутного столба х рт.ст. = –––––––––– моль Hg + M 0,0249265 0,758265 = ––––––––––––– 0,0249265 + М (0,758265) (0,0249265 + М) = 0,0249265
0,0189009 + 0,758265М = 0,0249265
0,758265М = 0,0060256
М = 0,00794656 моль золота
(196,96657 г/моль) (0,00794656 моль) = 1,565 г (до 4 сиг фиг)
Решение №2:
Этот метод устанавливает два метода расчета мольной доли равными друг другу.

х рт.ст., используя vp = х рт.ст., используя моль
P раствор моль ртутного столба ––––––– = –––––––––– PHgo моль Hg + M Пусть m = масса Au
25,00 5,00 ––––– 200,6 = –––––––––––––– 32,97 5,00 м –––––  + ––––– 200,6 197,0 Примечание: молярные массы округлены, все единицы измерения опущены.

0,0249265 0,758265 = ––––––––––––––––– м 0,0249265  + ––––– 197.0 0.758265m 0,018  + –––––––––  = 0,0249265 197.0 0.758265m –––––––––  = 0,00602561 197,0 0,758265 м = 1,18704517
м = 1,565 г (четыре знака инжира)
Вернуться к обсуждению влияния энергонезависимости на давление пара
Вернуться в меню решений
Калькулятор давления пара | Уравнение Клаузиуса-Клапейрона
Создано Юлией Жулавинской
Отредактировано Богной Шик и Джеком Боуотером
Последнее обновление: 30 сентября 2022 г.
Содержание:
- Что такое давление паров?
- Уравнение Клаузиуса-Клапейрона
- Что такое энтальпия парообразования?
- Уравнение Клаузиуса-Клапейрона — пример
- Как рассчитать давление пара? — Закон Рауля
- Часто задаваемые вопросы
С помощью этого калькулятора давления пара мы представляем вам два уравнения давления пара! Вы задавались вопросом: что такое давление пара? Как жидкость превращается в газ при изменении давления и температуры? Когда и как использовать уравнение Клаузиуса-Клапейрона? И какое отношение все это имеет к энтальпии парообразования? Если у вас есть — продолжайте читать. Мы ответим на все эти и многие другие вопросы!
И если вы любите термодинамику и химию так же сильно, как и мы, проверьте этот калькулятор комбинированного газового закона!
Что такое давление паров?
Давление пара — это давление, создаваемое молекулами пара вещества в замкнутой системе. Это происходит при равновесии, т.
 е. когда молекулы испаряются, и конденсируются с одинаковой скоростью при определенном давлении. Давление пара напрямую связано с кинетической энергией молекулы. Легкие молекулы с высокой кинетической энергией или со слабыми межмолекулярными силами имеют более высокое давление паров и, следовательно, более высокую летучесть — склонность к испарению.
е. когда молекулы испаряются, и конденсируются с одинаковой скоростью при определенном давлении. Давление пара напрямую связано с кинетической энергией молекулы. Легкие молекулы с высокой кинетической энергией или со слабыми межмолекулярными силами имеют более высокое давление паров и, следовательно, более высокую летучесть — склонность к испарению.Как рассчитать давление пара? Рассмотрим подробнее два уравнения давления пара: уравнение Клаузиуса-Клапейрона и закон Рауля.
Уравнение Клаузиуса-Клапейрона
Уравнение Клапейрона утверждает:
где:
- dPdT\small \frac{dP}{dT}dTdP — производная давления по температуре.
- H\footnotesize HH — удельная скрытая теплота — тепловая энергия, поглощаемая или выделяемая при фазовом переходе.
- T\footnotesize TT – температура.
- ΔV\footnotesize \Delta VΔV — изменение удельного объема при фазовом переходе.
Эта формула иллюстрируется фазовой диаграммой — диаграммой, показывающей, как фазы изменяются и сосуществуют в равновесии при различных давлениях и температурах.
(Изображение Matthieumarechal, CC BY-SA 3.0, ссылка)
Уравнение Клаузиуса-Клапейрона является производным от этой формулы. Он описывает взаимосвязь между давлением пара и температурой жидкости . Он точен для фазового перехода между жидкостью и газом ( испарение ) или твердым телом и газом ( сублимация ). При большой разнице между удельным объемом газовой фазы молекулы и ее конденсированной фазы можно вывести следующее уравнение: \frac{\Delta H}{R \cdot (\frac{1}{T_2}-\frac{1}{T_1})}lnP2P1=R⋅(T21−T11) ΔH
где:
- T1\footnotesize T_1T1 — начальная температура, измеренная в Кельвинах (K)
- *T2\footnotesize T_2T2 — конечная температура (K)
- P1\footnotesize P_1P1 — начальное давление
- P2\footnotesize P_2P2 — конечное давление
- ΔH\footnotesize \Delta HΔH — молярная энтальпия испарения или сублимации (Jmol\footnotesize \frac{J}{mol}molJ)
- R\footnotesize RR — газовая постоянная 8,3145 Джмоль⋅K\footnotesize \frac{J}{mol \cdot K}моль⋅KJ
При решении задач по физике и химии важно не забывать конвертировать единицы измерения.
 Не беспокойтесь об этом здесь — наш калькулятор давления паров конвертирует их для вас. Но если вы решаете уравнение Клаузиуса-Клапейрона самостоятельно, помните, что температура всегда должна выражаться в градусах Кельвина. Единица давления не имеет значения, если она одинакова как для начального, так и для конечного давления.
Не беспокойтесь об этом здесь — наш калькулятор давления паров конвертирует их для вас. Но если вы решаете уравнение Клаузиуса-Клапейрона самостоятельно, помните, что температура всегда должна выражаться в градусах Кельвина. Единица давления не имеет значения, если она одинакова как для начального, так и для конечного давления.Что такое энтальпия парообразования?
Энтальпия парообразования или, другими словами, теплота парообразования — это энергия, необходимая для фазового перехода — превращения жидкости в газ . Аналогично количество энергии, необходимое для прямого фазового перехода между твердым и газообразным состояниями, называется энтальпией сублимации.
Уравнение Клаузиуса-Клапейрона – пример
На уроках химии учитель может дать вам упражнение на определение давления пара или энтальпии парообразования. Давайте решим одну из них, чтобы помочь вам полностью понять уравнение Клаузиуса-Клапейрона.
- Вода имеет энтальпию испарения 40660 Дж / моль (ΔH пар ).

- Его давление паров составляет 102325 Па (P 1 ) при температуре 280 К (T 1 ).
- Какое у него давление при 263 К (T 2 )?
ln102325PaP2=40660Jmol⋅K⋅(1263K−1280K)\small ln\frac{102325Pa}{P_2} = \frac{40660\frac{J}{mol}}{8,3145 \frac{J}{mol \ cdot K}\cdot (\frac{1}{263K}-\frac{1}{280K})}lnP2102325Pa=8,3145моль⋅KJ⋅(263K1−280K1)40660molJ9{1,1289}} = 33090\пробел PaP2=e1,12825=33090 Па
Как видите, выполнить этот расчет вручную довольно сложно. Гораздо проще использовать научный калькулятор или, пока вы здесь, наш калькулятор давления пара :).
Как рассчитать давление пара? — Закон Рауля
Закон Рауля гласит:
Давление паров раствора равно произведению давления паров чистого растворителя на его мольную долю.
Это также выражается следующим уравнением:
Psolution=Psolvent⋅Xsolvent\small P_{раствор} = P_{растворитель} \cdot X_{растворитель}Psolution=Psolvent⋅Xsolvent
где:
- Psolution\ small P_{solution}Psolution – давление паров раствора 90 010
- Psolvent\small P_{solvent}Psolvent — давление паров растворителя
- Xsolvent\small X_{solvent}Xsolvent – молярная доля растворителя – отношение молей растворителя к молям всего раствора
Если в растворе более двух компонентов, необходимо применить закон Дальтона для парциальных давлений.

Закон Рауля справедлив только для идеальных растворов. Раствор считается идеальным, когда взаимодействия между всеми молекулами такие же, как взаимодействия между молекулами одного и того же химического вещества. Смеси различных молекул никогда не бывают идеальными, но мы можем обращаться с ними так, как будто они должны упростить наши расчеты.Давайте используем это уравнение для давления пара в упражнении:
Каково давление паров раствора, полученного путем растворения 100 граммов глюкозы (C 6 H 12 O 6 ) в 500 граммах воды? Давление паров чистой воды составляет 47,1 Торр при 37 °С.
- Рассчитайте мольную долю воды (растворителя).
- Xрастворитель=nводаглюкоза+nвода\маленький X_{растворитель} = \frac{n_{вода}}{n_{глюкоза} + n_{вода}}Xsolvent=nводаглюкоза+nводаnвода.
- Молярная масса воды 18 г / моль , а для глюкозы это 180,2 г / моль .
- nвода=500/18=27,70моль\маленькая n_{вода} = 500 / 18 = 27,70 молнвода=500/18=27,70моль.

- nглюкозы=100/180,2=0,555моль\small n_{глюкоза} = 100/180,2 = 0,555 мольглюкозы=100/180,2=0,555моль.
- Xрастворитель=27,70/(27,70+0,555)=0,98\малый X_{растворитель} = 27,70/(27,70+0,555) = 0,98Xрастворитель=27,70/(27,70+0,555)=0,98.
- Использование закона Рауля
- Psolution=47,1∗0,98=46,16 торр\малое P_{раствор} = 47,1 * 0,98 = 46,16 \space торрPsolution=47,1∗0,98=46,16 торр
Теперь вы знаете, как самостоятельно рассчитать давление пара. Оба эти уравнения поначалу могут показаться пугающими, но как только вы их поймете, они окажутся очень простыми. Не забудьте проверить наши другие калькуляторы, например, калькулятор осмотического давления.
Часто задаваемые вопросы
Какова температура кипения при 60% атмосферного давления (0,6 атм)?
Это 86,35°C. Вы можете использовать калькулятор давления паров Omnicalculator или уравнение Клаузиуса Клаперирона следующим образом:
- Определите свою первую точку.
 Например, вода кипит при 100°С при давлении 1 атм.
Например, вода кипит при 100°С при давлении 1 атм. - Получите энтальпию парообразования воды: 40660 Дж/моль. Также помните, что мы будем использовать газовую постоянную: 8,3145 Дж/моль×К .
- Решите уравнение для давления пара, считая, что давление во 2-й точке равно 0,6 атм. Вы получите результирующую температуру: 86,35°C.
Как давление пара влияет на ваш домашний насос?
Согласно уравнению Клаузиуса Клапейрона более низкое давление пара соответствует более низкой температуре кипения. Это означает, что когда ваш домашний насос всасывает воду за счет снижения давления на входе, она более склонна к испарению. Если это не контролировать, мы получим кавитацию внутри насоса, которая представляет собой бурное испарение воды с последующей взрывной конденсацией, которая может повредить внутренние части насоса.
Как рассчитать температуру кипения, зная давление пара?
Мы можем использовать инструмент Omnicalculator Калькулятор давления паров или уравнение Клаузиуса Клапейрона следующим образом:
- Определите известные вам температуру и давление кипения.



 ст.) = 23,4\; мм рт. ст.]
ст.) = 23,4\; мм рт. ст.]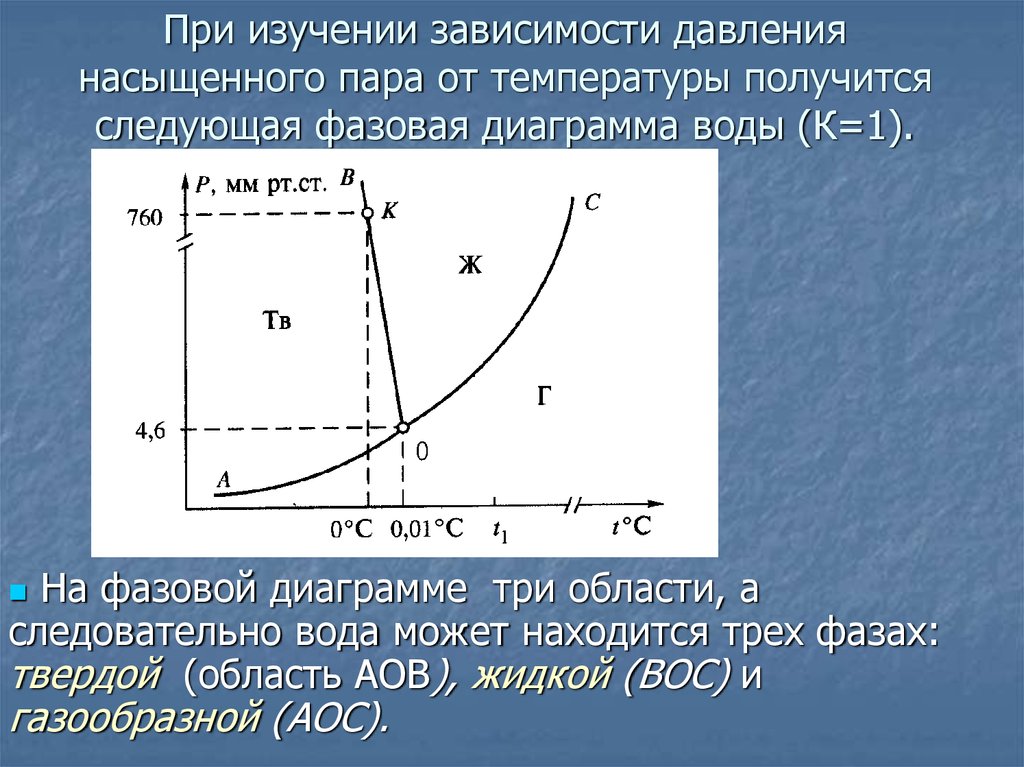
 ст. при 25 °C.
ст. при 25 °C.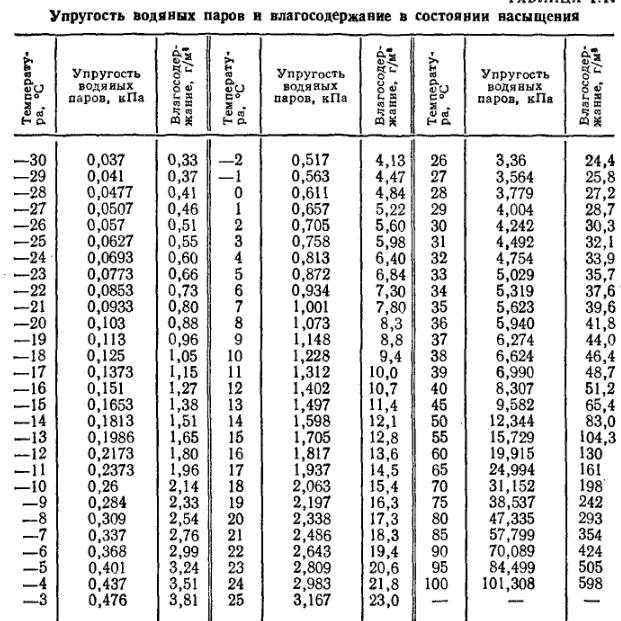
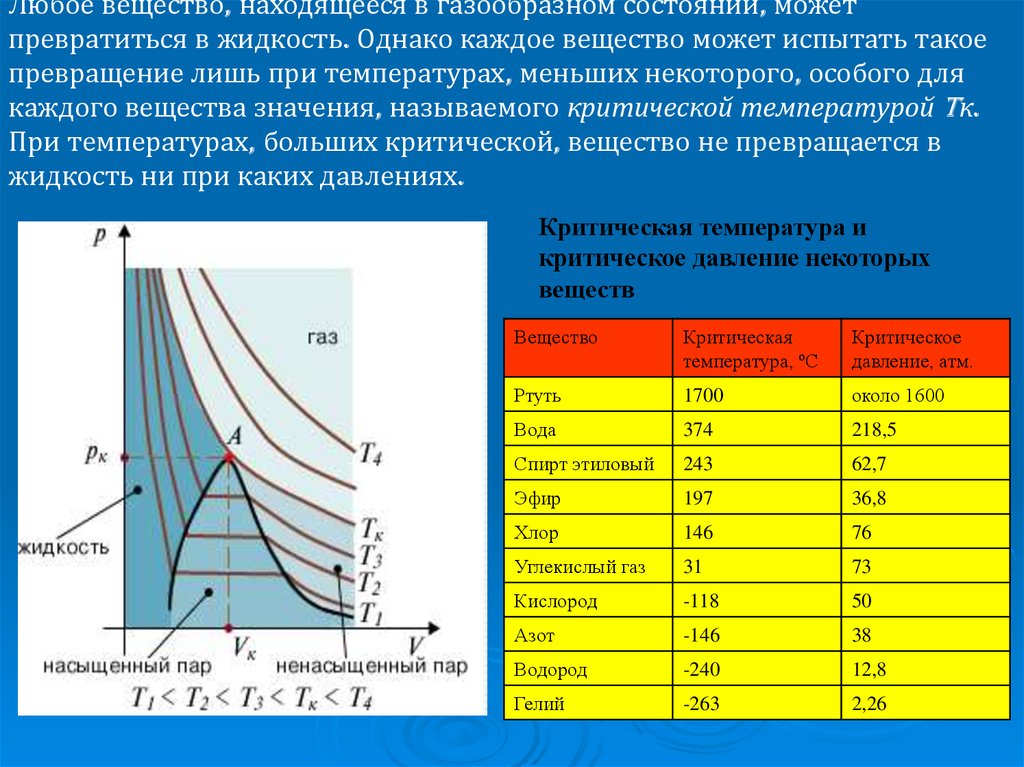 Давление паров полученного раствора составляет 28,6 торр. Рассчитайте молярную массу Y.
Давление паров полученного раствора составляет 28,6 торр. Рассчитайте молярную массу Y.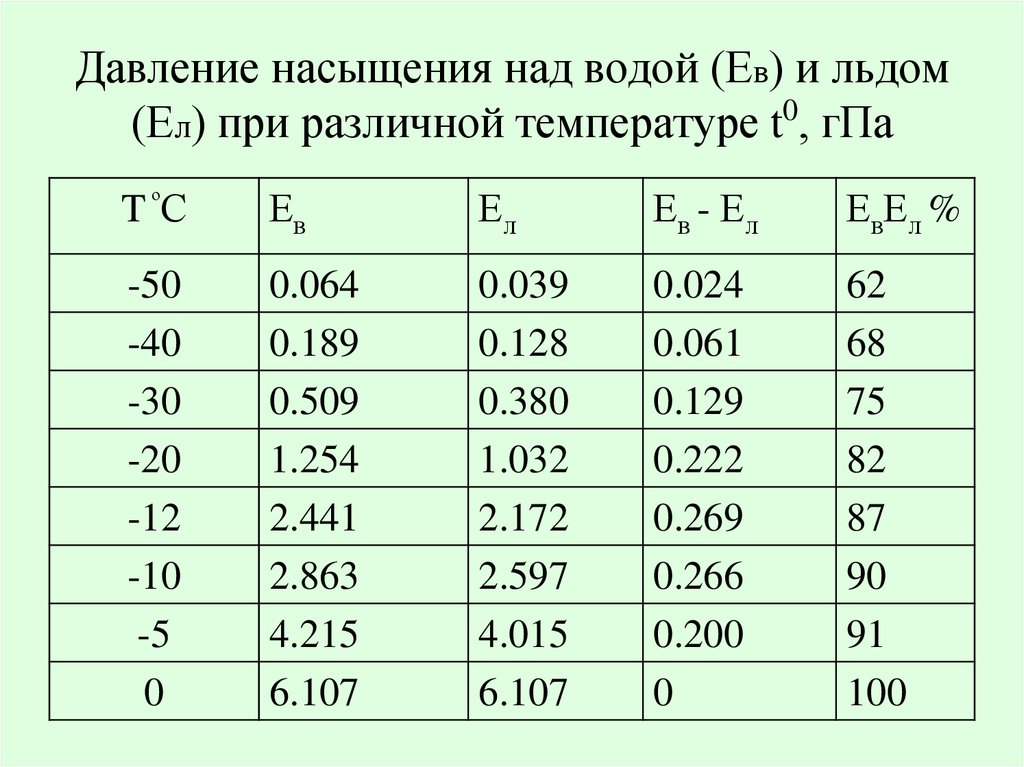 Каково давление пара 2,50 моляля C 6 H 12 O 6
Каково давление пара 2,50 моляля C 6 H 12 O 6  Давление паров бензола составляет 73,03 мм рт.ст. при 25,0 °C.)
Давление паров бензола составляет 73,03 мм рт.ст. при 25,0 °C.)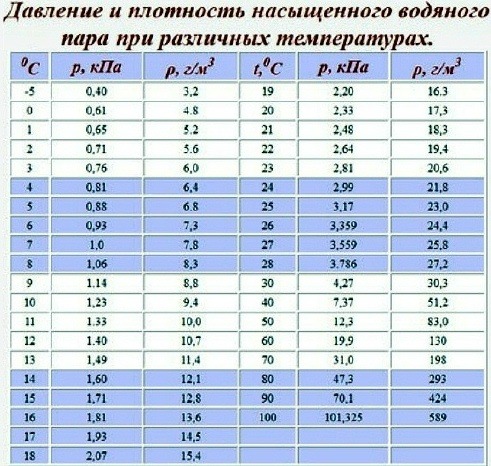 В предположении идеальной смеси давление паров раствора определяется законом Рауля:
В предположении идеальной смеси давление паров раствора определяется законом Рауля:
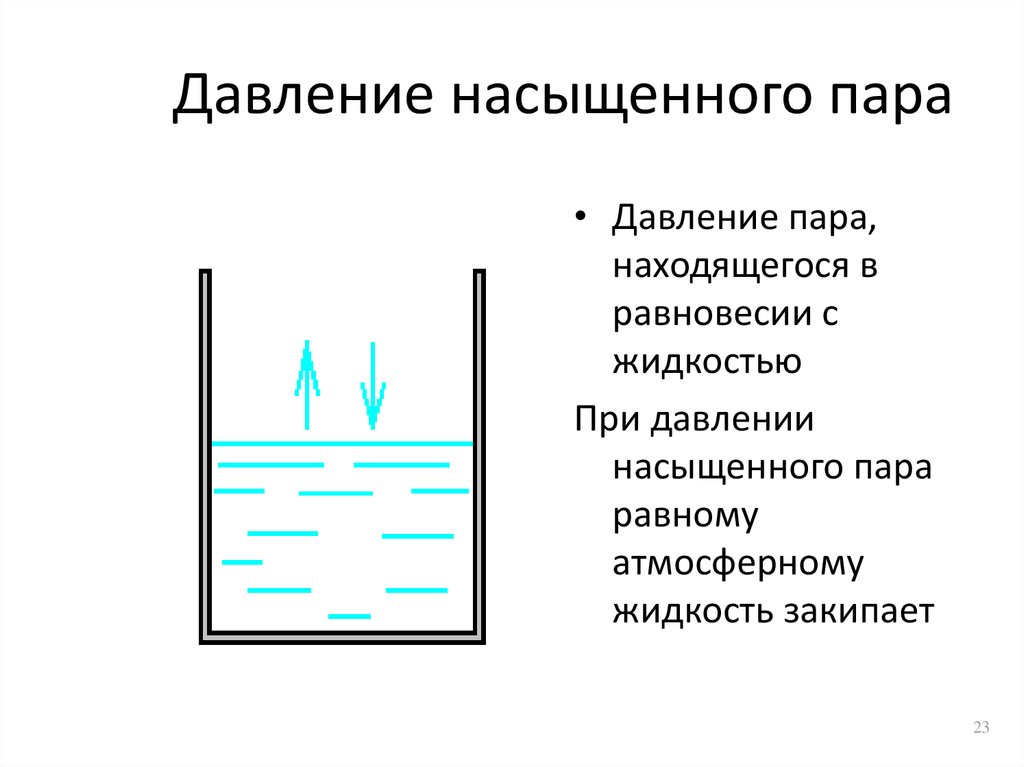 ст. при 25 °C? Предположим, что мочевина является нелетучей. Давление пара чистой воды составляет 23,77 мм рт.ст. при 25 °C.
ст. при 25 °C? Предположим, что мочевина является нелетучей. Давление пара чистой воды составляет 23,77 мм рт.ст. при 25 °C. ст. = (55,3 мм рт.ст.) (х)
ст. = (55,3 мм рт.ст.) (х) Каково давление паров этого раствора? (Давление паров воды составляет 31,82 мм рт.ст. при 30,0 °C.)
Каково давление паров этого раствора? (Давление паров воды составляет 31,82 мм рт.ст. при 30,0 °C.)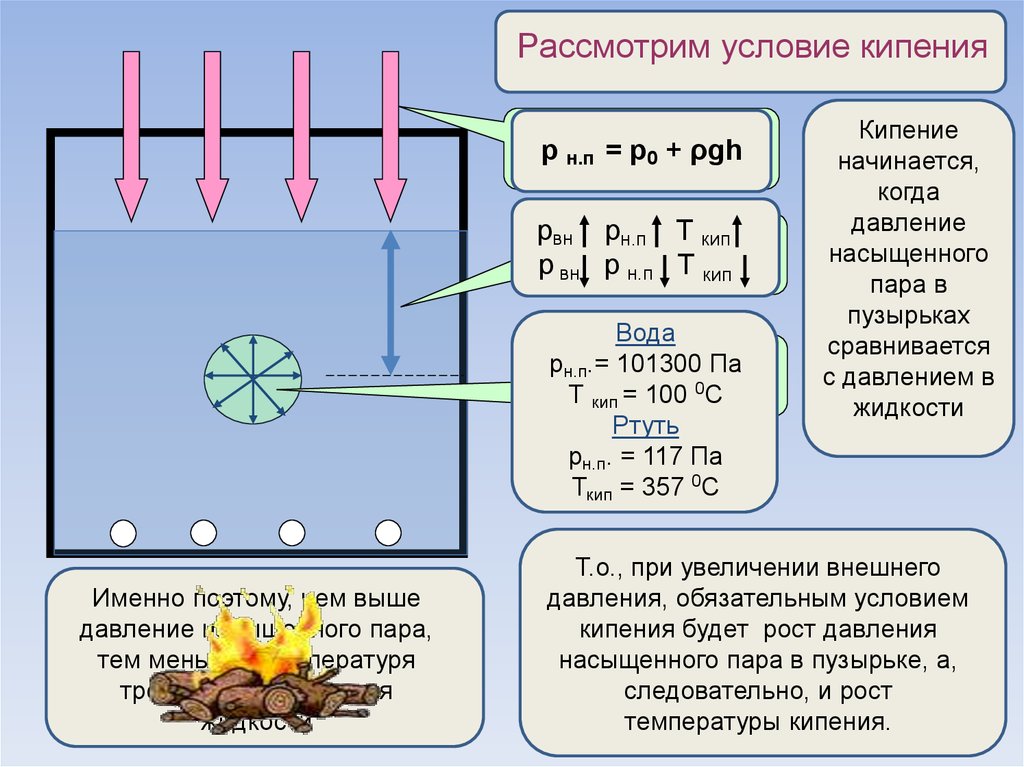 ст.) (0,9952836) = 31,67 мм рт. ст. (до четырех цифр)
ст.) (0,9952836) = 31,67 мм рт. ст. (до четырех цифр) При 300 ° C золото все еще находится в твердом состоянии, и его давление паров Au намного ниже, чем у Hg (который является жидким при 300 ° C. Следовательно, мы будем рассматривать растворенное вещество Au как нелетучее.
При 300 ° C золото все еще находится в твердом состоянии, и его давление паров Au намного ниже, чем у Hg (который является жидким при 300 ° C. Следовательно, мы будем рассматривать растворенное вещество Au как нелетучее.


 е. когда молекулы испаряются, и конденсируются с одинаковой скоростью при определенном давлении. Давление пара напрямую связано с кинетической энергией молекулы. Легкие молекулы с высокой кинетической энергией или со слабыми межмолекулярными силами имеют более высокое давление паров и, следовательно, более высокую летучесть — склонность к испарению.
е. когда молекулы испаряются, и конденсируются с одинаковой скоростью при определенном давлении. Давление пара напрямую связано с кинетической энергией молекулы. Легкие молекулы с высокой кинетической энергией или со слабыми межмолекулярными силами имеют более высокое давление паров и, следовательно, более высокую летучесть — склонность к испарению.
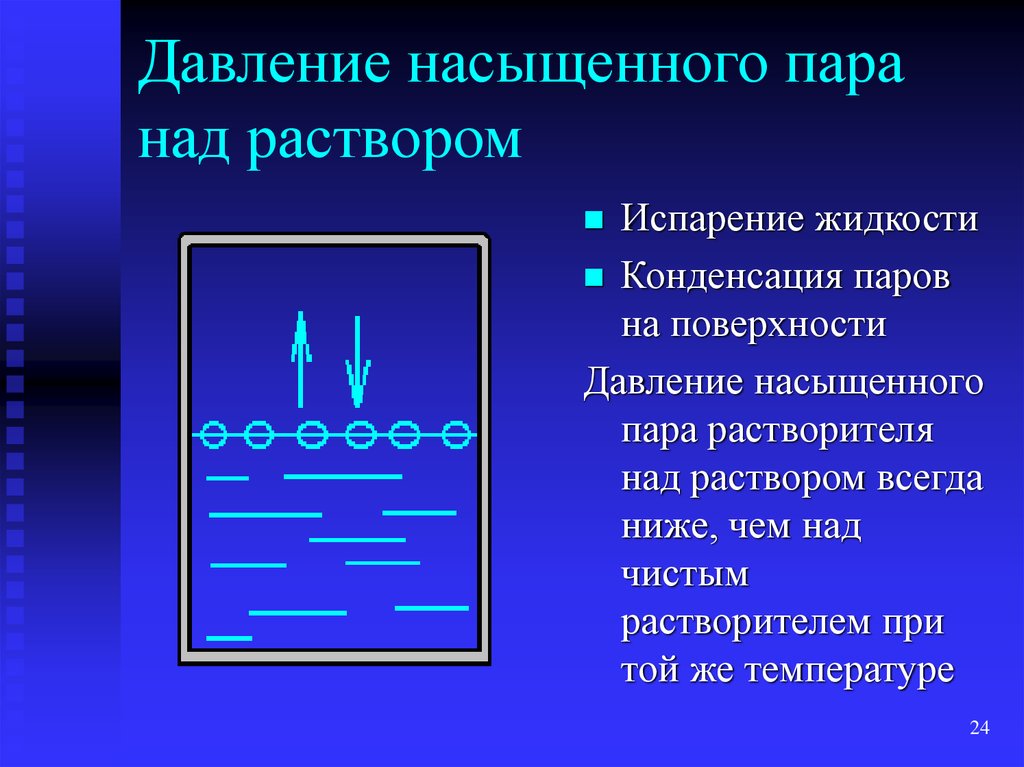 Не беспокойтесь об этом здесь — наш калькулятор давления паров конвертирует их для вас. Но если вы решаете уравнение Клаузиуса-Клапейрона самостоятельно, помните, что температура всегда должна выражаться в градусах Кельвина. Единица давления не имеет значения, если она одинакова как для начального, так и для конечного давления.
Не беспокойтесь об этом здесь — наш калькулятор давления паров конвертирует их для вас. Но если вы решаете уравнение Клаузиуса-Клапейрона самостоятельно, помните, что температура всегда должна выражаться в градусах Кельвина. Единица давления не имеет значения, если она одинакова как для начального, так и для конечного давления.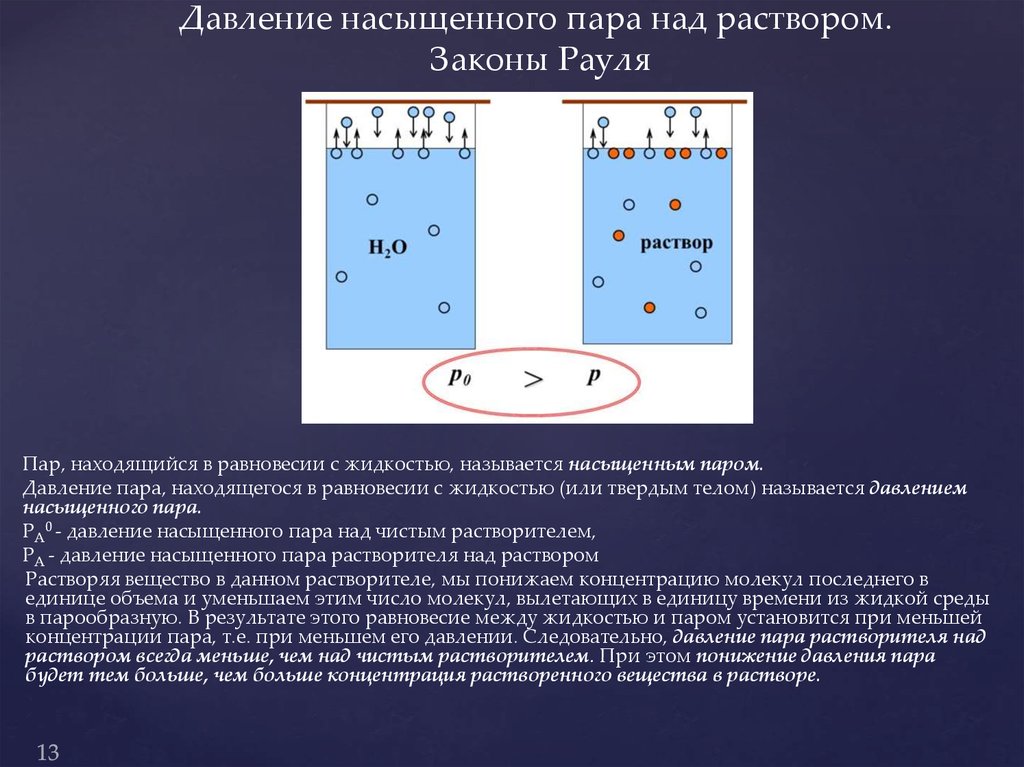
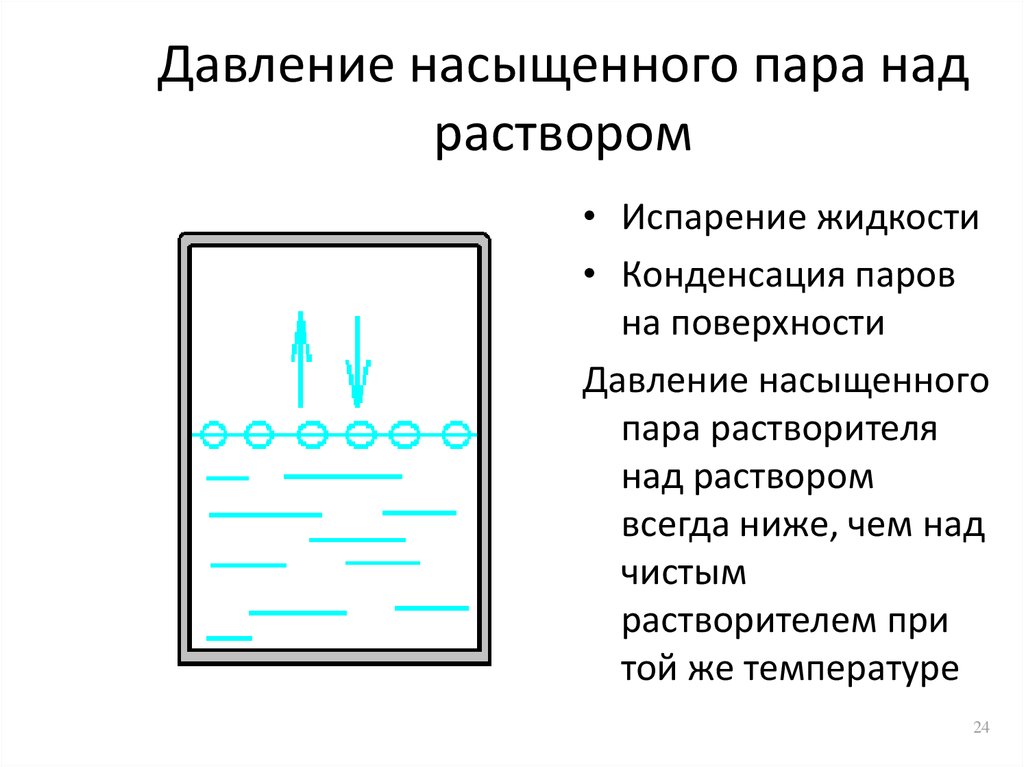

 Например, вода кипит при 100°С при давлении 1 атм.
Например, вода кипит при 100°С при давлении 1 атм.