5. Окислительно-восстановительные процессы.
Окислительно-восстановительными реакциями называют реакции, протекающие с изменением степени окисления (СО) элементов. Степень окисления – это тот условный заряд атома элемента, который вычисляют, исходя из предположения, что молекула состоит только из ионов (как правило, обозначают арабской цифрой, заряд ставят перед цифрой). СО рассчитывается на основании положения, что сумма СО всех атомов, входящих в молекулу равно нулю, а всех атомов , составляющих ион – заряду иона.
Ряд элементов имеют постоянную СО. Например:
Водород Н (за исключением гидридов, где, СО Н = — 1) +1
Щелочные металлы (Nа, К, Li и др.) +1
Металлы 2 группы периодической системы (Са, Zn и т. д.) +2
Металлы 3 группы периодической системы (А1) +3
Кислород О -2
(За исключением
ОF2,
где СО кислорода +1; перекисей Н д., где СО кислорода – 1).
д., где СО кислорода – 1).
Составление уравнений окислительно-восстановительных реакций.
Прежде всего необходимо рассчитать степени окисления всех элементов реакции в левой и правой частях уравнения. Для нахождения коэффициентов при составлении окислительно-восстановительных реакций необходимо:
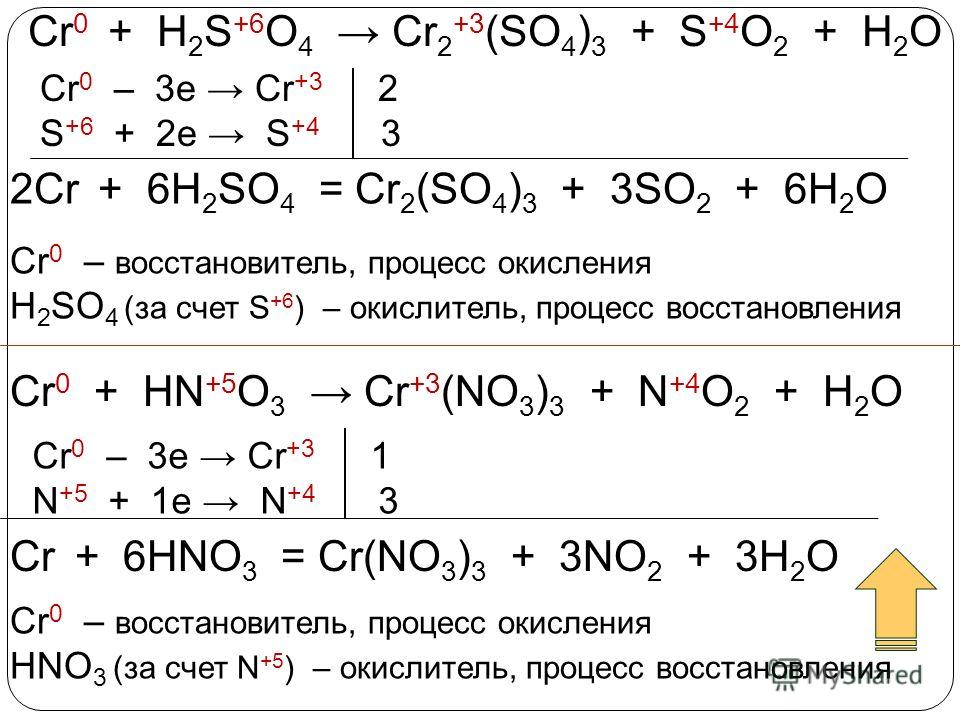
— соблюдение принципа электронного баланса (число электронов, отданных восстановителем (Red) , должно быть равно числу электронов, принятых окислителем (Ox), например:
Al + O2 Al2O3
Red Ox
4 Al — 3ē = Al3+()
3 O2 + 4ē = 2O2¯
4Al + 3O2 = 2Al2O3
В реакциях, протекающих в водных растворах, следует использовать среду (кислую, щелочную, нейтральную). Например, в кислой среде:
K2Cr 2O7 + KJ + H2SO4 Cr2(SO4)3 + J2 + H2O+ K2SO4
3 2J— — 2ē = J2
1 Cr2O72- + 6ē + 14H+ = 2Cr+3 + 7H2O
Суммарное молекулярное уравнение реакции:
K2Cr2O7 + 6KJ + 7H2SO4 Cr2(SO4)3 + 3J2 + 7H2O + 4K2SO4
В щелочной среде:
KCrO2 + KClO4 + KOH → K2CrO4 + KCl + H2O
8 CrO2— — 3ē + 4OH— → CrO42- + 2H2O
3 ClO4— + 8ē + 4H2O → Cl— + 8OH—
Суммарное молекулярное уравнение реакции
8KCrO2
Среда нейтральная:
KMnO4 + MnSO4 + H2O → MnO2 + K2SO4 + H2SO4
3 Mn — 2ē + 2H2O = MnO2 + 4H+
2 MnO4 + 3ē + 2H2O = MnO2 + 4OH—
6H2O + 4H2O → 12H+ + OH—
2H2O → 4H+
Суммарное молекулярное уравнение реакции:
2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
Задания 161-180.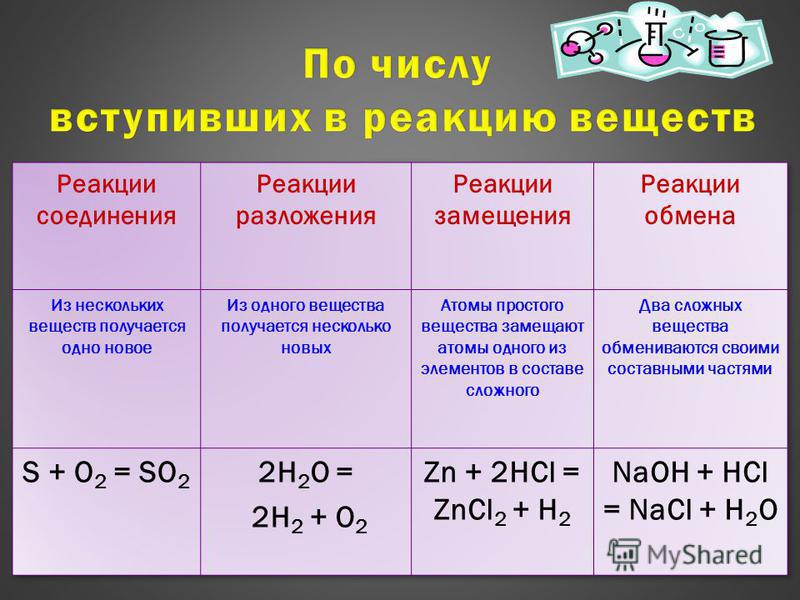 Составьте электронно-ионные схемы и
молекулярные уравнения реакций. Укажите
окислитель и восстановитель. Для каждого
задания по две реакции (а, б):
Составьте электронно-ионные схемы и
молекулярные уравнения реакций. Укажите
окислитель и восстановитель. Для каждого
задания по две реакции (а, б):
161. a) Na2SeO3 + KBrO + H2O Br2; SeO42-
б) HCl + HNO3 Cl2; NO
162. a) Cr2(SO4)3 + Cl2 + KOH CrO42-; Cl—
б) NaNO2 + KJ + H2SO4 NO; J2
163. a) NaCrO2 + NaClO + KOH CrO42-; Cl—
б) H2S + SO2 S; H2O
164. a) HNO3 + Ni0 N2O; Ni2+
б) SO2 + Br2 + H2O HBr; H2SO4
165. a) K2Cr2O7 + Na3AsO3 + H2SO4 AsO43-; Cr3+
б) KCrO2 + Cl2 + KOH CrO42-; Cl—
 a) SO2 + NaClO3 + H2O
SO42-;
Cl—
a) SO2 + NaClO3 + H2O
SO42-;
Cl—б) K2Cr2O7 + HCl Cr3+; Cl2
167. a) KMnO4 + H2S + H2SO4 Mn2+; SO42-
б) J2 + Cl2 + H2O JO3—; Cl—
168. SnCl2 + KBrO3 + HCl Sn4+; Br—
б) KClO3 + KCrO2 + NaOH CrO42-; Cl—
169. Ni(OH)2 + NaClO + H2O Ni(OH)3; Cl—
б) KMnO4 + Na2SO3 + H2O MnO2; SO42-
170. a) MnSO4 + PbO 2 + H2SO4 Pb2+; MnO4—
б) FeCl2 + KMnO4 + H2SO4 Fe+3; Mn+2
171. a)
H3PO3 + KMnO4 + H2SO4
Mn+2;
H3PO4
a)
H3PO3 + KMnO4 + H2SO4
Mn+2;
H3PO4
б) MnO2 + KClO2 + KOH MnO42-; Cl—
172. a) KMnO4 + NaNO2 + H2O NO3—; MnO2
б) S + HNO3 SO2; NO
173. a)H2S + K2Cr2O7 + H2SO4 S; Cr+3
б) KNO3 + Zn + KOH ZnO22-; NH3
174. a)
Cr2O3 + KClO3 + KOH
CrO42-;
Cl
б) FeCl2 + HNO3 + HCl Fe+3; N2O
175. a) KClO3 + MnO2 + KOH MnO42-; Cl—
б) Na3AsO3 + J2 + H2O AsO43-; J—
176. a) H2S
+ HNO3
SO42-;
Cl—
a) H2S
+ HNO3
SO42-;
Cl—
б) J2 + Na2SO3 + H2O J—; SO42-
177. a) C + HNO3 CO2; NO2
б) H2S + Cl2 + H2O SO42-; Cl—
178. a) SnCl2 + Na3AsO3 + HCl As; Sn+4
б) KNO3 + Zn + NaOH ZnO22-; NH 3
179. a) Cr2O3 + KClO3 + KOH CrO42-; Cl—
б) KMnO4 + Na2SO3 + H2SO4 Mn+2; SO42-
180. a) Mn(NO3)2 + NaBiO3 + HNO3 Bi+3; MnO4—
б) H2S + Br2 + H2O SO42-; Br—
Соли хрома: химические свойства и получение
Соли хромаСоли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
В растворах окисляются даже кислородом воздуха.
Например, хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
4CrCl2 + O2 + 20KOH + 2H2O → 4K3[Cr(OH)6] + 8KCl
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
CrCl2 + 4HNO3(конц) → Cr(NO3)3 + NO2↑ + 2HCl↑ + H2O
2CrCl2 + 4H2SO4(конц) → Cr2(SO4)3 + SO2↑ + 4HCl↑ +2H2O
Соли хрома (III)
Хром с валентностью III образует два типа солей:
- Соли, в которых хром (III) является катионом. Например, хлорид хрома (III) CrCl3.

- Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III). Например, хромит калия, KCrO
1. Соли хрома (III) проявляют слабые восстановительные свойства. окисляются под действием сильных окислителей в щелочной среде.
Например, бром в присутствии гидроксида калия окисляет хлорид хрома (III):
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Cr2(SO4)3 + 3Br2 + 16NaOH → 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
2CrCl3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 6NaCl + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Cr2(SO4)3 + 6KMnO4 + 16KOH → 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например, гексагидроксохроматы окисляются бромом в щелочи:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH → 2Na2CrO4 + 6NaBr + 8H
2K3[Cr(OH)6] + 3Br2 + 4KOH → 2K2CrO4 + 6KBr + 8H2O
Оксид свинца (IV) также окисляет хромиты:
2KCrO2 + 3PbO2 + 8KOH → 2K2CrO4 + 3K2PbO2 + 4H2O
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
Cr(OH)3 + 3KOH → K3[Cr(OH)6]
3. Более активные металлы вытесняют хром (III) из солей.
Например, цинк реагирует с хлоридом хрома (III):
2CrCl3 + Zn → 2CrCl2 + ZnCl2
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr3+ + H2O = CrOH2+ + H+
II ступень: CrOH2+ + H2O = Cr(OH)2+ + H+
III ступень: Cr(OH)2+ + H2O = Cr(OH)3 + H+
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например, при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Cr2(SO4)3 + 6NaHSO3 → 2Cr(OH)3 + 6SO2 + 3Na2SO4
2CrBr3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + CO2↑ + 6NaBr
2Cr(NO3)3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 6NaNO3 + 3CO2↑
2CrCl3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 6NaCl + 3CO2↑
Cr2(SO4)3 + 3K2CO3 + 3H2O → 2Cr(OH)3↓ + 3CO2↑ + 3K2SO4
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Cr2O3 + Na2O → 2NaCrO2
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например, хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HNO3 → Cr(NO3)3 + NaNO3 + 2H2O
2NaCrO2 + 4H2SO4 → Cr2(SO4)3 + Na2SO4 + 4H2O
Под действием избытка воды хромиты гидролизуются:
NaCrO2 + 2H2O → Cr(OH)3↓ + NaОН
Соли хрома (VI)
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например, хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например, хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
2K2CrO4 + H2SO4(разб.) → K2Cr2O7 + K2SO4 + H2O
2K2CrO4 + 2HCl(разб.) → K2Cr2O7 + 2KCl + H2O
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например, дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например, дихромат калия реагирует с сульфитом натрия в нейтральной среде:
K2Cr2O7 + 3Na2SO3 + 4H2O → 2Cr(OH)3↓ + 3Na2SO4 + 2KOH
Хромат калия окисляет сульфид аммония:
2K2CrO4 + 3(NH4)2S + 2H2O → 2Cr(OH)3↓ + 3S↓ + 6NH3↑ + 4KOH
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например, хромат калия окисляет гидросульфид аммония в щелочной среде:
2K2CrO4 + 3NH4HS + 2H2O + 2KOH → 3S + 2K3[Cr(OH)6] + 3NH3
Хромат натрия окисляет сернистый газ:
2Na2CrO4 + 3SO2 + 2H2O + 8NaOH → 2Na3[Cr(OH)6] + 3Na2SO4
Хромат натрия окисляет сульфид натрия:
2Na2CrO4 + 3Na2S + 8H2O → 3S + 2Na3[Cr(OH)6] + 4NaOH
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например, дихромат калия окисляет сероводород в присутствии серной кислоты:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
K2Cr2O7 + 7H2SO4 + 6KI → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
8K2Cr2O7 + 3Ca3P2 + 64HCl → 3Ca3(PO4)2 + 16CrCl3 + 16KCl + 32H2O
K2Cr2O7 + 7H2SO4 + 6FeSO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 4H2SO4 + 3KNO2 → Cr2(SO4)3 + 3KNO3 + K2SO4 + 4H2O
K2Cr2O7 + 3SO2 + 8HCl → 2KCl + 2CrCl3 + 3H2SO4 + H2O
K2Cr2O7 + 14HCl → 3Cl2 + 2CrCl3 + 7H2O + 2KCl
Понравилось это:
Нравится Загрузка. ..
..
[Решено] Степень окисления Cr в K2CrO4:
Вариант 2: 6
Свободный
Ячейка
6.9 тысяч пользователей
10 вопросов
10 баллов
7 минут
Понятие:
- Степень окисления/степень окисления элемента в соединении – это число зарядов (положительных или отрицательных), присвоенных атому в молекуле или ионе в соответствии с набором некоторых произвольных правил.
Правила присвоения степени окисления:
- Степень окисления всех элементов в свободном состоянии равна нулю.
- Самый электроотрицательный элемент, фтор имеет степень окисления -1 во всех соединениях.
- Степень окисления одноатомных ионов равна их заряду. Например:
- Степень окисления Li+, Ca2+ и Al3+ равна +1, +2 и +3 соответственно.
- Степень окисления Cl- и SO42- равна -1 и -2 соответственно.

- Водород имеет степень окисления +1 во всех соединениях, кроме ионных гидридов (степень окисления -1).
- Степень окисления кислорода составляет -2 в соединении, за исключением перекисей , для которых -1.
- Щелочные металлы (Li, Na, K и т. д.) всегда имеют степень окисления +1, а щелочно-земельные металлы (Be, Mg и т. д.) имеют степень окисления +2 соответственно.
- В комплексах переходных металлов учитывается заряд лигандов.
- Лиганды можно разделить на анионные, катионные и нейтральные. Нейтральные лиганды не несут никакого заряда.
- Некоторые примеры лигандов:
| Лиганды | Категория |
| Cl-, Br-, I-, NO3-, N3-, S2- и т. д. | Анионные лиганды |
| Этилендиамин(en), вода, аммиак, CO, PPh4 и т. д. | Нейтральные лиганды |
| НО+, НО2+ | Положительные лиганды |
Расчет:
- Пусть степень окисления будет ‘x’ хрома в K2Cr2O4.

- Четыре атома кислорода дают нам — 2 × 4 = -8 зарядов.
- Ион металла находится в одноположительном состоянии, поэтому два иона K + обеспечат заряд +2 .
- Молекула в целом не имеет заряда, она нейтральна.
- Отсюда уравнение для зарядов:
х + 2 + (-8 ) = 0,
или, х — 6 = 0, или х = 6
Следовательно, заряд на каждой ион хрома в K2CrO4 равен +6.
Скачать решение PDFПоделиться в WhatsApp
Последние обновления группы D RRB
Последнее обновление: 23 января 2023 г.
Результаты PET RRB группы D были опубликованы для RRB Bhubaneswar и RRB Prayagraj 23 января 2023 года. 10 января 2023 года. 4 января 2023 года выпущена пропускная карта RRB Group D PET для ECoR, WR и SR . Расписание ПЭТ группы D RRB опубликовано для RRB Ajmer. Ссылка на систему показателей группы D RRB активна. Теперь кандидаты могут проверить свои индивидуальные баллы. 26 декабря 2022 года было опубликовано расписание ПЭТ группы D RRB для различных зон. Результаты и отсечки группы D RRB объявлены 22 и 23 декабря 2022 года! Экзамен проводился с 17 августа по 11 октября 2022 года. RRB (Железнодорожная комиссия по найму) проводит экзамен группы D RRB для найма на различные должности ремонтника пути, помощника/ассистента в различных технических отделах, таких как электротехнический, механический, научно-технический и т. д. Процесс отбора на эти должности включает в себя 4 этапа: компьютерный тест, тест на физическую работоспособность, проверку документов и медицинский тест.
Расписание ПЭТ группы D RRB опубликовано для RRB Ajmer. Ссылка на систему показателей группы D RRB активна. Теперь кандидаты могут проверить свои индивидуальные баллы. 26 декабря 2022 года было опубликовано расписание ПЭТ группы D RRB для различных зон. Результаты и отсечки группы D RRB объявлены 22 и 23 декабря 2022 года! Экзамен проводился с 17 августа по 11 октября 2022 года. RRB (Железнодорожная комиссия по найму) проводит экзамен группы D RRB для найма на различные должности ремонтника пути, помощника/ассистента в различных технических отделах, таких как электротехнический, механический, научно-технический и т. д. Процесс отбора на эти должности включает в себя 4 этапа: компьютерный тест, тест на физическую работоспособность, проверку документов и медицинский тест.
В какой из следующих пар соединений степень окисления хрома одинакова — Sarthaks eConnect
← Предыдущий вопрос Следующий вопрос →
1 ответ
+1 голос
← Предыдущий вопрос Следующий вопрос →
Похожие вопросы
Рассчитать степень окисления следующих соединений:
спросил
16 апр. 2020 г.
в окислительно-восстановительных реакциях
к
Рукмани
(51,2 тыс. баллов)
2020 г.
в окислительно-восстановительных реакциях
к
Рукмани
(51,2 тыс. баллов)
- окисление
- реакция восстановления
- класс-11
Сбалансируйте следующую реакцию методом степени окисления, а также определите окислитель.
спросил 16 апр. 2020 г. в окислительно-восстановительных реакциях к Рукмани (51,2 тыс. баллов)
- окисление
- реакция восстановления
- класс-11
Что такое степень окисления? Как можно определить окисление и восстановление на основе
спросил 16 апр. 2020 г. в окислительно-восстановительных реакциях к Рукмани (51,2 тыс. баллов)
- окисление
- реакция восстановления
- класс-11
Расположите в порядке возрастания степеней окисления йода: I2, HI, HIO4, ICl
спросил
16 апр. 2020 г.
в окислительно-восстановительных реакциях
к
Рукмани
(51,2 тыс. баллов)
баллов)
- окисление
- реакция восстановления
- класс-11
При испытании нитрата образуется комплекс [Fe (h3O)5 (NO)(SO4)]. Какова степень окисления Fe в этом комплексе?
спросил 16 апр. 2020 г. в окислительно-восстановительных реакциях к Рукмани (51,2 тыс. баллов)
- окисление
- реакция восстановления
- класс-11
Категории
- Все категории
- JEE (29,9к)
- NEET (8,5к)
- Наука (760к)
- Математика (246к)
- Статистика (2,9к)
- Наука об окружающей среде (5,2к)
- Биотехнология (617)
- коммерция (66,8к)
- Электроника (3,8к)
- Компьютер (19,5к)
- Искусственный интеллект (ИИ) (1,4к)
- Информационные технологии (14,2к)
- Программирование (8,8к)
- Политическая наука (6,9к)
- Домашняя наука (6,7к)
- Психология (3,9к)
- Социология
(6.
 0k)
0k) - Английский (62,2к)
- хинди (25,7к)
- Способность (23,7к)
- Рассуждение (14,6к)
- ГК (25,7к)
- Олимпиада (530)
- Советы по навыкам (83)
- CBSE (747)
- РБСЭ
(49,1к)
- 12 класс (17,0 к)
- 11 класс
(13,8к)
- Математика (835)
- Физика (629)
- Химия
(624)
- Основные понятия химии (60)
- Атомная структура (50)
- Периодическая таблица (49)
- Химическая связь и молекулярная структура (40)
- Состояние вещества — газ и жидкость (51)
- Термодинамика (48)
- Равновесие (49)
- Окислительно-восстановительные реакции (40)
- Водород (40)
- s-элементы блока (40)
- Элементы p-блока (43)
- Органическая химия — некоторые основные принципы и методы (52)
- Углеводороды (35)
- Химия окружающей среды (26)
- Биология (1,3к)
- Английский
(1.



 0k)
0k)