| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
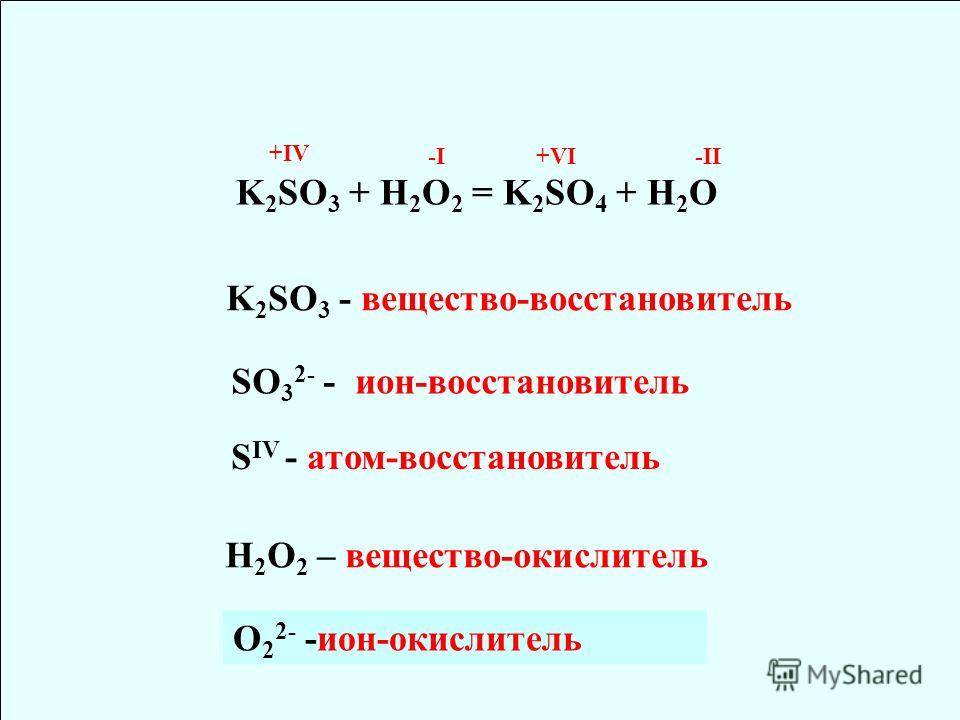
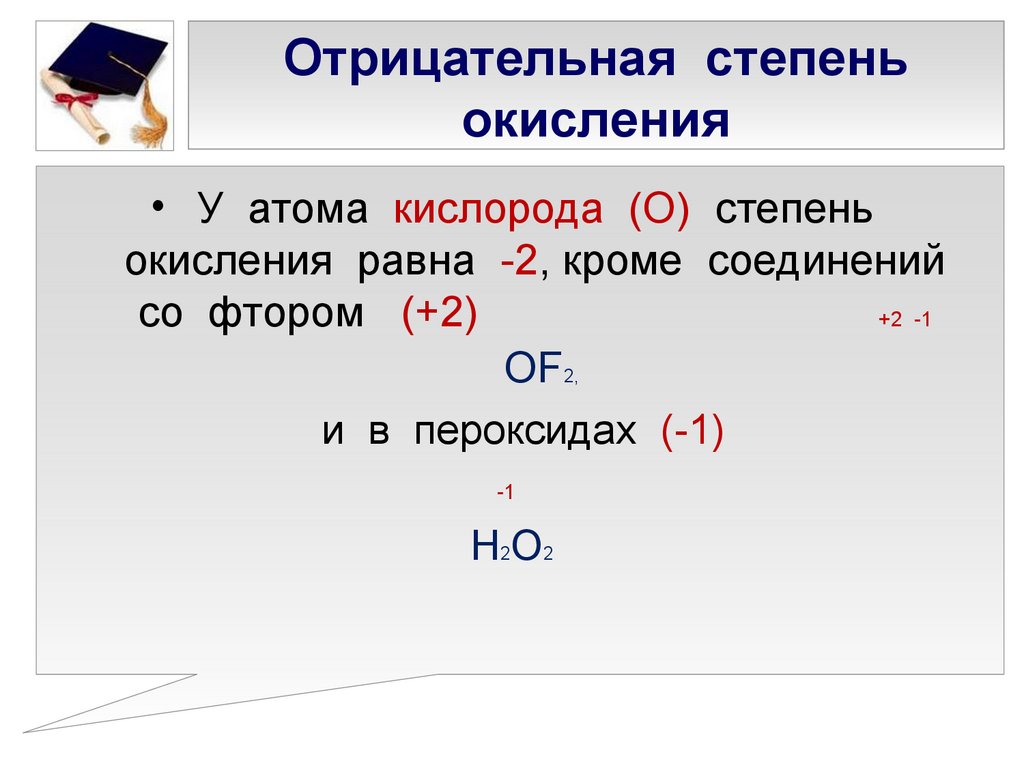
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
9.
получить 2,3 — диметилбутен-1 из…
Решено
При действии избытка соляной кислоты…
Надо срочно решить!
Решено
скорость химических реакций
WebElements Periodic Table » Калий » гидроксид калия
- Формула: КОН
- Формула системы Хилла: H 1 K 1 O 1
- Регистрационный номер CAS: [1310-58-3]
- Вес формулы: 56.106
- Класс: гидроксид
- Цвет: белый
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 406°C
- Температура кипения: 1327°C
- Плотность: 2044 кг·м -3
Ниже приведены некоторые синонимы гидроксида калия :
- гидроксид калия
- гидроксид калия(I)
Степень окисления калия в гидроксиде калия составляет 1 .
Синтез
Нет в наличии
Элементный анализ
В таблице показано процентное содержание элементов для KOH (гидроксид калия).
| Элемент | % |
|---|---|
| Н | 1,80 |
| К | 69,69 |
| О | 28,52 |
Изотопная схема KOH
На приведенной ниже диаграмме показана рассчитанная изотопная картина для формулы KOH с наиболее интенсивным ионом, установленным на 100%.
Каталожные номера
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
- Ф.
 А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999. - А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- Р.В.Г. Wyckoff, in Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Донней, (ред.) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лиде, (редактор) в справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996.
- Дж.В. Меллор в Всесторонний трактат по неорганической и теоретической химии , тома 1-16, Longmans, Лондон, Великобритания, 1922-1937.

- Дж. Э. Макинтайр (редактор) в Словаре неорганических соединений , тома 1–3, Chapman & Hall, Лондон, Великобритания, 1992.
Исследуйте периодические свойства по этим ссылкам
Соуль требуется часть4 — myQnt1notes
… Обратная связь: 2.
3. Определите количество молей гидроксида кальция , нейтрализованного:0221 4.84E-3 mol HNO 3 | = 2. 42E-3 mol Ca(OH) 2 42E-3 mol Ca(OH) 2 | ||||||||||||
4. Find the volume of the base:
| mL Ca(OH) 2 = | 2.42E-3 mol Ca(OH) 2 | = 19.8 mL Ca(OH ) 2 | ||||
OWL 4.8n МАС-титрование: M кислота/основание
Водный раствор гидроксида калия стандартизуют титрованием 0,191 М раствором азотной кислоты .
Если для нейтрализации 15,4 мл кислоты требуется 31,1 мл основания, какова молярность раствора гидроксида калия ?
Обратная связь:
1. Напишите сбалансированное химическое уравнение реакции:
HNO 3 + KOH K NO 3 + H 2 O
2. Определите число молеров ACID ACID в TITRATE:
2. Определите число молеров ACID ACID в TITRATE:
2. Определите число молеров ACID AINTIRTATE:
2. Определите число молеров ACID AINTRATION:
2. Определите число молеров ACID AINTIR mol HNO 3 =
 94E-3 mol HNO 3
94E-3 mol HNO 3 3 Определить число молей гидроксида калия , нейтрализованного:
| моль KOH = | 2,94E-3 моль 3 HNO 3 1 0 1 | = 2.94E-3 mol KOH | |
4. Find the molarity of the base:
| M KOH = |  94E-3 mol KOH 94E-3 mol KOH | = 9.46E-2 M KOH | ||
4.9 c MAS-степени окисления
Присвоение номеров окисления
Используйте эти правила по порядку.
Сумма всех степеней окисления всех элементов = заряд вещества
| | | Степень окисления: | Примеры: |
| 1. | Атомы в их элементарном состоянии 6 0 905 | ||
| Fe, H 2 , O 2 | |||
| 2. | Одноатомные ионы | = заряд | F − , Fe 3+ |
В СОЕДИНЕНИЯХ
3. | Группа 1А | +1 | NaCl, KNO 3 |
| 4. | Группа 2А | +2 | MgO |
| 5. | Фтор | −1 | HF, ClF |
| 6. | Водород | +1 | H 2 O |
| 7. | Кислород | −2 | SO 2 , HClO 4 |
| 8. | Группа 7А | −1 | HCl |
| 9. | Группа 6А | −2 | PbS 2 |
Используйте правила (по порядку), чтобы присвоить степени окисления каждому из элементов в соединениях ниже.
| … | HPO 3 2- | ….. | 1 | … | 3 | … | -2 | ||||
H 2 O 2 | -1 | 1 | |||||||||
H 2 C 2 O 4 | 1 | 3 | -2 | ||||||||
Feedback:
The oxidation numbers for элементы в HPO 3 2- определяются путем присвоения сначала степеней окисления H и O с использованием правил:
. .. .. | Водород в соединениях имеет степень окисления +1. Кислород имеет степень окисления -2 в соединениях. |
Затем вы можете рассчитать степень окисления P , помня, что сумма всех степеней окисления в HPO 3 2- = -2.
… x + 1(+1) + 3(-2) = -2 … и … x = 3
Степени окисления элементов в H 2 O 2 определяются путем присвоения сначала степени окисления H по правилу:
| … | Водород имеет степень окисления +1 в соединениях. |
Затем вы можете рассчитать степень окисления O , помня, что сумма всех степеней окисления в H 2 O 2 = 0,
… 2x + 2(+1) = 0 … и … x = -1
Степени окисления элементов в H 2 C 2 O 4 определяются путем присвоения сначала степеней окисления H и O по правилам:
Затем вы можете рассчитать степень окисления C , помня, что сумма всех степеней окисления в H 2 C 2 O 4 = 0.
… 2x + 2(+1) + 4(-2) = 0 … и … x = 3
===
Использование правила (по порядку) присвоения степеней окисления каждому из элементов в соединениях ниже.
| … | HNO 2 | ….. | 1 | … | 3 | … | -2 | ||||
SO 3 | 6 | -2 | |||||||||
Bi(OH) 3 | 1 | 3 | -2 | ||||||||
FIRBLACK: 2 : 2 . Затем можно рассчитать степень окисления N , помня, что сумма всех степеней окисления в HNO 2 = 0, Степени окисления для элементов в SO 3 определяются путем присвоения сначала степени окисления элементу O по правилу: Затем вы можете рассчитать степень окисления S , помня, что сумма всех степеней окисления в SO 3 = 0, Степени окисления элементов в Bi(OH) 3 определяются по первой присвоение степеней окисления H и O по правилам: Затем вы можете рассчитать степень окисления Bi помня, что сумма всех степеней окисления Bi(OH) 3 = 0, === Для одноатомных ионов степень окисления – это просто
заряд иона. Для ковалентно связанных элементов степень окисления
является бухгалтерским устройством и не означает, что элемент несет
фактический заряд. Определите степень окисления каждого из перечисленных ниже элементов. Обратная связь: Степень окисления ртути в Hg 2 2+ определяют, применяя правило: Степень окисления хлора в MgCl 2 определяют, применяя правила: Пусть x = степень окисления Cl. Then: Состояние окисления для марганье в млн. 2 O 3 определяется применением правил: Пусть x = степень окисления Mn. === 4.9F MAS-Analyze Reacsces: Oxidizing/Reducing Agent 9052 4.9F Analysized Analyze Реакции: Oxidizing/Reducing Agent 0171 HNO 2 определяются путем присвоения сначала степеней окисления H и O по правилам:
0171 HNO 2 определяются путем присвоения сначала степеней окисления H и O по правилам: … Водород имеет степень окисления +1 в соединениях.
Кислород имеет степень окисления -2 в соединениях.
… x + 1(+1) + 2(-2 ) = 0 … и … x = 3 11 … Кислород имеет степень окисления -2 в соединениях.
. .. х + 3(-2) = 0 … и … х = 6
.. х + 3(-2) = 0 … и … х = 6 … Водород имеет степень окисления +1 в соединениях.
Кислород имеет степень окисления -2 в соединениях.
… х + 3(+1) + 3(-2) = 0 … и .. x = 3
Степень окисления элемента является «зарядом» элемента.
было бы, если бы все его связи были полностью ионными; то есть, если
электронные пары каждой связи переносятся на более электроотрицательные
атом.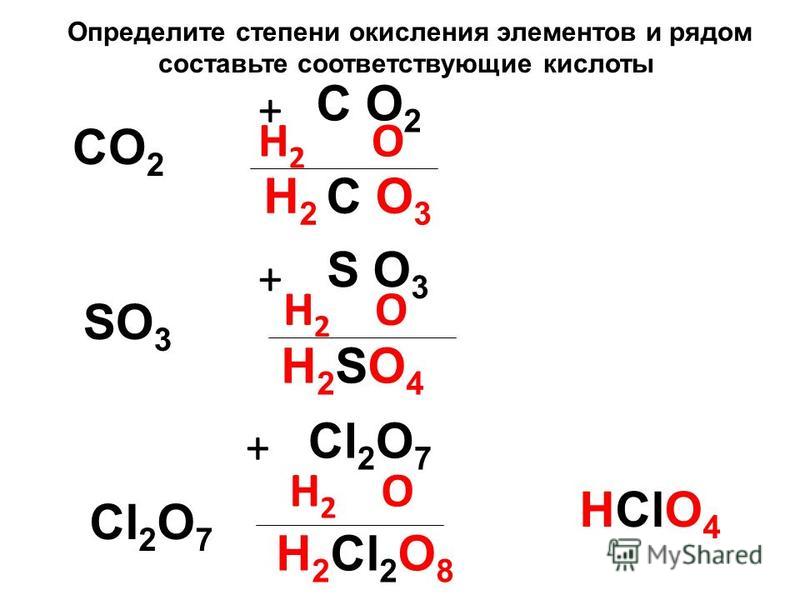
… … … ..
Hg 2 2+ … …
MgCl 2 
Mn 2 O 3 …
Одноатомные ионы имеют степень окисления, равную заряду иона.
Это двухатомный ион (немного необычный), и вы должны разделить заряд на 2, чтобы получить степень окисления +1 для ртути. .  ..
.. Сумма всех степеней окисления в MgCl 2 = 0.
Элементы группы 2А имеют в соединениях степень окисления +2. … 2x + 1(2) = 0 … and … x = -1 … Сумма всех окисляющих номеров в МН 2 11111111111111111111111111111111111111111111111111111111111111111 есть . 3 = 0,
Кислород имеет степень окисления -2 в соединениях.  Тогда:
Тогда: … 2x + 3(-2) = 0 … и … x = 3 4.9F. виды восстановлены, окислитель
и восстановитель в следующей реакции переноса электрона.
Pb 2+ + 2 Cr 2+ Pb + Cr 2 2
Ваш ответ:
Pb2+
Правильный ответ: | Pb2+ |
| 9 | |
Ваш ответ: | Пб |
| | |

Обратная связь:
Восстановление определяется как прирост электронов. Реакция восстановления:
Pb 2+ + 2 e — Pb
Восстанавливается Pb 2+ 90. Поскольку восстанавливаемые вещества вызывают окисление, их называют окислителями. Окисление определяется как потеря электронов. Реакция окисления: Окисляется соединение Cr 2+ Электроны переносятся от восстановителя Cr 2+ к окислителю Pb 2+ . Обратите внимание, что общее число молей переданных электронов для сбалансированного уравнения общей реакции составляет 2 . === 4.9g MAS- analyze redox reactions: oxidizing/reducing agents В
приведенная выше окислительно-восстановительная реакция, используйте степени окисления, чтобы идентифицировать элемент
окисляется, элемент восстанавливается, окислитель и восстановитель
агент. Обратная связь: Окисление — это увеличение степени окисления. Вещество, которое окисляется, является восстановителем. Восстановление – это уменьшение степени окисления. Вещество, которое восстанавливается, является окислителем. Присвоение степеней окисления: никель : Ni = 0 2) Найдите степень окисления никеля в Ni 2+ . Ni = +2 3) сурьма : 2) Найти степень окисления сурьмы СбО + . 3) 3) === 4.10a MAS-анализ окислительно-восстановительных реакций: степени окисления и перенос электрона В приведенной выше реакции степень окисления никеля изменяется с +4 в +2 . Сколько электронов передается в реакции? 2 Обратная связь: 2) Найдите степень окисления никеля в Ni ( ОН) 2 . 3) Степень окисления никеля изменяется с +4 на +2 , поэтому 2 электронов на каждый атом никеля переносится по 1 7 9002 . Общее количество переданных электронов равно ( 2 электронов / Ni )( 1 Ni ) = 2 электронов . === 2 Ал + 3 Zn 2+ 3 Zn + 2 Al 3+
Cr 2+ Cr 3+ + e — 9 . Поскольку частицы, которые окисляются, вызывают восстановление, их называют восстановителями.
Sb 2 O 5 + 2 Ni + 6 H + 2 Ni 2+ + 2 SbO + + 3 Н 2 О 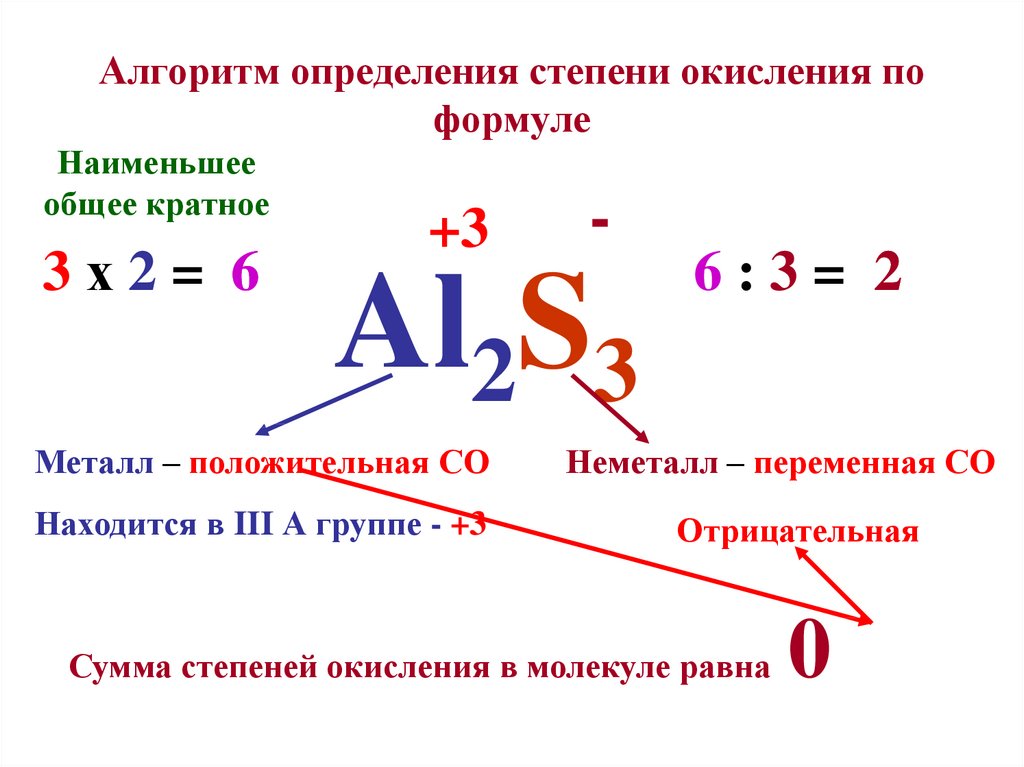
Для помощи в присвоении степеней окисления см. ниже:
Степень окисления никеля меняется с 0 в Ni до +2 в Ni 2+ . Следовательно, никель окисляется, а Ni является восстановителем.
Степень окисления сурьмы изменяется от +5 в Sb 2 O 5 до +3 в SbO + . Следовательно,
сурьма восстанавливается, а Sb 2 O 5 является окислителем.
1) Найдите степень окисления никеля в Ni , используя правила присвоения степеней окисления.
Каждый атом чистого элемента имеет нулевую степень окисления.
Для одноатомных ионов степень окисления равна заряду иона.
Окисление: Ni Ni 2+
Степень окисления1 никеля
172 меняется с 0 на +2 , поэтому никель окисляется.
1) Найдите степень окисления сурьмы в Sb 2 O 5 , используя приведенные выше правила присвоения степеней окисления.
O = -2, заряд = 0
2(Sb) + 5(-2) = 0
Sb = +5
o = -2, заряд = +1
SB +(-2) = +1
SB = +3
Снижение: SB 2
. SbO +
SbO +
Степень окисления сурьмы изменяется с +5 на +3 , поэтому сурьма восстанавливается.
2 Cl — + NiO 2 + 2 H 2 O Ni(OH) 2 + Cl 2 + 2 OH —
1) Найдите степень окисления никеля в NiO 2 , используя приведенные выше правила присвоения степеней окисления.
«O = -2, заряд = 0»
Ni + 2(-2) = 0
Ni = +4 
«ОН = -1, заряд = 0»
Ni + 2(-1) = 0
Ni = +2
Сколько электронов передается в реакции? 6
Обратная связь:
1) Найдите степень окисления цинка в Zn 2+ , используя приведенные выше правила присвоения степеней окисления.
Для одноатомных ионов степень окисления равна заряду иона.
Zn = +2
2) Найдите степень окисления цинка в Zn .

 .. — Учеба и наука
.. — Учеба и наука 11.13
11.13 А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
 Determine the number of moles of acid used in the titration:
Determine the number of moles of acid used in the titration: 