|
Random converter |
Конвертер массовой концентрации в раствореКонвертер длины и расстоянияКонвертер массыКонвертер мер объема сыпучих продуктов и продуктов питанияКонвертер площадиКонвертер объема и единиц измерения в кулинарных рецептахКонвертер температурыКонвертер давления, механического напряжения, модуля ЮнгаКонвертер энергии и работыКонвертер мощностиКонвертер силыКонвертер времениКонвертер линейной скоростиПлоский уголКонвертер тепловой эффективности и топливной экономичностиКонвертер чисел в различных системах счисления.Конвертер единиц измерения количества информацииКурсы валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияКонвертер ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыИмпульс (количество движения)Импульс силыКонвертер вращающего моментаКонвертер удельной теплоты сгорания (по массе)Конвертер плотности энергии и удельной теплоты сгорания топлива (по объему)Конвертер разности температурКонвертер коэффициента теплового расширенияКонвертер термического сопротивленияКонвертер удельной теплопроводностиКонвертер удельной теплоёмкостиКонвертер энергетической экспозиции и мощности теплового излученияКонвертер плотности теплового потокаКонвертер коэффициента теплоотдачиКонвертер объёмного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер плотности потока массыКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкостиКонвертер кинематической вязкостиКонвертер поверхностного натяженияКонвертер паропроницаемостиКонвертер плотности потока водяного параКонвертер уровня звукаКонвертер чувствительности микрофоновКонвертер уровня звукового давления (SPL)Конвертер уровня звукового давления с возможностью выбора опорного давленияКонвертер яркостиКонвертер силы светаКонвертер освещённостиКонвертер разрешения в компьютерной графикеКонвертер частоты и длины волныОптическая сила в диоптриях и фокусное расстояниеОптическая сила в диоптриях и увеличение линзы (×)Конвертер электрического зарядаКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаКонвертер объемной плотности зарядаКонвертер электрического токаКонвертер линейной плотности токаКонвертер поверхностной плотности токаКонвертер напряжённости электрического поляКонвертер электростатического потенциала и напряженияКонвертер электрического сопротивленияКонвертер удельного электрического сопротивленияКонвертер электрической проводимостиКонвертер удельной электрической проводимостиЭлектрическая емкостьКонвертер индуктивностиКонвертер реактивной мощностиКонвертер Американского калибра проводовУровни в dBm (дБм или дБмВт), dBV (дБВ), ваттах и др. Исходная величина килограмм на литрграмм на литрмиллиграмм на литрчастей на миллионгран на галлон (США)гран на галлон (брит.)фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл Преобразованная величина килограмм на литрграмм на литрмиллиграмм на литрчастей на миллионгран на галлон (США)гран на галлон (брит. Тепловая эффективность и топливная экономичностьДействительно ли можно сэкономить бензин, если выключить кондиционер и открыть окна в автомобиле? Подробнее… Общие сведения Бытовые и промышленные чистящие средства Маникюр Краски и растворители Правила безопасности при работе с растворителями Общие сведенияРастворение сахара в воде. 1 — сахар (растворенное вещество), 2 — вода (растворитель), 3 — раствор воды и сахара В повседневной жизни и в промышленности редко используются вещества в чистом виде. Даже вода, если она не дистиллированная, обычно смешана с другими веществами. Чаще всего мы используем растворы, которые являются смесью нескольких веществ одновременно. Не каждую смесь можно назвать раствором, а только ту, в которой смешанные вещества невозможно разделить механическим путем. РастворыС помощью лазера можно увидеть миллионы субмикроскопических частиц, взвешенных в коллоидной системе, которая образована пурпурными чернилами струйного принтера, растворенными в воде Если смешать два или более вещества, можно получить три типа смеси. Вещество, растворяемое в растворе называется, растворенным веществом. Компонент раствора, в котором находится растворенное вещество, называется растворителем. Обычно у каждого раствора есть максимальная концентрация растворенного вещества для определенных температуры и давления. Если попробовать растворить в таком растворе большее количество этого вещества, то оно просто не растворится. С изменением давления или температуры максимальная концентрация вещества тоже обычно меняется. Вода — универсальный растворитель Бытовые и промышленные чистящие средстваЧистка — химический процесс, во время которого чистящее средство растворяет пятна и грязь. Часто во время чистки грязь и чистящее средство образуют раствор. Чистящее средство выполняет роль растворителя, а грязь становится растворяемым веществом. Существуют и другие виды чистящих средств. Эмульгаторы снимают пятна, a биологические очистители из ферментов перерабатывают пятно, как бы съедая его. До развития химической промышленности, для чистки одежды, ткани и шерстяных изделий, а также для приготовления шерсти к дальнейшей обработке и валянию, использовали соли аммония, растворенные в воде. Обычно аммиак добывали из мочи животных и людей, и в Древнем Риме она была настолько востребована, что на ее продажу существовал налог. В Древнем Риме в процессе обработки шерсти ее обычно погружали в ферментированную мочу, и топтали ногами. Так как это достаточно неприятная работа, выполняли ее обычно рабы. Кроме мочи или вместе с ней использовали глины, которые хорошо впитывают жиры и другие биоматериалы, известные как отбеливающие глины. Позже такие глины использовали сами по себе, и они иногда используются и до сих пор. В процессе химической чистки используют растворители, не содержащие воды Вещества, которые используют для чистки в домашних условиях, также нередко содержит аммиак. В химической чистке одежды вместо него используют растворители, которые растворяют жир и другие вещества, приставшие к материалу. Почти весь растворитель, используемый во время чистки, восстанавливают после сушки, дистиллируют и используют повторно. Один из самых распространенных растворителей — тетрахлорэтилен. По сравнению с другими чистящими средствами, он дешев, но его считают недостаточно безопасным. В ряде стран тетрахлорэтилен постепенно вытесняется более безопасными веществами, например жидкийм CO₂, углеводородными растворителями, кремнийорганическими жидкостями и другими. МаникюрРазбавитель лака обычно состоит из растворителей, таких как эфиры, сложноэфирные соединения, кетоны и ароматические углеводородные соединения В состав лака для ногтей входят красители и пигменты, а также стабилизирующие вещества, которые защищают лак от выгорания на солнце. Кроме этого в него входят полимеры, которые делают лак более густым и не дают блесткам опуститься на дно, а также помогают лаку лучше держаться на ногтях. В некоторых странах лак для ногтей классифицируют как опасное вещество, так как он токсичен. Жидкость для снятия лака — тоже растворитель, который снимает лак для ногтей по тому же принципу, что и другие растворители. То есть, он образует с лаком раствор, превращая его из твердого состояния в жидкость. Существует несколько видов жидкостей для снятия лака: более сильные из них содержат в составе ацетон, а слабые растворители — без ацетона. Ацетон лучше и быстрее растворяет лак, но он больше сушит кожу и портит ногти, чем растворители без ацетона. Краски и растворителиРастворители краски похожи на жидкости для снятия лака. Они уменьшают концентрацию масляных красок. Примеры растворителей красок: уайт-спирит, ацетон, скипидар и метилэтилкетон. Эти вещества удаляют краску, например, с кистей во время чистки, или с испачканных во время покраски поверхностей. Также с их помощью разбавляют краску, например для того, чтобы залить ее в распылитель. Растворители краски выделяют токсичные пары, поэтому с ними необходимо работать в перчатках, защитных очках и респираторе. При работе с растворителями необходимо знать, с каким именно растворителем вы работаете, и соблюдать правила техники безопасности, чтобы избежать опасного воздействия этого растворителя на организм Правила безопасности при работе с растворителямиБольшая часть растворителей — токсична. К ним обычно относятся как к опасным веществам, и утилизируют согласно правилам утилизации опасных отходов. Литература Автор статьи: Kateryna Yuri Вас могут заинтересовать и другие конвертеры из группы «Гидравлика и гидромеханика — жидкости»:Конвертер объёмного расхода Конвертер массового расхода Конвертер молярного расхода Конвертер плотности потока массы Конвертер молярной концентрации Конвертер динамической (абсолютной) вязкости Конвертер кинематической вязкости Конвертер поверхностного натяжения Конвертер паропроницаемости Конвертер массы Конвертер удельного объема Конвертер объема и единиц измерения в кулинарных рецептах Компактный калькулятор Полный калькулятор Определения единиц Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. |
|
|
Конвертер массовой концентрации в раствореКонвертер длины и расстоянияКонвертер массыКонвертер мер объема сыпучих продуктов и продуктов питанияКонвертер площадиКонвертер объема и единиц измерения в кулинарных рецептахКонвертер температурыКонвертер давления, механического напряжения, модуля ЮнгаКонвертер энергии и работыКонвертер мощностиКонвертер силыКонвертер времениКонвертер линейной скоростиПлоский уголКонвертер тепловой эффективности и топливной экономичностиКонвертер чисел в различных системах счисления.Конвертер единиц измерения количества информацииКурсы валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияКонвертер ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыИмпульс (количество движения)Импульс силыКонвертер вращающего моментаКонвертер удельной теплоты сгорания (по массе)Конвертер плотности энергии и удельной теплоты сгорания топлива (по объему)Конвертер разности температурКонвертер коэффициента теплового расширенияКонвертер термического сопротивленияКонвертер удельной теплопроводностиКонвертер удельной теплоёмкостиКонвертер энергетической экспозиции и мощности теплового излученияКонвертер плотности теплового потокаКонвертер коэффициента теплоотдачиКонвертер объёмного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер плотности потока массыКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкостиКонвертер кинематической вязкостиКонвертер поверхностного натяженияКонвертер паропроницаемостиКонвертер плотности потока водяного параКонвертер уровня звукаКонвертер чувствительности микрофоновКонвертер уровня звукового давления (SPL)Конвертер уровня звукового давления с возможностью выбора опорного давленияКонвертер яркостиКонвертер силы светаКонвертер освещённостиКонвертер разрешения в компьютерной графикеКонвертер частоты и длины волныОптическая сила в диоптриях и фокусное расстояниеОптическая сила в диоптриях и увеличение линзы (×)Конвертер электрического зарядаКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаКонвертер объемной плотности зарядаКонвертер электрического токаКонвертер линейной плотности токаКонвертер поверхностной плотности токаКонвертер напряжённости электрического поляКонвертер электростатического потенциала и напряженияКонвертер электрического сопротивленияКонвертер удельного электрического сопротивленияКонвертер электрической проводимостиКонвертер удельной электрической проводимостиЭлектрическая емкостьКонвертер индуктивностиКонвертер реактивной мощностиКонвертер Американского калибра проводовУровни в dBm (дБм или дБмВт), dBV (дБВ), ваттах и др. Исходная величина килограмм на литрграмм на литрмиллиграмм на литрчастей на миллионгран на галлон (США)гран на галлон (брит.)фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл Преобразованная величина килограмм на литрграмм на литрмиллиграмм на литрчастей на миллионгран на галлон (США)гран на галлон (брит. ВалютаОт манилл к полимерам. А может быть вообще можно обойтись без наличных денег? Подробнее… Общие сведения Бытовые и промышленные чистящие средства Маникюр Краски и растворители Правила безопасности при работе с растворителями Общие сведенияРастворение сахара в воде. 1 — сахар (растворенное вещество), 2 — вода (растворитель), 3 — раствор воды и сахара В повседневной жизни и в промышленности редко используются вещества в чистом виде. Даже вода, если она не дистиллированная, обычно смешана с другими веществами. Чаще всего мы используем растворы, которые являются смесью нескольких веществ одновременно. Не каждую смесь можно назвать раствором, а только ту, в которой смешанные вещества невозможно разделить механическим путем. Также растворы стабильны, то есть все компоненты в них — в одном агрегатном состоянии, например в виде жидкости. РастворыС помощью лазера можно увидеть миллионы субмикроскопических частиц, взвешенных в коллоидной системе, которая образована пурпурными чернилами струйного принтера, растворенными в воде Если смешать два или более вещества, можно получить три типа смеси. Раствор — только один из этих типов. Вещество, растворяемое в растворе называется, растворенным веществом. Компонент раствора, в котором находится растворенное вещество, называется растворителем. Обычно у каждого раствора есть максимальная концентрация растворенного вещества для определенных температуры и давления. Если попробовать растворить в таком растворе большее количество этого вещества, то оно просто не растворится. С изменением давления или температуры максимальная концентрация вещества тоже обычно меняется. Вода — универсальный растворитель Бытовые и промышленные чистящие средстваЧистка — химический процесс, во время которого чистящее средство растворяет пятна и грязь. Часто во время чистки грязь и чистящее средство образуют раствор. Чистящее средство выполняет роль растворителя, а грязь становится растворяемым веществом. Существуют и другие виды чистящих средств. Эмульгаторы снимают пятна, a биологические очистители из ферментов перерабатывают пятно, как бы съедая его. До развития химической промышленности, для чистки одежды, ткани и шерстяных изделий, а также для приготовления шерсти к дальнейшей обработке и валянию, использовали соли аммония, растворенные в воде. Обычно аммиак добывали из мочи животных и людей, и в Древнем Риме она была настолько востребована, что на ее продажу существовал налог. В Древнем Риме в процессе обработки шерсти ее обычно погружали в ферментированную мочу, и топтали ногами. Так как это достаточно неприятная работа, выполняли ее обычно рабы. Кроме мочи или вместе с ней использовали глины, которые хорошо впитывают жиры и другие биоматериалы, известные как отбеливающие глины. Позже такие глины использовали сами по себе, и они иногда используются и до сих пор. В процессе химической чистки используют растворители, не содержащие воды Вещества, которые используют для чистки в домашних условиях, также нередко содержит аммиак. В химической чистке одежды вместо него используют растворители, которые растворяют жир и другие вещества, приставшие к материалу. Почти весь растворитель, используемый во время чистки, восстанавливают после сушки, дистиллируют и используют повторно. Один из самых распространенных растворителей — тетрахлорэтилен. По сравнению с другими чистящими средствами, он дешев, но его считают недостаточно безопасным. В ряде стран тетрахлорэтилен постепенно вытесняется более безопасными веществами, например жидкийм CO₂, углеводородными растворителями, кремнийорганическими жидкостями и другими. МаникюрРазбавитель лака обычно состоит из растворителей, таких как эфиры, сложноэфирные соединения, кетоны и ароматические углеводородные соединения В состав лака для ногтей входят красители и пигменты, а также стабилизирующие вещества, которые защищают лак от выгорания на солнце. Кроме этого в него входят полимеры, которые делают лак более густым и не дают блесткам опуститься на дно, а также помогают лаку лучше держаться на ногтях. В некоторых странах лак для ногтей классифицируют как опасное вещество, так как он токсичен. Жидкость для снятия лака — тоже растворитель, который снимает лак для ногтей по тому же принципу, что и другие растворители. То есть, он образует с лаком раствор, превращая его из твердого состояния в жидкость. Существует несколько видов жидкостей для снятия лака: более сильные из них содержат в составе ацетон, а слабые растворители — без ацетона. Ацетон лучше и быстрее растворяет лак, но он больше сушит кожу и портит ногти, чем растворители без ацетона. Краски и растворителиРастворители краски похожи на жидкости для снятия лака. Они уменьшают концентрацию масляных красок. Примеры растворителей красок: уайт-спирит, ацетон, скипидар и метилэтилкетон. Эти вещества удаляют краску, например, с кистей во время чистки, или с испачканных во время покраски поверхностей. Также с их помощью разбавляют краску, например для того, чтобы залить ее в распылитель. Растворители краски выделяют токсичные пары, поэтому с ними необходимо работать в перчатках, защитных очках и респираторе. При работе с растворителями необходимо знать, с каким именно растворителем вы работаете, и соблюдать правила техники безопасности, чтобы избежать опасного воздействия этого растворителя на организм Правила безопасности при работе с растворителямиБольшая часть растворителей — токсична. К ним обычно относятся как к опасным веществам, и утилизируют согласно правилам утилизации опасных отходов. Литература Автор статьи: Kateryna Yuri Вас могут заинтересовать и другие конвертеры из группы «Гидравлика и гидромеханика — жидкости»:Конвертер объёмного расхода Конвертер массового расхода Конвертер молярного расхода Конвертер плотности потока массы Конвертер молярной концентрации Конвертер динамической (абсолютной) вязкости Конвертер кинематической вязкости Конвертер поверхностного натяжения Конвертер паропроницаемости Конвертер массы Конвертер удельного объема Конвертер объема и единиц измерения в кулинарных рецептах Компактный калькулятор Полный калькулятор Определения единиц Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. |
|
Random converter |
Конвертер массовой концентрации в раствореКонвертер длины и расстоянияКонвертер массыКонвертер мер объема сыпучих продуктов и продуктов питанияКонвертер площадиКонвертер объема и единиц измерения в кулинарных рецептахКонвертер температурыКонвертер давления, механического напряжения, модуля ЮнгаКонвертер энергии и работыКонвертер мощностиКонвертер силыКонвертер времениКонвертер линейной скоростиПлоский уголКонвертер тепловой эффективности и топливной экономичностиКонвертер чисел в различных системах счисления.Конвертер единиц измерения количества информацииКурсы валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияКонвертер ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыИмпульс (количество движения)Импульс силыКонвертер вращающего моментаКонвертер удельной теплоты сгорания (по массе)Конвертер плотности энергии и удельной теплоты сгорания топлива (по объему)Конвертер разности температурКонвертер коэффициента теплового расширенияКонвертер термического сопротивленияКонвертер удельной теплопроводностиКонвертер удельной теплоёмкостиКонвертер энергетической экспозиции и мощности теплового излученияКонвертер плотности теплового потокаКонвертер коэффициента теплоотдачиКонвертер объёмного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер плотности потока массыКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкостиКонвертер кинематической вязкостиКонвертер поверхностного натяженияКонвертер паропроницаемостиКонвертер плотности потока водяного параКонвертер уровня звукаКонвертер чувствительности микрофоновКонвертер уровня звукового давления (SPL)Конвертер уровня звукового давления с возможностью выбора опорного давленияКонвертер яркостиКонвертер силы светаКонвертер освещённостиКонвертер разрешения в компьютерной графикеКонвертер частоты и длины волныОптическая сила в диоптриях и фокусное расстояниеОптическая сила в диоптриях и увеличение линзы (×)Конвертер электрического зарядаКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаКонвертер объемной плотности зарядаКонвертер электрического токаКонвертер линейной плотности токаКонвертер поверхностной плотности токаКонвертер напряжённости электрического поляКонвертер электростатического потенциала и напряженияКонвертер электрического сопротивленияКонвертер удельного электрического сопротивленияКонвертер электрической проводимостиКонвертер удельной электрической проводимостиЭлектрическая емкостьКонвертер индуктивностиКонвертер реактивной мощностиКонвертер Американского калибра проводовУровни в dBm (дБм или дБмВт), dBV (дБВ), ваттах и др. Исходная величина килограмм на литрграмм на литрмиллиграмм на литрчастей на миллионгран на галлон (США)гран на галлон (брит.)фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл Преобразованная величина килограмм на литрграмм на литрмиллиграмм на литрчастей на миллионгран на галлон (США)гран на галлон (брит. Электрический токЗнаете ли вы, что электрический ток можно измерить осциллографом? Один щелчок — и вы узнаете как это делается! Общие сведения Бытовые и промышленные чистящие средства Маникюр Краски и растворители Правила безопасности при работе с растворителями Общие сведенияРастворение сахара в воде. 1 — сахар (растворенное вещество), 2 — вода (растворитель), 3 — раствор воды и сахара В повседневной жизни и в промышленности редко используются вещества в чистом виде. Даже вода, если она не дистиллированная, обычно смешана с другими веществами. Чаще всего мы используем растворы, которые являются смесью нескольких веществ одновременно. Не каждую смесь можно назвать раствором, а только ту, в которой смешанные вещества невозможно разделить механическим путем. РастворыС помощью лазера можно увидеть миллионы субмикроскопических частиц, взвешенных в коллоидной системе, которая образована пурпурными чернилами струйного принтера, растворенными в воде Если смешать два или более вещества, можно получить три типа смеси. Вещество, растворяемое в растворе называется, растворенным веществом. Компонент раствора, в котором находится растворенное вещество, называется растворителем. Обычно у каждого раствора есть максимальная концентрация растворенного вещества для определенных температуры и давления. Если попробовать растворить в таком растворе большее количество этого вещества, то оно просто не растворится. С изменением давления или температуры максимальная концентрация вещества тоже обычно меняется. Вода — универсальный растворитель Бытовые и промышленные чистящие средстваЧистка — химический процесс, во время которого чистящее средство растворяет пятна и грязь. Часто во время чистки грязь и чистящее средство образуют раствор. Чистящее средство выполняет роль растворителя, а грязь становится растворяемым веществом. Существуют и другие виды чистящих средств. Эмульгаторы снимают пятна, a биологические очистители из ферментов перерабатывают пятно, как бы съедая его. До развития химической промышленности, для чистки одежды, ткани и шерстяных изделий, а также для приготовления шерсти к дальнейшей обработке и валянию, использовали соли аммония, растворенные в воде. Обычно аммиак добывали из мочи животных и людей, и в Древнем Риме она была настолько востребована, что на ее продажу существовал налог. В Древнем Риме в процессе обработки шерсти ее обычно погружали в ферментированную мочу, и топтали ногами. Так как это достаточно неприятная работа, выполняли ее обычно рабы. Кроме мочи или вместе с ней использовали глины, которые хорошо впитывают жиры и другие биоматериалы, известные как отбеливающие глины. Позже такие глины использовали сами по себе, и они иногда используются и до сих пор. В процессе химической чистки используют растворители, не содержащие воды Вещества, которые используют для чистки в домашних условиях, также нередко содержит аммиак. В химической чистке одежды вместо него используют растворители, которые растворяют жир и другие вещества, приставшие к материалу. Почти весь растворитель, используемый во время чистки, восстанавливают после сушки, дистиллируют и используют повторно. Один из самых распространенных растворителей — тетрахлорэтилен. По сравнению с другими чистящими средствами, он дешев, но его считают недостаточно безопасным. В ряде стран тетрахлорэтилен постепенно вытесняется более безопасными веществами, например жидкийм CO₂, углеводородными растворителями, кремнийорганическими жидкостями и другими. МаникюрРазбавитель лака обычно состоит из растворителей, таких как эфиры, сложноэфирные соединения, кетоны и ароматические углеводородные соединения В состав лака для ногтей входят красители и пигменты, а также стабилизирующие вещества, которые защищают лак от выгорания на солнце. Кроме этого в него входят полимеры, которые делают лак более густым и не дают блесткам опуститься на дно, а также помогают лаку лучше держаться на ногтях. В некоторых странах лак для ногтей классифицируют как опасное вещество, так как он токсичен. Жидкость для снятия лака — тоже растворитель, который снимает лак для ногтей по тому же принципу, что и другие растворители. То есть, он образует с лаком раствор, превращая его из твердого состояния в жидкость. Существует несколько видов жидкостей для снятия лака: более сильные из них содержат в составе ацетон, а слабые растворители — без ацетона. Ацетон лучше и быстрее растворяет лак, но он больше сушит кожу и портит ногти, чем растворители без ацетона. Краски и растворителиРастворители краски похожи на жидкости для снятия лака. Они уменьшают концентрацию масляных красок. Примеры растворителей красок: уайт-спирит, ацетон, скипидар и метилэтилкетон. Эти вещества удаляют краску, например, с кистей во время чистки, или с испачканных во время покраски поверхностей. Также с их помощью разбавляют краску, например для того, чтобы залить ее в распылитель. Растворители краски выделяют токсичные пары, поэтому с ними необходимо работать в перчатках, защитных очках и респираторе. При работе с растворителями необходимо знать, с каким именно растворителем вы работаете, и соблюдать правила техники безопасности, чтобы избежать опасного воздействия этого растворителя на организм Правила безопасности при работе с растворителямиБольшая часть растворителей — токсична. К ним обычно относятся как к опасным веществам, и утилизируют согласно правилам утилизации опасных отходов. Литература Автор статьи: Kateryna Yuri Вас могут заинтересовать и другие конвертеры из группы «Гидравлика и гидромеханика — жидкости»:Конвертер объёмного расхода Конвертер массового расхода Конвертер молярного расхода Конвертер плотности потока массы Конвертер молярной концентрации Конвертер динамической (абсолютной) вязкости Конвертер кинематической вязкости Конвертер поверхностного натяжения Конвертер паропроницаемости Конвертер массы Конвертер удельного объема Конвертер объема и единиц измерения в кулинарных рецептах Компактный калькулятор Полный калькулятор Определения единиц Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. |
|
Random converter |
Конвертер массовой концентрации в раствореКонвертер длины и расстоянияКонвертер массыКонвертер мер объема сыпучих продуктов и продуктов питанияКонвертер площадиКонвертер объема и единиц измерения в кулинарных рецептахКонвертер температурыКонвертер давления, механического напряжения, модуля ЮнгаКонвертер энергии и работыКонвертер мощностиКонвертер силыКонвертер времениКонвертер линейной скоростиПлоский уголКонвертер тепловой эффективности и топливной экономичностиКонвертер чисел в различных системах счисления.Конвертер единиц измерения количества информацииКурсы валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияКонвертер ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыИмпульс (количество движения)Импульс силыКонвертер вращающего моментаКонвертер удельной теплоты сгорания (по массе)Конвертер плотности энергии и удельной теплоты сгорания топлива (по объему)Конвертер разности температурКонвертер коэффициента теплового расширенияКонвертер термического сопротивленияКонвертер удельной теплопроводностиКонвертер удельной теплоёмкостиКонвертер энергетической экспозиции и мощности теплового излученияКонвертер плотности теплового потокаКонвертер коэффициента теплоотдачиКонвертер объёмного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер плотности потока массыКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкостиКонвертер кинематической вязкостиКонвертер поверхностного натяженияКонвертер паропроницаемостиКонвертер плотности потока водяного параКонвертер уровня звукаКонвертер чувствительности микрофоновКонвертер уровня звукового давления (SPL)Конвертер уровня звукового давления с возможностью выбора опорного давленияКонвертер яркостиКонвертер силы светаКонвертер освещённостиКонвертер разрешения в компьютерной графикеКонвертер частоты и длины волныОптическая сила в диоптриях и фокусное расстояниеОптическая сила в диоптриях и увеличение линзы (×)Конвертер электрического зарядаКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаКонвертер объемной плотности зарядаКонвертер электрического токаКонвертер линейной плотности токаКонвертер поверхностной плотности токаКонвертер напряжённости электрического поляКонвертер электростатического потенциала и напряженияКонвертер электрического сопротивленияКонвертер удельного электрического сопротивленияКонвертер электрической проводимостиКонвертер удельной электрической проводимостиЭлектрическая емкостьКонвертер индуктивностиКонвертер реактивной мощностиКонвертер Американского калибра проводовУровни в dBm (дБм или дБмВт), dBV (дБВ), ваттах и др. Исходная величина килограмм на литрграмм на литрмиллиграмм на литрчастей на миллионгран на галлон (США)гран на галлон (брит.)фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл Преобразованная величина килограмм на литрграмм на литрмиллиграмм на литрчастей на миллионгран на галлон (США)гран на галлон (брит. Удельное электрическое сопротивлениеЗнаете ли вы, что изолента бывает и жидкой? Подробнее… Общие сведения Бытовые и промышленные чистящие средства Маникюр Краски и растворители Правила безопасности при работе с растворителями Общие сведенияРастворение сахара в воде. 1 — сахар (растворенное вещество), 2 — вода (растворитель), 3 — раствор воды и сахара В повседневной жизни и в промышленности редко используются вещества в чистом виде. Даже вода, если она не дистиллированная, обычно смешана с другими веществами. Чаще всего мы используем растворы, которые являются смесью нескольких веществ одновременно. Не каждую смесь можно назвать раствором, а только ту, в которой смешанные вещества невозможно разделить механическим путем. Также растворы стабильны, то есть все компоненты в них — в одном агрегатном состоянии, например в виде жидкости. РастворыС помощью лазера можно увидеть миллионы субмикроскопических частиц, взвешенных в коллоидной системе, которая образована пурпурными чернилами струйного принтера, растворенными в воде Если смешать два или более вещества, можно получить три типа смеси. Раствор — только один из этих типов. Вещество, растворяемое в растворе называется, растворенным веществом. Компонент раствора, в котором находится растворенное вещество, называется растворителем. Обычно у каждого раствора есть максимальная концентрация растворенного вещества для определенных температуры и давления. Если попробовать растворить в таком растворе большее количество этого вещества, то оно просто не растворится. С изменением давления или температуры максимальная концентрация вещества тоже обычно меняется. Вода — универсальный растворитель Бытовые и промышленные чистящие средстваЧистка — химический процесс, во время которого чистящее средство растворяет пятна и грязь. Часто во время чистки грязь и чистящее средство образуют раствор. Чистящее средство выполняет роль растворителя, а грязь становится растворяемым веществом. Существуют и другие виды чистящих средств. Эмульгаторы снимают пятна, a биологические очистители из ферментов перерабатывают пятно, как бы съедая его. До развития химической промышленности, для чистки одежды, ткани и шерстяных изделий, а также для приготовления шерсти к дальнейшей обработке и валянию, использовали соли аммония, растворенные в воде. Обычно аммиак добывали из мочи животных и людей, и в Древнем Риме она была настолько востребована, что на ее продажу существовал налог. В Древнем Риме в процессе обработки шерсти ее обычно погружали в ферментированную мочу, и топтали ногами. Так как это достаточно неприятная работа, выполняли ее обычно рабы. Кроме мочи или вместе с ней использовали глины, которые хорошо впитывают жиры и другие биоматериалы, известные как отбеливающие глины. Позже такие глины использовали сами по себе, и они иногда используются и до сих пор. В процессе химической чистки используют растворители, не содержащие воды Вещества, которые используют для чистки в домашних условиях, также нередко содержит аммиак. В химической чистке одежды вместо него используют растворители, которые растворяют жир и другие вещества, приставшие к материалу. Почти весь растворитель, используемый во время чистки, восстанавливают после сушки, дистиллируют и используют повторно. Один из самых распространенных растворителей — тетрахлорэтилен. По сравнению с другими чистящими средствами, он дешев, но его считают недостаточно безопасным. В ряде стран тетрахлорэтилен постепенно вытесняется более безопасными веществами, например жидкийм CO₂, углеводородными растворителями, кремнийорганическими жидкостями и другими. МаникюрРазбавитель лака обычно состоит из растворителей, таких как эфиры, сложноэфирные соединения, кетоны и ароматические углеводородные соединения В состав лака для ногтей входят красители и пигменты, а также стабилизирующие вещества, которые защищают лак от выгорания на солнце. Кроме этого в него входят полимеры, которые делают лак более густым и не дают блесткам опуститься на дно, а также помогают лаку лучше держаться на ногтях. В некоторых странах лак для ногтей классифицируют как опасное вещество, так как он токсичен. Жидкость для снятия лака — тоже растворитель, который снимает лак для ногтей по тому же принципу, что и другие растворители. То есть, он образует с лаком раствор, превращая его из твердого состояния в жидкость. Существует несколько видов жидкостей для снятия лака: более сильные из них содержат в составе ацетон, а слабые растворители — без ацетона. Ацетон лучше и быстрее растворяет лак, но он больше сушит кожу и портит ногти, чем растворители без ацетона. Краски и растворителиРастворители краски похожи на жидкости для снятия лака. Они уменьшают концентрацию масляных красок. Примеры растворителей красок: уайт-спирит, ацетон, скипидар и метилэтилкетон. Эти вещества удаляют краску, например, с кистей во время чистки, или с испачканных во время покраски поверхностей. Также с их помощью разбавляют краску, например для того, чтобы залить ее в распылитель. Растворители краски выделяют токсичные пары, поэтому с ними необходимо работать в перчатках, защитных очках и респираторе. При работе с растворителями необходимо знать, с каким именно растворителем вы работаете, и соблюдать правила техники безопасности, чтобы избежать опасного воздействия этого растворителя на организм Правила безопасности при работе с растворителямиБольшая часть растворителей — токсична. К ним обычно относятся как к опасным веществам, и утилизируют согласно правилам утилизации опасных отходов. Литература Автор статьи: Kateryna Yuri Вас могут заинтересовать и другие конвертеры из группы «Гидравлика и гидромеханика — жидкости»:Конвертер объёмного расхода Конвертер массового расхода Конвертер молярного расхода Конвертер плотности потока массы Конвертер молярной концентрации Конвертер динамической (абсолютной) вязкости Конвертер кинематической вязкости Конвертер поверхностного натяжения Конвертер паропроницаемости Конвертер массы Конвертер удельного объема Конвертер объема и единиц измерения в кулинарных рецептах Компактный калькулятор Полный калькулятор Определения единиц Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. |
3.2.2. Трудовая функция \ КонсультантПлюс
3.2.2. Трудовая функция
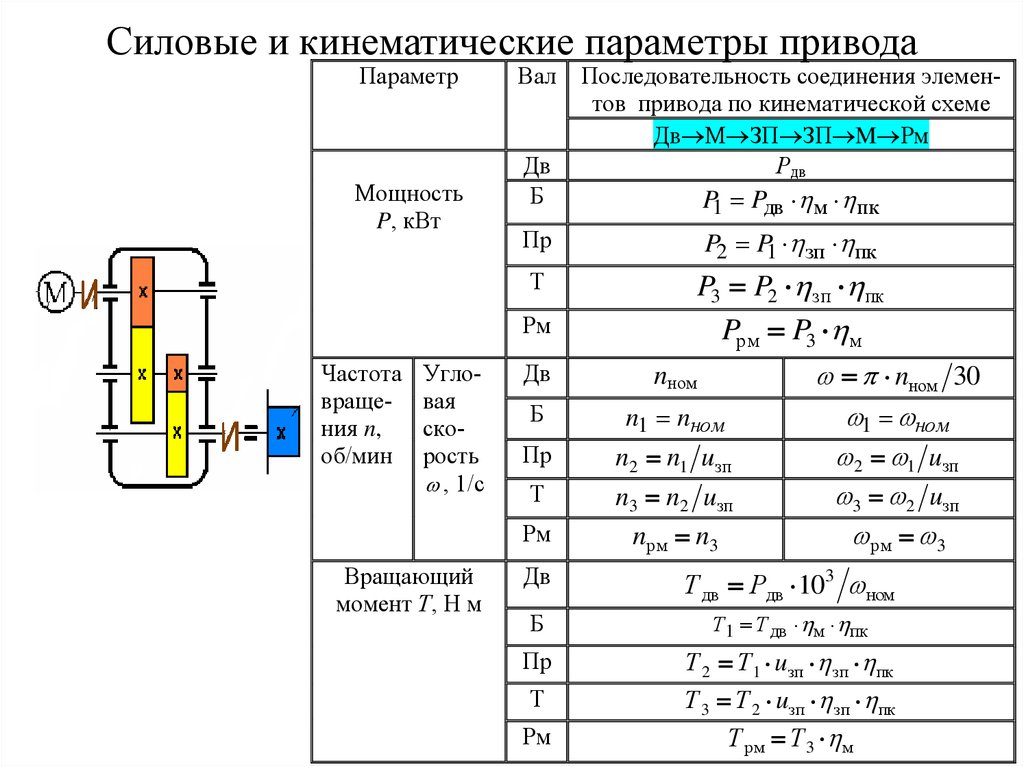
Наименование | Управление процессом конвертирования | Код | B/02.4 | Уровень (подуровень) квалификации | 4 |
Происхождение трудовой функции | Оригинал | X | Заимствовано из оригинала | ||
Код оригинала | Регистрационный номер профессионального стандарта |
Трудовые действия | Руководство заливкой штейна, загрузкой кварцевого флюса, холодных присадок и оборотов в конвертер |
Управление механизмами поворота конвертера, кислородными фурмами, установками для разогрева конвертера, для скачивания, слива шлака, подачи воздуха (кислорода), шлаковыми и металловывозными тележками | |
Регулирование по показаниям контрольно-измерительных приборов времени и интенсивности подачи воздуха, кислорода и воды в процессе продувки и разливки | |
Контроль параметров процесса конвертирования — давления, расхода конвертерного воздуха, температуры, концентрации двуокиси серы в отходящих газах, разрежения в пылевой камере | |
Контроль состояния фурм во время дутья | |
Наблюдение за кожухом конвертера, состоянием горловины кожуха и неподвижной части напыльника, своевременная их очистка от настылей | |
Отбор проб черновой меди, белого мата, файнштейна для анализа | |
Определение готовности файнштейна, черновой меди к выпуску | |
Выпуск готового металла из конвертера в ковши | |
Учет количества перерабатываемого штейна, холодных материалов и количества сливаемого из конвертеров шлака | |
Поддержание исправного состояния футеровки конвертера, системы охлаждения, подачи воздуха (кислорода), газоотведения и пылеулавливания, механизмов наклона конвертера | |
Контроль качества огнеупорной кладки во время ремонтов конвертера | |
Координация работы мостовых кранов при загрузке конвертера расплавом штейнов, сливе (откачке) шлака, выпуске рафинированного металла | |
Контроль соблюдения правил безопасности при эксплуатации оборудования и технологической тары | |
Ведение агрегатного журнала и учетной документации рабочего места конвертерщика | |
Необходимые умения | Корректировать параметры процесса плавки — давление, расход конвертерного воздуха, температуру и концентрацию двуокиси серы в отходящих газах, разрежение в пылевой камере |
Управлять углами наклона конвертера при заливке штейна, загрузке флюсовых материалов и металлолома, выпуске металла и шлака из конвертера | |
Визуально и с использованием приборов контролировать ход конвертирования, режимы продувки, определять стадии и время окончания технологического процесса, готовность металла к выпуску, готовность шлака к сливу из конвертера | |
Замерять и корректировать температуру металла в конвертере | |
Регулировать ход слива и отсечки шлака во время выпуска плавки | |
Предупреждать и устранять возникающие нештатные ситуации при загрузке конвертера, конвертировании, выпуске металла и сливе шлака | |
Выполнять горячий ремонт футеровки, производить смену и набивку фурм, прочистку канала вручную и пневмоинструментом | |
Пользоваться условными знаками и радиосвязью для подачи команд машинисту крана | |
Применять средства индивидуальной и коллективной защиты, газозащитную аппаратуру, средства пожаротушения и пользоваться аварийным инструментом в аварийных ситуациях | |
Пользоваться программным обеспечением рабочего места конвертерщика | |
Необходимые знания | Производственно-технологические инструкции процесса конвертирования |
Правила пуска и остановки конвертера | |
Технологические инструкции ведения процесса конвертирования меди, никеля | |
Физико-химические свойства, состав жидкого штейна, файнштена, черновой меди, флюсовых, холодных присадочных материалов и оборотов, технического воздуха (кислорода) и отходящих газов | |
Виды, назначение и свойства огнеупорных материалов | |
Режимные карты процесса | |
Перечень и методы определения возможных отклонений технологического процесса конвертирования от заданных параметров | |
Способы и порядок корректирующих действий по устранению отклонений параметров конвертирования от нормального хода | |
Порядок и правила загрузки в конвертер холодных присадок, флюса и заливки расплава | |
Способы выявления и устранения неисправностей в работе основного и вспомогательного оборудования конвертера | |
Устройство и правила обслуживания систем подачи кислорода и воды в фурмы конвертера | |
Требования, предъявляемые к качеству загружаемых в конвертер материалов и получаемых после продувки металлов | |
Способы перемещения расплавленного металла | |
Технологические приемы экономии энергоносителей и материалов на плавку | |
Технические требования, предъявляемые к тележке и экрану отбора проб для защиты от теплового излучения расплавленного металла и шлака | |
Устройство, принцип работы и правила технической эксплуатации термопар | |
Правила строповки и транспортировки ковшей, коробов подъемно-транспортными сооружениями | |
Порядок действий и способы устранения нештатных технологических ситуаций — при хлопках в конвертере во время заливки штейна, покраснении или прогаре корпуса конвертера, течи металла из ковша при выпуске готового металла, прогаре шлаковой чаши на стенде или на кране, при расклинивании корпуса конвертера и кессона шлакометаллическим настылем | |
План мероприятий по локализации и ликвидации последствий аварий в конвертерном цехе | |
Требования бирочной системы и нарядов-допусков при работе в конвертерном цехе | |
Требования охраны труда, промышленной, экологической и пожарной безопасности в конвертерном цехе | |
Программное обеспечение процесса рабочего места конвертерщика | |
Другие характеристики | — |
Пролактин (ПРЛ) перевести в мкМЕ/мл, мМЕ/л, нг/мл, мкг/л, нг/дл, нг/100мл, нг%.
 Онлайн калькулятор / конвертер традиционных единиц в единицы СИ
Онлайн калькулятор / конвертер традиционных единиц в единицы СИWe stand with Ukraine. 🇺🇦
You Can Help
Синоним
Лактотропный гормон, маммотропин, лютеотропный гормон, физолактин
Единицы измерения
мкМЕ/мл, мМЕ/л, нг/мл, мкг/л, нг/дл, нг/100мл, нг%
Пролактин человека (ПРЛ) — это полипептидный гормон передней доли гипофиза с молекулярной массой приблизительно 22 800. Секреция пролактина контролируется гипоталамусом, в основном, через высвобождение пролактин-ингибирующего фактора (дофамина) и пролактин-рилизинг фактора (серотонина). Тиреотропин-рилизинг-фактор (ТРФ) стимулирует секрецию ПРЛ и используется при провокационном тесте для оценки резервов ПРЛ и нарушения секреции ПРЛ гипофизом.
Пролактин присутствует в сыворотке в трех различных формах. Преобладает иммунологически активная мономерная («малая») форма (приблиз. 80 %), 5-20 % находится в биологически неактивной димерной (“большой”) форме и 0.5-5 % находится в тетрамерной (“большой-большой”) форме, которая обладает низкой биологической активностью.
80 %), 5-20 % находится в биологически неактивной димерной (“большой”) форме и 0.5-5 % находится в тетрамерной (“большой-большой”) форме, которая обладает низкой биологической активностью.
Органом-мишенью для пролактина служит молочная железа, развитие и дифференцирование которой обеспечивается этим гормоном. Высокие концентрации пролактина оказывают ингибирующее действие на стероидогенез яичников и на продукцию и секрецию гипофизарного гонадотропина.
Согласно публикациям, референтным диапазоном для циркулирующего пролактина в норме являются концентрации приблизительно до 20 нг/мл. Концентрации гормона у новорожденных значительно выше, но в течение трех месяцев снижаются до взрослого уровня.
По сравнению с мужчинами у женщин содержание пролактина несколько выше, уровень гормона немного поднимается в период полового созревания (в связи с влиянием эстрогенов) и соответствующим образом падает в период менопаузы. Во время беременности уровень пролактина стабильно увеличивается в 10 или 20 раз, а после родов снижается до нормального — за три недели у некормящих матерей. У кормящих грудью снижение до нормального уровня происходит более постепенно из-за быстрых и мощных выбросов пролактина на фоне кормления. У женщин, принимающих оральные контрацептивы или получающих заместительную гормонотерапию, уровни пролактина могут быть выше нормы.
У кормящих грудью снижение до нормального уровня происходит более постепенно из-за быстрых и мощных выбросов пролактина на фоне кормления. У женщин, принимающих оральные контрацептивы или получающих заместительную гормонотерапию, уровни пролактина могут быть выше нормы.
При оценке значимости умеренных повышений важно понимать, что пролактин является гормоном стресса. Причиной кратковременного подъема уровня гормона могут стать не только хирургическое вмешательство, но даже такие незначительные стрессовые ситуации, как венепункция или клиническое обследование.
Период биологической полужизни ПРЛ приблизительно 20–50 минут. Концентрации ПРЛ в сыворотке изменяются в течение менструального цикла и обычно незначительно повышаются в середине цикла. Концентрации пролактина у здоровых субъектов имеют тенденцию к повышению в ответ на физиологические стимулы, такие как сон, упражнения, стимуляция сосков, половое сношение, гипогликемия, беременность и хирургический стресс. Кроме того, выбросу пролактина свойственен эпизодический характер, с колебанием день ото дня до 30 %. Наконец, имеются связанные со сном суточные изменения: уровни пролактина увеличиваются во время сна и достигают минимума через несколько часов после пробуждения. Рекомендации брать пробы в период с 9:00 до 12:00 основаны на том, что испытуемые соблюдают относительно нормальный режим сна.
Наконец, имеются связанные со сном суточные изменения: уровни пролактина увеличиваются во время сна и достигают минимума через несколько часов после пробуждения. Рекомендации брать пробы в период с 9:00 до 12:00 основаны на том, что испытуемые соблюдают относительно нормальный режим сна.
Недостаточность пролактина у здоровых субъектов отмечается редко.
Гиперпролактинемия (у мужчин и женщин) является основной причиной нарушений, связанных с фертильностью. Определение уровня пролактина используется в диагностике ановуляторных циклов, гиперпролактинемичной аменореи и галактореи (избыточной лактации), гинекомастии и азооспермии.
К патологическим состояниям, вызывающим гиперпролактинемию, относятся: секретирующие ПРЛ аденомы гипофиза (пролактиномы), функциональные и органические заболевания гипоталамуса, гипотиреоидизм, почечная недостаточность и эктопические опухоли.
При первичном гипотиреоидизме повышение концентраций ПРЛ может отмечаться вследствие повышения секреции ТРФ (стимулирует выделение ПРЛ), сопровождающегося снижением концентраций T4 в сыворотке и повышением сывороточных концентраций тиреотропного гормона.
Гиперпролактинемия также связана с угнетением синтеза стероидов в яичниках, созреванием фолликула, а также секрецией лютеинизирующего гормона и фолликулостимулирующего гормона.
Показано, что некоторые препараты или повышают, или понижают концентрации ПРЛ. Прием L-dopa угнетает секрецию ПРЛ. Бромкриптин угнетает секрецию ПРЛ и используется при лечении аменорреи и галакторреи, вызванных гиперпролактинемией. Прием психотропных препаратов (фенотиазинов), антигипертензивных препаратов (резерпин), а также ТРФ могут привести к повышению секреции ПРЛ. Лечение эстрогенами также может вызвать повышение концентраций ПРЛ в сыворотке.
РЕФЕРЕНТНЫЕ ИНТЕРВАЛЫ
Метод: Электрохемилюминесцентный иммунотест ECLIA
Мужчины | 86-324 мкМЕ/мл | 4.04-15.2 нг/мл |
Женщины (не беременные) | 102-496 мкМЕ/мл | 4.79-23.3 нг/мл |
Пролактин (ПРЛ) — перевод, преобразование, перерасчет единиц измерения из общепринятых или традиционных единиц в единицы СИ и наоборот мкМЕ/мл, мМЕ/л, нг/мл, мкг/л, нг/дл, нг/100мл, нг%.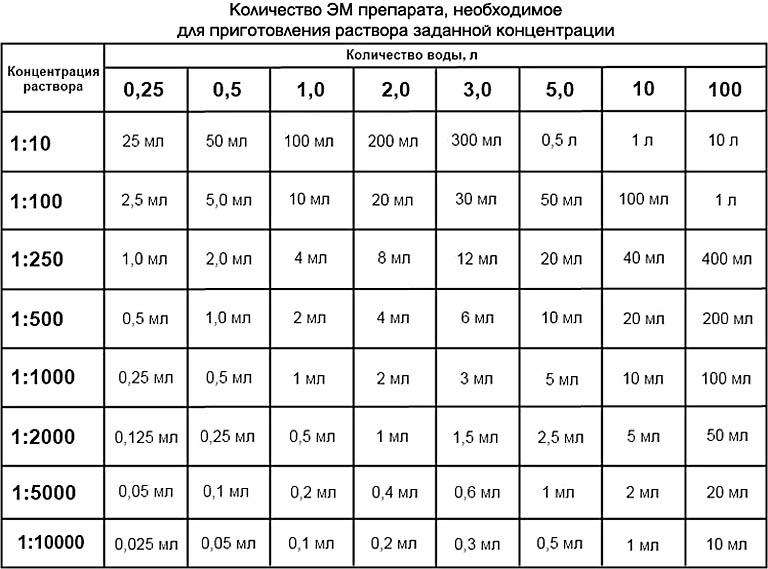 Лабораторный онлайн калькулятор. Перевод количественных значений результатов лабораторных анализов из одних единиц измерения в другие. Таблица с коэффициентами пересчета результатов исследования.
Лабораторный онлайн калькулятор. Перевод количественных значений результатов лабораторных анализов из одних единиц измерения в другие. Таблица с коэффициентами пересчета результатов исследования.
Клиническая химия Гормоны и специфические маркеры
Преобразователь случайных чисел | Преобразователь молярной концентрации Конвертер длины и расстоянияПреобразователь массыСухой объем и общие измерения для приготовления пищиКонвертер площадиКонвертер объема и общего измерения для приготовления пищиПреобразователь температурыПреобразователь давления, напряжения, модуля ЮнгаПреобразователь энергии и работыПреобразователь мощностиПреобразователь силыПреобразователь силыПреобразователь времениПреобразователь линейной скорости и скоростиПреобразователь углаПреобразователь эффективности использования топлива, расхода топлива и экономии топливаПреобразователь чиселКонвертер единиц информации и Хранение данныхКурсы обмена валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияПреобразователь ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыКонвертер импульсаИмпульс крутящего моментаКонвертер удельной энергии, теплоты сгорания (в расчете на массу)Конвертер удельной энергии, теплоты сгорания (в объеме) Конвертер температуры Конвертер интервала Конвертер коэффициента теплового расширенияКонвертер теплового сопротивленияТеплопровод Конвертер удельной теплоемкостиПлотность теплоты, плотность пожарной нагрузкиКонвертер плотности теплового потокаКонвертер коэффициента теплопередачиКонвертер объемного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер массового потокаКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкости Конвертер кинематической вязкости Конвертер поверхностного натяженияМодерация проницаемости, проницаемости, паропроницаемости Преобразователь скорости пропускания паровПреобразователь уровня звукаПреобразователь чувствительности микрофонаПреобразователь уровня звукового давления (SPL)Преобразователь уровня звукового давления с выбираемым эталонным давлениемПреобразователь яркостиПреобразователь силы светаПреобразователь освещенностиПреобразователь разрешения цифрового изображенияПреобразователь частоты и длины волныПреобразователь оптической силы (диоптрий) в фокусное расстояниеПреобразователь оптической силы (диоптрий) в увеличение (X)Электрический заряд КонвертерКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаОбъемный заряд De Преобразователь электрического токаПреобразователь линейной плотности токаПреобразователь поверхностной плотности токаПреобразователь напряженности электрического поляПреобразователь электрического потенциала и напряженияПреобразователь электрического сопротивленияПреобразователь удельного электрического сопротивленияПреобразователь электрической проводимостиПреобразователь электропроводностиПреобразователь емкостиПреобразователь емкостиПреобразователь индуктивностиПреобразователь реактивной мощности переменного токаПреобразователь калибров проводов в СШАПреобразование уровней в дБм, дБВ, Ватт и других единицахПреобразователь силы магнитного поля КонвертерПлотность магнитного потокаМощность поглощенной дозы излучения, Мощность общей дозы ионизирующего излучения КонвертерРадиоактивность. From: mole/meter³mole/litermole/centimeter³mole/millimeter³kilomole/meter³kilomole/literkilomole/centimeter³kilomole/millimeter³millimole/meter³millimole/litermillimole/centimeter³millimole/millimeter³mole/decimeter³molarmillimolarmicromolarnanomolarpicomolarfemtomolarattomolarzeptomolaryoctomolar To: mole/meter³mole/litermole/centimeter³mole/ миллиметр³киломоль/метр³киломоль/литркиломоль/сантиметр³киломоль/миллиметр³миллимоль/метр³миллимоль/литрмиллимоль/сантиметр³миллимоль/миллиметр³моль/дециметр³мольмиллимолярныймикромолярнаномольпикомолярфемтомоляраттомолярзептомоляриоктомолярный Сделай сам — Как определить оптическую силу новых очков без посещения врачаДа, ты можешь сделать это сам! Как? Прочитайте статью… Обзор Изменения в молярной концентрации единиц Нахождение молярной концентрации Примеры используют в фармации Обзор Один из углерод — это количество, которое имеет то же самое, которое имеет то же самое. Концентрацию раствора можно измерить различными способами, например, путем измерения отношения массы растворенного вещества к общему объему раствора. Здесь мы рассматриваем молярную концентрацию , которая измеряется как отношение количества вещества в молях к общему объему раствора. Веществом в нашем случае является растворенное вещество, а объем измеряется для всего раствора, даже если в нем есть другие растворенные вещества. Здесь количество вещества измеряется как количество элементарных объектов (например, атомов или молекул) вещества. Поскольку даже в небольшом объеме вещества существует огромное количество элементарных объектов, мы используем специальные единицы, называемые молями, для количества вещества. Один моль определяется как количество атомов в 12 граммах углерода-12, что составляет примерно 6×10²³ атомов. Моли очень удобно использовать для веществ, находящихся в достаточно малых количествах, которые можно легко измерить с помощью бытовых или промышленных измерительных приборов. Мы должны быть осторожны, чтобы не спутать молярность с другим родственным свойством, моляльностью . В отличие от молярности, моляльность – это отношение количества вещества растворенного вещества к массе растворителя, а не к массе всего раствора. В некоторых случаях значения молярности и моляльности раствора очень близки. Это в том случае, если наш растворитель — вода, и если количество растворенного вещества достаточно мало, чтобы его масса и объем были незначительными — но это не всегда так. Масса одного моля различных веществ. Его можно найти с помощью периодической таблицы. Изменения молярной концентрацииМолярная концентрация может зависеть от температуры, хотя это зависит от веществ, присутствующих в этом растворе. Температура может вызвать расширение некоторых растворителей, и если растворенное вещество не расширяется вместе с растворителем, молярная концентрация уменьшается. Также возможно, что растворитель испарится, а количество растворенного вещества останется прежним при повышении температуры. В этом случае концентрация раствора увеличится. В некоторых случаях происходит обратное. Иногда повышение или понижение температуры изменяет растворимость. В результате растворитель полностью или частично перестает растворяться в растворе, а концентрация снижается. Единицы Молярная концентрация измеряется в молях на единицу объема, например, в молях на литр или в молях на кубический метр. Последняя является единицей СИ. Его также можно измерить в молях на другую единицу объема. Определение молярной концентрацииЧтобы найти молярную концентрацию, нам нужно знать количество вещества и общий объем раствора. Для определения количества вещества мы могли бы использовать молекулярную формулу этого вещества и информацию о массе этого вещества, присутствующего в растворе. В частности, чтобы найти, сколько молей раствора у нас есть, мы можем найти атомную массу каждого атома, присутствующего в молекуле, в таблице Менделеева, а затем разделить общую массу вещества на общий атомный вес атомов в периодической таблице. молекула. Мы должны убедиться, что перед сложением атомных масс мы умножаем каждую из атомных масс для конкретного атома на число атомов этого типа, присутствующих в молекуле. Возможно и обратное. Если мы знаем молярную концентрацию нашего раствора и формулу растворенного вещества, то мы можем определить количество растворителя, присутствующего в растворе, как в молях, так и в граммах. Для этого нам нужно будет проверить периодическую таблицу атомных весов, как описано ранее. ПримерыРассчитаем молярность раствора, содержащего 3 столовые ложки пищевой соды, смешанные с 20 литрами воды. 1 столовая ложка составляет около 17 граммов, поэтому 3 столовые ложки составляют 51 грамм. Пищевая сода также известна как бикарбонат натрия, а ее химическая формула — NaHCO₃. В этом примере мы будем работать с атомами, поэтому давайте найдем атомные массы натрия (Na), водорода (H), углерода (C) и кислорода (O). Na: 22,989769 Молярная концентрация 1 кубика сахара в одной чашке чая составляет 0,049 моль/л. У нас в формуле есть O₃, поэтому нам нужно умножить атомную массу кислорода на 3, получив 47,9982. Теперь добавим эти атомные массы. Мы получим 84.006609. Атомные массы в периодической таблице обычно указываются в атомных единицах массы. Это относится и к нашим данным. Эта атомная масса в атомных единицах массы соответствует массе 1 моля элемента в граммах. Это означает, что масса 1 моля NaHCO₃ равна 84,006609. Это означает, что мы разбавили 0,6 моля пищевой соды в 20 литрах воды. Разделим это количество пищевой соды на 20 литров, чтобы получить молярную концентрацию: 0,6 моль/20 л = 0,03 моль/л. Мы получили низкую концентрацию, потому что использовали такое небольшое количество соды и разводили ее в большом объеме воды. Давайте попробуем другой пример и найдем молярную концентрацию 1 кубика сахара в одной чашке чая. Столовый сахар состоит из сахарозы. Сначала найдем вес одного моля сахарозы, формула которой C₁₂H₂₂O₁₁. Используя периодическую таблицу, находим, что масса одного моля равна 12×12 + 22×1 + 11×16 = 342 грамма. 1 куб сахара равен 4 граммам, что составляет 4/342 = 0,01 моля. 1 чашка — это 237 миллилитров, поэтому 1 кубик сахара, смешанный с одной чашкой чая, дает 0,01 моля / 237 миллилитров × 1000 (для перевода в литры) = 0,049.
ИспользованиеСтехиометрия помогает определить количество веществ, которые реагируют друг с другом, а также количества веществ, которые образуются в результате этой реакции. Молярная концентрация удобна в использовании. Если температура и давление одинаковы для всех газов, то один моль каждого газа занимает один и тот же объем, и мы можем использовать это свойство для различных расчетов. Для удобства при работе с химическими реакциями часто используется молярная концентрация. Раздел химии, изучающий определение количества исходных веществ и продуктов химических реакций, стехиометрия часто имеет дело с молярной концентрацией. Мы можем найти молярную концентрацию, используя химическую формулу конечного компонента, который становится растворенным, как мы сделали для пищевой соды, но мы также можем использовать химические уравнения, чтобы найти ее. Нам нужно будет знать формулы и количества веществ (реагентов), которые используются в нашей химической реакции для создания растворенного вещества в качестве конечного продукта. Когда мы начинаем с нескольких веществ, которые реагируют друг с другом, мы можем найти формулу конечного продукта, уравновешивая уравнение химической реакции между веществами. Если мы смешаем продукт этой реакции с раствором, мы сможем найти молярную концентрацию, как описано в предыдущих примерах. Давайте рассмотрим простой пример. Мы снова будем использовать пищевую соду и смешать ее с уксусом для интересной химической реакции. Вы можете легко найти эти вещества, возможно, они уже есть в вашей кладовой. Как мы упоминали ранее, формула пищевой соды — NaHCO₃. Уксус не является чистым соединением, это 5% смесь уксусной кислоты с водой. Химическая формула уксусной кислоты CH₃COOH. Запишем и составим уравнение реакции пищевой соды с уксусной кислотой: NaHCO₃ + CH3COOH → NaC₂H3O₂ + H₂CO₃ Один из продуктов этой реакции, H₂CO₃, нестабилен и вступит в другую реакцию: H₂CO₃ → H₂O + CO₂ Итак, в итоге у нас есть вода (H₂O), углекислый газ (CO₂) и ацетат натрия (NaC₂H₃O₂). Затем мы можем смешать ацетат натрия с водой и приступить к расчету молярной концентрации, как мы сделали в предыдущем примере для пищевой соды. Мы должны быть осторожны при расчете объема воды, чтобы учесть воду, с которой смешивали уксусную кислоту, чтобы сделать уксус, и воду, которая была продуктом химической реакции. Ацетат натрия — интересное химическое соединение — его используют в грелках и грелках для рук. Когда мы используем стехиометрию для определения либо количества реагентов, либо количества конечного продукта, используемого позже в расчетах молярной концентрации, мы заметим, что только ограниченное количество одного реагента будет реагировать с другими реагентами. Это повлияет на выход нашего конечного продукта. Поскольку молярная концентрация может помочь нам выполнить расчеты «обратного инжиниринга», чтобы выяснить, с какого количества реагентов мы должны начать, это полезная концепция для практических приложений при работе с химическими реакциями. Всякий раз, когда мы используем рецепт, будь то приготовление пищи, изготовление лекарств или даже создание условий для аквариумных рыбок, нам важна концентрация. В то время как в повседневной жизни мы можем предпочесть работать с граммами, в химии или фармации часто используется молярная концентрация. При изготовлении лекарств, контактирующих с мембранами организма, таких как глазные лекарства, фармацевты должны привести осмотическую концентрацию лекарства в соответствие с осмотической концентрацией телесных жидкостей по другую сторону мембраны. В аптеке Молярная концентрация важна при смешивании соединений для создания лекарства, поскольку она влияет на то, как это лекарство действует на организм. Некоторые лекарства ядовиты, если их концентрация слишком высока, а многие не так эффективны, когда концентрация слишком мала. Кроме того, важна концентрация в обмене жидкости между оболочками организма. Здесь мы можем рассмотреть молярную концентрацию или рассчитать значение осмотической концентрации , используя молярную концентрацию. В этом контексте чаще используется осмотическая концентрация. Если вещество на одной стороне мембраны, например лекарство, имеет более высокую концентрацию, чем на другой стороне мембраны, например внутри глаза, то более концентрированный раствор будет поступать в область с меньшей концентрацией. Этот поток может создать проблемы. Например, если есть поток жидкости в клетку, такую как клетка крови, то клетка может достичь своей емкости для жидкости и разрушиться. Пациент получает лекарство из капельницы на шесте. Примечание по переводу молярности в осмотическую концентрацию: в некоторых случаях эти значения совпадают, но не всегда. Это будет зависеть от того, разделились ли растворенные в растворе вещества на ионы в процессе, называемом диссоциацией . Это связано с тем, что осмотическая концентрация рассматривает частицы в целом, а молярность рассматривает только определенный тип частиц, например, молекулы. Так, например, если мы рассматриваем молекулы для молярной концентрации, но наше вещество разделилось на ионы, то у нас было бы меньше молекул, чем общее количество частиц. В результате молярная концентрация будет ниже. Мы должны быть осторожны и знать физические свойства раствора, чтобы иметь возможность преобразовать молярную концентрацию в осмотическую концентрацию. Фармацевты также должны учитывать тоничность раствора. Тоничность является родственным свойством, зависящим от концентрации. В отличие от осмотической концентрации тоничность указывает на концентрацию веществ в растворе, которая не может пройти через мембрану в рассматриваемом организме. Эти вещества оказывают давление на мембрану из-за осмоса и их неспособности преодолевать барьер. Когда лекарство предназначено для попадания в кровоток или любую другую жидкость организма, фармацевты уравновешивают тоничность, чтобы гарантировать, что это лекарство не вызывает осмотического давления. Для обеспечения правильного тонуса лекарство часто разводят в солевом растворе . Это раствор поваренной соли (NaCl) в воде, приготовленный в концентрации, обеспечивающей правильный тонус, соответствующий внутренней жидкости организма при смешивании с лекарством. Обычно он находится в стерильном контейнере при внутривенном введении или смешивается непосредственно с лекарством. Справочная информация Автор статьи: Kateryna Yuri Вас могут заинтересовать другие преобразователи из группы Гидравлика — Жидкости:Тормотрический преобразователь расхода расхода Передача массовой скорости расхода Молярная концентрация расхода расхода Mass Flux Converter Массовая концентрация в преобразователе раствора Динамический (абсолютный) конвертер видкативности Kinematic Converter Converter 4Kinemacatic Compretter 440007 KinemacaticConfertertter 440007 KinemacaticConfertertter 40007 KINEMATIC.Конвертер единиц проницаемости, проницаемости, паропроницаемости Конвертер массы Конвертер единиц удельного объема Конвертер единиц измерения объема и общей кулинарной обработки Компактный калькулятор Полный калькулятор Определения единиц измерения У вас есть трудности с переводом единицы измерения на другой язык? Помощь доступна! Разместите свой вопрос в TCTerms и вы получите ответ от опытных технических переводчиков в считанные минуты. |
Преобразователь случайных чисел | Преобразователь молярной концентрации Конвертер длины и расстоянияПреобразователь массыСухой объем и общие измерения для приготовления пищиКонвертер площадиКонвертер объема и общего измерения для приготовления пищиПреобразователь температурыПреобразователь давления, напряжения, модуля ЮнгаПреобразователь энергии и работыПреобразователь мощностиПреобразователь силыПреобразователь силыПреобразователь времениПреобразователь линейной скорости и скоростиПреобразователь углаПреобразователь эффективности использования топлива, расхода топлива и экономии топливаПреобразователь чиселКонвертер единиц информации и Хранение данныхКурсы обмена валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияПреобразователь ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыКонвертер импульсаИмпульс крутящего моментаКонвертер удельной энергии, теплоты сгорания (в расчете на массу)Конвертер удельной энергии, теплоты сгорания (в объеме) Конвертер температуры Конвертер интервала Конвертер коэффициента теплового расширенияКонвертер теплового сопротивленияТеплопровод Конвертер удельной теплоемкостиПлотность теплоты, плотность пожарной нагрузкиКонвертер плотности теплового потокаКонвертер коэффициента теплопередачиКонвертер объемного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер массового потокаКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкости Конвертер кинематической вязкости Конвертер поверхностного натяженияМодерация проницаемости, проницаемости, паропроницаемости Преобразователь скорости пропускания паровПреобразователь уровня звукаПреобразователь чувствительности микрофонаПреобразователь уровня звукового давления (SPL)Преобразователь уровня звукового давления с выбираемым эталонным давлениемПреобразователь яркостиПреобразователь силы светаПреобразователь освещенностиПреобразователь разрешения цифрового изображенияПреобразователь частоты и длины волныПреобразователь оптической силы (диоптрий) в фокусное расстояниеПреобразователь оптической силы (диоптрий) в увеличение (X)Электрический заряд КонвертерКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаОбъемный заряд De Преобразователь электрического токаПреобразователь линейной плотности токаПреобразователь поверхностной плотности токаПреобразователь напряженности электрического поляПреобразователь электрического потенциала и напряженияПреобразователь электрического сопротивленияПреобразователь удельного электрического сопротивленияПреобразователь электрической проводимостиПреобразователь электропроводностиПреобразователь емкостиПреобразователь емкостиПреобразователь индуктивностиПреобразователь реактивной мощности переменного токаПреобразователь калибров проводов в СШАПреобразование уровней в дБм, дБВ, Ватт и других единицахПреобразователь силы магнитного поля КонвертерПлотность магнитного потокаМощность поглощенной дозы излучения, Мощность общей дозы ионизирующего излучения КонвертерРадиоактивность. From: mole/meter³mole/litermole/centimeter³mole/millimeter³kilomole/meter³kilomole/literkilomole/centimeter³kilomole/millimeter³millimole/meter³millimole/litermillimole/centimeter³millimole/millimeter³mole/decimeter³molarmillimolarmicromolarnanomolarpicomolarfemtomolarattomolarzeptomolaryoctomolar To: mole/meter³mole/litermole/centimeter³mole/ миллиметр³киломоль/метр³киломоль/литркиломоль/сантиметр³киломоль/миллиметр³миллимоль/метр³миллимоль/литрмиллимоль/сантиметр³миллимоль/миллиметр³моль/дециметр³мольмиллимолярныймикромолярнаномольпикомолярфемтомоляраттомолярзептомоляриоктомолярный Плотность токаЗнаете ли вы, что закон Мура выдыхается и, возможно, пришло время для второй редакции этого закона? Обзор Изменения в молярной концентрации единиц Обнаружение молярной концентрации Примеры Используются в аптеке Обзор Одна моль из углерода — это количество вещества, которое имеет одинаковое число атомов, как и атмосы, как и то же количество атмосов, как и атмосы, как и то же количество атмосов, как и атмосы, как и то же количество атмосов, как и атмосы, как и одно и то же количество ат -ат. Концентрацию раствора можно измерить различными способами, например, путем измерения отношения массы растворенного вещества к общему объему раствора. Здесь мы рассматриваем молярную концентрацию , которая измеряется как отношение количества вещества в молях к общему объему раствора. Веществом в нашем случае является растворенное вещество, а объем измеряется для всего раствора, даже если в нем есть другие растворенные вещества. Здесь количество вещества измеряется как количество элементарных объектов (например, атомов или молекул) вещества. Поскольку даже в небольшом объеме вещества существует огромное количество элементарных объектов, мы используем специальные единицы, называемые молями, для количества вещества. Один моль определяется как количество атомов в 12 граммах углерода-12, что составляет примерно 6×10²³ атомов. Моли очень удобно использовать для веществ, находящихся в достаточно малых количествах, которые можно легко измерить с помощью бытовых или промышленных измерительных приборов. Мы должны быть осторожны, чтобы не спутать молярность с другим родственным свойством, моляльностью . В отличие от молярности, моляльность – это отношение количества вещества растворенного вещества к массе растворителя, а не к массе всего раствора. В некоторых случаях значения молярности и моляльности раствора очень близки. Это в том случае, если наш растворитель — вода, и если количество растворенного вещества достаточно мало, чтобы его масса и объем были незначительными — но это не всегда так. Масса одного моля различных веществ. Его можно найти с помощью периодической таблицы. Изменения молярной концентрацииМолярная концентрация может зависеть от температуры, хотя это зависит от веществ, присутствующих в этом растворе. Температура может вызвать расширение некоторых растворителей, и если растворенное вещество не расширяется вместе с растворителем, молярная концентрация уменьшается. Также возможно, что растворитель испарится, а количество растворенного вещества останется прежним при повышении температуры. В этом случае концентрация раствора увеличится. В некоторых случаях происходит обратное. Иногда повышение или понижение температуры изменяет растворимость. В результате растворитель полностью или частично перестает растворяться в растворе, а концентрация снижается. Единицы Молярная концентрация измеряется в молях на единицу объема, например, в молях на литр или в молях на кубический метр. Последняя является единицей СИ. Его также можно измерить в молях на другую единицу объема. Определение молярной концентрацииЧтобы найти молярную концентрацию, нам нужно знать количество вещества и общий объем раствора. Для определения количества вещества мы могли бы использовать молекулярную формулу этого вещества и информацию о массе этого вещества, присутствующего в растворе. В частности, чтобы найти, сколько молей раствора у нас есть, мы можем найти атомную массу каждого атома, присутствующего в молекуле, в таблице Менделеева, а затем разделить общую массу вещества на общий атомный вес атомов в периодической таблице. молекула. Мы должны убедиться, что перед сложением атомных масс мы умножаем каждую из атомных масс для конкретного атома на число атомов этого типа, присутствующих в молекуле. Возможно и обратное. Если мы знаем молярную концентрацию нашего раствора и формулу растворенного вещества, то мы можем определить количество растворителя, присутствующего в растворе, как в молях, так и в граммах. Для этого нам нужно будет проверить периодическую таблицу атомных весов, как описано ранее. ПримерыРассчитаем молярность раствора, содержащего 3 столовые ложки пищевой соды, смешанные с 20 литрами воды. 1 столовая ложка составляет около 17 граммов, поэтому 3 столовые ложки составляют 51 грамм. Пищевая сода также известна как бикарбонат натрия, а ее химическая формула — NaHCO₃. В этом примере мы будем работать с атомами, поэтому давайте найдем атомные массы натрия (Na), водорода (H), углерода (C) и кислорода (O). Na: 22,989769 Молярная концентрация 1 кубика сахара в одной чашке чая составляет 0,049 моль/л. У нас в формуле есть O₃, поэтому нам нужно умножить атомную массу кислорода на 3, получив 47,9982. Теперь добавим эти атомные массы. Мы получим 84.006609. Атомные массы в периодической таблице обычно указываются в атомных единицах массы. Это относится и к нашим данным. Эта атомная масса в атомных единицах массы соответствует массе 1 моля элемента в граммах. Это означает, что масса 1 моля NaHCO₃ равна 84,006609. Это означает, что мы разбавили 0,6 моля пищевой соды в 20 литрах воды. Разделим это количество пищевой соды на 20 литров, чтобы получить молярную концентрацию: 0,6 моль/20 л = 0,03 моль/л. Мы получили низкую концентрацию, потому что использовали такое небольшое количество соды и разводили ее в большом объеме воды. Давайте попробуем другой пример и найдем молярную концентрацию 1 кубика сахара в одной чашке чая. Столовый сахар состоит из сахарозы. Сначала найдем вес одного моля сахарозы, формула которой C₁₂H₂₂O₁₁. Используя периодическую таблицу, находим, что масса одного моля равна 12×12 + 22×1 + 11×16 = 342 грамма. 1 куб сахара равен 4 граммам, что составляет 4/342 = 0,01 моля. 1 чашка — это 237 миллилитров, поэтому 1 кубик сахара, смешанный с одной чашкой чая, дает 0,01 моля / 237 миллилитров × 1000 (для перевода в литры) = 0,049.
ИспользованиеСтехиометрия помогает определить количество веществ, которые реагируют друг с другом, а также количества веществ, которые образуются в результате этой реакции. Молярная концентрация удобна в использовании. Если температура и давление одинаковы для всех газов, то один моль каждого газа занимает один и тот же объем, и мы можем использовать это свойство для различных расчетов. Для удобства при работе с химическими реакциями часто используется молярная концентрация. Раздел химии, изучающий определение количества исходных веществ и продуктов химических реакций, стехиометрия часто имеет дело с молярной концентрацией. Мы можем найти молярную концентрацию, используя химическую формулу конечного компонента, который становится растворенным, как мы сделали для пищевой соды, но мы также можем использовать химические уравнения, чтобы найти ее. Нам нужно будет знать формулы и количества веществ (реагентов), которые используются в нашей химической реакции для создания растворенного вещества в качестве конечного продукта. Когда мы начинаем с нескольких веществ, которые реагируют друг с другом, мы можем найти формулу конечного продукта, уравновешивая уравнение химической реакции между веществами. Если мы смешаем продукт этой реакции с раствором, мы сможем найти молярную концентрацию, как описано в предыдущих примерах. Давайте рассмотрим простой пример. Мы снова будем использовать пищевую соду и смешать ее с уксусом для интересной химической реакции. Вы можете легко найти эти вещества, возможно, они уже есть в вашей кладовой. Как мы упоминали ранее, формула пищевой соды — NaHCO₃. Уксус не является чистым соединением, это 5% смесь уксусной кислоты с водой. Химическая формула уксусной кислоты CH₃COOH. Запишем и составим уравнение реакции пищевой соды с уксусной кислотой: NaHCO₃ + CH3COOH → NaC₂H3O₂ + H₂CO₃ Один из продуктов этой реакции, H₂CO₃, нестабилен и вступит в другую реакцию: H₂CO₃ → H₂O + CO₂ Итак, в итоге у нас есть вода (H₂O), углекислый газ (CO₂) и ацетат натрия (NaC₂H₃O₂). Затем мы можем смешать ацетат натрия с водой и приступить к расчету молярной концентрации, как мы сделали в предыдущем примере для пищевой соды. Мы должны быть осторожны при расчете объема воды, чтобы учесть воду, с которой смешивали уксусную кислоту, чтобы сделать уксус, и воду, которая была продуктом химической реакции. Ацетат натрия — интересное химическое соединение — его используют в грелках и грелках для рук. Когда мы используем стехиометрию для определения либо количества реагентов, либо количества конечного продукта, используемого позже в расчетах молярной концентрации, мы заметим, что только ограниченное количество одного реагента будет реагировать с другими реагентами. Это повлияет на выход нашего конечного продукта. Поскольку молярная концентрация может помочь нам выполнить расчеты «обратного инжиниринга», чтобы выяснить, с какого количества реагентов мы должны начать, это полезная концепция для практических приложений при работе с химическими реакциями. Всякий раз, когда мы используем рецепт, будь то приготовление пищи, изготовление лекарств или даже создание условий для аквариумных рыбок, нам важна концентрация. В то время как в повседневной жизни мы можем предпочесть работать с граммами, в химии или фармации часто используется молярная концентрация. При изготовлении лекарств, контактирующих с мембранами организма, таких как глазные лекарства, фармацевты должны привести осмотическую концентрацию лекарства в соответствие с осмотической концентрацией телесных жидкостей по другую сторону мембраны. В аптеке Молярная концентрация важна при смешивании соединений для создания лекарства, поскольку она влияет на то, как это лекарство действует на организм. Некоторые лекарства ядовиты, если их концентрация слишком высока, а многие не так эффективны, когда концентрация слишком мала. Кроме того, важна концентрация в обмене жидкости между оболочками организма. Здесь мы можем рассмотреть молярную концентрацию или рассчитать значение осмотической концентрации , используя молярную концентрацию. В этом контексте чаще используется осмотическая концентрация. Если вещество на одной стороне мембраны, например лекарство, имеет более высокую концентрацию, чем на другой стороне мембраны, например внутри глаза, то более концентрированный раствор будет поступать в область с меньшей концентрацией. Этот поток может создать проблемы. Например, если есть поток жидкости в клетку, такую как клетка крови, то клетка может достичь своей емкости для жидкости и разрушиться. Пациент получает лекарство из капельницы на шесте. Примечание по переводу молярности в осмотическую концентрацию: в некоторых случаях эти значения совпадают, но не всегда. Это будет зависеть от того, разделились ли растворенные в растворе вещества на ионы в процессе, называемом диссоциацией . Это связано с тем, что осмотическая концентрация рассматривает частицы в целом, а молярность рассматривает только определенный тип частиц, например, молекулы. Так, например, если мы рассматриваем молекулы для молярной концентрации, но наше вещество разделилось на ионы, то у нас было бы меньше молекул, чем общее количество частиц. В результате молярная концентрация будет ниже. Мы должны быть осторожны и знать физические свойства раствора, чтобы иметь возможность преобразовать молярную концентрацию в осмотическую концентрацию. Фармацевты также должны учитывать тоничность раствора. Тоничность является родственным свойством, зависящим от концентрации. В отличие от осмотической концентрации тоничность указывает на концентрацию веществ в растворе, которая не может пройти через мембрану в рассматриваемом организме. Эти вещества оказывают давление на мембрану из-за осмоса и их неспособности преодолевать барьер. Когда лекарство предназначено для попадания в кровоток или любую другую жидкость организма, фармацевты уравновешивают тоничность, чтобы гарантировать, что это лекарство не вызывает осмотического давления. Для обеспечения правильного тонуса лекарство часто разводят в солевом растворе . Это раствор поваренной соли (NaCl) в воде, приготовленный в концентрации, обеспечивающей правильный тонус, соответствующий внутренней жидкости организма при смешивании с лекарством. Обычно он находится в стерильном контейнере при внутривенном введении или смешивается непосредственно с лекарством. Справочная информация Автор статьи: Kateryna Yuri Вас могут заинтересовать другие преобразователи из группы Гидравлика — Жидкости:Тормотрический преобразователь расхода расхода Передача массовой скорости расхода Молярная концентрация расхода расхода Mass Flux Converter Массовая концентрация в преобразователе раствора Динамический (абсолютный) конвертер видкативности Kinematic Converter Converter 4Kinemacatic Compretter 440007 KinemacaticConfertertter 440007 KinemacaticConfertertter 40007 KINEMATIC.Конвертер единиц проницаемости, проницаемости, паропроницаемости Конвертер массы Конвертер единиц удельного объема Конвертер единиц измерения объема и общей кулинарной обработки Компактный калькулятор Полный калькулятор Определения единиц измерения У вас есть трудности с переводом единицы измерения на другой язык? Помощь доступна! Разместите свой вопрос в TCTerms и вы получите ответ от опытных технических переводчиков в считанные минуты. |
Преобразователь случайных чисел | Преобразователь молярной концентрации Конвертер длины и расстоянияПреобразователь массыСухой объем и общие измерения для приготовления пищиКонвертер площадиКонвертер объема и общего измерения для приготовления пищиПреобразователь температурыПреобразователь давления, напряжения, модуля ЮнгаПреобразователь энергии и работыПреобразователь мощностиПреобразователь силыПреобразователь силыПреобразователь времениПреобразователь линейной скорости и скоростиПреобразователь углаПреобразователь эффективности использования топлива, расхода топлива и экономии топливаПреобразователь чиселКонвертер единиц информации и Хранение данныхКурсы обмена валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияПреобразователь ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыКонвертер импульсаИмпульс крутящего моментаКонвертер удельной энергии, теплоты сгорания (в расчете на массу)Конвертер удельной энергии, теплоты сгорания (в объеме) Конвертер температуры Конвертер интервала Конвертер коэффициента теплового расширенияКонвертер теплового сопротивленияТеплопровод Конвертер удельной теплоемкостиПлотность теплоты, плотность пожарной нагрузкиКонвертер плотности теплового потокаКонвертер коэффициента теплопередачиКонвертер объемного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер массового потокаКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкости Конвертер кинематической вязкости Конвертер поверхностного натяженияМодерация проницаемости, проницаемости, паропроницаемости Преобразователь скорости пропускания паровПреобразователь уровня звукаПреобразователь чувствительности микрофонаПреобразователь уровня звукового давления (SPL)Преобразователь уровня звукового давления с выбираемым эталонным давлениемПреобразователь яркостиПреобразователь силы светаПреобразователь освещенностиПреобразователь разрешения цифрового изображенияПреобразователь частоты и длины волныПреобразователь оптической силы (диоптрий) в фокусное расстояниеПреобразователь оптической силы (диоптрий) в увеличение (X)Электрический заряд КонвертерКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаОбъемный заряд De Преобразователь электрического токаПреобразователь линейной плотности токаПреобразователь поверхностной плотности токаПреобразователь напряженности электрического поляПреобразователь электрического потенциала и напряженияПреобразователь электрического сопротивленияПреобразователь удельного электрического сопротивленияПреобразователь электрической проводимостиПреобразователь электропроводностиПреобразователь емкостиПреобразователь емкостиПреобразователь индуктивностиПреобразователь реактивной мощности переменного токаПреобразователь калибров проводов в СШАПреобразование уровней в дБм, дБВ, Ватт и других единицахПреобразователь силы магнитного поля КонвертерПлотность магнитного потокаМощность поглощенной дозы излучения, Мощность общей дозы ионизирующего излучения КонвертерРадиоактивность. From: mole/meter³mole/litermole/centimeter³mole/millimeter³kilomole/meter³kilomole/literkilomole/centimeter³kilomole/millimeter³millimole/meter³millimole/litermillimole/centimeter³millimole/millimeter³mole/decimeter³molarmillimolarmicromolarnanomolarpicomolarfemtomolarattomolarzeptomolaryoctomolar To: mole/meter³mole/litermole/centimeter³mole/ миллиметр³киломоль/метр³киломоль/литркиломоль/сантиметр³киломоль/миллиметр³миллимоль/метр³миллимоль/литрмиллимоль/сантиметр³миллимоль/миллиметр³моль/дециметр³мольмиллимолярныймикромолярнаномольпикомолярфемтомоляраттомолярзептомоляриоктомолярный Передача данных и теорема о дискретизацииЗнаете ли вы, почему для записи звука в видеопроизводстве используется стандарт 48 кГц? Нажмите или коснитесь, чтобы узнать! Обзор Изменения в молярной концентрации единиц Обнаружение молярной концентрации Примеры Используются в аптеке Обзор Одна моль из углерода — это количество вещества, которое имеет одинаковое число атомов, как и атмосы, как и то же количество атмосов, как и атмосы, как и то же количество атмосов, как и атмосы, как и то же количество атмосов, как и атмосы, как и одно и то же количество ат -ат. Концентрацию раствора можно измерить различными способами, например, путем измерения отношения массы растворенного вещества к общему объему раствора. Здесь мы рассматриваем молярную концентрацию , которая измеряется как отношение количества вещества в молях к общему объему раствора. Веществом в нашем случае является растворенное вещество, а объем измеряется для всего раствора, даже если в нем есть другие растворенные вещества. Здесь количество вещества измеряется как количество элементарных объектов (например, атомов или молекул) вещества. Поскольку даже в небольшом объеме вещества существует огромное количество элементарных объектов, мы используем специальные единицы, называемые молями, для количества вещества. Один моль определяется как количество атомов в 12 граммах углерода-12, что составляет примерно 6×10²³ атомов. Моли очень удобно использовать для веществ, находящихся в достаточно малых количествах, которые можно легко измерить с помощью бытовых или промышленных измерительных приборов. Мы должны быть осторожны, чтобы не спутать молярность с другим родственным свойством, моляльностью . В отличие от молярности, моляльность – это отношение количества вещества растворенного вещества к массе растворителя, а не к массе всего раствора. В некоторых случаях значения молярности и моляльности раствора очень близки. Это в том случае, если наш растворитель — вода, и если количество растворенного вещества достаточно мало, чтобы его масса и объем были незначительными — но это не всегда так. Масса одного моля различных веществ. Его можно найти с помощью периодической таблицы. Изменения молярной концентрацииМолярная концентрация может зависеть от температуры, хотя это зависит от веществ, присутствующих в этом растворе. Температура может вызвать расширение некоторых растворителей, и если растворенное вещество не расширяется вместе с растворителем, молярная концентрация уменьшается. Также возможно, что растворитель испарится, а количество растворенного вещества останется прежним при повышении температуры. В этом случае концентрация раствора увеличится. В некоторых случаях происходит обратное. Иногда повышение или понижение температуры изменяет растворимость. В результате растворитель полностью или частично перестает растворяться в растворе, а концентрация снижается. Единицы Молярная концентрация измеряется в молях на единицу объема, например, в молях на литр или в молях на кубический метр. Последняя является единицей СИ. Его также можно измерить в молях на другую единицу объема. Определение молярной концентрацииЧтобы найти молярную концентрацию, нам нужно знать количество вещества и общий объем раствора. Для определения количества вещества мы могли бы использовать молекулярную формулу этого вещества и информацию о массе этого вещества, присутствующего в растворе. В частности, чтобы найти, сколько молей раствора у нас есть, мы можем найти атомную массу каждого атома, присутствующего в молекуле, в таблице Менделеева, а затем разделить общую массу вещества на общий атомный вес атомов в периодической таблице. молекула. Мы должны убедиться, что перед сложением атомных масс мы умножаем каждую из атомных масс для конкретного атома на число атомов этого типа, присутствующих в молекуле. Возможно и обратное. Если мы знаем молярную концентрацию нашего раствора и формулу растворенного вещества, то мы можем определить количество растворителя, присутствующего в растворе, как в молях, так и в граммах. Для этого нам нужно будет проверить периодическую таблицу атомных весов, как описано ранее. ПримерыРассчитаем молярность раствора, содержащего 3 столовые ложки пищевой соды, смешанные с 20 литрами воды. 1 столовая ложка составляет около 17 граммов, поэтому 3 столовые ложки составляют 51 грамм. Пищевая сода также известна как бикарбонат натрия, а ее химическая формула — NaHCO₃. В этом примере мы будем работать с атомами, поэтому давайте найдем атомные массы натрия (Na), водорода (H), углерода (C) и кислорода (O). Na: 22,989769 Молярная концентрация 1 кубика сахара в одной чашке чая составляет 0,049 моль/л. У нас в формуле есть O₃, поэтому нам нужно умножить атомную массу кислорода на 3, получив 47,9982. Теперь добавим эти атомные массы. Мы получим 84.006609. Атомные массы в периодической таблице обычно указываются в атомных единицах массы. Это относится и к нашим данным. Эта атомная масса в атомных единицах массы соответствует массе 1 моля элемента в граммах. Это означает, что масса 1 моля NaHCO₃ равна 84,006609. Это означает, что мы разбавили 0,6 моля пищевой соды в 20 литрах воды. Разделим это количество пищевой соды на 20 литров, чтобы получить молярную концентрацию: 0,6 моль/20 л = 0,03 моль/л. Мы получили низкую концентрацию, потому что использовали такое небольшое количество соды и разводили ее в большом объеме воды. Давайте попробуем другой пример и найдем молярную концентрацию 1 кубика сахара в одной чашке чая. Столовый сахар состоит из сахарозы. Сначала найдем вес одного моля сахарозы, формула которой C₁₂H₂₂O₁₁. Используя периодическую таблицу, находим, что масса одного моля равна 12×12 + 22×1 + 11×16 = 342 грамма. 1 куб сахара равен 4 граммам, что составляет 4/342 = 0,01 моля. 1 чашка — это 237 миллилитров, поэтому 1 кубик сахара, смешанный с одной чашкой чая, дает 0,01 моля / 237 миллилитров × 1000 (для перевода в литры) = 0,049.
ИспользованиеСтехиометрия помогает определить количество веществ, которые реагируют друг с другом, а также количества веществ, которые образуются в результате этой реакции. Молярная концентрация удобна в использовании. Если температура и давление одинаковы для всех газов, то один моль каждого газа занимает один и тот же объем, и мы можем использовать это свойство для различных расчетов. Для удобства при работе с химическими реакциями часто используется молярная концентрация. Раздел химии, изучающий определение количества исходных веществ и продуктов химических реакций, стехиометрия часто имеет дело с молярной концентрацией. Мы можем найти молярную концентрацию, используя химическую формулу конечного компонента, который становится растворенным, как мы сделали для пищевой соды, но мы также можем использовать химические уравнения, чтобы найти ее. Нам нужно будет знать формулы и количества веществ (реагентов), которые используются в нашей химической реакции для создания растворенного вещества в качестве конечного продукта. Когда мы начинаем с нескольких веществ, которые реагируют друг с другом, мы можем найти формулу конечного продукта, уравновешивая уравнение химической реакции между веществами. Если мы смешаем продукт этой реакции с раствором, мы сможем найти молярную концентрацию, как описано в предыдущих примерах. Давайте рассмотрим простой пример. Мы снова будем использовать пищевую соду и смешать ее с уксусом для интересной химической реакции. Вы можете легко найти эти вещества, возможно, они уже есть в вашей кладовой. Как мы упоминали ранее, формула пищевой соды — NaHCO₃. Уксус не является чистым соединением, это 5% смесь уксусной кислоты с водой. Химическая формула уксусной кислоты CH₃COOH. Запишем и составим уравнение реакции пищевой соды с уксусной кислотой: NaHCO₃ + CH3COOH → NaC₂H3O₂ + H₂CO₃ Один из продуктов этой реакции, H₂CO₃, нестабилен и вступит в другую реакцию: H₂CO₃ → H₂O + CO₂ Итак, в итоге у нас есть вода (H₂O), углекислый газ (CO₂) и ацетат натрия (NaC₂H₃O₂). Затем мы можем смешать ацетат натрия с водой и приступить к расчету молярной концентрации, как мы сделали в предыдущем примере для пищевой соды. Мы должны быть осторожны при расчете объема воды, чтобы учесть воду, с которой смешивали уксусную кислоту, чтобы сделать уксус, и воду, которая была продуктом химической реакции. Ацетат натрия — интересное химическое соединение — его используют в грелках и грелках для рук. Когда мы используем стехиометрию для определения либо количества реагентов, либо количества конечного продукта, используемого позже в расчетах молярной концентрации, мы заметим, что только ограниченное количество одного реагента будет реагировать с другими реагентами. Это повлияет на выход нашего конечного продукта. Поскольку молярная концентрация может помочь нам выполнить расчеты «обратного инжиниринга», чтобы выяснить, с какого количества реагентов мы должны начать, это полезная концепция для практических приложений при работе с химическими реакциями. Всякий раз, когда мы используем рецепт, будь то приготовление пищи, изготовление лекарств или даже создание условий для аквариумных рыбок, нам важна концентрация. В то время как в повседневной жизни мы можем предпочесть работать с граммами, в химии или фармации часто используется молярная концентрация. При изготовлении лекарств, контактирующих с мембранами организма, таких как глазные лекарства, фармацевты должны привести осмотическую концентрацию лекарства в соответствие с осмотической концентрацией телесных жидкостей по другую сторону мембраны. В аптеке Молярная концентрация важна при смешивании соединений для создания лекарства, поскольку она влияет на то, как это лекарство действует на организм. Некоторые лекарства ядовиты, если их концентрация слишком высока, а многие не так эффективны, когда концентрация слишком мала. Кроме того, важна концентрация в обмене жидкости между оболочками организма. Здесь мы можем рассмотреть молярную концентрацию или рассчитать значение осмотической концентрации , используя молярную концентрацию. В этом контексте чаще используется осмотическая концентрация. Если вещество на одной стороне мембраны, например лекарство, имеет более высокую концентрацию, чем на другой стороне мембраны, например внутри глаза, то более концентрированный раствор будет поступать в область с меньшей концентрацией. Этот поток может создать проблемы. Например, если есть поток жидкости в клетку, такую как клетка крови, то клетка может достичь своей емкости для жидкости и разрушиться. Пациент получает лекарство из капельницы на шесте. Примечание по переводу молярности в осмотическую концентрацию: в некоторых случаях эти значения совпадают, но не всегда. Это будет зависеть от того, разделились ли растворенные в растворе вещества на ионы в процессе, называемом диссоциацией . Это связано с тем, что осмотическая концентрация рассматривает частицы в целом, а молярность рассматривает только определенный тип частиц, например, молекулы. Так, например, если мы рассматриваем молекулы для молярной концентрации, но наше вещество разделилось на ионы, то у нас было бы меньше молекул, чем общее количество частиц. В результате молярная концентрация будет ниже. Мы должны быть осторожны и знать физические свойства раствора, чтобы иметь возможность преобразовать молярную концентрацию в осмотическую концентрацию. Фармацевты также должны учитывать тоничность раствора. Тоничность является родственным свойством, зависящим от концентрации. В отличие от осмотической концентрации тоничность указывает на концентрацию веществ в растворе, которая не может пройти через мембрану в рассматриваемом организме. Эти вещества оказывают давление на мембрану из-за осмоса и их неспособности преодолевать барьер. Когда лекарство предназначено для попадания в кровоток или любую другую жидкость организма, фармацевты уравновешивают тоничность, чтобы гарантировать, что это лекарство не вызывает осмотического давления. Для обеспечения правильного тонуса лекарство часто разводят в солевом растворе . Это раствор поваренной соли (NaCl) в воде, приготовленный в концентрации, обеспечивающей правильный тонус, соответствующий внутренней жидкости организма при смешивании с лекарством. Обычно он находится в стерильном контейнере при внутривенном введении или смешивается непосредственно с лекарством. Справочная информация Автор статьи: Kateryna Yuri Вас могут заинтересовать другие преобразователи из группы Гидравлика — Жидкости:Тормотрический преобразователь расхода расхода Передача массовой скорости расхода Молярная концентрация расхода расхода Mass Flux Converter Массовая концентрация в преобразователе раствора Динамический (абсолютный) конвертер видкативности Kinematic Converter Converter 4Kinemacatic Compretter 440007 KinemacaticConfertertter 440007 KinemacaticConfertertter 40007 KINEMATIC.Конвертер единиц проницаемости, проницаемости, паропроницаемости Конвертер массы Конвертер единиц удельного объема Конвертер единиц измерения объема и общей кулинарной обработки Компактный калькулятор Полный калькулятор Определения единиц измерения У вас есть трудности с переводом единицы измерения на другой язык? Помощь доступна! Разместите свой вопрос в TCTerms и вы получите ответ от опытных технических переводчиков в считанные минуты. |
Преобразователь случайных чисел | Преобразователь молярной концентрации Конвертер длины и расстоянияПреобразователь массыСухой объем и общие измерения для приготовления пищиКонвертер площадиКонвертер объема и общего измерения для приготовления пищиПреобразователь температурыПреобразователь давления, напряжения, модуля ЮнгаПреобразователь энергии и работыПреобразователь мощностиПреобразователь силыПреобразователь силыПреобразователь времениПреобразователь линейной скорости и скоростиПреобразователь углаПреобразователь эффективности использования топлива, расхода топлива и экономии топливаПреобразователь чиселКонвертер единиц информации и Хранение данныхКурсы обмена валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияПреобразователь ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыКонвертер импульсаИмпульс крутящего моментаКонвертер удельной энергии, теплоты сгорания (в расчете на массу)Конвертер удельной энергии, теплоты сгорания (в объеме) Конвертер температуры Конвертер интервала Конвертер коэффициента теплового расширенияКонвертер теплового сопротивленияТеплопровод Конвертер удельной теплоемкостиПлотность теплоты, плотность пожарной нагрузкиКонвертер плотности теплового потокаКонвертер коэффициента теплопередачиКонвертер объемного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер массового потокаКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкости Конвертер кинематической вязкости Конвертер поверхностного натяженияМодерация проницаемости, проницаемости, паропроницаемости Преобразователь скорости пропускания паровПреобразователь уровня звукаПреобразователь чувствительности микрофонаПреобразователь уровня звукового давления (SPL)Преобразователь уровня звукового давления с выбираемым эталонным давлениемПреобразователь яркостиПреобразователь силы светаПреобразователь освещенностиПреобразователь разрешения цифрового изображенияПреобразователь частоты и длины волныПреобразователь оптической силы (диоптрий) в фокусное расстояниеПреобразователь оптической силы (диоптрий) в увеличение (X)Электрический заряд КонвертерКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаОбъемный заряд De Преобразователь электрического токаПреобразователь линейной плотности токаПреобразователь поверхностной плотности токаПреобразователь напряженности электрического поляПреобразователь электрического потенциала и напряженияПреобразователь электрического сопротивленияПреобразователь удельного электрического сопротивленияПреобразователь электрической проводимостиПреобразователь электропроводностиПреобразователь емкостиПреобразователь емкостиПреобразователь индуктивностиПреобразователь реактивной мощности переменного токаПреобразователь калибров проводов в СШАПреобразование уровней в дБм, дБВ, Ватт и других единицахПреобразователь силы магнитного поля КонвертерПлотность магнитного потокаМощность поглощенной дозы излучения, Мощность общей дозы ионизирующего излучения КонвертерРадиоактивность. From: mole/meter³mole/litermole/centimeter³mole/millimeter³kilomole/meter³kilomole/literkilomole/centimeter³kilomole/millimeter³millimole/meter³millimole/litermillimole/centimeter³millimole/millimeter³mole/decimeter³molarmillimolarmicromolarnanomolarpicomolarfemtomolarattomolarzeptomolaryoctomolar To: mole/meter³mole/litermole/centimeter³mole/ миллиметр³киломоль/метр³киломоль/литркиломоль/сантиметр³киломоль/миллиметр³миллимоль/метр³миллимоль/литрмиллимоль/сантиметр³миллимоль/миллиметр³моль/дециметр³мольмиллимолярныймикромолярнаномольпикомолярфемтомоляраттомолярзептомоляриоктомолярный Передача данныхЗнаете ли вы, что отказ от бумаги, вероятно, не уменьшит углеродный след? Нажмите или коснитесь, чтобы узнать, почему! Обзор Изменения в молярной концентрации единиц Обнаружение молярной концентрации Примеры Используются в аптеке Обзор Одна моль из углерода — это количество вещества, которое имеет одинаковое число атомов, как и атмосы, как и то же количество атмосов, как и атмосы, как и то же количество атмосов, как и атмосы, как и то же количество атмосов, как и атмосы, как и одно и то же количество ат -ат. Концентрацию раствора можно измерить различными способами, например, путем измерения отношения массы растворенного вещества к общему объему раствора. Здесь мы рассматриваем молярную концентрацию , которая измеряется как отношение количества вещества в молях к общему объему раствора. Веществом в нашем случае является растворенное вещество, а объем измеряется для всего раствора, даже если в нем есть другие растворенные вещества. Здесь количество вещества измеряется как количество элементарных объектов (например, атомов или молекул) вещества. Поскольку даже в небольшом объеме вещества существует огромное количество элементарных объектов, мы используем специальные единицы, называемые молями, для количества вещества. Один моль определяется как количество атомов в 12 граммах углерода-12, что составляет примерно 6×10²³ атомов. Моли очень удобно использовать для веществ, находящихся в достаточно малых количествах, которые можно легко измерить с помощью бытовых или промышленных измерительных приборов. Мы должны быть осторожны, чтобы не спутать молярность с другим родственным свойством, моляльностью . В отличие от молярности, моляльность – это отношение количества вещества растворенного вещества к массе растворителя, а не к массе всего раствора. В некоторых случаях значения молярности и моляльности раствора очень близки. Это в том случае, если наш растворитель — вода, и если количество растворенного вещества достаточно мало, чтобы его масса и объем были незначительными — но это не всегда так. Масса одного моля различных веществ. Его можно найти с помощью периодической таблицы. Изменения молярной концентрацииМолярная концентрация может зависеть от температуры, хотя это зависит от веществ, присутствующих в этом растворе. Температура может вызвать расширение некоторых растворителей, и если растворенное вещество не расширяется вместе с растворителем, молярная концентрация уменьшается. Также возможно, что растворитель испарится, а количество растворенного вещества останется прежним при повышении температуры. В этом случае концентрация раствора увеличится. В некоторых случаях происходит обратное. Иногда повышение или понижение температуры изменяет растворимость. В результате растворитель полностью или частично перестает растворяться в растворе, а концентрация снижается. Единицы Молярная концентрация измеряется в молях на единицу объема, например, в молях на литр или в молях на кубический метр. Последняя является единицей СИ. Его также можно измерить в молях на другую единицу объема. Определение молярной концентрацииЧтобы найти молярную концентрацию, нам нужно знать количество вещества и общий объем раствора. Для определения количества вещества мы могли бы использовать молекулярную формулу этого вещества и информацию о массе этого вещества, присутствующего в растворе. В частности, чтобы найти, сколько молей раствора у нас есть, мы можем найти атомную массу каждого атома, присутствующего в молекуле, в таблице Менделеева, а затем разделить общую массу вещества на общий атомный вес атомов в периодической таблице. молекула. Мы должны убедиться, что перед сложением атомных масс мы умножаем каждую из атомных масс для конкретного атома на число атомов этого типа, присутствующих в молекуле. Возможно и обратное. Если мы знаем молярную концентрацию нашего раствора и формулу растворенного вещества, то мы можем определить количество растворителя, присутствующего в растворе, как в молях, так и в граммах. Для этого нам нужно будет проверить периодическую таблицу атомных весов, как описано ранее. ПримерыРассчитаем молярность раствора, содержащего 3 столовые ложки пищевой соды, смешанные с 20 литрами воды. 1 столовая ложка составляет около 17 граммов, поэтому 3 столовые ложки составляют 51 грамм. Пищевая сода также известна как бикарбонат натрия, а ее химическая формула — NaHCO₃. В этом примере мы будем работать с атомами, поэтому давайте найдем атомные массы натрия (Na), водорода (H), углерода (C) и кислорода (O). Na: 22,989769 Молярная концентрация 1 кубика сахара в одной чашке чая составляет 0,049 моль/л. У нас в формуле есть O₃, поэтому нам нужно умножить атомную массу кислорода на 3, получив 47,9982. Теперь добавим эти атомные массы. Мы получим 84.006609. Атомные массы в периодической таблице обычно указываются в атомных единицах массы. Это относится и к нашим данным. Эта атомная масса в атомных единицах массы соответствует массе 1 моля элемента в граммах. Это означает, что масса 1 моля NaHCO₃ равна 84,006609. Это означает, что мы разбавили 0,6 моля пищевой соды в 20 литрах воды. Разделим это количество пищевой соды на 20 литров, чтобы получить молярную концентрацию: 0,6 моль/20 л = 0,03 моль/л. Мы получили низкую концентрацию, потому что использовали такое небольшое количество соды и разводили ее в большом объеме воды. Давайте попробуем другой пример и найдем молярную концентрацию 1 кубика сахара в одной чашке чая. Столовый сахар состоит из сахарозы. Сначала найдем вес одного моля сахарозы, формула которой C₁₂H₂₂O₁₁. Используя периодическую таблицу, находим, что масса одного моля равна 12×12 + 22×1 + 11×16 = 342 грамма. 1 куб сахара равен 4 граммам, что составляет 4/342 = 0,01 моля. 1 чашка — это 237 миллилитров, поэтому 1 кубик сахара, смешанный с одной чашкой чая, дает 0,01 моля / 237 миллилитров × 1000 (для перевода в литры) = 0,049.
ИспользованиеСтехиометрия помогает определить количество веществ, которые реагируют друг с другом, а также количества веществ, которые образуются в результате этой реакции. Молярная концентрация удобна в использовании. Если температура и давление одинаковы для всех газов, то один моль каждого газа занимает один и тот же объем, и мы можем использовать это свойство для различных расчетов. Для удобства при работе с химическими реакциями часто используется молярная концентрация. Раздел химии, изучающий определение количества исходных веществ и продуктов химических реакций, стехиометрия часто имеет дело с молярной концентрацией. Мы можем найти молярную концентрацию, используя химическую формулу конечного компонента, который становится растворенным, как мы сделали для пищевой соды, но мы также можем использовать химические уравнения, чтобы найти ее. Нам нужно будет знать формулы и количества веществ (реагентов), которые используются в нашей химической реакции для создания растворенного вещества в качестве конечного продукта. Когда мы начинаем с нескольких веществ, которые реагируют друг с другом, мы можем найти формулу конечного продукта, уравновешивая уравнение химической реакции между веществами. Если мы смешаем продукт этой реакции с раствором, мы сможем найти молярную концентрацию, как описано в предыдущих примерах. Давайте рассмотрим простой пример. Мы снова будем использовать пищевую соду и смешать ее с уксусом для интересной химической реакции. Вы можете легко найти эти вещества, возможно, они уже есть в вашей кладовой. Как мы упоминали ранее, формула пищевой соды — NaHCO₃. Уксус не является чистым соединением, это 5% смесь уксусной кислоты с водой. Химическая формула уксусной кислоты CH₃COOH. Запишем и составим уравнение реакции пищевой соды с уксусной кислотой: NaHCO₃ + CH3COOH → NaC₂H3O₂ + H₂CO₃ Один из продуктов этой реакции, H₂CO₃, нестабилен и вступит в другую реакцию: H₂CO₃ → H₂O + CO₂ Итак, в итоге у нас есть вода (H₂O), углекислый газ (CO₂) и ацетат натрия (NaC₂H₃O₂). Затем мы можем смешать ацетат натрия с водой и приступить к расчету молярной концентрации, как мы сделали в предыдущем примере для пищевой соды. Мы должны быть осторожны при расчете объема воды, чтобы учесть воду, с которой смешивали уксусную кислоту, чтобы сделать уксус, и воду, которая была продуктом химической реакции. Ацетат натрия — интересное химическое соединение — его используют в грелках и грелках для рук. Когда мы используем стехиометрию для определения либо количества реагентов, либо количества конечного продукта, используемого позже в расчетах молярной концентрации, мы заметим, что только ограниченное количество одного реагента будет реагировать с другими реагентами. Это повлияет на выход нашего конечного продукта. Поскольку молярная концентрация может помочь нам выполнить расчеты «обратного инжиниринга», чтобы выяснить, с какого количества реагентов мы должны начать, это полезная концепция для практических приложений при работе с химическими реакциями. Всякий раз, когда мы используем рецепт, будь то приготовление пищи, изготовление лекарств или даже создание условий для аквариумных рыбок, нам важна концентрация. В то время как в повседневной жизни мы можем предпочесть работать с граммами, в химии или фармации часто используется молярная концентрация. При изготовлении лекарств, контактирующих с мембранами организма, таких как глазные лекарства, фармацевты должны привести осмотическую концентрацию лекарства в соответствие с осмотической концентрацией телесных жидкостей по другую сторону мембраны. В аптеке Молярная концентрация важна при смешивании соединений для создания лекарства, поскольку она влияет на то, как это лекарство действует на организм. Некоторые лекарства ядовиты, если их концентрация слишком высока, а многие не так эффективны, когда концентрация слишком мала. Кроме того, важна концентрация в обмене жидкости между оболочками организма. Здесь мы можем рассмотреть молярную концентрацию или рассчитать значение осмотической концентрации , используя молярную концентрацию. В этом контексте чаще используется осмотическая концентрация. Если вещество на одной стороне мембраны, например лекарство, имеет более высокую концентрацию, чем на другой стороне мембраны, например внутри глаза, то более концентрированный раствор будет поступать в область с меньшей концентрацией. Этот поток может создать проблемы. Например, если есть поток жидкости в клетку, такую как клетка крови, то клетка может достичь своей емкости для жидкости и разрушиться. Пациент получает лекарство из капельницы на шесте. Примечание по переводу молярности в осмотическую концентрацию: в некоторых случаях эти значения совпадают, но не всегда. Это будет зависеть от того, разделились ли растворенные в растворе вещества на ионы в процессе, называемом диссоциацией . Это связано с тем, что осмотическая концентрация рассматривает частицы в целом, а молярность рассматривает только определенный тип частиц, например, молекулы. Так, например, если мы рассматриваем молекулы для молярной концентрации, но наше вещество разделилось на ионы, то у нас было бы меньше молекул, чем общее количество частиц. В результате молярная концентрация будет ниже. Мы должны быть осторожны и знать физические свойства раствора, чтобы иметь возможность преобразовать молярную концентрацию в осмотическую концентрацию. Фармацевты также должны учитывать тоничность раствора. Тоничность является родственным свойством, зависящим от концентрации. В отличие от осмотической концентрации тоничность указывает на концентрацию веществ в растворе, которая не может пройти через мембрану в рассматриваемом организме. Эти вещества оказывают давление на мембрану из-за осмоса и их неспособности преодолевать барьер. Когда лекарство предназначено для попадания в кровоток или любую другую жидкость организма, фармацевты уравновешивают тоничность, чтобы гарантировать, что это лекарство не вызывает осмотического давления. Для обеспечения правильного тонуса лекарство часто разводят в солевом растворе . Это раствор поваренной соли (NaCl) в воде, приготовленный в концентрации, обеспечивающей правильный тонус, соответствующий внутренней жидкости организма при смешивании с лекарством. Обычно он находится в стерильном контейнере при внутривенном введении или смешивается непосредственно с лекарством. Справочная информация Автор статьи: Kateryna Yuri Вас могут заинтересовать другие преобразователи из группы Гидравлика — Жидкости:Тормотрический преобразователь расхода расхода Передача массовой скорости расхода Молярная концентрация расхода расхода Mass Flux Converter Массовая концентрация в преобразователе раствора Динамический (абсолютный) конвертер видкативности Kinematic Converter Converter 4Kinemacatic Compretter 440007 KinemacaticConfertertter 440007 KinemacaticConfertertter 40007 KINEMATIC.Конвертер единиц проницаемости, проницаемости, паропроницаемости Конвертер массы Конвертер единиц удельного объема Конвертер единиц измерения объема и общей кулинарной обработки Компактный калькулятор Полный калькулятор Определения единиц измерения У вас есть трудности с переводом единицы измерения на другой язык? Помощь доступна! Разместите свой вопрос в TCTerms и вы получите ответ от опытных технических переводчиков в считанные минуты. |
Калькулятор концентрации раствора в единицах объема
Калькулятор концентрации раствора в единицах объема
Этот калькулятор (см. ниже) предназначен для использования как в учебной, так и в исследовательской лаборатории. выполнить ряд различных расчетов для приготовления растворов, имеющих единиц на объем (т. е. единиц по объему) единицы концентрации, такие как Единицы/мл, мкЕдиницы/мкл, мЕдиницы/мл, Единицы/л и т. д. Такие расчеты концентрации необходимы, если исходить из твердой формы фермента (например, как коллагеназа), гапарин или любая другая биологически активная молекула, где единица активности указана в Единицах/мг, а раствор необходимо приготовить с единицей концентрации, выраженной в единицах активности на единицу объема, например Единиц/мл.
выполнить ряд различных расчетов для приготовления растворов, имеющих единиц на объем (т. е. единиц по объему) единицы концентрации, такие как Единицы/мл, мкЕдиницы/мкл, мЕдиницы/мл, Единицы/л и т. д. Такие расчеты концентрации необходимы, если исходить из твердой формы фермента (например, как коллагеназа), гапарин или любая другая биологически активная молекула, где единица активности указана в Единицах/мг, а раствор необходимо приготовить с единицей концентрации, выраженной в единицах активности на единицу объема, например Единиц/мл.
Единицы деятельности (U) обычно используются для описания каталитической активности фермента, где единица (U) относится к количеству фермента, которое катализирует превращение 1 микромоля (мкмоль) субстрата в минуту. Таким образом, 1 единица фермента (U) = 1 мкмоль/мин, где мкмоль относится к количеству преобразованного субстрата. Поскольку каждый фермент имеет уникальный субстрат, единица активности одного фермента отличается от другой. Кроме того, должны быть указаны экспериментальные условия, при которых определяется ферментативная активность (например, концентрация субстрата, температура, рН, ионная сила и т. д.). Единицей каталитической активности ферментов в СИ является каталь, однако на практике он используется реже. 1 катал = количество фермента, которое катализирует превращение 1 моля субстрата в секунду (1 катал = 1 моль/с). Таким образом, 1 Единица = 1,667 × 10 -8 каталов и 1 катал = 6,00 × 10 7 Единиц.
Кроме того, должны быть указаны экспериментальные условия, при которых определяется ферментативная активность (например, концентрация субстрата, температура, рН, ионная сила и т. д.). Единицей каталитической активности ферментов в СИ является каталь, однако на практике он используется реже. 1 катал = количество фермента, которое катализирует превращение 1 моля субстрата в секунду (1 катал = 1 моль/с). Таким образом, 1 Единица = 1,667 × 10 -8 каталов и 1 катал = 6,00 × 10 7 Единиц.
Также важно отметить, что для различных биологически активных молекул существуют другие единицы активности, каждая из которых определяется уникальным образом в соответствии со стандартом, установленным экспертами в данной области. Приведенный ниже калькулятор можно также использовать в других случаях, когда единицы активности используются аналогично тому, как это описано выше для ферментов. Например, гепарин является природным антикоагулянтом, присутствующим в базофилах и тучных клетках. При высвобождении из этих клеток гепарин связывается с антитромбином III, что вызывает инактивацию тромбина и других факторов свертывания крови. Таким образом, гепарин предотвращает образование тромбов. Физиологическое значение гепарина как антикоагулянта обсуждается. Тем не менее внутривенное введение гепарина широко используется благодаря его антикоагулянтным свойствам. Кроме того, гепарин имеет огромное значение и используется для предотвращения свертывания крови вне организма, например, для образцов крови, взятых для клинического анализа компонентов крови. Из-за его способности предотвращать свертывание крови единица гепарина определяется как количество гепарина, необходимое для поддержания 1 мл кошачьей кровяной жидкости в течение 24 часов при температуре 0 °C. При покупке твердой формы гепарина единица активности обычно указывается в единицах/мг. Коммерческие препараты растворов гепарина обычно указывают активность в единицах/мл.
При высвобождении из этих клеток гепарин связывается с антитромбином III, что вызывает инактивацию тромбина и других факторов свертывания крови. Таким образом, гепарин предотвращает образование тромбов. Физиологическое значение гепарина как антикоагулянта обсуждается. Тем не менее внутривенное введение гепарина широко используется благодаря его антикоагулянтным свойствам. Кроме того, гепарин имеет огромное значение и используется для предотвращения свертывания крови вне организма, например, для образцов крови, взятых для клинического анализа компонентов крови. Из-за его способности предотвращать свертывание крови единица гепарина определяется как количество гепарина, необходимое для поддержания 1 мл кошачьей кровяной жидкости в течение 24 часов при температуре 0 °C. При покупке твердой формы гепарина единица активности обычно указывается в единицах/мг. Коммерческие препараты растворов гепарина обычно указывают активность в единицах/мл.
Наш Калькулятор разбавления единиц на объем можно использовать для расчета разбавления растворов с единицами концентрации единиц на объем (например, единиц/мл).
Если вы хотите выполнить расчет коэффициента разбавления или кратного разведения для растворов с единицами объемной концентрации (например, мЕд/мл, мкЕд/мкл, мкЕд/л и т. д.), используйте наш калькулятор коэффициента разбавления — Единиц на объем.
Единицы на объем (единицы/объем) уравнение концентрации
- C — желаемая концентрация конечного раствора с единицей концентрации, выраженной в единицах активности на объем раствора (например, Единицы/мл).
- A – активность твердого материала с единицей активности, выраженной в единицах активности на массу материала (например, Единицы/мг).
- m — масса (т.е. вес) растворенного вещества, которое необходимо растворить в объеме V раствора для получения желаемой концентрации раствора ( C ).
- V – это объем раствора, в котором необходимо растворить указанную массу ( m ) растворенного вещества, чтобы получить раствор требуемой концентрации ( C ).
 Обратите внимание, что V — это конечный или общий объем раствора после добавления растворенного вещества в растворитель.
Обратите внимание, что V — это конечный или общий объем раствора после добавления растворенного вещества в растворитель.
Единицы на объем (единицы/объем) Калькулятор концентрации раствора
Каждая показанная ниже ячейка калькулятора соответствует термину в представленной выше формуле. Введите соответствующие значения во все ячейки, кроме той, которую вы хотите рассчитать. Следовательно, не менее трех ячеек должны содержать значения, и не более одной ячейки может быть пустой . Значение пустой ячейки будет рассчитано на основе других введенных значений. После выполнения вычисления вычисляемая ячейка будет выделена, и последующие вычисления будут вычислять значение выделенной ячейки (без необходимости иметь пустую ячейку). Однако пустая ячейка имеет приоритет над выделенной ячейкой.
Для удобства этот калькулятор позволяет вам выбирать различные единицы измерения активности, массы, объема и концентрации, и для вас выполняются необходимые преобразования, чтобы получить значение пустой ячейки в нужной единице. Обратите внимание, что символ U относится к единице и, в качестве расширения, может быть определено следующее: fU (фемтоединица), pU (пикоединица), nU (наноединица), µU (микроединица) и mU (миллиединица).
Обратите внимание, что символ U относится к единице и, в качестве расширения, может быть определено следующее: fU (фемтоединица), pU (пикоединица), nU (наноединица), µU (микроединица) и mU (миллиединица).
Комментарии и/или инструкции по приготовлению
Опубликовано: суббота, 30 апреля 2005 г.
Последнее обновление: понедельник, 31 декабря 2018 г.
Калькулятор процентной концентрации к молярности
Создано Луцией Заборовской, доктором медицинских наук, кандидатом наук : 25 августа 2022 г.
Содержание:- Как использовать калькулятор преобразования процентной концентрации в молярность?
- Как преобразовать молярность в процентную концентрацию?
- Список самых популярных молярных масс
- Часто задаваемые вопросы
Если у вас есть вещество и вы хотите быстро преобразовать процент концентрации в молярность , наш инструмент сделает это за три простых шага.
Не беспокойтесь, если вы не знаете молярную массу того или иного раствора – мы предоставили вам список самых популярных . Помните, что наш калькулятор работает в обе стороны — вам не нужно вводить значения сверху вниз .
Помните, что наш калькулятор работает в обе стороны — вам не нужно вводить значения сверху вниз .
В тексте ниже мы обсудим растворы, плотность и как преобразовать процентную концентрацию в молярность, вручную 👏
Как пользоваться калькулятором преобразования процентной концентрации в молярность?
Расчет молярности с помощью нашего калькулятора, вероятно, займет у вас меньше времени, чем чтение заголовка этого раздела 😉
Выполните следующие действия, чтобы быстро получить результат:
Знаете ли вы молярную массу вашего вещества ?
Если нет, попробуйте найти его в нашем списке самых популярных веществ, используемых в химии. Пожалуйста, выберите custom и введите известное значение, если оно известно.
Молярная масса – это масса 1 моля вещества, выраженная в г/моль . 1 моль состоит ровно из 6,02214076 × 10²³ частиц.

❗ Молярную массу не следует путать с молекулярной массой – массой одиночной молекулы вещества, выраженной в дальтонах (например, одна частица HO равна 18 u). Вам может понадобиться периодическая таблица для расчета молярной массы.
Несмотря на то, что обе эти переменные схожи по значению, они описывают разные вещи .
Введите плотность вашего раствора .
Не забудьте перепроверить условия реакции, концентрацию и разбавление вашего раствора!
Введите процентную концентрацию вашего раствора или молярность вашего раствора .
Молярность, A.K.A. молярная концентрация , описывает количество молей в данном объеме раствора. Обычно мы используем такие единицы, как 1 моль/л (моль на литр) = 1 моль/дм³ (моль на кубический дециметр) = 1 М (моль).

Ваши результаты подсчитаны! 🎉
Вы также можете проверить, происходят ли ваши химические реакции в стандартных условиях 🌡️
Как перевести молярность в процентную концентрацию?
Вот уравнение, которое мы используем для преобразования процентной концентрации в молярность:
Молярность = (Процентная концентрация × Плотность) / (Молярная масса × 100)
Единицы, необходимые для этого расчета:
- Молярность -> моль/дм³ = М = моль/л;
- Концентрация в процентах -> %;
- Плотность -> г/л = г/дм³; и
- Молярная масса -> г/моль.
Будьте внимательны – плотность раствора обычно указывается в г/мл, г/см³ или кг/м³! Наш калькулятор поможет вам рассчитать все конверсии, так что не переживайте.
Проверьте наши другие полезные инструменты для молекулярной массы и растворов:
- Калькулятор моляльности ⚖️
- Калькулятор титрования ⚗️
- Калькулятор молярной массы газа 🎈
Список самых популярных молярных масс
Вещество | Молярная масса (г/моль) |
|---|---|
Аммиак | 17. |
Уксусная кислота | 60,05 |
Этанол | 46.07 |
Формальдегид | 30.03 |
Глюкоза | 180,16 |
Кислота соляная | 36,46 |
Перекись водорода | 34.01 |
Азотная кислота | 63.01 |
Фосфорная кислота | 97,99 |
Гидроксид калия | 56.11 |
Хлорид натрия | 58,44 |
Гидроксид натрия | 40,0 |
Серная кислота | 98.08 |
Часто задаваемые вопросы
Как найти молярную массу вещества?
Молярная масса Значение обычно равно молекулярной массе вещества.

 )фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл
)фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл Также растворы стабильны, то есть все компоненты в них — в одном агрегатном состоянии, например в виде жидкости. Растворы широко используют в медицине, косметике, кулинарии, в красителях и красках и в чистящих средствах. В домашних чистящих средствах часто содержатся растворы. Нередко и сам растворитель образует раствор с загрязнениями. Многие напитки — тоже растворы. Важно иметь возможность отрегулировать концентрацию веществ в растворах, так как концентрация влияет на свойства раствора. В этом конвертере мы поговорим о концентрации по массе, хотя можно также измерять концентрацию по объему или в процентах. Чтобы определить концентрацию по массе, необходимо разделить общую массу растворенного вещества на объем всего раствора. Эту величину легко перевести в концентрацию в процентах, умножив ее на 100%.
Также растворы стабильны, то есть все компоненты в них — в одном агрегатном состоянии, например в виде жидкости. Растворы широко используют в медицине, косметике, кулинарии, в красителях и красках и в чистящих средствах. В домашних чистящих средствах часто содержатся растворы. Нередко и сам растворитель образует раствор с загрязнениями. Многие напитки — тоже растворы. Важно иметь возможность отрегулировать концентрацию веществ в растворах, так как концентрация влияет на свойства раствора. В этом конвертере мы поговорим о концентрации по массе, хотя можно также измерять концентрацию по объему или в процентах. Чтобы определить концентрацию по массе, необходимо разделить общую массу растворенного вещества на объем всего раствора. Эту величину легко перевести в концентрацию в процентах, умножив ее на 100%. Раствор — только один из этих типов. Кроме этого можно получить коллоидную систему, похожую на раствор, но полупрозрачную, или непрозрачную смесь, в которой присутствуют частицы, большего размера, чем частицы в растворе — суспензию. Частицы в ней еще больше, и они отделяются от остальной смеси, то есть оседают, если суспензию оставить в состоянии покоя на определенное время. Молоко и кровь — примеры коллоидных систем, а воздух с частицами пыли или морская вода после шторма с частицами ила и песка — примеры суспензий.
Раствор — только один из этих типов. Кроме этого можно получить коллоидную систему, похожую на раствор, но полупрозрачную, или непрозрачную смесь, в которой присутствуют частицы, большего размера, чем частицы в растворе — суспензию. Частицы в ней еще больше, и они отделяются от остальной смеси, то есть оседают, если суспензию оставить в состоянии покоя на определенное время. Молоко и кровь — примеры коллоидных систем, а воздух с частицами пыли или морская вода после шторма с частицами ила и песка — примеры суспензий. Чаще всего с увеличением температуры повышается и возможная концентрация растворяемого вещества, хотя для некоторых веществ эта зависимость — обратная. Растворы с большой концентрацией растворенного вещества называют концентрированными растворами, а вещества с низкой концентрацией — наоборот, слабыми растворами. После того, как растворяемое вещество растворится в растворителе, свойства растворителя и растворяемого вещества меняются, а сам раствор принимает однородное агрегатное состояние. Ниже описаны примеры растворителей и растворов, которые мы часто используем в быту.
Чаще всего с увеличением температуры повышается и возможная концентрация растворяемого вещества, хотя для некоторых веществ эта зависимость — обратная. Растворы с большой концентрацией растворенного вещества называют концентрированными растворами, а вещества с низкой концентрацией — наоборот, слабыми растворами. После того, как растворяемое вещество растворится в растворителе, свойства растворителя и растворяемого вещества меняются, а сам раствор принимает однородное агрегатное состояние. Ниже описаны примеры растворителей и растворов, которые мы часто используем в быту.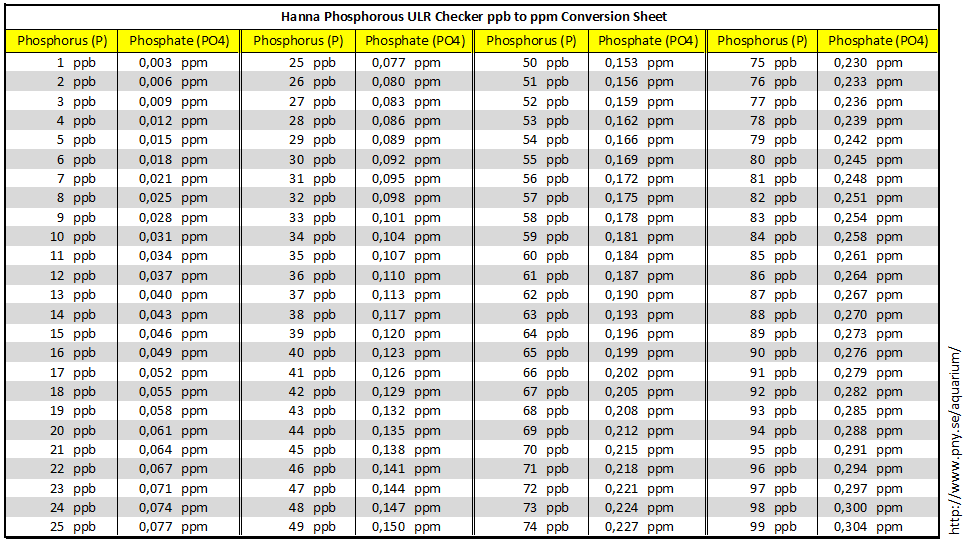 В этой статье мы рассмотрим только растворители.
В этой статье мы рассмотрим только растворители. Обычно эти растворители — жидкости, так же как и при обычной стирке, но химчистка отличается тем, что это более щадящий процесс. Растворители обычно настолько сильны, что могут растворить пуговицы и декоративные элементы из пластмассы, например пайетки. Чтобы их не испортить, их либо закрывают защитным материалом, либо отпарывают, а потом пришивают после чистки. Одежду промывают дистиллированным растворителем, который после этого убирают с помощью центрифугирования и испарения. Цикл чистки происходит при низкой температуре, до 30°C. Во время цикла сушки одежду сушат горячим воздухом при 60–63°C, чтобы испарить растворитель, оставшийся после отжима.
Обычно эти растворители — жидкости, так же как и при обычной стирке, но химчистка отличается тем, что это более щадящий процесс. Растворители обычно настолько сильны, что могут растворить пуговицы и декоративные элементы из пластмассы, например пайетки. Чтобы их не испортить, их либо закрывают защитным материалом, либо отпарывают, а потом пришивают после чистки. Одежду промывают дистиллированным растворителем, который после этого убирают с помощью центрифугирования и испарения. Цикл чистки происходит при низкой температуре, до 30°C. Во время цикла сушки одежду сушат горячим воздухом при 60–63°C, чтобы испарить растворитель, оставшийся после отжима.
 При снятии накладных ногтей без ацетона не обойтись — он растворяет их так же, как и лак для ногтей.
При снятии накладных ногтей без ацетона не обойтись — он растворяет их так же, как и лак для ногтей. С растворителями нужно обращаться аккуратно, и следовать правилам безопасности в инструкциях об их использовании, хранении, и переработке. Например, в большинстве случаев работы с растворителями необходимо защищать глаза, кожу и слизистые оболочки перчатками, защитными очками, и респиратором. К тому же, растворители очень горючи, и опасно оставлять их в баллонах и контейнерах, даже в очень маленьких количествах. Именно поэтому пустые банки, баллоны и контейнеры от растворителей хранят дном вверх. При переработке и утилизации растворителей необходимо вначале ознакомиться с правилами их утилизации, принятыми в данном населенном пункте или стране, чтобы избежать загрязнения окружающей среды.
С растворителями нужно обращаться аккуратно, и следовать правилам безопасности в инструкциях об их использовании, хранении, и переработке. Например, в большинстве случаев работы с растворителями необходимо защищать глаза, кожу и слизистые оболочки перчатками, защитными очками, и респиратором. К тому же, растворители очень горючи, и опасно оставлять их в баллонах и контейнерах, даже в очень маленьких количествах. Именно поэтому пустые банки, баллоны и контейнеры от растворителей хранят дном вверх. При переработке и утилизации растворителей необходимо вначале ознакомиться с правилами их утилизации, принятыми в данном населенном пункте или стране, чтобы избежать загрязнения окружающей среды.
 Концентрацией растворённого вещества называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л).
Концентрацией растворённого вещества называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л). », то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах. com на YouTube
com на YouTube
 )фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл
)фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл Растворы широко используют в медицине, косметике, кулинарии, в красителях и красках и в чистящих средствах. В домашних чистящих средствах часто содержатся растворы. Нередко и сам растворитель образует раствор с загрязнениями. Многие напитки — тоже растворы. Важно иметь возможность отрегулировать концентрацию веществ в растворах, так как концентрация влияет на свойства раствора. В этом конвертере мы поговорим о концентрации по массе, хотя можно также измерять концентрацию по объему или в процентах. Чтобы определить концентрацию по массе, необходимо разделить общую массу растворенного вещества на объем всего раствора. Эту величину легко перевести в концентрацию в процентах, умножив ее на 100%.
Растворы широко используют в медицине, косметике, кулинарии, в красителях и красках и в чистящих средствах. В домашних чистящих средствах часто содержатся растворы. Нередко и сам растворитель образует раствор с загрязнениями. Многие напитки — тоже растворы. Важно иметь возможность отрегулировать концентрацию веществ в растворах, так как концентрация влияет на свойства раствора. В этом конвертере мы поговорим о концентрации по массе, хотя можно также измерять концентрацию по объему или в процентах. Чтобы определить концентрацию по массе, необходимо разделить общую массу растворенного вещества на объем всего раствора. Эту величину легко перевести в концентрацию в процентах, умножив ее на 100%. Кроме этого можно получить коллоидную систему, похожую на раствор, но полупрозрачную, или непрозрачную смесь, в которой присутствуют частицы, большего размера, чем частицы в растворе — суспензию. Частицы в ней еще больше, и они отделяются от остальной смеси, то есть оседают, если суспензию оставить в состоянии покоя на определенное время. Молоко и кровь — примеры коллоидных систем, а воздух с частицами пыли или морская вода после шторма с частицами ила и песка — примеры суспензий.
Кроме этого можно получить коллоидную систему, похожую на раствор, но полупрозрачную, или непрозрачную смесь, в которой присутствуют частицы, большего размера, чем частицы в растворе — суспензию. Частицы в ней еще больше, и они отделяются от остальной смеси, то есть оседают, если суспензию оставить в состоянии покоя на определенное время. Молоко и кровь — примеры коллоидных систем, а воздух с частицами пыли или морская вода после шторма с частицами ила и песка — примеры суспензий. Чаще всего с увеличением температуры повышается и возможная концентрация растворяемого вещества, хотя для некоторых веществ эта зависимость — обратная. Растворы с большой концентрацией растворенного вещества называют концентрированными растворами, а вещества с низкой концентрацией — наоборот, слабыми растворами. После того, как растворяемое вещество растворится в растворителе, свойства растворителя и растворяемого вещества меняются, а сам раствор принимает однородное агрегатное состояние. Ниже описаны примеры растворителей и растворов, которые мы часто используем в быту.
Чаще всего с увеличением температуры повышается и возможная концентрация растворяемого вещества, хотя для некоторых веществ эта зависимость — обратная. Растворы с большой концентрацией растворенного вещества называют концентрированными растворами, а вещества с низкой концентрацией — наоборот, слабыми растворами. После того, как растворяемое вещество растворится в растворителе, свойства растворителя и растворяемого вещества меняются, а сам раствор принимает однородное агрегатное состояние. Ниже описаны примеры растворителей и растворов, которые мы часто используем в быту. В этой статье мы рассмотрим только растворители.
В этой статье мы рассмотрим только растворители. Обычно эти растворители — жидкости, так же как и при обычной стирке, но химчистка отличается тем, что это более щадящий процесс. Растворители обычно настолько сильны, что могут растворить пуговицы и декоративные элементы из пластмассы, например пайетки. Чтобы их не испортить, их либо закрывают защитным материалом, либо отпарывают, а потом пришивают после чистки. Одежду промывают дистиллированным растворителем, который после этого убирают с помощью центрифугирования и испарения. Цикл чистки происходит при низкой температуре, до 30°C. Во время цикла сушки одежду сушат горячим воздухом при 60–63°C, чтобы испарить растворитель, оставшийся после отжима.
Обычно эти растворители — жидкости, так же как и при обычной стирке, но химчистка отличается тем, что это более щадящий процесс. Растворители обычно настолько сильны, что могут растворить пуговицы и декоративные элементы из пластмассы, например пайетки. Чтобы их не испортить, их либо закрывают защитным материалом, либо отпарывают, а потом пришивают после чистки. Одежду промывают дистиллированным растворителем, который после этого убирают с помощью центрифугирования и испарения. Цикл чистки происходит при низкой температуре, до 30°C. Во время цикла сушки одежду сушат горячим воздухом при 60–63°C, чтобы испарить растворитель, оставшийся после отжима.
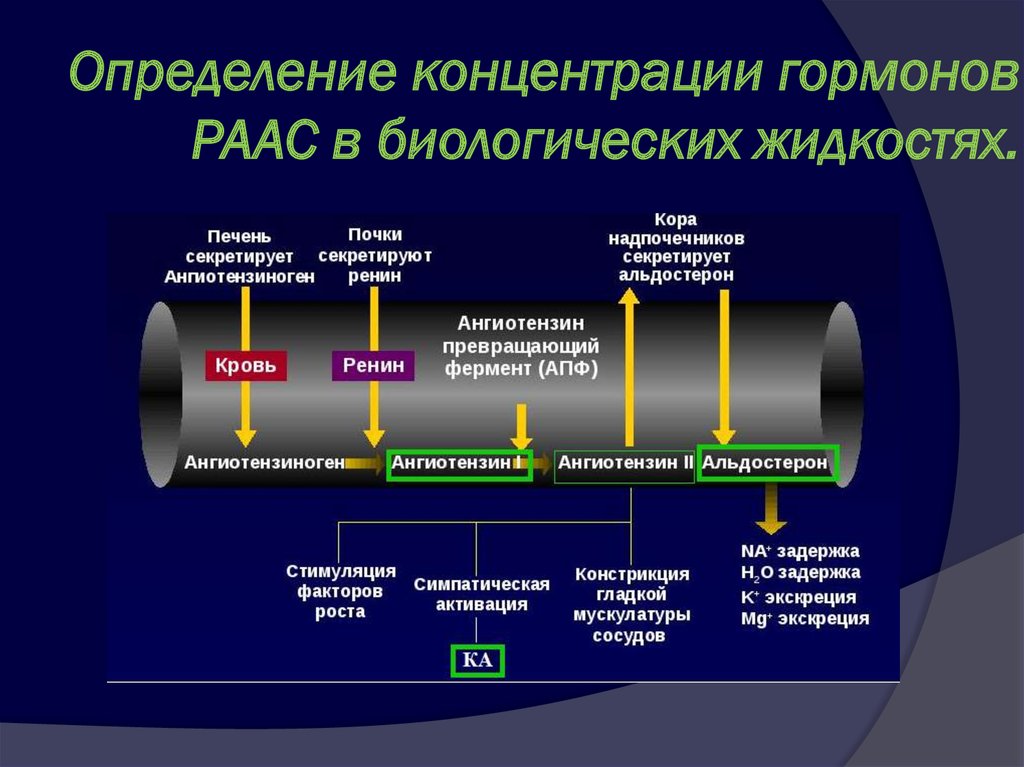 При снятии накладных ногтей без ацетона не обойтись — он растворяет их так же, как и лак для ногтей.
При снятии накладных ногтей без ацетона не обойтись — он растворяет их так же, как и лак для ногтей. С растворителями нужно обращаться аккуратно, и следовать правилам безопасности в инструкциях об их использовании, хранении, и переработке. Например, в большинстве случаев работы с растворителями необходимо защищать глаза, кожу и слизистые оболочки перчатками, защитными очками, и респиратором. К тому же, растворители очень горючи, и опасно оставлять их в баллонах и контейнерах, даже в очень маленьких количествах. Именно поэтому пустые банки, баллоны и контейнеры от растворителей хранят дном вверх. При переработке и утилизации растворителей необходимо вначале ознакомиться с правилами их утилизации, принятыми в данном населенном пункте или стране, чтобы избежать загрязнения окружающей среды.
С растворителями нужно обращаться аккуратно, и следовать правилам безопасности в инструкциях об их использовании, хранении, и переработке. Например, в большинстве случаев работы с растворителями необходимо защищать глаза, кожу и слизистые оболочки перчатками, защитными очками, и респиратором. К тому же, растворители очень горючи, и опасно оставлять их в баллонах и контейнерах, даже в очень маленьких количествах. Именно поэтому пустые банки, баллоны и контейнеры от растворителей хранят дном вверх. При переработке и утилизации растворителей необходимо вначале ознакомиться с правилами их утилизации, принятыми в данном населенном пункте или стране, чтобы избежать загрязнения окружающей среды.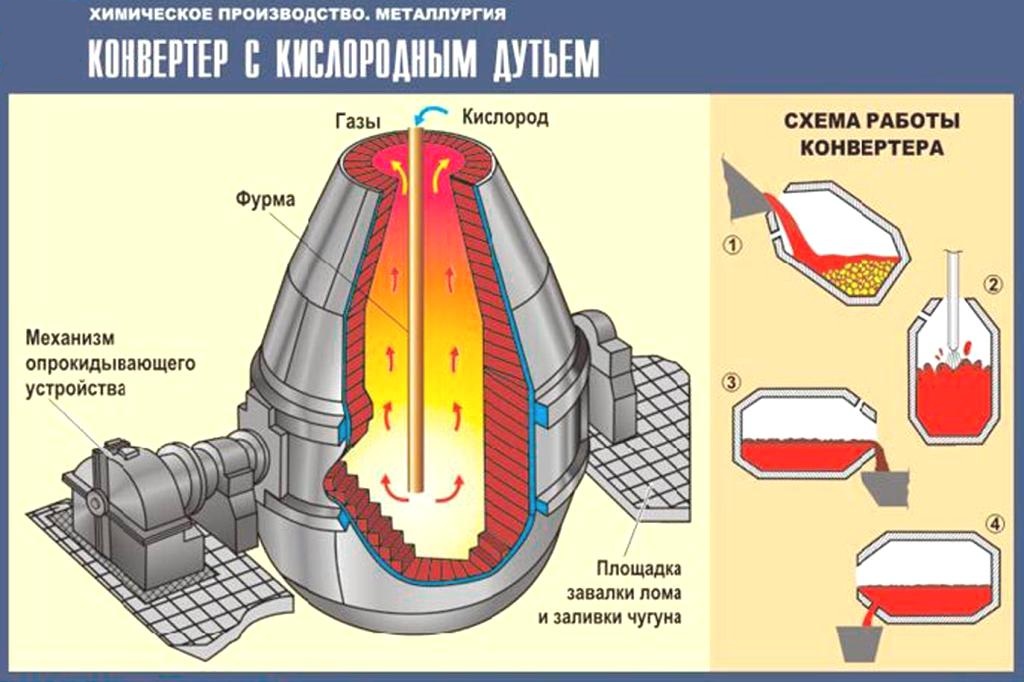 Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ. Концентрацией растворённого вещества называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л).
Концентрацией растворённого вещества называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л). », то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах. com на YouTube
com на YouTube единицахКонвертер магнитодвижущей силыКонвертер напряженности магнитного поляКонвертер магнитного потокаКонвертер магнитной индукцииРадиация. Конвертер мощности поглощенной дозы ионизирующего излученияРадиоактивность. Конвертер радиоактивного распадаРадиация. Конвертер экспозиционной дозыРадиация. Конвертер поглощённой дозыКонвертер десятичных приставокПередача данныхКонвертер единиц типографики и обработки изображенийКонвертер единиц измерения объема лесоматериаловВычисление молярной массыПериодическая система химических элементов Д. И. Менделеева
единицахКонвертер магнитодвижущей силыКонвертер напряженности магнитного поляКонвертер магнитного потокаКонвертер магнитной индукцииРадиация. Конвертер мощности поглощенной дозы ионизирующего излученияРадиоактивность. Конвертер радиоактивного распадаРадиация. Конвертер экспозиционной дозыРадиация. Конвертер поглощённой дозыКонвертер десятичных приставокПередача данныхКонвертер единиц типографики и обработки изображенийКонвертер единиц измерения объема лесоматериаловВычисление молярной массыПериодическая система химических элементов Д. И. Менделеева )фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл
)фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл Также растворы стабильны, то есть все компоненты в них — в одном агрегатном состоянии, например в виде жидкости. Растворы широко используют в медицине, косметике, кулинарии, в красителях и красках и в чистящих средствах. В домашних чистящих средствах часто содержатся растворы. Нередко и сам растворитель образует раствор с загрязнениями. Многие напитки — тоже растворы. Важно иметь возможность отрегулировать концентрацию веществ в растворах, так как концентрация влияет на свойства раствора. В этом конвертере мы поговорим о концентрации по массе, хотя можно также измерять концентрацию по объему или в процентах. Чтобы определить концентрацию по массе, необходимо разделить общую массу растворенного вещества на объем всего раствора. Эту величину легко перевести в концентрацию в процентах, умножив ее на 100%.
Также растворы стабильны, то есть все компоненты в них — в одном агрегатном состоянии, например в виде жидкости. Растворы широко используют в медицине, косметике, кулинарии, в красителях и красках и в чистящих средствах. В домашних чистящих средствах часто содержатся растворы. Нередко и сам растворитель образует раствор с загрязнениями. Многие напитки — тоже растворы. Важно иметь возможность отрегулировать концентрацию веществ в растворах, так как концентрация влияет на свойства раствора. В этом конвертере мы поговорим о концентрации по массе, хотя можно также измерять концентрацию по объему или в процентах. Чтобы определить концентрацию по массе, необходимо разделить общую массу растворенного вещества на объем всего раствора. Эту величину легко перевести в концентрацию в процентах, умножив ее на 100%. Раствор — только один из этих типов. Кроме этого можно получить коллоидную систему, похожую на раствор, но полупрозрачную, или непрозрачную смесь, в которой присутствуют частицы, большего размера, чем частицы в растворе — суспензию. Частицы в ней еще больше, и они отделяются от остальной смеси, то есть оседают, если суспензию оставить в состоянии покоя на определенное время. Молоко и кровь — примеры коллоидных систем, а воздух с частицами пыли или морская вода после шторма с частицами ила и песка — примеры суспензий.
Раствор — только один из этих типов. Кроме этого можно получить коллоидную систему, похожую на раствор, но полупрозрачную, или непрозрачную смесь, в которой присутствуют частицы, большего размера, чем частицы в растворе — суспензию. Частицы в ней еще больше, и они отделяются от остальной смеси, то есть оседают, если суспензию оставить в состоянии покоя на определенное время. Молоко и кровь — примеры коллоидных систем, а воздух с частицами пыли или морская вода после шторма с частицами ила и песка — примеры суспензий. Чаще всего с увеличением температуры повышается и возможная концентрация растворяемого вещества, хотя для некоторых веществ эта зависимость — обратная. Растворы с большой концентрацией растворенного вещества называют концентрированными растворами, а вещества с низкой концентрацией — наоборот, слабыми растворами. После того, как растворяемое вещество растворится в растворителе, свойства растворителя и растворяемого вещества меняются, а сам раствор принимает однородное агрегатное состояние. Ниже описаны примеры растворителей и растворов, которые мы часто используем в быту.
Чаще всего с увеличением температуры повышается и возможная концентрация растворяемого вещества, хотя для некоторых веществ эта зависимость — обратная. Растворы с большой концентрацией растворенного вещества называют концентрированными растворами, а вещества с низкой концентрацией — наоборот, слабыми растворами. После того, как растворяемое вещество растворится в растворителе, свойства растворителя и растворяемого вещества меняются, а сам раствор принимает однородное агрегатное состояние. Ниже описаны примеры растворителей и растворов, которые мы часто используем в быту. В этой статье мы рассмотрим только растворители.
В этой статье мы рассмотрим только растворители. Обычно эти растворители — жидкости, так же как и при обычной стирке, но химчистка отличается тем, что это более щадящий процесс. Растворители обычно настолько сильны, что могут растворить пуговицы и декоративные элементы из пластмассы, например пайетки. Чтобы их не испортить, их либо закрывают защитным материалом, либо отпарывают, а потом пришивают после чистки. Одежду промывают дистиллированным растворителем, который после этого убирают с помощью центрифугирования и испарения. Цикл чистки происходит при низкой температуре, до 30°C. Во время цикла сушки одежду сушат горячим воздухом при 60–63°C, чтобы испарить растворитель, оставшийся после отжима.
Обычно эти растворители — жидкости, так же как и при обычной стирке, но химчистка отличается тем, что это более щадящий процесс. Растворители обычно настолько сильны, что могут растворить пуговицы и декоративные элементы из пластмассы, например пайетки. Чтобы их не испортить, их либо закрывают защитным материалом, либо отпарывают, а потом пришивают после чистки. Одежду промывают дистиллированным растворителем, который после этого убирают с помощью центрифугирования и испарения. Цикл чистки происходит при низкой температуре, до 30°C. Во время цикла сушки одежду сушат горячим воздухом при 60–63°C, чтобы испарить растворитель, оставшийся после отжима.
 При снятии накладных ногтей без ацетона не обойтись — он растворяет их так же, как и лак для ногтей.
При снятии накладных ногтей без ацетона не обойтись — он растворяет их так же, как и лак для ногтей.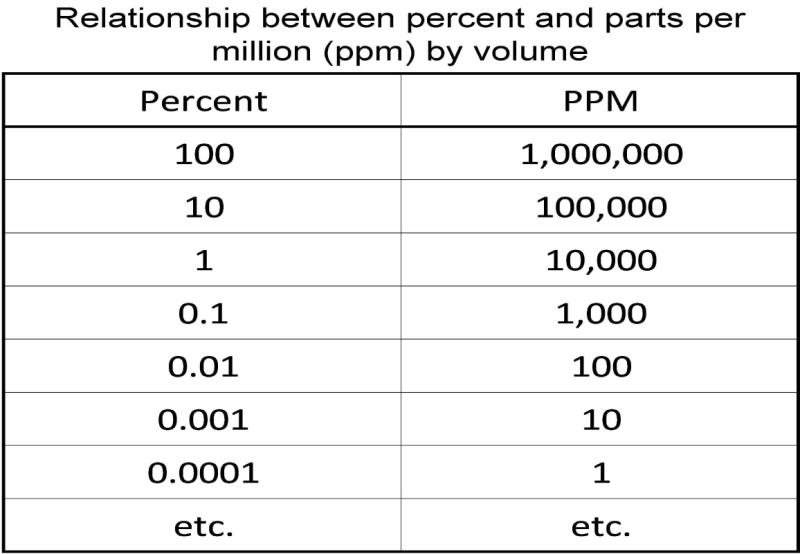 С растворителями нужно обращаться аккуратно, и следовать правилам безопасности в инструкциях об их использовании, хранении, и переработке. Например, в большинстве случаев работы с растворителями необходимо защищать глаза, кожу и слизистые оболочки перчатками, защитными очками, и респиратором. К тому же, растворители очень горючи, и опасно оставлять их в баллонах и контейнерах, даже в очень маленьких количествах. Именно поэтому пустые банки, баллоны и контейнеры от растворителей хранят дном вверх. При переработке и утилизации растворителей необходимо вначале ознакомиться с правилами их утилизации, принятыми в данном населенном пункте или стране, чтобы избежать загрязнения окружающей среды.
С растворителями нужно обращаться аккуратно, и следовать правилам безопасности в инструкциях об их использовании, хранении, и переработке. Например, в большинстве случаев работы с растворителями необходимо защищать глаза, кожу и слизистые оболочки перчатками, защитными очками, и респиратором. К тому же, растворители очень горючи, и опасно оставлять их в баллонах и контейнерах, даже в очень маленьких количествах. Именно поэтому пустые банки, баллоны и контейнеры от растворителей хранят дном вверх. При переработке и утилизации растворителей необходимо вначале ознакомиться с правилами их утилизации, принятыми в данном населенном пункте или стране, чтобы избежать загрязнения окружающей среды. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ. Концентрацией растворённого вещества называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л).
Концентрацией растворённого вещества называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л). », то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах. com на YouTube
com на YouTube единицахКонвертер магнитодвижущей силыКонвертер напряженности магнитного поляКонвертер магнитного потокаКонвертер магнитной индукцииРадиация. Конвертер мощности поглощенной дозы ионизирующего излученияРадиоактивность. Конвертер радиоактивного распадаРадиация. Конвертер экспозиционной дозыРадиация. Конвертер поглощённой дозыКонвертер десятичных приставокПередача данныхКонвертер единиц типографики и обработки изображенийКонвертер единиц измерения объема лесоматериаловВычисление молярной массыПериодическая система химических элементов Д. И. Менделеева
единицахКонвертер магнитодвижущей силыКонвертер напряженности магнитного поляКонвертер магнитного потокаКонвертер магнитной индукцииРадиация. Конвертер мощности поглощенной дозы ионизирующего излученияРадиоактивность. Конвертер радиоактивного распадаРадиация. Конвертер экспозиционной дозыРадиация. Конвертер поглощённой дозыКонвертер десятичных приставокПередача данныхКонвертер единиц типографики и обработки изображенийКонвертер единиц измерения объема лесоматериаловВычисление молярной массыПериодическая система химических элементов Д. И. Менделеева )фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл
)фунт на галлон (США)фунт на галлон (брит.)миллионная фунта на галлон (США)фунт на миллион галлонов (брит.)фунт на кубический футкилограмм на куб. метрграмм на 100 мл Растворы широко используют в медицине, косметике, кулинарии, в красителях и красках и в чистящих средствах. В домашних чистящих средствах часто содержатся растворы. Нередко и сам растворитель образует раствор с загрязнениями. Многие напитки — тоже растворы. Важно иметь возможность отрегулировать концентрацию веществ в растворах, так как концентрация влияет на свойства раствора. В этом конвертере мы поговорим о концентрации по массе, хотя можно также измерять концентрацию по объему или в процентах. Чтобы определить концентрацию по массе, необходимо разделить общую массу растворенного вещества на объем всего раствора. Эту величину легко перевести в концентрацию в процентах, умножив ее на 100%.
Растворы широко используют в медицине, косметике, кулинарии, в красителях и красках и в чистящих средствах. В домашних чистящих средствах часто содержатся растворы. Нередко и сам растворитель образует раствор с загрязнениями. Многие напитки — тоже растворы. Важно иметь возможность отрегулировать концентрацию веществ в растворах, так как концентрация влияет на свойства раствора. В этом конвертере мы поговорим о концентрации по массе, хотя можно также измерять концентрацию по объему или в процентах. Чтобы определить концентрацию по массе, необходимо разделить общую массу растворенного вещества на объем всего раствора. Эту величину легко перевести в концентрацию в процентах, умножив ее на 100%. Кроме этого можно получить коллоидную систему, похожую на раствор, но полупрозрачную, или непрозрачную смесь, в которой присутствуют частицы, большего размера, чем частицы в растворе — суспензию. Частицы в ней еще больше, и они отделяются от остальной смеси, то есть оседают, если суспензию оставить в состоянии покоя на определенное время. Молоко и кровь — примеры коллоидных систем, а воздух с частицами пыли или морская вода после шторма с частицами ила и песка — примеры суспензий.
Кроме этого можно получить коллоидную систему, похожую на раствор, но полупрозрачную, или непрозрачную смесь, в которой присутствуют частицы, большего размера, чем частицы в растворе — суспензию. Частицы в ней еще больше, и они отделяются от остальной смеси, то есть оседают, если суспензию оставить в состоянии покоя на определенное время. Молоко и кровь — примеры коллоидных систем, а воздух с частицами пыли или морская вода после шторма с частицами ила и песка — примеры суспензий. Чаще всего с увеличением температуры повышается и возможная концентрация растворяемого вещества, хотя для некоторых веществ эта зависимость — обратная. Растворы с большой концентрацией растворенного вещества называют концентрированными растворами, а вещества с низкой концентрацией — наоборот, слабыми растворами. После того, как растворяемое вещество растворится в растворителе, свойства растворителя и растворяемого вещества меняются, а сам раствор принимает однородное агрегатное состояние. Ниже описаны примеры растворителей и растворов, которые мы часто используем в быту.
Чаще всего с увеличением температуры повышается и возможная концентрация растворяемого вещества, хотя для некоторых веществ эта зависимость — обратная. Растворы с большой концентрацией растворенного вещества называют концентрированными растворами, а вещества с низкой концентрацией — наоборот, слабыми растворами. После того, как растворяемое вещество растворится в растворителе, свойства растворителя и растворяемого вещества меняются, а сам раствор принимает однородное агрегатное состояние. Ниже описаны примеры растворителей и растворов, которые мы часто используем в быту. В этой статье мы рассмотрим только растворители.
В этой статье мы рассмотрим только растворители.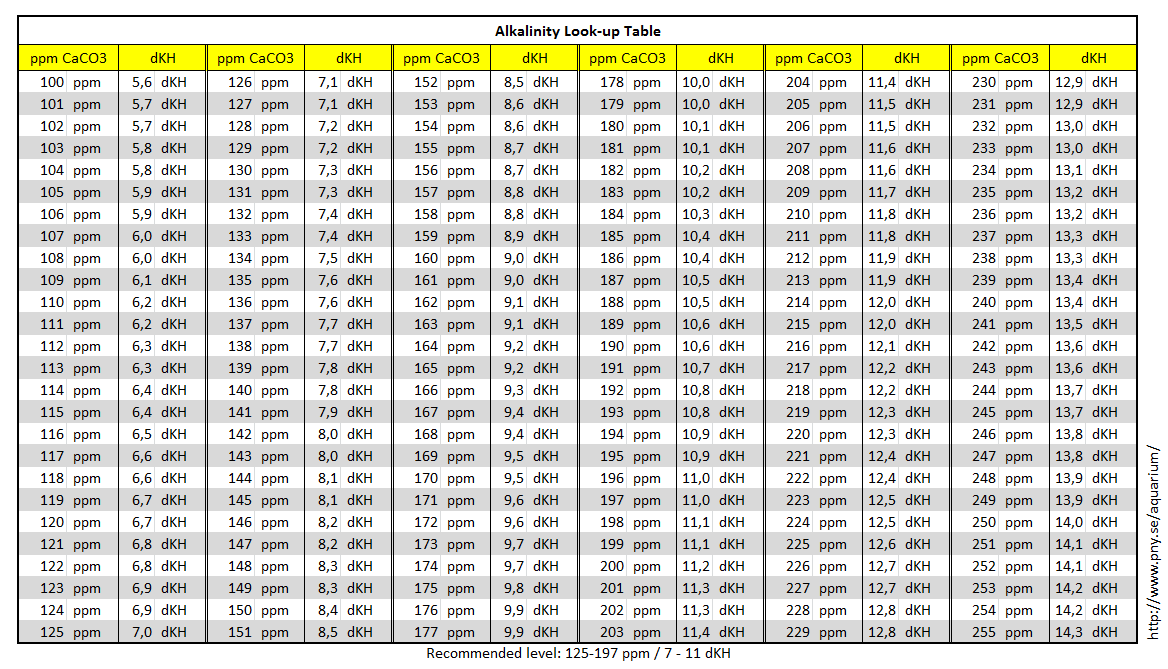 Обычно эти растворители — жидкости, так же как и при обычной стирке, но химчистка отличается тем, что это более щадящий процесс. Растворители обычно настолько сильны, что могут растворить пуговицы и декоративные элементы из пластмассы, например пайетки. Чтобы их не испортить, их либо закрывают защитным материалом, либо отпарывают, а потом пришивают после чистки. Одежду промывают дистиллированным растворителем, который после этого убирают с помощью центрифугирования и испарения. Цикл чистки происходит при низкой температуре, до 30°C. Во время цикла сушки одежду сушат горячим воздухом при 60–63°C, чтобы испарить растворитель, оставшийся после отжима.
Обычно эти растворители — жидкости, так же как и при обычной стирке, но химчистка отличается тем, что это более щадящий процесс. Растворители обычно настолько сильны, что могут растворить пуговицы и декоративные элементы из пластмассы, например пайетки. Чтобы их не испортить, их либо закрывают защитным материалом, либо отпарывают, а потом пришивают после чистки. Одежду промывают дистиллированным растворителем, который после этого убирают с помощью центрифугирования и испарения. Цикл чистки происходит при низкой температуре, до 30°C. Во время цикла сушки одежду сушат горячим воздухом при 60–63°C, чтобы испарить растворитель, оставшийся после отжима.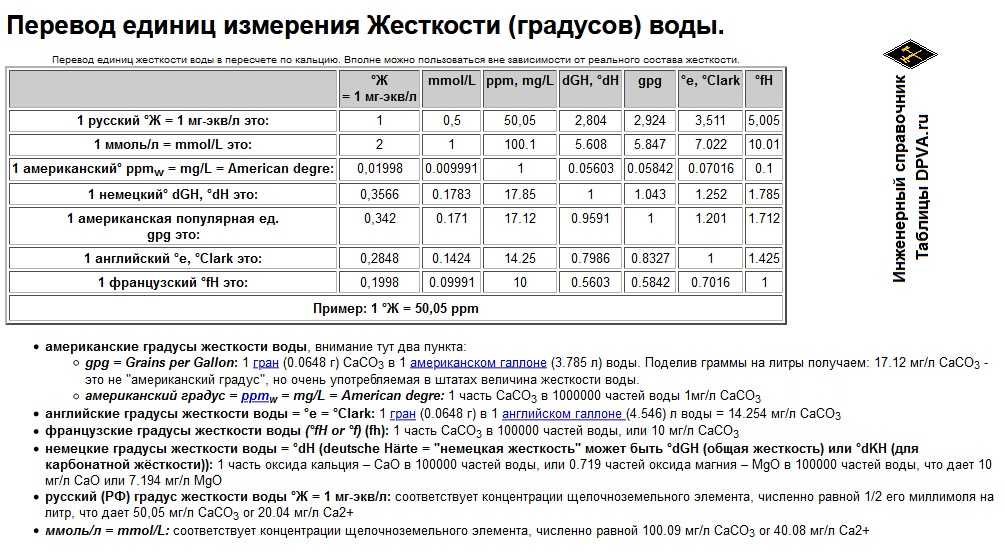
 При снятии накладных ногтей без ацетона не обойтись — он растворяет их так же, как и лак для ногтей.
При снятии накладных ногтей без ацетона не обойтись — он растворяет их так же, как и лак для ногтей. С растворителями нужно обращаться аккуратно, и следовать правилам безопасности в инструкциях об их использовании, хранении, и переработке. Например, в большинстве случаев работы с растворителями необходимо защищать глаза, кожу и слизистые оболочки перчатками, защитными очками, и респиратором. К тому же, растворители очень горючи, и опасно оставлять их в баллонах и контейнерах, даже в очень маленьких количествах. Именно поэтому пустые банки, баллоны и контейнеры от растворителей хранят дном вверх. При переработке и утилизации растворителей необходимо вначале ознакомиться с правилами их утилизации, принятыми в данном населенном пункте или стране, чтобы избежать загрязнения окружающей среды.
С растворителями нужно обращаться аккуратно, и следовать правилам безопасности в инструкциях об их использовании, хранении, и переработке. Например, в большинстве случаев работы с растворителями необходимо защищать глаза, кожу и слизистые оболочки перчатками, защитными очками, и респиратором. К тому же, растворители очень горючи, и опасно оставлять их в баллонах и контейнерах, даже в очень маленьких количествах. Именно поэтому пустые банки, баллоны и контейнеры от растворителей хранят дном вверх. При переработке и утилизации растворителей необходимо вначале ознакомиться с правилами их утилизации, принятыми в данном населенном пункте или стране, чтобы избежать загрязнения окружающей среды. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ. Концентрацией растворённого вещества называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л).
Концентрацией растворённого вещества называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л). », то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.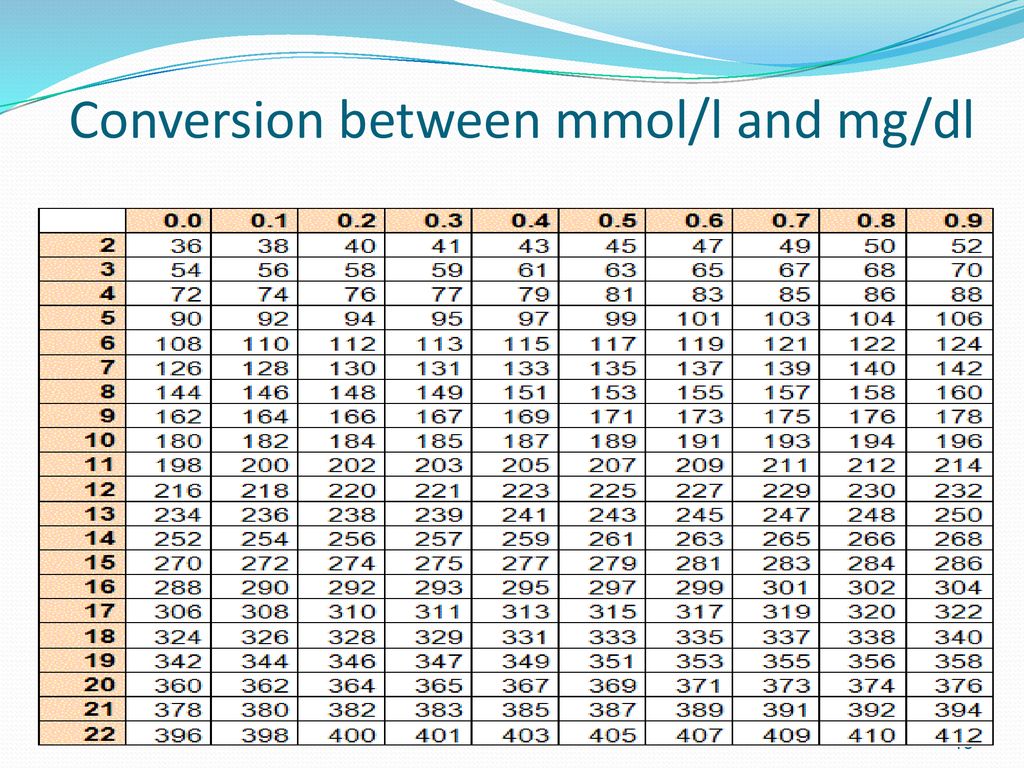 com на YouTube
com на YouTube Преобразователь радиоактивного распадаПреобразователь радиационного воздействияИзлучение. Конвертер поглощенной дозыКонвертер метрических префиксовКонвертер передачи данныхКонвертер типографских и цифровых изображенийКонвертер единиц измерения объема пиломатериаловКалькулятор молярной массыПериодическая таблица
Преобразователь радиоактивного распадаПреобразователь радиационного воздействияИзлучение. Конвертер поглощенной дозыКонвертер метрических префиксовКонвертер передачи данныхКонвертер типографских и цифровых изображенийКонвертер единиц измерения объема пиломатериаловКалькулятор молярной массыПериодическая таблица количество атомов, как в 12 граммах углерода-12, или, точнее, 6×10²³ атомов.
количество атомов, как в 12 граммах углерода-12, или, точнее, 6×10²³ атомов. В противном случае нам пришлось бы использовать либо очень большие числа, либо очень малые величины (для массы или веса), с которыми трудно работать и которые невозможно измерить с помощью доступных в настоящее время измерительных устройств. Элементарными частицами, наиболее часто используемыми при работе с молями, являются атомы. Мы также можем использовать моли для измерения других частиц, таких как молекулы или электроны, но нам нужно указать, какие частицы используются в этом случае. Молярную концентрацию также иногда называют молярность .
В противном случае нам пришлось бы использовать либо очень большие числа, либо очень малые величины (для массы или веса), с которыми трудно работать и которые невозможно измерить с помощью доступных в настоящее время измерительных устройств. Элементарными частицами, наиболее часто используемыми при работе с молями, являются атомы. Мы также можем использовать моли для измерения других частиц, таких как молекулы или электроны, но нам нужно указать, какие частицы используются в этом случае. Молярную концентрацию также иногда называют молярность .
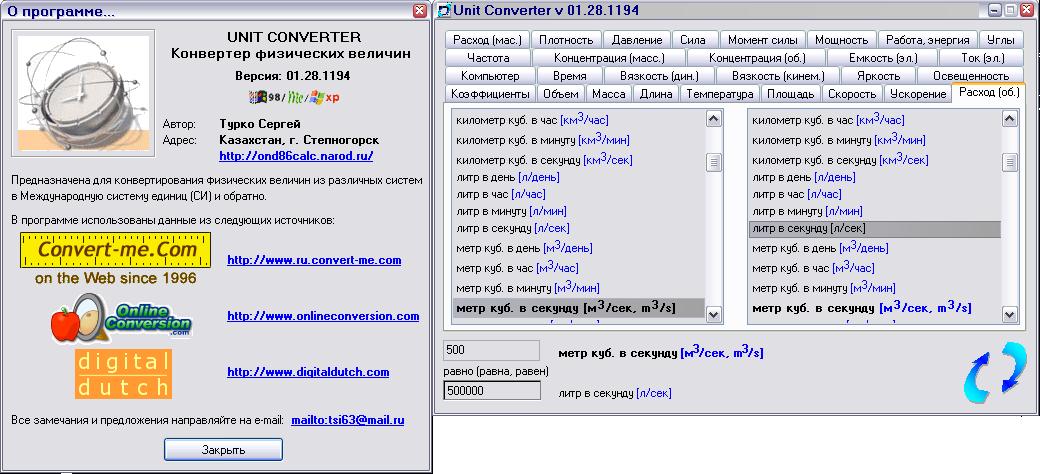
 грамм. Нам дали 51 грамм соды. Найдем, сколько у нас молей, разделив общее количество 51 грамма на количество граммов в одном моле, или 84 грамма. Получаем около 0,6 моль.
грамм. Нам дали 51 грамм соды. Найдем, сколько у нас молей, разделив общее количество 51 грамма на количество граммов в одном моле, или 84 грамма. Получаем около 0,6 моль. моль/литр.
моль/литр. Затем нам нужно будет сбалансировать уравнение, чтобы узнать результирующий продукт, а затем использовать периодическую таблицу, как описано выше, чтобы найти необходимую информацию для расчета молярной концентрации. В этом случае мы можем сделать и обратное, если знаем молярную концентрацию.
Затем нам нужно будет сбалансировать уравнение, чтобы узнать результирующий продукт, а затем использовать периодическую таблицу, как описано выше, чтобы найти необходимую информацию для расчета молярной концентрации. В этом случае мы можем сделать и обратное, если знаем молярную концентрацию. Концентрация может быть меньше, в зависимости от производителя и страны происхождения, потому что стандартными в разных странах считаются разные концентрации. Нам не нужно беспокоиться о воде в этой реакции, потому что вода и пищевая сода не реагируют друг с другом.
Концентрация может быть меньше, в зависимости от производителя и страны происхождения, потому что стандартными в разных странах считаются разные концентрации. Нам не нужно беспокоиться о воде в этой реакции, потому что вода и пищевая сода не реагируют друг с другом.
 Если этого не сделать, различия в осмотической концентрации могут вызвать перемещение жидкости через мембрану и привести к проблемам.
Если этого не сделать, различия в осмотической концентрации могут вызвать перемещение жидкости через мембрану и привести к проблемам. Отток жидкости из клетки будет столь же проблематичным, поскольку будет мешать нормальному функционированию клетки. Поэтому, как правило, желательно, чтобы концентрация жидкости в целевой области тела, такой как кровь, соответствовала концентрации лекарства.
Отток жидкости из клетки будет столь же проблематичным, поскольку будет мешать нормальному функционированию клетки. Поэтому, как правило, желательно, чтобы концентрация жидкости в целевой области тела, такой как кровь, соответствовала концентрации лекарства.
 Моль используется для выражения количества реагентов и продуктов химических реакций. Моль, символ моль, является единицей СИ количества вещества. Один моль содержит ровно 6,02214076×10²³ элементарных частиц. Это число представляет собой фиксированное числовое значение постоянной Авогадро, N A , выраженное в единицах моль⁻¹, и называется числом Авогадро. Количество вещества, символ n системы является мерой количества указанных элементарных объектов. Элементарным объектом может быть атом, молекула, ион, электрон, любая другая частица или определенная группа частиц. Моль — это также количество вещества, которое содержит столько же элементарных частиц, сколько атомов содержится в 12 граммах чистого углерода-12 (¹²C), изотопа углерода с атомным весом 12.
Моль используется для выражения количества реагентов и продуктов химических реакций. Моль, символ моль, является единицей СИ количества вещества. Один моль содержит ровно 6,02214076×10²³ элементарных частиц. Это число представляет собой фиксированное числовое значение постоянной Авогадро, N A , выраженное в единицах моль⁻¹, и называется числом Авогадро. Количество вещества, символ n системы является мерой количества указанных элементарных объектов. Элементарным объектом может быть атом, молекула, ион, электрон, любая другая частица или определенная группа частиц. Моль — это также количество вещества, которое содержит столько же элементарных частиц, сколько атомов содержится в 12 граммах чистого углерода-12 (¹²C), изотопа углерода с атомным весом 12.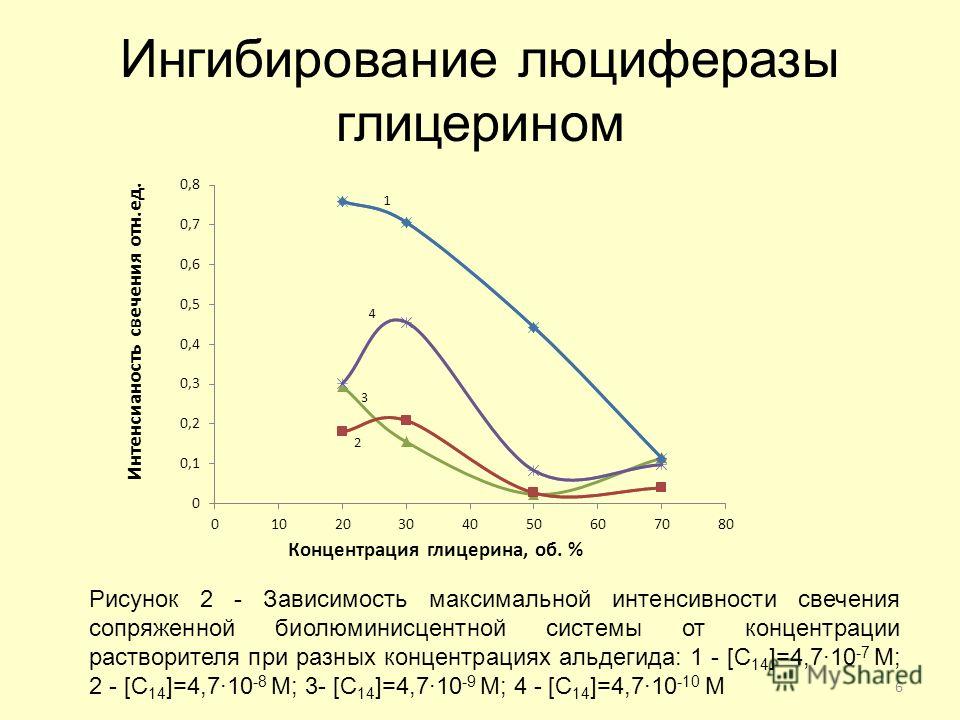
 Преобразователь радиоактивного распадаПреобразователь радиационного воздействияИзлучение. Конвертер поглощенной дозыКонвертер метрических префиксовКонвертер передачи данныхКонвертер типографских и цифровых изображенийКонвертер единиц измерения объема пиломатериаловКалькулятор молярной массыПериодическая таблица
Преобразователь радиоактивного распадаПреобразователь радиационного воздействияИзлучение. Конвертер поглощенной дозыКонвертер метрических префиксовКонвертер передачи данныхКонвертер типографских и цифровых изображенийКонвертер единиц измерения объема пиломатериаловКалькулятор молярной массыПериодическая таблица в 12 граммах углерода-12, или, точнее, в 6×10²³ атомов.
в 12 граммах углерода-12, или, точнее, в 6×10²³ атомов.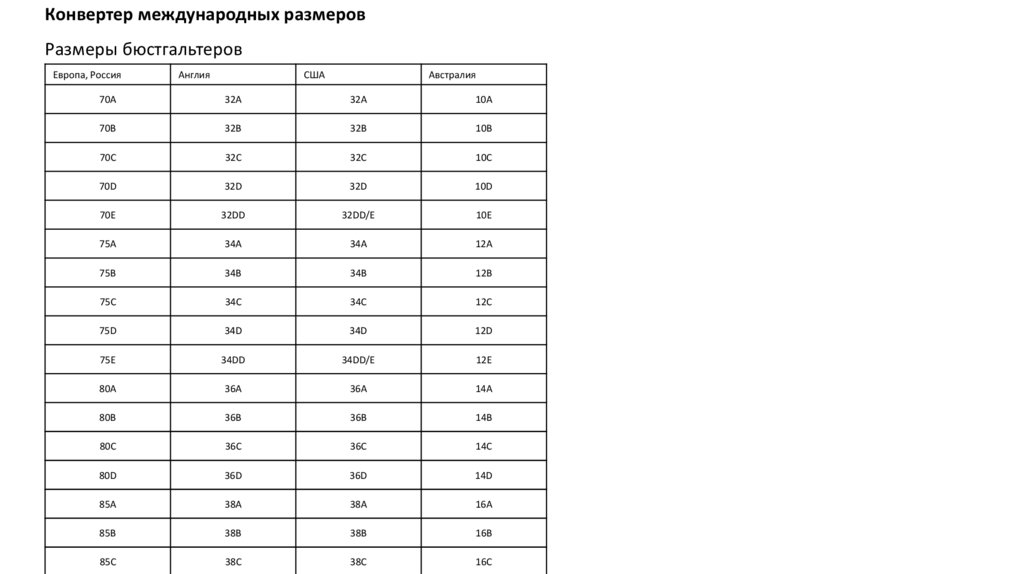 В противном случае нам пришлось бы использовать либо очень большие числа, либо очень малые величины (для массы или веса), с которыми трудно работать и которые невозможно измерить с помощью доступных в настоящее время измерительных устройств. Элементарными частицами, наиболее часто используемыми при работе с молями, являются атомы. Мы также можем использовать моли для измерения других частиц, таких как молекулы или электроны, но нам нужно указать, какие частицы используются в этом случае. Молярную концентрацию также иногда называют молярность .
В противном случае нам пришлось бы использовать либо очень большие числа, либо очень малые величины (для массы или веса), с которыми трудно работать и которые невозможно измерить с помощью доступных в настоящее время измерительных устройств. Элементарными частицами, наиболее часто используемыми при работе с молями, являются атомы. Мы также можем использовать моли для измерения других частиц, таких как молекулы или электроны, но нам нужно указать, какие частицы используются в этом случае. Молярную концентрацию также иногда называют молярность .
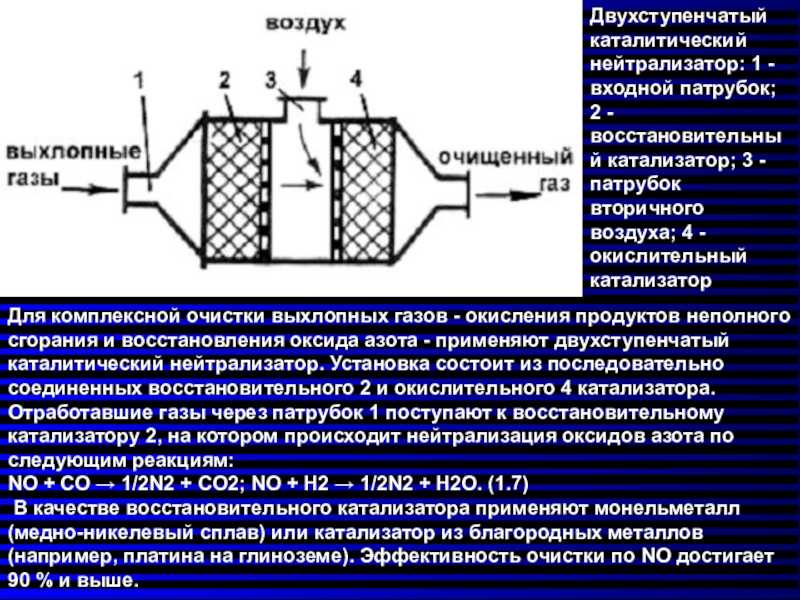
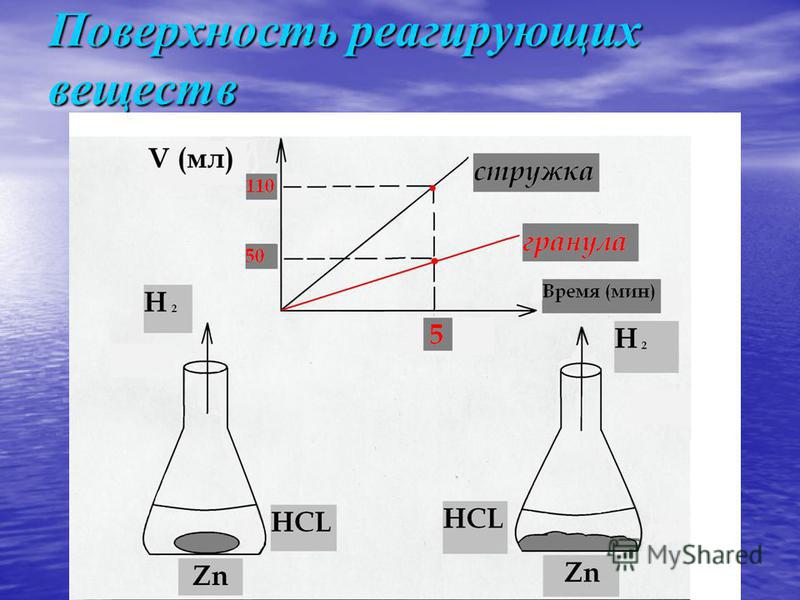
 грамм. Нам дали 51 грамм соды. Найдем, сколько у нас молей, разделив общее количество 51 грамма на количество граммов в одном моле, или 84 грамма. Получаем около 0,6 моль.
грамм. Нам дали 51 грамм соды. Найдем, сколько у нас молей, разделив общее количество 51 грамма на количество граммов в одном моле, или 84 грамма. Получаем около 0,6 моль.