Молярная масса — что это? Как рассчитать? Формулы и примеры
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 1023. Постоянная Авогадро обозначается NA, а измеряется в моль-1.
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 1023 моль-1.
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Запоминаем!
Правильно говорить именно молярная, а не мольная масса.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.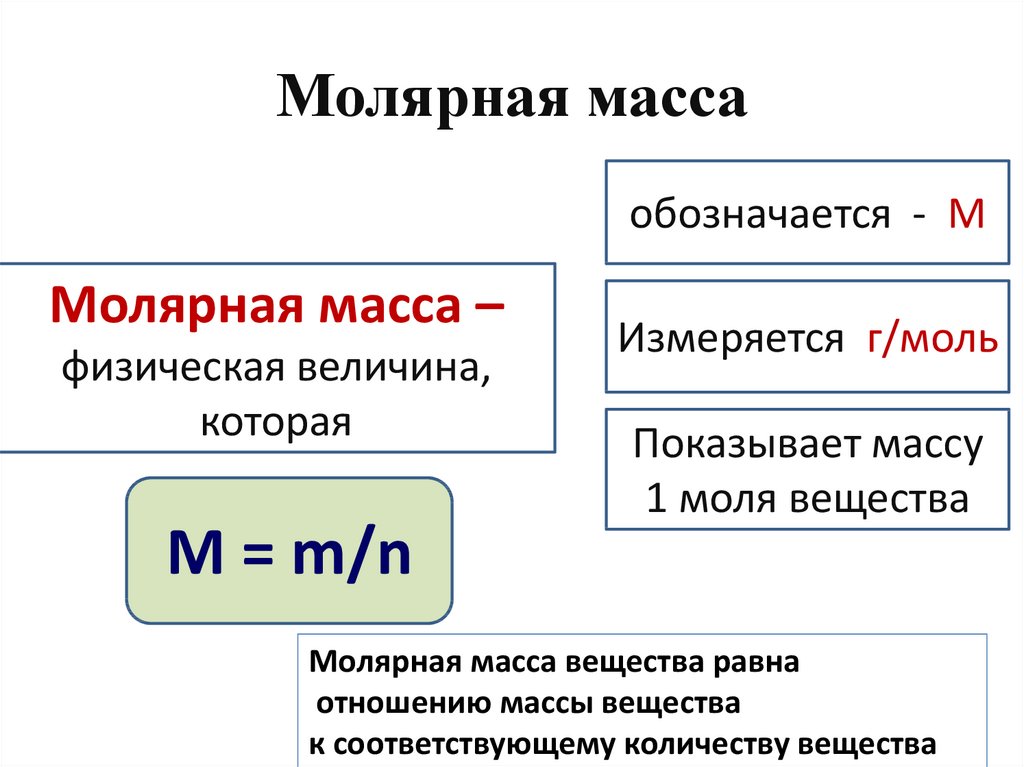
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, A
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Ar(Na) = 23, Ar(N) = 14, Ar(O) = 16.
Mr(NaNO2) = 23 + 14 + 16 · 2 = 69.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Важно
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Учёба без слёз (бесплатный гайд для родителей)
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
, следовательно .
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Воспользуемся формулой .
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Mr(BaSO4) = Ar(Ba) + Ar(S) + Ar(O) · 4 = 137 + 32 + 16 · 4 = 233.
М(BaSO4) = Mr(BaSO4) = 233 г/моль.
Подставим значение молярной массы в формулу:
моль.
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 1023 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
М(CO) = Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 28.
М(H) = Mr(H2) = 2 · Ar(H) = 2 · 1 = 2.
.
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
M(CO2) = Mr(CO2) = 12 + 2 · 16 = 44.
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 1023 молекул. Чему равна молярная масса данного вещества?
Дано:
N(х) = 12,04 · 1023.
m(х) = 300 г.
M(х) = ?
Решение:
Найдем количество вещества моль.
Подставим количество вещества в формулу :
г/моль.
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
Дано:
моль.
Решение:
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
л.
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 1023 атомов кислорода. Какова масса этой порции?
Дано:
N(O) = 8,356 · 1023.
m(SO3) = ?
Решение:
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
, следовательно .
Зная количество молекул, рассчитаем количество вещества:
моль.
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
г.
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 1023 молекул? Назовите это вещество.
Дано:
m(x) = 100 г.
N(x) = 15,05 · 1023.
М(х) = ?
Решение:
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
моль.
Исходя из этого, рассчитаем молярную массу:
г/моль.
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Решение:
Нам требуется вычислить относительную плотность сероводорода по водороду:
.
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
.
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.
Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
Глава 12. Основные понятия и принципы молекулярно-кинетической теории
В задания ЕГЭ по физике всегда включаются задачи, касающиеся основных принципов молекулярно-кинетической теории. Это задачи, связанные с молекулярной структурой газов, жидкостей и твердых тел, с определением температуры, с методами подсчета числа составляющих тело молекул. В этой главе собраны задачи, связанные с понятиями моля и температуры.
В этой главе собраны задачи, связанные с понятиями моля и температуры.
Молем вещества называется такое количество этого вещества, которое содержит приблизительно молекул, причем независимо от того, какое это вещество (точнее ). Приведенное выше число молекул в моле называется числом Авогадро и обозначается как . Как правило, при решении задач считают, что
(12.1) |
Обратим внимание читателя на то, что моль — макроскопическое количество вещества (в переводе с латинского языка — языка средневековой науки — слово moles означает толпа).
Масса одного моля вещества называется молярной массой этого вещества. И поскольку массы молекул разных веществ — разные, а число молекул в моле разных веществ одинаковое, то молярные массы веществ различны. При этом отношение молярных масс двух веществ равно отношению масс их молекул. Поэтому массы молей пропорциональны массам молекул. Число Авогадро (12.1) было подобрано так, чтобы масса моля, выраженная в граммах, численно совпадала с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Поэтому массы молей различных веществ легко найти из периодической системы химических элементов. Например, в таблице находим, что масса молекулы гелия — 4,0026 а.е.м., следовательно, масса моля гелия — 4,0026 4 г, масса двухатомной молекулы кислорода — 31,986 а.е.м., следовательно, масса моля кислорода — 31,986 32 г.
Число Авогадро (12.1) было подобрано так, чтобы масса моля, выраженная в граммах, численно совпадала с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Поэтому массы молей различных веществ легко найти из периодической системы химических элементов. Например, в таблице находим, что масса молекулы гелия — 4,0026 а.е.м., следовательно, масса моля гелия — 4,0026 4 г, масса двухатомной молекулы кислорода — 31,986 а.е.м., следовательно, масса моля кислорода — 31,986 32 г.
Необходимо также знать определение температуры. Температура тела — величина, пропорциональная средней кинетической энергии молекулы
(12.2) |
где — средняя кинетическая энергия молекулы, — абсолютная температура (ее называют также температурой в шкале Кельвина), — постоянная, которая называется постоянной Больцмана. Из формулы (12.2) следует, что температура по шкале Кельвина не может быть отрицательна, ее минимальное значение (абсолютный нуль температуры) достигается, когда все молекулы имеют нулевые кинетические энергии. 1 градус шкалы Кельвина (или просто один Кельвин) совпадает с градусом более привычной в быту шкалы Цельсия, нуль которой определяется как температура плавления льда, а температура 100 отвечает температуре кипения воды при атмосферном давлении. Как показывает опыт, абсолютному нулю температуры отвечает температура . Важнейшее свойство температуры заключается в том, что при приведении тел в тепловой контакт их температуры через некоторое время выровняются и далее (в отсутствие теплообмена с окружающими телами) не будут изменяться. Рассмотрим теперь задачи.
1 градус шкалы Кельвина (или просто один Кельвин) совпадает с градусом более привычной в быту шкалы Цельсия, нуль которой определяется как температура плавления льда, а температура 100 отвечает температуре кипения воды при атмосферном давлении. Как показывает опыт, абсолютному нулю температуры отвечает температура . Важнейшее свойство температуры заключается в том, что при приведении тел в тепловой контакт их температуры через некоторое время выровняются и далее (в отсутствие теплообмена с окружающими телами) не будут изменяться. Рассмотрим теперь задачи.
В задаче 12.1.1 правильным ответом правильным ответом является ответ 3, поскольку число молекул в моле не зависит от того, какое это вещество, и равно числу Авогадро.
Поскольку массы молекул разных веществ — разные, одинаковые массы разных веществ содержат различные количества молекул. Найти эти количества можно, зная молярные массы и число Авогадро. Например, в задаче 12. 1.2 можно провести такие рассуждения. Водород массой 1 г составляет половину моля, и, следовательно, содержит молекул. Кислород массой 1 г составляет 1/32 часть моля, и, следовательно, содержит молекул. Отсюда находим отношение числа молекул в 1 г водорода к числу молекул в 1 г кислорода: (ответ
1.2 можно провести такие рассуждения. Водород массой 1 г составляет половину моля, и, следовательно, содержит молекул. Кислород массой 1 г составляет 1/32 часть моля, и, следовательно, содержит молекул. Отсюда находим отношение числа молекул в 1 г водорода к числу молекул в 1 г кислорода: (ответ
Согласно определению число молекул в моле одинаково для любого вещества, причем независимо от того, сколько атомов входят в состав одной молекулы этого вещества. Другими словами, это число не зависит от того, являются ли молекулы одно-, двух-, и т.д. атомными. Поэтому правильный ответ в задаче 12.1.3 — 4.
Поскольку число молекул в моле любого вещества равно числу Авогадро, то для молярной массы любого вещества справедливо соотношение: , где — масса одной молекулы. Отсюда находим в задаче 12.1.4, что (ответ 1).
Чтобы понять, сколько молей содержит та или иная масса вещества, нужно разделить эту массу на молярную массу данного вещества (или число содержащихся в ней молекул на число Авогадро).
Для характеристики числа молекул в некоторой массе вещества принято использовать величину, которая называется количество вещества. Эта величина определяется как число молей, составляющих данную массу. Для нахождения количества вещества нужно разделить число молекул этой массы вещества на число Авогадро, (или саму массу на молярную массу данного вещества). Поскольку в задаче 12.1.6 газ в сосуде содержит молекул, то количество вещества газа составляет 0,5 моль (ответ 2).
Как указывалась во введении к настоящей главе, молярные массы веществ можно найти по периодической таблице элементов. Масса моля, выраженная в граммах, численно совпадает с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Из приведенной в условии
 е.м. (второе число в клетке, которое для всех элементов является обязательно целым, представляет собой порядковый номер элемента). Поэтому для рутения находим: = 101,07 ≈ 101 г/моль (ответ 2).
е.м. (второе число в клетке, которое для всех элементов является обязательно целым, представляет собой порядковый номер элемента). Поэтому для рутения находим: = 101,07 ≈ 101 г/моль (ответ 2).Связь температуры и средней кинетической энергии молекул определяется формулой (12.2) (задача 12.1.8 – ответ 2).
Температурой плавления льда (и замерзания воды) является температура 0 . Поскольку нуль шкалы Кельвина (абсолютный нуль температуры) в шкале Цельсия составляет –273 (см. введение к настоящей главе), то температура плавления льда по абсолютной шкале равна 273 ( задача 12.1.9 — ответ 3).
Изменением температуры тела в некотором процессе называется разность его конечной и начальной температур тела . Так как температуры в шкале Цельсия и Кельвина связаны «сдвигом»: , то разность температур в градусах Кельвина и в градусах Цельсия совпадает:
Другими словами, изменение температуры тела одинаково при задании температуры как в шкале Кельвина, так и в шкале Цельсия. Поэтому правильный ответ в задаче 12.1.10 — 2.
Поэтому правильный ответ в задаче 12.1.10 — 2.
В задаче 12.2.1 нужно снова использовать определение количества вещества. Напоминаем, что количеством вещества называется число молей, составляющих данную порцию вещества. Отсюда находим количество вещества водорода моль и количество кислорода моль в сосудах. Поэтому (ответ 1).
Поэтому = 63 г/моль (ответ 4).
Масса одной молекулы углерода = 12 а.е.м. А поскольку моль углерода содержит , то масса моля углерода равна а.е.м. (задача 12.2.3 – ответ 1).
Поскольку молярная масса — это характеристика вещества, то, находя эту величину, можно определить вещество. Например, в задаче 12.2.4 плотность газа (масса единицы объема) и концентрация молекул (число молекул в единице объема), очевидно, связаны друг с другом через массу одной молекулы . Умножая правую и левую часть этой формулы на число Авогадро и учитывая, что , получим = 4 г/моль. Поэтому неизвестный газ — гелий (ответ 2).
Умножая правую и левую часть этой формулы на число Авогадро и учитывая, что , получим = 4 г/моль. Поэтому неизвестный газ — гелий (ответ 2).
Используя определение температуры (12.2), получим для средней скорости молекул водорода в задаче 12.2.5
(ответ 3).
Из определения температуры (12.2) следует, что при повышении температуры в 2 раза средняя скорость молекул увеличивается в раз (задача 12.2.6 – ответ 3).
При приведении газов в тепловой контакт их температуры выровняются (задача 12.2.7). Отсюда согласно определению температуры следует, что средние кинетические энергии молекул газов станут равными:
или (ответ 3).
Задача 12.2.8 аналогична предыдущей. Используя определение температуры (12.2) для каждого газа и учитывая, что независимо от того, сколько атомов входит в состав молекулы, в правую часть определения температуры (12. 2) входит коэффициент 3/2, получим
2) входит коэффициент 3/2, получим
где — средняя скорость молекул водорода, — средняя скорость молекул гелия. Поскольку масса молекулы гелия в два раза больше массы молекулы водорода, то
(ответ 2).
Поскольку моль любого вещества содержит одинаковое количество молекул, то для сравнения числа молекул воды и ртути в стакане (задача 12.2.9) можно сравнить число молей. Число молей воды и ртути в стакане найдем из следующих цепочек формул. Воды:
(1) |
Ртути:
(2) |
где и — массы и плотности веществ, — молярные массы, — объем стакана. Сравнивая величины (1) и (2), заключаем
(здесь использованы плотности и молярные массы воды и ртути). Поэтому в стакане ртути больше молекул, чем в стакане воды (ответ 2), причем в 67/55 =1,2 раза.
Сначала обратим внимание читателя, что предложенные в задаче 12.2.10 значения температур и варианты ответов «подталкивают» к выбору ответа , поскольку конечная температура в 5 раз больше начальной. Тем не менее это неправильно, поскольку температуры заданы в градусах Цельсия, а в формулу (12.2), связывающую температуру и среднюю кинетическую энергию молекул, входит абсолютная температура. Поэтому
(ответ 4).
КОЛИЧЕСТВО ВЕЩЕСТВА, МОЛЬ, МОЛЯРНАЯ МАССА, ЧИСЛО АВОГАДРО.
Пожалуй, ни один современный учебник по молекулярной физике, и тем более по химии не обойдется без таких понятий как: количество вещества, моль, молярная масса, число Авогадро. Давайте попробуем разобраться что же это такое, и заодно посчитаем сколько молекул в стакане воды.
Когда речь заходит о атомах и молекулах, из которых состоят вещества, следует понимать две вещи:
- Мы имеем дело с чем-то очень «маленьким».
- Этого «маленького» очень, и очень много.

Все это, естественно, вносит свои коррективы. К примеру, для измерения массы атомов и молекул использовать привычные нам граммы и килограммы будет не совсем удобно.
Так, по современным расчетам, атом водорода имеет массу около 1,6726• 10-27 кг. а атом углерода 1,995 • 10-26 . это конечно в 12 раз больше, но все равно очень мало. И понятно, что для работы с такими числами понадобиться хороший инженерный калькулятор и железные нервы. Ну а для тех, кто не обладает ни тем, ни другим была введена специальная величина, которая свела все расчеты на уровень арифметики начальной школы.
Относительная атомная и молекулярная массы (Ar, Mr).
Относительная атомная масса (Ar) — это отношение массы атома к 1/12 массы атома углерода. (Если быть точнее, то нейтрального атома изотопа углерода 12C).
Относительная молекулярная масса (Mr) — это отношение массы одной молекулы к 1/12 массы атома углерода.
Почему углерода? Учебник физики за 10 класс говорит нам следующее:
— Мякишев, Буховцев, Сотский, Учебник Физика 10 класс.Сравнение масс атомов и молекул с 1/12 массы атома углерода было принято в 1961 г. Главная причина такого выбора состоит в том, что углерод входит в огромное число различных химических соединений. Множитель 1/12 введен для того, чтобы относительные массы атомов были близки к целым числам.
Относительную атомную массу можно посмотреть в таблице Менделеева.
Если же мы хотим найти относительную молекулярную массу для какой-то молекулы, то необходимо сложить относительные атомные массы всех атомов входящих в её состав.
Ну например, если мы возьмем воду, то молекула воды состоит из двух атомов водорода и одного атома кислорода. Относительная атомная масса водорода 1, у кислорода 16. Соответственно получаем 1+1+16=18. Простая арифметика. Как я и говорил.
Относительная молекулярная масса, а также относительная атомная масса величины безразмерные. Они показывают во сколько раз масса данной молекулы или атома больше 1/12 массы атома углерода. Которая, к слову, равна 1,660 539 066 60 •10-27 кг, или приближенно 1,66 •10-27 кг. Это число называют еще атомной единицей массы или а.е.м..
Они показывают во сколько раз масса данной молекулы или атома больше 1/12 массы атома углерода. Которая, к слову, равна 1,660 539 066 60 •10-27 кг, или приближенно 1,66 •10-27 кг. Это число называют еще атомной единицей массы или а.е.м..
1 а.е.м. ≈ 1,66 •10-27 кг.
Зная это, мы можем легко определить массу любой молекулы, умножив ее относительную молекулярную массу на 1,66 •10-27 кг.
m 0 ≈ Mr•1,66 •10-27 кг.
Кому интересно, можете посчитать массу молекулы воды, ну а мы идем дальше.
Число Авогадро, моль и количество вещества.
Измерять количество молекул штуками, так же неудобно, как и мерить массу отдельных молекул килограммами.
И здесь, опять же для удобства, вводится такая величина как количество вещества. Ее обозначают греческой буквой ню (ν), и измеряют в молях. Не путайте с молью что живет в шифоньерах и питается исключительно шубами.
Моль — это такое количество вещества, в котором содержится столько же атомов (или молекул), сколько атомов содержится в 12 граммах углерода.
А их там 6.02•1023 штук. Это число называется числом Авогадро (NА ). В честь итальянского ученого из Турина Лоренцо Романо Амедео Карло Авогадро ди Кваренья э ди Черрето (Не пугайтесь, это все один человек).
Число Авогадро — количество атомов или молекул в одном моле вещества.
NА =6.02•1023 Моль -1
Чтобы иметь представление что такое 1 моль вещества, и соответственно, что такое число Авогадро, рассмотрим простой пример. Если взять условно размер одной песчинки за 1 мм 3, то 1 моль таких песчинок будет занимать объем 6,02•1014 м3. Если насыпать этот песок слоем толщиной 150 метров, мы получим пустыню площадью порядка 4 000 000 км2. Для сравнения площадь пустыни Сахара 9 200 000 км²…
Молярная масса (M)
Еще одна важная величина — это молярная масса. Нет, это не масса маляра, как может показаться. Молярная масса (М) — это масса одного моля вещества. Тут все просто, если в одном моле содержится NА частиц (т.е. равное числу Авогадро), то, умножая массу одной такой частицы m0 на число Авогадро, мы получим молярную массу.
Нет, это не масса маляра, как может показаться. Молярная масса (М) — это масса одного моля вещества. Тут все просто, если в одном моле содержится NА частиц (т.е. равное числу Авогадро), то, умножая массу одной такой частицы m0 на число Авогадро, мы получим молярную массу.
Но это делать не обязательно, так как малярную массу легко узнать по таблице Менделеева. Как? Точно так же, как и относительную молекулярную массу. Вообще это будет одно и тоже число, только единицы измерения будут разные, в первом случае едениц не будет вообще (так как величины безразмерные), а во втором, это г/моль. Ну или чтоб перевести молярную массу в систему СИ, необходимо ее умножить на 10-3. Получим кг/моль.
Чему будет равна молярная масса воды? Правильно! 18 г/моль или 18•10-3кг/моль
Сколько молекул в стакане воды?
И напоследок давайте разберемся как теперь со всем этим жить. И ответим на извечный вопрос что делать? К примеру, жизненные обстоятельства заставили Вас посчитать вместимость стакана, но не в миллилитрах, и даже не в сантиметрах кубических, а в молекулах.
Сколько же молекул воды помещается в обыкновенный граненный стакан?
Чтобы ответить на этот вопрос нам необходимо знать массу воды в стакане. Мои измерения показали 200 грамм.
Теперь, если вы в самом начале не поленились, и нашли массу одной молекулы воды, то можете смело делить на нее общую массу воды в стакане.
Я поленился, поэтому переходим к плану “Б”. Для этого необходимо найти сколько моль воды содержится в стакане. Количество вещества рассчитывается как отношение массы вещества, к молярной массе.
Если умножить количество вещества на число Авогадро, мы получим количество молекул.
В общем виде формула будет выглядеть следующим образом:
Осталось подставить значения и произвести расчет.
Физика Масса молекул. Количество вещества
Материалы к уроку
Конспект урока
Рассмотрим основные понятия молекулярно-кинетической теории: относительная молекулярная масса, количество вещества, постоянная АвогАдро, молярная масса.
Так как массы молекул очень малы, удобно использовать в расчетах не абсолютные значения масс, а относительные. По международному соглашению массы всех атомов и молекул сравниваются с 1/12 массы атома углерода. Массу частицы, измеренную в а.е.м. (атомная единица массы), принято называть относительной атомной (или молекулярной) массой. Значения относительных атомных масс приведены в периодической системе химических элементов Дмитрия Ивановича Менделеева. Относительная молекулярная масса молекулы вещества равна сумме относительных атомных масс атомов, составляющих данную молекулу. Относительные атомные массы всех химических элементов точно измерены. Относительная молекулярная масса (Mr) – отношение массы молекулы данного вещества к 1/12 массы атома углерода (m0c).
Складывая относительные массы элементов, входящих в состав молекулы вещества, можно вычислить относительную молекулярную массу вещества. Например, относительная молекулярная масса углекислого газа СО2 приблизительно равна 44, так как относительная атомная масса углерода точно равна 12, а кислорода примерно 16: к 12+2*16=44
Количество вещества – это физическая величина, характеризующая число структурных единиц в теле (атомов в атомарном веществе, молекул – в молекулярном).
Единицей количества вещества в СИ является моль. Один моль равен количеству вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в чистом углероде массой 0,012 кг. Такое число атомов называется числом Авогадро в честь итальянского ученого.
Для определения постоянной Авогадро надо найти массу одного атома углерода. Постоянную Авогадро можно определить, если разделить массу углерода, взятого в количестве одного моля на массу атома углерода:
Количество вещества равно отношению числа частиц в теле (атомов – в атомарном веществе, молекул – в молекулярном) к числу молекул в одном моле вещества, т.е. к числу Авогадро.
Если два разных тела состоят из одного и того же числа частиц (хотя и разных), то эти тела содержат одинаковое количество вещества (при этом массы тел могут не совпадать). Слева атомы углерода, справа атомы водорода.
Молярная масса M равна массе вещества, взятого в количестве один моль. Единица молярной массы – кг/моль.
Молярные массы веществ, молекулы которых состоят из одного атома, приведены в Периодической системе Д.И.Менделеева.
Например, информация в клетке с углеродом, помимо порядкового номера 6 углерода в Периодической системе, задает его молярную массу в г/моль 12,011. Молярная масса углерода в СИ равна 0,012 кг/моль. Для веществ, молекулы которых состоят из двух атомов (например, О2), молярная масса составит удвоенную цифру, взятую из Периодической системы.
Для молекул более сложного состава при расчете учитывается число атомов всех химических элементов в молекуле.
Если массу одной молекулы вещества обозначить через m0 (эм нулевое), то молярную массу можно трактовать как массу постоянной Авогадро (Nа) молекул. Масса любого количества вещества равна произведению массы одной молекулы на число молекул в теле. Заменив постоянное Авогадро и число молекул в теле их выражениями, получим, что количество вещества равно отношению массы вещества к его молярной массе.
Масса молекулы может быть рассчитана на основе молярной массы и числа Авогадро.
Масса одного атома водорода, например, составляет 1,67·10-27 кг, молекулы водорода Н2 в 2 раза больше, масса атома углерода в 12 раз, а молекулы кислорода в 32 раза больше массы атома водорода.
Размер молекулы a может быть оценен как размер кубика, в котором содержится одна молекула, исходя из плотности твердых или жидких веществ и массы одной молекулы.
Для воды диаметр а = 3·10-10 м. Для газов, в которых молекулы разделены друг от друга зазором, как показано на рисунке, такая оценка дает среднее расстояние между молекулами.
Часто при решении той или иной задачи важнее знать не число частиц вещества, а их концентрацию. Концентрация (n) показывает, сколько частиц содержится в единице объема (чаще всего — в одном кубическом метре) данного вещества.
Рассмотрим задачи.
Определим молярную массу воды.
Решение. В молекуле воды Н2О 2 атома водорода и 1 атом кислорода. Атомная масса водорода = 1, а кислорода – 16. Следовательно молекулярная масса воды равна 2* 1 + 16 = 18 атомных единиц массы, а молярная масса воды =0,018 кг/моль.
В молекуле воды Н2О 2 атома водорода и 1 атом кислорода. Атомная масса водорода = 1, а кислорода – 16. Следовательно молекулярная масса воды равна 2* 1 + 16 = 18 атомных единиц массы, а молярная масса воды =0,018 кг/моль.
Какое количество вещества содержится в воде массой 200 г?
Для решения задачи переведем массу в систему СИ. Запишем формулу для определения количества вещества.
Чтобы иметь возможность воспользоваться ей, надо найти молярную массу воды.
Теперь подставим наши результаты в исходную формулу и получим ответ.
В воде массой 200 г содержится 11,1 моль вещества.
Остались вопросы по теме? Наши репетиторы готовы помочь!
Подготовим к ЕГЭ, ОГЭ и другим экзаменам
Найдём слабые места по предмету и разберём ошибки
Повысим успеваемость по школьным предметам
Поможем подготовиться к поступлению в любой ВУЗ
Выбрать репетитора
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 г\моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=m\M
n=V\22. 4 (л\моль)
4 (л\моль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л\моль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем \ массу \ кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4.Определите массу карбоната натрия количеством вещества 0.25 моль.
Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории: |
(Правила комментирования)
Вычисление массовой доли элемента или вещества
Вычисление массовой доли элемента или вещества
— как вычислить массовую долю элемента в веществе;
— примеры решения задач на вычисление массовых долей химических элементов в сложном веществе;
— как вычислить массовую долю вещества в кристаллогидрате.
Как вычислить массовую долю элемента в веществе
Массовая доля элемента ω(Э) % — это отношение массы данного элемента m (Э) во взятой молекуле вещества к молекулярной массе этого вещества Mr (в-ва).
Массовую долю элемента выражают в долях от единицы или в процентах:
ω(Э) = m (Э) / Мr(в-ва) (1)
ω% (Э) = m(Э) · 100%/Мr(в-ва)
Сумма массовых долей всех элементов вещества равна 1 или 100%.
Как правило, для расчетов массовой доли элемента берут порцию вещества, равную молярной массе вещества, тогда масса данного элемента в этой порции равна его молярной массе, умноженной на число атомов данного элемента в молекуле.
Так, для вещества АxВy в долях от единицы:
ω(A) = Ar(Э) · Х / Мr(в-ва) (2)
Из пропорции (2) выведем расчетную формулу для определения индексов (х, y) в химической формуле вещества, если известны массовые доли обоих элементов и молярная масса вещества:
Х = ω%(A) · Mr(в-ва) / Аr(Э) · 100% (3)
Разделив ω% (A) на ω% (В) , т.е. преобразовав формулу (2), получим:
ω(A) / ω(В) = Х · Ar(А) / У · Ar(В) (4)
Расчетную формулу (4) можно преобразовать следующим образом:
Х : У = ω%(A) / Ar(А) : ω%(В) / Ar(В) = X(А) : У(В) (5)
Расчетные формулы (3) и (5) используют для определения формулы вещества.
Если известны число атомов в молекуле вещества для одного из элементов и его массовая доля, можно определить молярную массу вещества:
Mr(в-ва) = Ar(Э) · Х / W(A)
Примеры решения задач на вычисление массовых долей химических элементов в сложном веществе
Пример 1. Определите массовые доли химических элементов в серной кислоте H2SO4 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу серной кислоты:
Mr (H2SO4) = 1 · 2 + 32 + 16 · 4 = 98
2. Вычисляем массовые доли элементов.
Для этого численное значение массы элемента (с учетом индекса) делят на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, вычисления массовых долей проводят так:
ω(Н) = 2 : 98 = 0,0204, или 2,04%;
ω(S) = 32 : 98 = 0,3265, или 32,65%;
ω(О) = 64 : 98 =0,6531, или 65,31%
Пример 2. Определите массовые доли химических элементов в оксиде алюминия Al2O3 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу оксида алюминия:
Mr( Al2O3) = 27 · 2 + 16 · 3 = 102
2. Вычисляем массовые доли элементов:
ω(Al) = 54 : 102 = 0,53 = 53%
ω(O) = 48 : 102 = 0,47 = 47%
Как вычислить массовую долю вещества в кристаллогидрате
Массовая доля вещества — отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) = m(Х) / m,
где ω(X) — массовая доля вещества Х,
m(X) — масса вещества Х,
m — масса всей системы
Массовая доля — безразмерная величина. Её выражают в долях от единицы или в процентах.
Пример 1. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
Молярная масса BaCl2·2H2O составляет:
М(BaCl2·2H2O) = 137+ 2 · 35,5 + 2 · 18 = 244 г/моль
Из формулы BaCl2·2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль H2O. Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
m(h3O) = 2 · 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
ω(H2O) = m(H2O)/m(BaCl2 · 2H2O) = 36 / 244 = 0,1475 = 14,75%.
Пример 2. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
Дано: m(Ag )=5,4 г m = 25 г | Решение Определяем количество вещества серебра, находящегося в аргентите: n(Ag ) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 моль. Из формулы Ag2S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита: n(Ag2S) = 0,5 · n(Ag) = 0,5 · 0,05 = 0,025 моль Рассчитываем массу аргентита: m(Ag2S) = n(Ag2S) · М(Ag2S) = 0,025 · 248 = 6,2 г . Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г. ω(Ag2S) = m(Ag2S) / m = 6,2/25 = 0,248 = 24,8%. |
Найти: ω(Ag2S) = ? |
Расчет масс-молей Учебное пособие по химии
Ключевые понятия
⚛ 1 моль чистого вещества имеет массу, равную его молекулярной массе (1) , выраженной в граммах.
· Известна как молярная масса M и выражается в г моль -1
(г/моль, грамм на моль вещества)
⚛ Соотношение между молярной массой, массой и молями можно выразить в виде математического уравнения, как показано ниже:
г моль -1 = г ÷ моль
молярная масса = масса ÷ моль
М = м ÷ п
где:
M = молярная масса чистого вещества (измеряется в г моль -1 )
m = масса чистого вещества (измеряется в граммах, г)
n = количество чистого вещества (измеряется в молях, моль)
⚛ Это математическое уравнение можно преобразовать, чтобы получить следующее:
(i) п = м ÷ М
моль = масса ÷ молярная масса
(ii) m = n × M
масса = моли × молярная масса
⚛ Для расчета молей чистого вещества: n = m ÷ M
⚛ Для расчета массы чистого вещества: m = n × M
⚛ Для расчета молярной массы чистого вещества: M = m ÷ n
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Расчет массы чистого вещества (m=nM)
1 моль чистого вещества определяется как масса в граммах, равная его относительной молекулярной массе.
Эта величина известна как молярная масса (символ М).
Итак, масса 1 моля чистого вещества = относительная молекулярная масса в граммах
А, масса 1 моля чистого вещества = молярная масса чистого вещества (г моль -1 )
Или масса 1 моля = M (г моль -1 )
В таблице ниже указана масса 1 моля ряда обычных чистых веществ:
| name | molecular formula | relative molecular mass | molar mass (g mol -1 ) | mass of 1 mole (g) |
|---|---|---|---|---|
| helium gas | He | 4.003 | 4,003 г моль -1 | 4,003 г |
| oxygen gas | O 2 | 2 × 16. 00 = 32.00 00 = 32.00 | 32.00 g mol -1 | 32.00 g |
| carbon dioxide gas | CO 2 | 12.01 + (2 × 16,00) = 44,01 | 44,01 г моль -1 | 44,01 г |
| Жидкая вода | ч 2 O | (2 × 1,008) + 16,00 = 18,0108 | (2 × 1,008). | 18,016 г |
Из таблицы видно, что 1 моль воды имеет массу 18,016 грамма, что не так уж и много (примерно масса воды в паре маленьких кубиков льда, которые можно приготовить в семейном морозильнике).
А что, если бы у вас было 10 молей воды? Какова будет масса 10 молей воды?
Если 1 моль воды имеет массу 18,016 г, то 10 моль воды должны иметь массу в десять раз больше:
масса 10 молей воды = 10 × масса 1 моля воды
масса 10 молей воды = 10 × 18,016 = 180,16 г (о массе воды, которую можно налить в небольшой стакан)
Итак, если бы у нас было только ½ моля воды, какая масса воды была бы у нас?
Если 1 моль воды имеет массу 18,016 г, то ½ моля воды должно иметь ½ массы:
масса ½ моля воды = ½ × масса 1 моля воды
масса ½ моля воды = ½ × 18,016 = 9,008 г
В обоих приведенных выше примерах мы можем рассчитать массу воды в граммах, умножив количество молей воды на массу 1 моля воды в граммах:
масса воды = моль воды × масса 1 моля воды
, так как масса 1 моля воды в граммах известна как его молярная масса, мы можем записать:
масса воды = моли воды × молярная масса воды
В таблице ниже сравниваются массы различных количеств воды в молях:
| масса воды (г) | = | моль воды (моль) | × | mass of 1 mole of water (molar mass of water) (g mol -1 ) |
|---|---|---|---|---|
| 0 | = | 0. 00 00 | × | 18.016 |
| 9.008 | = | 0.50 | × | 18.016 |
| 18.016 | = | 1.00 | × | 18.016 |
| 27.024 | = | 1.50 | × | 18.016 |
| 180.16 | = | 10.00 | × | 18.016 |
| 270.24 | = | 15.00 | × | 18.016 |
Из данных таблицы можно обобщить и сказать, что для любого чистого вещества масса вещества в граммах равна количеству молей вещества, умноженному на массу 1 моля вещества:
масса = моли × масса 1 моля
и так как масса 1 моля вещества (в граммах) = молярная масса (в граммах на моль)
масса (г) = моли × молярная масса (г моль -1 )
м = п × М
где
m = масса чистого вещества в граммах
n = количество чистого вещества в молях
M = молярная масса чистого вещества в граммах на моль
Мы также можем нанести данные из таблицы выше на график, как показано ниже:
| масса (г) | 051015300250200150100500 |
| молей (моль) |
На приведенном выше графике показана прямая линия, проходящая через начало координат (0,0), поэтому уравнение для линии:
y = наклон × х
где:
y масса воды (г)
x моль воды (моль)
наклон (градиент) линии = вертикальный подъем ÷ горизонтальный ход
Мы можем определить наклон линии, используя 2 точки на прямой, например, (0,0) и (15,0, 270,24):
наклон = (270,24 г — 0 г) ÷ (15 моль — 0 моль) = 18,016 г моль -1
С 18,016 г моль -1 — молярная масса воды, можно сказать:
наклон = молярная масса воды (г моль -1 )
Следовательно, уравнение для этой линии:
Масса(H 2 O) = молярная масса (H 2 O) × моль (H 2 O)
В целом:
масса (г) = молярная масса (г моль -1 ) × моль (моль)
Из данных таблицы и ее графического представления можно обобщить и сказать, что для любого чистого вещества масса вещества в граммах равна количеству молей вещества, умноженному на массу 1 моля вещества:
масса = моли × масса 1 моля
и так как масса 1 моля вещества (в граммах) = молярная масса (в граммах на моль)
масса (г) = моли × молярная масса (г моль -1 )
м = п × М
Выполните следующие шаги, чтобы рассчитать массу чистого вещества, зная количество вещества в молях:
Шаг 1. Извлечь данные из вопроса:
Извлечь данные из вопроса:
масса = m = ? (единицы измерения граммы)
крота = n = запишите, что вам говорят в вопросе
молярная масса = M = запишите то, что вам сказали в вопросе (единицы измерения: г моль -1 )
(возможно, вам придется рассчитать это, используя молекулярную формулу чистого вещества и периодическую таблицу)
Шаг 2. Проверить соответствие единиц измерения и при необходимости преобразовать:
Количество вещества должно быть в молях (моль) !
Если количество указано в миллимолях (ммоль), разделите его на 1000, чтобы получить количество в молях (моль).
Если количество указано в микромолях (мкмоль), разделите его на 1 000 000, чтобы получить количество в молях (моль).
Если количество указано в киломолях (кмоль), умножьте его на 1000, чтобы получить количество в молях (моль).
Шаг 3. Напишите математическое уравнение (математическую формулу):
масса = моли × молярная масса
или
м = п × М
Шаг 4. Подставьте значения и решите уравнение, чтобы найти значение массы m в граммах (г).
Подставьте значения и решите уравнение, чтобы найти значение массы m в граммах (г).
↪ Наверх
Расчет молей чистого вещества (n=m/M)
В обсуждении выше мы обнаружили, что можем рассчитать массу чистого вещества, используя моли и молярную массу вещества:
масса (г) = моли (моль) × молярная масса (г моль -1 )
Как бы мы рассчитали количество молей чистого вещества, если бы знали массу этого вещества?
(a) Мы могли бы использовать некоторую алгебру: разделить обе части уравнения на молярную массу:
| масса | = | моль × |
| молярная масса | |
моль = масса ÷ молярная масса
н = м ÷ М
или
(б) Мы могли бы использовать некоторую логику:
| знаем массу в единицах | грамм (г) |
| знаем молярную массу в единицах | грамм на моль (г моль -1 ) |
| нам нужно найти моли с единицами | моль (моль) |
При рассмотрении единиц мы видим, что деление молярной массы на массу даст нам количество в единицах «моль -1 »
молярная масса/масса = г моль -1 / г = моль -1
Если мы перевернем это с ног на голову (в математических терминах, возьмем обратное), мы получим количество с единицами «моль», что и нужно:
масса/молярная масса = г / г моль -1 = моль
так
моль = масса ÷ молярная масса
н = м ÷ М
Выполните следующие шаги, чтобы рассчитать количество чистого вещества в молях, учитывая массу вещества:
Шаг 1. Извлечь данные из вопроса:
Извлечь данные из вопроса:
масса = m = запишите, что вам сказали в вопросе
моль = n = ? (единицы моль)
молярная масса = M = запишите то, что вам сказали в вопросе (единицы измерения: г моль -1 )
(возможно, вам придется рассчитать это, используя молекулярную формулу чистого вещества и периодическую таблицу)
Шаг 2. Проверить единицы на согласованность и при необходимости преобразовать:
Масса должна быть в граммах!
Если масса указана в миллиграммах (мг), разделите ее на 1000, чтобы получить массу в граммах (г).
Если масса указана в микрограммах (мкг), разделите ее на 1 000 000, чтобы получить массу в граммах (г).
Если масса указана в килограммах (кг), умножьте ее на 1000, чтобы получить массу в граммах (г).
Шаг 3. Напишите математическое уравнение (математическую формулу):
моль = масса ÷ молярная масса
или
н = м ÷ М
Шаг 4. Подставьте значения и решите уравнение, чтобы найти количество молей вещества (моль).
Подставьте значения и решите уравнение, чтобы найти количество молей вещества (моль).
↪ Наверх
Расчет молярной массы чистого вещества (M=m/n)
Что, если бы вы знали количество чистого вещества в молях и его массу?
Не могли бы вы рассчитать его молярную массу?
Напомним, что масса = моли × молярная масса или m = n × M
(a) Мы могли бы использовать некоторую алгебру: разделить обе части уравнения на моли:
| mass | = | |
| moles | |
молярная масса = масса ÷ моль
М = м ÷ п
или (б) Мы могли бы использовать некоторую логику:
При рассмотрении единиц мы видим, что, разделив массу в граммах на количество в молях, мы получим количество с единицами грамм на моль (г моль -1 ), которые являются единицами измерения молярной массы.
Следовательно, молярная масса (г моль -1 ) = масса (г) ÷ моль (моль)
или можно написать
М = м ÷ п
Выполните следующие шаги, чтобы рассчитать молярную массу чистого вещества, зная количество вещества в молях и массу вещества:
Шаг 1. Извлечь данные из вопроса:
масса = m = запишите, что вам сказали в вопросе
крота = n = запишите, что вам говорят в вопросе
молярная масса = M = ? (единицы г моль -1 )
Шаг 2. Проверить единицы на согласованность и при необходимости преобразовать:
Масса должна быть указана в граммах (г)!
Количество, моли, должно быть указано в молях (моль)!
Шаг 3. Напишите математическое уравнение (математическую формулу):
молярная масса = масса ÷ моль
или
М = м ÷ п
Шаг 4. Подставьте значения и решите уравнение, чтобы найти молярную массу вещества в граммах на моль.
↪ Наверх
Примеры расчета массы, молей, молярной массы
В каждом из приведенных ниже рабочих примеров вам будет предложено рассчитать моль, массу или молярную массу чистого вещества.
Чтобы правильно ответить на каждый вопрос, вам необходимо:
- Шаг 1. Извлечение информации из вопроса
- Шаг 2. Проверка данных на согласованность единиц
- Шаг 3. Выберите математическое уравнение, чтобы найти неизвестное
- Шаг 4. Подставьте свои значения в уравнение и решите
Рабочий пример: масса = моли × молярная масса (m=n×M)
Вопрос: Рассчитайте массу 0,25 моль воды, H 2 O.
Решение:
Шаг 1. Извлечь данные из вопроса:
моль = n = 0,25 моль
молярная масса = M = (2 × 1,008) + 16,00 = 18,016 г моль -1
(Рассчитано с использованием периодической таблицы)
масса = м = ? г
Шаг 2. Проверить данные на непротиворечивость:
Проверить данные на непротиворечивость:
Количество воды в молях (моль)? Да.
Нам не нужно конвертировать это.
Шаг 3. Напишите математическое уравнение (математическую формулу):
масса = моли × молярная масса
или
м = п × М
Шаг 4. Подставьте значения в уравнение и найдите массу (г):
масса = m = 0,25 моль × 18,016 г моль -1 = 4,5 г
(обоснованы только 2 значащие цифры)
Рабочий пример: моли = масса &делите молярную массу (n=m/M)
Вопрос: Рассчитайте количество газообразного кислорода O 2 в молях, содержащегося в 124,5 г газообразного кислорода.
Решение:
Шаг 1. Извлечь данные из вопроса:
масса = m = 124,5 г
молярная масса = M = 2 × 16,00 = 32,00 г моль -1
(Рассчитано с использованием периодической таблицы)
моля = n = ? моль
Шаг 2. Проверить данные на непротиворечивость:
Проверить данные на непротиворечивость:
Масса газообразного кислорода указана в граммах (г)? Да.
Нам не нужно конвертировать это.
Шаг 3. Напишите математическое уравнение (математическую формулу):
моль = масса ÷ молярная масса
или
н = м ÷ М
Шаг 4. Подставьте значения в уравнение и решите, чтобы найти моли газообразного кислорода:
моль = n = 124,5 г ÷ 32,00 г моль -1 = 3,891 моль
(обоснованы 4 значащие цифры)
Рабочий пример: молярная масса = масса ÷ моли (M=m/n)
Вопрос: Рассчитайте молярную массу чистого вещества, если 1,75 моля вещества имеют массу 29,79 г.
Решение:
Шаг 1. Извлечь данные из вопроса:
масса = m = 29,79 г
моль = n = 1,75 моль
Шаг 2. Проверить данные на непротиворечивость:
Масса в граммах (г)? Да. Нам не нужно конвертировать это.
Количество вещества указано в молях (моль)? Да. Нам не нужно конвертировать это.
Шаг 3. Напишите уравнение:
молярная масса = масса ÷ моль
или
М = м ÷ н
Шаг 4. Подставьте значения в уравнение и решите молярную массу:
молярная масса = M = 29,79 г ÷ 1,75 моль = 17,0 г·моль -1
(обоснованы 3 значащие цифры)
↪ Наверх
Решение задач с использованием молей, массы и молекулярной массы
Проблема: Карбонат кальция, CaCO 3 , является важным промышленным химикатом.
У Химика Криса есть неочищенный образец карбоната кальция.
Масса нечистого образца составляет 0,1250 кг, и он состоит из 87,00% (по массе) карбоната кальция.
Прежде чем Крис сможет использовать этот карбонат кальция в химической реакции, Крису необходимо знать количество карбоната кальция в молях, присутствующее в этом образце.
Рассчитайте количество карбоната кальция в молях, присутствующее в этом нечистом образце карбоната кальция.
Решение проблемы с использованием модели StoPGoPS для решения проблемы:
| Сформулируйте вопрос. | Какой вопрос просит вас сделать? Рассчитайте количество карбоната кальция в молях n(CaCO 3 ) = моли карбоната кальция = ? моль | |
| Пауза для планирования. | Какой химический принцип вам нужно применить? Применение стехиометрии (n = m ÷ M) Какую информацию (данные) вам предоставили?
Каков ваш план решения этой проблемы? (i) Напишите математическое уравнение для расчета количества молей карбоната кальция: n(моль) = м(г) ÷ M(г моль -1 ) (ii) Рассчитайте массу карбоната кальция в образце в килограммах (кг). масса карбоната кальция (кг) = 87,00% от массы образца (кг) м (CaCO 3 ) в килограммах = ( 87,00/100 ) × м (проба) (iii) Перевести массу карбоната кальция в килограммах (кг) в массу в граммах (г) m(CaCO 3 ) в граммах = m(CaCO 3 ) в кг × 1000 г/кг (iv) Рассчитайте молярную массу карбоната кальция молярная масса = M(CaCO 3 ) = M(Ca) + M(C) + [3 × M(O)] = (v) Подставьте значения m(CaCO 3 ) в граммах и M(CaCO 3 ) в г моль -1 в математическое уравнение и найдите n (моль) n(моль) = м(г) ÷ M(г моль -1 ) | |
| Следуйте плану. | (i) Напишите математическое уравнение для расчета молей карбоната кальция: n(моль) = м(г) ÷ M(г моль -1 ) n(CaCO 3 ) = m(CaCO 3 ) ÷ M(CaCO 3 ) (ii) Рассчитайте массу карбоната кальция в образце в килограммах (кг). масса карбоната кальция (кг) = 87,00% от массы образца (кг) м (CaCO 3 ) в килограммах = ( 87,00/100 ) × м (проба) м (CaCO 3 ) в килограммах = ( 87,00/100 ) × 0,1250 кг = 0,10875 кг (iii) Перевести массу карбоната кальция в килограммах (кг) в массу в граммах (г) m(CaCO 3 ) в граммах = m(CaCO 3 ) в кг × 1000 г/кг m(CaCO 3 ) в граммах = 0,10875 кг × 1000 г/кг = 108,75 г (iv) Рассчитайте молярную массу карбоната кальция молярная масса = M(CaCO 3 ) = M(Ca) + M(C) + [3 × M(O)] М(CaCO 3 ) = 40,08 + 12,01 + [3 × 16,00] = 40,08 + 12,01 + 48,00 = 100,09 г моль -1 (v) Подставьте значения m(CaCO 3 ) в граммах и M(CaCO 3 ) в г моль -1 в математическое уравнение и найдите n (моль) n(CaCO 3 ) = m(CaCO 3 ) ÷ M(CaCO 3 ) n(CaCO 3 ) = m(CaCO 3 ) ÷ M(CaCO 3 ) = 108,75 (обоснованы 4 значащие цифры) | |
Подумайте о правдоподобии. | Вы ответили на заданный вопрос? Да, мы рассчитали количество молей карбоната кальция в образце. Разумно ли ваше решение вопроса? Давайте вернемся назад, чтобы увидеть, дадут ли рассчитанные нами моли карбоната кальция правильную массу образца. Поскольку это приблизительное значение массы образца примерно равно массе образца, указанной в вопросе, мы достаточно уверены в правильности нашего ответа. | |
Укажите решение. | Сколько молей карбоната кальция содержится в образце? н (CaCO 3 ) = 1,087 моль |
↪ Наверх
Пример вопроса: моли, масса и молярная масса
Определите массу в граммах 0,372 моля твердой ромбической серы (S 8 ).
м(S 8 ) = г
↪ Наверх
Сноски:
(1) Молекулярная масса также известна как молекулярная масса, формульная масса или формульная масса
↪ Вернуться к ключевым понятиям
Глава 1.7: Моль и молярная масса
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 17282
- Анонимный
- LibreTexts
Цели обучения
- Рассчитать молекулярную массу ковалентного соединения.

- Для расчета формулы массы ионного соединения.
- Для расчета количества атомов, молекул или формульных единиц в образце.
Химия — это изучение того, как атомы и молекулы взаимодействуют друг с другом в атомном масштабе. Химикам нужен способ просто определить, сколько молекул содержится в стакане. Понятие крота, которое мы здесь введем, устраняет этот пробел, связывая массу отдельного атома или молекулы в а.е.м. с массой множества таких молекул в граммах.
Как вы узнали, массовое число представляет собой сумму количества протонов и нейтронов, присутствующих в ядре атома. Массовое число – это целое число, приблизительно равное числовому значению атомной массы. Хотя массовое число безразмерно, ему присваиваются единицы, называемые атомными единицами массы (а.е.м.) . Поскольку молекула или многоатомный ион представляют собой совокупность атомов, идентичность которых указана в их молекулярной или ионной формуле, мы можем вычислить среднюю атомную массу любой молекулы или многоатомного иона, исходя из их состава, путем сложения масс составляющих атомов. Средняя масса одноатомного иона такая же, как средняя масса атома элемента, потому что масса электронов настолько мала, что в большинстве расчетов не имеет значения. Это не очень поможет в лаборатории типичному химику, у которого есть весы только для взвешивания химических веществ, но ему нужно знать, сколько атомов или молекул. Ясно, что нужно что-то умное, но сначала давайте кратко рассмотрим, как вычислять молекулярные массы.
Средняя масса одноатомного иона такая же, как средняя масса атома элемента, потому что масса электронов настолько мала, что в большинстве расчетов не имеет значения. Это не очень поможет в лаборатории типичному химику, у которого есть весы только для взвешивания химических веществ, но ему нужно знать, сколько атомов или молекул. Ясно, что нужно что-то умное, но сначала давайте кратко рассмотрим, как вычислять молекулярные массы.
Молекулярная
Молекулярная масса Сумма средних масс атомов в одной молекуле вещества, умноженная на ее нижний индекс. вещества – это сумма средних масс атомов в одной молекуле вещества. Он рассчитывается путем сложения атомных масс элементов в веществе, каждое из которых умножается на его нижний индекс (написанный или подразумеваемый) в молекулярной формуле. Поскольку единицами атомной массы являются атомные единицы массы, единицы молекулярной массы также являются атомными единицами массы. Процедура расчета молекулярных масс проиллюстрирована в примере 1.
Пример 1.7.1
Рассчитайте молекулярную массу этанола, сокращенная структурная формула которого: CH 3 CH 2 OH. Среди множества применений этанол является топливом для двигателей внутреннего сгорания.
Дано: молекула
Запрошено: молекулярная масса
Стратегия:
A Определите число атомов каждого элемента в молекуле.
B Найдите атомную массу каждого элемента из таблицы Менделеева и умножьте атомную массу каждого элемента на количество атомов этого элемента.
C Сложите массы, чтобы получить молекулярную массу.
Решение:
A Молекулярная формула этанола может быть записана тремя различными способами: CH 3 CH 2 OH (что иллюстрирует наличие этильной группы, CH 3 CH 2 — и группу -OH), C 2 H 5 OH и C 2 H 6 O; все показывают, что этанол имеет два атома углерода, шесть атомов водорода и один атом кислорода.
B Взяв массы атомов из периодической таблицы, получим
\( 2 \times atomic;\ масса\;of\:углерода = 2\;атомов \left( {\dfrac{12.011amu}{ атом}} \right) = 24,022\;а.е.м.\)
\( 6 \х атомных;\ масса\;водорода = 6\;атомов \влево( {\dfrac{1,0079а.е.м.} {атом} } \right) = 6,0474\;а.е.м.\)
\( 1 умножить на атомную;\ масса\;кислорода = 1\;атомов \влево( {\dfrac{15,9994а.е.м.}}{атом}} \ справа) = 15,9994 а.е.м.\)
C Сложение масс дает молекулярную массу:
24,022 а.е.м. + 6,0474 а.е.м. + 15,9994 а.е.м. = 46,069 а.е.м. 2
\( \left [ 2\; атомы\: \; \left ( \dfrac{12.011\; amu}{1\, \; атом\; C} \right ) \right ] +\) \( \слева [ 6\; атомы\: H\; \слева ( \dfrac{1.0079\; аму} {1\, \; атом\; H} \справа ) \справа ]+\) \( \слева [ 1\ ; атомы\: O\; \left ( \dfrac{15.9994\; аму}{1\, \; атом\; O} \right ) \right ] \)
Тот же расчет можно выполнить в табличном формате, что особенно полезно для более сложных молекул:
| 2C | (2 атома) (12,011 а. е.м./атом) = 24,022 а.е.м. е.м./атом) = 24,022 а.е.м. |
| 6ч | (6 атомов) (1,0079 а.е.м./атом) = 6,0474 а.е.м. |
| 1О | (1 атом) (15,9994 а.е.м./атом) = 15,9994 а.е.м. |
| С 2 Н 6 О | молекулярная масса этанола = 46,069 а.е.м. |
Упражнение
Рассчитайте молекулярную массу трихлорфторметана, также известного как фреон-11, его сокращенная структурная формула CCl 3 F. До недавнего времени он использовался в качестве хладагента. Структура молекулы фреона-11 следующая:
Ответ: 137,368 а.е.м.
Обратите внимание на шаблон
Атомная масса и молекулярная масса имеют одни и те же единицы измерения: атомные единицы массы.
Крот
В теории Дальтона каждое химическое соединение имеет определенную комбинацию атомов и что отношения чисел атомов присутствующих элементов обычно представляют собой небольшие целые числа. Мы также описали закон кратных пропорций , который утверждает, что отношения масс элементов, образующих ряд соединений, являются небольшими целыми числами. Проблема для Дальтона и других ранних химиков состояла в том, чтобы обнаружить количественную связь между числом атомов в химическом веществе и его массой. Поскольку массы отдельных атомов настолько ничтожны (порядка 10 −23 г/атом), химики не измеряют массу отдельных атомов или молекул. В лаборатории, например, массы соединений и элементов, используемых химиками, обычно колеблются от миллиграммов до граммов, тогда как в промышленности химические вещества покупаются и продаются в килограммах и тоннах. Поэтому для анализа превращений, происходящих между отдельными атомами или молекулами в химической реакции, химикам совершенно необходимо знать, сколько атомов или молекул содержится в измеряемой в лаборатории величине — заданной массе образца. Единицей, обеспечивающей эту связь, является моль (моль).
Мы также описали закон кратных пропорций , который утверждает, что отношения масс элементов, образующих ряд соединений, являются небольшими целыми числами. Проблема для Дальтона и других ранних химиков состояла в том, чтобы обнаружить количественную связь между числом атомов в химическом веществе и его массой. Поскольку массы отдельных атомов настолько ничтожны (порядка 10 −23 г/атом), химики не измеряют массу отдельных атомов или молекул. В лаборатории, например, массы соединений и элементов, используемых химиками, обычно колеблются от миллиграммов до граммов, тогда как в промышленности химические вещества покупаются и продаются в килограммах и тоннах. Поэтому для анализа превращений, происходящих между отдельными атомами или молекулами в химической реакции, химикам совершенно необходимо знать, сколько атомов или молекул содержится в измеряемой в лаборатории величине — заданной массе образца. Единицей, обеспечивающей эту связь, является моль (моль). Количество вещества, которое содержит такое же количество единиц (например, атомов или молекул), что и число атомов углерода ровно в 12 г изотопно чистого углерода-12., от латинского кротов , что означает «куча» или «куча» (, а не от маленького подземного животного!).
Количество вещества, которое содержит такое же количество единиц (например, атомов или молекул), что и число атомов углерода ровно в 12 г изотопно чистого углерода-12., от латинского кротов , что означает «куча» или «куча» (, а не от маленького подземного животного!).
Многие знакомые предметы продаются в числовых количествах с необычными названиями. Например, банки с газировкой продаются в упаковках по шесть штук, яйца продаются дюжинами (12), а карандаши часто продаются оптом (12 дюжин, или 144). Листы бумаги для принтера упакованы в пачки по 500 штук, что кажется большим количеством. Однако атомы настолько малы, что даже 500 атомов слишком малы, чтобы их можно было увидеть или измерить с помощью наиболее распространенных методов. Любая легко измеримая масса элемента или соединения содержит чрезвычайно большое количество атомов, молекул или ионов, поэтому для их подсчета требуется чрезвычайно большая числовая единица. Для этой цели используется моль.
моль определяется как количество вещества, которое содержит количество атомов углерода ровно в 12 г изотопно чистого углерода-12. Согласно самым последним экспериментальным измерениям, эта масса углерода-12 содержит 6,022142 × 10 23 атомов, но для большинства целей достаточно 6,022 × 10 23 значащих цифр. Так же, как 1 моль атомов содержит 6,022 × 10 23 атомов, 1 моль яиц содержит 6,022 × 10 23 яиц. Число в моле называется числом Авогадро: 6,022142 х 10 23 , в честь итальянского ученого 19-го века, который первым предложил, как измерить количество молекул в газе. Поскольку массу газа также можно измерить на чувствительных весах, знание количества молекул и их общей массы позволяет нам просто определить массу отдельной молекулы в граммах.
Согласно самым последним экспериментальным измерениям, эта масса углерода-12 содержит 6,022142 × 10 23 атомов, но для большинства целей достаточно 6,022 × 10 23 значащих цифр. Так же, как 1 моль атомов содержит 6,022 × 10 23 атомов, 1 моль яиц содержит 6,022 × 10 23 яиц. Число в моле называется числом Авогадро: 6,022142 х 10 23 , в честь итальянского ученого 19-го века, который первым предложил, как измерить количество молекул в газе. Поскольку массу газа также можно измерить на чувствительных весах, знание количества молекул и их общей массы позволяет нам просто определить массу отдельной молекулы в граммах.
Крот обеспечивает мост между атомным миром (аму) и лабораторией (граммы). Он позволяет определить количество молекул или атомов путем их взвешивания. Числовое значение числа Авогадро, обычно записываемое как Нет, является следствием произвольного значения одного килограмма, блока металла Pt-Ir, называемого международным прототипом килограмма, и выбора эталона для шкалы единиц атомной массы, одного атома. углерода-12. Моль C-12 по определению весит ровно 12 г, а число Авогадро определяется путем подсчета количества атомов. Это не так просто. Число Авогадро — фундаментальная константа, которая определяется наименее точно.
углерода-12. Моль C-12 по определению весит ровно 12 г, а число Авогадро определяется путем подсчета количества атомов. Это не так просто. Число Авогадро — фундаментальная константа, которая определяется наименее точно.
Определение моля, то есть решение основывать его на 12 г углерода-12, является произвольным, но оно было принято после некоторого обсуждения между химиками и физиками, спорящими о том, следует ли использовать встречающийся в природе углерод, смесь C -12 и С-13, или водород. Важным моментом является то, что 1 моль углерода — или чего-либо еще, будь то атомы, компакт-диски или дома — всегда имеет одно и то же число объектов: 6,022 × 10 23 .
В следующем видео профессор Стив Бун показывает, как можно использовать гипотезу Авогадро для измерения молекулярных масс He, N 2 и CO2. Следуйте и запишите измерения, чтобы получить относительные массы. Когда мы рассматриваем поведение газов в блоке 5, мы можем использовать данные для расчета молекулярной массы каждого газа. Этот метод был, до изобретения масс-спектрометра, лучшим способом измерения молекулярной массы молекул газа .
Этот метод был, до изобретения масс-спектрометра, лучшим способом измерения молекулярной массы молекул газа .
Чтобы оценить значение числа Авогадро, возьмем моль пенни. Сложенный вертикально моль пенни будет иметь высоту 4,5 × 10 17 миль, или почти в шесть раз больше диаметра галактики Млечный Путь. Если бы моль пенни распределить поровну между всем населением Земли, каждый человек получил бы более одного триллиона долларов. Ясно, что моль настолько велика, что ее можно использовать только для измерения очень маленьких объектов, таких как атомы.
Концепция моля позволяет нам подсчитать определенное количество отдельных атомов и молекул путем взвешивания измеримых количеств элементов и соединений. Чтобы получить 1 моль атомов углерода-12, мы должны взвесить 12 г изотопно чистого углерода-12. Однако, поскольку каждый элемент имеет разную атомную массу, моль каждого элемента имеет разную массу, даже если он содержит одинаковое количество атомов (6,022 × 10 23 ). Это аналогично тому факту, что дюжина очень больших яиц весит больше, чем дюжина маленьких яиц, или что общий вес 50 взрослых людей больше, чем общий вес 50 детей. Из-за способа определения моля для каждого элемента количество граммов в моле совпадает с количеством атомных единиц массы в атомной массе элемента. Например, масса 1 моля магния (атомная масса = 24,305 а.е.м.) равна 24,305 г. Поскольку атомная масса магния (24,305 а.е.м.) чуть более чем в два раза превышает массу атома углерода-12 (12 а.е.м.), масса 1 моля атомов магния (24,305 г) чуть более чем в два раза превышает массу 1 моля углерода. -12 (12 г). Точно так же масса 1 моля гелия (атомная масса = 4,002602 а.е.м.) составляет 4,002602 г, что составляет примерно одну треть массы 1 моля углерода-12. Теперь, используя концепцию крота, мы можем переформулировать теорию Дальтона: 1 моль соединения образуется путем соединения элементов в количествах, молярные отношения которых представляют собой небольшие целые числа. Например, 1 моль воды (H 2 O) содержит 2 моля атомов водорода и 1 моль атомов кислорода.
Это аналогично тому факту, что дюжина очень больших яиц весит больше, чем дюжина маленьких яиц, или что общий вес 50 взрослых людей больше, чем общий вес 50 детей. Из-за способа определения моля для каждого элемента количество граммов в моле совпадает с количеством атомных единиц массы в атомной массе элемента. Например, масса 1 моля магния (атомная масса = 24,305 а.е.м.) равна 24,305 г. Поскольку атомная масса магния (24,305 а.е.м.) чуть более чем в два раза превышает массу атома углерода-12 (12 а.е.м.), масса 1 моля атомов магния (24,305 г) чуть более чем в два раза превышает массу 1 моля углерода. -12 (12 г). Точно так же масса 1 моля гелия (атомная масса = 4,002602 а.е.м.) составляет 4,002602 г, что составляет примерно одну треть массы 1 моля углерода-12. Теперь, используя концепцию крота, мы можем переформулировать теорию Дальтона: 1 моль соединения образуется путем соединения элементов в количествах, молярные отношения которых представляют собой небольшие целые числа. Например, 1 моль воды (H 2 O) содержит 2 моля атомов водорода и 1 моль атомов кислорода.
Молярная масса
Молярная масса определяется как масса в граммах 1 моля этого вещества. Один моль изотопно чистого углерода-12 имеет массу 12 г. Для элемента молярная масса — это масса 1 моля атомов этого элемента; для ковалентного молекулярного соединения это масса 1 моль молекул этого соединения; для ионного соединения это масса 1 моля формульных единиц. То есть молярная масса вещества – это масса (в граммах на моль) 6,022×10 23 атомов, молекул или формульных единиц этого вещества. В каждом случае количество граммов в 1 моль равно количеству атомных единиц массы, которые описывают атомную массу, молекулярную массу или формулу массы соответственно.
Обратите внимание на шаблон
Молярная масса любого вещества — это его атомная масса, молекулярная масса или формульная масса в граммах на моль.
В периодической таблице атомная масса углерода равна 12,011 а.е.м.; средняя молярная масса углерода — масса 6,022 × 10 23 атомов углерода — следовательно, 12,011 г/моль:
| Вещество (формула) | Атомная, молекулярная или формульная масса (а. е.м.) е.м.) | Молярная масса (г/моль) |
|---|---|---|
| углерод (С) | 12,011 (атомная масса) | 12.011 |
| этанол (C 2 H 5 OH) | 46,069 (молекулярная масса) | 46.069 |
| фосфат кальция [Ca 3 (PO 4 ) 2 ] | 310.177 (масса формулы) | 310.177 |
Молярная масса встречающегося в природе углерода отличается от массы углерода-12 и не является целым числом, поскольку углерод представляет собой смесь углерода-12, углерода-13 и углерода-14. В одном моле углерода остается 6,022 × 10 23 атомов углерода, но 98,89% этих атомов составляют углерод-12, 1,11% — углерод-13 и след (около 1 атома на 10 12 ) — углерод-14. (Дополнительную информацию см. в разделе 1.6). Аналогично, молярная масса урана составляет 238,03 г/моль, а молярная масса йода — 126,90 г/моль. Когда мы имеем дело с такими элементами, как йод и сера, которые встречаются в виде двухатомной молекулы (I 2 ) и многоатомной молекулы (S 8 ), соответственно, молярная масса обычно относится к массе 1 моль атомов элемента — в данном случае I и S, , а не к массе 1 моля молекул элемента (I 2 и S 8 ).
В одном моле углерода остается 6,022 × 10 23 атомов углерода, но 98,89% этих атомов составляют углерод-12, 1,11% — углерод-13 и след (около 1 атома на 10 12 ) — углерод-14. (Дополнительную информацию см. в разделе 1.6). Аналогично, молярная масса урана составляет 238,03 г/моль, а молярная масса йода — 126,90 г/моль. Когда мы имеем дело с такими элементами, как йод и сера, которые встречаются в виде двухатомной молекулы (I 2 ) и многоатомной молекулы (S 8 ), соответственно, молярная масса обычно относится к массе 1 моль атомов элемента — в данном случае I и S, , а не к массе 1 моля молекул элемента (I 2 и S 8 ).
Молярная масса этанола – это масса этанола (C 2 H 5 OH), содержащего 6,022 × 10 23 молекул этанола. Как вы подсчитали в примере 1, молекулярная масса этанола составляет 46,069 а.е.м. Поскольку 1 моль этанола содержит 2 моль атомов углерода (2 × 12,011 г), 6 моль атомов водорода (6 × 1,0079г) и 1 моль атомов кислорода (1 × 15,9994 г), его молярная масса 46,069 г/моль. Точно так же формула массы фосфата кальция [Ca 3 (PO 4 ) 2 ] равна 310,177 а.е.м., поэтому его молярная масса составляет 310,177 г/моль. Это масса фосфата кальция, содержащая 6,022 × 10 23 формульных единиц.
Точно так же формула массы фосфата кальция [Ca 3 (PO 4 ) 2 ] равна 310,177 а.е.м., поэтому его молярная масса составляет 310,177 г/моль. Это масса фосфата кальция, содержащая 6,022 × 10 23 формульных единиц.
Моль является основой количественной химии. Он предоставляет химикам способ легко преобразовать массу вещества в число отдельных атомов, молекул или формульных единиц этого вещества. И наоборот, он позволяет химикам рассчитать массу вещества, необходимую для получения желаемого количества атомов, молекул или формульных единиц. Например, чтобы перевести моли вещества в массу, мы используем соотношение 9= граммы \)
\( \left ( \dfrac{масса}{молярная\; масса} \right )\rightarrow моли \tag{1.72}\)
\( \left ( \dfrac{граммы}{граммы/ моль} \справа )=граммы\лево ( \dfrac{моль}{граммы} \справа )=моли \)
Обязательно обращайте внимание на единицы измерения при преобразовании между массой и молями.
На рис. 1.7.2 представлена блок-схема преобразования массы; количество родинок; и количество атомов, молекул или формульных единиц. Использование этих преобразований показано в примере 3 и примере 4.
1.7.2 представлена блок-схема преобразования массы; количество родинок; и количество атомов, молекул или формульных единиц. Использование этих преобразований показано в примере 3 и примере 4.
Рис. 1.7.2 Блок-схема преобразования массы; Количество родинок; и число атомов, молекул или формульных единиц
Пример 1.7.2
Для 35,00 г этиленгликоля (HOCH 2 CH 2 OH), который используется в чернилах для шариковых ручек, рассчитайте число
- молей.
- молекулы.
Дано: масса и молекулярная формула
Требуется: количество молей и количество молекул
Стратегия:
A Используйте молекулярную формулу соединения для расчета его молекулярной массы в граммах на моль.
B Преобразование массы в моли путем деления полученной массы на молярную массу соединения.
C Преобразование молей в молекулы путем умножения числа молей на число Авогадро.
Решение:
A Молекулярную массу этиленгликоля можно рассчитать по его молекулярной формуле, используя метод, показанный в примере 1:
| 2C | (2 атома) (12,011 а.е.м./атом) = 24,022 а.е.м. |
| 6ч | (6 атомов) (1,0079 а.е.м./атом) = 6,0474 а.е.м. |
| 2О | (2 атома) (15,9994 а.е.м./атом) = 31,9988 а.е.м. |
| С 2 Н 6 О | молекулярная масса этанола = 62,068 а.е.м. |
Молярная масса этиленгликоля 62,068 г/моль
B Количество молей этиленгликоля в 35,00 г можно рассчитать путем деления массы (в граммах) на молярную массу (в граммах на моль):
\( \; 35,00\; г\; этиленгликоль\ост. ( \фрак{1\; моль\; этилен\; гликоль\; (г))}{62,068\; г\; этилен\; гликоль} \справа )=0,5639\; моль\; этилен\; гликоль\)
( \фрак{1\; моль\; этилен\; гликоль\; (г))}{62,068\; г\; этилен\; гликоль} \справа )=0,5639\; моль\; этилен\; гликоль\)
Всегда полезно оценить ответ до того, как вы сделаете фактический расчет . В этом случае указанная масса (35,00 г) на меньше молярной массы, поэтому ответ должен быть меньше 1 моль. Вычисленный ответ (0,5639 моль) действительно меньше 1 моль, так что, вероятно, мы не допустили серьезной ошибки в расчетах.
C Чтобы рассчитать количество молекул в образце, мы умножаем количество молей на число Авогадро: 9{23}\; молекул \)
Задание
Для 75,0 г CCl 3 F (фреон-11) рассчитайте количество
- молей.
- молекулы.
Ответ:
- 0,546 моль
- 3,29 × 10 23 молекул
Пример 1.7.3
Рассчитайте массу 1,75 моль каждого соединения.
- S 2 Cl 2 (обычное название: монохлорид серы; систематическое название: дихлорид дихлорида)
- Ca(ClO) 2 (гипохлорит кальция)
Дано: число молей и молекулярная или эмпирическая формула
Запрошено: масса
Стратегия:
A Рассчитайте молекулярную массу соединения в граммах или эмпирическая формула (если ионная).
B Преобразование молей в массу путем умножения количества молей соединения на его молярную массу.
Решение:
Начнем с расчета молекулярной массы S 2 Cl 2 и формулы массы Ca(ClO) 2 .
A Молярная масса S 2 Cl 2 получается из его молекулярной массы следующим образом:
| 2S | (2 атома) (32,065 а.е.м./атом) = 64,130 а.е.м. |
| 2Кл | (2 атома) (35,353 а.е.м./атом) = 70,906 аму |
| S 2 Класс 2 | молекулярная масса S 2 Cl 2 = 135,036 а.е.м. |
Молярная масса S 2 Cl 2 составляет 135,036 г/моль.
Масса 1,75 моль S 2 Cl 2 рассчитывается следующим образом:
\( моль\; S{_{2}}Cl_{2} \left [моль\; масса \dfrac{g }{моль} \справа ]= масса\; S{_{2}}Cl_{2} \)
\( 1,75\; моль\; S{_{2}}Cl_{2}\left ( \dfrac{135,036\; г\; S{_{2}}Cl_{2}}{1\;моль\ ;S{_{2}}Cl_{2}} \right )=236\;g\;S{_{2}}Cl_{2} \)
B Масса формулы Ca(ClO) 2 получается следующим образом:
| 1Ca | (1 атом) (40,078 а. е.м./атом) = 40,078 а.е.м. е.м./атом) = 40,078 а.е.м. |
| 2Кл | (2 атома) (35,453 а.е.м./атом) = 70,906 а.е.м. |
| 2О | (2 атома) (15,9994 а.е.м./атом) = 31,9988 а.е.м. |
| Ca(ClO) 2 | формула масса Ca(ClO) 2 = 142,983 а.е.м. |
Молярная масса Ca(ClO) 2 равна 142,983 г/моль
\( моль\; Ca\left ( ClO \right )_{2}\left [ \dfrac{molar\; масса\; Ca\слева ( ClO \справа )_{2}}{1\; моль\; Ca\слева ( ClO \справа )_{2}} \справа ]=масса\; Ca\слева ( ClO \справа )_{2} \)
\( 1,75\; моль\; Ca\левый ( ClO \правый )_{2}\левый [ \dfrac{142,983\; г Ca\левый (ClO \правый )_{2}}{1\; моль \; Ca\left ( ClO \right )_{2}} \right ]=250.\; g\; Ca\left ( ClO \right )_{2} \)
Упражнение
Вычислите массу 0,0122 моль каждого соединения.
- Si 3 N 4 (нитрид кремния), используемые в качестве подшипников и роликов
- (CH 3 ) 3 N (триметиламин), ингибитор коррозии
Ответ:
- 1,71 г
- 0,721 г
Резюме
Молекулярная масса и формула массы соединения получаются путем сложения атомных масс атомов, присутствующих в молекулярной формуле или эмпирической формуле, соответственно; единицами измерения обоих являются атомные единицы массы (а. е.м.). моль — это единица, используемая для измерения числа атомов, молекул или (в случае ионных соединений) формульных единиц в данной массе вещества. Моль определяется как количество вещества, которое содержит количество атомов углерода ровно в 12 г углерода-12 и состоит из Число Авогадро (6,022 × 10 23 ) атомов углерода-12. Молярная масса вещества определяется как масса 1 моля этого вещества, выраженная в граммах на моль, и равна массе 6,022 × 10 23 атомов, молекул или формульных единиц этого вещества.
е.м.). моль — это единица, используемая для измерения числа атомов, молекул или (в случае ионных соединений) формульных единиц в данной массе вещества. Моль определяется как количество вещества, которое содержит количество атомов углерода ровно в 12 г углерода-12 и состоит из Число Авогадро (6,022 × 10 23 ) атомов углерода-12. Молярная масса вещества определяется как масса 1 моля этого вещества, выраженная в граммах на моль, и равна массе 6,022 × 10 23 атомов, молекул или формульных единиц этого вещества.
Key Takeaway
- Для анализа химических превращений необходимо использовать стандартизированную единицу измерения, называемую моль.
Концептуальные проблемы
Пожалуйста, убедитесь, что вы знакомы с темами, обсуждаемыми в разделе Основные навыки 2 (Раздел 7.7 «Основные навыки 2»), прежде чем переходить к Концептуальным проблемам.
Опишите соотношение между атомной единицей массы и граммом.

Постройте блок-схему, показывающую, как можно рассчитать количество молей кремния в 37,0 г образца ортоклаза (KAlSi 3 O 8 ), минерала, используемого в производстве фарфора.
Постройте блок-схему, показывающую, как можно рассчитать количество молей азота в образце нитроглицерина массой 22,4 г, содержащем 18,5% азота по массе.
Численные задачи
Прежде чем приступить к числовым задачам, убедитесь, что вы знакомы с темами, обсуждаемыми в разделе «Основные навыки 2» (Раздел 7.7 «Основные навыки 2»).
Выведите выражение, связывающее число молекул в образце вещества с его массой и молекулярной массой.
Рассчитайте молекулярную массу или формульную массу каждого соединения.
- KCl (хлорид калия)
- NaCN (цианид натрия)
- H 2 S (сероводород)
- NaN 3 (азид натрия)
- H 2 CO 3 (угольная кислота)
- K 2 O (оксид калия)
- Al(NO 3 ) 3 (нитрат алюминия)
- Cu(ClO 4 ) 2 [перхлорат меди(II)]
Рассчитайте молекулярную массу или формульную массу каждого соединения.

- V 2 O 4 (оксид ванадия(IV))
- CaSiO 3 (силикат кальция)
- BiOCl (оксихлорид висмута)
- CH 3 COOH (уксусная кислота)
- Ag 2 SO 4 (сульфат серебра)
- Na 2 CO 3 (карбонат натрия)
- (CH 3 ) 2 CHOH (изопропиловый спирт)
Рассчитайте массу каждого образца в граммах.
- 0,520 моль N 2 O 4
- 1,63 моль C 6 H 4 Br 2
- 4,62 моль (NH 4 ) 2 SO 3
Укажите количество молекул или формульных единиц в каждом образце.
- 1,30 × 10 −2 моль SCl 2
- 1,03 моль N 2 O 5
- 0,265 моль Ag 2 Cr 2 O 7
Укажите количество молей в каждом образце.

- 9,58 × 10 26 молекул Cl 2
- 3,62 × 10 27 формульные единицы KCl
- 6,94 × 10 28 формульных единиц Fe(OH) 2
Каково общее количество атомов в каждом образце?
- 0,431 моль Li
- 2,783 моль метанола (CH 3 OH)
- 0,0361 моль CoCO 3
- 1,002 моль SeBr 2 O
Каково общее количество атомов в каждом образце?
- 0,980 моль Na
- 2,35 моль O 2
- 1,83 моль Ag 2 S
- 1,23 моль пропана (C 3 H 8 )
Каково общее количество атомов в каждом образце?
- 2,48 г HBr
- 4,77 г CS 2
- 1,89 г NaOH
- 1,46 г SrC 2 O 4
Решите, верно каждое утверждение или нет, и объясните свои рассуждения.

- В 0,5 моль Cl 2 молекул больше, чем в 0,5 моль H 2 .
- Один моль H 2 содержит 6,022 × 10 23 атомов водорода.
- Молекулярная масса H 2 O составляет 18,0 а.е.м.
- Масса формулы бензола составляет 78 а.е.м.
Заполните следующую таблицу.
Вещество Масса (г) Количество родинок Количество молекул или формульных единиц Число атомов или ионов MgCl 2 37,62 AgNO 3 2,84 BH 4 Класс 8,93 × 10 25 К 2 С 7,69 × 10 26 H 2 SO 4 1,29 С 6 Н 14 11,84 HClO 3 2,45 × 10 26
Авторы
- Анонимно
Изменено Джошуа Халперном
Проверка гипотезы Авогадро Видео из HC Communications на YouTube
Эта страница под названием Глава 1. 7: Моль и молярная масса распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована Anonymous.
7: Моль и молярная масса распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована Anonymous.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Аноним
- Встроить Hypothes.is?
- да
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу Содержание
- да на странице
- Теги

2.11: Молярная масса — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49444
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
- Электронная библиотека химического образования (ChemEd DL)
Как мы видели в книге «Количество вещества: моли», нет никакой связи между массой или объемом вещества и количеством молекул. Но затем мы определили количество вещества , n, чтобы представить число частиц. Таким образом, количество полезно для определения того, какое количество каждого вещества будет реагировать. При этом 1 г ртутного столба, или 1 см 3 Hg, вступает в реакцию с массой или объемом Br 2 что не связано с коэффициентами химического уравнения, 1 моль Hg всегда реагирует с 1 моль Br 2 , так как вступает в реакцию один атом Hg с одной молекулой Br 2 :
При этом 1 г ртутного столба, или 1 см 3 Hg, вступает в реакцию с массой или объемом Br 2 что не связано с коэффициентами химического уравнения, 1 моль Hg всегда реагирует с 1 моль Br 2 , так как вступает в реакцию один атом Hg с одной молекулой Br 2 :
Нам нужен удобный способ преобразования массы в количества , а необходимый коэффициент преобразования называется молярной массой . Молярное количество – это количество, которое было разделено на количество вещества. Например, чрезвычайно полезной молярной величиной является молярная масса 9.2421 М :
\[\text{Молярная масса}=\frac{\text{масса}}{\text{количество вещества}}\\\textit{M}\text{(г/моль)}=\frac{\textit {m}\text{ (g)}}{\textit{n}\text{ (моль)}} \nonumber \]
Часто бывает удобно выражать физические величины на единицу количества вещества (на моль), потому что таким образом сравниваются равные количества атомов или молекул. Такие молярных величин часто говорят нам что-то о самих атомах или молекулах. Например, если молярный объем одного твердого вещества больше, чем у другого, разумно предположить, что молекулы первого вещества больше, чем молекулы второго. (Сравнение молярных объемов жидкостей и особенно газов не обязательно даст ту же информацию, поскольку молекулы не будут так плотно упакованы.)
Такие молярных величин часто говорят нам что-то о самих атомах или молекулах. Например, если молярный объем одного твердого вещества больше, чем у другого, разумно предположить, что молекулы первого вещества больше, чем молекулы второго. (Сравнение молярных объемов жидкостей и особенно газов не обязательно даст ту же информацию, поскольку молекулы не будут так плотно упакованы.)
Получить молярную массу почти тривиально, так как атомный и молекулярный веса, выраженные в граммах, дают нам массу 1 моля вещества.
Пример \(\PageIndex{1}\): Молярная масса
Определите молярную массу Hg (a) и Hg (b) 2 Br 2 .
Раствор
а) Атомный вес ртути равен 200,59, поэтому 1 моль ртути весит 200,59 г.
- \( M _ {\ text {Hg}} = \ frac {m _ {\ text {Hg}}} {n _ {\ text {Hg}}} = \ frac {\ text {200} \ text {0,59{-1} \nonumber \]
Молярная масса численно совпадает с атомной или молекулярной массой, но выражается в граммах на моль.
 Уравнение, определяющее молярную массу, имеет тот же вид, что и уравнения, определяющие плотность и постоянную Авогадро. Как и в случае плотности или постоянной Авогадро, нет необходимости запоминать или манипулировать формулой. Просто помните, что масса и количество вещества связаны через молярную массу .
Уравнение, определяющее молярную массу, имеет тот же вид, что и уравнения, определяющие плотность и постоянную Авогадро. Как и в случае плотности или постоянной Авогадро, нет необходимости запоминать или манипулировать формулой. Просто помните, что масса и количество вещества связаны через молярную массу .\[\text{Масса}\overset{\text{Молярная масса}} {\longleftrightarrow} \text{количество вещества}\textit{м}\overset{\textit{M}}{\longleftrightarrow}\textit{ п} \номер\] 9{\text{-1}} \nonumber \]
Количество вещества будет равно массе, умноженной на коэффициент преобразования, позволяющий исключить единицы измерения:
\[\textit{n}=\textit{m}\cdot\ text {коэффициент преобразования} = \ text {m} \ cdot \ tfrac {1} {\ textit {M}} = 500 \ text {г} \ cdot \ tfrac {\ text {1 моль}} {\ text {114,2 г }}=\text{4,38 моль} \nonumber \]
В этом случае подходящим коэффициентом преобразования была величина, обратная молекулярной массе.
Постоянная Авогадро, молярная масса и плотность могут использоваться в комбинации для решения более сложных задач.

Пример \(\PageIndex{3}\): Молекулы
Сколько молекул содержится в 25,0 мл чистого четыреххлористого углерода (CCl 4 )?
Решение
В предыдущих примерах мы показали, что число молекул может быть получено из количества вещества с помощью константы Авогадро. Количество вещества может быть получено из массы с помощью молярной массы, а масса из объема с помощью плотности. Дорожная карта для решения этой проблемы
\[\text{Объем}\xrightarrow{\text{плотность}}\text{масса}\overset{\text{Молярная масса}}{\longleftrightarrow}\text{количество}\overset{\text{константа Авогадро} }{\longleftrightarrow}\text{количество молекул} \nonumber \]
или сокращенно
\[\text{V}\xrightarrow{\rho}\textit{m}\xrightarrow{\textit{M} }\textit{n}\xrightarrow{\textit{N}_{\textit{A}}}\textit{N} \nonumber \]
Дорожная карта говорит нам, что мы должны найти плотность CCl 4 (откроется в новом окне): 9{23} \text{ молекулы} \end{align}
- \( M _ {\ text {Hg}} = \ frac {m _ {\ text {Hg}}} {n _ {\ text {Hg}}} = \ frac {\ text {200} \ text {0,59{-1} \nonumber \]
Обратите внимание, что в этой задаче нам пришлось объединить метода из предыдущих примеров. Для этого вы должны помнить отношения между величинами. Например, был задан объем, и мы знали, что его можно преобразовать в соответствующую массу с помощью плотности, поэтому мы искали плотность в таблице. Написав дорожную карту или, по крайней мере, увидев ее мысленным взором, вы сможете отслеживать такие отношения, определять, какие коэффициенты преобразования необходимы, а затем использовать их для решения проблемы.
Для этого вы должны помнить отношения между величинами. Например, был задан объем, и мы знали, что его можно преобразовать в соответствующую массу с помощью плотности, поэтому мы искали плотность в таблице. Написав дорожную карту или, по крайней мере, увидев ее мысленным взором, вы сможете отслеживать такие отношения, определять, какие коэффициенты преобразования необходимы, а затем использовать их для решения проблемы.
Эта страница под названием 2.11: Молярная масса распространяется под лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавье Прат-Ресина, Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу Содержание
- нет на странице
- Теги
- молярная масса
- молярное количество
Расчет молярной массы: Процесс и формула
Расчет молярной массы: Процесс и формула | StudySmarterВыберите язык
Предлагаемые языки для вас:
Европа
английский (DE) английский (Великобритания)
StudySmarter — универсальное учебное приложение.
4.8 • Рейтинг +11k
Более 3 миллионов загрузок
Бесплатно
Сохранять
Распечатать
Редактировать
Расчеты молярной массы
Содержание :
ОГЛАВЛЕНИЕ
Представьте, что вы работаете на стройке, а инженер очень точный человек: он подсчитал, что вам нужно использовать 100 миллионов песчинок на одну партию цементной смеси. Теперь у вас может возникнуть соблазн начать и фактически подсчитать это, потому что вам платят почасовую оплату, но если вам нужно сделать это эффективно, есть другой способ.
Вероятно, вы сможете определить, сколько весит средняя песчинка, измерив 100 таких песчинок на весах. Допустим, вы получили 10 мг, что означает 1/10 мг на песчинку. Тогда вы можете просто рассчитать, сколько килограммов песка вам нужно. В этом случае вам потребуется 10 кг песка на партию цемента. Химик сталкивается с этой проблемой ежедневно: мы знаем, сколько атомов нам нужно, но мы не можем сосчитать их по одному. Поэтому мы придумали что-то, чтобы решить эту проблему. Это называется атомной массы (как вес средней песчинки в приведенном выше примере), и мы используем его для расчета веса моля этих атомов, то есть их веса. Затем мы можем рассчитать, насколько тяжел моль молекул, сложив атомные массы. Это называется молекулярная масса . Единицами для обеих мер являются атомные единицы массы.
Атомная масса определяется как масса покоя атома, обычно выражаемая в атомных единицах.
Атомный вес — это то, что вы измерили бы для атомной массы вблизи (или на поверхности) тяжелого объекта. Думайте очень тяжело, как земля. Это зависит от массы Земли, от того, насколько далеко вы находитесь от центра Земли, и от атомной массы.
Думайте очень тяжело, как земля. Это зависит от массы Земли, от того, насколько далеко вы находитесь от центра Земли, и от атомной массы.
Когда мы занимаемся химией на планете Земля, мы говорим об «атомном весе», но поскольку мы еще не занимаемся химией на других планетах или в космосе, мы обычно используем термины атомный масса и атомный вес взаимозаменяемо. С этого момента , если мы говорим о молекулярной массе, мы имеем в виду молекулярную массу . Это также распространено в учебниках, и пока это происходит на Земле (как и в большинстве лабораторий), вам не нужно беспокоиться об этой разнице.
Если это кажется вам запутанным, на нашем сайте есть статьи, которые помогут вам понять основы, прежде чем мы приступим к вычислениям: «Кроты и молярная масса» и «Число Авогадро и моль» — хорошие места для начала. Если вы чувствуете, что вам нужно освежить свои знания, прочитайте их сейчас, и мы продолжим с того места, на котором остановились!
Резюме: периодическая таблица с молярными массами
Следующие определения взяты из золотой книги ИЮПАК 1 :
Молярная масса – это отношение массы молекулы к унифицированной атомной единице массы.
Атомная единица массы – это единица массы (равная атомной постоянной массы), определяемая как одна двенадцатая часть массы атома углерода-12 в его основном состоянии и используемая для выражения масс атомных частиц, u ≈1,660 5402(10)×10 −27 кг.
В периодической таблице вы найдете молярные массы (точнее, веса) элементов, обычно под их названиями. (см. рис. 1). Если у вас есть конкретная молекула, состоящая из более чем одного атома, например вода (H 2 O, три атома), вы можете рассчитать, насколько тяжелым будет ее моль. Или даже для полностью вымышленного соединения, которое вы хотите сделать, например. Изучайте Smarter-ium.
Некоторые из моих любимых элементов! — Аттила Ласло Олах StudySmarter Originals
Расчет молярной массы соединения
Расчет молярной массы соединения довольно прост, но я не буду записывать его в виде уравнения (пока), потому что это делает его излишне сложным и пугающим для большинства учащихся. Сначала я дам вам список шагов (что-то вроде алгоритма для компьютера), чтобы получить окончательную молярную массу. Если вы повторите эти шаги, вы всегда сможете рассчитать правильную молярную массу, независимо от того, насколько сложно ваше соединение.
Сначала я дам вам список шагов (что-то вроде алгоритма для компьютера), чтобы получить окончательную молярную массу. Если вы повторите эти шаги, вы всегда сможете рассчитать правильную молярную массу, независимо от того, насколько сложно ваше соединение.
1. Подсчитайте количество атомов каждого элемента, из которых состоит соединение/молекула.
Вода имеет химическую формулу H 2 O, что означает, что она имеет 2 атома H и 1 атом O. Точно так же амфетамин, органическое соединение, имеет химическую формулу C 9 H 13 N, что означает, что он имеет 9 C , 13 H и 1 атом N.
2. Получить атомные массы из таблицы Менделеева.
Сделаем это для молекулы ST (i) UDySmarTeR (a) (подсказка: посмотрите на рисунок выше). Цифры под названиями элементов являются средними атомными массами, но в данном случае у нас есть только по одному каждому элементу, поэтому в формуле соединения нет чисел. Итак, в этом случае: 32,07 г/моль для серы, 204,38 г. /моль для таллия и так далее, пока не получим 226,03 г/моль для радия.
/моль для таллия и так далее, пока не получим 226,03 г/моль для радия.
Сделай сам для воды и амфетамина, он понадобится вам на следующем этапе!
3. Сложим все вместе, чтобы получить молярную массу соединения/молекулы!
StudySmarter-ium содержит по одному элементу каждого элемента, поэтому я просто складываю атомные массы всех компонентов , чтобы получить молекулярную массу соединения: 1181,37 г/моль — действительно тяжелое соединение! С водой немного сложнее: не забывайте, что есть 2 водорода (H 2 O) дает нам 1,01 + 1,01 + 16,00, чтобы получить 18,02 г / моль в качестве молярной массы. Или, упрощенно: 1,01*2 + 16,00, чтобы тоже получить 18,02 г/моль. Наконец, мы слишком часто злоупотребляли фармацевтическим прекурсором, амфетамином. Состоит из 9 атомов углерода, 13 атомов водорода и 1 атома азота. Приходит молярная масса 9 * 12,01 + 13 * 1,01 + 1 * 14,01 = 135,23 г/моль.
Теперь вы просто промываете и повторяете, чтобы вычислить молярную массу любого соединения. В конце будет несколько примеров расчета молярной массы, чтобы вы могли попробовать и поучиться.
В конце будет несколько примеров расчета молярной массы, чтобы вы могли попробовать и поучиться.
На самом деле существует целая куча различных типов весов и масс, используемых для описания атомов, и может быть важно знать разницу между ними. Возможно, вы даже слышали о некоторых из них, например. масса формулы, масса моноизотопа, молекулярная масса, молекулярная масса, атомная масса и т. д. Строго говоря, то, что мы обсуждали (и то, что вам нужно для вашего экзамена), — это молярная масса , учитывающая фактическую формулу интересующего вас соединения . и , если сложить атомные массы . Иногда вы строите соединения с неестественным распределением изотопов, например, ядерную бомбу. Он содержит уран, средний вес которого приближается к 235 г/моль. Итак, то, как вы это делаете… если подумать, я не думаю, что должен учить вас, как очищать уран для ваших домашних махинаций с атомной бомбой, поэтому я пропущу этот раздел здесь. Дело в том, что в данном случае вы необходимо обратить внимание на то, какой изотоп соединения вы используете, потому что каждый из них даст разную конечную молярную массу. В крайнем случае у вас будет только один изотоп (например, в растворителях ЯМР, по крайней мере очень дорогих), а затем вы будете использовать атомный вес этого конкретного изотопа. Например, «тяжелая вода» — это вода, состоящая из дейтерия, который представляет собой просто тяжелый водород, но эта крошечная разница имеет большое значение при расчете молярной массы тяжелой воды. Существует множество расширенных приложений для моноизотопных соединений (соединений, содержащих только один изотоп), и вы можете узнать больше о них в статье «Изотопы».
В крайнем случае у вас будет только один изотоп (например, в растворителях ЯМР, по крайней мере очень дорогих), а затем вы будете использовать атомный вес этого конкретного изотопа. Например, «тяжелая вода» — это вода, состоящая из дейтерия, который представляет собой просто тяжелый водород, но эта крошечная разница имеет большое значение при расчете молярной массы тяжелой воды. Существует множество расширенных приложений для моноизотопных соединений (соединений, содержащих только один изотоп), и вы можете узнать больше о них в статье «Изотопы».
Формула расчета молярной массы
Вам нужна формула, я понимаю, я тоже очень люблю формулы. Для соединения, состоящего из атомов A Na B Nb C Nc …. , можно использовать эту формулу для расчета молярной массы.
где Ni — число атомов i в формуле соединения, а Ar(i) — атомный вес атома i для всех атомов в формуле.
Символ просто означает сумму всего, что содержится внутри самого символа, в данном случае сумму произведения количества атомов каждого элемента в соединении и атомного веса указанного атома.
Другими словами, в случае воды:
Если эта формула кажется очень сложной, просто используйте процесс, описанный выше, это одно и то же. Разница вот в чем: вверху это описано словами, а здесь — математическими обозначениями. Ни то, ни другое не лучше!
Пример расчета молярной массы с помощью шагов
Итак, теперь вы можете уверенно рассчитывать молярные массы соединений, но для чего вы это используете? Мы можем рассчитать молярную массу любого соединения, которое нам нужно, с помощью таблицы Менделеева, и мы можем использовать ее для преобразования граммов вещества в моли вещества. Химия работает с молями, но вы можете измерять только граммы или другую связанную с ними величину, но не моли. Отсюда важность возможности перехода от одного измерения к другому.
Позвольте мне показать вам два примера расчета молярной массы, чтобы понять значение молярных масс в повседневной жизни химика.
Допустим, я знаю из недавней статьи, что моим вкусовым рецепторам требуется 0,5 моль/л глюкозы (эта мера называется концентрацией), чтобы компенсировать горький утренний кофе. Я также знаю, что мой кофе в среднем имеет объем 50 мл, также известный как 0,05 л. Умножение этих двух значений дает мне количество молей сахара, которое мне нужно добавить в кофе утром, 9.1219 r не более 0,025 моль или 25 ммоль.
Я также знаю, что мой кофе в среднем имеет объем 50 мл, также известный как 0,05 л. Умножение этих двух значений дает мне количество молей сахара, которое мне нужно добавить в кофе утром, 9.1219 r не более 0,025 моль или 25 ммоль.
Как бы вы поступили? Умножение на число Авогадро (6,022×10 23 ) дает нам 1,5055×10 22 атомов молекул сахара, что не слишком полезно. А молярная масса? Формула глюкозы составляет C 6 H 12 O
9 71220 O 9 6 0101010 10101010101010101010101010101010101010101010101010101010101010 101220 . Используя периодическую таблицу, мы можем рассчитать молярную массу глюкозы. Используя приведенные выше шаги или формулу, мы получаем 180,16 г/моль глюкозы: Молярная масса приблизительно равна 180,16 г/моль.
Молярная масса 180,16 г/моль говорит нам о том, что 1 моль сахара весит ровно 180,16 г, поэтому можете ли вы вычислить, сколько весит 0,025 моль?
Вы правы, это это 180,16 г/моль x 0,025 моль, что составляет 4,5 г или примерно 2 кубика сахара.
И наоборот тоже работает! Я просто положил 120 граммов сахара в литр кофе (это экзаменационный период, так что не судите меня)! Будет ли это на вкус достаточно сладким? Помните, нам по-прежнему требуется 0,5 моль сахара на литр кофе. Можно поступить так: 120 г разделить на молярную массу глюкозы даст вам 0,667 моль. Круто, а какой у нас был объем кофе? 1 л. Таким образом, мы в основном добавили 0,667 моль/л кофе. Это будет достаточно сладко, так как это более 0,5 моль/л, что будет равно 9.0 г, на самом деле.
Интересное явление можно заметить, в частности, с единицами СИ. Они разработаны таким образом, что вы можете выполнять с ними алгебру. Просто относитесь к граммам, молям, литрам и т. д. так, как если бы они были такими переменными, как x, y и z. Вы хотите решить на граммы? Вы можете сделать это так: г/моль * что-то = г. Что это может быть за или за ? Естественно, вы обнаружите, что это родинки. Чтобы получить более четкую картину, замените x на g и y на mol. Сможете ли вы решить это уравнение?
Вы хотите решить на граммы? Вы можете сделать это так: г/моль * что-то = г. Что это может быть за или за ? Естественно, вы обнаружите, что это родинки. Чтобы получить более четкую картину, замените x на g и y на mol. Сможете ли вы решить это уравнение?
x/y * something = x, да, это y, а y — это моль по определению. Это называется анализом размерностей и может быть очень полезным, если вы знаете, какой результат (например, граммы, моли, литры и т. д.) ты ищешь.
Примеры расчета молярной массы с ответами!
Не знаю, как для вас, а для меня в детстве химия была интересна взрывами. Итак, давайте рассчитаем молярную массу пары взрывчатых веществ на случай, если они вам тоже понравятся. Ответы в конце этого раздела, но сначала попробуйте решить их самостоятельно.
Когда-то была передача про химика, больного раком легких, который варит метамфетамин. Это было довольно популярно, и в одной из знаковых сцен он использовал фульминат ртути, чтобы снести верхний этаж здания. Но посчитаем молярную массу.
Но посчитаем молярную массу.
Молниеносная ртуть может разрушить здание, но она работает не так, как ее изображали. Если вы просто уроните его, он не взорвется на вас.
Гремучая ртуть имеет химическую формулу Hg(CNO) 2. Это означает, что на каждый атом ртути приходится 2 атома углерода, 2 атома азота и 2 атома кислорода. Можешь рассчитать молекулярную массу? А если я скажу вам, что вам нужно 2,5 моля этой дряни, чтобы заставить плохих парней заплатить за ваш метамфетамин, сколько граммов вы возьмете с собой?
Нитроглицерин используется для изготовления динамита путем его поглощения определенным материалом. Это очень стабильное взрывчатое вещество. В чистом виде нитроглицерин очень легко взорвать, например, случайно опрокинув его в лаборатории. Неуклюжий химик только что опрокинул 13 г , и мы знаем, что 0,1 моль определенно убьет его , но ниже этого количества он выживает. Формула нитроглицерина: C 3 H 5 N 3 O 9 , так мне вызвать скорую помощь?
Сначала рассчитайте молярную массу!
На карточках есть дополнительные расчеты молекулярной массы, если вы хотите еще потренироваться. Ответы:
Ответы:
- Молекулярная масса гремучей ртути 284,62 г/моль, th — это то, сколько весит ее моль. 2,5 моль будет весить в 2,5 раза больше, примерно 711,6 г. 284,62 г/моль * 2,5 моль = 711,6 г
- Нитроглицерин имеет молярную массу 227,09 г/моль. Здесь у вас есть два варианта:
- Вы можете посчитать, сколько весит 0,1 моль: 0,1 моль будет весить 22,7 г, значит, он выживет. 227,09 г/моль * 0,1 моль = 22,7 г
- Другой вариант такой: Сколько молей содержится в 13 г нитроглицерина? Вы знаете, что 1 моль равен 227,09 г, поэтому вы можете просто разделить 13 г на 227,09 г/моль, чтобы получить количество молей в этом количестве, это работает в обе стороны! Вы получите 0,057 моля, меньше 0,1, так что опять же, он выживает. М (нитроглицерин) = 227,09г/моль, m(нитроглицерин) = 13,0 г, n(нитроглицерин) = ? моль = м/м = (13,0 г) / (227,09 г/моль) = 0,057 моль
Надеюсь, теперь вы понимаете расчеты молярной массы. Я просто пригоню скорую для моего неуклюжего коллеги. Он может и не умереть, но ожоги будут ужасными!
Я просто пригоню скорую для моего неуклюжего коллеги. Он может и не умереть, но ожоги будут ужасными!
Расчеты молярной массы – основные выводы
- Молярная масса важна, потому что подсчет более пары сотен миллионов атомов один за другим был бы очень утомительным и трудоемким. Молярная масса говорит вам, сколько граммов атомов вам нужно вместо того, сколько штук атомов.
- Молярная масса рассчитывается путем сложения суммы атомных масс каждого элемента в соединении.
- Умножение молярного количества (количества атомов в соединении) на их молярную массу дает вес (граммы). Точно так же, разделив массу (граммы) на молярную массу (г/моль), вы получите молярное количество.
Ссылки
- ИЮПАК. Сборник химической терминологии, 2-е изд. («Золотая книга»). Составители А. Д. Макнот и А. Уилкинсон. Оксфорд 1997; ISBN 0-9678550-9-8., https://doi.org/10.1351/goldbook.
Часто задаваемые вопросы о расчете молярной массы
Формула для расчета молярной массы любого соединения очень проста. Вам нужно только сложить атомные массы всех атомов, составляющих молекулу , чтобы получить молярную массу соединения.
Вам нужно только сложить атомные массы всех атомов, составляющих молекулу , чтобы получить молярную массу соединения.
Молярная масса обычно используется в стехиометрических расчетах для преобразования молей в граммы. химические реакции фундаментально зависят от молей , но в лаборатории мы предпочитаем использовать граммы , поскольку это то, что мы можем измерить с помощью шкалы , поэтому нам нужно преобразование между ними.
Процесс расчета молярной массы Li 2 S так же прост, как сложение атомных масс атомов, из которых построена молекула. В данном случае это означает два атома лития и один атом серы с атомными массами 6,94 и 32,07 соответственно .
Молярная масса Li 2 S = 2 * 6,94 + 32,07 = 45,95 г/моль
Молярную массу любого данного соединения можно рассчитать относительно легко. Вам нужно только сложить атомные массы всех атомов, составляющих молекулу , чтобы получить молярную массу соединения.
Вам нужно только сложить атомные массы всех атомов, составляющих молекулу , чтобы получить молярную массу соединения.
Примером расчета молярной массы является, например, расчет молярной массы Li 2 S. Это делается следующим образом:
Процесс вычисления молярной массы Li 2 S так же прост, как сложение атомных масс атомов, из которых построена молекула. В данном случае это означает два атома лития и один атом серы с атомными массами 6,94 и 32,07 соответственно .
Молярная масса Li 2 S = 2 * 6,94 + 32,07 = 45,95 г/моль
Финальная викторина по расчету молярной массы
Вопрос
C 2 H 5 N(CH 2 CH 2 Cl) 2 — это азотистый иприт, который в основном использовался во время Первой мировой войны для уничтожения большого количества солдат. Однако я использую его в лаборатории для создания катализаторов. Забыл написать молярную массу. Можете ли вы помочь мне понять это?
Однако я использую его в лаборатории для создания катализаторов. Забыл написать молярную массу. Можете ли вы помочь мне понять это?
Показать ответ
Ответить
Итак, сначала вам нужно подсчитать все элементы в молекуле. Помните, что все в скобках учитывается столько раз, сколько индексов в скобках. Итак, атомов углерода 6, водорода 13, хлора 2 и азота 1. Это дает нам молярную массу 170,08 г/моль.
Показать вопрос
Вопрос
Рассчитайте молярную массу воды H 2 O и тяжелой воды D 2 O.
Подсказка: Атомный вес дейтерия (D) не указан в периодической таблице. Вы можете найти его в Google или рассматривать как версию 2.0 для этого упражнения.
Показать ответ
Ответ
Вода состоит из двух атомов водорода и одного кислорода, а тяжелая вода состоит из двух атомов дейтерия и одного кислорода. Теперь нам нужно сложить атомные веса (1+1+16 для воды и 2+2+16 для тяжелой воды). Таким образом, вы получаете 18 г/моль для воды, а для тяжелой воды — 20 г/моль.
Показать вопрос
Вопрос
Какова молярная масса H 2 ?
Показать ответ
Ответ
2 г/моль. Вы можете получить это, добавив атомную массу 1 дважды.
Показать вопрос
Вопрос
Каков атомный вес Li 2 S?
Показать ответ
Ответ
Это 45,95 г/моль. Вы можете получить это, сложив атомные веса 2 атомов лития и 1 атома серы.
Показать вопрос
Вопрос
Один из самых важных белков в Sars-CoV-2 (вирус Covid-19) имеет состав:
Углерод-1499 штук, Водород-2318 штук, Азот-402 штуки, Кислород- 445 шт, Сера-22 шт.
Да, это всего лишь одна большая молекула. Не подскажете молярную массу этого чудовища?
Показать ответ
Ответить
Как и в случае с любым другим соединением, мы можем просто все сложить.
1499 * 12 + 2318 * 1 + 402 * 14 + 445 * 16 +22 * 32 = 33758 г/моль
Показать вопрос
Вопрос
Если вы выпьете 4 чашки кофе одновременно, это эквивалентно 400 мг кофеина. Вы можете выжить до 10 миллимолей одновременно. (значение вымышленное, не пробуйте!)
Вы можете выжить до 10 миллимолей одновременно. (значение вымышленное, не пробуйте!)
Молярная масса кофеина составляет 194,19 г/моль. Ты будешь в порядке?
Показать ответ
Ответить
Разделив 400 миллиграммов на 194,19 грамма на моль, мы получим 0,0021 моль или 2,1 ммоль, так что, скорее всего, с вами все будет в порядке.
Показать вопрос
Вопрос
Сколько весят 2 моля NaCl (поваренной соли)?
Показать ответ
Ответ
Во-первых, мы должны вычислить молярную массу, которая равна 58,44 г/моль. Теперь умножьте это на количество молей, чтобы получить 116,88 грамма.
Показать вопрос
Вопрос
Какова молярная масса HF?
Показать ответ
Ответ
Около 20 г/моль.
Показать вопрос
Вопрос
Сколько молей содержится в 130 г хлорбензола? (C 6 H 5 Cl)
Показать ответ
Ответ
Это эквивалентно 1,16 моля
Показать вопрос
Вопрос
Кофе
Кофе содержит 1,0 грамма кофе
. Сколько молей кофеина содержится в 1-фунтовом пакетике кофе?
Сколько молей кофеина содержится в 1-фунтовом пакетике кофе?
Кофеин имеет следующую химическую формулу: C 8 H 10 N 4 O 2 Показать ответ
Ответить
В одном фунте около 450 г, что соответствует 6,1 г кофеина. Теперь нам нужна молярная масса, чтобы преобразовать это количество в моли. М = 194,2 г/моль для этого.
Разделив 6,1 на 194,2, мы получим 31,41 ммоль
Показать вопрос
Вопрос
Не могли бы вы сказать мне, сколько атомов углерода содержится в 5-каратном алмазе? ( 1 карат равен 0,2 г )
Показать ответ
Ответ
5 карат примерно равен 1 г. Алмаз содержит только атомы углерода, поэтому «молярная масса» алмаза составляет 12,0 г/моль. Таким образом, число атомов равно 1 г/12 г/моль * число Авогадро (примерно 6,02*10 23 ) . Получается примерно 5*10 22 атомов углерода.
Показать вопрос
Вопрос
Какова молярная масса NaI?
Показать ответ
Ответ
149,9 г/моль
Показать вопрос
Вопрос
Молярная масса Al 2 O 3 ?
Показать ответ
Ответ
Около 102 г/моль
Показать вопрос
Подробнее о расчете молярной массы
Откройте для себя подходящий контент для ваших тем
Не нужно жульничать, если у вас есть все необходимое для успеха! Упаковано в одно приложение!
Учебный план
Будьте идеально подготовлены вовремя с индивидуальным планом.
Тесты
Проверьте свои знания с помощью игровых тестов.
Карточки
Создавайте и находите карточки в рекордно короткие сроки.
Заметки
Создавайте красивые заметки быстрее, чем когда-либо прежде.
Учебные наборы
Все учебные материалы в одном месте.
Документы
Загружайте неограниченное количество документов и сохраняйте их в Интернете.
Study Analytics
Определите сильные и слабые стороны вашего исследования.
Еженедельные цели
Ставьте индивидуальные учебные цели и зарабатывайте баллы за их достижение.
Умные напоминания
Хватит откладывать на потом наши напоминания об учебе.
Награды
Зарабатывайте очки, открывайте значки и повышайте уровень во время учебы.
Волшебный маркер
Создавайте карточки в заметках полностью автоматически.
Умное форматирование
Создавайте самые красивые учебные материалы, используя наши шаблоны.
Разница между молярной массой и молекулярной массой
25 июня 2017 г.
от Madhusha
Чтение через 5 минут
Основное отличие – молярная масса против молекулярной массы
Молекулы – это вещества, образованные за счет комбинаций одних и тех же или разных атомов в разных соотношениях. Эти молекулы могут присоединяться друг к другу, образуя соединения. Почти во все химические реакции вовлечены изменения, происходящие в молекулах или соединениях. Поэтому очень важно понимать химические и физические свойства молекул, чтобы проводить химические реакции и предсказывать конечные продукты. Молярная масса и молекулярная масса — два таких физических свойства веществ. Основное различие между молярной массой и молекулярной массой заключается в том, что 9Молярная масса 1219 дает массу моля определенного вещества
, тогда как молекулярная масса — это масса молекулы определенного вещества. Разделив 6,1 на 194,2, мы получим 31,41 ммоль


Ключевые области, охватываемые
1. Что представляет собой молярная масса
Что представляет собой молярная масса
— Определение, формула, единицы, расчет
2. Что представляет , В чем разница между молярной массой и молекулярной массой
– Сравнение ключевых различий
Ключевые термины: атомы, углерод, изотоп, молярная масса, моль, молекулярный вес вещество. Это физическое свойство веществ. Молярная масса получается путем деления массы конкретного вещества на его количество.
Единицей СИ для молярной массы является кгмоль -1 или кг/моль. Но в целом дается в единицах гмоль -1 или г/моль.
Молярная масса элемента – это атомная масса этого элемента. Следовательно, молярная масса вещества может быть рассчитана путем сложения атомных масс каждого элемента, присутствующего в этой молекуле.
Расчет молярной массы
Рассчитаем молярную массу соединения H 2 O.
H 2 O:
- Количество присутствующих атомов водорода = 2
- Атомная масса водорода = 1,00794 г/моль
- Количество присутствующих атомов кислорода = 1
- Атомная масса кислорода = 15,999 г/моль
- Следовательно, молярная масса H 2 O = (2 x 1,00794 г/моль) + (1 x 15,999 г/моль)
= 18,01488 г/моль
Этот простой расчет показывает, что масса одного моля соединения H 2 O составляет 18 г.
Что такое молекулярная масса
Термин молекулярная масса может быть определен как масса молекулы. Его еще называют 9.1219 относительная молекулярная масса . Это связано с тем, что молекулярная масса рассчитывается как масса относительно изотопа углерода-12.
Рассматривая гипотетическую молекулу с именем A,
Приведенное выше уравнение показывает, что молекулярная масса не имеет единиц; это потому, что деление производится между двумя массами, имеющими одни и те же единицы измерения. Поэтому молекулярная масса указывается в атомных единицах массы или а.е.м. Используя приведенное выше уравнение, мы можем найти молекулярную массу элемента или соединения. Следовательно, как и в молярной массе, молекулярная масса конкретной молекулы равна сумме атомных масс каждого элемента.
Расчет молекулярной массы
Если рассмотреть тот же пример H 2 O,
- Количество присутствующих атомов водорода = 2
- Количество присутствующих атомов кислорода = 1
- Масса атома водорода = 1,00794 а.
 е.м.
е.м. - Масса атома кислорода = 15,999 а.е.м.
- Следовательно, молекулярная масса H 2 O = (2 x 1,00794 а.е.м.) + (1 x 15,999 а.е.м.)
= 18,01488 а.е.м.
Это указывает на то, что и молярная масса, и молекулярная масса одинаковы по своим значениям, но различаются по своим единицам.
Рисунок 1: Фосфин. Молярная масса фосфина 33,99758 г/моль. Молекулярная масса составляет 33,99758 а.е.м.
Разница между молярной массой и молекулярной массой
Определение
Молярная масса: Молярная масса – это масса моля определенного вещества.
Молекулярная масса: Термин «молекулярная масса» может быть определен как масса молекулы.
Единицы
Молярная масса: Единицей молярной массы является кгмоль-1 (или кг/моль).
Молекулярная масса: Молекулярная масса безразмерна, но выражается в а. е.м. (или атомных единицах массы).
е.м. (или атомных единицах массы).
Расчет
Молярная масса: Молярная масса рассчитывается путем деления массы вещества на количество вещества.
Молекулярная масса: Молекулярная масса рассчитывается как масса вещества по отношению к 1/12 -й массы атома углерода-12.
Заключение
Основное различие между молярной массой и молекулярной массой заключается в том, что молярная масса дает массу моля определенного вещества, тогда как молекулярная масса представляет собой массу молекулы определенного вещества. Хотя определение и единицы для молярной массы и молекулярной массы различаются, значение одинаковое. Это физические свойства веществ, которые очень полезны в методах химического анализа.
Ссылки:
1. Хельменстин, Энн Мари. «Что такое молекулярная масса? Химическое определение». Мысль Ко. н.п., н.д. Веб. Доступна здесь. 21 июня 2017 г.
2. «Почему важна молярная масса?» наука. н.п., н.д. Веб. Доступна здесь. 21 июня 2017 г.
н.п., н.д. Веб. Доступна здесь. 21 июня 2017 г.
Изображение предоставлено:
1. «Монофосфан» Автор NEUROTiker — собственная работа, общественное достояние) через Commons Wikimedia
Об авторе: Мадхуша
Мадхуша имеет степень бакалавра (с отличием) в области биологических наук и в настоящее время получает степень магистра в области промышленной и экологической химии. Области ее интересов для написания и исследований включают биохимию и химию окружающей среды.
Просмотреть все сообщения
Вам также могут понравиться эти
Числа, математика и статистика — Набор академических навыков
Молярные расчеты
ContentsToggle Главное меню 1 Атомный вес 2 Молекулярный вес 3 Моли 4 Растворы 4.1 1) Молярность 4.2 2) Массовая концентрация 4.3 Примечание о единицах концентрации 4.4 Разбавляющие растворы 5 Проверьте себя
Атомный вес
Атомный вес (или атомная масса ) элемента говорит нам в среднем, сколько весит один атом данного элемента, принимая во внимание учитывать типичные пропорции изотопов. Например, около 98,9% встречающегося в природе углерода составляет 12 C («Углерод 12») и около 1,1% составляет 13 C, поэтому углерод имеет атомный вес \begin{equation} 0,989 \times 12 + 0,011 \times 13 = 12,011. \end{equation} (Этот тип суммы известен как средневзвешенное , вычисление атомных весов на самом деле немного более техническое, чем это, но мы не будем вдаваться в подробности здесь).
Например, около 98,9% встречающегося в природе углерода составляет 12 C («Углерод 12») и около 1,1% составляет 13 C, поэтому углерод имеет атомный вес \begin{equation} 0,989 \times 12 + 0,011 \times 13 = 12,011. \end{equation} (Этот тип суммы известен как средневзвешенное , вычисление атомных весов на самом деле немного более техническое, чем это, но мы не будем вдаваться в подробности здесь).
Единицей атомного веса является дальтон (Да). Некоторые примеры атомных весов приведены ниже.
Кальций (Ca) | 40.078 |
Углерод (C) | 12.011 |
Водород (H) | 1,008 |
Азот (N) | 14.007 |
Кислород (O) | 15,999 |
Фосфор (P) | 30,974 |
Сера (S) | 32. |
Молекулярный вес
Молекулы состоят из нескольких атомов, например, молекула двуокиси углерода (CO 2 ) состоит из 1 атома углерода и 2 атомов кислорода. Молекулярная масса (или молекулярная масса или относительная молекулярная масса (RMM) ) представляет собой сумму атомных весов всех атомов в молекуле.
Пример 1
Рассчитайте молекулярную массу двуокиси углерода — CO 2 .
Раствор
Молекула двуокиси углерода состоит из 1 атома углерода и 2 атомов кислорода. У углерода атомный вес 12,011, а у кислорода атомный вес 15,999, поэтому молекулярный вес двуокиси углерода равен \begin{equation} 1 \times 12,011 + 2 \times 15,999 = 44,009 \text{ Да}. \end{уравнение}
Пример 2
Рассчитайте молекулярную массу монокальцийфосфата — Ca(H 2 PO 4 ) 2 .
Раствор
Молекула монокальцийфосфата имеет 1 атом кальция и 2 иона дигидрофосфата (H 2 PO 4 ). Нам не нужно слишком беспокоиться о том, что здесь представляет собой ион, мы просто отметим, что обозначение (H 2 PO 4 ) 2 означает, что есть 2 партии H 2 PO 4 для всего 4 атома водорода, 2 атома фосфора и 8 атомов кислорода. Следовательно, молекулярная масса монокальцийфосфата равна \begin{equation} 1 \times 40,078 + 4 \times 1,008 + 2 \times 30,9.74 + 8 \× 15,999 = 234,05 \text{Да}. \end{equation}
Нам не нужно слишком беспокоиться о том, что здесь представляет собой ион, мы просто отметим, что обозначение (H 2 PO 4 ) 2 означает, что есть 2 партии H 2 PO 4 для всего 4 атома водорода, 2 атома фосфора и 8 атомов кислорода. Следовательно, молекулярная масса монокальцийфосфата равна \begin{equation} 1 \times 40,078 + 4 \times 1,008 + 2 \times 30,9.74 + 8 \× 15,999 = 234,05 \text{Да}. \end{equation}
Проверь себя
Тест Numbas на молекулярную массу
Моль
моль — это количество вещества (в граммах), которое численно равно его молекулярной массе. Например, один моль углерода весит 12,011 грамма, а один моль монокальцийфосфата (Ca(H 2 PO 4 ) 2 ) весит 234,05 грамма. Количество молекул вещества в одном моле равно 6,02 $\times$ 10 23 , этот номер известен как номер Авогадро .
Если мы знаем молекулярную массу вещества, мы можем рассчитать, сколько будет весить заданное количество молей, используя формулу
\begin{equation} \text{молекулярная масса} \times \text{количество молей} = \ text{масса вещества (в граммах)}. \end{equation}
\end{equation}
Пример 3
Хлорид натрия (NaCl) имеет молекулярную массу 58,44. Сколько весят 3 моля хлорида натрия?
Решение
Используя приведенную выше формулу, мы находим, что 3 моля хлорида натрия весят \begin{equation} 58,44 \times 3 = 175,32\text{г}. \end{equation} Мы не ограничены работой с целыми числами для количества молей.
Пример 4
Сколько весят 2,4 моля монофосфата кальция (Ca(H 2 PO 4 ) 2 )?
Раствор
Мы видели в примере 2, что монокальцийфосфат имеет молекулярную массу 234,05, поэтому, используя нашу формулу, мы находим, что 2,4 моля монокальцийфосфата весят \begin{equation} 234,05 \times 2,4 = 561,72\text{г}. \end{уравнение}
Если мы знаем массу вещества и молекулярный вес, мы можем вычислить, сколько молей вещества мы имеем, изменив формулу \begin{equation} \text{молекулярная масса} \times \text{число молей} = \text{масса вещества} \end{уравнение} для получения
\begin{уравнение} \frac{\text{масса вещества (в граммах)}}{\text{молекулярная масса}} = \text{число родинок}. \end{equation}
\end{equation}
Пример 5
Глюкоза (C 6 H 12 O 6 ) имеет молекулярную массу 180,16, сколько молей глюкозы содержится в 45 г?
Решение
Используя нашу измененную формулу, мы находим, что в 45 г содержится \begin{equation} \frac{45}{180,16} = 0,222 \text{ молей} \end{equation} глюкозы.
Формула треугольника
Чтобы запомнить формулы в этом разделе, вы можете использовать формулу треугольника. Чтобы получить формулу из треугольника, закройте значение, которое вы хотите вычислить, и используйте оставшиеся два значения. Если они находятся рядом друг с другом, умножьте их, чтобы получить ответ, если одно находится поверх другого, разделите верхнее на нижнее, чтобы получить ответ.
Проверь себя
Numbas тест на родинках
Растворы
Часто мы хотим растворить вещество, например. глюкоза в жидкости, напр. воды для приготовления раствора. Когда мы делаем это, нам нужен способ описать, сколько нашего вещества находится в данном объеме жидкости, это известно как концентрация раствора. Существуют разные способы описания концентрации раствора, мы рассмотрим 2 из них.
Существуют разные способы описания концентрации раствора, мы рассмотрим 2 из них.
1) Молярность
Молярность раствора равна количеству молей растворенного вещества, деленному на количество литров раствора. То есть
\begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}. \end{equation}
Если у нас есть 1 моль вещества, растворенного в 1 литре жидкости (т.е. 1 моль/л), мы называем это 1 молярным (1М) раствором, если у нас есть 1 моль вещества, растворенного в 2 литров жидкости (т.е. 0,5 моль/л), это называется 0,5 молярным (0,5 М) раствором и так далее.
2) Массовая концентрация
Массовая концентрация раствора равна массе растворенного вещества, деленной на объем жидкости, использованной для приготовления раствора. Для расчета используем формулу
\begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в г/л)}. \end{equation}
\end{equation}
Примечание о единицах концентрации
Иногда для массовой концентрации используются единицы, отличные от г/л, например мг/100 мл (миллиграммы на 100 миллилитров), и существуют другие способы описания концентрации кроме молярности и массовой концентрации. Если вы хотите узнать немного больше о различных способах измерения концентрации раствора, см. Википедия: Концентрация. В этой статье мы будем работать только с г/л при использовании массовой концентрации. Если вы используете другие единицы для массовой концентрации, будьте осторожны при использовании формул в этой статье. В формулах в этой статье используется массовая концентрация в (г/л), поэтому вам придется преобразовать используемые вами единицы в (г/л), чтобы использовать их. Дополнительные сведения о том, как это сделать, см. в разделе, посвященном размерам.
Давайте рассмотрим несколько примеров, касающихся молярности.
Пример 6
7 молей вещества растворяют в 4 литрах жидкости, чтобы получить раствор, какова концентрация раствора в М (моль/л)?
Раствор
Используя нашу формулу, мы находим, что концентрация равна \begin{equation} \frac{7}{4} = 1,75\text{M} \end{equation}, поэтому мы имеем 1,75-молярный раствор.
Мы также работаем с единицами измерения, отличными от литров (л), когда имеем дело с жидкостями, такими как миллилитры (мл). Мы должны помнить, что в нашей формуле используется объем жидкости в литрах, поэтому, если нам говорят объем в миллилитрах и мы хотим определить концентрацию, мы сначала должны преобразовать наш объем в миллилитрах в объем в литрах. Дополнительные сведения о том, как это сделать, см. в разделе, посвященном размерам.
Пример 7
Полмоля вещества растворяют в 250 мл жидкости, чтобы получить раствор. Какова концентрация раствора в М (моль/л)?
Раствор
Наша формула говорит нам, что \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/ L)} \end{equation} и мы знаем, что у нас есть 250 мл раствора, поэтому сначала нам нужно определить, сколько это в литрах. В 1 л содержится 1000 мл, поэтому, чтобы получить объем в литрах, мы делим 250 на 1000, чтобы получить \begin{equation} \frac{250}{1000} = 0,25\text{L}. \end{equation} Теперь мы можем рассчитать концентрацию, как и раньше, у нас есть полмоля вещества в 0,25 л жидкости, поэтому концентрация равна \begin{equation} \frac{0,5}{0,25} = 2\text{M }. \end{уравнение}
\end{equation} Теперь мы можем рассчитать концентрацию, как и раньше, у нас есть полмоля вещества в 0,25 л жидкости, поэтому концентрация равна \begin{equation} \frac{0,5}{0,25} = 2\text{M }. \end{уравнение}
Если мы знаем объем раствора и концентрацию, мы можем вычислить количество молей растворенного вещества, изменив формулу \begin{equation} \frac{\text{число молей вещества}}{\text {объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}. \end{уравнение} для получения
\begin{уравнение} \text{объем жидкости (в литрах)} \times \text{концентрация (в моль/л)} = \text{количество молей вещества}. \end{уравнение}
Пример 8
Сколько молей глюкозы содержится в 3 л 0,5 М раствора?
Раствор
Используя нашу формулу, находим, что \begin{equation} 3 \times 0,5 = 1,5 \text{ моль} \end{equation} глюкозы в 3 л 0,5 М раствора.
Пример 9
Сколько молей хлорида натрия содержится в 50 мл 5М раствора?
Раствор
В нашей формуле используется объем в литрах, поэтому нам нужно преобразовать 50 мл в объем в литрах. В 1 л 1000 мл, поэтому 50 мл равны \begin{equation} \frac{50}{1000} = 0,05\text{L}. \end{equation} Используя нашу формулу, находим, что количество молей хлорида натрия в растворе равно \begin{equation} 0,05 \times 5 = 0,25 \text{ молей}. \end{уравнение}
В 1 л 1000 мл, поэтому 50 мл равны \begin{equation} \frac{50}{1000} = 0,05\text{L}. \end{equation} Используя нашу формулу, находим, что количество молей хлорида натрия в растворе равно \begin{equation} 0,05 \times 5 = 0,25 \text{ молей}. \end{уравнение}
Более длинный пример:
Пример 10
Глюкоза (C 6 H 12 O 6 ) имеет молекулярную массу 180,16, какую массу глюкозы нужно растворить в 500 мл воды Решение 3М?
Решение
Давайте разобьем этот вопрос на части. Сначала нам нужно знать, сколько молей глюкозы нам нужно, чтобы получить раствор 3M, используя 500 мл воды. В нашей формуле используется объем в литрах, поэтому нам нужно преобразовать 500 мл в объем в литрах, сделав это, мы обнаружим, что 500 мл равны \begin{equation} \frac{500}{1000} = 0,5\text{L}. \end{equation} Чтобы найти количество молей, необходимое для получения раствора 3М из 0,5 л (500 мл) воды, мы используем формулу \begin{equation} \text{объем жидкости (в литрах)} \times \ text{концентрация (в моль/л)} = \text{количество молей вещества}. \end{equation} Подставив наши числа, мы находим, что нам нужно \begin{equation} 0,5 \times 3 = 1,5 \text{ моль} \end{equation} глюкозы. Наконец, чтобы вычислить необходимую нам массу глюкозы, мы используем формулу \begin{equation} \text{молекулярная масса} \times \text{число молей} = \text{масса вещества}. \end{equation} В вопросе нам говорят, что молекулярная масса глюкозы равна 180,16, поэтому, подставив наши числа, мы получим, что нам нужно \begin{equation} 180,16 \times 1,5 = 270,24\text{г} \end{equation } глюкозы. То есть, если мы растворим 270,24 г глюкозы в 500 мл (0,5 л) воды, мы получим 3М раствор.
\end{equation} Подставив наши числа, мы находим, что нам нужно \begin{equation} 0,5 \times 3 = 1,5 \text{ моль} \end{equation} глюкозы. Наконец, чтобы вычислить необходимую нам массу глюкозы, мы используем формулу \begin{equation} \text{молекулярная масса} \times \text{число молей} = \text{масса вещества}. \end{equation} В вопросе нам говорят, что молекулярная масса глюкозы равна 180,16, поэтому, подставив наши числа, мы получим, что нам нужно \begin{equation} 180,16 \times 1,5 = 270,24\text{г} \end{equation } глюкозы. То есть, если мы растворим 270,24 г глюкозы в 500 мл (0,5 л) воды, мы получим 3М раствор.
Давайте также рассмотрим пример, связанный с массовой концентрацией.
Пример 11
318 г карбоната натрия растворяют в 1500 мл воды. Какая концентрация в г/л?
Раствор
Нас спрашивают о концентрации в г/л, а наш объем был указан в мл, поэтому сначала мы должны преобразовать 1500 мл в объем в литрах. В 1 л 1000 мл, поэтому 1500 мл равно \begin{equation} \frac{1500}{1000} = 1,5 \text{ л}. \end{equation} Подставляем наши числа в формулу \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация ( в г/л)} \end{equation} получаем, что концентрация в г/л равна \begin{equation} \frac{318}{1.5} = 212 \text{ г/л}. \end{уравнение}
\end{equation} Подставляем наши числа в формулу \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация ( в г/л)} \end{equation} получаем, что концентрация в г/л равна \begin{equation} \frac{318}{1.5} = 212 \text{ г/л}. \end{уравнение}
Формула треугольников
Чтобы запомнить формулы в этом разделе, вы можете использовать формулы треугольников. Чтобы получить формулу из треугольника, закройте значение, которое вы хотите вычислить, и используйте оставшиеся два значения. Если они находятся рядом друг с другом, умножьте их, чтобы получить ответ, если одно находится поверх другого, разделите верхнее на нижнее, чтобы получить ответ. Убедитесь, что вы используете правильный треугольник в зависимости от того, хотите ли вы, чтобы концентрация была в моль/л или г/л!
Проверь себя
Тест Numbas на растворах
Разбавляющие растворы
Если у нас есть раствор определенной концентрации, мы можем добавить больше жидкости (без добавления вещества), чтобы разбавить раствор. Это снижает концентрацию раствора. Например, если у нас есть 500 мл 1М раствора глюкозы в воде, мы можем добавить еще 500 мл воды, чтобы разбавить раствор. Мы можем определить концентрацию разбавленного раствора следующим образом. Формула концентрации раствора: \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л) )}. \end{equation} Мы начали с 500 мл раствора, а затем добавили еще 500 мл воды, так что теперь общий объем жидкости в растворе равен \begin{equation} 500 + 500 = 1000 \text{ мл} \end{equation} что равен 1 л. Нам также необходимо знать, сколько молей глюкозы содержится в растворе. Мы начали с 500 мл 1М раствора и больше не добавляли вещества (глюкозы), поэтому у нас осталось то же количество молей, с которого мы начали. Мы можем рассчитать это по формуле \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)} , \end{equation} помня, что объем в этой формуле указан в литрах, а не в мл, и что 500 мл = 0,5 л.
Это снижает концентрацию раствора. Например, если у нас есть 500 мл 1М раствора глюкозы в воде, мы можем добавить еще 500 мл воды, чтобы разбавить раствор. Мы можем определить концентрацию разбавленного раствора следующим образом. Формула концентрации раствора: \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л) )}. \end{equation} Мы начали с 500 мл раствора, а затем добавили еще 500 мл воды, так что теперь общий объем жидкости в растворе равен \begin{equation} 500 + 500 = 1000 \text{ мл} \end{equation} что равен 1 л. Нам также необходимо знать, сколько молей глюкозы содержится в растворе. Мы начали с 500 мл 1М раствора и больше не добавляли вещества (глюкозы), поэтому у нас осталось то же количество молей, с которого мы начали. Мы можем рассчитать это по формуле \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)} , \end{equation} помня, что объем в этой формуле указан в литрах, а не в мл, и что 500 мл = 0,5 л. Количество молей, с которого мы начали, равно количеству молей глюкозы в 0,5 л (500 мл) 1 М раствора, что равно \begin{equation} 1 \times 0,5 = 0,5 \text{ моль}. \end{equation} Это означает, что мы начали с 0,5 моль глюкозы в 0,5 л (500 мл) воды, а затем добавили еще 500 мл воды, чтобы разбавить раствор, так что теперь у нас есть 0,5 моль глюкозы в 1 л (1000 мл) воды. Теперь воспользуемся формулой \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}. \end{equation}, чтобы найти новую концентрацию, которая равна \begin{equation} \frac{0,5}{1} = 0,5 \text{ M}. \end{equation} Это половина концентрации, с которой мы начали. Как и следовало ожидать, если мы начнем с раствора заданной концентрации, а затем разбавим его, удвоив общий объем жидкости (мы перешли от 500 мл к 1000 мл), не добавляя больше вещества, новая концентрация составит половину концентрации, которую мы началось с.
Количество молей, с которого мы начали, равно количеству молей глюкозы в 0,5 л (500 мл) 1 М раствора, что равно \begin{equation} 1 \times 0,5 = 0,5 \text{ моль}. \end{equation} Это означает, что мы начали с 0,5 моль глюкозы в 0,5 л (500 мл) воды, а затем добавили еще 500 мл воды, чтобы разбавить раствор, так что теперь у нас есть 0,5 моль глюкозы в 1 л (1000 мл) воды. Теперь воспользуемся формулой \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}. \end{equation}, чтобы найти новую концентрацию, которая равна \begin{equation} \frac{0,5}{1} = 0,5 \text{ M}. \end{equation} Это половина концентрации, с которой мы начали. Как и следовало ожидать, если мы начнем с раствора заданной концентрации, а затем разбавим его, удвоив общий объем жидкости (мы перешли от 500 мл к 1000 мл), не добавляя больше вещества, новая концентрация составит половину концентрации, которую мы началось с.
Пример 12
20 мл 0,25 М раствора разбавляют добавлением еще 480 мл жидкости. Какова новая концентрация в М (моль/л)?
Какова новая концентрация в М (моль/л)?
Решение
Мы начали с 20 мл жидкости и добавили еще 480 мл, так что новый объем жидкости равен \begin{equation} 20 + 480 = 500 \text{ мл}. \end{equation} 20 мл равно \begin{equation} \frac{20}{1000} = 0,02 \text{ L} \end{equation}, поэтому количество молей, с которого мы начали, равно \begin{equation} 0,02 \ умножить на 0,25 = 0,005 \text{молей}. \end{equation} Мы не добавляли больше вещества, так что у нас все еще есть 0,005 моля, но теперь оно растворено в 500 мл жидкости. 500 мл равны 0,5 л, поэтому новая концентрация равна \begin{equation} \frac{0,005}{0,5} = 0,01 \text{ М}. \end{уравнение}
Примечание
Другой способ задать этот вопрос состоит в том, чтобы сказать следующее:
20 мл 0,25 М раствора разбавляют до 500 мл, какова новая концентрация в М (моль/л)?
«Разбавить до 500 мл» означает добавить достаточное количество жидкости, чтобы новый объем жидкости составил 500 мл. Таким же образом мы можем вычислить новую концентрацию, но первый шаг определения нового общего объема жидкости (500 мл) уже сделан. Если бы нас попросили приготовить этот раствор, нам нужно было бы рассчитать, сколько жидкости нам нужно добавить, чтобы получить новый общий объем 500 мл. В приведенном выше примере мы начали с 20 мл 0,25 М раствора, поэтому, чтобы разбавить его до 500 мл, нам нужно было бы добавить еще \begin{equation} 500 — 20 = 480 \text{ мл} \end{equation} жидкости.
Если бы нас попросили приготовить этот раствор, нам нужно было бы рассчитать, сколько жидкости нам нужно добавить, чтобы получить новый общий объем 500 мл. В приведенном выше примере мы начали с 20 мл 0,25 М раствора, поэтому, чтобы разбавить его до 500 мл, нам нужно было бы добавить еще \begin{equation} 500 — 20 = 480 \text{ мл} \end{equation} жидкости.
Давайте рассмотрим пример, объединяющий несколько изученных нами идей.
Пример 13
Исходный раствор содержал 318 г карбоната натрия (Na 2 CO 3 ) в 1 л раствора. 50 мл исходного раствора разбавляли до 250 мл. Какова концентрация конечного раствора в г/л и М (моль/л). [Требуемые относительные атомные массы (Да): Na 22,990; С 12.011; О 15,999].
Решение
В этом примере нас попросили сделать довольно много вычислений, поэтому давайте разобьем его на несколько более мелких частей. Чтобы рассчитать концентрации в г/л и моль/л после разбавления, нам нужно сначала рассчитать концентрации в г/л и моль/л «исходного» раствора. Начнем с расчета концентрации «исходного» раствора в г/л.
Начнем с расчета концентрации «исходного» раствора в г/л.
Исходный раствор содержит 318 г карбоната натрия, растворенного в 1 л жидкости. Для расчета концентрации в г/л используем формулу \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{ концентрация (в г/л)}. \end{equation} Подставив наши числа, мы находим, что концентрация «исходного» раствора в г/л равна \begin{equation} \frac{318}{1} = 318 \text{ г/л}. \end{equation}
Далее мы можем определить концентрацию исходного раствора в M (моль/л). Формула для этого: \begin{equation} \frac{\text{число молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}. \end{уравнение}
Мы видим, что нам нужно выяснить, сколько молей карбоната натрия (Na 2 CO 3 ) содержится в 318 г. Формула для этого: \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{молекулярная масса}} = \text{количество молей}. \end{equation}
Мы видим, что для этого нам нужно определить молекулярную массу карбоната натрия (Na 2 CO 3 ). Нам сказали атомный вес каждого из атомов в карбонате натрия (Na 2 CO 3 ), поэтому мы можем сделать это, сложив атомные массы всех атомов, чтобы получить молекулярную массу, которая равна \begin{equation} 2 \times 22,990 + 1 \times 12,011 + 3 \times 15,999 = 82,998 \text{ Да}. \end{equation}
Нам сказали атомный вес каждого из атомов в карбонате натрия (Na 2 CO 3 ), поэтому мы можем сделать это, сложив атомные массы всех атомов, чтобы получить молекулярную массу, которая равна \begin{equation} 2 \times 22,990 + 1 \times 12,011 + 3 \times 15,999 = 82,998 \text{ Да}. \end{equation}
Теперь мы можем использовать это, чтобы определить, сколько молей карбоната натрия содержится в 318 г, используя приведенную выше формулу. Подставляя числа, мы получаем, что \begin{equation} \frac{318}{82,998} = 3,831 \text{ молей на 3 д.п. (десятичные знаки)} \end{уравнение} карбоната натрия в 318г. Теперь мы можем определить концентрацию «исходного» раствора в М (моль/л). Формула \begin{equation} \frac{\text{количество молей вещества}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в моль/л)}. \end{equation} У нас есть 318 г карбоната натрия, растворенного в 1 л жидкости, и мы подсчитали, что в 318 г содержится 3,831 моль карбоната натрия. Подставляя эти числа в формулу, получаем, что концентрация «исходного» раствора в M равна \begin{equation} \frac{3,831}{1} = 3,831 \text{ M}. \end{уравнение}
\end{уравнение}
Давайте подытожим наши расчеты. Мы выяснили, что концентрация «исходного» раствора в г/л составляет \begin{equation} 318 \text{ г/л} \end{equation}, а в M — \begin{equation} 3,831 \text{ M }. \end{equation}
Поскольку мы разбавляем 50 мл исходного раствора, нам нужно определить, сколько карбоната натрия содержится в 50 мл раствора, используя рассчитанные нами концентрации. Нам нужно вычислить это количество как в граммах, так и в молях, начнем с граммов. Если мы переформулируем формулу \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в г/л)} . \end{equation} находим, что
\begin{equation} {\text{объем жидкости (в литрах)}} \times \text{концентрация (в г/л)} = \text{масса вещества (в граммах)}. \end{equation}
Итак, 50 мл равны \begin{equation} \frac{50}{1000} = 0,05 \text{ л}, \end{equation}, поэтому в 50 мл исходного раствора содержится \begin{equation} 0,05 \times 318 = 15,9 \text{ г} \end{equation} карбоната натрия. Точно так же мы можем определить количество молей карбоната натрия, используя формулу \begin{equation} {\text{объем жидкости (в литрах)}} \times \text{концентрация (в моль/л)} = \text {количество молей вещества}. \end{уравнение}. Подставляя наши числа, получаем, что в 50 мл «базового» раствора содержится \begin{equation} 0,05 \times 3,831 = 0,19.2 \text{ моль на 3 д.п.} \end{уравнение} карбоната натрия.
Точно так же мы можем определить количество молей карбоната натрия, используя формулу \begin{equation} {\text{объем жидкости (в литрах)}} \times \text{концентрация (в моль/л)} = \text {количество молей вещества}. \end{уравнение}. Подставляя наши числа, получаем, что в 50 мл «базового» раствора содержится \begin{equation} 0,05 \times 3,831 = 0,19.2 \text{ моль на 3 д.п.} \end{уравнение} карбоната натрия.
Наконец, мы можем определить концентрацию разбавленного раствора. Мы знаем, что 50 мл исходного раствора разбавляют до 250 мл, поэтому конечный объем жидкости составляет 250 мл. Мы выяснили, что в 50 мл исходного раствора содержится 15,9 г (0,192 моля) карбоната натрия, и мы не добавляли больше карбоната натрия, поэтому в нашем разбавленном растворе мы имеем 15,9 г (0,192 моля) карбоната натрия в 250 мл жидкости. . Формула концентрации в г/л: \begin{equation} \frac{\text{масса вещества (в граммах)}}{\text{объем жидкости (в литрах)}} = \text{концентрация (в г/л)}. \end{equation} 250 мл равны 0,25 л, поэтому концентрация разбавленного раствора в г/л равна \begin{equation} \frac{15,9{0,25} = 63,6 \text{ г/л}.

