Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.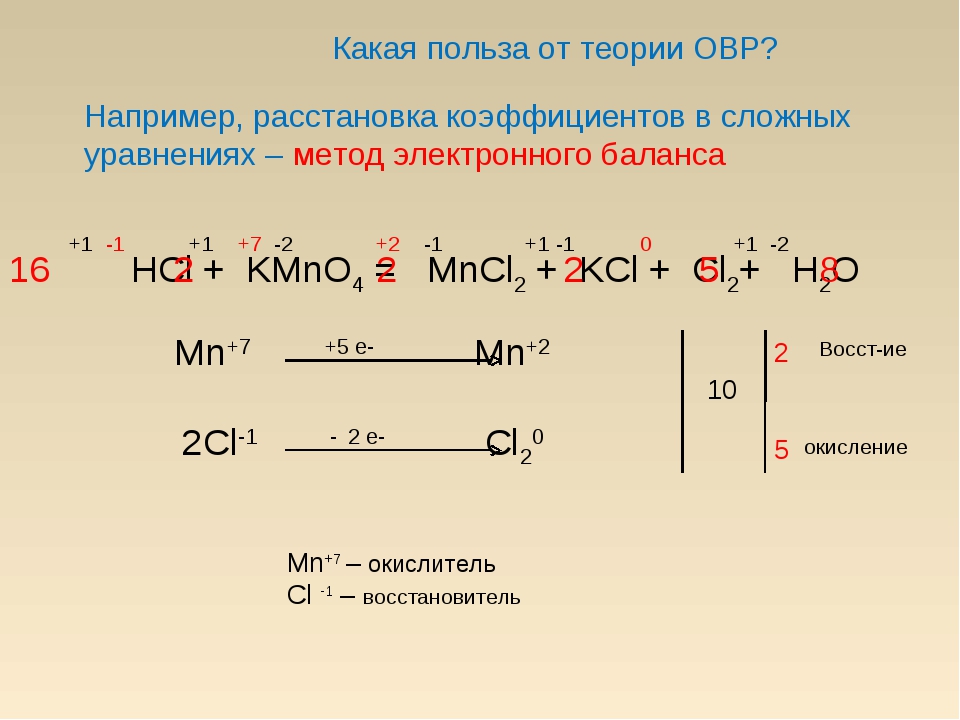
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Понравилось это:
Нравится Загрузка…
Физические и химические явления. Закон сохранения массы веществ. Уравнения химических реакций. Типы химических реакций презентация, доклад
Физические и химические явления. Закон сохранения массы веществ. Уравнения химических реакций. Типы химических реакций.(8 класс)
Титович Е.Н.
Тема урока: Физические и химические явления, Химические реакции
Цель урока: Познакомить с признаками физических и химических явлений, научить записывать уравнения простейших реакций.
Явления
Физические
Химические
Замерзание воды
Изгибание стеклянной трубки
Плавление парафина
Горение Бумаги
Скисание молока
Потемнение медного подсвечника
Признаки
явлений Физических и Химических
Закон сохранения массы веществ,уравнения химических реакций
М.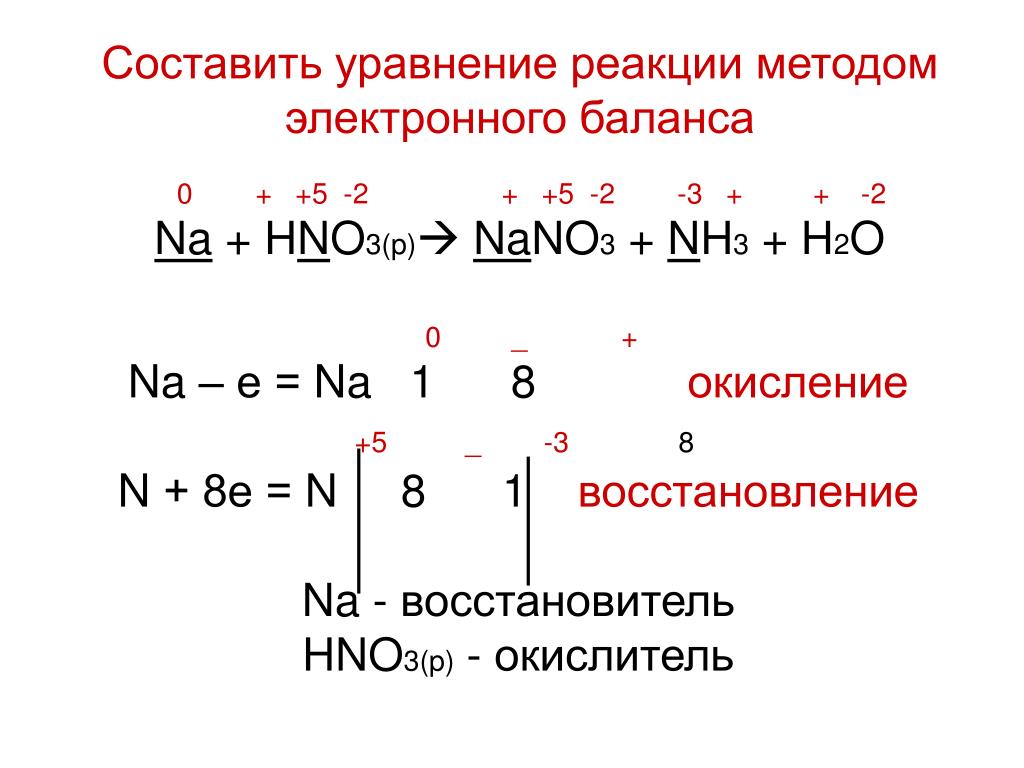 В. Ломоносов
В. Ломоносов
Роберт Бойль
А.Л. Лавуазье
А.
Уравнения химических реакций
Химическое уравнение- условная запись химической реакции с помощью химических формул и коэффициентов
С+О2=СО2
Р+ О2=
AL+ O2 =
Mg+CL2=
AL+S=
P O
+5
-2
2
5
5
2
4
Al O
-2
2
2
3
+3
4
3
Запишите уравнения реакций, подтвердите расчётом закон сохранения массы веществ
Ca+ O2=
Mg+ N2=
AL+ CL2=
h3O= h3 +…
AL + HCl = AlCL3 + …
Na+ Cl2 =
K+ S =
CO+ Fe2O3 = CO2+ …
Типы химических реакций
Обмена
Разложения
Замещения
А+В=АВ
АВ=А+В
А+ВС=АС+В
АВ+СД=СВ+АД
Соединения
Закончить уравнения реакций и определить их тип
K+ N2=
AL+ Fe3O4= … + …
Ba+ O2=
KOH+ ALCL3= AL(OH)3+….
HgO= O2 + …
SO2+ O2= SO3
Na2O+ h3O=
Mg+ h4PO4= Mg3(PO4)2 +…
Для первого и второго уравнения подтвердить расчётом
закон сохранения массы веществ
Запишите уравнения реакций между:
1 серной кислотой и гидроксидом алюминия
3 сульфатом алюминия и гидроксидом натрия
4 сульфатом меди(II) и алюминием
5 карбонатом кальция и азотной кислотой
6 нитратом железа(III) и гидроксидом калия
7 оксидом железа(III) и алюминием
8 алюминием и соляной кислотой
9 хлоридом бария и сульфатом натрия
10 сернистой кислотой и гидроксидом калия
Самостоятельная работа
АL+O2=
Mg+ HCL=MgCL2+…
K2O+HCL= KCL+…
Ag2O=Ag+…
Na+O2=
BaO+HCL=BaCL2+…
h3O=h3+…
C+CuO=CO2+…
В-1
В-2
Для последнего уравнения
подтвердите расчётом закон
сохранения массы веществ.
Закончите уравнения реакций, расставьте
коэффициенты, укажите тип реакции.
Скачать презентацию
Видео с вопросами: расчет молярной концентрации Mg(OH)₂ с использованием данных эксперимента по титрованию
Концентрацию образца магнезиального молока, Mg(OH)₂, определяли титрованием фосфорной кислотой (H3PO4). Для нейтрализации 30 мл магнезиального молока потребовалось 54,8 мл 0,5 М фосфорной кислоты. Уравнение этой реакции показано: 2H₃PO₄ + 3Mg(OH)₂ ⟶ 6H₂O + Mg3(PO₄)₂, Какова была концентрация магнезиального молока?Только для подписчиков
04:22
Стенограмма видео
Концентрация образца
магнезиального молока, Mg(OH)2 определяли титрованием фосфорной кислотой,
h4PO4. 30 миллилитров магнезиального молока
для его нейтрализации потребовалось 54,8 миллилитров 0,5-молярной фосфорной кислоты. Уравнение этой реакции
показано. Два h4PO4 плюс три Mg(OH)2 реагируют
с образованием шести H3O плюс Mg3(PO4)2. Какова была концентрация
молоко магнезии?
Уравнение этой реакции
показано. Два h4PO4 плюс три Mg(OH)2 реагируют
с образованием шести H3O плюс Mg3(PO4)2. Какова была концентрация
молоко магнезии?
Этот вопрос просит нас рассчитать концентрацию образца молока магнезии, используя результаты эксперимент по титрованию. Титрование – это количественный аналитический метод, используемый для определения концентрации аналита с использованием известного концентрация второго раствора.
Описание эксперимента по титрованию
в этой задаче – кислотно-основное титрование. В ходе эксперимента фосфор
кислоту, или h4PO4, добавляют в магнезиальное молоко, содержащее основание, магний
гидроксид или Mg(OH)2. Реакция нейтрализации протекает
место, производя воду и соль фосфата магния. Молярное отношение кислоты к основанию равно
от двух до трех.
Освободим место для записи экспериментальные данные, приведенные в задаче.
Концентрация фосфорной кислоты в этом эксперименте составляет 0,5 мол. Объем фосфорной кислоты необходимое для нейтрализации молочка магнезии составляет 54,8 миллилитров. Объем молока магнезии в эксперименте 30 миллилитров. И цель этой проблемы состоит в том, чтобы рассчитать молярную концентрацию магнезии в молоке.
Решение этой проблемы требует трех
шаги. Во-первых, нам нужно рассчитать
число используемых молей кислоты. Затем нам нужно преобразовать моли
кислоты к молям основания, используя молярное соотношение из сбалансированного уравнения. Наконец, на третьем шаге мы
рассчитать молярную концентрацию основания. Прежде чем приступить к первому шагу, нам нужно
перевести измерения объема из миллилитров в литры путем умножения на единицу
литр на 1000 миллилитров.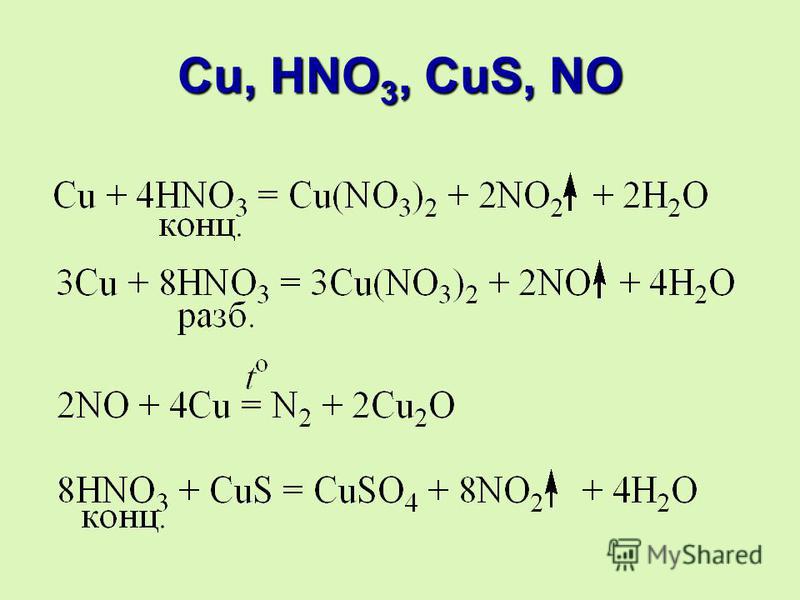
Чтобы найти количество молей кислоты используется, мы можем использовать следующее уравнение, в котором число молей равно молярность в молях на литр, умноженная на объем в литрах. Умножаем 0,5 моль на литр на 0,0548 литра, что позволяет сократить единицы литры. В результате получается 0,0274 моль h4PO4.
Теперь мы можем использовать молярное соотношение из сбалансированного химического уравнения, чтобы преобразовать из молей кислоты в моли база. Умножим 0,0274 моль h4PO4 на три моля Mg(OH)2 на два моля h4PO4, что позволяет сократить из единиц молей h4PO4. В результате получается 0,0411 моль Мг(ОН)2.
Теперь, когда мы знаем количество
молей прореагировавшего основания, можно рассчитать молярную концентрацию. Для расчета молярной
концентрации или молярности, мы должны разделить количество молей основания на
объем базы. Следовательно, нам нужно разделить 0,0411
моль на 0,03 л. В результате получается 1,37 моль/л.
литр. Мы также можем представить единицы
молей на литр с прописной М.
Следовательно, нам нужно разделить 0,0411
моль на 0,03 л. В результате получается 1,37 моль/л.
литр. Мы также можем представить единицы
молей на литр с прописной М.
В заключении по результатам опыта по титрованию концентрация магнезиального молока 1,37 молярный.
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| 30500 ± 0.00060″> 3Mg | + | 2H 3 PO 4 | → | + | Mg 3 (PO 4 ) 2 | ||
| магний | |||||||
| hydrogen | magnesium phosphate | ||||||
| (dung dịch pha loãng) | (khí) | (kt) | |||||
| 3 | 2 | 3 | 1 | Hệ số | |||
| Нгуен-Фантукхой (г/моль) | |||||||
| Со моль | |||||||
| Кхой лунг (г) |
6 Рекламное объявление
Дополнительная информация об уравнении 3 мг + 2H
3 PO 4 → 3H 2 + MG 3 (PO 4 ) 2Что такое условие реакции MG (Magnesium) REACTS 4PO4 (4PO4 (4PO4.
 Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты) ?
Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты) ?Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта. Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3 (водорода) и Mg3(PO4)2 (фосфата магния)?
Явление после реакции Mg (магния) с h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта Mg3(PO4)2 (фосфат магния), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
