Факторы, влияющие на скорость химической реакции
Цель: усвоение всеми учащимися знаний о факторах, влияющих на скорость химической реакции и единицах её измерения.
Задачи:
сформировать понятие о факторах, влияющих на скорость химической реакции;
развивать умение вступать в диалог, уточнять, слушать, анализировать ответы других;
развивать умение раскрывать смысл химических явлений.
Формы учебной деятельности: фронтальная, индивидуальная.
Оборудование: штатив с пробирками, щипцы, салфетки, ступка с пестиком, чашка Петри, чайник электрический.
Реактивы:
Простые вещества: Zn, Al, Mg, Fe,Cu, Na, I;
Оксиды: MnO2, CuO, H2O2, H2O
Кислоты: HCl, H2SO4, CH3COOH,
Соли: Na2SO3, CaCO3, KI, CuSO4,
Гидроксиды: NaOH
Ход урока
1. Организационный момент
Организационный момент
2. Организация целевого пространства (подведение к теме)
Как вы можете объяснить понятие “скорость”?
Химики характеризуют быстроту химических реакций, т.е. превращения веществ за единицу времени, как скорость химических реакций. Так как в зависимости от условий одна и та же реакция может протекать с различными скоростями. Скорость химической реакции может быть 1моль/л. с, 1 кмоль/ м3. мин, 1 ммоль/мл. ч и т.д.
Учащиеся самостоятельно формулируют проблему, которую необходимо решить на уроке.
Тема урока “Факторы, влияющие на скорость химических реакций”
Выполнение лабораторной работы (демонстрационной) учителем.
1) Демонстрационный опыт. В 1-ю чашку Петри
налить воды и прибавить 2-3 капли раствора
фенолфталеина. Бросить в воду небольшой кусочек
металлического натрия. Во 2-ю чашку Петри с водой
опустить гранулу цинка. Сравнить наблюдения.
Обратить внимание учащихся на ряд активности
металлов (таблица).
HCl + Mg =
HCl + Fe =
HCl + Zn =
HCl + Al =
Вопрос учителя: Какая реакция идет быстрее? В чём причина? Обратите внимание на природу веществ.
Вывод (с записью в тетрадях): на скорость химической реакции влияет природа реагирующих веществ. У каждого вещества свой темперамент. Для металлов необходимо учитывать их положение в ряду напряжений.
2) Демонстрационный опыт. В 3 пробирки налить раствор тиосульфата натрия (1, 2 и 3 мл соответственно). К содержимому в1 пробирки добавить 2мл воды и во 2-ю пробирку – 1 мл. во все 3 пробирки добавить по 1 мл раствора серной кислоты. Через какое время наблюдается образование мути в каждой пробирке?
Р-р H2SO4 +Zn =
Конц. H2SO4 + Zn =
Р-р HCl + Zn =
Конц. HCl + Zn =
Р-р H2SO4 + Cu =
Конц. H2SO4 + Cu =
Вопрос учителя: Какая реакция идет быстрее? В чём причина?
Вывод (с записью в тетрадях): На скорость
химической реакции влияет концентрация кислоты
(реагирующих веществ). Эксперимент обобщается
законом действия масс. Закон не распространяется
на твердые вещества.
Эксперимент обобщается
законом действия масс. Закон не распространяется
на твердые вещества.
3) Демонстрационный опыт
В стакане нагрето 150 мл воды до 50-60 С. В 2 пробирки налить по 4 мл раствора пероксида водорода и по 3 капли раствора гидроксида натрия. Одну пробирку оставить в штативе, а 2-ю погрузить в стакан с горячей водой. По интенсивности выделения газа определяется различная скорость разложения пероксида водорода.
H2SO4 + CuO =
H2SO4 + CuO нагревание =
H2SO4 +Zn =
H2SO4 +Zn нагревание =
NH4Cl =
NH4Cl нагревание =
Вопрос учителя: В каких условиях заметна реакция?
Вывод (с записью в тетрадях): На скорость химической реакции влияет подогрев (повышенная температура)
Этот закон установил С.Аррениус в 1889 г. При
повышении температуры на 100 С скорость
химической реакции увеличивается в 2 раза. Закон
Вант-Гоффа: при изменении (повышении или
понижении) температуры реакции на каждые 10
Закон
Вант-Гоффа: при изменении (повышении или
понижении) температуры реакции на каждые 10
H2SO4 + Al =
H2SO4 + Al + CuSO4 =
Что повлияло на скорость химической реакции?
Вывод: На скорость химической реакции влияет присутствие катализатора- вещества, ускоряющего химическую реакцию, но сами при этом не расходуются.
Ингибитор – вещество, которое замедляет скорость химической реакции.
HCl + порошок мела =
HCl + комочек мела
Какая реакция закончится быстрее? Что повлияло?
Вывод: на скорость химической реакции влияет площадь соприкосновения веществ
К.Л. Бертолле – французский химик разработал
основные закономерности протекания химических
реакций. О скорости реакции судят по изменению
концентрации одного из исходных веществ в
единицу времени.
4. Рефлексия
1) Какая из реакций будет идти быстрее?
а) Cu + HCl =
б) Fe + HCl =
в) Al + HCl =
2) Где лучше будет гореть лучина?
а) на воздухе
б) в кислороде в) в азоте
3) Во сколько раз возрастет скорость химической реакции при изменении температуры от 10 до 500 С.
а) в 4 раза
б) в 2 раза
в) в 5 раз
4) К каким системам относятся:
| а) вода – лёд | б) газ – газ | |
| А) гомогенная | Б) гетерогенная |
5) Признаки химических реакций:
а) изменение агрегатного состояния
б) изменение цвета
в) образование осадка
г) растворение вещества
д) образование газа
5. Подведение итогов
Подведение итогов
6. Домашнее задание
1) изучить § 29, ответить на вопросы устно;
2) приведите примеры влияния факторов на скорость реакции на бытовом уровне.
| Приложение 1. Лабораторный эксперимент. Выполнить 2 лабораторных опыта, наблюдения записать в таблицу. Опыт 1. Взаимодействие Mg с кислотой. 1) В пробирку с порошком магния (Mg) прилить осторожно, по каплям! 0,5 мл раствора кислоты HCl, что наблюдаете? 2) Аккуратно ! потрогайте нижнюю часть пробирки. Наблюдения и уравнение реакции записать в таблицу: Mg + HCl → Опыт 2. Растворение азотного удобрения в воде 1) В стакан с белым кристаллическим веществом прилейте имеющуюся воду, перемешайте стеклянной палочкой. 2) потрогайте стакан; наблюдения запишите в соответствующую графу таблицы. Фамилии учащихся, класс.
Приложение 2. Программа деятельности 1.
Приложение 3. Программа деятельности 2. По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему. Пример 1. По термохимическому уравнению реакции t˚ СаСО3 (тв.) = СаО (тв.) + СО2 (г) – 157 кДж вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж. Q1 = – 1570 кДж СаСО3 = СаО + СО2 – 157 кДж ————————- √ 1 моль m (СаСО3) — ? Мr 100 М 100 г/моль m 100г
Мr (СаСО3) = Аr(Са) + Аr(С) + Аr(О) 3 = 40 + 12 + 16 3 = 100 Мr = Мr ; m = √ ͯ М M(СаСО3) = 1 моль 100 г/моль = 100г
если в реакцию вступает 100г СаСО3, то поглощается (т. если в реакцию вступает х г СаСО3, то поглощается 1570 кДж энергии 100г : 157 кДж = х г : 1570 кДж х = 1000г СаСО3
Решите задачу по алгоритму. Определите массу взорвавшегося водорода, если ТХУ этой реакции 2 H2(г) + O2(г) = 2 H2О (ж) + 572 кДж, а количество выделившейся при этом энергии 57,2 кДж. 1. Заполни пропуски Реакции, протекающие с выделением теплоты и света, называют реакциями …. Это реакции …. Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам): а) разложения; б) горения; в) эндотермические; г) экзотермические. Образец ответа: 1ав. 2. Какую схему можно назвать термохимическим уравнением реакции? а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж б) 2 H2 + O2 = 2 H2О + 572 кДж в) 2 H2(г) + O2(г) = 2 H2О(ж) г) H2 + O2 → H2О + 572 кДж а) С(тв) + O2(г) = СO2(г) + 394 кДж б) СаСO3 = СO2 + СаО – 310 кДж г) Н2 + I2 = 2HI – 52 кДж д) 3Fe + O2 = Fe3O4 + 118 кДж А) СH4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДж Б) 2 H2О = 2 H2 + О2 – 572 кДж Г) 2 KMnO4 = K2MnO4 + MnO2 + O2
5. Приведены уравнения реакций: А. СаО + Н2О = Са(ОН)2 Б. 2HgO = 2Hg + O2 Определите тип, к которому относятся данные реакции.
Приложение 5. Выбери наиболее подходящее:
выбери наиболее подходящее твоему мнению Каталог: articles жүктеу/скачать 101.5 Kb. Достарыңызбен бөлісу: |
Скорость химических реакций
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
- Предмет химия
- Тема урока « Скорость химических реакций»
- Аудитория – 11 класс ( УМК Габриелян О.
 С.),
С.), - МОУ « Русская православная классическая гимназия имени Сергия Радонежского»
- Цель: объяснить понятие скорости химической реакции и её зависимость от различных факторов
- Работа с презентацией по ходу урока
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Цель урока:
Изучить понятие скорости химической реакции и её зависимости от различных факторов.
Химическая кинетика — это раздел физической химии, который изучает скорость химической реакции и факторы, влияющие на её величину.
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Скорость химической реакции – это изменение концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени
Факторы, влияющие на скорость реакции.
Фактор
Пример
Вывод
Фактор
Пример
1. Природа реагирующих веществ
Природа реагирующих веществ
1) Zn+HCl
2) Mg+HCl
Вывод
Фактор
Пример
1. Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
Вывод
Чем активнее реагируют вещества, тем больше скорость реакции
Фактор
Пример
1. Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
Вывод
Zn+HCl
Чем активнее реагируют вещества, тем больше скорость реакции
- разб.
- конц.
Фактор
Пример
1. Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
Концентрация
Вывод
Zn+2HCl ZnCl 2 +H 2
Чем активнее реагируют вещества, тем больше скорость реакции
- разб.
- конц.
Чем больше концентрация, тем больше скорость реакции
Фактор
Пример
1. Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
Вывод
Zn+2HCl ZnCl 2 +H 2
3. Температура
Чем активнее реагируют вещества, тем больше скорость реакции
- разб.
- конц.
CuO+HCl
Чем больше концентрация, тем больше скорость реакции
- Без t
- При t
Фактор
Пример
1. Природа реагирующих веществ
Природа реагирующих веществ
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
Вывод
Zn+2HCl ZnCl 2 +H 2
3. Температура
Чем активнее реагируют вещества, тем больше скорость реакции
- разб.
- конц.
CuO+2HCl CuCl 2 +H 2 O
Чем больше концентрация, тем больше скорость реакции
- Без t
- При t
Чем выше t , тем больше скорость реакции
Фактор
1. Природа реагирующих веществ
Пример
2. Концентрация
Вывод
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
Чем активнее реагируют вещества, тем больше скорость реакции
Zn+2HCl ZnCl 2 +H 2
3. Температура
Температура
4. Площадь соприкосновения веществ
Чем больше концентрация, тем больше скорость реакции
- разб.
- конц.
CuO+2HCl CuCl 2 +H 2 O
Чем выше t , тем больше скорость реакции
Fe+HCl
- Без t
- При t
- Гвоздь
- Порошок
Фактор
1. Природа реагирующих веществ
Пример
2. Концентрация
Вывод
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
3. Температура
Чем активнее реагируют вещества, тем больше скорость реакции
Zn+2HCl ZnCl 2 +H 2
4. Площадь соприкосновения веществ
Чем больше концентрация, тем больше скорость реакции
CuO+2HCl CuCl 2 +H 2 O
- разб.

- конц.
Чем выше t , тем больше скорость реакции
Fe+2HCl FeCl 2 + H 2
- Без t
- При t
Чем больше площадь соприкосновения, тем больше скорость реакции
- Гвоздь
- Порошок
Фактор
1. Природа реагирующих веществ
Пример
2. Концентрация
Вывод
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
3. Температура
Zn+2HCl ZnCl 2 +H 2
Чем активнее реагируют вещества, тем больше скорость реакции
Чем больше концентрация, тем больше скорость реакции
4. Площадь соприкосновения веществ
- разб.

- конц.
CuO+2HCl CuCl 2 +H 2 O
Чем выше t , тем больше скорость реакции
Fe+2HCl FeCl 2 + H 2
5. Катализатор
- Без t
- При t
Чем больше площадь соприкосновения, тем больше скорость реакции
- Гвоздь
- Порошок
H 2 O 2
- Без катализатора
- С катализатором
Фактор
Пример
1. Природа реагирующих веществ
Вывод
1) Zn+2HCl ZnCl 2 +H 2
2) Mg+2HCl MgCl 2 +H 2
2. Концентрация
3. Температура
Чем активнее реагируют вещества, тем больше скорость реакции
Zn+2HCl ZnCl 2 +H 2
CuO+2HCl CuCl 2 +H 2 O
- разб.

- конц.
Чем больше концентрация, тем больше скорость реакции
4. Площадь соприкосновения веществ
- Без t
- При t
Чем выше t , тем больше скорость реакции
Fe+2HCl FeCl 2 + H 2
5. Катализатор
- Гвоздь
- Порошок
2H 2 O 2 2H 2 O+O 2
Чем больше площадь соприкосновения, тем больше скорость реакции
- Без катализатора
- С катализатором
Катализатор – это вещество, увеличивающее скорость реакции
Ответьте на вопросы
- 1 . Скорость химической реакции цинка с раствором серной кислоты не зависит от :
- 1) Числа взятых гранул цинка ;
- 2) Степени измельчения цинка ;
- 3) Концентрации серной кислоты;
- 4) Температуры.

Ответьте на вопросы
- 2 . Одинаковые кусочки магния взаимодействуют с наибольшей скоростью с соляной кислотой если :
- 1) Разбавить кислоту ;
- 2) Увеличить концентрацию кислоты ;
- 3) Увеличить давление ;
- 4) Уменьшить температуру.
Ответьте на вопросы
- 3 . Скорость реакции разложения пероксида водорода увеличится при :
- 1) Разбавлении раствора ;
- 2) Увеличении давления ;
- 3) Внесения катализатора ;
- 4) Охлаждении раствора.
Ответьте на вопросы
- 4 . Химическая кинетика — раздел физической химии, изучающий:
- 1) Принципиальную возможность самопроизвольного протекания химического процесса в том или ином направлении;
- 2) Тепловые эффекты химических реакций;
- 3) Скорость протекания химических реакций во времени, факторы, влияющие на её величину;
- 4) Возможный механизм химических реакций с учётом строения молекул участвующих в них веществ.

Ответьте на вопросы
- 5 . С большей скоростью с кислородом при комнатной температуре реагирует :
- 1) Fe;
- 2) Cu;
- 3) Al ;
- 4) Na .
Проверьте себя.
- 1) 1 ;
- 2) 2 ;
- 3) 3;
- 4) 3;
- 5) 4.
Домашнее задание: §15 + вопросы после параграфа
Спасибо за внимание!
Химия, 8 класс, параграф 32, 8 вопрос. Рудзитис и Фельдман
Химия, 8 класс, параграф 32, 8 вопрос. Рудзитис и Фельдман — какие из этих реакций могут быть? – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Привет, вот эти уравнения и само задание
Напишите уравнения реакций, которые осуществимы.
Na+HCl→ Zn + HCl→
Mg+HCl→ CaO + HCl→
Al + HCl→ Fe2O3+ HCl→
Mg + H3PO4 → Fe2O3 + H2SO4 →
Ca + H3PO4 → Li2O + H3PO4→
Zn + H2SO4 → MgO + H3PO4 →
Al + H2SO4 → Al2O3+H2SO4 →
MgO + H2SO4 → Cu + HCl →
Mg + H2SO4 → Au + H2SO4 →
NaCl + HCl → H3PO4 + H2SO4 →
Na2SO4 + HСl → Na2CO3 + HCl →
Fe(OH)3 + HNO3 → NaCl + HNO3 →
Лучший ответ
Привет))
2 Na + 2 HCl → 2 NaCl + H2
Mg + 2 HCl → MgCl2 + H2
2Al + 6HCl → 2 AlCl3 + 3H2
3 Mg + 2 H3PO4 → Mg3(PO4)2 + 3 H2
3 Ca + 2 H3PO4 → Ca3(PO4)2 + 3 H2
Zn + H2SO4 → ZnSO4 + H2
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2
MgO + H2SO4 → MgSO4 + H2O
Zn + 2 HCl → ZnCl2 + H2
CaO + 2HCl → CaCl2 + H2O
Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O
Fe2O3 + H2SO4 → Fe(SO4)3 + 3 H2O
3 Li2O + 2 H3PO4 → 2 Li3PO4 + 3 H2O
3 MgO + 2 H3PO4 → Mg3(PO4)2 + 3 H2O
Al2O3 + 3 H9SO4 → Al9(SO4)3 + 3 H9O
Mg + H2SO4 → MgSO4 + H2
Fe(OH)3 + 3 HNO3 → Fe(NO3)3 + 3 H2O
Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2
еще ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Психология
ЕГЭ
10 класс
9 класс
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых). ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Основные типы химических реакций — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Учитель химии МКОУ СОШ 15 г.Лиски Решетников Е.А.
коэффициенты2. Основные типы химических реакций.
Реакции соединенияА + Б = АБ
Реакции разложения
АБ = А + Б
Реакции замещения
А + БВ = АВ + Б
Реакции обмена
АБ + ВГ = АГ + ВБ
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
реакции соединения
№
1
2
3
4
5
6
7
8
9
1 ВАРИАНТ
Mg + O2 = MgO
2 Mg + O2 = 2 MgO
K + h3O = KOH + h3 ↑
Fe + h3SO4 = FeSO4+h3 ↑
Zn +Cu(NO3)2 = Cu +Zn(NO3)2
CaO + h3O = Ca(OH)2
CaO + h3O = Ca(OH)2
CaO + h4PO4 =
Ca3(PO4)2 + h3O
NaOH + h3S = Na2S + h3O
BaCl2 + Na2SO4 = BaSO4↓+ NaCl
CO2 + h3O ↔ h3CO3
CO2 + h3O ↔ h3CO3
4.
 УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции соединения2 ВАРИАНТ
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции соединения2 ВАРИАНТ1
2
Fe + CuCl2 = Cu + FeCl2
P + O2 = P2O5
3
Mg + HCl = MgCl2 + h3
4
Al2O3 + HCl = AlCl3 + h3O
5
P2O5 + h3O = h4PO4
6
Ba(OH)2 + HNO3 =
Ba(NO3)2 + h3O
7
Ca + h3O = Ca(OH)2 + h3
8
AgNO3 + KCl = AgCl + KNO3
9
Fe(OH)3 = Fe2O3 + h3O
4 P + 5 O2 = 2 P2O5
P2O5 + 3 h3O = 2 h4PO4
5. УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции соединения
3 ВАРИАНТ1
Сu + O2 = CuO
2
Fe2O3 + HCl = FeCl3 + h3O
3
Ba + h3O = Ba(OH)2 + h3
4
SO2 + h3O ↔ h3SO3
5
CuCl2 + KOH = Cu(OH)2 + KCl
6
Ca(OH)2 + HNO3 =
Ca(NO3)2 + h3O
7
AgNO3 + NaBr = AgBr + NaNO3
8
Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
9
Mg + HCl = MgCl2 + h3
2 Сu + O2 = 2 CuO
SO2 + h3O ↔ h3SO3
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
реакции соединения
4 ВАРИАНТ
№
Na + h3O = NaOH + h3 ↑
1
2 Zn + Pb(NO3)2=Pb + Zn(NO3)2
3 Mg + h3SO3 = MgSO3+h3 ↑
h3+ O2 = h3O
4
5 Cu(OH)2 = CuO + h3O
6 CaCO3 + HCl =
2 h3+ O2 = 2 h3O
CaCl2 + h3O + CO2
7 HBr + NaOH = NaBr + h3O
8 AgNO3 + KI = AgI + KNO3
9
Na2O + h3O = NaOH
Na2O + h3O = 2 NaOH
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
реакции разложения
№
1
2
3
4
5
6
7
8
9
1 ВАРИАНТ
Mg + O2 = MgO
K + h3O = KOH + h3 ↑
Fe + h3SO4 = FeSO4+h3 ↑
Zn +Cu(NO3)2 = Cu +Zn(NO3)2
CaO + h3O = Ca(OH)2
CaO + h4PO4 =
Ca3(PO4)2 + h3O
NaOH + h3S = Na2S + h3O
BaCl2 + Na2SO4 = BaSO4↓+ NaCl
CO2 + h3O ↔ h3CO3
CO2 + h3O ↔ h3CO3
8.
 УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции разложения2 ВАРИАНТ
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции разложения2 ВАРИАНТ1
2
Fe + CuCl2 = Cu + FeCl2
P + O2 = P2O5
3
Mg + HCl = MgCl2 + h3
4
Al2O3 + HCl = AlCl3 + h3O
5
P2O5 + h3O = h4PO4
6
Ba(OH)2 + HNO3 =
Ba(NO3)2 + h3O
7
Ca + h3O = Ca(OH)2 + h3
8
AgNO3 + KCl = AgCl + KNO3
9
Fe(OH)3 = Fe2O3 + h3O
2 Fe(OH)3 = Fe2O3 +3 h3O
9. УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции разложения
3 ВАРИАНТ1
Сu + O2 = CuO
2
Fe2O3 + HCl = FeCl3 + h3O
3
Ba + h3O = Ba(OH)2 + h3
4
SO2 + h3O ↔ h3SO3
5
CuCl2 + KOH = Cu(OH)2 + KCl
6
Ca(OH)2 + HNO3 =
Ca(NO3)2 + h3O
7
AgNO3 + NaBr = AgBr + NaNO3
8
Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
9
Mg + HCl = MgCl2 + h3
SO2 + h3O ↔ h3SO3
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
реакции разложения
4 ВАРИАНТ
№
Na + h3O = NaOH + h3 ↑
1
2 Zn + Pb(NO3)2=Pb + Zn(NO3)2
3 Mg + h3SO3 = MgSO3+h3 ↑
h3+ O2 = h3O
4
5 Cu(OH)2 = CuO + h3O
6 CaCO3 + HCl =
CaCl2 + h3O + CO2
7 HBr + NaOH = NaBr + h3O
8 AgNO3 + KI = AgI + KNO3
9
Na2O + h3O = NaOH
Cu(OH)2 = CuO + h3O
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
реакции замещения
№
1
2
3
4
5
6
7
8
9
1 ВАРИАНТ
Mg + O2 = MgO
K + h3O = KOH + h3 ↑
2 K + 2 h3O = 2 KOH + h3 ↑
Fe + h3SO4 = FeSO4+h3 ↑
Fe + h3SO4 = FeSO4+h3 ↑
Zn +Cu(NO3)2 = Cu +Zn(NO3)2
Zn +Cu(NO3)2 = Cu +Zn(NO3)2
CaO + h3O = Ca(OH)2
CaO + h4PO4 =
Ca3(PO4)2 + h3O
NaOH + h3S = Na2S + h3O
BaCl2 + Na2SO4 = BaSO4↓+ NaCl
CO2 + h3O ↔ h3CO3
12.
 УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции замещения2 ВАРИАНТ
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции замещения2 ВАРИАНТ1
2
Fe + CuCl2 = Cu + FeCl2
Fe + CuCl2 = Cu + FeCl2
P + O2 = P2O5
3
Mg + HCl = MgCl2 + h3
4
Al2O3 + HCl = AlCl3 + h3O
5
P2O5 + h3O = h4PO4
6
Ba(OH)2 + HNO3 =
Ba(NO3)2 + h3O
7
Ca + h3O = Ca(OH)2 + h3
8
AgNO3 + KCl = AgCl + KNO3
9
Fe(OH)3 = Fe2O3 + h3O
Mg + 2 HCl = MgCl2 + h3
Ca + 2 h3O = Ca(OH)2 + h3
13. УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции замещения
3 ВАРИАНТ1
Сu + O2 = CuO
2
Fe2O3 + HCl = FeCl3 + h3O
3
Ba + h3O = Ba(OH)2 + h3
4
SO2 + h3O ↔ h3SO3
5
CuCl2 + KOH = Cu(OH)2 + KCl
6
Ca(OH)2 + HNO3 =
Ca(NO3)2 + h3O
7
AgNO3 + NaBr = AgBr + NaNO3
8
Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
9
Mg + HCl = MgCl2 + h3
Ba + 2 h3O = Ba(OH)2 + h3
Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
Mg + 2 HCl = MgCl2 + h3
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
реакции замещения
4 ВАРИАНТ
№
Na + h3O = NaOH + h3 ↑
1
2 Zn + Pb(NO3)2=Pb + Zn(NO3)2
3 Mg + h3SO3 = MgSO3+h3 ↑
h3+ O2 = h3O
4
5 Cu(OH)2 = CuO + h3O
6 CaCO3 + HCl =
CaCl2 + h3O + CO2
7 HBr + NaOH = NaBr + h3O
8 AgNO3 + KI = AgI + KNO3
9
Na2O + h3O = NaOH
2 Na + 2 h3O = 2 NaOH + h3
Zn + Pb(NO3)2=Pb + Zn(NO3)2
Mg + h3SO3 = MgSO3+h3 ↑
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
реакции обмена
№
1
2
3
4
5
6
7
8
9
1 ВАРИАНТ
Mg + O2 = MgO
K + h3O = KOH + h3 ↑
Fe + h3SO4 = FeSO4+h3 ↑
Zn +Cu(NO3)2 = Cu +Zn(NO3)2
CaO + h3O = Ca(OH)2
CaO + h4PO4 =
Ca3(PO4)2 + h3O
NaOH + h3S = Na2S + h3O
BaCl2 + Na2SO4 = BaSO4↓+ NaCl
CO2 + h3O ↔ h3CO3
3 CaO + 2 h4PO4 =
Ca3(PO4)2 +3 h3O
2 NaOH + h3S = Na2S + 2 h3O
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
16.
 УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции обмена2 ВАРИАНТ
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции обмена2 ВАРИАНТ1
2
Fe + CuCl2 = Cu + FeCl2
P + O2 = P2O5
3
Mg + HCl = MgCl2 + h3
4
Al2O3 + HCl = AlCl3 + h3O
5
P2O5 + h3O = h4PO4
6
Ba(OH)2 + HNO3 =
Ba(NO3)2 + h3O
7
Ca + h3O = Ca(OH)2 + h3
8
AgNO3 + KCl = AgCl + KNO3
9
Fe(OH)3 = Fe2O3 + h3O
Al2O3 + 6 HCl =2 AlCl3 +3 h3O
Ba(OH)2 + 2 HNO3 =
Ba(NO3)2 + 2 h3O
AgNO3 + KCl = AgCl + KNO3
17. УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: реакции обмена
3 ВАРИАНТ1
Сu + O2 = CuO
2
Fe2O3 + HCl = FeCl3 + h3O
3
Ba + h3O = Ba(OH)2 + h3
4
SO2 + h3O ↔ h3SO3
5
CuCl2 + KOH = Cu(OH)2 + KCl
6
Ca(OH)2 + HNO3 =
Ca(NO3)2 + h3O
7
AgNO3 + NaBr = AgBr + NaNO3
8
Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
9
Mg + HCl = MgCl2 + h3
Fe2O3 + 6 HCl = 2 FeCl3 + 3 h3O
CuCl2 + 2 KOH = Cu(OH)2 + 2 KCl
Ca(OH)2 + 2 HNO3 =
Ca(NO3)2 + 2 h3O
AgNO3 + NaBr = AgBr + NaNO3
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ:
реакции обмена
4 ВАРИАНТ
№
Na + h3O = NaOH + h3 ↑
1
2 Zn + Pb(NO3)2=Pb + Zn(NO3)2
3 Mg + h3SO3 = MgSO3+h3 ↑
h3+ O2 = h3O
4
5 Cu(OH)2 = CuO + h3O
6 CaCO3 + HCl =
CaCl2 + h3O + CO2
7 HBr + NaOH = NaBr + h3O
8 AgNO3 + KI = AgI + KNO3
9
Na2O + h3O = NaOH
CaCO3 + 2 HCl =
CaCl2 + h3O + CO2
HBr + NaOH = NaBr + h3O
AgNO3 + KI = AgI + KNO3
19.
 Напишите уравнения реакций, расставьте коэффициенты. 5
Напишите уравнения реакций, расставьте коэффициенты. 5Al +Cl2 → ?
KClO3 → KCl + O2
Al + Fe2O3 → ?
NO + O2 → NO2
Na + Cl2 → ?
6
Ch5 + O2 → CO2 + h3O
1
2
3
4
2 Al + 3 Cl2 = 2 AlCl3
2 KClO3 = 2 KCl + 3 O2
2 Al + Fe2O3 = Al2O3 + 2 Fe
2 NO + O2 = 2 NO2
2 Na + Cl2 = 2 NaCl
Ch5 + 2 O2 → CO2 + 2 h3O
2 Al + 3 S = Al2S3
Al + S → ?
8
4 P + 5 O2 = 2 P2O5
P + O2 → ?
9
N2 + 3 h3 ↔ 2 Nh4
N2 + h3 → Nh4
10 CuO + C → Cu + CO2 2 CuO + C = 2 Cu + CO2
7
English Русский Правила
Скорость реакции — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Скоростью химической реакции называется изменение концентрации вещества в единицу времени, , где концентрация С выражена в моль/л. В ЕГЭ не требуется применение этой формулы, необходимо лишь уметь сравнивать скорости различных реакций и определять, как на них влияют изменения внешних условий.
Скорость реакции зависит от нескольких факторов:
- — Природы взаимодействующих веществ
- — Температуры
- — Концентрации реагирующих веществ
- — Присутствия в реакционной смеси катализатора или ингибитора
- — Площади поверхности соприкосновения реагентов (для гетерогенных процессов).
Рассмотрим каждый пункт отдельно:
1) Природа реагентов
Очевидно, что разные реакции при одних и тех же условиях протекают с различными скоростями. Нейтрализация щелочи кислотой протекает почти моментально, растворение цинка в соляной кислоте — быстро, ржавление железа под действием воды и кислорода – намного дольше. Общее правило очевидно: чем активнее реагирующие вещества, тем быстрее они взаимодействуют друг с другом.
Самые быстрые реакции – гомогенные, протекающие в одной фазе (газы или смешивающиеся жидкости). В них взаимодействие происходит во всем объеме смеси реагентов.
Гетерогенные реакции – взаимодействие не смешивающихся друг с другом веществ – протекают на границе раздела фаз. Эти процессы медленнее, и скорость определяется площадью поверхности соприкосновения.
2) Температура
При увеличении температуры молекулы начинают двигаться быстрее, следовательно, чаще сталкиваются друг с другом. Таким образом, скорость реакции всегда возрастает при повышении температуры и уменьшается – при понижении. Мы активно пользуемся этим в быту: например, для замедления процессов гниения (сложных химических реакций) храним продукты в холодильнике, а для ускорения реакции Майяра (взаимодействие белков с сахарами) готовим пищу при высокой температуре.
Зависимость скорости реакции от температуры определяется уравнением Вант-Гоффа: , где v2 и v1 – скорости реакции при температурах Т2 и Т1 соответственно, γ – температурный коэффициент, принимающий значения от 2 до 4. Например, если γ=3, при повышении температуры на 20 градусов скорость реакции возрастет в раз.
Например, если γ=3, при повышении температуры на 20 градусов скорость реакции возрастет в раз.
3) Концентрация реагентов
Очевидно, что чем выше концентрации реагирующих веществ, тем чаще их молекулы будут сталкиваться друг с другом, следовательно, тем быстрее будет протекать взаимодействие. Зависимость скорости от концентрации реагентов выражается законом действующих масс.
Например, для реакции aA + bB = cC + dD скорость . На самом деле часто зависимость скорости от концентраций реагентов носит более сложный характер, так как многие процессы протекают через образование промежуточных продуктов, но мы оставим эти случаи университетскому курсу.
Пожалуйста, не путайте: скорость реакции зависит от концентраций реагентов и не зависит от концентраций продуктов!
Здесь же рассмотрим влияние давления на скорость реакции. Жидкости и твердые тела практически несжимаемы и давление не влияет на их концентрации. Для газов увеличение давления вызывает возрастание концентрации, следовательно, ускоряет реакцию.
4) Катализаторы и ингибиторы
Катализатор – вещество, увеличивающее скорость реакции, но не расходующееся в ней, ингибитор – это «катализатор наоборот», он замедляет реакцию.
5) Площадь границы раздела фаз
Для примера рассмотрим реакцию цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2.
Кусочек цинка будет постепенно растворяться в кислоте: сначала прореагирует верхний слой молекул, потом следующий, — и так далее. «Внутренние» атомы смогут прореагировать только после того, как перейдут в раствор «внешние».
Если же этот кусочек измельчить (то есть увеличить площадь его поверхности) реакция пойдет заметно быстрее, т.к. возрастет количество «доступных для кислоты» частиц.
Таким образом, чем сильнее измельчено твердое вещество, тем выше скорость реакции. Количество твердого вещества на скорость влияет намного слабее, чем степень его измельченности и концентрация жидких или газообразных реагентов.
Потренируемся. Ниже приведены вопросы из ЕГЭ разных лет:
| А) Скорость химической реакции 2С(тв) + СО2(г) = 2СО(г) не зависит от | 1) температуры 2) концентрации СО 3) степени измельченности угля 4) давления | ||||||||
| Б) С наибольшей скоростью при комнатной температуре протекает реакция меду водородом и | 1) серой 2) иодом 3) фтором 4) бромом | ||||||||
| В) Для увеличения скорости химической реакции Mg(тв) + 2HCl(р-р) = MgCl2(р-р) + h3(г) необходимо | 1) увеличить давление 2) уменьшить температуру 3) увеличить концентрацию HCl 4) увеличить количество магния. | ||||||||
| Г) Повышение давления приведет к увеличению скорости реакции | 1) 2P(тв) + 3S(тв) = P2S3(тв) 2) Br2(ж) + 2Na(тв) = 2NaBr 3) h3O(ж) + 2Na(тв) = 2NaOH + h3(г) 4) N2(г) + 3h3(г) = 2Nh4(г) | ||||||||
Ответы:
| |||||||||
Как влияет изменение концентрации соляной кислоты на ее реакции с магнием? — GCSE Science
- Поиск
- Присоединяйтесь к более чем 1,2 миллионам студентов каждый месяц
- Ускорьте свое обучение на 29%
- Неограниченный доступ всего от 6,99 фунтов стерлингов в месяц
Выдержки из этого документа. ..
..
Как изменение концентрации соляной кислоты влияет на ее реакцию с магнием? Цель: Цель нашего исследования — выяснить, как различные растворы соляной кислоты по-разному реагируют на магний. Введение: Два основных вещества, которые будут использоваться во время этого эксперимента, следующие: Гипотеза: я предсказываю, что по мере увеличения концентрации соляной кислоты время, необходимое для исчезновения магния, уменьшается. Таким образом, чем выше концентрация кислоты, тем быстрее будет реакция между магниевой лентой и соляной кислотой. Это было бы связано с тем, что было больше молекул кислоты, которые реагировали с лентой магния. Я также предсказываю, что когда концентрация соляной кислоты удваивается, скорость реакции также удваивается. (Поэтому hcl прямо пропорционально мг, hcl ? мг.) Увеличение концентрации реагентов увеличит частоту столкновений между двумя реагентами. Итак, это снова теория столкновений. Кинетическая теория актуальна. Это связано с тем, что молекулы в реакционной смеси имеют диапазон энергетических уровней. Когда происходят столкновения, они не всегда приводят к реакции. Если две сталкивающиеся молекулы обладают достаточной энергией, они вступят в реакцию. Атомы или молекулы в газе очень разбросаны. Чтобы два химических вещества вступили в реакцию, между их молекулами должно произойти столкновение. Увеличивая давление, мы сжимаем молекулы вместе, поэтому вы увеличиваете частоту столкновений между ними. Это снова теория столкновений. В реакции между соляной кислотой и лентой магния соляная кислота растворяет магний и выделяет газообразный водород. Во всех химических реакциях участвуют реагенты, которые при смешивании могут вызвать химическую реакцию, в результате которой образуются продукты. В моем случае реагентами являются соляная кислота и магниевая лента. Химическая реакция происходит, когда ленту магния опускают в соляную кислоту. В ходе этой реакции образуются газообразный водород и хлорид магния. …читать далее.
Когда происходят столкновения, они не всегда приводят к реакции. Если две сталкивающиеся молекулы обладают достаточной энергией, они вступят в реакцию. Атомы или молекулы в газе очень разбросаны. Чтобы два химических вещества вступили в реакцию, между их молекулами должно произойти столкновение. Увеличивая давление, мы сжимаем молекулы вместе, поэтому вы увеличиваете частоту столкновений между ними. Это снова теория столкновений. В реакции между соляной кислотой и лентой магния соляная кислота растворяет магний и выделяет газообразный водород. Во всех химических реакциях участвуют реагенты, которые при смешивании могут вызвать химическую реакцию, в результате которой образуются продукты. В моем случае реагентами являются соляная кислота и магниевая лента. Химическая реакция происходит, когда ленту магния опускают в соляную кислоту. В ходе этой реакции образуются газообразный водород и хлорид магния. …читать далее.
Я решил начать показания с 20°C и увеличивать на 10°C каждый раз, пока не будет достигнуто 60°C, так как это позволит мне увидеть увеличение скорости реакции, а 5 результатов должно быть достаточно для выявления любых тенденций. * Скорость реакции Повышение температуры увеличивает скорость частиц. Чем быстрее движутся частицы, тем больше число столкновений и, следовательно, скорость реакции увеличивается. Повышение температуры на 10°С почти удваивает скорость большинства реакций. Химические реакции происходят случайно. Частицы должны сталкиваться с достаточной скоростью, чтобы они реагировали. При повышении температуры частицы движутся быстрее, так как у них больше энергии. Это означает, что они сталкиваются чаще, и большее количество столкновений имеет достаточную скорость, чтобы вызвать реакцию. Поскольку столкновений больше, химическая реакция протекает быстрее. В начале каждой кривой проведена касательная и рассчитан ее градиент, градиенты показаны в таблице ниже. Оценка доказательств Я считаю, что эксперимент был успешным, но некоторые результаты были неожиданными/ненадежными. Линии на графиках для 20OC и 30OC пересекаются, это не влияет на мои результаты, так как меня интересует только начальная скорость или реакция, но это было неожиданно.
* Скорость реакции Повышение температуры увеличивает скорость частиц. Чем быстрее движутся частицы, тем больше число столкновений и, следовательно, скорость реакции увеличивается. Повышение температуры на 10°С почти удваивает скорость большинства реакций. Химические реакции происходят случайно. Частицы должны сталкиваться с достаточной скоростью, чтобы они реагировали. При повышении температуры частицы движутся быстрее, так как у них больше энергии. Это означает, что они сталкиваются чаще, и большее количество столкновений имеет достаточную скорость, чтобы вызвать реакцию. Поскольку столкновений больше, химическая реакция протекает быстрее. В начале каждой кривой проведена касательная и рассчитан ее градиент, градиенты показаны в таблице ниже. Оценка доказательств Я считаю, что эксперимент был успешным, но некоторые результаты были неожиданными/ненадежными. Линии на графиках для 20OC и 30OC пересекаются, это не влияет на мои результаты, так как меня интересует только начальная скорость или реакция, но это было неожиданно.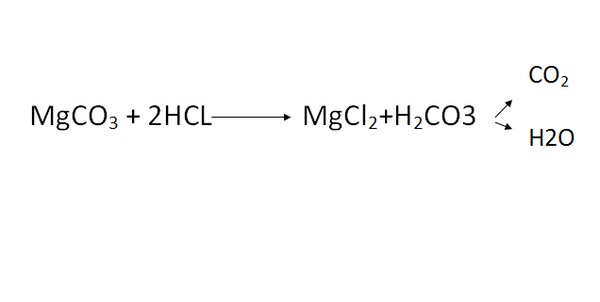 На графике 3 скорость реакции для 60°С ниже, чем для 50°С — этот результат является аномальным и не учитывался в данном исследовании. Я считаю, что эксперимент был спланирован хорошо, но было несколько проблем. Хотя начальная скорость реакции (именно ее я и рассматриваю в этом исследовании), казалось, соответствовала тенденции, кривые скорости реакции при некоторых температурах на графиках пересекались. Это могло произойти из-за того, что часть магния подверглась коррозии, образуя слой оксида магния, который повлиял бы на скорость реакции. Другим фактором, который мог дать мне ненадежные результаты, могло быть то, что газовые шприцы были влажными, из-за чего они …читать дальше.
На графике 3 скорость реакции для 60°С ниже, чем для 50°С — этот результат является аномальным и не учитывался в данном исследовании. Я считаю, что эксперимент был спланирован хорошо, но было несколько проблем. Хотя начальная скорость реакции (именно ее я и рассматриваю в этом исследовании), казалось, соответствовала тенденции, кривые скорости реакции при некоторых температурах на графиках пересекались. Это могло произойти из-за того, что часть магния подверглась коррозии, образуя слой оксида магния, который повлиял бы на скорость реакции. Другим фактором, который мог дать мне ненадежные результаты, могло быть то, что газовые шприцы были влажными, из-за чего они …читать дальше.
График дает нам хороший способ доказать, что если вы удвоите концентрацию, скорость также удвоится. Если вы увеличите количество частиц в растворе, то, скорее всего, они будут чаще сталкиваться. Должно быть выделено больше h3, если мы сравним его в диапазоне температур, потому что реакция идет быстрее, и поэтому за этот промежуток времени выделяется больше h3. Выделяется больше h3, если вы сравните его с диапазоном концентраций, который вы используете, это показывает, что реакция находится на разных стадиях и, следовательно, производит разные количества h3. Кроме того, наши результаты не были точными, но это могло быть связано с рядом причин. Есть много причин, по которым наши результаты не подтвердили эту точку точно. � При высоких температурах кислота вокруг магния начинает быстро разбавляться, поэтому, если вы не будете вращать реакцию, магний будет реагировать с кислотой при более низкой концентрации, что изменит результаты. Нагревание кислоты может привести к выделению HCl, что также сделает кислоту более разбавленной, что также повлияет на результаты. � Когда происходит реакция, выделяются пузырьки h3, которые могут оставаться вокруг магния, что, следовательно, уменьшает площадь поверхности магния, и поэтому кислота не может правильно реагировать с ним, что влияет на результаты. Чтобы получить более точные результаты, мы могли бы нагреть кислоту до более низкой температуры, чтобы остановить выделение большого количества HCl.
Выделяется больше h3, если вы сравните его с диапазоном концентраций, который вы используете, это показывает, что реакция находится на разных стадиях и, следовательно, производит разные количества h3. Кроме того, наши результаты не были точными, но это могло быть связано с рядом причин. Есть много причин, по которым наши результаты не подтвердили эту точку точно. � При высоких температурах кислота вокруг магния начинает быстро разбавляться, поэтому, если вы не будете вращать реакцию, магний будет реагировать с кислотой при более низкой концентрации, что изменит результаты. Нагревание кислоты может привести к выделению HCl, что также сделает кислоту более разбавленной, что также повлияет на результаты. � Когда происходит реакция, выделяются пузырьки h3, которые могут оставаться вокруг магния, что, следовательно, уменьшает площадь поверхности магния, и поэтому кислота не может правильно реагировать с ним, что влияет на результаты. Чтобы получить более точные результаты, мы могли бы нагреть кислоту до более низкой температуры, чтобы остановить выделение большого количества HCl. Другая важная вещь, которая могла бы помочь нам получить более точные результаты, заключается в том, что мы закрутили реакционную смесь, чтобы предотвратить разбавление кислоты и выделение пузырьков h3. Если бы у меня было время, я мог бы провести реакции еще несколько раз, чтобы получить лучший набор результатов. Это помогло бы моим графикам показать лучшие показания … читать дальше.
Другая важная вещь, которая могла бы помочь нам получить более точные результаты, заключается в том, что мы закрутили реакционную смесь, чтобы предотвратить разбавление кислоты и выделение пузырьков h3. Если бы у меня было время, я мог бы провести реакции еще несколько раз, чтобы получить лучший набор результатов. Это помогло бы моим графикам показать лучшие показания … читать дальше.
Приведенный выше предварительный просмотр представляет собой неформатированный текст
Эта письменная работа студента — одна из многих, которые можно найти в нашем разделе GCSE Patterns of Behavior.
Нашли то, что искали?
Не тот? Найдите название своего сочинения…
- Присоединяйтесь к более чем 1,2 миллионам студентов каждый месяц
- Ускорьте свое обучение на 29%
- Неограниченный доступ всего от 6,99 фунтов стерлингов в месяц
Посмотреть связанные эссе
4 звезды
Таким образом, в растворе меньше шансов, что частица кислоты ударится о частицу магния, что замедлит скорость реакции.
 Однако при более высокой концентрации кислоты, такой как 2 моль, количество частиц кислоты больше, что увеличивает вероятность столкновения частицы кислоты с частицей магния.
Однако при более высокой концентрации кислоты, такой как 2 моль, количество частиц кислоты больше, что увеличивает вероятность столкновения частицы кислоты с частицей магния.Мы повторим это для 5 различных концентраций соляной кислоты, убедившись, что каждый раз запускаем секундомер примерно в одно и то же время. 7. Мы повторим эксперимент для каждой концентрации, если два набора данных постоянны, мы перейдем к следующим
Таким образом, важно поддерживать постоянную длину магния. Это будет решено после проведения моих испытаний. 2. Объем соляной кислоты Объем соляной кислоты может влиять на скорость реакции. Большой объем кислоты ускорит скорость, потому что кислотных частиц больше.
Увеличение концентрации реагентов и повышение температуры вызывают больше столкновений и, следовательно, более успешных столкновений, увеличивая скорость реакции. Когда катализатор подвергается столкновению с молекулами реагентов, для осуществления химического превращения требуется меньше энергии, и, следовательно, большее количество столкновений имеет достаточную энергию для протекания реакции.

Покажите свои расчеты концентрации H+. Ka = [H+] [Ch4COONa] / [Ch4COOH] Ответ: В A концентрация уксусной кислоты в реакционной смеси = 0,05 моль дм-3 x (30/1000) дм3 / [(75+30+25+5+ 5+10) /1000] дм3 =0,01 моль дм-3 В А концентрация ацетата натрия в реакционной смеси =0,05 моль дм-3 x (30/1000)
Это помогло бы рассеять тепло, создаваемое экзотермической реакцией, чтобы оно меньше влияло на скорость реакции, которую я измерял. По мере протекания реакции объем зерен магния уменьшается.
Предсказание В нашем эксперименте мы изменим концентрацию HCL, используемую для реакции с лентой мг. Я думаю, что чем выше концентрация HCL, тем выше скорость реакции. Скорость реакции увеличивается благодаря теории столкновений: увеличение концентрации просто означает увеличение числа частиц, которые могут столкнуться и вступить в реакцию.
Верхняя поверхность не соприкасается с кислотой, поэтому это может замедлить реакцию и сделать ее неравномерной.
 Решение: мы заставим верхнюю поверхность соприкасаться с кислотой, используя магнитную мешалку для перемешивания кислоты, создавая вихрь, в который мы можем поместить магний, чтобы обеспечить покрытие всех сторон.
Решение: мы заставим верхнюю поверхность соприкасаться с кислотой, используя магнитную мешалку для перемешивания кислоты, создавая вихрь, в который мы можем поместить магний, чтобы обеспечить покрытие всех сторон.
- Более 160 000 штук
письменных работ студентов - Аннотировано
опытными учителями - Идеи и отзывы для
улучшения вашей работы
Скорость реакции HCl и Mg Лабораторные ответы
Цель
Целью данного исследования является определение влияния изменения температуры на скорость реакции.
Введение
Основная идея модели столкновения, основанная на кинетической молекулярной теории, состоит в том, что молекулы должны столкнуться, чтобы прореагировать. Следовательно, чем больше число столкновений в секунду, тем больше скорость реакции.
Энергия столкновения напрямую зависит от кинетической энергии сталкивающихся частиц, а температура является мерой средней кинетической энергии частиц в веществе.
Таким образом, с повышением температуры вещества увеличивается средняя кинетическая энергия частиц. Следовательно, будет большее количество столкновений в секунду и большая скорость реакции.
Материалы
- Дистиллированная вода
- Erlenmeyer Flask
- Graduated Cylinder
- Bunsen Burner
- Retort Stand
- Ring Clamp
- Thermometer
- Stopwatch
- Sandpaper
- Mass Balance
- Ice
- HCl (aq)
- Mg (s )
Процедура
- Приготовьте 50,0 мл 2,00 М HCl (водн.) , используя 16 мл соляной кислоты и 34 мл дистиллированной воды
- . Залейте 50,0 мл разбавленного раствора Ersklenmey во флакон.
- Отмерьте 0,200 г Mg (s). Обязательно очистите магний наждачной бумагой перед взвешиванием, чтобы удалить любые загрязнения.
- Подставка для реторты с кольцевым зажимом и горелкой Бунзена
- Нагрейте 50,0 мл HCl (водн.
 ) 70,0 o C. .
) 70,0 o C. . - С помощью секундомера зафиксируйте время реакции от начала до конца.
- Выполните шаги 1-7 три раза, чтобы получить 3 попытки
- Выполнить шаги 1-8 с HCl (водн.) при 40,0 o C и 10,0 o C, поддерживая количество Mg (s) постоянным
1
| Trial # | Temperature of HCl ( ±0.05 o C) | Mass of Mg
( ±0.001g) | Time of Reaction ( ±0.001s) |
| 1 | 70.0 | 0.200 | 30.08 |
| 2 | 70.0 | 0.198 | 29.41 |
| 3 | 70,0 | 0,197 | 30,52 |
Таблица 2: Наблюдения за температурой 2
Temperature of HCl ( ±0. 05 o C) 05 o C) | Mass of Mg
( ±0.001g) | Time of Reaction ( ±0.001s ) | |
| 1 | 40.0 | 0.199 | 37.28 |
| 2 | 40.0 | 0.204 | 36.59 |
| 3 | 40.0 | 0.198 | 37.89 |
Table 3: Observations for Temperature 3
| Trial # | Temperature of HCl ( ±0.05 o C) | Mass of Mg
( ± 0,001G) | Время реакции ( ± 0,001S) | ||||
| 1 | 0102060692010201010201010209698 | 01020102010102010101010101010101016 | 010201010201010201998 | 992019601969699699699699969998 96996996996999699969996979теля | |||
| 2 | 10. 0 0 | 0.198 | 44.54 | ||||
| 3 | 10.0 | 0.199 | 45.12 |
Calculations and Data Processing
Calculating Average Mass and Time
Table 4: Средние значения температуры и времени
| Температура HCl (водн.) ( ±0,05 o C) | Масса Mg (s) ( ±0.001g)1.5%) | Time (s) ( ±0.003s) |
| 70.00 | 0.20 | 30.00 |
| 40.00 | 0.20 | 37.25 |
| 10.00 | 0.20 | 45.17 |
Calculating Moles of Mg (s)
Table 5: Rate of Reaction of Mg with HCl
| Температура HCL (AQ) (± 0,05 O C) | МАСА MG (S) (1,50%) | Время (S) (S) (S) (± 0,003S) 0202020202020202020202020202020202020202A920202A 0292020202020202A 92020202020202020202. 92020202020202020202020202. 92020202020202020202020202. | . Rate of Reaction (±3.00%) |
| 70 | 0.200 | 30.00 | 0.0067 |
| 40 | 0.200 | 37.25 | 0.0054 |
| 10 | 0.200 | 45.17 | 0,0044 |
График 1: Температура HCl в зависимости от скорости реакции
График 1 показывает взаимосвязь между изменением температуры и скоростью реакции. Тенденция показывает, что с повышением температуры HCl увеличивается и скорость реакции. Это полиномиальная зависимость, которая означает, что скорость реакции увеличивается экспоненциально по отношению к повышению температуры.
Заключение и оценка
Как обсуждалось во введении, взаимосвязь между температурой и скоростью реакции объясняется с помощью модели столкновения и кинетической молекулярной теории. Эти две теории оправдывают соответствующее увеличение обоих факторов. Кинетическая молекулярная теория утверждает, что температура является мерой средней кинетической энергии частиц 9.0019
Эти две теории оправдывают соответствующее увеличение обоих факторов. Кинетическая молекулярная теория утверждает, что температура является мерой средней кинетической энергии частиц 9.0019
Таким образом, из-за повышения температуры средняя кинетическая энергия частиц пропорционально увеличивается, что приводит к более высокой общей энтропии. Поэтому из-за увеличения средней кинетической энергии частиц пропорционально увеличивается скорость столкновения, что приводит к более высокой скорости реакции.
Таким образом, этот эксперимент был успешным в определении взаимосвязи между температурой и скоростью реакции. Он показал, что температура и скорость реакции увеличиваются пропорционально большему числу столкновений.
Несмотря на то, что эксперимент показал связь, описанную выше, в нем было допущено несколько ошибок, которые могли повлиять на точность результатов. Эта ошибка составляет примерно 3%, что не имеет значения для общей тенденции. Однако, что касается конкретных скоростей реакции, они влияют на точность.
Одним из факторов, который мог повлиять на точность этого эксперимента, является тот факт, что каждый раствор HCl разбавлялся отдельно. Это допускает большую ошибку, поскольку каждый раз, когда что-то измеряется, возникает ошибка, связанная с используемым оборудованием. Этого можно было бы избежать, внося большое количество HCl нужной концентрации в начале эксперимента.
Другим фактором, который мог повлиять на точность, являются колебания комнатной температуры во время этого эксперимента. Это могло повысить или понизить температуру HCl во время реакции. Во избежание этой проблемы реакцию следует проводить в закрытом помещении со стабильной комнатной температурой.
Кроме того, некоторые реакции могут быть ускорены в зависимости от количества света, которому они подвергаются. Этот эксперимент проводился в открытом классе с ярким светом и открытыми окнами. Таким образом, этот свет мог увеличить энергию частиц, участвующих в реакции, и, таким образом, увеличить погрешность, поскольку это внешний фактор, влияющий на скорость реакции. Опять же, этого можно избежать, проводя эксперимент в закрытой комнате.
Опять же, этого можно избежать, проводя эксперимент в закрытой комнате.
В заключение, несмотря на некоторые ошибки, связанные с этим экспериментом, он был успешным в определении зависимости между температурой и скоростью реакции. Он показал, что температура и скорость реакции увеличиваются пропорционально большему числу столкновений.
РЕАКЦИИ ЭЛЕМЕНТОВ ГРУППЫ 2 С ОБЫЧНЫМИ КИСЛОТАМИ На этой странице рассматриваются реакции элементов 2-й группы — бериллия, магния, кальция, стронция и бария — с обычными кислотами. Реакции с разбавленной соляной кислотой Все металлы реагируют с разбавленной соляной кислотой с образованием пузырьков водорода и бесцветного раствора хлорида металла.
Как и следовало ожидать от элементов в этой части периодической таблицы, реакции становятся более бурными по мере продвижения вниз по группе. Реакции с разбавленной серной кислотой Это сложнее из-за образования нерастворимых сульфатов. Бериллий и магний Это точно так же, как реакции с разбавленной соляной кислотой, и вы, вероятно, знакомы с реакцией между магнием и разбавленной серной кислотой почти с тех пор, как начали заниматься химией. Образуются пузырьки водорода вместе с бесцветными растворами сернокислого бериллия или магния. Например:
Кальций, стронций и барий Сульфат кальция плохо растворим, а сульфаты стронция и бария можно считать нерастворимыми. Это означает, что вы получите слой нерастворимого сульфата на всех них, который замедлит реакцию или полностью остановит ее. В случае с кальцием вы получите некоторое количество водорода вместе с белым осадком сульфата кальция. | ||
Примечание: Со стронцием и барием я никогда не видел ни одной реакции, и я не могу найти какие-либо видеоклипы в Интернете. Я ожидаю, что реакции никогда не начнутся, оставив металл покрытым белым твердым веществом. Если у вас есть какие-либо непосредственные сведения об этом, желательно с небольшим количеством видео в поддержку этого, не могли бы вы сообщить мне об этом по адресу на странице об этом сайте. | ||
Реакции с азотной кислотой Это сложнее. Когда большинство металлов реагируют с большинством кислот, на самом деле они восстанавливают ионы водорода до газообразного водорода, добавляя электроны к ионам водорода. Металл, конечно, окисляется до положительных ионов металла, потому что он теряет электроны. Но нитрат-ионы также легко восстанавливаются до таких продуктов, как монооксид азота и диоксид азота. Таким образом, металлы, реагирующие с азотной кислотой, имеют тенденцию давать оксиды азота, а не водород. Концентрированная азотная кислота дает диоксид азота. Бериллий Существует много разногласий среди различных источников относительно того, реагирует ли бериллий с азотной кислотой. Бериллий имеет прочный оксидный слой (похожий на более привычный алюминий), который замедляет реакцию до тех пор, пока его не удалят. Некоторые источники говорят, что бериллий не реагирует с азотной кислотой. С другой стороны, легко найти практические детали для получения нитрата бериллия путем взаимодействия порошка бериллия с азотной кислотой. Один источник использует полуконцентрированную азотную кислоту и говорит, что выделяющийся газ представляет собой монооксид азота. Это то, что вы ожидаете. Кажется, что происходит то, реагирует ли он или нет, зависит от источника бериллия (как он был изготовлен) — возможно, изменение небольшого количества примесей в металле, которые влияют на реакцию. Все это настолько неопределенно, что трудно понять, как можно задать вопрос об этом на экзамене. Другие металлы группы 2 Они будут производить водород из азотной кислоты, если кислота очень разбавлена, но даже в этом случае она будет загрязнена оксидами азота. Образуются бесцветные растворы нитратов металлов. В качестве примера возьмем магний, если раствор очень разбавлен:
При умеренных концентрациях (и даже с очень разбавленной кислотой это произойдет в некоторой степени): 3Mg + 8HNO 3 3Mg(NO 3 ) 2 + 2NO + 4H 2 O А с концентрированной кислотой: Mg + 4HNO 3 Mg(NO 3 ) 2 + 2НО 2 + 2H 2 O
В меню группы 2 . . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2011 г. (последнее изменение: декабрь 2021 г.) | ||
Когда магний реагирует с соляной кислотой?
Вопрос задан: Лонни Бернхард
Оценка: 4,9/5 (55 голосов)
Добавление металлического магния к соляной кислоте дает газообразный водород . Магний растворяется с образованием хлорида магния, MgCl 2 .
Что происходит, когда магний реагирует с соляной кислотой?
При взаимодействии ленты магния с соляной кислотой образуется хлорид магния и выделяется газообразный водород . Произойдет изменение температуры пробирки, легкое шипение пузырьков газа, затем полоска магния растворится в воде, оставив синеву.
Произойдет изменение температуры пробирки, легкое шипение пузырьков газа, затем полоска магния растворится в воде, оставив синеву.
Какой газ образуется при реакции магния и соляной кислоты?
Магний реагирует с соляной кислотой с образованием газообразного водорода в соответствии с уравнением 1. Когда магний реагирует с кислотой, выделяющийся газообразный водород собирают путем вытеснения воды и измеряют его объем.
Что реагирует с магнием с образованием водорода?
Кислоты : При взаимодействии с кислотами магний растворяется и образует растворы, содержащие как ион Mg(II), так и газообразный водород.
Является ли соляная кислота и магний химическим изменением?
Химические свойства — это просто набор химических изменений, которые возможны для этого вещества. Для элемента магния (Mg) можно сказать, что химические свойства включают: реакцию с кислородом с образованием MgO. реакция с соляной кислотой с образованием MgCl 2 и газообразного водорода (H 2 )
Лаборатория магния и соляной кислоты
youtube.com/embed/BRX40XLBiak?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Найдено 29 связанных вопросов
Реагирует ли цинк с соляной кислотой?
При взаимодействии цинка с соляной кислотой образуется хлорид цинка и газообразный водород . Мы можем измерить скорость реакции, измерив скорость образования водорода.
Магний и соляная кислота являются экзотермическими или эндотермическими?
Горение магния является экзотермической реакцией, поскольку при столкновении частиц магния и кислорода с образованием новых связей в окружающую среду выделяется энергия. Лимонная кислота и пищевая сода являются эндотермической реакцией при понижении температуры. Магний и соляная кислота экзотермична при повышении температуры .
Почему соляная кислота растворяет магний?
Окисление-восстановление. Добавление металлического магния к соляной кислоте дает газообразный водород . Магний растворяется с образованием хлорида магния, MgCl 2 . Напишем сбалансированное уравнение этой реакции.
Добавление металлического магния к соляной кислоте дает газообразный водород . Магний растворяется с образованием хлорида магния, MgCl 2 . Напишем сбалансированное уравнение этой реакции.
3 интересных факта о магнии?
Некоторые интересные факты о магнии
- Ион магния присутствует в молекуле хлорофилла каждого живого зеленого растения.
- Магний критически важен для функционирования метаболической системы человека. … Колеса
- «Mag» изготовлены из магниевого сплава.
Какие 3 изотопа магния?
Магний является вездесущим элементом в природе и имеет три встречающихся в природе стабильных изотопа: 24 Mg, 25 Mg и 26 Mg с относительной численностью 78,99%, 10,00% и 11,01% соответственно.
Что образуется при взаимодействии алюминия с соляной кислотой?
Металлический алюминий реагирует с соляной кислотой с образованием газообразного водорода и раствора хлорида алюминия .
Что происходит, когда алюминий реагирует с разбавленной соляной кислотой?
Алюминий реагирует с разбавленной соляной кислотой при комнатной температуре. Металл растворяется в соляной кислоте с образованием хлорида алюминия и бесцветного газообразного водорода 9.0572 . Эта реакция необратима, так как конечные продукты не будут реагировать друг с другом.
Что происходит при взаимодействии железа с соляной кислотой?
При добавлении разбавленной соляной кислоты к железным опилкам образуется хлорид железа(II) и газообразный водород . В этой реакции железо вытесняет водород из соляной кислоты с образованием хлорида железа и газообразного водорода, эта реакция представляет собой единую реакцию замещения.
Почему повышается температура при добавлении магния в соляную кислоту?
Реакция между металлическим магнием и соляной кислотой является экзотермической, поскольку при ней выделяется энергия в виде тепла (повышение температуры). Энергия, необходимая для разрыва связей реагентов, была больше, чем энергия, необходимая для образования новых связей продуктов.
Энергия, необходимая для разрыва связей реагентов, была больше, чем энергия, необходимая для образования новых связей продуктов.
Что вступает в реакцию с HCl, вызывая взрыв?
Соляная кислота и хлористый водород бурно реагируют со многими металлами с образованием легковоспламеняющегося газообразного водорода , который может взорваться. Реакция с окислителями, такими как перманганаты, хлораты, хлориты и гипохлориты, может привести к образованию газообразного хлора или брома. Национальный исследовательский совет.
Что является ограничивающим реагентом в магнии и соляной кислоте?
Металлический магний растворяют в HCl в флорентийских колбах объемом 500 мл, закрытых воздушными шарами. Моли каждого реагента меняются в каждой колбе, чтобы продемонстрировать концепцию ограничивающего реагента. В колбах 1 и 2 используется небольшое количество Mg, поэтому металл является лимитирующим реагентом.
Какие 5 применений магния?
Магний используется в продуктах, которые выигрывают от легкости, таких как автомобильные сиденья, чемоданы, ноутбуки, камеры и электроинструменты. Его также добавляют в расплавленный чугун и сталь для удаления серы. Поскольку магний легко воспламеняется на воздухе и горит ярким светом, он используется в ракетах, фейерверках и бенгальских огнях.
Его также добавляют в расплавленный чугун и сталь для удаления серы. Поскольку магний легко воспламеняется на воздухе и горит ярким светом, он используется в ракетах, фейерверках и бенгальских огнях.
Где в организме содержится больше всего магния?
Взрослый организм содержит приблизительно 25 г магния, причем от 50 до 60 % магния содержится в костях , а большая часть остального находится в мягких тканях [4]. Менее 1% общего количества магния находится в сыворотке крови, и эти уровни находятся под жестким контролем.
Токсичен ли магний?
Магний необходим для хорошего самочувствия, но его избыток может вызвать проблемы, в том числе проблемы с пищеварением, вялость и нерегулярное сердцебиение. В редких случаях передозировка магния может быть фатальной. Токсичность магния редко встречается у здоровых людей, и уровни, скорее всего, будут низкими, чем высокими.
Как узнать, вступает ли в реакцию соляная кислота?
Чтобы убедиться, что вся кислота прореагировала, добавьте избыток твердого реагента . Фильтрация удаляет непрореагировавший нерастворимый реагент из раствора соли. Поскольку вся кислота израсходована и нерастворимый реагент удален, остаются только соль и вода. Поэтому при испарении воды остается чистая соль.
Фильтрация удаляет непрореагировавший нерастворимый реагент из раствора соли. Поскольку вся кислота израсходована и нерастворимый реагент удален, остаются только соль и вода. Поэтому при испарении воды остается чистая соль.
Что произойдет, если смешать соляную кислоту с водой?
Соляная кислота, сильная кислота, полностью ионизируется в воде с образованием ионов гидроксония и хлора (Cl — ) в реакции, благоприятной для продукта.
Какой тип реакции вызывает горение магния?
После горения образует белый порошок оксида магния. Магний отдает два электрона атомам кислорода, образуя этот порошкообразный продукт. Это экзотермическая реакция . Экзотермическая реакция — это термин, описывающий химическую реакцию, в которой происходит чистое выделение энергии (тепла).
Является ли плавление эндотермическим или экзотермическим процессом?
Поскольку вещество плавится, процесс эндотермический , поэтому изменение энергии будет иметь положительный знак.
Является ли реакция пищевой соды с соляной кислотой эндотермической или экзотермической?
Бикарбонат натрия с соляной кислотой.
Как определить, является реакция эндотермической или экзотермической?
Если изменение энтальпии, указанное для реакции, отрицательное, то в ходе этой реакции выделяется тепло — реакция является экзотермической (экзо- = выход). Если изменение энтальпии, указанное для реакции, положительное, то эта реакция поглощает тепло по мере своего протекания — реакция эндотермическая (эндо- = in).
Похожие вопросы
- 19 Следует ли принимать добавки магния во время еды?
- 43Для плотности магнитного потока?
- 35Прилипают ли магниты к алюминию?
- 35 Мэгги Смит была в Титанике?
- 41Почему магнитные школы плохи?
- 17Кто такой магнитный круг?
- 27Был ли сын Магнуса Рагнара?
- 44Сможет ли Магнус Карлсен победить компьютер?
- 15Сколько стоит медленный магазин?
- 19Кто старшая сестра маг?
Реклама
Популярные вопросы
- 20Есть пики и долины?
- 41Где находится шиловидный отросток локтевой кости?
- 27Кто владеет виски Дьюарс?
- 44Для чего используется соединение внахлест?
- 19Подходят ли эрго-рюкзаки больших размеров?
- 23Кому принадлежит звездный рынок?
- 26Разрешены ли обеды во время ковида?
- 23Где купить декс крипто?
- 44Сказать ли мне правду?
- 42Имеет ли логарифмическая функция асимптоту?
Цетиризин перорально: применение, побочные эффекты, взаимодействие, изображения, предупреждения и дозировка прежде чем принимать это лекарство.
 Если у вас есть какие-либо вопросы, проконсультируйтесь с вашим фармацевтом. Если ваш врач прописал это лекарство, принимайте его по назначению, обычно один раз в день.
Если у вас есть какие-либо вопросы, проконсультируйтесь с вашим фармацевтом. Если ваш врач прописал это лекарство, принимайте его по назначению, обычно один раз в день.Если вы принимаете жевательные таблетки, хорошо разжевывайте каждую таблетку и проглатывайте. Если вы используете быстрорастворимую таблетку, дайте ей раствориться на языке, а затем проглотите ее с водой или без нее. Если вы используете жидкую форму этого лекарства, тщательно измерьте дозу с помощью специального измерительного устройства / ложки. Не используйте бытовую ложку, потому что вы можете не получить правильную дозу.
Дозировка зависит от вашего возраста, состояния здоровья и реакции на лечение. Не увеличивайте дозу и не принимайте это лекарство чаще, чем указано.
Сообщите своему врачу, если ваши симптомы аллергии не улучшаются, если ваша крапивница не проходит после 3 дней лечения или если ваша крапивница длится более 6 недель. Немедленно обратитесь за медицинской помощью, если ваше состояние ухудшится или вы подозреваете, что у вас серьезная медицинская проблема (например, очень серьезная аллергическая реакция/анафилаксия).
Побочные эффекты
Могут возникнуть сонливость, усталость и сухость во рту. Также может возникать боль в животе, особенно у детей. Если какой-либо из этих эффектов сохраняется или ухудшается, немедленно сообщите об этом своему врачу или фармацевту.
Если ваш врач прописал это лекарство, помните, что ваш врач пришел к выводу, что польза для вас больше, чем риск побочных эффектов. Многие люди, использующие это лекарство, не имеют серьезных побочных эффектов.
Немедленно сообщите своему врачу, если у вас возникнут какие-либо серьезные побочные эффекты, в том числе: затрудненное мочеиспускание, слабость.
Очень серьезная аллергическая реакция на этот препарат встречается редко. Однако немедленно обратитесь за медицинской помощью, если заметите какие-либо симптомы серьезной аллергической реакции, в том числе: сыпь, зуд/отек (особенно лица/языка/горла), сильное головокружение, затрудненное дыхание.
Это не полный список возможных побочных эффектов. Если вы заметили другие эффекты, не перечисленные выше, обратитесь к врачу или фармацевту.
Если вы заметили другие эффекты, не перечисленные выше, обратитесь к врачу или фармацевту.
В США: позвоните своему врачу, чтобы получить медицинскую консультацию о побочных эффектах. Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088 или на сайте www.fda.gov/medwatch.
В Канаде: позвоните своему врачу, чтобы получить медицинскую консультацию о побочных эффектах. Вы можете сообщить о побочных эффектах в Министерство здравоохранения Канады по телефону 1-866-234-2345.
Меры предосторожности
Прежде чем принимать цетиризин, сообщите своему врачу или фармацевту, если у вас аллергия на него; или к гидроксизину; или левоцетиризину; или если у вас есть какие-либо другие аллергии. Этот продукт может содержать неактивные ингредиенты, которые могут вызывать аллергические реакции или другие проблемы. Поговорите с вашим фармацевт для получения более подробной информации.
Перед использованием этого лекарства сообщите своему врачу или фармацевту свою историю болезни, особенно о: затрудненном мочеиспускании (например, из-за увеличения простаты), заболеваниях почек, заболеваниях печени.
Если вы используете это лекарство для лечения крапивницы, немедленно сообщите своему врачу, если у вас есть какие-либо из этих симптомов, потому что они могут быть признаками более серьезного состояния: крапивница необычного цвета, крапивница, которая выглядит как синяк или волдырь, крапивница, которая не чешется.
Этот препарат может вызвать сонливость. Алкоголь или марихуана (марихуана) могут сделать вас более сонливыми. Не садитесь за руль, не пользуйтесь механизмами и не делайте ничего, что требует бдительности, пока вы не сможете делать это безопасно. Избегайте алкогольных напитков. Поговорите со своим врачом, если вы употребляете марихуану (каннабис).
Жидкие продукты могут содержать сахар. Осторожность рекомендуется, если у вас диабет. Спросите своего врача или фармацевта о безопасном использовании этого продукта.
Перед операцией сообщите своему врачу или стоматологу обо всех продуктах, которые вы используете (включая рецептурные и безрецептурные препараты и растительные продукты).
Во время беременности это лекарство следует использовать только в случае крайней необходимости. Обсудите риски и преимущества с вашим врачом.
Это лекарство проникает в грудное молоко. Перед кормлением грудью проконсультируйтесь с врачом.
Проконсультируйтесь с фармацевтом или врачом.
Взаимодействия
Взаимодействие с лекарствами может изменить действие ваших лекарств или увеличить риск серьезных побочных эффектов. Этот документ не содержит всех возможных лекарственных взаимодействий. Составьте список всех продуктов, которые вы используете (включая рецептурные и безрецептурные препараты и растительные продукты), и поделитесь им со своим врачом и фармацевтом. Не начинайте, не останавливайте и не изменяйте дозировку любых лекарств без разрешения врача.
Сообщите своему врачу или фармацевту, если вы принимаете другие продукты, вызывающие сонливость, такие как опиоидные обезболивающие или средства от кашля (например, кодеин, гидрокодон), алкоголь, марихуану (каннабис), снотворные или тревожные препараты (такие как алпразолам, лоразепам, золпидем), миорелаксанты (такие как каризопродол, циклобензаприн) или другие антигистаминные средства (такие как хлорфенирамин, дифенгидрамин).
Проверьте этикетки на всех ваших лекарствах (таких как средства от аллергии или от кашля и простуды), поскольку они могут содержать ингредиенты, вызывающие сонливость. Спросите своего фармацевта о безопасном использовании этих продуктов.
Не используйте с другими антигистаминными препаратами, наносимыми на кожу (такими как крем с дифенгидрамином, мазь, спрей), так как это может усилить побочные эффекты.
Цетиризин очень похож на гидроксизин и левоцетиризин. Не используйте эти лекарства при использовании цетиризина.
Это лекарство может мешать некоторым лабораторным тестам (включая кожные тесты на аллергию), что может привести к ложным результатам теста. Убедитесь, что персонал лаборатории и все ваши врачи знают, что вы принимаете этот препарат.
Взаимодействует ли цетиризин гидрохлорид с другими препаратами, которые вы принимаете?
Введите свое лекарство в средство проверки взаимодействия WebMD
Передозировка
Если у кого-то произошла передозировка и появились серьезные симптомы, такие как обморок или затрудненное дыхание, позвоните по номеру 911.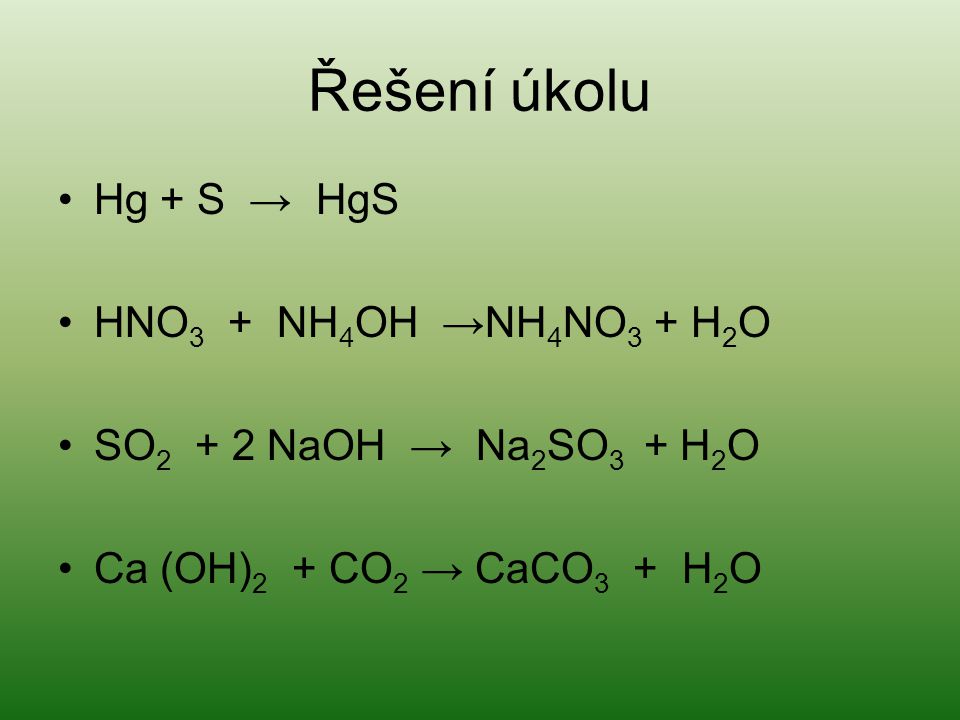 В противном случае немедленно позвоните в токсикологический центр. Жители США могут позвонить в местный токсикологический центр по телефону 1-800-222-1222. Жители Канады могут позвонить в провинциальный токсикологический центр. Симптомы передозировки могут включать: сильную сонливость. У детей изменения психики/настроения (например, беспокойство, раздражительность) могут возникать перед сонливостью.
В противном случае немедленно позвоните в токсикологический центр. Жители США могут позвонить в местный токсикологический центр по телефону 1-800-222-1222. Жители Канады могут позвонить в провинциальный токсикологический центр. Симптомы передозировки могут включать: сильную сонливость. У детей изменения психики/настроения (например, беспокойство, раздражительность) могут возникать перед сонливостью.
Приходить на все регулярные медицинские и лабораторные осмотры.
Если вы пропустите дозу, примите ее, как только вспомните. Если приближается время приема следующей дозы, пропустите пропущенную дозу. Примите следующую дозу в обычное время. Не удваивайте дозу, чтобы наверстать упущенное.
Хранить при комнатной температуре вдали от света и влаги. Не хранить в ванной. Различные марки этого лекарства могут иметь разные потребности в хранении. Инструкции по хранению вашего бренда см. на упаковке продукта или обратитесь к фармацевту. Держите все лекарства подальше от детей и домашних животных.
Не смывайте лекарства в унитаз и не выливайте их в канализацию, если это не предписано. Правильно утилизируйте этот продукт, когда он просрочен или больше не нужен. Проконсультируйтесь с вашим фармацевтом или местной компанией по утилизации отходов.
Изображения
Ссылки по теме
Найдите другое лекарство
Найдите другие лекарства, которые лечат ваше заболевание
Выбрано из данных, включенных с разрешения First Databank, Inc. провайдером и не предназначен для распространения, за исключением случаев, когда это разрешено применимыми условиями использования.
УСЛОВИЯ ИСПОЛЬЗОВАНИЯ: Информация в этой базе данных предназначена для дополнения, а не замены опыта и суждений медицинских работников. Информация не предназначена для охвата всех возможных применений, указаний, мер предосторожности, взаимодействий с лекарственными средствами или побочных эффектов, а также не должна толковаться как указание на то, что использование конкретного лекарственного средства является безопасным, подходящим или эффективным для вас или кого-либо еще. Перед приемом любого препарата, изменением диеты, началом или прекращением любого курса лечения следует проконсультироваться с врачом.
Перед приемом любого препарата, изменением диеты, началом или прекращением любого курса лечения следует проконсультироваться с врачом.
Цетиризин: антигистаминный препарат, облегчающий симптомы аллергии
1. О цетиризине
Цетиризин — антигистаминный препарат, помогающий облегчить симптомы аллергии.
Он используется для лечения:
- Hay Fever
- Конъюнктивит (красный, зуд глаз)
- Экзема
- (красот) не вызывающий сонливость антигистаминный препарат. Вероятность того, что вы почувствуете сонливость, гораздо ниже, чем у некоторых других антигистаминных препаратов.
Цетиризин отпускается по рецепту, но его также можно купить в аптеках и супермаркетах.
Он выпускается в виде таблеток, капсул и жидкости для проглатывания.

2. Ключевые факты
- Цетиризин обычно принимают один раз в день. Детям до 12 лет принимать два раза в день.
- Цетиризин классифицируется как антигистаминный препарат, не вызывающий сонливости, но некоторые люди по-прежнему считают, что он вызывает у них сильную сонливость.
- Общие побочные эффекты включают головные боли, сухость во рту, тошноту, головокружение и диарею.
- Некоторые марки цетиризина выпускаются в виде капсул. Они могут содержать соевое масло. Не принимайте капсулы цетиризина, если у вас аллергия на арахис или сою.
- Некоторые продукты Benadryl содержат не цетиризин, а другой антигистаминный препарат, например акривастин.
3. Кому можно и нельзя принимать цетиризин
Большинство взрослых могут принимать цетиризин.

Дети
- Дети в возрасте 1 года и старше могут принимать цетиризин жидкий, если это предписано врачом.
- Дети в возрасте 2 лет и старше могут принимать жидкий цетиризин, купленный в аптеке или прописанный врачом.
- Дети в возрасте 6 лет и старше могут принимать цетиризин в таблетках и жидкости, которые вы покупаете в аптеках и супермаркетах.
- Дети в возрасте 12 лет и старше могут принимать цетиризин в капсулах, таблетках и жидкости, которые вы покупаете в аптеках и супермаркетах.
Кому может быть противопоказан цетиризин
Цетиризин не подходит для некоторых людей. Чтобы убедиться, что это безопасно для вас, сообщите своему врачу или фармацевту, если вы:
- у вас когда-либо была аллергическая реакция на цетиризин или любое другое лекарство
- у вас аллергия на пищевые добавки
- у вас аллергия на арахис или сою – некоторые марки капсул цетиризина (но не таблетки) содержат сою
- у вас почечная недостаточность
- страдаете эпилепсией или другой проблемой со здоровьем, которая подвергает вас риску судорог или припадков
- имеете заболевание, при котором вам трудно мочиться прекратить прием за несколько дней до теста
4.
 Как и когда принимать цетиризин
Как и когда принимать цетиризинЕсли вам или вашему ребенку прописали цетиризин, следуйте инструкциям своего врача о том, как и когда его принимать. Если это лекарство из аптеки или магазина, следуйте инструкциям на упаковке.
Дозировка и сила действия
Цетиризин выпускается в виде таблеток и капсул (10 мг), а также в виде жидкого лекарства (с маркировкой 5 мг/5 мл или 1 мг/1 мл).
Обычная доза для взрослых составляет 10 мг один раз в день.
Дозы обычно ниже для людей с проблемами почек.
Дети
- Для детей в возрасте от 6 до 11 лет обычная доза составляет 5 мг два раза в день. Постарайтесь оставить 10-12 часов между дозами. Итак, одну порцию утром и одну перед сном.
- Детям в возрасте от 2 до 5 лет доза составляет 2,5 мг два раза в день.

- Для детей в возрасте от 1 до 2 лет ваш врач будет использовать их вес или возраст для определения правильной дозы.
Как принимать
Вы можете принимать цетиризин независимо от приема пищи, но всегда запивайте таблетки или капсулы водой, молоком или тыквой. Проглотите их целиком. Не жевать их.
Жидкий цетиризин детям легче принимать, чем таблетки. Жидкое лекарство поставляется с пластиковым шприцем или ложкой, чтобы дать правильную дозу. Если у вас нет шприца или ложки, попросите их у фармацевта. Не используйте кухонную чайную ложку, так как она не отмерит нужное количество.
Когда принимать
Вам может понадобиться принять цетиризин только в тот день, когда у вас появятся симптомы, например, если вы были в контакте с чем-то, что вызвало вашу аллергию, например, с шерстью животных.
Или вам может потребоваться принимать его регулярно, чтобы предотвратить симптомы, например, чтобы остановить сенную лихорадку весной и летом.

Что, если я забуду взять его?
Примите забытую дозу, как только вспомните, если только не пришло время принять следующую дозу. В этом случае пропустите пропущенную дозу и примите следующую дозу в обычное время.
Не принимайте 2 дозы, чтобы компенсировать пропущенную дозу.
Если вы забыли дать дозу ребенку, который принимает цетиризин два раза в день, вы можете дать пропущенную дозу, если она получена в течение 4 часов после того, как она должна была быть принята.
Если вы помните об этом более чем через 4 часа, не давайте пропущенную дозу. Вместо этого подождите до следующей дозы и продолжайте принимать как обычно.
Если вы часто забываете о дозах, может помочь установка будильника, который напомнит вам. Вы также можете обратиться к своему фармацевту за советом о других способах, которые помогут вам не забывать принимать лекарство.

Что, если я возьму слишком много?
Цетиризин, как правило, очень безопасен. Прием дозы, превышающей обычную, вряд ли нанесет вред вам или вашему ребенку.
Если вы примете дополнительную дозу, у вас могут возникнуть некоторые из распространенных побочных эффектов. Если это произойдет или вы обеспокоены, обратитесь к врачу.
5. Побочные эффекты
Как и все лекарства, цетиризин может вызывать побочные эффекты, хотя они возникают не у всех.
Общие побочные эффекты
Наиболее частые побочные эффекты цетиризина — сонливость и усталость. Это происходит более чем у 1 из 10 человек. Поговорите со своим врачом или фармацевтом, если этот побочный эффект вас беспокоит или не проходит.
Другие распространенные побочные эффекты цетиризина возникают более чем у 1 из 100 человек.

Поговорите со своим врачом или фармацевтом, если вас беспокоят или не проходят следующие побочные эффекты:
- головные боли
- сухость во рту
- плохое самочувствие (тошнота)
- головокружение
- боль в горле 60006
- боль в горле
- 6
- 6 заложенность носа и насморк
Дети чаще страдают диареей, чиханием или заложенностью носа и насморком, чем взрослые.
Серьезные побочные эффекты
Серьезные побочные эффекты цетиризина возникают редко.
Немедленно позвоните своему врачу, если у вас появились кровоподтеки или кровотечение, превышающее норму.
Серьезная аллергическая реакция
В редких случаях возможна серьезная аллергическая реакция (анафилаксия) на цетиризин.

Требуются немедленные действия: позвоните по номеру 999 или обратитесь в службу неотложной помощи сейчас, если:
- у вас кожная сыпь, которая может включать зуд, покраснение, отек, образование волдырей или шелушение кожи
- у вас свистящее дыхание
- у вас стеснение в груди или горле
- у вас проблемы с дыханием или речью
- у вас начинает отекать рот, лицо, губы, язык или горло
У вас может быть серьезная аллергическая реакция и может потребоваться немедленное лечение в больнице.
Это не все побочные эффекты цетиризина. Полный список см. в листовке внутри упаковки с лекарствами.
Информация:
Вы можете сообщить о любом предполагаемом побочном эффекте, используя схему безопасности Yellow Card.
Посетите Желтую карточку для получения дополнительной информации.
6. Как справиться с побочными эффектами цетиризина
Что делать с :
- сонливость и усталость – попробуйте другой не вызывающий сонливость антигистаминный препарат.
 Если это не поможет, поговорите со своим врачом.
Если это не поможет, поговорите со своим врачом. - головные боли – обязательно отдыхайте и пейте много жидкости. Лучше не пить слишком много алкоголя. Попросите фармацевта порекомендовать обезболивающее от головной боли, но обычно они проходят после первой недели приема цетиризина. Поговорите со своим врачом, если ваши головные боли длятся дольше недели или являются сильными.
- сухость во рту – жевать жевательную резинку без сахара или сосать сладости без сахара.
- плохое самочувствие (тошнота) – попробуйте принимать таблетки во время еды. Также может помочь, если вы придерживаетесь простых блюд и избегаете жирной или острой пищи.
- головокружение – если цетиризин вызывает у вас головокружение, когда вы встаете, попробуйте вставать очень медленно или оставайтесь в сидячем положении, пока не почувствуете себя лучше. Если вы начинаете чувствовать головокружение, лягте, чтобы не упасть в обморок, затем посидите, пока не почувствуете себя лучше.
 Не садитесь за руль, не ездите на велосипеде и не пользуйтесь инструментами или механизмами, если вы чувствуете головокружение или небольшую дрожь.
Не садитесь за руль, не ездите на велосипеде и не пользуйтесь инструментами или механизмами, если вы чувствуете головокружение или небольшую дрожь. - диарея – при диарее пейте много воды или другой жидкости. Поговорите с фармацевтом, если у вас есть признаки обезвоживания, такие как мочеиспускание реже, чем обычно, или моча темного цвета с сильным запахом. Не принимайте другие лекарства для лечения диареи, не посоветовавшись с фармацевтом или врачом.
- боль в горле — если вам 16 лет и старше, вы можете попробовать полоскать горло раствором аспирина (1 растворимая таблетка аспирина, растворенная в половине стакана воды) или использовать обезболивающее средство для полоскания рта, такое как Oraldene. Если ваши симптомы длятся дольше недели, обратитесь за советом к фармацевту или врачу. Детям до 16 лет нельзя давать аспирин.
- чихание или заложенность и насморк – попробуйте другой антигистаминный препарат, не вызывающий сонливости.
 Если это не поможет, поговорите со своим врачом.
Если это не поможет, поговорите со своим врачом.
7. Беременность и кормление грудью
Цетиризин можно применять при беременности. Нет убедительных доказательств того, что это наносит вред ребенку. Тем не менее, могут быть рекомендованы другие антигистаминные препараты, такие как лоратадин, поскольку имеется больше информации о его применении во время беременности.
Цетиризин и грудное вскармливание
Если ваш врач или патронажная сестра говорят, что ваш ребенок здоров, вы можете принимать цетиризин во время грудного вскармливания.
Имеются данные, свидетельствующие о том, что в грудное молоко попадает лишь очень небольшое количество. Цетиризин используется в течение многих лет при грудном вскармливании без побочных эффектов у детей.
Если ваш ребенок не ест так хорошо, как обычно, кажется необычно сонливым или если у вас есть какие-либо другие опасения по поводу вашего ребенка, поговорите со своим врачом, фармацевтом, патронажной сестрой или акушеркой.

Несрочный совет: сообщите своему врачу, если вы:
- попытка забеременеть
- беременность
- кормление грудью
Узнайте больше о том, как цетиризин может повлиять на вас и вашего ребенка во время беременности, на веб-сайте Best Use of Medicines in Pregnancy (BUMPS).
8. Предостережения при приеме других лекарственных средств
Некоторые лекарства могут увеличить вероятность побочных эффектов при приеме цетиризина.
Уточните у своего фармацевта или врача, принимаете ли вы какие-либо лекарства, вызывающие сонливость, сухость во рту или затрудняющие мочеиспускание. Прием цетиризина может усугубить эти побочные эффекты.
Смешивание цетиризина с растительными лекарственными средствами и добавками
При приеме некоторых растительных лекарственных средств и добавок вместе с цетиризином могут возникнуть проблемы, особенно те, которые вызывают сонливость, сухость во рту или затрудняют мочеиспускание.

Безопасность медицины
Сообщите своему врачу или фармацевту, если вы принимаете какие-либо другие лекарства, включая лекарственные травы, витамины или добавки.
9. Общие вопросы о цетиризине
Как действует цетиризин?Цетиризин — это лекарство, называемое антигистаминным средством. Когда вы вступаете в контакт с чем-то, на что у вас аллергия, например, пыльцой, шерстью животных или мехом, ваше тело вырабатывает химическое вещество под названием гистамин.
Обычно гистамин является полезным веществом, но при аллергической реакции он вызывает неприятные симптомы, включая зуд, слезотечение, насморк или заложенность носа, чихание и кожную сыпь.
Цетиризин блокирует действие гистамина и уменьшает эти симптомы.
Когда я почувствую себя лучше?Через час вы почувствуете себя лучше.
Как долго я должен принимать цетиризин?
Это зависит от того, почему вы принимаете цетиризин.
Возможно, вам потребуется принять его в течение короткого времени или в виде разовой дозы.
Например, если у вас есть реакция на укус насекомого, вам может понадобиться принимать цетиризин всего один или два дня.
Возможно, вам придется принимать цетиризин дольше, если вы принимаете его для предотвращения симптомов, например, чтобы остановить сенную лихорадку при высоком уровне пыльцы.
Поговорите со своим врачом или фармацевтом, если вы не знаете, как долго вам нужно принимать цетиризин.
Безопасно ли принимать цетиризин в течение длительного времени?Цетиризин вряд ли причинит вам вред, если вы будете принимать его в течение длительного времени.
Однако лучше всего принимать цетиризин столько, сколько вам нужно.
 Если вы принимаете его регулярно в течение длительного периода, существует очень небольшая вероятность сильного зуда, если вы внезапно прекратите лечение.
Если вы принимаете его регулярно в течение длительного периода, существует очень небольшая вероятность сильного зуда, если вы внезапно прекратите лечение.Если вы принимаете цетиризин каждый день в течение длительного времени, поговорите со своим врачом перед прекращением приема.
Можно ли с ним пить алкоголь?Во время приема цетиризина лучше не употреблять алкоголь, так как он может вызывать сонливость.
Есть ли какая-то еда или питье, которых мне следует избегать?Вы можете нормально есть и пить, принимая цетиризин.
Могу ли я водить или ездить на велосипеде с ним?Цетиризин классифицируется как антигистаминный препарат, не вызывающий сонливости, но после его приема все же возможно чувство сонливости.
Если это случилось с вами, не водите машину, не ездите на велосипеде, не пользуйтесь инструментами или механизмами до тех пор, пока не почувствуете усталость.

Вождение автомобиля является правонарушением, если это влияет на вашу способность безопасно управлять автомобилем. Вы несете ответственность за принятие решения о том, безопасно ли водить машину. Если вы сомневаетесь, не садитесь за руль.
Поговорите со своим врачом или фармацевтом, если вы не уверены, безопасно ли вам управлять автомобилем, принимая цетиризин. На сайте GOV.UK есть дополнительная информация о законе о наркотиках и вождении.
В чем разница между цетиризином и другими антигистаминными препаратами?Цетиризин известен как антигистаминный препарат, не вызывающий сонливости. Это потому, что он с меньшей вероятностью вызовет у вас сонливость, чем седативные антигистаминные препараты, такие как Пиритон (хлорфенамин).
Большинство людей предпочитают принимать не вызывающие сонливость антигистаминные препараты, а не те, которые вызывают сонливость. Исключением является случай, когда вы хотите, чтобы лекарство вызывало сонливость, например, если у вас зуд кожи, который не дает вам уснуть.
В чем разница между цетиризином и другими антигистаминными препаратами, не вызывающими сонливости?
Другие антигистаминные препараты, не вызывающие сонливости, такие как лоратадин, дезлоратадин, фексофенадин и левоцетиризин, по-видимому, действуют так же хорошо, как цетиризин.
Но цетиризин вызывает сонливость чаще, чем лоратадин, дезлоратадин или фексофенадин.
Можно ли принимать с обезболивающими?Да, цетиризин можно принимать вместе с парацетамолом или ибупрофеном.
Можно ли принимать 2 вида антигистаминных препаратов в 1 день?Иногда врачи рекомендуют людям с сильной зудящей кожной сыпью одновременно принимать 2 разных антигистаминных препарата в течение нескольких дней.
Помимо приема антигистаминного препарата, не вызывающего сонливость, в течение дня (например, цетиризина или лоратадина), врач может посоветовать вам принимать антигистаминный препарат, вызывающий сонливость, в ночное время, если зуд мешает заснуть.

Не принимайте 2 антигистаминных препарата вместе, если это не рекомендовано врачом.
Могу ли я принимать цетиризин с другими препаратами для лечения сенной лихорадки?Да, можно принимать цетиризин вместе с некоторыми другими средствами для лечения сенной лихорадки, например, стероидными назальными спреями (такими как беклометазон (Beconase), Rhinocort Aqua и Flixonase Nasules) или глазными каплями.
Могу ли я принимать цетиризин в более высоких дозах, чем указано на упаковке?Ваш врач может назначить вам или вашему ребенку более высокую дозу цетиризина (вплоть до 4-кратной обычной дозы) при сильной зудящей кожной сыпи или припухлости под кожей (ангионевротический отек).
Однако прием высоких доз цетиризина подходит не всем. Поговорите со своим врачом, если вы считаете, что цетиризин вам не подходит.
Повлияет ли это на мою фертильность?Нет никаких доказательств того, что прием цертиризина снижает фертильность как у мужчин, так и у женщин.

Поговорите с фармацевтом или врачом, прежде чем принимать его, если вы пытаетесь забеременеть.
Повлияет ли это на мою контрацепцию?Цетиризин не влияет ни на один вид контрацепции, включая комбинированные таблетки и экстренную контрацепцию.
Однако, если цетиризин вызывает у вас рвоту или тяжелую диарею в течение более 24 часов, ваши противозачаточные таблетки могут не защитить вас от беременности. Проверьте упаковку с таблетками, чтобы узнать, что делать.
Узнайте больше о том, что делать, если вы принимаете противозачаточные таблетки и у вас плохое самочувствие или диарея.
Могут ли изменения образа жизни облегчить сенную лихорадку?Будет полезно, если вы не будете проводить слишком много времени на улице, если количество пыльцы высокое.
Советы, когда вы на улице
- Не косите траву и не ходите по траве.



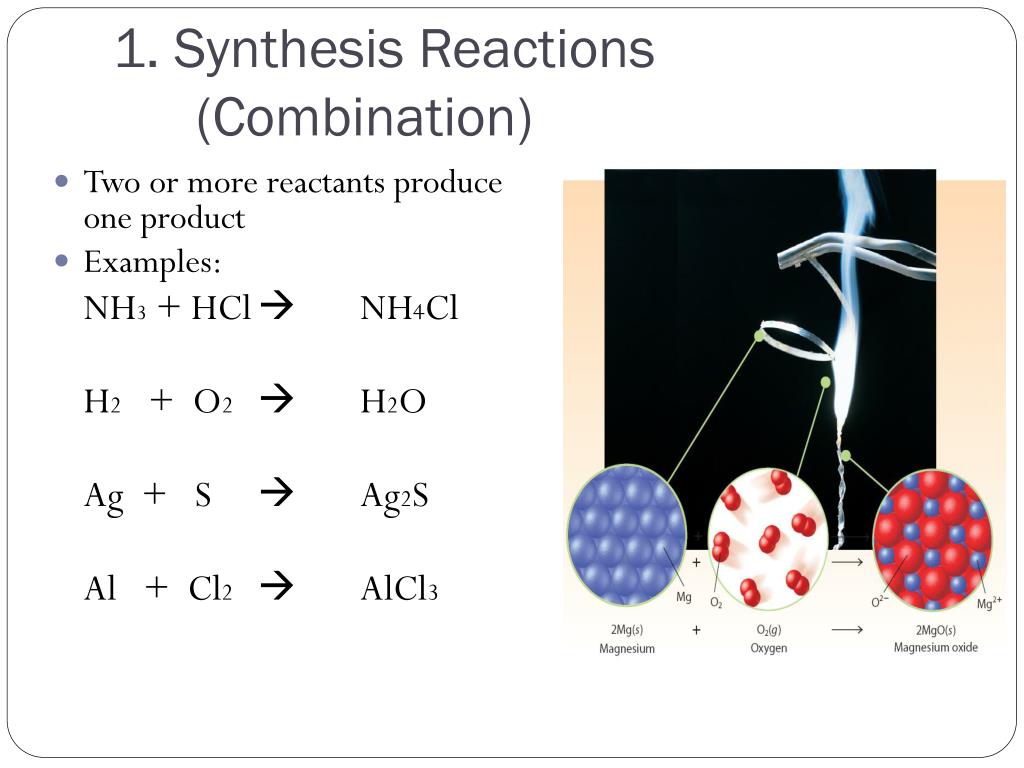
 к. – Q) 157 кДж энергии,
к. – Q) 157 кДж энергии, 
 Установите соответствие между схемой реакции и её типом:
Установите соответствие между схемой реакции и её типом:
 С.),
С.),



 Однако при более высокой концентрации кислоты, такой как 2 моль, количество частиц кислоты больше, что увеличивает вероятность столкновения частицы кислоты с частицей магния.
Однако при более высокой концентрации кислоты, такой как 2 моль, количество частиц кислоты больше, что увеличивает вероятность столкновения частицы кислоты с частицей магния.
 Решение: мы заставим верхнюю поверхность соприкасаться с кислотой, используя магнитную мешалку для перемешивания кислоты, создавая вихрь, в который мы можем поместить магний, чтобы обеспечить покрытие всех сторон.
Решение: мы заставим верхнюю поверхность соприкасаться с кислотой, используя магнитную мешалку для перемешивания кислоты, создавая вихрь, в который мы можем поместить магний, чтобы обеспечить покрытие всех сторон. ) 70,0 o C. .
) 70,0 o C. .

 Если кислота относительно разбавлена, вы, как правило, получаете монооксид азота, хотя он немедленно реагирует с кислородом воздуха, образуя коричневый диоксид азота.
Если кислота относительно разбавлена, вы, как правило, получаете монооксид азота, хотя он немедленно реагирует с кислородом воздуха, образуя коричневый диоксид азота.
 Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.
Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.

 Как и когда принимать цетиризин
Как и когда принимать цетиризин




 Если это не поможет, поговорите со своим врачом.
Если это не поможет, поговорите со своим врачом. Не садитесь за руль, не ездите на велосипеде и не пользуйтесь инструментами или механизмами, если вы чувствуете головокружение или небольшую дрожь.
Не садитесь за руль, не ездите на велосипеде и не пользуйтесь инструментами или механизмами, если вы чувствуете головокружение или небольшую дрожь. Если это не поможет, поговорите со своим врачом.
Если это не поможет, поговорите со своим врачом.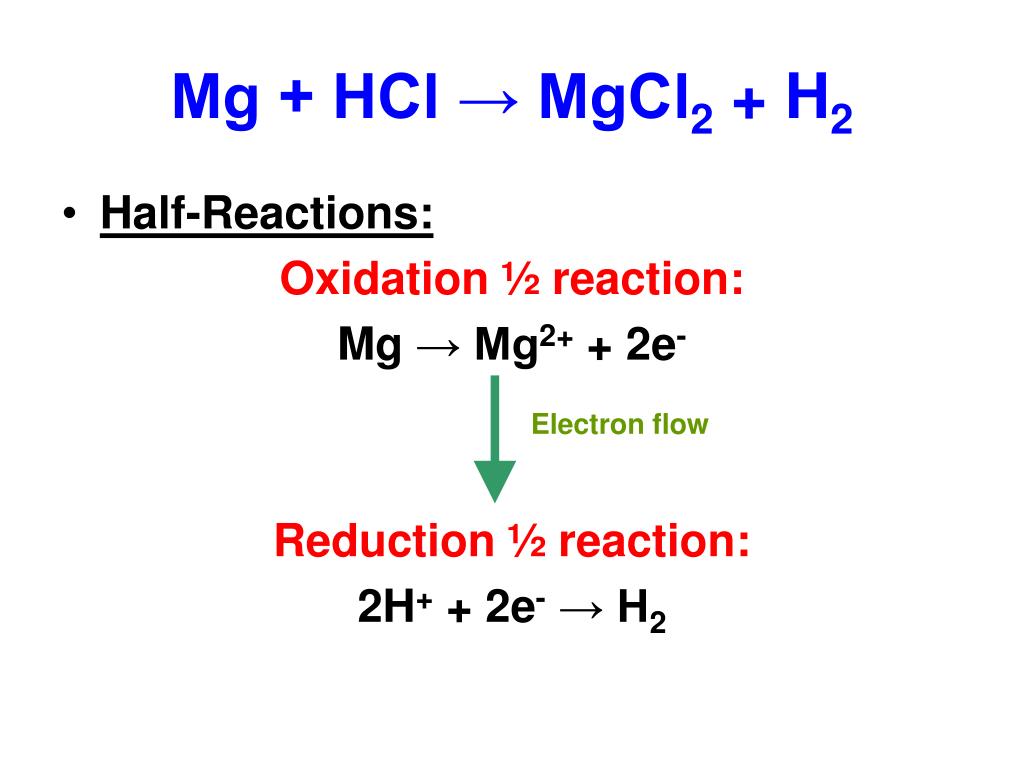


 Если вы принимаете его регулярно в течение длительного периода, существует очень небольшая вероятность сильного зуда, если вы внезапно прекратите лечение.
Если вы принимаете его регулярно в течение длительного периода, существует очень небольшая вероятность сильного зуда, если вы внезапно прекратите лечение.



