Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.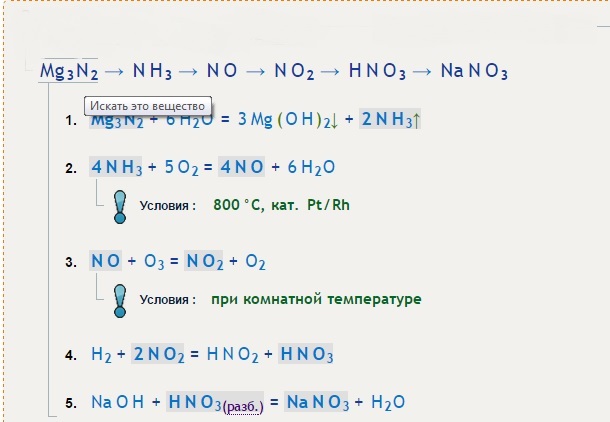 д. Координационные свойства проявляются всеми элементами периодической системы.
д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26. 12.2016 12:02
12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
– 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.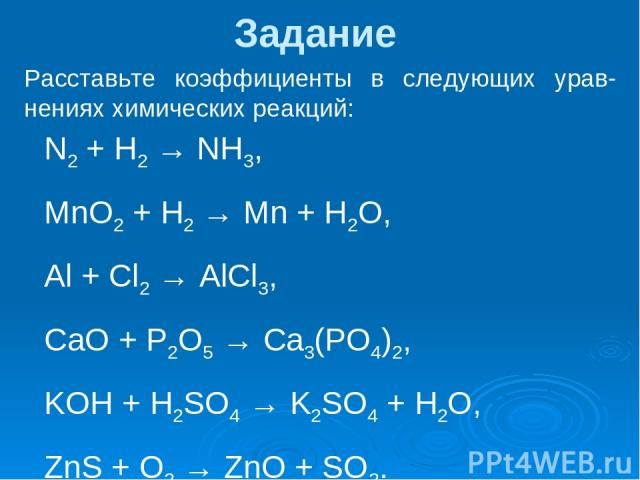
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701. 32 kB
32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
Самостоятельная работа «Химические уравнения. Расстановка коэффициентов»
Материал опубликовала
4
#8 класс #Химия #Учебно-дидактические материалы #Контрольные / проверочные работы #Учитель-предметник #Школьное образование #УМК О. С. Габриеляна
Нажмите, чтобы скачать публикацию
в формате MS WORD (*.DOC)
Размер файла: 25.52 Кбайт
Учебно-методический материал
Самостоятельная работа по химии
«Химические уравнения. Расстановка коэффициентов»
Расстановка коэффициентов»
Маланина Е. А., учитель химии
МБОУ Одинцовская гимназия № 13,
Московская область
Пояснительная записка
УМК
Авторская программа О. С. Габриеляна, соответствующей Федеральному компоненту Государственного стандарта общего образования и допущенной Министерством образования и науки Российской Федерации (О. С. Габриелян, С. А. Сладков. Химия. Рабочие программы. Предметная линия учебников Габриеляна О. С.7, 8-9 классы – М.: Просвещение, 2019). Учебник «Химия -8», Габриелян О. С., Остроумов И. Г., Сладков С. А. M: Просвещение, 2019
Назначение диагностической работы
Работа предназначена для определения умения объяснять и расставлять коэффициенты в уравнениях химических реакций учащимися 8-х классов.
Проведение самостоятельной работы на момент изучения понятий: химические реакции, химические уравнения, содержание параграфов 9-10, глава 1 «Первоначальные химические понятия».
Условия проведения диагностической работы.
При проведении самостоятельной работы предусматривается использование учащимися: Периодической системы химических элементов Д.И. Менделеева. В зависимости от каества обученности классного коллектива возможно использование материала параграфа 9 «Химические реакции», параграфа 10 «Химические уравнения».
Время выполнения диагностической работы
На выполнение всей работы отводится 10 минут.
Содержание и структура самостоятельной работы
Комплект содержит шесть карточек (вариантов). Каждый вариант включает 9 уравнений химических реакций, в которых необходимо расставить коэффициенты. Содержание самостоятельной работы охватывает учебный материал параграфа 9 и 10, изученный к моменту проведения работы.
Система оценивания
За каждое уравнение, в котором верно расставлены коэффициенты – 1 балл
Максимальный балл за всю работу – 9 баллов. За выполнение работы учащиеся получают школьные оценки по пятибалльной шкале.
Оценка:
5 «отлично»: правильных ответов от 9 баллов
4 «хорошо»: правильных ответов от 8 баллов
3 «удовлетворительно»: правильных ответов от 6 баллов
2 «неудовлетворительно»: правильных ответов от 0 баллов
Тема «Химические уравнения. Расстановка коэффициентов»
Задание. Расставить коэффициенты в уравнениях химических реакциях
Ф. И. _______________________________________
K + Br2 → KBr
Ch5 → C2h3 + h3
Mg + N2 → Mg3N2
Ag2O → Ag + O2
h3 + F2 → HF
Cr2O3 + Al → Al2O3 + Cr
CuO + C → Cu + CO2
MgCl2 + KOH → KCl + Mg(OH)2
CaBr2 + K3PO4→ KBr + Ca3(PO4)2
Тема «Химические уравнения. Расстановка коэффициентов»
Задание. Расставить коэффициенты в уравнениях химических реакциях
Ф. И. _______________________________________
И. _______________________________________
Ba + O2 → BaO
h4N → h3 + N2
Al + C → Al4C3
Na + Cl2 → NaCl
HBr → h3 + Br2
Ba + h3O → Ba(OH)2 + h3
CuO + Al → Al2O3 + Cu
HNO3 + BaO → Ba(NO3)2 + h3O
Al2(SO4)3 + NaOH → Na2SO4 + Al(OH)3
Тема «Химические уравнения. Расстановка коэффициентов»
Задание. Расставить коэффициенты в уравнениях химических реакциях
Ф. И. _______________________________________
B + O2→ B2O3
HgO → Hg + O2
Cu + O2 → CuO
h3O → h3 + O2
Ca + N2 → Ca3N2
Fe2O3 + C → CO2 + Fe
WO3 + h3 → W + h3O
Fe2O3 + h3SO4 → Fe2(SO4)3 + h3O
Ca3P2 + h3O → Ca(OH)2 + Ph4
Тема «Химические уравнения. Расстановка коэффициентов»
Задание. Расставить коэффициенты в уравнениях химических реакциях
Ф. И. _______________________________________
Fe + O2 →Fe3O4
KClO3 → KCl + O2
Al + S → Al2S3
Mg + O2 → MgO
Al(OH)3 → Al2O3 + h3O
FeO + Al → Al2O3 + Fe
HgCl2 + Al → AlCl3 + Hg
Na2CO3 + Ca(NO3)2 → CaCO3 + NaNO3
HBr + Al2O3 → AlBr3 + h3O
Тема «Химические уравнения. Расстановка коэффициентов
Расстановка коэффициентов
Задание. Расставить коэффициенты в уравнениях химических реакциях
Ф. И. _______________________________________
Li + O2 →Li2O
N2 + F2 →NF3
CuOH →Cu2O + h3O
S + F2 →SF6
P2O5 + Na2O → Na3PO4
Si + CaO → Ca + SiO2
KI + Br2 → I2 + KBr
CuCl2 + K2S → CuS + KCl
Cr(OH)3 + h3SO4→ Cr2(SO4)3 + h3O
Тема «Химические уравнения. Расстановка коэффициентов»
Задание. Расставить коэффициенты в уравнениях химических реакциях
Ф. И. _______________________________________
P + O2 → P2O5
NO → N2 + O2
K + P → K3P
P + Cl2 → PCl5
Na + S→ Na2S
Sih5 + O2 → SiO2 + h3O
TiO2 + Ca → CaO + Ti
ZnSO4 + KOH → K2SO4 + Zn(OH)2
LiOH + Fe(NO3)3 → Fe(OH)3 + LiNO3
Опубликовано в группе «Дидактический материал к уроку химии 8 класс»
Чтобы написать комментарий необходимо авторизоваться.
: Баланс химического уравнения для реакции между нитридом магния и водой
Нитрид магния энергично реагирует с водой с образованием аммиака и гидроксида магния по следующей реакции: _ Mg₃N₂ + _ H₂O ⟶ _ NH₃ + _ Mg(OH)₂. Какие из следующих чисел в правильном порядке являются стехиометрическими коэффициентами, отсутствующими в уравнении реакции? [А] 1, 3, 1, 2 [Б] 1, 3, 2, 2 [В] 2, 6, 4, 3 [Г] 2, 3, 4, 3 [Д] 1, 6, 2, 3
Стенограмма видеозаписи
Нитрид магния энергично реагирует с водой с образованием аммиака и гидроксида магния в соответствии со следующей реакцией: пустой Mg3N2 плюс пустой H3O реагируют с образованием чистого Nh4 плюс пустой Mg(OH)2. Какие из следующих чисел в правильном порядке являются стехиометрическими коэффициентами, отсутствующими в уравнении реакции? (А) Раз, три, раз, два; (Б) один, три, два, два; (С) два, шесть, четыре, три; (Г) два, три, четыре, три; или (Е) один, шесть, два, три.
Какие из следующих чисел в правильном порядке являются стехиометрическими коэффициентами, отсутствующими в уравнении реакции? (А) Раз, три, раз, два; (Б) один, три, два, два; (С) два, шесть, четыре, три; (Г) два, три, четыре, три; или (Е) один, шесть, два, три.
По сути, нам нужно сбалансировать это уравнение. Начнем с того, что перепишем его. У нас есть нитрид магния, или Mg3N2, реагирующий с водой, или h3O, с образованием аммиака, Nh4, и гидроксида магния, Mg(OH)2. Начнем с определения всех присутствующих элементов. У нас есть Mg, магний; N, азот; Н, водород; и О, кислород. Теперь нам нужно подсчитать, сколько существует эквивалентов каждого атома в реагентах в левой части уравнения и в продуктах в правой части уравнения.
Начнем с Mg, магний. На стороне реагента присутствует только один магний, и он имеет индекс три. Таким образом, мы можем подсчитать три рядом с магнием в колонке реагентов. В правой части уравнения есть только одно появление магния, и у него нет нижнего индекса.
Если мы проделаем то же самое для азота, то мы подсчитаем два для реагентов и один для продуктов. Если мы повторим процесс для водорода, мы подсчитаем два для реагентов, а затем три плюс еще два для стороны продукта. Таким образом, у нас есть пять баллов по водороду со стороны продукта. Если мы проделаем то же самое еще раз для кислорода, у нас будет одна цифра слева и две цифры справа.
Чтобы сбалансировать уравнение реакции, нам нужно убедиться, что числа на каждой стороне таблицы равны. Начнем с магния. У нас есть три эквивалента для реагентов и только один для продуктов. Если бы вместо этого у нас было три моля гидроксида магния, то у нас было бы три эквивалента магния на стороне продукта. Следовательно, суммы будут равными. Но при этом мы также увеличиваем количество кислорода и водорода.
Мы можем насчитать три эквивалента кислорода. Но поскольку каждый эквивалент гидроксида магния содержит два эквивалента гидроксид-ионов, на самом деле нам нужно шесть атомов кислорода.
Теперь давайте сбалансируем количество атомов азота. У нас есть два эквивалента на стороне реагента и один на стороне продукта из аммиака. Если у нас есть два моля аммиака, то у нас будет два эквивалента азота на стороне продукта. Теперь это уравновешивается количеством азота на стороне реагента. Но при этом мы увеличиваем количество атомов водорода. Это число увеличивается на три, в результате чего общее количество атомов водорода на стороне продукта достигает 12.
Теперь попробуем сбалансировать количество атомов водорода. На стороне продукта 12, но только два на стороне реагента. Нам нужно довести это число до 12. Если мы добавим еще один моль H3O в сторону реагента, мы увеличим количество водорода на два и кислорода на один. Но это по-прежнему дает нам только четыре атома водорода на стороне реагента, когда нам нужно 12.
Теперь, когда количество эквивалентов каждого атома уравновешено в обеих частях уравнения, мы можем вычислить стехиометрические коэффициенты уравнения. Коэффициент для нитрида магния равен единице, коэффициент для воды равен шести, коэффициент для аммиака равен двум, а коэффициент для гидроксида магния равен трем. Мы рассчитали коэффициенты: один, шесть, два и три. Это соответствует значениям, найденным в опции (E).
Итак, ответ на вопрос «Какие из следующих чисел в правильном порядке являются стехиометрическими коэффициентами, отсутствующими в уравнении реакции?» это (Е) один, шесть, два, три.
Магний реагирует с азотом с образованием нитрида магния. Химическая формула этой реакции: $Mg + {N_2} \to Mg{N_2}$. Что является продуктом или продуктами этой реакции?
Последняя обновленная дата: 01 -й января 2023
•
Общее представление: 159,6K
•
Просмотр сегодня: 15,90K
Ответ
Проверено
159,6K+ виды
HINT: 9003
159,6K+
. известный как динитрид тримагния. Это неорганическое соединение состоит из различных атомов магния и азота. В природе встречается в виде минерала нитромагнезита.
Полный ответ:
При нагревании магния при очень высокой температуре в присутствии азота образуется нитрид магния. Сбалансированное химическое уравнение можно представить следующим образом:
$3Mg + {N_2}\xrightarrow{\Delta }M{g_3}{N_2}$
Продуктом этой реакции является нитрид магния. Вышеупомянутая реакция может быть как синтезом, так и их комбинацией, поскольку два реагента реагируют с образованием одного продукта. Химическая формула нитрида магния: $M{g_3}{N_2}$. Его молекулярная масса составляет 100,9 доллара.\circ}C$. Выше этой температуры он разлагается с образованием газообразного азота. Он частично растворим в воде и полностью растворим в органических растворителях, таких как этанол, метанол и аммиак. Он также растворяется в кислотах.
Вышеупомянутая реакция может быть как синтезом, так и их комбинацией, поскольку два реагента реагируют с образованием одного продукта. Химическая формула нитрида магния: $M{g_3}{N_2}$. Его молекулярная масса составляет 100,9 доллара.\circ}C$. Выше этой температуры он разлагается с образованием газообразного азота. Он частично растворим в воде и полностью растворим в органических растворителях, таких как этанол, метанол и аммиак. Он также растворяется в кислотах.
Продукт нитрид магния может подвергаться гидролизу с получением гидроксида магния и газообразного аммиака. Реакция может быть показана как:
$M{g_3}{N_2}_{(s)} + 6{H_2}{O_{(l)}} \to 3Mg{(OH)_{2(aq)}} + 2N{H_{3(aq)}}$
Примечание:
Нитрид магния является очень твердым соединением и имеет керамическую природу. Он также обладает некоторой теплопроводностью, твердостью, износостойкостью и коррозионно-стойкими свойствами. Это может быть полезно в процессе синтеза новых материалов, например, сплавов с разными типами керамики.
