ГДЗ Хімія 8 клас Григорович §40 2021 / §42 2016 ГЕНЕТИЧНІ ЗВ’ЯЗКИ МІЖ КЛАСАМИ НЕОРГАНІЧНИХ СПОЛУК відповіді » Допомога учням
Інші завдання дивись тут…
Завдання для засвоєння матеріалу
Вправа 1
Складіть формули таких речовин: кальцій оксид CaO, калій оксид K2O, фосфор (III) оксид P2O3, барій оксид BaO, цинк оксид ZnO, сульфідна кислота H2S, карбонатна кислота H2CO3, магній гідроксид Mg(OH)2, ферум (II) гідроксид Fe(OH)2, силікатна кислота H2SiO3, купрум (II) гідроксид Cu(OH)2, літій гідроксид LiOH, калій гідроксид KOH, нікол (II) сульфат NiSO4, алюміній гідроксид Al(OH)3, натрій ортофосфат Na3PO4, хлоридна кислота HCl, ортофосфатна кислота H3PO4.
Вправа 2
Із наведених формул речовин випишіть окремо формули та назви оксидів, кислот, основ і солей: NaOH, HCl, H2SO4, Ca(OH)2, HBr, Cu(OH)2, H3PO4, H2SiО3, H2S, NaOH, Fe(OH)2, K2SO4, CaBr2, CuCO3, CO2, Mg(OH)2, AlPO4, SO3, HI, CuSO4, Zn(OH)2, Ba(NO3)2, FeCl3, Na2S, Al(NO3)3, Ba3(PO4)2.
Оксиди: CO2 карбон (IV) оксид, SO3 сульфур (VI) оксид.
Кислоти: HCl хлоридна кислота, H2SO4 сульфатна кислота, HBr бромідна кислота, H3PO4 ортофосфатна кислота, H2SiО3 силікатна кислота, H2S сульфідна кислота, HI йодидна кислота.
Основи: NaOH натрій гідроксид, Ca(OH)2 кальцій гідроксид, Cu(OH)2 купрум (ІІ) гідроксид, Fe(OH)2 ферум (ІІ) гідроксид, Mg(OH)2 магній гідроксид, Zn(OH)2 цинк гідроксид.
Солі: K2SO4 калій сульфат, CaBr2 кальцій бромід, CuCO3 купрум (ІІ) карбонат, AlPO4 алюміній ортофосфат, CuSO4 купрум (ІІ) сульфат, Ba(NO3)2 барій нітрат, FeCl3 ферум (ІІІ) хлорид, Na2S натрій сульфід, Al(NO3)3 алюміній нітрат, Ba3(PO4)2 барій ортофосфат.
Оксиди — це бінарні сполуки елементів з Оксигеном, і яких Оксиген виявляє ступінь окиснення -2.
Кислоти — це складні речовини, що складаються з йонів Гідрогену та кислотного залишку.
Основи — це сполуки, що складаються з йонів металічного елемента й одного або декількох гідроксид-іонів OH–.
Солі — це сполуки, що складаються з йонів металічних елементів та кислотних залишків.
Вправа 3
Невідомий оксид розчиняється у воді з утворенням розчину, що забарвлює лакмус у червоний колір. Який висновок можна зробити щодо характеру властивостей цього оксиду? Це кислотний оксид. Чи буде він взаємодіяти з хлоридною кислотою, натрій гідроксидом, натрій хлоридом, кальцій оксидом? Відповідь обґрунтуйте. Кислотні оксиди взаємодіють з лугами і основними оксидами, тому кислотний оксид, наприклад, СО2 буде реагувати з натрій гідроксидом і кальцій оксидом.
СО2 + 2NaOH = Na2CO3 + H2O
CO2 + CaO = CaCO3
Вправа 4
Проілюструйте генетичний зв’язок між класами неорганічних речовин на прикладі магнію й сірки. Складіть відповідні рівняння реакцій.
Складіть відповідні рівняння реакцій.
Mg → MgO → MgSO4
2Mg + O2 = 2MgO
MgO + H2SO4 = MgSO4 + H2O
При згорянні магнію утворюється основний оксид MgO. З водою магній оксид не взаємодіє, бо не утворює лугу (не є оксидом лужного і лужноземельного елемента). При взаємодії основного оксиду і кислоти утворюється сіль.
S → SO2 → H2SO3
S + O2 = SO2
SO2 + H2O = H2SO3
При згорянні сірки утворюється кислотний оксид SO2, що реагує з водою з утворенням сульфітної кислоти H2SO3.
Вправа 5
Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
а) Mg → MgО → MgCl2 → MgCO3 → Mg(NO3)2;
2Mg + O2 = 2MgO
MgO + 2HCl = MgCl2 + H2O
MgCl2 + Na2CO3 = 2NaCl + MgCO3
MgCO3 + 2HNO3 = Mg(NO3)2 + H2O + CO2↑
б) S → SO2 → Na2SO3 → BaSO3 → SO2;
S + O2 = SO2
SO2 + Na2O = Na2SO3
Na2SO3 + BaCl2 = BaSO3↓+ 2NaCl
BaSO3 = BaO + SO2↑
в) Na → NaOH → Na2SO4 → NaCl → NaNO3.
2Na + 2H2O = 2NaOH + H2↑
2NaOH + SO3 = Na2SO4 + H2O
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
NaCl + AgNO3 = NaNO3 + AgCl↓
Вправа 6
Наведіть рівняння реакцій, що ілюструють чотири різні способи добування кальцій карбонату.
СaO + CO2 = CaCO3
Ca(OH)2 + CO2 = CaCO3 + H2O
Ca(OH)2 + Na2CO3 = CaCO3 + 2NaOH
CaCl2 + Na2CO3 = CaCO3 + 2NaCl
Вправа 7
Розташуйте запропоновані речовини за порядком, що характеризує генетичний
зв’язок класів речовин, та складіть відповідні рівняння реакцій:
а) фосфор (V) оксид, калій ортофосфат, фосфор, ортофосфатна кислота;
Р -> P2O5 -> H3PO4 -> K3PO4
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + 3KOH = K3PO4 + 3H2O
б) барій гідроксид, барій оксид, барій карбонат, барій;
Ba -> BaO -> Ba(OH)2 -> BaCO3
2Ba + O2 = 2BaO
BaO + H2O = Ba(OH)2↓
Ba(OH)2 + H2CO3 = BaCO3 + 2H2O
в) купрум (II) оксид, купрум (II) гідроксид, мідь, купрум (II) сульфат.
Cu -> CuO -> CuSO4 -> Cu(OH)2
2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
Вправа 8
Як добути кальцій хлорид з кальцій нітрату, використовуючи калій карбонат і хлоридну кислоту? Складіть рівняння реакцій.
Ca(NO3)2 + K2CO3 = CaCO3↓ + 2KNO3
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Вправа 9
Визначте відсутні ланки ланцюгів перетворень, що характеризують генетичний зв’язок речовин. Складіть рівняння реакцій, що характеризують ці перетворення.
а) S → ? → H2SO3 → CaSO3;
S → SO2→ H2SO3 → CaSO3;
S + O2 = SO2
SO2 + H2O = H2SO3
H2SO3 + Ca(OH)2 = CaSO3 + 2H2O
б) Fe → Fe2O3 → ? → Fe(OH)3.
Fe → Fe2O3 → FeCl3 → Fe(OH)3.
4Fe + 3O2 = 2Fe2O3
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
Вправа 10
Складіть рівняння реакцій для здійснення таких перетворень:
а) Ca → CaO → Ca(ОН)2 → CaСl2;
2Ca + O2 = 2CaO
CaO + H2O = Ca(OH)2
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
б) S → SО2 → Н2SО3 → Nа2SО3;
S + O2 = SO2
SO2 + H2O = H2SO3
H2SO3 + 2NaOH = Na2SO3 + 2H2O
в) Ba → BaО → Ba(ОН)2 → BaSО4;
2Ba + O2 = 2BaO
BaO + H2O = Ba(OH)2
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
г) С → CO2 → CaCO3 → CaСl2 → Ca(ОН)2;
C + O2 = CO2↑
CO2 + CaO = CaCO3
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
CaCl2 + 2NaOH = Ca(OH)2 + 2NaCl
д) NаОН → Nа2CO3 → CO2 → MgCO3;
2NaOH + H2CO3 = Na2CO3 + 2H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CO2 + MgO = MgCO3
е) Аl → Аl2О3 → Аl2(SО4)3 → Аl(ОН)3 → Аl2О3;
4Al + 3O2 = 2Al2O3
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
Al2(SO4)3 + 6NaOH = 2Al(OH)3↓+ 3Na2SO4
2Al(OH)3↓ = Al2O3 + 3H2O
є) Fe → Fe2O3 → Fe(NO3)3 → Fe(OH)3 → Fe2O3 → Fe → FeCl2.
4Fe + 3O2 = 2Fe2O3
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Fe(NO3)3 + 3NaOH = Fe(OH)3↓+ 3NaNO3
2Fe(OH)3↓ = Fe2O3 + 3H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
Fe+ 2HCl = FeCl2 + H2↑
Вправа 11
Визначте відсутні ланки ланцюгів, що характеризують генетичний зв’язок речовин:
а) Ca → ? → ? → Ca(NO3)2;
Ca -> CaO -> Ca(OH)2 -> Ca(NO3)2
2Ca + O2 = 2CaO
CaO + H2O = Ca(OH)2
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
б) SO3 -> ? -> ? -> ?
SO3 -> H2SO4 -> MgSO4 -> Mg(OH)2
SO3 + H2O = H2SO4
H2SO4 + Mg = MgSO4 + H2↑
MgSO4 + 2NaOH = Na2SO4 + Mg(OH)2
в) Mg(OH)2 -> ? -> ? -> ? -> ?
Mg(OH)2 -> MgO -> MgCl2 -> Mg(OH)2 -> MgSO4
Mg(OH)2↓= MgO + H2O
MgO + 2HCl = MgCl2 + H2O
MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
Вправа 12
До розчину блакитного кольору додали розчин лугу, при цьому випав блакитний осад. Осад відфільтрували і прожарили. У результаті одержали чорний порошок, що потім обробили воднем під час нагрівання.
Осад відфільтрували і прожарили. У результаті одержали чорний порошок, що потім обробили воднем під час нагрівання.
Утворився метал червоного кольору. Визначте описані речовини, складіть рівняння реакцій.
Речовини: розчин мідного купоросу CuSO4 має блакитний колір, розчин натрій гідроксиду NaOH, купрум (ІІ) гідроксид Cu(OH)2, купрум оксид CuO, метал купрум Cu.
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ — осад блакитного кольору
Cu(OH)2↓ = Н2О + CuO — оксид чорного кольору
CuO + H2 = Н2О + Cu — метал червоного кольору
Вправа 13
Порівняйте об’єм сульфур (IV) оксиду (за н.у.), що можна добути із сірки масою 480 г та натрій сульфіту масою 630 г.
Відомо: m(S)=480 г, m(Na2SO3)=630 г
Порівняти V1(SO2) і V2(SO2)
Розв’язування
І спосіб
1. Обчислюємо кількості речовини сірки масою 480 г і натрій сульфіту масою 630 г за формулою n=m/M, де M=Mr г/моль.
Обчислюємо кількості речовини сірки масою 480 г і натрій сульфіту масою 630 г за формулою n=m/M, де M=Mr г/моль.
Mr(S)=Ar(S)=32, M(S)=32 г/моль,
Mr(Na2SO3)=2•Ar(Na)+Ar(S)+3•Ar(О)=2•23+32+3•16=126, M(Na2SО3)=126 г/моль
n(S)=m(S)/M(S)=480 г : 32 г/моль=15 моль
n(Na2SО3)=m(Na2SО3)/M(Na2SО3)=630 г : 126 г/моль=5 моль
2. Записуємо два рівняння реакції:
S + O2 = SO2↑ (1)
Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑ (2)
За рівнянням реакції (1) n(S):n1(SО2)=1:1, кількість речовини однакова, тому
n1(SO2)=n(S)=15 моль
За рівнянням реакції (2) n(Na2SO3):n2(SО2)=1:1, кількість речовини однакова, тому
n2(SO2)=n(Na2SO3)=5 моль
3, Обчислюємо об’єми SO2 кількість речовини 15 моль і 5 моль за формулою V=n•VM
V1(SO2)=n1(SO2)•VM=15 моль•22,4 л/моль=336 л
V2(SO2)=n2(SO2)•VM=5 моль•22,4 л/моль=112 л
V1(SO2)>V2(SO2)
ІІ спосіб
Записуємо два рівняння реакції:
S + O2 = SO2↑ (1)
Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑ (2)
За рівнянням реакції (1) n(S)/1=n1(SO2)/1
У ццьому співвідношенні замінюємо кількість речовини сульфур (IV) оксиду на співвідношення об’ємів, а кількість речовини сірки — на співвідношення мас.
V1(SO2)/VM=m(S)/M(S)
Звідси виражаємо об’єм газу сульфур (IV) оксиду:
V1(SO2)•М(S)=m(S)•VM, тому
V1(SO2)=m(S)•VM:M(S)
Обчислюємо молярну масу сірки і підставляємо значення у формулу.
Mr(S)=Ar(S)=32, M(S)=32 г/моль
V1(SO2)=480 г • 22,4 л/моль : 32 г/моль=336 л
За рівнянням реакції (2) n(Na2SO3)/1=n1(SO2)/1
У цьому співвідношені замінюємо кількість речовини сульфур (IV) оксиду на співвідношення об’ємів, а кількість речовини натрій сульфіту — на співвідношення мас.
V2(SO2)/VM=m(Na2SO3)/M(Na2SO3)
Звідси виражаємо об’єм газу сульфур (IV) оксиду:
V2(SO2)•М(Na2SO3)=m(Na2SO3)•VM, тому
V2(SO2)=m(Na2SO3)•VM:M(Na2SO3)
Обчислюємо молярну масу Na2SO3 і підставляємо значення у формулу.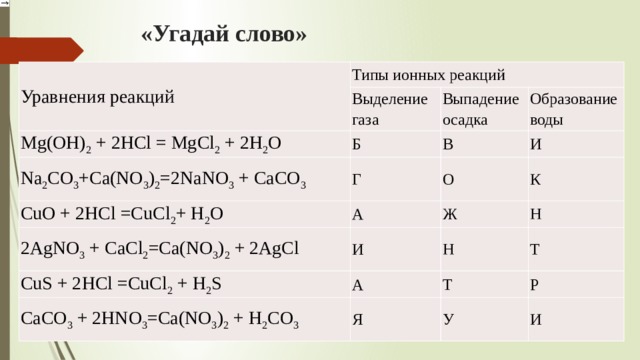
Mr(Na2SO3)=2•Ar(Na)+Ar(S)+3•Ar(О)=2•23+32+3•16=126, тому M(Na2SО3)=126 г/моль
V2(SO2)=630 г•22,4 л/моль:126 г/моль=112 л
V1(SO2)>V2(SO2)
Відповідь: більший об’єм SO2 можна добути з порції cірки
Вправа 14
Обчисліть масу фосфору, що необхідно ввести в низку перетворень для добування кальцій ортофосфату масою 15,5 г.
Відомо: m(Са3(PО4)2)=15,5 г
Знайти m(P)-?
Розв’язування
1. Обчислюємо кількість речовини Са3(PО4)2 масою 15,5 г за формулою n=m/M, де
M=Mr г/моль
Mr(Са3(PО4)2)=3•Ar(Ca)+2•Ar(P)+8•Ar(O)=3•40+2•31+8•16=310, М(Ca3(PO4)2)=310 г/моль
n(Ca3(PO4)2)=m(Ca3(PO4)2)/M(Ca3(PO4)2)=15,5 г : 310 г/моль=0,05 моль
2. Записуємо рівняння реакції: 2P2O5+ 6CaО = 2Ca3(PO4)2
Записуємо рівняння реакції: 2P2O5+ 6CaО = 2Ca3(PO4)2
За рівнянням реакції n(P2O5):n(Ca3(PO4)2)=2:2=1:1, кількості речовини однакові,
n(P2O5)=n(Са3(PO4)2=0,05 моль
3. Записуємо рівняння реакції: 4Р + 5О2=2Р2О5
За рівнянням реакції n(P):n(P2O5)=4:2, звідси
n(P)•2=n(P2O5)•4, тому
n(P)=4•n(P2O5):2=4•0,05:2=0,1 моль
4. Обчислюємо масу фосфору кількістю речовини 0,1 моль за формулою m=n•M
Mr(P)=Ar(P)=31, тому М(P)=31 г/моль
m(P)=n(P)•M(P)=0,1•31=3,1 г
Відповідь: 3,1 г
Інші завдання дивись тут…
Досрочный вариант ЕГЭ по химии 2023
ЙДосрочный вариант ЕГЭ по химии-2023. Вариант 1. Скачать разбор досрочного варианта ЕГЭ по химии-2023 от 10 апреля 2023 с ответами и решениями. Здесь вы можете посмотреть, как выглядит реальный вариант ЕГЭ по химии.
Здесь вы можете посмотреть, как выглядит реальный вариант ЕГЭ по химии.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) Cu 2) Li 3) Cl 4) Fe 5) F Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
1. Определите, атомы каких из указанных в ряду элементов имеют одинаковую электронную конфигурацию предвнешнего энергетического уровня. Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые находятся три элемента малых
периодов. Расположите выбранные элементы в порядке возрастания электроотрицательности.
3. Из числа указанных в ряду элементов выберите два элемента, которые имеют постоянную степень окисления. Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите два вещества немолекулярного строения, в каждом из которых присутствует ковалентная неполярная химическая связь.
Из предложенного перечня выберите два вещества немолекулярного строения, в каждом из которых присутствует ковалентная неполярная химическая связь.
1) карбид алюминия
2) алмаз
3) карбид кальция
4) ацетилен
5) пероксид водорода
Запишите в поле ответа номера выбранных веществ.
5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) соль азотной кислоты; Б) нерастворимое основание; В) основная соль
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
6. Даны две пробирки с раствором гидроксида калия. В одну из них добавили раствор вещества X и наблюдали выделение газа с резким запахом. Во вторую пробирку добавили нерастворимое в воде Y и наблюдали его растворение.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) сульфит натрия
2) нитрат магния
3) бромид аммония
4) гидроксид железа (II)
5) гидроксид алюминия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
7. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Mg Б) HCl(конц.) В) NaHCO3 Г) Al(OH)3 | 1) Cl2, NaOH, KI 2) С, Zn(NO3)2, P 3) NaNO3, Cl2, HNO3 4) KMnO4, CaO, Fe 5) HNO3, HBr, KOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
8. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ |
| А) SO3 + KOH (изб.) Б) KHSO3 + KOH В) SO2(изб.) + KOH Г) P2O5 + KOH (изб.) | 1) K2SO3 2) K2SO3 + H2O 3) K2SO4 + H2O 4) KHSO3 5) K3PO4 + H2O 6) K2HPO4 + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
9. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NaNO3
2) Mg(OH)2
3) Mg(NO3)2
4) Cu(NO3)2
5) KNO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
10. Установите соответствие между классом/группой органических веществ и веществом, которое принадлежит к этому(-ой) классу/группе: к каждой
| КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | ВЕЩЕСТВО |
| А) CnH2n-6 Б) CnH2n-2 В) CnH2n-8 | 1) стирол 2) дивинил 3) циклогексан 4) толуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
11. Из предложенного перечня выберите два вещества, у которых отсутствуют 𝜋-связи.
1) пропаналь
2) 2-хлорпропан
3) ацетон
4) циклогексан
5) этен
Запишите номера выбранных ответов.
12. Из предложенного перечня выберите все вещества, которые вступают в реакцию с водородом.
1) 2-метилпропан
2) 2-хлорпропен
3) циклогексан
4) циклопропан
5) хлоропрен
Запишите номера выбранных ответов.
13. Из предложенного перечня выберите две реакции, в ходе которых образуется анилин.
1) хлорид фениламмония и гидроксид натрия
2) бензойная кислота и аммиак
3) бензол и азотная кислота
4) фенол и азотная кислота
5) восстановление нитробензола
Запишите номера выбранных ответов.
14. Установите соответствие между продуктом и веществом, из которого оно преимущественно получается по реакции гидробромирования: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОДУКТ | РЕАГИРУЮЩЕЕ ВЕЩЕСТВО |
| А) 2,2-дибромпропан Б) 2-бромпропан В) 1-бромпропан Г) 2-бромбутан | 1) бутин-1 2) бутен-2 3) пропин 4) циклопропан 5) пропен 6) циклобутан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
15. Установите соответствие между веществом и возможным способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | СПОСОБ ПОЛУЧЕНИЯ |
| 1) этен 2) этанол 3) уксусная кислота 4) этан 5) этаналь 6) пропан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
16. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами Х и Y.
1) бутанол-1
2) пропионат калия
3) бутаноат калия
4) пропановая кислота
5) бутановая кислота
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
17. Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие пропанола-1 и уксусной кислоты.
1) реакция гидролиза
2) реакция этерификации
3) каталитическая реакция
4) реакция нейтрализации
5) обратимая реакция
Запишите номера выбранных ответов.
18. Из предложенного перечня выберите схемы все факторы, ускоряющие скорость реакции гидрирование этилена:
1) повышение давления
2) повышение концентрации этана
3) добавление катализатора
4) повышение температуры
5) добавление ингибитора
Запишите номера выбранных ответов
19. Установите соответствие между уравнением реакции и свойством атома азота в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | СВОЙСТВО АТОМА АЗОТА |
| А) 4NO2 + O2 + 2H2O = 4HNO3 Б) Ca(OH)2 + 2HNO3 = Ca(NO3)2 + H2O В) N2 + 3H2 = 2NH3 | 1) не проявляет окислительно-восстановительных свойств 2) только восстановитель 3) и окислитель, и восстановитель 4) только окислитель |
Запишите в таблицу выбранные цифры под соответствующими буквами.
20.
Установите соответствие между солью и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.| СОЛЬ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) хлорид меди (II) Б) сульфат магния В) фторид натрия | 1) водород, галоген 2) металл, кислород 3) металл, галоген 4) водород, кислород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| Для выполнения задания 21 используйте следующие справочные данные. Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V). pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики |
21. Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) ацетат натрия
2) нитрат магния
3) хлорид бария
4) серная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
22. Установите соответствие между способом воздействия на равновесную систему
H2SO3(p-p) ↔ HSO3—(p-p) + H+(p-p) – Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) понижение температуры Б) повышение давление В) добавление гидросульфита натрия Г) добавление гидроксида натрия | 1) смещается в сторону прямой реакции 2) смещается в сторону обратной реакции 3) практически не смещается |
Запишите в таблицу выбранные цифры под соответствующими буквами.
23. В реактор постоянного объема поместили метан и пары воды. При этом исходная концентрация метана составила 2,8 моль\л. В результате протекания обратимой химической реакции:
СН4(г) + Н2О(г) ↔ СО(г) +ЗН2(г)
в системе установилось химическое равновесие, при котором равновесная концентрация метана и воды составила соответственно 2,0 моль\л и 2,2 моль\л. Используя данные, приведенные в таблице, определите равновесную концентрацию водорода (Х) и исходную концентрацию воды (Y).
Выберите из списка номера правильных ответов:
1) 1 моль/л
2) 2 моль/л
3) 2,4 моль/л
4) 3 моль/л
5) 3,6 моль/л
6) 4 моль/л
В ответ сначала запишите Х, затем Y.
24. Установите соответствие между реагирующими веществами и признаком(-ами) протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАГЕНТ |
| А) ацетилен и бромная вода Б) фенол и бромная вода В) пентен-1 и бромная вода Г) анилин и бромная вода | 1) выделение газа 2) образование осадка 3) без видимых признаков 4) только обесцвечивание раствора 5) обесцвечивание раствора и выпадение осадка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
25. Установите соответствие между областью применения и веществом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) СH4 Б) HC ≡ CH В) CH3COOH | 1) топливо в бытовых условиях 2) пищевая промышленность 3) производство полиэтилена 4) газовая сварка металлов |
Запишите в таблицу выбранные цифры под соответствующими буквами.
26. Сколько граммов 15% раствора необходимо добавить к 85 г раствору с массовой доли вещества 10%, чтобы получить 13% раствор? (Запишите число с точностью до десятых.)
27. Горение угля протекает в соответствии с термохимическим уравнением реакции
2NaOH(p-p) + H2SO2 (p-p) = Na2SO4 + 2H2O + 113,5 кДж.
Какую массу гидроксида натрия необходим взять для получения 568 кДж теплоты. (Запишите число с точностью до целых.)
28. Ацетальдегид массой 4,4 г прореагировал с аммиачным раствором оксида серебра. В ходе реакции было получено 19,44 г серебра. Вычислить выход
реакции. (Запишите число с точностью до целых.)
Для записи ответов на задания 29–34 используйте чистый лист бумаги. Запишите сначала номер задания (29, 30 и т.д.), а затем его подробное решение. Ответы записывайте чётко и разборчиво. Ответы записывайте чётко и разборчиво. |
| Для выполнения заданий 29 и 30 используйте следующий перечень веществ: пероксид натрия, йодид калия, нитрит калия, силикат калия, серная кислота, гидрокарбонат кальция. Допустимо использование водных растворов |
29. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми приводит к образованию газа и образованию окрашенного простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с
участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30. Из предложенного перечня выберите две соли, реакция ионного обмена между которыми сопровождается выпадением осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
31. Гидроксид калия прореагировал с раствором бромида железа (II). Полученная соль прореагировала с концентрированным раствором серной
Гидроксид калия прореагировал с раствором бромида железа (II). Полученная соль прореагировала с концентрированным раствором серной
кислоты. Полученное простое вещество разделили на две части. Первую часть добавили к раствору гидроксида калия и нагрели. Вторую часть
добавили к раствору, содержащему сульфит калия и гидроксид натрия. Напишите уравнения четырёх описанных реакций.
32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
33. При сгорании 1,52 г органического вещества А образуется 1,568 л (н.у.) углекислого газа, 1,06 г карбонат натрия и 0,9 г воды . Известно, что вещество А взаимодействует с 2-хлор-2-метилпропаном с образованием алкина.
1. Проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного вещества А.
2. Составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле.
3. Напишите уравнение реакции вещества А с 2-хлор-2-метилпропаном, используя структурную формулу вещества.
34. Смесь меди и оксида меди (I) массой 42,4 г растворили в 460 г растворе концентрированной серной кислоты. Атомы меди в оксиде меди (I) отдали в 2,5 раза больше электронов, чем атомы металлической меди. (Образованием кислых солей пренебречь). Определите массовую долю соли в итоговом растворе.
Ответы на досрочный вариант ЕГЭ по химии-2022
| № задания | Ответ | № задания | Ответ | № задания | Ответ |
| 1 | 13 | 11 | 15 | 21 | 2431 |
| 2 | 413 | 12 | 135 | 22 | 1123 |
| 3 | 13 | 13 | 15 | 23 | 32 |
| 4 | 14 | 14 | 5561 | 24 | 3414 |
| 5 | 746 | 15 | 4236 | 25 | 421 |
| 6 | 15 | 16 | 31 | 26 | 32 |
| 7 | 1352 | 17 | 134 | 27 | 54 |
| 8 | 2264 | 18 | 14 | 28 | 54 |
| 9 | 15 | 19 | 344 | ||
| 10 | 134 | 20 | 113 |
Понравилось это:
Нравится Загрузка. ..
..
Назовите соль, образующуюся при взаимодействии гидроксида магния [Mg(OH) 2 ] с разбавленной соляной кислотой [HCl]. Напишите химическое уравнение реакции. Какая кислота используется для получения сульфата магния?
Назовите соль, образующуюся при взаимодействии гидроксида магния [Mg(OH) 2 ] с разбавленной соляной кислотой [HCl]. Напишите химическое уравнение реакции. Какая кислота используется для получения сульфата магния?Book: Kerala Board Chemistry Part II
Глава: 5. Кислоты, щелочи и соли
Предмет: Химия — класс 9
thQ. № 3 Давайте оценим
Слушайте аудиокниги NCERT, чтобы повысить свою производительность и удержание в 2 раза.
3
Назовите соль, образующуюся в результате реакции между гидроксидом магния [Mg(OH) 2 ] и разбавленной соляной кислотой [HCl].
Напишите химическое уравнение реакции.
Какая кислота используется для получения сульфата магния?
• Название соли – хлорид магния [MgCl 2 ]
Гидроксид магния является сильным основанием [Mg(OH) 2 ], а соляная кислота [HCl] является сильной кислотой.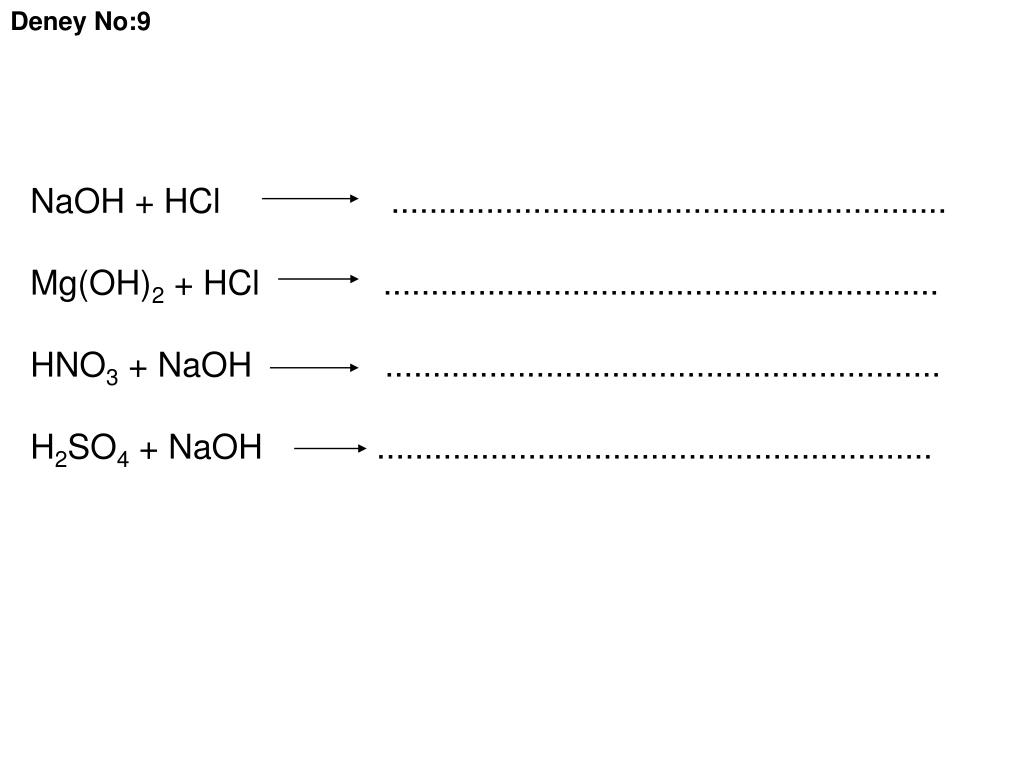 Когда основание и кислота реагируют, они взаимно сводят на нет свои свойства и приводят к образованию соли и воды. Такие реакции называются реакциями нейтрализации. Таким образом, гидроксид магния и соляная кислота будут реагировать с образованием соли и воды, и название этой соли — хлорид магния.
Когда основание и кислота реагируют, они взаимно сводят на нет свои свойства и приводят к образованию соли и воды. Такие реакции называются реакциями нейтрализации. Таким образом, гидроксид магния и соляная кислота будут реагировать с образованием соли и воды, и название этой соли — хлорид магния.
• Mg(OH) 2 + 2HCl → MgCl 2 + H 2 O
Реакция между гидроксидом магния и соляной кислотой представляет собой реакцию нейтрализации, в которой кислота и основание реагируют с образованием соли и воды. Таким образом, один моль гидроксида магния реагирует с двумя молями соляной кислоты с образованием хлорида магния (соли) и воды.
• Серная кислота [H 2 SO 4 ] используется для получения сульфата магния.
Химическая формула сульфата магния: [MgSO 4 ]. Из его формулы мы можем сделать вывод, что для его приготовления нам требуется основание, которое может дать нам ион магния, и кислота, которая может дать нам сульфат-ион. В данной задаче мы используем гидроксид магния в качестве основания, которое даст нам ион магния. Кислота, которая может дать нам ион сульфата, — это серная кислота. Получение [MgSO 4 ] можно представить следующим образом:
В данной задаче мы используем гидроксид магния в качестве основания, которое даст нам ион магния. Кислота, которая может дать нам ион сульфата, — это серная кислота. Получение [MgSO 4 ] можно представить следующим образом:
Mg(OH) 2 + H 2 SO 4 → MgSO 4 + H 2 O
13
Глава Упражнения
2
Определите символы ионов из рамки и напишите напротив их названия.
СО 3 2–, № 3 — , HCO 3 — , OH — , CO 3 2–, HSO 4 —
, CARSO 4 — 32............. —Сульфит —
Нитрат —
Гидроксид —
Бикарбонат —
Молоко магнезии, взвесь Mg(OH)2 в воде, реагирует с кислотой желудка (HCl) в реакции нейтрализации.
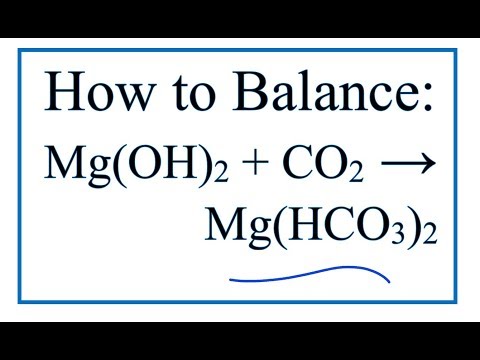 Mg(OH)2(т) + 2 HCl(водн.) −→ 2 h3O(л) + MgCl2(водн.)
Mg(OH)2(т) + 2 HCl(водн.) −→ 2 h3O(л) + MgCl2(водн.)Химия
Хилари Л.
спросил 19.04.21а) Какая масса MgCl2 образуется при реакции 6,99 г Mg(OH)2? Ответ в единицах g.
б) Какая масса HCl потребуется для полной реакции с 6,99 г Mg(OH)2? Ответ в единицах g.
Подписаться І 2
Подробнее
Отчет
2 ответа от опытных наставников
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Аноним А. ответил 20.04.21
Репетитор
Новое в Византе
Магистр биологии со второстепенным знанием химии — 33 года преподавания химии HS
См. таких репетиторов
Смотрите таких репетиторов
У вас есть сбалансированное уравнение, так что это хорошее начало. Сбалансированные коэффициенты уравнения говорят вам моли каждого. 1 Mg(OH)2=2 HCl=2 h3O=1 MgCl2.
Сбалансированные коэффициенты уравнения говорят вам моли каждого. 1 Mg(OH)2=2 HCl=2 h3O=1 MgCl2.
Первый шаг заключается в преобразовании граммов Mg(OH)2 в моли.
Грамм x 1 моль/молекулярная масса г. 6,99 г Mg(OH)2 x 1 моль/___ г. = ____ моль Mg(OH)2
Посмотрите, как граммы компенсируют оставшиеся моли.
__ молей Mg(OH)2 x (1 моль MgCl2/1 моль Mg(OH)2) Это из сбалансированного уравнения.
Часть HCl будет решена с использованием преобразования (2 моль HCl/1 моль Mg(OH)2) вместо Снова из сбалансированного уравнения. Затем переведите моли в граммы
.Голосовать за 0 Понизить
Подробнее
Отчет
Стэнтон Д. ответил 20.04.21
Репетитор
4.6 (42)
Репетитор, который пробудит ваш интерес к наукам
Смотрите таких репетиторов
Смотрите таких репетиторов
Да ладно, Хилари, это 5 вопросов по одному и тому же материалу. Сначала сбалансируйте уравнение, конвертируйте любые дайты в моли, переносите реагенты в продукты в соответствии со стехиометрией, конвертируйте обратно в единицы массы и т. д. по мере необходимости.
Сначала сбалансируйте уравнение, конвертируйте любые дайты в моли, переносите реагенты в продукты в соответствии со стехиометрией, конвертируйте обратно в единицы массы и т. д. по мере необходимости.
Дальнейшие вопросы будут спамом!
— г-н д.
Голосовать за 0 Понизить
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн.

