Фосфор и его соединения
Фосфор (P) — открыт алхимиком Х. Брандом в 1669 году. В свободном состоянии в природе не встречается.
Электронная конфигурация 1S22S22P63S23P3
Важнейшие аллотропные модификации
Белый фосфор. Получается при конденсации паров. Состоит из молекул P4. Мягкое, бесцветное вещество, ядовит, имеет чесночный запах, t°пл.= 44°С, t°кип.= 280°С, растворим в сероуглероде (CS2), летуч. Очень реакционноспособен, окисляется на воздухе (при этом самовоспламеняется), в темноте светится.
Красный фосфор. Без запаха, цвет красно-бурый, не ядовит. Атомная кристаллическая решётка очень сложная, обычно аморфен. Нерастворим в воде и в органических растворителях. Устойчив. В темноте не светится. Физические свойства зависят от способа получения.
Чёрный фосфор — полимерное вещество с металлическим блеском, похож на графит, без запаха, жирный на ощупь. Нерастворим в воде и в органических растворителях. Атомная кристаллическая решётка, полупроводник. t°кип.= 453°С (возгонка), t°пл.= 1000°C (при p=1,8 • 109 Па), устойчив.
t°кип.= 453°С (возгонка), t°пл.= 1000°C (при p=1,8 • 109 Па), устойчив.
Получение
Красный и черный фосфор получают из белого. Белый фосфор получают восстановлением фосфата кальция (сплавление в электрической печи):
Ca3(PO4)2 + 3SiO2 + 5C –t°® 3CaSiO3 + 5CO + 2P
Химические свойства.
1. Реакции с кислородом:
4P0 + 5O2 –t°® 2P2+5O5
(при недостатке кислорода: 4P0 + 3O2 –t°® 2P2+3O3)
2. С галогенами и серой:
2P + 3Cl2 ® 2PCl3
2P + 5Cl2 ® 2PCl5
2P + 5S –t°® P2S5
(галогениды фосфора легко разлагаются водой, например:
PCl3 + 3h3O ® h4PO3 + 3HCl
PCl5 + 4h3O ® h4PO4 + 5HCl)
3. С азотной кислотой:
3P0 + 5HN+5O3 + 2h3O ® 3h4P+5O4 + 5N+2O
4. С металлами образует фосфиды, в которых фосфор проявляет степень окисления — 3:
2P0 + 3Mg ® Mg3P2-3
(фосфид магния легко разлагается водой
Mg3P2 + 6h3O ® 3Mg(OH)2 + 2Ph4(фосфин))
3Li + P ® Li3P-3
5. Со щелочью:
Со щелочью:
4P + 3NaOH + 3h3O ® Ph4 + 3Nah3PO2
В реакциях (1,2,3) — фосфор выступает как восстановитель, в реакции (4) — как окислитель; реакция (5) — пример реакции диспропорционирования.
Соединения фосфора
P-3h4 Фосфин – газ, с неприятным запахом тухлой рыбы, бесцветный, малорастворим в воде, нестоек, ядовит; t°пл.= -87,5°С, t°кип.= -134°С.
Получение
Фосфиды щелочных и щелочноземельных металлов разлагаются водой и кислотами с образованием фосфина:
Ca3P2 + 6HCl ® 3CaCl2 + 2Ph4
Ca3P2-3 + 6h3O ® 3Ca(OH)2+ 2P-3h4
Химические свойства.
1) Разлагается при нагревании:
2Ph4 –t°® 2P + 3h3
2) Проявляет слабые основные свойства:
Ph4 + HI ® [Ph5]+I-
йодистый фосфоний менее устойчивый, чем соли аммония.
3) Сильный восстановитель. На воздухе самовоспламеняется.
P2+3 O3 Фосфористый ангидрид (оксид фосфора (III)).
Белые кристаллы, t°пл.= 24°С; t°кип.= 175°C. Существует в виде нескольких модификаций. В парах состоит из молекул P4O6. P2O3 соответствует фосфористая кислота h4PO3.
Получение
Окисление фосфора при недостатке кислорода
4P + 3O2 ® 2P2O3
Химические свойства
1. Все свойства кислотных оксидов.
P2O3 + 3h3O ® 2h4PO3
2. Сильный восстановитель
O2+ P2+3O3 ® P2+5O5
P2+5O5 Фосфорный ангидрид (оксид фосфора (V)).
Белые кристаллы, t°пл.= 570°С, t°кип.= 600°C, r = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4h20, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
4P + 5O2 ® 2P2O5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1)
P2O5 + h3O ® 2HPO3(метафосфорная кислота)
P2O5 + 2h3O ® h5P2O7(пирофосфорная кислота)
P2O5 + 3h3O ® 2h4PO4(ортофосфорная кислота)
2)
P2O5 + 3BaO ® Ba3(PO4)2
3)
P2O5 + 6KOH ® 2K3PO4+ 3h3O
P2O5 — сильное водоотнимающее средство:
4)
P2O5+ 2HNO3 ® 2HPO3 + N2O5
P2O5+ 2HClO4 ® 2HPO3+ Cl2O7
HP+5O3 Метафосфорная кислота.
Получение
P2O5+ h3O ® 2HPO3
Соли метафосфорной кислоты — метафосфаты (KPO3 – метафосфат калия)
Химические свойства
Характерны все свойства кислот.
h4P+5O3 Фосфористая кислота
Бесцветное кристаллическое вещество; t°пл.= 74°С, хорошо растворимое в воде.
Получение
PCl3+ 3h3O ® h4PO3+ 3HCl
Химические свойства
1) Водный раствор h4PO3 — двухосновная кислота средней силы (соли – фосфиты):
h4PO3+ 2NaOH ® Na2HPO3+ 2h3O
2) При нагревании происходит превращение в ортофосфорную кислоту и фосфин:
4h4PO3 ® 3h4PO4+ Ph4
3) Восстановительные свойства:
h4PO3+ HgCl2+ h3O ® h4PO4+ Hg + 2HCl
h4P+5O4 Ортофосфорная кислота.
Белое твердое вещество, гигроскопичное, хорошо растворимое в воде; t°пл.= 42°С, r = 1,88 г/см3.
Диссоциация:
h4PO4 « 3H+ + PO4-3
h4PO4+ 3h3O « 3h4O+ + PO43-
h4PO4 « H+ + h3PO4-
h3PO4- « H+ + HPO42-
HPO42- « H+ + PO43-
Ортофосфорная кислота — средней силы, не является окислителем, трехосновная. Она образует средние соли — ортофосфаты (Na3PO4) и два типа кислых солей — дигидрофосфаты (Nah3PO4) и гидрофосфаты (Na2HPO4).
Она образует средние соли — ортофосфаты (Na3PO4) и два типа кислых солей — дигидрофосфаты (Nah3PO4) и гидрофосфаты (Na2HPO4).
Получение
1)
P2O5+ 3h3O ® 2h4PO4
Промышленный способ:
2)
Ca3(PO4)2(твердый) + 3h3SO4(конц.) ® 2h4PO4+ 3CaSO4¯
3)
3P + 5HNO3+ 2h3O ® 3h4PO4+ 5NO
Химические свойства
Для ортофосфорной кислоты характерны все свойства кислот – неокислителей. При нагревании она превращается в пирофосфорную кислоту.
2h4PO4 –t°® h5P2O7 + h3O
Качественная реакция на обнаружение в растворе анионов PO43-
3Ag+ + PO43- ® Ag3PO4¯(ярко-желтый осадок)
Фосфорные удобрения
Фосфорными удобрениями являются кальциевые и аммонийные соли фосфорной кислоты.
Фосфоритная мука
Получают при тонком размоле фосфоритов. Так как она содержит нерастворимую соль Ca3(PO4)2, то усваиваться растениями может только на кислых почвах.
При обработке фосфоритов или аппатитов серной или фосфорной кислотой получают растворимые в воде соединения, хорошо усваемые растениями на любых почвах:
Ca3(PO4)2 + 2h3SO4 ® Ca(h3PO4)2 + 2CaSO4
(Ca(h3PO4)2 простой суперфосфат (обычно применяют в виде гранул Æ 2-4 мм))
Ca3(PO4)2 + 4h4PO4 ® 3Ca(h3PO4)2(двойной суперфосфат)
Нейтрализацией гашеной извести фосфорной кислотой получают преципитат:
h4PO4 + Ca(OH)2 ® CaHPO4 • 2h3O
Нейтрализацией фосфорной кислоты аммиаком получают аммофос – (Nh5)2HPO4 + Nh5h3PO4, содержащий N и P. Разновидности: нитроаммофос – Nh5h3PO4 + Nh5NO3; аммофоска – (Nh5)2HPO4 + Nh5h3PO4 + KCl.
Презентация на тему «Бинарные соединения»
#8 класс #Химия #Учебно-методические материалы #Презентация #Учитель-предметник #Школьное образование
ДЕВИЗ УРОКА : ДЕВИЗ УРОКА : УЗНАТЬ СМОТРЕТЬ ПРОБОВАТЬ ЕСТЕСТВЕННО ХОТЕТЬ
Закончите предложения:
Степень окисления (СО) простых веществ равна ____ . Сумма СО всех входящих в её состав атомов элементов равна ____ .
СО Ме всегда имеет _______________ значение.
Постоянную СО имеют элементы _____ групп главных подгрупп – определяется по ____________ .
СО фтора во всех соединениях равна ___ .
СО водорода — ___, искл. ___________ , где СО водорода равна ___ .
СО кислорода — ___, искл. _________ , где СО кислорода равна ___ .
СО остальных элементов имеет ______________ значение.
Высшая СО элемента определяется по ______________.
Низшая — _______________________.
Сумма СО всех входящих в её состав атомов элементов равна ____ .
СО Ме всегда имеет _______________ значение.
Постоянную СО имеют элементы _____ групп главных подгрупп – определяется по ____________ .
СО фтора во всех соединениях равна ___ .
СО водорода — ___, искл. ___________ , где СО водорода равна ___ .
СО кислорода — ___, искл. _________ , где СО кислорода равна ___ .
СО остальных элементов имеет ______________ значение.
Высшая СО элемента определяется по ______________.
Низшая — _______________________.
Определите степени окисления атомов элементов в сложных веществах, назовите эти вещества: 1 вариант 2 вариант Mg3P2 – Ca2Si – SiC – CuI2 – NF3 – Fe2O3 – Li3N – NaCl –
№ 1 № 2 № 3
Она и дождь, и град, и снег,
Туман и гололед,
Носитель благ, предвестник бед —
И радуга, и лед. Фалес Милетский
Фалес Милетский
№ 3 Песок
Н2О SiO2 CO2
БИНАРНЫЕ СОЕДИНЕНИЯ Учитель химии МОУ «СОШ №32» г. о. Саранск Нуянзина М.И.
ОКСИДЫ – ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ ДВУХ ЭЛЕМЕНТОВ, ОДНИМ ИЗ КОТОРЫХ ЯВЛЯЕТСЯ КИСЛОРОД СО СТЕПЕНЬЮ ОКИСЛЕНИЯ -2. ОКСИДЫ – ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ ДВУХ ЭЛЕМЕНТОВ, ОДНИМ ИЗ КОТОРЫХ ЯВЛЯЕТСЯ КИСЛОРОД СО СТЕПЕНЬЮ ОКИСЛЕНИЯ -2.
ИЗ ПРЕДЛОЖЕННЫХ ВЕЩЕСТВ ВЫБЕРИТЕ ОКСИДЫ И НАЗОВИТЕ ИХ NO2, CaSO4, Bа(OH)2, NaCl, SO3, KNO3, Li2O, MgO, h3S
NO2 – ОКСИД АЗОТА (IV) NO2 – ОКСИД АЗОТА (IV) SO3 – ОКСИД СЕРЫ (VI) Li2O – ОКСИД ЛИТИЯ MgO — ОКСИД МАГНИЯ
КЛАССИФИКАЦИЯ ОКСИДОВ ОКСИДЫ ОСНОВНЫЕ КИСЛОТНЫЕ (ОКСИДЫ МЕТАЛЛОВ) (ОКСИДЫ НЕМЕТАЛЛОВ) Li2O, MgO NO2, SO3
СДЕЛАЙТЕ ВЫВОДЫ О ФИЗИЧЕСКИХ СВОЙСТВАХ ОКСИДОВ. СДЕЛАЙТЕ ВЫВОДЫ О ФИЗИЧЕСКИХ СВОЙСТВАХ ОКСИДОВ.
ШИРОКА НАТУРА У ОКСИДОВ, МОЖЕТ ЧЕРНЫМ БЫТЬ, И БЕЛЫМ,
КАМНЕМ ВНИЗ, А ТО РЕКОЙ ТЕЧЕТ, МОЖЕТ С ЗАПАХОМ И БЕЗ,
А ЗАХОЧЕТ — ГАЗ РАЗЛИЧНЫХ ВИДОВ, НЕ ОСТАВИТ ВАС БЕЗ ДЕЛА:
И ВЕЩЕСТВ СОЗДАСТ КРУГОВОРОТ. «ИЗУЧАЙТЕ — МИР ЧУДЕС!»
СДЕЛАЙТЕ ВЫВОДЫ О ФИЗИЧЕСКИХ СВОЙСТВАХ ОКСИДОВ.
ШИРОКА НАТУРА У ОКСИДОВ, МОЖЕТ ЧЕРНЫМ БЫТЬ, И БЕЛЫМ,
КАМНЕМ ВНИЗ, А ТО РЕКОЙ ТЕЧЕТ, МОЖЕТ С ЗАПАХОМ И БЕЗ,
А ЗАХОЧЕТ — ГАЗ РАЗЛИЧНЫХ ВИДОВ, НЕ ОСТАВИТ ВАС БЕЗ ДЕЛА:
И ВЕЩЕСТВ СОЗДАСТ КРУГОВОРОТ. «ИЗУЧАЙТЕ — МИР ЧУДЕС!»
Чем сходны данные соединения? NaH, h4N, HCl, Mgh3, Sih5, h3S, Bah3, KH
КЛАССИФИКАЦИЯ ВОДОРОДНЫХ СОЕДИНЕНИЙ ВОДОРОДНЫЕ СОЕДИНЕНИЯ МЕТАЛЛОВ НЕМЕТАЛЛОВ NaH, Mgh3, h4N, HCl, Bah3, KH Sih5, h3S
ГИДРИДЫ МЕТАЛЛОВ Гидриды металлов – твердые, нелетучие, тугоплавкие вещества.
ГИДРИДЫ НЕМЕТАЛЛОВ
ЗАПИШИТЕ ФОРМУЛЫ ТЕХ ОКСИДОВ, КОТОРЫЕ ВСТРЕЧАЮТСЯ В РАССКАЗЕ:
В ЗЕМНОЙ КОРЕ – ЛИТОСФЕРЕ НАХОДЯТСЯ ГЛИНА, В ЕЁ СОСТАВ ВХОДИТ ОКСИД АЛЮМИНИЯ ___1__ , ОКСИД КРЕМНИЯ (IV) __2___ (ПЕСОК), ОКСИД ЖЕЛЕЗА (III) __3__ (СОДЕРЖИТСЯ В КРАСНОМ ЖЕЛЕЗНЯКЕ). ВОДНАЯ ОБОЛОЧКА ЗЕМЛИ – ГИДРОСФЕРА – ЭТО ОКСИД ВОДОРОДА ___4__. В ВОЗДУХЕ ЕСТЬ ОКСИД УГЛЕРОДА (IV) __5__ (УГЛЕКИСЛЫЙ ГАЗ).
В РЕЗУЛЬТАТЕ ХОЗЯЙСТВЕННОЙ ДЕЯТЕЛЬНОСТИ ЧЕЛОВЕКА ОБРАЗУЮТСЯ ВЕЩЕСТВА, ЗАГРЯЗНЯЮЩИЕ АТМОСФЕРУ: ОКСИД УГЛЕРОДА (II) ____6____ (УГАРНЫЙ ГАЗ), ОКСИД СЕРЫ (IV) _____7____ (СЕРНИСТЫЙ ГАЗ), ОКСИД АЗОТА (II) ____8___ И ОКСИД АЗОТА (IV) ___9__.
ВОДНАЯ ОБОЛОЧКА ЗЕМЛИ – ГИДРОСФЕРА – ЭТО ОКСИД ВОДОРОДА ___4__. В ВОЗДУХЕ ЕСТЬ ОКСИД УГЛЕРОДА (IV) __5__ (УГЛЕКИСЛЫЙ ГАЗ).
В РЕЗУЛЬТАТЕ ХОЗЯЙСТВЕННОЙ ДЕЯТЕЛЬНОСТИ ЧЕЛОВЕКА ОБРАЗУЮТСЯ ВЕЩЕСТВА, ЗАГРЯЗНЯЮЩИЕ АТМОСФЕРУ: ОКСИД УГЛЕРОДА (II) ____6____ (УГАРНЫЙ ГАЗ), ОКСИД СЕРЫ (IV) _____7____ (СЕРНИСТЫЙ ГАЗ), ОКСИД АЗОТА (II) ____8___ И ОКСИД АЗОТА (IV) ___9__.
Лежу на берегу, вокруг одни оксиды, Куда не погляжу – прекраснейшие виды: Песочек – пляж, вода морская, А с моря бриз. Волна крутая. И воздух… дышится легко, Вода – парное молоко. Забудешь беды и обиды… А все же… где же здесь оксиды?!
Что, как сбалансировать и часто задаваемые вопросы —
Вишнуприя Тадури
Фосфид магния (Mg 3 P 2 ) представляет собой соль, состоящую из трех металлов Mg и двух неметаллов P. Бромоводород (HBr) — сильная кислота. Рассмотрим реакцию HBr и Mg 3 P 2 .
Фосфид магния представляет собой белое кристаллическое кубическое твердое вещество. Воспламеняется при контакте с воздухом и интенсивно реагирует с водой. Это сильный восстановитель, который в основном используется в качестве фумиганта в сельском хозяйстве. HBr — острая кислота и сильный окислитель, используемый в производстве броморганических соединений.
Воспламеняется при контакте с воздухом и интенсивно реагирует с водой. Это сильный восстановитель, который в основном используется в качестве фумиганта в сельском хозяйстве. HBr — острая кислота и сильный окислитель, используемый в производстве броморганических соединений.
В этой статье мы обсуждаем различные факты и часто задаваемые вопросы о HBr + Mg продукт HBr и Mg 3 P 2 ?
HBr реагирует с фосфидом магния с образованием бромида магния (MgBr 2 ) вместе с выделением газа фосфина (PH 3 ).
6HBr + Mg 3 P 2 —> 3MgBr 2 + 2PH 3
Какой тип реакции HBr + Mg
3 0 6 P 900?Реакция HBr + Mg 3 P 2 является примером реакции двойного замещения, также известной как реакция метатезиса солей .
Как сбалансировать HBr + Mg
3 P 2 ?Шаги для балансировки HBr + Mg 3 P 2 следующим образом –
- Присвойте алфавит каждому соединению в реагенте и продукте, чтобы представить неизвестные коэффициенты.

- а HBr + b Mg 3 P 2 —– > c MgBr 2 + d PH 3 90 составить все уравнение коэффициенты каждого элемента, участвующего в реакция.
- H → a=3d, Br → a=2c, Mg → 3b=c, P → 2b=d
- Примените метод исключения Гаусса для определения значений каждого назначенного коэффициента.
- Значение коэффициентов, полученных после упрощения, равно a= 6, b=1, c=3, d=2.
- Общее сбалансированное уравнение: 0018
HBr + Mg
3 P 2 титрованиеHBr + Mg 3 P 2 титрования обычно избегают, так как их токсическая реакция протекает энергично 18 фосфиновый газ.
HBr + Mg
3 P 2 результирующее ионное уравнениерезультирующее ионное уравнение между HBr+ Mg 3 P равно 2:9005 3 P 0018
6H + (водный) + Мг 3 P 2 (s) = 3Mg 2+ (водн. ) + PH 3 (g)
) + PH 3 (g)
Итоговое ионное уравнение выводится с помощью следующих шагов: 0096 Запись сбалансированное уравнение, указывающее физические состояния каждой молекулы.
- HBr представляет собой сильную кислоту с Br – в качестве сопряженного основания.

- Сопряженной пары Mg 3 P 2 нет, так как чувствителен к влаге.
HBr + Mg
3 P 2 межмолекулярные силы- Диполь-дипольные взаимодействия в основном существуют в HBr из-за огромной электроотрицательной разницы между атомом брома и водорода. Другими межмолекулярными силами, действующими в HBr, являются дисперсионные силы Лондона и сила Вандер-Ваала.
- Ионная связь наблюдается в Mg 3 P 2 , так как она состоит из металла и неметалла. Mg 3 P 2 представляет собой бинарное ионное соединение.
HBr + Mg
3 P 2 энтальпия реакцииHBr + Mg 3 P 2 энтальпия реакции 4 составляет -399 кДж/моль. Значения энтальпии образования приведены ниже –
| Реагенты и продукты | Энтальпия в кДж/моль |
|---|---|
| HBr | -35,66 |
Mg 4 06 P 26 P 2 | |
| MgBr 2 | -524 |
| PH 3 | +9 |
- ∆H f ° ∆H f ° 005 ф ° (продукты) – ∆H ф ° (реагенты)
= -515 – (-115,66)
= -399,34 кДж/моль
Is HBr + Mg 9 0900 P
3 3 06 буферный раствор? HBr + Mg 3 P 2 не является буферным раствором, так как HBr является сильной кислотой, а Mg 3 P 2 является неорганической солью, которая не может ни образовывать буферный раствор, ни поддерживать pH уровень других решений.
Is HBr + Mg
3 P 2 полная реакция?HBr + Mg 3 P 2 является полной реакцией, так как вместе с газообразным фосфином образуется водорастворимая соль бромида магния.
Является ли HBr + Mg
3 P 2 экзотермической реакцией?HBr + Mg 3 P 2 является экзотермической реакцией, при которой выделяется огромное количество тепла вместе с выделением газообразного фосфина.
HBr + Mg
3 P 2 окислительно-восстановительная реакция? HBr + Mg 3 P 2 не является окислительно-восстановительной реакцией , поскольку в ходе реакции не происходит переноса электронов. Более того, в реакции HBr + Mg 3 P 2 не происходит изменения степени окисления ни одного элемента; таким образом, это не окислительно-восстановительная реакция.
Является ли HBr + Mg
3 P 2 реакцией осаждения?HBr + Mg 3 P 2 не является реакцией осаждения, поскольку продукт (MgBr 2 ), образующийся в ходе химической реакции, представляет собой электрически нейтральную соль, растворимую в воде.
Является ли HBr + Mg
3 P 2 необратимой реакцией?HBr + Mg 3 P 2 является необратимой реакцией, поскольку реакция никогда не может достичь равновесия из-за выделения газообразного фосфина.
Является ли HBr + Mg
3 P 2 реакцией замещения? HBr + Mg 3 P 2 представляет собой реакцию двойного замещения, поскольку более реакционноспособный магний вытесняет водород из HBr, а H соединяется с неметаллом P с образованием PH 3 .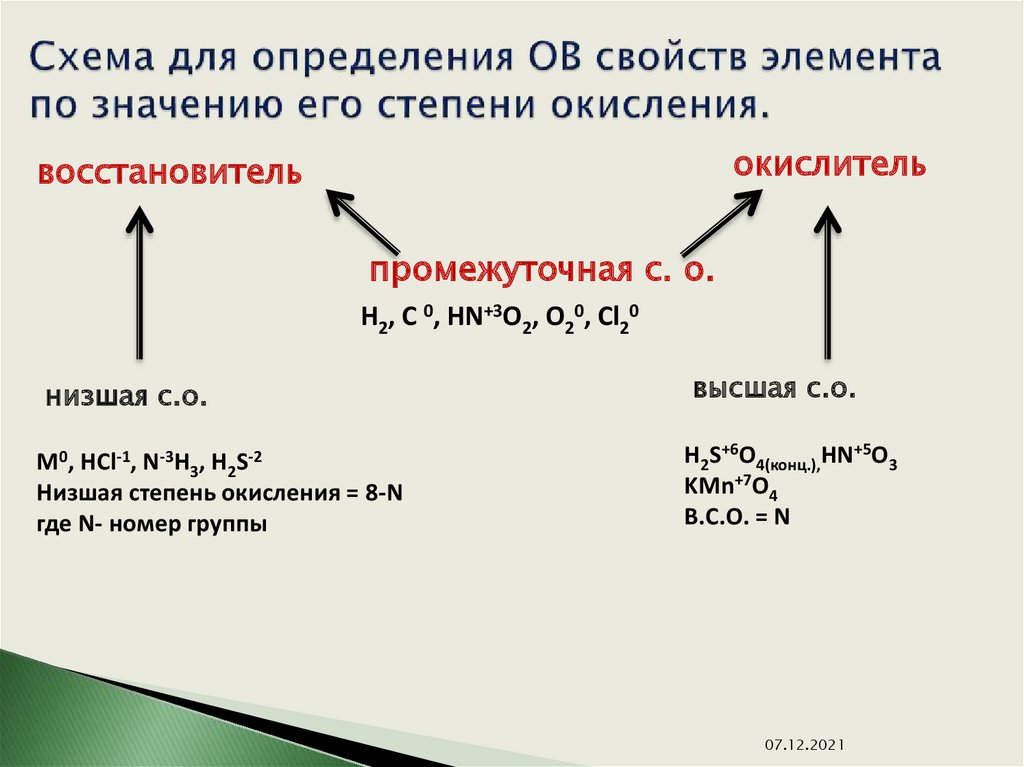
Двойная реакция замещения Заключение
Фосфид магния представляет собой бинарную соль щелочного металла, слабо растворимую в кислотах. MgBr 2 , образующийся в этой реакции, в основном используется в качестве транквилизатора и катализатора в синтезе органических соединений. PH 3 используется для фумигации продовольственного зерна.
Mg(3)P(2) при гидролизе образует
- Курс
- NCERT
- Класс 12
- Класс 11
- Класс 10
- Класс 9
- Класс 7
- Класс 6
- IIT JEE
- NCERT
- Экзамен
- JEE MAINS
- JEE ADVANCED
- X BOARDS
- XII BOARDS
- NEET
- Neet Предыдущий год (по годам)
- Физика Предыдущий год 9
- Биология Предыдущий год
- Нет Все образцы документов
- Примеры работ по биологии
- Примеры работ по физике
- Примеры работ по химии
- Скачать PDF-файлы
- Класс 12
- Класс 11
- Класс 10
- Класс 9
- Класс 8
- Класс 7
- Класс 6
- Угол экзамена 95
- Онлайн-класс
- Викторина
- Задать вопрос WhatsApp
- Поиск Doubtnut
- Английский словарь
- Обсуждение Toppers
- Блог 909958 О нас
- Карьера
- Скачать
- Получить приложение
Вопрос
Обновлено: 29. 11.2019 МЕНЦ-Задание (Раздел-J)
11.2019 МЕНЦ-Задание (Раздел-J)
РЕКЛАМА
Текст Решение
Проверено экспертами
Правильный ответ:
A, C
Был ли этот ответ полезен?
74
Ab Padhai каро бина объявления ке
Khareedo DN Про и дехо сари видео бина киси объявление ки рукаават ке!
Похожие видео
Степень окисления P в Mg2P2O7 равна
11032647
01:09
Что из следующего получается при гидролизе Mg_(2)C_(3) ?
12676546
01:18
Моль углеводорода, полученного при гидролизе 1 моля Mg_(2)C_(3) (карбида магния)
18238887
01:10
3
18239019
02:52
Нет соединений, образующих газ при гидролизе (с H_(2)O ), Al_(4)C_(3),BaC_(2),Mg_(2)C_(3),SiC,B_(2 )H_(6),Fe_(3)C
33102524
Текст Решение
Масса Mg_(3)N_(2), полученного при взаимодействии 48 г металла с 34 г газа NH_(3), равна Mg + NH_(3) в Mg_(3)N_(2) ) + H_(2)
34125068
Text Solution
Степень окисления P в Mg2P2O7 равна
60007105
01:09
Mg2P2O7 Номер телефона:
94847455
04:56
Если 0,1 г соединения орана, содержащего фосфор, дает 0,222 г Mg_(2)P_(2)O_(7), то процент фосфора, присутствующего в соединении, равен
112987659
02:34
Реакция борида магния (Mg_(3)B_(2)) с раствором кислоты дает
233489486
01:03
902g2 органическое соединение Mg2 Р2О7. Каково процентное содержание фосфора в соединении? (P=31) (Молярная масса Mg2P2O7=222 г)
Каково процентное содержание фосфора в соединении? (P=31) (Молярная масса Mg2P2O7=222 г)642795674
Текстовый раствор
0,12 г органического соединения дает 0,22 г Mg_(2)P_(2)O_(7) . Каково процентное содержание фосфора в соединении? (P= 31) (Молярная масса Mg_(2)P_(2)O_(7)= 222 г)
642811402
Text Solution
Щелочной гидролиз P_(4) с NaOH дает
643885275
Text Solution
Степень окисления P в Mg_(2_P0O7)03 равна (2) 2 644116555
01:14
Mg3P2 при гидролизе дает
644350680
01:47
РЕКЛАМА
- 90 CK ELEMENTS-Назначение (Раздел-J)
Верно из следующего
03:12
В ячейке Кастнера-Келинера при электролизе рассола 23 г натрия р… к продукту. Продукт будет
00:57
Какой из хлоридов наименее растворим в воде?
03:08
Порядок энтальпии решетки такой же, как
01:57
0003
01:25
Щелочноземельные металлы в жидк.




