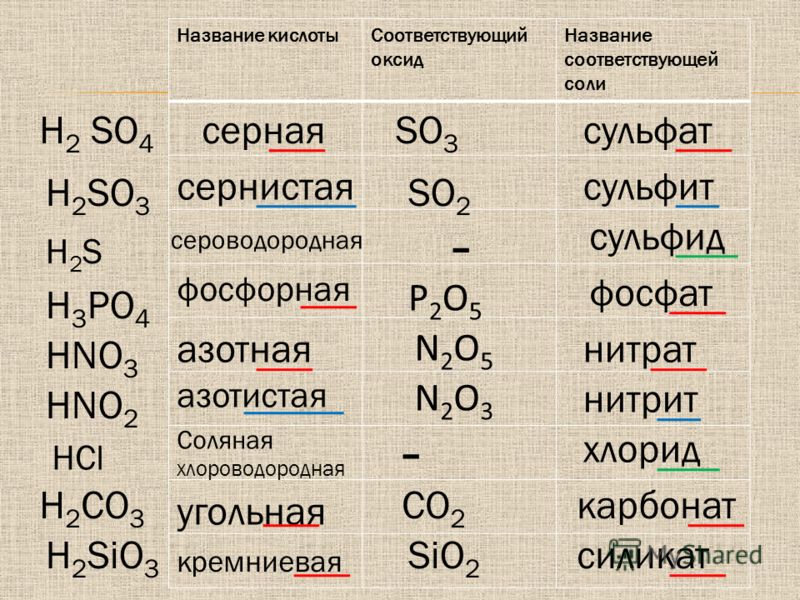
Тема | Закон постоянства состава веществ. Химические формулы. Относительная молекулярная масса | |||
Тип урока | комбинированный | |||
Дидактическая цель | Обеспечить в ходе урока усвоение понятий: «масса молекулы», «относительная молекулярная масса», массовая доля элемента и формирование знаний о массе молекулы, как о ее количественной характеристики | |||
Воспитательная | формирование диалектико- материалистических представлений | |||
знания | Развиваемые: относительная атомная масса, относительная молекулярная масса | |||
умения | Развиваемые: определять относительную атомную массу по ПСХЭ, относительную молекулярную массу вещества, рассчитывать массовую долю элемента | |||
Лит-ра | Г. | |||
Этап урока | Содержание | t,мин | Деятельность учителя | Деятельность учащихся |
Организационный момент | Здравствуйте ребята! Приготовьтесь, пожалуйста, к уроку. Отметим отсутствующих….. | 2 | Приветствует учащихся, отмечает отсутвующих в журнале. | Приветствует учителя. |
Актуализация и коррекция знаний |
| 5 | Задает вопросы | Отвечают на вопросы учителя |
Целеполагание и мотивация | Тема урока: «Закон постоянства состава веществ. | 1 | Сообщает тему и цель урока. | Отвечают на вопросы. Пишут тему в тетради |
Используя химические знаки, индексы и коэффициенты, запишите обозначения двух молекул воды, трех молекул оксида азота (если известно, что в молекуле оксида азота на один атом азота приходится два атома кислорода),трех молекул сероводорода (в его молекуле на два атома водорода приходится один атом серы),четырех молекул оксида фосфора (в каждой молекуле этого оксида на два атома фосфора приходится пять атомов кислорода). | 10 | Объясняет задание. Вызывает к доске ученика | Выполняют самостоятельную работу. Работает один ученик на доске, остальные в тетради. Работа ют вместе с учителем | |
Восприятие и осознание нового материала | Пользуясь ПСХЭ, вычислите относительные молекулярные массы веществ. НСl Na2SO4 H2SO4 HNO3 KCl BaSO4 H2SO3 CaCO3 | 12 | Выполняют предложенные задания Записывают информацию | |
Массовая доля элемента(W) в сложном веществе равна отношению его массы в молекуле к молекулярной массе данного вещества W(Э)=Ar(Э)*n/ Mr(вещества), единицы измерения массовые доли или % | 5 | Выполняют предложенные задания Записывают информацию | ||
Обобщение и закрепление материала |
А)СО2 б) NaOHв)Н2О г)СаСО3 д)HNO3 | 7 | Первый пример разбирает вместе с вызванным учеником. | Выполняют предложенные задания |
Подведение итогов урока | Спасибо за работу на уроке, отметки сегодня получают… | 2 | Оценивает работу класса в целом и отдельных учеником. | Оценивают свою работу на уроке. |
Объяснение домашнего задания | А теперь откройте дневники, запишите домашнее задание… §9,10упр.4-9, 11-12 с.32 | 1 | Записывает Д/З на доске и объясняет его. | Записывают Д/З в дневник. |
Структура и характеристики Na2so4 Lewis: 17 полных фактов
Натриевая соль серной кислоты известна как сульфат натрия. Изучим некоторые факты о Структура Льюиса Na2so4.
Na2SO4 — это химическая формула сульфата натрия. Молекулярная масса безводного Na2SO4 составляет 322 г/моль, а молекулы декагидрата – 142 г/моль. Природные рассолы и кристаллические месторождения, найденные в Техасе и Калифорнии, используются для производства природного сульфата натрия.
Природные рассолы и кристаллические месторождения, найденные в Техасе и Калифорнии, используются для производства природного сульфата натрия.
Na2SO4 можно получить по методу Мангейма, реакция следующая: h3SO4 + 2NaCl → Na2SO4 + 2HCl. Ниже мы обсудим факты и характеристики структуры na2so4 lewis.
Как нарисовать структуру Льюиса na2so4?Структура Льюиса Na2so4 может быть представлена как простое электронное представление связей, электронных пар и валентных электронов. Вот шаги, которые необходимо выполнить.
Подсчет общего количества валентных электроновПодсчитайте все самые внешние электроны на валентных орбиталях атомов, присутствующих в Na2So4. Na имеет 1, S имеет 6, а O имеет шесть валентных электронов. Всего валентных электронов в структуре Льюиса na2so4 32.
Выбор центрального атомаСера занимает центр, потому что она менее электроотрицательна. Атом кислорода окружен серой. Ионы в структуре Льюиса na2so4 представляют собой SO4-2 и Na2+.
Ионы в структуре Льюиса na2so4 представляют собой SO4-2 и Na2+.
Прежде чем структура Льюиса будет окончательно построена, молекула представлена в электронном виде своей скелетной системой. Два электрона от Na до SO4-2 переносятся ионы. Рисунки Na и SO4-2 вместе с их соответствующим окружением валентных электронов.
Рисование окончательной структуры точек ЛьюисаСтруктура Льюиса Na2So4 имеет как ионную, так и ковалентную структуру. Итак, Na2+ и SO4-2 анионные и электровалентные связи, образованные ковалентными связями. Октет выполняется для Na2+ и SO4-2. Ниже представлена структура Na2so4 с точками Льюиса. .
.
Самые внешние электроны, которые слабо связаны с ядрами и принимают участие в формировании связей, известны как валентные электроны. Определим валентные электроны Na2so4.
- Структура Льюиса na2so4 содержит всего 32 валентных электрона.
- Каждый атом натрия имеет один электрон.
- Каждый атом кислорода включает в себя шесть, т. е. четыре атома кислорода обеспечивают 24 электрона.
- А атом серы имеет шесть валентных электронов.
- Всего валентных электронов =1*2+6*4+6=32.
Правило октета объясняет, что каждый атом должен заполнить 8 электронов в своей валентной оболочке, чтобы достичь стабильности ядро-оболочка. Давайте посмотрим, следует ли Na2So4 правилу октетов.
Структура Льюиса Na2So4 удовлетворяла правилу октетов. Это связано с электронной конфигурацией серы S= [Ne] 3s2,3p4. Когда мы расширяем это, мы получаем: S = [Ne]3s2, 3px2,3py1, 3pz1 и 3d0. Если мы разделим, мы получим, что d-орбитали остаются негибридными, что приводит к расширенным орбиталям.
Это связано с электронной конфигурацией серы S= [Ne] 3s2,3p4. Когда мы расширяем это, мы получаем: S = [Ne]3s2, 3px2,3py1, 3pz1 и 3d0. Если мы разделим, мы получим, что d-орбитали остаются негибридными, что приводит к расширенным орбиталям.
Формальный заряд — это заряд, который имела бы молекула, если бы электроны были равномерно распределены в каждом атоме. Выясним формальный заряд Na2so4.
Формальный заряд Na2SO4 = (Количество валентных электронов в свободном атоме элемента) – (Количество неподеленных электронов на атоме) –½ (Количество связей с атомом). Используя приведенную выше формулу, определите формальный заряд.
- Формальный заряд Na =1-0-1=0
- Формальный заряд на S =6-0-6=0
- Формальный заряд на 2О =6-0-6=0
- Общий формальный заряд равен нулю на na2so4 более стабилизированная структура.
Резонансная структура обычно демонстрирует делокализацию электронного облака в системе. Проанализируем резонансную структуру Na2so4.
Проанализируем резонансную структуру Na2so4.
В Na2so4 имеется шесть резонансных структур. Na2+ и SO4-2 ионы присутствуют в Na2so4, а SO4-2 имеет шесть резонансных конфигураций. Металл (Na+2) отдает свои электроны сульфатному аниону. SO4-2 формируется стабилизированная резонансная структура. На изображении ниже представлена резонансная структура Na2So4.
Структура резонанса Льюиса Na2SO4Валентный угол структуры Льюиса Na2so4Молекулярные валентные углы различаются в зависимости от угла, образованного между окружающими их атомами. Определим валентный угол Na2so4.
Валентный угол Na2So4 равен 109.5°. Структура na2so4 lewis состоит из двух ионных звеньев: Na+2 и SO4-2, причем сульфат-ион определяет угол.
Na2so4 форма структуры ЛьюисаМолекула структурирована, поэтому окружающие ее атомы не отталкивают центральный атом. Давайте посмотрим больше на форму Na2So4.
Давайте посмотрим больше на форму Na2So4.
Форма Na2so4 тетраэдрическая, потому что ионы сульфата (SO4-2) присутствуют. В Na2SO4, SO4-2 имеет тетраэдрическую форму с углом 109.5° для минимизации их сил отталкивания. Точно так же ионы [Na(Oh3)6]+ в кристаллах декагидратов имеют октаэдрическую молекулярную геометрию.
Важно отметить, что восемь из десяти молекул воды, присоединенных к этим октаэдрам, связаны с натрием, а две другие, междоузельные к сульфату, связаны водородными связями.
Na2so4 структуры Льюиса неподеленные парыСтруктура точек Льюиса описывает неподеленные пары, которые не участвуют в связывании во время гибридизации. Вычислим неподеленную пару Na2SO4.
В структуре Льюиса Na2So4 всего неподеленных пар = 32-12 = 20, т.е. 10 пар. Эти неподеленные пары присутствуют на атоме кислорода сульфат-ионов ( SO4-2). Однако ни один из валентных электронов не локализован, и все они участвуют в формировании частичных связей.
Однако ни один из валентных электронов не локализован, и все они участвуют в формировании частичных связей.
Гибридизация — это образование новых гибридных орбиталей путем смешивания орбиталей на одном энергетическом уровне в молекуле. Рассмотрим гибридизацию na2so4.
Гибридизации Na2so4 не происходит из-за его ионной природы. Но это sp3 из-за его SO4-2 ионы. Формула, которая используется для определения гибридизации, приведена ниже.
- H=1/2[V+X-C+A].
- Общее количество валентных электронов на центральном атоме серы(V) =6
- Количество одновалентных атомов натрия(X) =2
- Заряд катиона Na+2(C) =+2
- Заряд на анионе SO4-2(А) =-2
- H = 1/2[6 +2+2+(-2)].
- Гибридизация (H) = 4, что указывает на гибридизацию sp3 из-за SO.4-2.
Твердое состояние описывается, когда все молекулы в веществе плотно упакованы и имеют правильную форму. Давайте рассмотрим подробнее.
Давайте рассмотрим подробнее.
Na2SO4 представляет собой белое твердое вещество в виде кристаллов. Неорганический химикат, широко известный как сульфат соды, связан с несколькими гидратами. Минерал тенардит также известен как безводный сульфат, а декагидрат Na2SO4.10·2HXNUMXO также называют глауберовой солью или мирабилисом.
Как твердый na2so4?Важным компонентом натрия является сульфат натрия. Обсудим, почему Na2so4 находится в твердом состоянии.
Na2so4 представляет собой белое гигроскопичное твердое вещество для сухого порошкового химиката. Он имеет орторомбические бипирамидальные кристаллы в качестве кристаллической структуры. Частицы похожи на кристаллический порошок и представляют собой практически бесцветные или белые кристаллы.
Растворяется ли na2so4 в воде?Степень упаковки ионов влияет на энергию гидратации или скорость растворимости. Поясним подробнее.
Na2so4 наиболее растворим в воде и белых твердых веществах во всех формах.
- При 0 ℃ растворимость в воде составляет 4.76 г/100 г воды.
- При 25 ℃ растворимость в воде составляет 28.1 г/100 г воды.
Как правило, ионы щелочных металлов и сульфатные соли растворимы в воде. Посмотрим, растворим Na2so4 или нет.
Na2SO4 хорошо растворим в воде, так как na2sO4 включает ионы Na+ и сульфат-ионы. Na+ – ионы щелочных металлов, растворимые в воде, сульфат-ионы также растворимы в воде. В воде Na2so4 диссоциирует на ионы и образует водный раствор.
Является ли na2so4 молекулярным?Ионный или молекулярный характер можно определить, используя структуру и общие закономерности. Посмотрим ниже, является ли Na2so4 молекулярным или нет.
Будучи ионным соединением, na2so4 не является молекулярным. Поскольку натрий (Na+) и сульфат (SO4-2) ионы объединяются с образованием сульфата натрия. Два +1 иона натрия потребуются, чтобы уравновесить один ион ( SO4-2). В результате формула сульфата натрия станет Na2SO4.
В результате формула сульфата натрия станет Na2SO4.
В зависимости от ионов или атомов, которые они содержат, молекулы могут быть либо ионными, либо молекулярными. Давайте поймем причину этого.
Na2so4 является не молекулярным, а ионным из-за присутствия противоположно заряженных ионов. Но сульфатный анион создается за счет ковалентного взаимодействия между кислородом и серой. Эти связи SO являются полярными ковалентными связями, потому что они имеют полярность связи.
Катионы Na+ притягиваются к SO42- под действием ионной силы. Сульфат — это многоатомные ионы, которым требуются противоположные заряды, такие как Na+, которые оба эквивалентны для образования связи.
Является ли na2so4 полярным или неполярным?Полярность и неполярность молекул определяются их геометрией и структурными особенностями. Разберемся, какой природой обладает Na2so4.
Структура Льюиса na2so4 полярна. Это связано с тем, что Na2so4 состоит из двух ионов: положительного (Na+) и отрицательного (SO4-2), притягиваются друг к другу и образуют ионную связь.
Это связано с тем, что Na2so4 состоит из двух ионов: положительного (Na+) и отрицательного (SO4-2), притягиваются друг к другу и образуют ионную связь.
Молекула развивает электрический дипольный момент из-за полярности, которая представляет собой разделение электрического заряда, называемое полярностью. Найдем причину полярности na2so4.
na2so4 полярен из-за притяжения противоположных зарядов. Металл, соединяясь с неметаллом, создает ионную связь, и это ионное притяжение создает полярность. Полярность между Na+ и SO4-2 выше.
na2so4 это кислота или основание?В случае растворения кислоты или основания в воде образуется сопряженное основание или кислота. Рассмотрим структуру Льюиса Na2so4 более подробно.
Na2so4 не является ни кислотой, ни основанием, поскольку проявляет реакция нейтрализации между кислотой и основанием, как серная кислота и основание гидроксида натрия.
Почему na2so4 ведет себя нейтрально?Реакция нейтрализации происходит при взаимодействии сильной кислоты с сильным основанием. Разберемся с этим в случае na2so4.
Структура Льюиса Na2so4 ведет себя как нейтральная. Это связано с тем, что сульфат-ион технически получают из сильной кислоты, серной кислоты; нейтрализация таких растворов следует этому аспекту.
Является ли na2so4 электролитом?Соединения известны как электролиты; когда они ионизируются полностью или частично при растворении в воде. Разберемся, является ли Na2so4 электролитом или нет.
Na2so4 является сильным электролитом, так как при растворении в воде теряет Na+ и SO.4-2 ионов в водном растворе.
При подаче электрического тока между электродами в растворе катионы и анионы мигрируют в противоположных направлениях. Давайте найдем причину этого.
Na2so4 является сильным электролитом, поскольку при растворении в воде он вырабатывает электричество. Количество образующихся в равновесии ионов определяет степень диссоциации Na2so4 в растворе. Под действием электричества он распадается на ионы.
Является ли na2so4 солью?Соль – это вещество, состоящее из катионов и анионов с одинаковым суммарным зарядом. Давайте углубимся в детали.
Na2so4 — нейтральная соль, образующаяся при взаимодействии h3SO4 и NaOH с водой в качестве побочного продукта. Эта реакция называется нейтрализацией. Это нейтральная реакция соли металла и неметалла.
Как Na2so4 превращается в соль?Сульфат натрия в основном представляет собой неорганическую нейтральную соль. Рассмотрим, почему Na2so4 является солью.
Рассмотрим, почему Na2so4 является солью.
Na2so4 — это соль, потому что она образуется при реакции сильной кислоты и сильного основания. Он будет состоять из двух шагов, как показано ниже.
- h3SO4 (сильная кислота) + NaOH (сильное основание) → Na2SO4 (нейтральная соль) + h3O (вода)
- Этот нейтральный раствор соли имеет значение pH 7.
Электростатические взаимодействия связывают ионы вместе, образуя ионную молекулу. Давайте углубимся в детали.
Na2so4 — ионное соединение, содержащее Na+ и SO4-2 ионов в их кристаллических решетках. Na+ передает свой один электрон на SO4-2 ионы, чтобы сделать себя стабильным. ТАК4-2 состоят из S, который имеет пустую d-орбиталь и расширяет свой октет, таким образом, содержащий более восьми электронов и стабилизирующий структуру.
Формульная единица ионных соединений – Na2SO4. Давайте рассмотрим это подробно.
Na2so4 имеет ионный характер, поскольку ионы в сульфате натрия связаны электростатически. Ион Na+ в Na2so4 имеет только один заряд. В этом случае электронейтральность достигается заменой каждого SO4-2 ион с двумя ионами Na+.
ЗаключениеNa2SO4 может быть получен по методу Мангейма. В воде Na2so4 диссоциирует на ионы и образует водный раствор. Сухой порошок Na2so4 имеет орторомбические бипирамидальные кристаллы в качестве своей кристаллической структуры.
Напишите формулу и рассчитайте молярную массу сульфата натрия.
Ответить
Проверено
213.9k+ просмотров
Подсказка: Нам необходимо знать определение молярной массы и состав сульфата натрия и соответственно написать его формулу. Эмпирическая формула показывает простейшее целочисленное соотношение атомов в соединении, тогда как молекулярная формула показывает количество атомов каждого типа в молекуле. Молярная масса химического соединения определяется как произведение массы этого соединения на число атомов в этом соединении, измеренное в молях.
Эмпирическая формула показывает простейшее целочисленное соотношение атомов в соединении, тогда как молекулярная формула показывает количество атомов каждого типа в молекуле. Молярная масса химического соединения определяется как произведение массы этого соединения на число атомов в этом соединении, измеренное в молях.
Полный пошаговый ответ:
Чтобы написать молекулярную формулу соединения, выполните следующие шаги:
Мы записываем символ элемента вместе с его зарядом из периодической таблицы.
Если в соединении есть многоатомный ион, находим его название и заряд.
Мы уравновешиваем расходы, добавляя индексы.
Данное соединение представляет собой сульфат натрия. В состав входят натрий и многоатомный ион сульфат. Символом натрия является $Na$, и он несет заряд $ + 1$, поскольку принадлежит к группе 1 периодической таблицы. Символ сульфата — $S{O_4}$, и за него взимается плата в размере $-2$. Чтобы сбалансировать этот отрицательный заряд сульфат-ионов, необходимы 2 атома натрия, поскольку каждый несет заряд $ + 1$. Следовательно, формула принимает вид $N{a_2}S{O_4}$.
Следовательно, формула принимает вид $N{a_2}S{O_4}$.
Используя формулу и атомные массы составляющих элементов, мы можем рассчитать молярную массу сульфата натрия.
Атомная масса натрия ($Na$) = $23$
Число атомов $Na$=$2$
Атомная масса серы ($S$) = $32$
Число атомов $S$= $1$
Атомная масса кислорода ($O$) = $16$
Число атомов $O$= $4$
Отсюда молярная масса $N{a_2}S{O_4}$=$(2 \times 23) + (1 \ умножить на 16) + (4 \умножить на 16) = 46 + 32 + 64 = 142$
Следовательно, формула сульфата натрия $N{a_2}S{O_4}$, а его молярная масса $142г/моль$.
Примечание:
Следует отметить, что существуют разные названия молярной массы соединения. Название может быть молекулярной массой, молекулярной массой, массой формулы грамма и т. д., но все они учитывают массу одного моля вещества в граммах на моль. Кроме того, обратите внимание, что атомные массы различных элементов в периодической таблице в основном представляют собой десятичные дроби, но для удобства расчетов берется приблизительное целое число.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
Трендовые сомнения
Как вычислять молекулярные массы и моли
Расчеты аптеки
Как вычислять молекулярные массы и моле
Введение
. Учащиеся по фирменным пластам. Темы включают концентрации, разбавления, изотоничность и значения вытеснения.
Учащиеся по фирменным пластам. Темы включают концентрации, разбавления, изотоничность и значения вытеснения.
Здесь мы составили краткий обзор молекулярных масс и молей; важная тема, которая поднимается снова и снова.
В этом руководстве мы рассмотрим основы следующих тем:
- Расчет молекулярных масс
- Расчет молей
- Расчет количества молекул в образце веса.
Расчет молекулярной массы
Пример 1
Какова молекулярная масса метана, CH 4 ?
Сначала — найдите, сколько атомов каждого элемента в формуле.
В данном случае имеется 1 атом углерода и 4 атома водорода.
Второй — обратитесь к периодической таблице, чтобы найти относительную атомную массу каждого элемента. Относительная атомная масса учитывает все изотопы элемента в том виде, в каком они встречаются в природе.
Третий – умножить значение относительной атомной массы на число атомов каждого элемента.

В случае метана тогда:
- 1 атом углерода = 12
- 4 атома водорода = 4 x (1) = 4
Сложив два значения вместе, мы находим молекулярную массу метана 16.
Давайте рассмотрим еще один пример.
Пример 2
Какова молекулярная масса глюкозы?
Химическая формула глюкозы C 6 H 12 O 6 .
Следуя трем описанным выше шагам, мы находим, что глюкоза имеет:
- 6 атомов углерода = 6 x (12) = 72
- 12 атомов водорода = 12 x (1) = 12
- 6 атомов кислорода = 6 x (16) = 96
Таким образом, молекулярная масса глюкозы равна 180.
Расчет молей
Расчет количества молей в образце прост. Вот основные шаги, которые вы должны предпринять.
Пример 3
Рассчитайте число молей в 30 граммах сульфата натрия.
Химическая формула
сульфата натрия: Na 2 SO 4 .
Шаг 1 – рассчитайте молекулярную массу соединения. На данный момент забудьте о количестве граммов соединения. Мы используем это
значение позже.Для этого проделываем ту же процедуру, что и для примеров 1 и 2.
- 2 атома натрия = 2 х (23) = 46
- 1 атом серы = 1 х (32) = 32
- 4 атома кислорода = 4 x (16) = 64
Общая молекулярная масса сульфата натрия равна 142.
Шаг 2 – массу образца разделить на его молекулярную массу.
В этом случае в вопросе указано, что масса образца составляет 30 граммов.
- 30 граммов сульфата натрия, деленные на его молекулярную массу, которая, как мы выяснили, равна 142, дают нам значение 0,2113 молей.
В 30 граммах натрия содержится 0,2113 молей
Пример 4
Найдите количество молекул в 30 граммах сульфата натрия.
Это расширение примера 3 — на этот раз нас просят рассчитать количество молекул в 30 граммах сульфата натрия.

Чтобы рассчитать количество молекул, мы должны сначала узнать общее количество молей в 30 граммах сульфата натрия. Мы узнали, что эта цифра равна 0,2113.
Чтобы найти количество молекул, нам просто нужно сделать еще один шаг — умножить это значение на число Авогадро — 6 x 10 23 .
0,2113 x (6 x 10 23 ) = 1,27 x 10 23 молекул в 30 г натрия
Пример 5
Сколько миллимолей хлорида содержится в 300 мг хлорида кальция?
Химическая формула хлорида кальция CaCl 2 .
Это означает, что имеется 1 моль ионов кальция и 2 моля ионов хлора.
Во-первых, мы должны выяснить, сколько молей содержится в общем соединении. Молекулярная масса хлорида кальция равна 110.
У нас есть 300 мг хлорида кальция. Мы должны перевести это в граммы – 0,3 грамма.
Как и раньше, мы делим массу образца на молекулярную массу — в данном случае 0,3 делим на 110 — и получаем 0,0027 молей.


 Е. Рудзитис, Ф.Г. Фельдман Химия 8, М. « Просвещение» 2008,стр.175
Е. Рудзитис, Ф.Г. Фельдман Химия 8, М. « Просвещение» 2008,стр.175 Химические формулы. Относительная молекулярная масса»
Химические формулы. Относительная молекулярная масса»
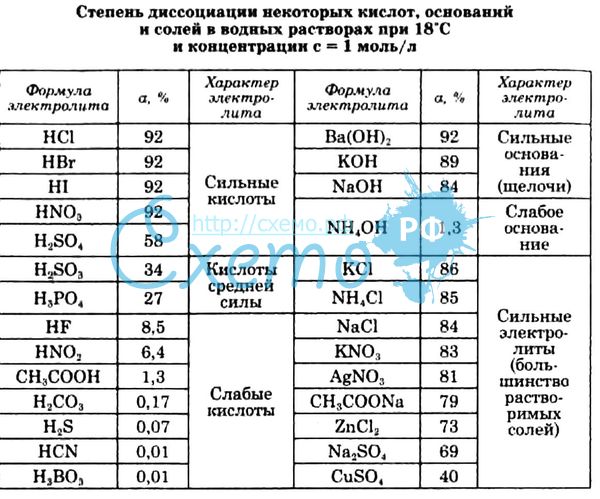 Все остальные примеры разбираются под контролем учителя.
Все остальные примеры разбираются под контролем учителя.