Базовые расчетные формулы — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Базовые расчетные формулы
БАЗОВЫЕ РАСЧЕТНЫЕ ФОРМУЛЫДЛЯ РЕШЕНИЯ ЗАДАЧ ПО ХИМИИ
2. Основные физические величины, используемые при решении задач по химии
ОСНОВНЫЕ ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ,ИСПОЛЬЗУЕМЫЕ ПРИ РЕШЕНИИ ЗАДАЧ ПО ХИМИИ
Физическая величина
Обозначение
Единицы измерения
Масса
m
г, кг
Количество вещества
n
моль
Молярная масса
M
г/моль
Относительная атомная масса
Ar
—
Относительная молекулярная масса
Mr
—
Объем
V
л, мл
Молярный объем
Vm
л/моль
Плотность
p
г/мл
Относительная плотность
D
—
Число Авогадро
NA
моль-1
3.
 Основные физические величины, используемые при решении задач по химииОСНОВНЫЕ ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ,
Основные физические величины, используемые при решении задач по химииОСНОВНЫЕ ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ,ИСПОЛЬЗУЕМЫЕ ПРИ РЕШЕНИИ ЗАДАЧ ПО ХИМИИ
Обозначение
Единицы измерения
Число частиц
N
—
Скорость химической реакции
моль/л*с
Cm ; CM
моль/л
Массовая доля компонента
—
Объемная доля компонента
—
вых
—
Температура по Цельсию
t
С
Термодинамическая температура
T
К
Тепловой эффект
Q
кДж/моль
Физическая величина
Молярная концентрация
Массовая доля выхода
4. Основные формулы и величины, необходимые для расчетов
ОСНОВНЫЕ ФОРМУЛЫ И ВЕЛИЧИНЫ,НЕОБХОДИМЫЕ ДЛЯ РАСЧЕТОВ
• Аr – отношение массы атома элемента к 1/12 массы атома С.
Аr(x)=ma(x) / 1/12ma(C).
• Mr – отношение массы молекулы вещества к 1/12 массы атома С.
Мr(ХУ)= Ar(Х)+Ar(У)
• Масса – основная характеристика всех физических тел и частиц,
определяющая их инерционные и гравитационные свойства.

5. Основные формулы и величины, необходимые для расчетов
ОСНОВНЫЕ ФОРМУЛЫ И ВЕЛИЧИНЫ,НЕОБХОДИМЫЕ ДЛЯ РАСЧЕТОВ
Моль – количество вещества системы, содержащей столько же структурных
элементов, сколько содержится атомов в углероде массой 0,012 кг.
Молярная масса – это масса 1 моль вещества.
m=n*M; n=m/M;
M=m/n
Молярный объем – объем вещества количеством один моль.
Vm газа=22,4 л/моль
n=V/Vm; V=n*Vm;
Vm=V/n
6. Основные формулы и величины, необходимые для расчетов
ОСНОВНЫЕ ФОРМУЛЫ И ВЕЛИЧИНЫ,НЕОБХОДИМЫЕ ДЛЯ РАСЧЕТОВ
• Число структурных единиц
N=n*NA;
n=N/NA
• Плотность вещества
ρ=m/V;
m=ρ*V;
V=m/ρ
• Относительная плотность – отношение плотностей двух веществ, показывающее, во
сколько раз одно вещество тяжелее другого.
Dx (У) = M(У)/M(x) = Mr(У)/ Mr(x)
7. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ• 1. Найти относительную атомную массу кислорода, если масса
атома кислорода
равна 2,66*10-23г, а масса атома углерода 1,99*10-23г.

8. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ• 1. Найти относительную атомную массу кислорода, если масса
атома кислорода
равна 2,66*10-23г, а масса атома углерода 1,99*10-23г.
9. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ• 1. Найти относительную атомную массу кислорода, если масса
атома кислорода
равна 2,66*10-23г, а масса атома углерода 1,99*10-23г.
Ответ: Ar(O)=16
10. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ• 2. Вычислить относительную молекулярную массу K3PO4
Ответ: Mr (K3PO4)=212.
11. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ3. На весах отвесили 500г сульфата цинка. Какому количеству вещества это
соответствует?
Ответ: n(ZnSO4)=3,1моль.
4. Сколько молекул содержится в h3O массой 54г, какова масса 1 молекулы h3O?
Ответ: N=18,06*1023 молекул,
mm=(h3O)=2,99*10-23 г
5. Вычислите, какая масса углерода содержится в 90г этана C2H6 .

Ответ: m(C)= 72 г
12. Расчеты по химическим формулам
РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ6. Вычислите, в какой массе оксида фосфора(III) P2O3 содержится 6,2г
фосфора.
Ответ: m(P2O3)=11г
7. Вычислить, сколько молекул содержится в 36г h3O. В каком объеме метана
(н.у.) столько же молекул?
Ответ: N(h3O)=12,04*1023молекул,
V(Ch5)=44,8л.
8. Сколько молей атомов углерода в 15г Ch4COOH?
Ответ: n(C)=0,5моль.
9. Чему равно общее число атомов в 3г этана?
Ответ: N(атомов)=48,16*1022.
13. Задачи для самостоятельного решения:
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ:1.
Вычислите относительную молекулярную массу веществ состава: а) CO2 б) HNO3 ; в) CuSO4;
г) Cu(OH)2.
2.
Рассчитайте массу 2 моль оксида меди (II), 0,5 моль серной кислоты; 0,1 моль хлорида
натрия; 0,1 моль кислорода.
3.
На одну чашку весов поместили 0,5 моль оксида меди (II). Какое количество оксида железа
(III) необходимо поместить на другую чашку весов, чтобы они были в равновесии?
4.

Какое вещество содержит больше составных частиц: бор массой 1 г или медь массой 1 г?
Ответ подтвердите расчётами.
5.
Какой должна быть масса магния, чтобы она содержала столько же атомов, сколько их
содержится в веществе железа массой 28 г?
;
14. Задачи для самостоятельного решения:
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ:6. Сколько молекул воды содержится в воде объёмом 1мл?
7. Какое вещество содержит больше молекул: вода массой 1 г или сероводород массой 1 г?
Ответ подтвердите расчётами.
8. Одинаковое ли число молекул в 1 л воды и в 1 л серной кислоты, плотность которой 1831
кг/м ? Ответ подтвердите расчётами.
3
9. Определите объём (н.у.), который займёт при нормальных условиях газовая смесь,
содержащая водород массой 1,4 г и азот массой 5,6 г.
бромоводорода.
English Русский Правила
Самостоятельная работа «Молекулярная масса.
 Знаки химических элементов»
Знаки химических элементов»Самостоятельная работа Вариант 1 1. Определите Mr h3CO3, Mg (NO3)2, CoCO3 2. Определите ω Cr в Cr2O3, K в K2SO4 3. Что означает формула 5K2SiO3 , 3HNO3 4. Определите положение элементов N, Zn, Cl, Mg 5. Что называют относительной молекулярной массой 6. Группа | Самостоятельная работа Вариант 3 1. Определите Mr Mg 3 (PO4)2, HNO3, Ag2SO4 2. Определите ω O в AgNO3, H в Nh5Cl 3. Что означает формула 9 Cr2O3, 3 Na2SO4 4. Определите положение элементов Ni, Ca, B, As 5. Что называют относительной атомной массой 6. Группа |
Самостоятельная работа Вариант 2 1. 2. Определите ω Li в Li2CO3, Fe в Fe (NO2)2 3. Что означает формула 2 Na2O, 7 h3Cr2O7 4. Определите положение элементов Ti, C, S, Ag 5. Что такое химическая формула 6. Период | Самостоятельная работа Вариант 4 1. Определите Mr Al (OH)3, HClO4, Cr (NO3)3 2. Определите ω H в h3Cr2O7, Cu в Cu2O 3. Что означает формула 6 Li2CO3, 4 K3PO4 4. Определите положение элементов P, Mn, Br, Al 5. Почему относительную атомную массу называют относительной 6. Период |
Самостоятельная работа Вариант 1 1. Определите Mr h3CO3, Mg (NO3)2, CoCO3 2. Определите ω Cr в Cr2O3, K в K2SO4 3. Что означает формула 5K2SiO3 , 3HNO3 4. 5. Что называют относительной молекулярной массой 6. Группа | Самостоятельная работа Вариант 3 1. Определите Mr Mg 3 (PO4)2, HNO3, Ag2SO4 2. Определите ω O в AgNO3, H в Nh5Cl 3. Что означает формула 9 Cr2O3, 3 Na2SO4 4. Определите положение элементов Ni, Ca, B, As 5. Что называют относительной атомной массой 6. Группа |
Самостоятельная работа Вариант 2 1. Определите Mr Ba (OH)2, K3PO4, SrCl2 2. Определите ω Li в Li2CO3, Fe в Fe (NO2)2 3. Что означает формула 2 Na2O, 7 h3Cr2O7 4. Определите положение элементов Ti, C, S, Ag 5. Что такое химическая формула 6. Период | Самостоятельная работа Вариант 4 1. 2. Определите ω H в h3Cr2O7, Cu в Cu2O 3. Что означает формула 6 Li2CO3, 4 K3PO4 4. Определите положение элементов P, Mn, Br, Al 5. Почему относительную атомную массу называют относительной 6. Период |
Химия CH.6 и 7 — Химические реакции и кислоты/Основы
Баланс Химическое уравнение онлайн балансировщик: Глава 6 — Химические вещества и их реакции6.1 — Описание химических реакций
| 16._chemical. pdf |
| 2._chapter_6.1_textbook_solutions.png |
6.3 — Сохранение массы в химических реакциях
Атомная теория Дальтона:
1. Вся материя состоит из неделимых атомов
2. Все атомы данного элемента одинаковы по массе и свойствам
Все атомы данного элемента одинаковы по массе и свойствам
3. Соединения комбинации двух или более различных типов атомов
4. Химическая реакция представляет собой перегруппировку атомов
Атомная теория Дальтона | Академия Хана: https://www.khanacademy.org/science/chemistry/atomic-structure-and-properties/introduction-to-compounds/a/daltons-atomic-theory-version-2
Атомная теория Дальтона | Интеллектуальное обучение для всех: https://youtu.be/kJ-6Qy05u_Q
Антуан Лавуазье Сохранение массы: https://youtu.be/x9iZq3ZxbO8
Закон сохранения массы | TED-ED: https://youtu.be/2s6e11nbwiw
| 3._conservation_of_mass_powerpoint.pdf |
4__6.3_-_conserving_mass_in_chemical_reactions_solutions. png png |
6.4 — Information in Chemical Equations
| 4._balancing_chemical_equations.pdf |
| 4__6.4_-_information_in_chemical_equations.png |
Уравновешивание химических уравнений | Khan Academy: https://youtu.be/RnGu3xO2h74
Balancing Chemical Equations Practice Problems: https://youtu.be/eNsVaUCzvLA
Conservation of Mass Lab| pre- lab.docx |
| talk_of_mass_lab_handout__for_student_.doc |
| conversation_of_mass__lab_report_template_.doc |
grade_9-10_formal_lab_report_guidelines. pdf pdf |
SDS (Safety Data Sheets)
|
|
|
| ||||||||
Типы химических реакций > |
| ||
6.5 — Реакция синтеза и разложения
Демонстрация электролиза воды | ScienceFix: https://youtu. be/HQ9Fhd7P_HA
be/HQ9Fhd7P_HA
| 5c._6.5_-_синтез___decomposition_reactions_solutions.png |
6.6 — Single & Double Replacement Reactions
| 6a._6.6_-_single___double_displacement_solutions.png |
| 6b._classifying_reactions_and_balancing_chemical_equations_solutions.pdf |
| 6b._advanced_balancing_practice_pg_1.jpg |
| 6B._ADVAND_BALANCE_PRACTICE_PG_2.JPG |
6.9 — Combustion Реакция 9000
400121220202020202020 гг. FuseSchool: https://youtu.be/EGKGe0beRDs
7a._6. 9_-_combustion_rxns_solutions.png 9_-_combustion_rxns_solutions.png |
6.10 — Коррозия
- Прочтите раздел 6.10 и создайте примечания к исследованию
- Q#1-7 стр. 251
| 8._6.10 _-_ corrosion_solutions.png |
Глава 6 Обзор
9003 11002
.- Q#5-9,11 на стр. 258
- Самопроверка на стр. 260-261
|
| ||||
|
| ||||
| types_of_chemical_reactions_concept_map.png |
ГЛАВА 7 — кислоты и основания
7.2 — кислоты и основания
| 9._ACIDS ___ BASES_POWERPOINT.PDF |
Как назвать общие бинарные кислоты и оксикислоты | Mr.Causey: https://youtu.be/LoSLKUN7FQ4
| 4b._binary_acids_and_oxyacids_practice_answers.pdf |
7.3 — The pH Scale
| 10._the_ph_scale_powerpoint. pdf |
7. |
Натуральные индикаторы | Партнер по дизайну: https://youtu.be/R5yqIyRMhVY
7,5 — Реакции и приложения нейтрализации
| 11._NEUTRALASION_REACTIONS_POWERPOINT.PDF |
771
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Определите Mr Ba (OH)2, K3PO4, SrCl2
Определите Mr Ba (OH)2, K3PO4, SrCl2 Определите положение элементов N, Zn, Cl, Mg
Определите положение элементов N, Zn, Cl, Mg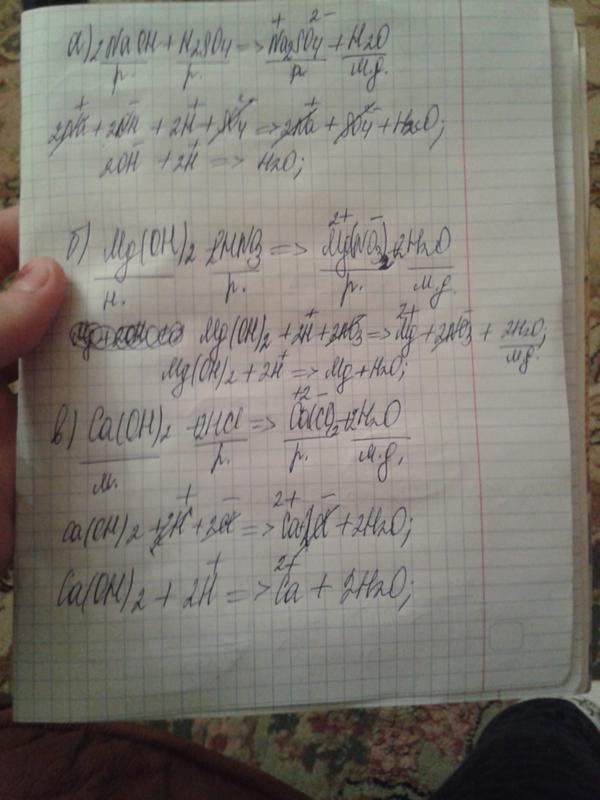 Определите Mr Al (OH)3, HClO4, Cr (NO3)3
Определите Mr Al (OH)3, HClO4, Cr (NO3)3 2.jpg
2.jpg  be/AU2c-9D-Cj8
be/AU2c-9D-Cj8
 Его также можно использовать в качестве высокоэффективного жидкого комплексного удобрения и вспомогательного средства для извлечения серы из кислого газа при производстве синтетического каучука. Это также буферный агент, хелатирующий агент, пищевые дрожжи, эмульгирующая соль, антиоксидантный синергист в пищевой промышленности.
Его также можно использовать в качестве высокоэффективного жидкого комплексного удобрения и вспомогательного средства для извлечения серы из кислого газа при производстве синтетического каучука. Это также буферный агент, хелатирующий агент, пищевые дрожжи, эмульгирующая соль, антиоксидантный синергист в пищевой промышленности.  %
%
 . Сырье Фосфорная кислота производится самостоятельно, поэтому качество продукции стабильно и превосходно. Фосфатные продукты горячего процесса отличаются высокой чистотой, низким содержанием примесей, низким содержанием тяжелых металлов и полностью растворимы в воде.
. Сырье Фосфорная кислота производится самостоятельно, поэтому качество продукции стабильно и превосходно. Фосфатные продукты горячего процесса отличаются высокой чистотой, низким содержанием примесей, низким содержанием тяжелых металлов и полностью растворимы в воде. 