Новые гибридные материалы на основе водорастворимых фталоцианинов цинка и V2O5·nh3O
1. Semenenko D.A., Kulova T.L., Skundin A.M., Kozlova M.G., Pomerantseva E.A., Grigorieva A.V., Goodilin E.A., Tretyakov Yu.D. ISJAEE 2007, 48(4), 82-86.
2. Perera S.D., Patel B., Bonso J., Grunewald M., Ferraris J.P., Balkus K.J. ACS Appl. Mater. Interfaces 2011, 3, 4512-4517.
http://dx.doi.org/10.1021/am2011965
3. Grigorieva A.V., Badalyan S.M., Goodilin E.A., Rumyantseva M.N., Gaskov A.M., Birkner A., Tretyakov Y.D. Eur. J. Inorg. Chem. 2010, 5247–5253.
http://dx.doi.org/10.1002/ejic.201000372
4. Kameyama H., Narumi F., Hattori T. J. Mol. Catal. A: Chem. 2006, 258, 172-177.
http://dx.doi.org/10.1016/j.molcata.2006.05.022
5. Constantino V.R.L., Barbosa C.A.S., Bizeto M.A., Dias P.M. An. Acad. Bras. Ci. 2000, 72(1), 45-49.
http://dx.doi.org/10.1590/S0001-37652000000100006
6. Inabe T., Tajima H. Chem. Rev. 2004, 104, 5503-5533.
2004, 104, 5503-5533.
http://dx.doi.org/10.1021/cr030649x
7. Berezin B.D. Coordination Compounds of Porphyrins and Phthalocyanine, Moscow: Nauka, 1978. 180 p. (in Russ.).
8. Simon J., Andre J.-J. Molecular Semiconductors: Photoelectrical Properties and Solar Cells, Springer-Verlag Berlin Heidelberg Berlin, 1985, 288 pp.
http://dx.doi.org/10.1007/978-3-642-70012-5
9. Wöhrle D. Macromol. Rapid. Commun. 2001, 22, 68-97.
http://dx.doi.org/10.1002/1521-3927(20010201)22:2<68::AID-MARC68>3.0.CO;2-Z
10. Abellan G., Busolo F., Coronado E., Marti-Gastaldo C., Ribera C. J. Phys. Chem. C 2012, 116, 15756-15764.
11. Bizeto M.A., Constantino V.R.L. Microporous Mesoporous Mater. 2005, 83(1-3), 212-218.
http://dx.doi.org/10.1016/j.micromeso.2005.04.013
12. Cady S.S., Pinnavaia T.J. Inorg. Chem. 1978, 17, 1501-1507.
http://dx.doi.org/10.1021/ic50184a022
13. Livage J. Coord. Chem. Rev. 1998, 178-180, Part 2, 999-1018.
Rev. 1998, 178-180, Part 2, 999-1018.
http://dx.doi.org/10.1016/S0010-8545(98)00105-2
14. Grigorieva A.V., Tarasov A.B., Goodilin E.A., Volkov V.V., Tretyakov Yu. D. Glass Phys. Chem. 2007, 3, 232-236.
http://dx.doi.org/10.1134/S1087659607030078
15. Zakharova G.S., Volkov V.L., Ivanovskaya V.V., Ivanovskiy A.L. Nanotubes and Related Nanostructures of Metal Oxides, Ekaterinburg: UrO RAN, 2005, 240 p. (in Russ.).
16. Patzke G. R., Krumeich F., Nesper R. Angew. Chem. 2002, 114, 2554-2571.
http://dx.doi.org/10.1002/1521-3757(20020715)114:14<2554::AID-ANGE2554>3.0.CO;2-Q
17. Bieri F., Krumeich F., Muhr H.-J., Nesper R. Helv. Chim. Acta 2001, 84, 3015-3022.
http://dx.doi.org/10.1002/1522-2675(20011017)84:10<3015::AID-HLCA3015>3.0.CO;2-P
18. Chandrappa G.T., Steunou N., Cassaignon S., Bauvais C., Livage J. Catal. Today 2003, 78, 85-89.
http://dx.doi.org/10.1016/S0920-5861(02)00298-5
19. Chandrappa G.T., Steunou N., Cassaignon S., Bauvais C., Biswas P.K., Livage J. J. Sol-Gel Sci. Technol. 2003, 26, 593-596
Chandrappa G.T., Steunou N., Cassaignon S., Bauvais C., Biswas P.K., Livage J. J. Sol-Gel Sci. Technol. 2003, 26, 593-596
http://dx.doi.org/10.1023/A:1020728205967.
20. Anaissi F. J., Engelmann F.M., Araki K., Toma H.E. Solid State Sci. 2003, 5, 621-628.
http://dx.doi.org/10.1016/S1293-2558(03)00053-0
21. Toma H.E., Oliveira H.P., Rechenberg H.R. J. Inclusion Phenom. Mol. Recognit. Chem. 1994, 17, 351-363.
http://dx.doi.org/10.1007/BF00707131
22. Suvorova O.N., Domrachev G.A., Shchupak E.A., Kudryavtseva G.S., Kirillov A.I., Zaitsev A.A. Russ. Chem. Bull., Int. Ed. 2009, 58, 2233-2239 [Izv. AN, Ser. Khim. 2009, 58, 2167-2173 (in Russ.)]
http://dx.doi.org/10.1007/s11172-009-0311-0.
23. Suvorova O.N., Wöhrle D., Shchupak E.A., Kirillov A.I., Lopatina T.I., Zabrodina G.S., Macroheterocycles 2010, 3, 134-138.
24. Lapok L., Schnurpfeil G., Gerdes R., Gorun S.M., Suvorova O., Kudryavtseva G.S., Wohrle D. J. Porphyrins Phthalocyanines 2009, 13, 346-357.
J. Porphyrins Phthalocyanines 2009, 13, 346-357.
http://dx.doi.org/10.1142/S1088424609000097
25. Zakharova G., Volkov V. Russ. Chem. Rev. 2003, 72, 311-327 [Uspekhi Khimii 2003, 72, 346-362 (in Russ.)].
http://dx.doi.org/10.1070/RC2003v072n04ABEH000762
26. Kwon C.-W., Murugan A.V., Campet G. Active and Passive Electronic Components 2003, 26, 171-183.
http://dx.doi.org/10.1080/1042015031000073904
27. Petkov V., Trikalitis P.N., Bozin E.S., Billinge S.J.L., Vogt T., Kanatzidis M.G. J. Am. Chem. Soc. 2002, 124, 10157-10162.
http://dx.doi.org/10.1021/ja026143y
28. Scheidt R.W., Dow W. J. Am. Chem. Soc. 1977, 99, 1101-1104.
http://dx.doi.org/10.1021/ja00446a021
Изготовление на месте трехмерного композитного нанолиста V2O5-x·nh3O из углерода, легированного азотом/богатого дефектами, для высокоэффективных волокнистых гибких Zn-ионных аккумуляторов
In situ Создание 3D-углерода с примесью азота/богатого дефектами V 2 O 5− x · n H 2 O нанолистовой композит для высокопроизводительных волокнистых гибких Zn-ионных аккумуляторов †Руи Пан, и Анки Чжэн, и Бинг Он, с Ювэй Сюн, и Фэнсай Хан, б Лей Вэй, с Цинвэнь Ли, * б Цичун Чжан* б Куйбо Инь * и и Литао Солнце * и
Принадлежности автора
* Соответствующие авторы
и SEU-FEI Nano-Pico Center, Ключевая лаборатория МЭМС Министерства образования, Юго-восточный университет, Нанкин, Китай
Электронная почта: yinkuibo@seu. edu.cn, [email protected]
edu.cn, [email protected]
б Ключевая лаборатория многофункциональных наноматериалов и интеллектуальных систем, Сучжоуский институт нанотехнологий и нанобионики Китайской академии наук, Сучжоу 215123, Китай
с Школа электротехники и электронной инженерии, Наньянский технологический университет, 50 Наньян-авеню, Сингапур
Аннотация
rsc.org/schema/rscart38″> Аккумуляторы на водной основе с небольшим объемом, малым весом и растяжимостью способствовали созданию носимых интеллектуальных текстильных систем, таких как биосовместимая электроника, для более эффективного использования электроэнергии. Проблемы, с которыми все еще сталкиваются волокнистые батареи, включают не только недостаточную фактическую емкость, но и возможность циклирования на стороне катода. Здесь сообщается, что стратегия анодного окисления Расчеты теории функционала плотности из первых принципов также показали, что кислородные вакансии могут ослабить электростатическое взаимодействие между Zn 2+ и катодом-хозяином, сопровождающее низкий диффузионный энергетический барьер Zn 2+ . Чтобы подчеркнуть потенциальные области применения, был продемонстрирован прототип носимого волокна AZIB (FAZIB), обладающего замечательной гибкостью и исключительными возможностями плетения. Что еще более обнадеживает, получившийся FAZIB можно заряжать солнечными батареями и питать датчик давления. Таким образом, наша работа представляет собой многообещающую стратегию рационального создания высокоэффективных гибких катодов на основе ванадия для носимых AZIB следующего поколения.
Расчеты теории функционала плотности из первых принципов также показали, что кислородные вакансии могут ослабить электростатическое взаимодействие между Zn 2+ и катодом-хозяином, сопровождающее низкий диффузионный энергетический барьер Zn 2+ . Чтобы подчеркнуть потенциальные области применения, был продемонстрирован прототип носимого волокна AZIB (FAZIB), обладающего замечательной гибкостью и исключительными возможностями плетения. Что еще более обнадеживает, получившийся FAZIB можно заряжать солнечными батареями и питать датчик давления. Таким образом, наша работа представляет собой многообещающую стратегию рационального создания высокоэффективных гибких катодов на основе ванадия для носимых AZIB следующего поколения.- Эта статья является частью тематического сборника: Новые горизонты в материалах для преобразования энергии, оптики и электроники
Nh3O-Льюис Структура и характеристики (13 полезных фактов) – Lambda Geeks
NH 2 O – представляет собой молекулу, похожую на гидроксиламин с потерянным одним протоном и имеющую молекулярную массу 32 г/моль. Давайте обсудим более важные факты о NH 2 О – .
Давайте обсудим более важные факты о NH 2 О – .
NH 2 O – представляет собой белое кристаллическое твердое вещество, широко используемое в органическом синтезе в качестве слабого основания во многих реакциях конверсии альдегидов. Он широко используется в синтезе полимеров, таких как нейлон-6. Его можно получить из NH 2 OH при растворении в сильнокислом растворе.
NH 2 O – играет важную роль в нитрификации. Давайте изучим более подробно о NH 2 O – , такие как валентные электроны, структура Льюиса, неподеленные пары и другие характеристики.
Как нарисовать NH
2 структуру О-Льюиса?Структура Льюиса — это простой метод представления скелетной электронной структуры молекулы с учетом валентных электронов. Давайте научимся рисовать шаги.
Подсчет общего количества валентных электронов
Для подсчета общего количества валентных электронов важно знать электронную конфигурацию основного состояния участвующих атомов. Крайнее внешнее состояние H, N и O равно 1s 1 , 2s 2 2p 3 и 2s 2 2p 4 . Два атома H дают 2 валентных электрона, N и O дают в общей сложности 11 валентных электронов.
Крайнее внешнее состояние H, N и O равно 1s 1 , 2s 2 2p 3 и 2s 2 2p 4 . Два атома H дают 2 валентных электрона, N и O дают в общей сложности 11 валентных электронов.
Таким образом, всего 13 плюс один дополнительный электрон из-за отрицательного заряда — это доступные валентные электроны для построения структуры NH 2 O – льюиса.
Выбор центрального атома
N выбран в качестве центрального атома, так как его электроотрицательность ниже, чем O. H не выбран в качестве центрального атома, так как он имеет низкую электроотрицательность, он может образовывать только связи, поэтому ковалентность также является решающим фактором при выборе центрального атома. N может образовывать не менее 3 ковалентных связей.
Электроотрицательность участвующих атомов N, H и O составляет 3,04, 2,2 и 3,44, из которых N лучше всего подходит для роли центрального атома.
Создание и формирование связей
Между центральным атомом и любым другим атомом, присоединенным к нему, помещается одна пара электронов. Таким образом, 3 пары связей назначаются между NH, NO, NH. 6 валентных электронов используются из 14. Остальные 8 валентных электронов останутся несвязывающей парой электронов.
Присвоение оставшихся валентных электронов
Остальные 8 валентных электронов относятся к неподеленным парам электронов на атомах N и O. N кроме 3 связывающих пар требует еще 2 электрона для завершения своего октета. И O также требует 6 электронов, чтобы завершить свой октет. Таким образом, эти электроны находятся в виде неподеленных пар электронов на O и N. общая структура, принимаемая молекулой, которая зависит только от общего количества задействованных связывающих пар. Обсудим форму NH 2 O – подробнее.
Форма NH 2 O – треугольно-пирамидальная. Его молекулярная геометрия включает 4 пары связей, но форма включает только 3 пары связей, которые расположены пирамидально, чтобы предотвратить отталкивание между неподеленной парой и парой связей. Неподеленная пара на N не влияет на общую форму.
Его молекулярная геометрия включает 4 пары связей, но форма включает только 3 пары связей, которые расположены пирамидально, чтобы предотвратить отталкивание между неподеленной парой и парой связей. Неподеленная пара на N не влияет на общую форму.
Если бы атом был соединен с N вместо неподеленной пары, форма была бы тетраэдрической.
Треугольная пирамидальная форма из NH 2 O –NH
2 O – Формальный заряд структуры ЛьюисаФормальный заряд – это гипотетический электрический заряд, приписываемый каждому ковалентно связанному атому, при условии, что электроны связаны в равной степени. Изучаем детально.
Формальный заряд NH 2 O – равен 0 и рассчитан по формуле электронов на атоме) – (Число связей с атомом)’.
- Формальный заряд N = 5-2-3= 0
- Формальный заряд H = 1-0-1 = 0
- Формальный заряд O = 6-6-1 = -1
- Электрический заряд общей молекулы NH 2 O – составляет -1.

- Это заряженная, а не нейтральная молекула.
NH
2 O – Правило октетов структуры ЛьюисаПравило октетов гласит, что каждый атом пытается принять инертную конфигурацию оболочки, чтобы обрести стабильность, забирая 8 электронов в свою оболочку. Посмотрим, будет ли Nh3O – следует правилу октетов.
NH 2 O – следует правилу октетов. Каждый атом в этой молекуле имеет полную конфигурацию инертной оболочки. N имеет ровно 8 электронов в своей подоболочке, включая 3 связывающих и 1 несвязывающую электронную пару. O имеет ровно 8 электронов в своем окружении с 1 связывающей и 3 несвязывающими электронными парами.
H не имеет 8 электронов, но его октет является полным, поскольку он может принимать максимум 2 электрона, что достигается путем образования одинарной ковалентной связи.
NH
2 O – неподеленные пары структуры Льюиса Неподеленные пары – это те электронные пары, которые не участвуют в образовании какой-либо химической связи. Теперь мы изучим, как вычислять одинокие пары.
Теперь мы изучим, как вычислять одинокие пары.
NH 2 O – Структура Льюиса имеет всего 4 неподеленные пары электронов. N имеет одну неподеленную пару электронов. O имеет в общей сложности 3 неподеленные пары электронов. Эти неподеленные пары не подвергаются делокализации и остаются локализованными на соответствующих атомах. Эти 4 одинокие пары не являются связующими по своей природе.
Общее количество неподеленных пар или несвязывающих электронов в NH 2 O – можно легко найти, вычитая общее количество связывающих электронов из общего числа валентных электронов, что равно 14-6=8.
NH
2 O – валентные электроныВалентные электроны – это свободно связанные электроны внешней оболочки, которые используются для образования любых ковалентных или ионных химических связей. Давайте изучим более подробно ниже.
NH 2 O – имеет всего 14 валентных электронов.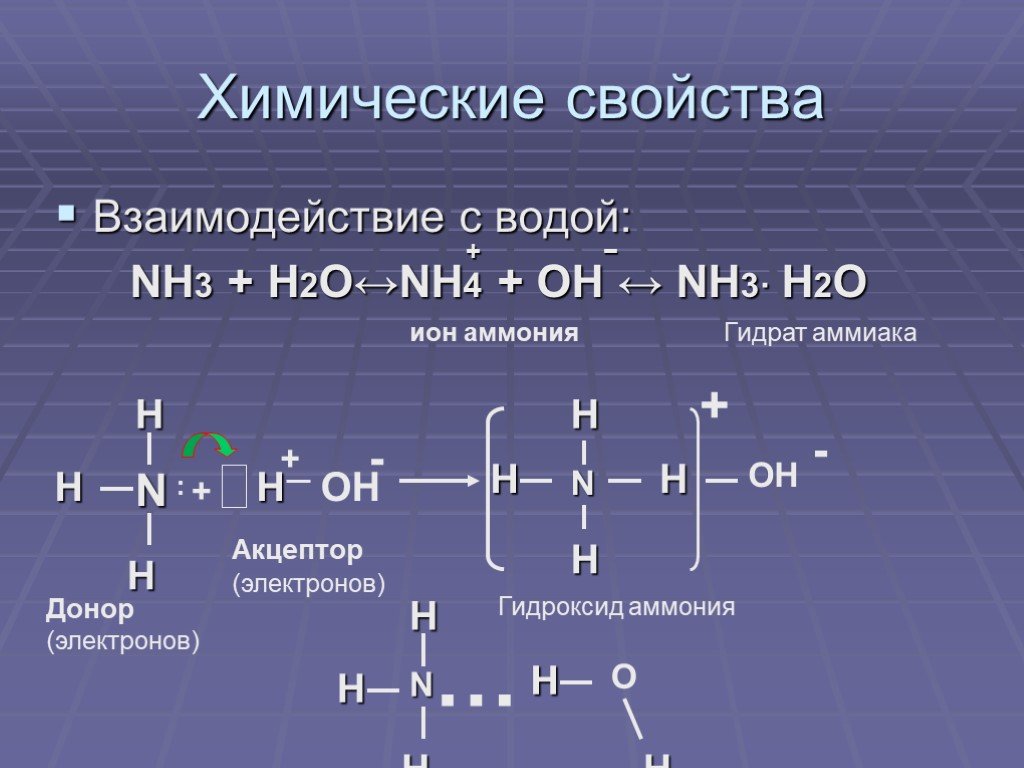 Валентные электроны можно легко рассчитать, используя электронную конфигурацию основного состояния отдельных атомов. N, O и H имеют электронное состояние внешней оболочки как 2s 2 2p 3 , 2s 2 2p 4 и 1s 1 .
Валентные электроны можно легко рассчитать, используя электронную конфигурацию основного состояния отдельных атомов. N, O и H имеют электронное состояние внешней оболочки как 2s 2 2p 3 , 2s 2 2p 4 и 1s 1 .
Слабо связанные электроны с ядрами в 2s, 2p, 3s, 3p и 1s представляют собой валентные электроны, из которых N имеет 5, O имеет 6 и каждый из двух атомов H имеет 1 валентный электрон.
NH
2 O – гибридизацияГибридизация – это явление в теории валентных связей, когда атомные орбитали всех участвующих атомов эффективно перекрываются. Давайте изучим больше фактов ниже.
NH 2 O – имеет sp 3 гибридизацию. Молекулярная геометрия из-за гибридизации sp 3 является тетраэдрической, что означает наличие 4 электронных пар. Гибридизация учитывает как связывающие, так и несвязывающие пары. Четыре подоболочки N (2p z , 2p x , 2p y , 2s) подвергаются гибридизации с атомными орбиталями H и O. Полярность любой молекулы зависит от ее электроотрицательности, расстояния между соединенными атомами и заряда. Выясним, является ли NH 2 O – полярным или нет. NH 2 O – – полярная молекула. Полярность возникает из-за его тригонально-пирамидальной структуры, которая приводит к асимметричному распределению электронного облака. Векторы дипольного момента двух связей NH плюс N-одинокая пара меньше, чем дипольный момент связи NO –. Это делает чистую отмену более 0, Электроотрицательность O больше, чем у N и у неподеленной пары, поэтому он притягивает электронную плотность неподеленной пары, а также N к себе, создавая частичный отрицательный заряд. Образование парциальных положительных и отрицательных связей приводит к формированию постоянного дипольного дипольного взаимодействия с другими полярными молекулами. Кислота имеет тенденцию принимать электроны или отдавать протоны, а основание высвобождает ион гидроксила или отдает электроны. NH 2 O – является основанием в том смысле, что оно имеет неподеленные пары электронов на атоме O, а также на атоме N, которые могут отдавать электроны кислоте. Это слабое основание с очень низким значением pKa. Он не полностью диссоциирует на соответствующие ионы. Электролит – это химическое вещество, состоящее из положительных и отрицательных радикалов, называемых катионами и анионами. Выясним, является ли NH 2 O – является электролитом или нет. NH 2 O – не является электролитом. Его сопряженная кислота, NH 2 OH, является электролитом. Он не растворяется в отдельных катионах или анионах в растворе из-за низкой энергии диссоциации. Растворимость соединения зависит от того, насколько плотно упакованы ионы, его энергии гидратации и энергии решетки. NH 2 O – is soluble in few polar solvents like NH 2 O – gets dissolved easily в полярных растворителях из-за своей полярной природы. Энергии гидратации NH 2 O – достаточно для разрушения структуры решетки. Положительные, отрицательные диполи и дополнительный отрицательный заряд притягиваются к полярным молекулам и создают сильные диполь-дипольные взаимодействия. Эти диполи притягивают полярные молекулы и окружают их ими, что делает его устойчивым в растворе. Ковалентная молекула образуется среди неметаллов с очень низкой разницей электроотрицательностей, тогда как ионные соединения имеют большую разницу электроотрицательностей.
Является ли NH
2 O – кислотным или основным? Проверим, если NH 2 O – представляет собой кислоту или основание.
Проверим, если NH 2 O – представляет собой кислоту или основание. Является ли NH
2 O – электролитом? NH
2 O – растворимость Теперь изучим, как растворители влияют на NH 2 O – растворимость.
Теперь изучим, как растворители влияют на NH 2 O – растворимость. Является ли NH
2 O – ионным или ковалентным?

