что, как сбалансировать и часто задаваемые вопросы —
By Авниш Рават
Бромоводород — распространенный химический реагент, используемый в аналитических реакциях для образования соединений промышленного значения. Исследуем химическую активность HBr и Na.2S.
HBr реагент, используемый в лабораторном синтезе броморганических соединений путем присоединения свободных радикалов. Таким образом, соединения являются сильными алкилирующими агентами. Na2S обычно встречается в виде чистого кристаллического бесцветного твердого вещества с запахом тухлых яиц.
Реакционная способность HBr и Na2S производит молекулы поглотителя кислорода, используемые при очистке воды или в качестве отбеливающих агентов в целлюлозно-бумажной промышленности. Таким образом, важные условия реакционной способности реагентов обсуждаются следующим образом.
Что является продуктом HBr и Na2S?HBr и Na2S взаимодействуют с образованием сероводорода и бромида натрия. Полная реакция представлена в виде:
Полная реакция представлена в виде:
HBr + Na2S = NaBr + H2S
Какой тип реакции HBr + Na2S?HBr + Na2S является кислотно-щелочная реакция где HBr представляет собой кислоту Бренстеда, а Na2S представляет собой основание Бренстеда, которое реагирует с образованием ионной соли NaBr.
Как сбалансировать HBr + Na2S?Приведенная ниже алгебраическая методология используется для балансировки химической реакции.
Na2S + HBr = NaBr + H2S,
- Каждый вид, присутствующий в уравнении, отмечен соответствующей переменной (A, B, C и D), чтобы проиллюстрировать неизвестные коэффициенты.
- А На2S + B HBr = C NaBr + DH2S
- Затем для решения уравнения применяется подходящая величина, коэффициент реагентов и продуктов.

- Na = 2A = C, S = A = D, H = B = 2D, Br = B = C
- Наблюдения и советы этой статьи мы подготовили на основании опыта команды Гауссово исключение методология применяется для установления всех переменных и коэффициентов, и результаты
- А = 1, В = 2, С = 2 и D = 1
- Следовательно, общее сбалансированное уравнение:
- Na2S + 2HBr = 2NaBr + H2S
HBr + Na2Система титрования S невозможна, так как Na2S — база Бренстеда, которая не может выполнять кислотно-основное титрование вместе с ХБр.
HBr + Na2S чистое ионное уравнениеЧистое ионное уравнение HBr + Na2S is
2 H+ (водный) + Na2S (с) = 2 Na+2 (вод) + H2С (г)
Наблюдения и советы этой статьи мы подготовили на основании опыта команды чистое ионное уравнение получается с помощью следующих шагов
- Напишите сбалансированное химическое уравнение и обозначьте соответственно физические состояния реагентов и продуктов
- 2 HBr + Na2S = 2 NaBr + H2S
- Итак, сильные кислоты, основания и соли диссоциируют на ионы, тогда как чистые твердые вещества и молекулы не диссоциируют.

- Таким образом, результирующее ионное уравнение имеет вид
- 2 H+ (водн.) + Na2S (с) = 2 Na+2 (вод) + H2С (г)
- Сопряженная пара кислоты HBr представляет собой Br–.
- Сопряженная пара оснований Na2S — это Na2+.
Межмолекулярные силы, действующие на HBr и Na2S составляют:
- Молекулы HBr образуют между молекулами диполь-дипольное взаимодействие и лондоновские дисперсионные силы.
- Na2S формы сильные ионная связь между молекулами Na и S.
HBr + Na2S проявляет реакцию энтальпия -274. 8 кДж/моль.
8 кДж/моль.
HBr + Na2S не может сформировать буфер потому что HBr не является слабой кислотой, а Na2S не является солью любого сопряженного основания слабой кислоты.
HBr + Na2Полная реакция?HBr + Na2S является полной реакцией, поскольку стабильные продукты (NaBr и H2S) образуются в результате реакции.
HBr + Na2S экзотермическая или эндотермическая реакция?HBr + Na2S есть экзотермическая реакция поскольку при образовании ионного соединения NaBr выделяется тепло, энтальпия реакции имеет отрицательное значение.Развитие экзотермической реакции
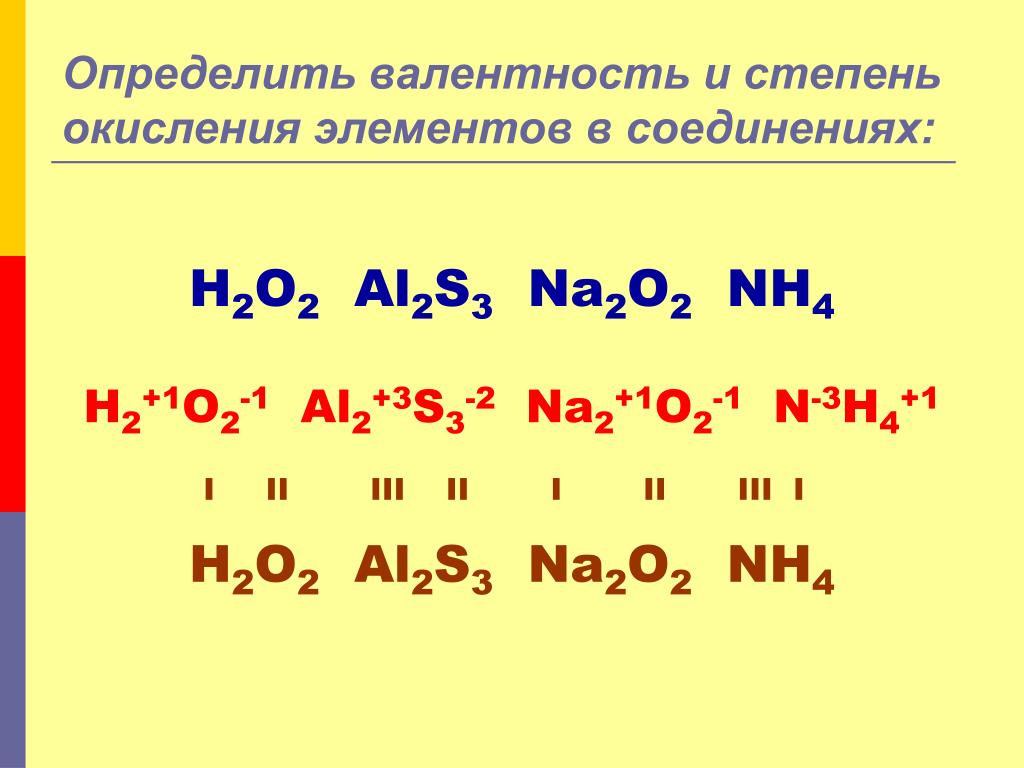
HBr + Na2S окислительно-восстановительная реакция?HBr + Na2S не окислительно-восстановительная реакция потому что реакции окисления и восстановления не протекают одновременно в процессе. Степень окисления Na, S, Cl и H остается +1 как со стороны реагента, так и со стороны продукта.
Степень окисления Na, S, Cl и H остается +1 как со стороны реагента, так и со стороны продукта.
HBr + Na2S не реакция осаждения так как соль, образующаяся в результате реакции, растворяется в HBr.
HBr + Na2Обратимая или необратимая реакция?HBr + Na2S есть необратимая реакция потому что продукты не превращаются обратно в исходные реагенты, когда условия реакции остаются неизменными.
HBr + Na2S реакция смещения?HBr + Na2S — это реакция двойного вытеснения поскольку оба анионных компонента реагентов (Br и S) замещаются соответствующей катионной частью (H и Na) с образованием новых продуктов комбинации.
ВыводыХимическая активность HBr + Na2S образуя ионную соль, NaBr представляет собой экзотермическую комбинированную реакцию с двойным замещением. NaBr представляет собой кристаллическое твердое вещество, которое кристаллизуется в кубической кристаллической решетке, подобной NaCl. NaBr действует как источник бромида в многочисленных реакциях органического синтеза.
NaBr представляет собой кристаллическое твердое вещество, которое кристаллизуется в кубической кристаллической решетке, подобной NaCl. NaBr действует как источник бромида в многочисленных реакциях органического синтеза.
Ионная связь — определение, образование и примеры
Поможем понять и полюбить химию
Начать учиться
В этом материале речь пойдет о том, что такое ионная связь и чем она отличается от других видов, которые изучают на уроках химии в 8 классе.
Общие сведения о химических связях
Давайте вспомним, как образуются химические связи. Для этого представим атом: он состоит из ядра с положительным зарядом и набора отрицательно заряженных электронов, которые располагаются на нескольких уровнях. Внешний уровень называется валентным, на нем располагаются валентные электроны. Они могут образовывать пары или быть свободными, т. е. неспаренными.
Во взаимодействии двух атомов участвуют свободные электроны внешней оболочки. Сколько таких электронов имеется у атома — столько химических связей он может образовать.
Сколько таких электронов имеется у атома — столько химических связей он может образовать.
При этом каждый атом стремится приобрести устойчивую конфигурацию — двух- или восьмиэлектронную внешнюю оболочку, подобную той, что есть у инертного газа. Атом может достичь ее, отдавая или принимая часть электронов, а также образуя общую электронную пару с другим атомом. Если в результате получается два разноименно заряженных иона, говорят об ионном типе связи. Он характерен для взаимодействия атомов металла и неметалла.
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Определение ионной связи
Рассмотрим этот тип связи на примере реакции натрия и водорода, в результате которой получается гидрид натрия. У атома натрия Na есть один свободный электрон на внешнем уровне, в то время как атому водорода H не хватает одного электрона, чтобы завершить внешнюю оболочку и принять стабильную форму. Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и получает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд. В итоге образуется два иона — катион Na+ и анион H—.
Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и получает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд. В итоге образуется два иона — катион Na+ и анион H—.
Между положительным ионом Na+ и отрицательным H— возникает электростатическое притяжение, которое и удерживает их вместе. Так образуется ионная связь в гидриде натрия.
Ионная связь — это тип химической связи, характерный для разноименно заряженных ионов, которые образовались в результате отдачи и присоединения электронов атомами. В нее вступают элементы с большой разностью электроотрицательности. Обычно так взаимодействуют атомы металла и неметалла.
Чаще всего именно так связаны в соединениях щелочные и щелочноземельные металлы с галогенами. Поскольку у щелочных металлов электроотрицательность ниже, их атомы становятся катионами, а атомы галогенов — анионами.
Механизм образования ионной связи похож на донорно-акцепторный механизм ковалентной связи. Первую даже называют крайним выражением второй.
Важно!
Соли аммония NH4NO3, NH4Cl, (NH4)2SO4 хоть и не являются соединениями металла и неметалла, но также образованы с помощью ионной связи.
Координационное число
Вернемся к нашему примеру с гидридом натрия и посмотрим на кристаллическую решетку, которую имеет это ионное соединение. Каждый ион Na+ контактирует с шестью ионами H—. Это максимально возможное для данного иона число химических связей, оно называется координационным.
Координационное число — это количество ближайших соседей иона в ионной кристаллической решетке. По сути это количество связей, которые образует каждый ион в составе сложного вещества.
Обратите внимание
При рассмотрении ковалентной химической связи говорят о валентности — она характеризует, сколько связей есть у конкретного атома с другими атомами. Но к ионным соединениям это понятие не применяют, потому что все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Но к ионным соединениям это понятие не применяют, потому что все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Примеры веществ с ионной связью
Таким же образом, как в гидриде натрия, ионы образуются и в других подобных ему соединениях. Например, в хлориде натрия NaCl атом натрия имеет один свободный электрон и отдает его атому хлора. В итоге оба завершают свой внешний уровень. Образуется ион натрия с положительным зарядом и отрицательно заряженный ион хлора.
Другой пример ионной химической связи — сульфид натрия Na2S. В данном случае у нас также есть натрий с одним свободным электроном и сера, у которой на внешнем уровне есть 2 свободных электрона из 6. Таким образом, чтобы завершить уровень и обрести стабильную форму, сере нужно 2 электрона. Поэтому в формуле сульфида серы присутствует два атома натрия.
Характеристики ионной связи
Мы узнали, как образуется ионная связь, а теперь поговорим о ее характеристиках. Она существенно отличается от других типов связи между атомами.
Ионная связь:
не направлена;
не насыщена;
не имеет кратности.
Разберемся в каждом пункте и начнем с направленности. Ковалентная полярная связь направлена, потому что она подразумевает смещение общей электронной пары к тому атому, который имеет большую электроотрицательность. В случае с ионами все иначе. Согласно закону Кулона притяжение между отрицательным и положительным ионом идет по прямой, соединяющей эти заряженные частицы. В кристаллической решетке все разноименно заряженные ионы взаимодействуют друг с другом и притяжение распределяется равномерно, поэтому говорят, что ионная связь не направлена.
А как насчет насыщаемости? Эта характеристика указывает на то, что атом может вступить в ограниченное количество химических связей, поскольку имеет ограниченное число неспаренных электронов. Но ионная связь — это не процесс соединения свободных электронов в пары, а взаимное притяжение ионов. Каждый ион может притягивать к себе неограниченное число ближайших соседей, поэтому нет смысла говорить о насыщаемости.
Из вышесказанного понятно, что ионная связь не имеет и кратности. Эта характеристика означает число общих электронных пар у атома, но в данном случае мы рассматриваем притяжение между ионами.
Физические свойства ионной связи
Между ионами в молекуле всегда образуется достаточно сильное притяжение, поэтому вещества с ионной связью в обычных условиях твердые и нелетучие. Такие соединения сложно разрушить при помощи тепловой энергии, что обуславливает высокую температуру кипения и плавления.
Свойства ионных соединений:
твердость,
хрупкость,
нелетучесть,
тугоплавкость,
растворимость в воде,
электропроводность.
Типичным веществом с ионными связями можно считать хлорид натрия NaCl или поваренную соль. Ее кристаллы в точности соответствуют всем характеристикам.
Как определить ионную связь
Чтобы быстро понять, является ли нужное нам соединение ионным, выполните следующие действия:
Посмотрите, какие элементы входят в состав соединения. Формула вещества с ионной связью должна включать металл и неметалл.
 Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.
Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.По шкале Полинга определите электроотрицательности обоих элементов соединения. Если разница между ними больше 1,7 — связь ионная. Это объясняется тем, что такой тип связи характерен для веществ, у которых сильно отличаются показатели электроотрицательности.
Дополнительным способом убедиться в правильности результата может стать оценка физических свойств вещества. Если оно имеет высокую температуру кипения или плавления и проводит электроток — связь скорее всего ионная.
Вопросы для самопроверки:
Опишите, как образуется ионная связь. Какие условия для этого необходимы?
Что такое координационное число элемента в ионном соединении?
Каковы основные физические свойства ионных соединений?
В чем разница между характеристиками ионной и ковалентной связей?
Как можно определить ионную связь, зная электроотрицательность элементов в соединении?
Яна Кононенко
К предыдущей статье
144.
Окислительно-восстановительные реакции
К следующей статье
Теория электролитической диссоциации
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Сульфид натрия – структура, свойства, использование и побочные эффекты
Сульфид натрия, или Na2S, представляет собой неорганическое химическое соединение с формулой Na2S, получившее известность в органической химической промышленности. Это сильный щелочной раствор, который пахнет тухлыми яйцами при воздействии влажного воздуха. Несмотря на то, что твердое вещество имеет желтый цвет, раствор бесцветен. Обычно в сортах он обозначается как «хлопья сульфида натрия».
Сульфид натрия представляет собой соль, которая играет важную роль в промышленности органической химии. Формула сульфида натрия – Na2S, или чаще его гидрат Na2S·9.h3O. И безводная, и водная соли представляют собой бесцветные твердые вещества. Сульфид натрия представляет собой водорастворимое соединение с сильно щелочным раствором. При экспонировании соединения во влажном воздухе Na2S и его гидраты выделяют сероводород. Эти выбросы пахнут тухлым яйцом. Твердое состояние сульфида натрия в растворе имеет желтый цвет, и он поставляется в виде сортов, известных как хлопья сульфида натрия. Название IUPAC сульфида натрия — динатрий сульфид. Степень окисления сульфида натрия равна -2, тогда как его значение рН равно 10,4.
Название IUPAC – сульфид натрия
Структура сульфида натрия – Na
2 S Na2S имеет антифлюоритную структуру. Эта структура получается путем обмена положениями анионов и катионов. Это означает, что Na+ занимает места фторида, а S2- занимают места для Ca2+.
Это означает, что Na+ занимает места фторида, а S2- занимают места для Ca2+.
(изображение будет загружено в ближайшее время)
Сульфид натрия-Na
2 S Химическая информацияNa2S | Сульфид натрия |
Плотность | 1,8 6 г/см³ |
Молекулярный вес/Молярная масса | 78,0452 г/моль |
Температура самовоспламенения | >480°C (896°F;753K) |
Температура плавления | 1176° С(2149°F) |
Химическая формула | Na2S |
Сульфид натрия – Na
2 9001 2 S – Физические свойстваЗапах | Запах тухлых яиц |
Внешний вид | Безводные желтые кристаллические вещества |
Температура хранения | 2-8°C |
pH | 10. |
Оксид номер | -2 |
Растворимость | Нерастворим в любом; мало растворим в спирте |
Химическая формула сульфида натрия | 9 0031|
Внешний вид | Бесцветное и гигроскопичное твердое вещество |
Запах сернистого натрия Тухлые яйца | |
Плотность | 1,856 г/см3, для безводного 1,58 г/см3, для пентагидрата 1,43 г/см3, для нонагидрата |
Температура плавления сульфида натрия | 1,176° С |
Растворимость | Мало растворим в спирте, нерастворим в эфирах |
Молярная масса сульфида натрия | 78,0452 г/моль |
Сила сцепления | 2/2 = 1 |
Сульфид натрия – Na
2 S – Химические свойства Сульфид натрия растворяется в воде и образует необходимые ионы. Далее идет реакция.
Далее идет реакция.
Na2S + h3O → 2 Na+ + HS– + OH–
При нагревании быстро окисляется с образованием карбоната натрия и диоксида серы.
2Na2S + 3O2 + 2CO2 → 2Na2CO3 + 2SO2
Полисульфиды образуются при взаимодействии с серой.
2Na2S + S8 → 2Na2S5
Na2S + h3O → 2 Na+ + HS- + OH-
2Na2S + 3O2 + 2CO2 → 2Na2CO3 + 2SO2
Na2S + 4 h3 O2 → 4h3O + Na2SO4
2Na2S + S8 → 2Na2S5
Как производится сульфид натрия?
В промышленности Na2S получают реакцией карботермического восстановления. В этой реакции восстановления в качестве восстановителя используется углерод.
Аналогичным образом, для сульфида натрия сульфат натрия реагирует с углем.
Na2SO4 + 2 C → Na2S + 2 CO2
В лабораториях сульфид натрия обычно получают методом восстановления. Сера натрия реагирует с безводным аммиаком или через натрий в сухом ТГФ с помощью нафталина в качестве катализатора. В результате образуется леноид нафты натрия.
Сера натрия реагирует с безводным аммиаком или через натрий в сухом ТГФ с помощью нафталина в качестве катализатора. В результате образуется леноид нафты натрия.
2NA + S → NA2S
Сульфид натрия (NA
2 S) имеет различные применения.
Используется в качестве отбеливателя в текстильной промышленности для защиты растворов проявителя от окисления в фотобизнесе.
Используется для изготовления эластомерных синтетических материалов, серных красок и других материалов.
В процессе изготовления он в основном используется в целлюлозно-бумажной промышленности. Повышает селективность процесса сульфатной варки и ускоряет процесс делигнификации.

Использование сульфида натрия
В целлюлозно-бумажной промышленности он используется в крафт-процессе.
При очистке воды используется как поглотитель кислорода.
В текстильной промышленности используется как отбеливатель.
Сульфид натрия в основном используется в целлюлозно-бумажной промышленности для крафт-процесса. Как и в крафт-процессе, древесина превращается в древесную массу, гидроксид натрия и сульфид натрия помогают растворить лигнин древесного волокна.
Это соединение используется для очистки воды. В этом методе сульфид натрия действует как поглотитель кислорода
В химической фотографии сульфид натрия используется в качестве осадителя металла для тонирования черно-белых фотографий
В текстильной промышленности сульфид натрия используется в качестве отбеливателя, дехлорирующего агента, а также десульфурирующего агента.

В производстве резиновых химикатов используются сернистые красители и другие химические соединения.
Используется в различных областях, таких как флотация руды, производство красителей, извлечение нефти и моющие средства.
Меры безопасности:
Используется в качестве средства для удаления волос в процессе известкования при производстве кожи.
Поскольку сульфид натрия является сильной щелочью, он вызывает ожоги кожи.
Когда сульфиды натрия быстро соединяются с кислотой, образуется ядовитый сероводород.
Побочные эффекты сульфида натрия
Верхний слой кожи слегка шелушится. Это нормально. Раздражение, покраснение и шелушение кожи также являются возможными побочными эффектами. Прекратите принимать это лекарство и немедленно сообщите своему врачу или фармацевту, если какой-либо из этих эффектов сохраняется или ухудшается.
Это нормально. Раздражение, покраснение и шелушение кожи также являются возможными побочными эффектами. Прекратите принимать это лекарство и немедленно сообщите своему врачу или фармацевту, если какой-либо из этих эффектов сохраняется или ухудшается.
Имейте в виду, что ваш врач прописал это лекарство, потому что он/она считает, что польза для вас перевешивает риск побочных эффектов. Большинство людей, которые принимают это лекарство, не имеют каких-либо существенных побочных эффектов.
Сульфид натрия сильно щелочной. Это может вызвать значительные ожоги кожи. При взаимодействии с кислотой может образовываться сероводород, который является высокотоксичным и легковоспламеняющимся газом. В помещениях с редуцированной вентиляцией сероводород скапливается на дне. Для использования сероводорода необходимо иметь при себе паспорт безопасности.
Na2S + 2HCl → 2NaCl + h3S(g)
Какой тип связывания сульфида натрия?
Соединение сульфида натрия представляет собой ионное соединение. На 1 атом сульфида приходится 2 атома Na. Он имеет центральный атом серы, окруженный 4 атомами кислорода в ковалентных связях. Атомы натрия и атомы серы или кислорода в соединении обмениваются своими электронами. Кроме того, сера находится в группе 6, и ей требуется еще два электрона, чтобы достичь состояния благородного газа аргона.
На 1 атом сульфида приходится 2 атома Na. Он имеет центральный атом серы, окруженный 4 атомами кислорода в ковалентных связях. Атомы натрия и атомы серы или кислорода в соединении обмениваются своими электронами. Кроме того, сера находится в группе 6, и ей требуется еще два электрона, чтобы достичь состояния благородного газа аргона.
Точно так же оставшиеся 2 атома натрия хотят потерять по 1 электрону каждый, чтобы перейти в состояние благородного газа неона. Таким образом, каждый из двух атомов натрия обеспечивает по одному электрону атому серы, помогая ему быть стабильным во внешней оболочке.
Поскольку атомы натрия отдают все свои лишние электроны своей внешней оболочке, два атома достигают конфигурации благородного газа неона и, следовательно, становятся стабильными.
Сульфид натрия: применение, взаимодействие, механизм действия
0407 заглушка и не был полностью аннотирован. В ближайшее время планируется его аннотирование.
В ближайшее время планируется его аннотирование.
- Общее название
- Сульфид натрия
- Регистрационный номер в DrugBank
- DB11159
- История вопроса
Сульфид натрия представляет собой химическое соединение с химической формулой Na 2С. Сульфид натрия используется в целлюлозно-бумажной промышленности, при очистке воды, в текстильной промышленности и в различных химических производственных процессах, включая производство резиновых химикатов, сернистых красителей и нефтедобычи. Вместе с гидратной формой сульфид натрия выделяет сероводород (h3S) при контакте с влажным воздухом. h3S является эндогенным газообразным медиатором, обладающим противовоспалительными и антиапоптотическими свойствами. Наряду с другими сульфидами противовоспалительное и тканезащитное действие сульфида натрия исследовано на моделях воспаления и окислительного стресса. Интересно, что сульфид натрия, как было показано, играет некоторую кардиозащитную роль против сердечной ишемии или реперфузионного повреждения, а также защищает легкие от повреждения легких, вызванного вентилятором 1 .
 Однако клиническое значение и механизм действия сульфида натрия, а также повторение результатов других исследований еще полностью не определены.
Однако клиническое значение и механизм действия сульфида натрия, а также повторение результатов других исследований еще полностью не определены.- Тип
- Малая молекула
- Группы
- Одобрено
- Структура
- Вес
- Среднее значение: 78,0 4
Моноизотопный: 77.95160973 - Химическая формула
- Na 2 S
- Синонимы
- Нет в наличии
- Показание
Недоступно
Сокращение количества отказов при разработке лекарств
Создание, обучение и проверка моделей машинного обучения с использованием доказательных и структурированных наборов данных .
Узнайте, как
Создавайте, обучайте и проверяйте прогнозные модели машинного обучения со структурированными наборами данных.
Узнайте, как
- Противопоказания и предупреждения Blackbox
Избегайте опасных для жизни нежелательных явлений, связанных с приемом лекарств
Улучшите поддержку принятия клинических решений с помощью информации о противопоказаниях и предупреждениях черного ящика, ограничениях для населения, вредных рисках и многом другом.

Узнать больше
Предотвращение опасных для жизни нежелательных явлений и улучшить поддержку принятия клинических решений.
Узнать больше
- Фармакодинамика
Нет в наличии
- Механизм действия
- Нет в наличии
- Абсорбция
Нет в наличии
- Объем распределения
Нет в наличии
- Связывание с белками
Нет в наличии
- Метаболизм 9041 3 Недоступно
- Путь элиминации
Недоступно
- Период полураспада
Недоступно
- Разрешение
Недоступно
- Побочные эффекты
Улучшение поддержки принятия решений и результатов исследований
Со структурированными данными о побочных эффектах, включая: предупреждений черного ящика, побочные реакции, предупреждения и меры предосторожности, а также показатели заболеваемости.

Узнать больше
Улучшите поддержку принятия решений и результаты исследований с помощью наших структурированных данных о побочных эффектах.
Узнать больше
- Токсичность
Недоступно
- Пути введения
- Недоступно
- Фармакогеномные эффекты/НЛР 9041 3 Недоступно
- Лекарственные взаимодействия
Эту информацию не следует интерпретировать без помощи поставщика медицинских услуг. Если вы считаете, что испытываете взаимодействие, немедленно обратитесь к поставщику медицинских услуг. Отсутствие взаимодействия не обязательно означает отсутствие взаимодействия.
Недоступно- Взаимодействие с пищей
- Взаимодействие не обнаружено.
Информация о лекарственных препаратах из более чем 10 регионов мира
Наши наборы данных содержат утвержденную информацию о продукте, включая: дозировку, форму, маркировщик, способ введения и период реализации.

Доступ сейчас
Получите доступ к информации о лекарственных препаратах из более чем 10 регионов мира.
Доступ сейчас
- Продукты, отпускаемые без рецепта
Название Дозировка Сила действия Способ применения 9 0615 ЭтикетировщикНачало маркетинга Конец маркетинга Регион Изображение Средство от вросшего ногтя Dr. Scholls Гель 10 мг/1 г 9003 1 ТематическийBayer Healthcare Llc. 2003-05-07 2021-02-28 США Scholls Wellness Company LLC Вросший ноготь на ноге Гель 9003 4 1 г/10 г Местное применение Scapa Tapes North America, LLC 01.01.2021 Неприменимо US Scholls Wellness Company LLC Вросший ноготь на ноге Гель 1 г/10 г Местное Scholls Wellness Company ООО 01.  01.2021
01.2021Неприменимо США Суфид натрия Гель 0,085 г/8,5 г Местное применение Walgreens 01.03.2018 Неприменимо 9 0031 СШАСуфид натрия Гель 0,085 г/8,5 г Местно CVS Health 22.05.2017 02.10.2017 9003 1 US
- Категории лекарств
- Анионы
- Электролиты
- Сероводород
- Ионы
- Соединения серы
- Химическая таксономия Предоставлено Classyfire
- Описание
- Это соединение принадлежит к классу неорганических соединений, известных как сульфиды щелочных металлов. Это неорганические соединения, содержащие атом серы со степенью окисления -2, в которых самый тяжелый атом, связанный с кислородом, представляет собой щелочной металл.

- Королевство
- Неорганические соединения
- Суперкласс
- Смешанные соединения металлов и неметаллов
- Класс
- Органиды щелочных металлов
- Подкласс
- Алка сульфиды металлов
- Прямые исходные вещества
- Сульфиды щелочных металлов
- Альтернативные исходные вещества
- Неорганические сульфиды / Неорганические соли натрия
- Заместители
- Сульфид щелочного металла / Неорганическая соль / Неорганическая натриевая соль / Неорганический сульфид
- Молекулярный каркас
- Недоступно
- Внешние дескрипторы
- неорганическая натриевая соль, сульфидная соль (CHEBI:76208)
- Пораженные организмы
- Недоступно
- UNII
- YGR27ZW0Y7
- Номер CAS
- 1313 -82-2
- ИнЧИ Ключ
- ГРВФОГОЕДУУМБП-УХФФФАОЙСА-Н
- ИнЧИ
ИнЧИ=1S/2Na.S/q2*+1;-2
- Название ИЮПАК
динатрия сульфандиид
- СМАЙЛС
[Na+].




 Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.
Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная. 4
4

 Однако клиническое значение и механизм действия сульфида натрия, а также повторение результатов других исследований еще полностью не определены.
Однако клиническое значение и механизм действия сульфида натрия, а также повторение результатов других исследований еще полностью не определены.


 01.2021
01.2021