Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
»,сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г.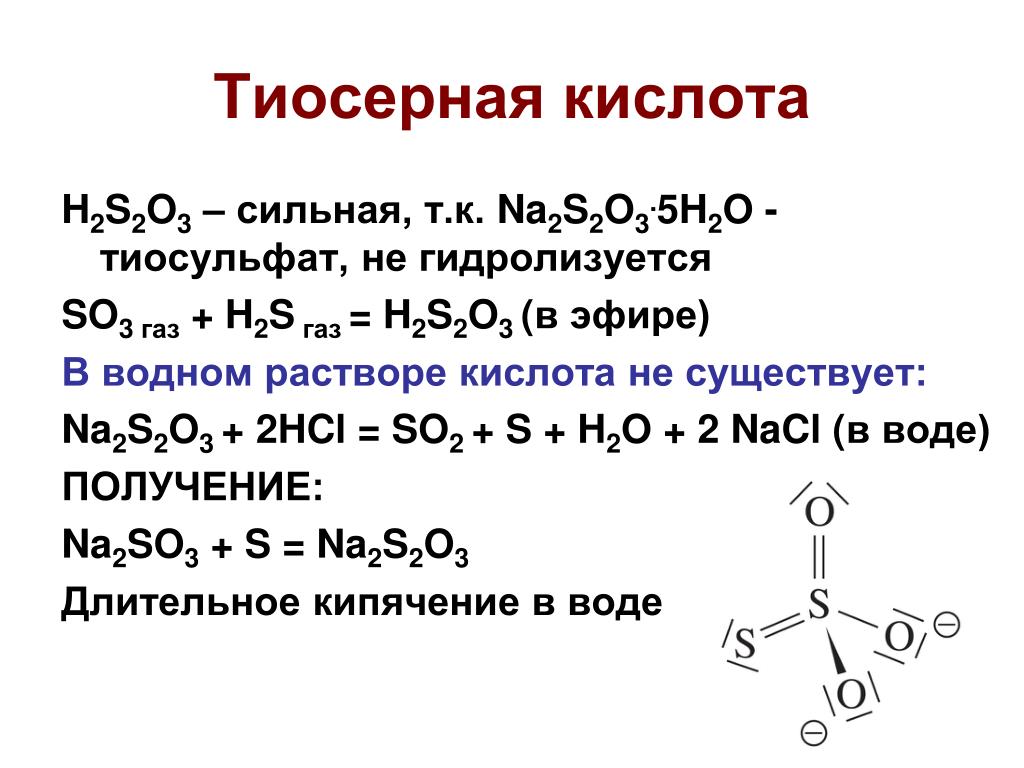 №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
№1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.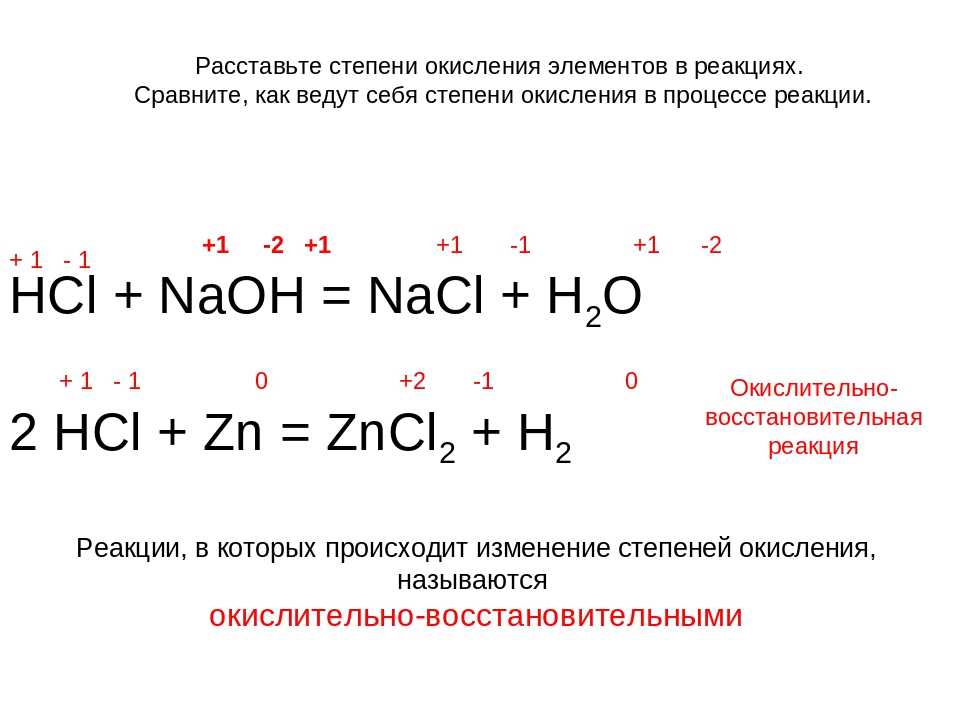 07.2016.
07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
What, How To Balance & FAQs – Lambda Geeks
HCl и Na2S2O3 are the chemical names of hydrochloric acid and sodium thiosulfate. Here, we are discussing the chemical reaction within HCl and Na2S2O3 соединения.
Hydrochloric acid is a strong acid composed of two elements i.e. hydrogen atom and chlorine atom. Тиосульфат натрия is an inorganic salt and is composed of mainly three elements i.e. 2 sodium atoms, 2 sulfur atoms, and 3 oxygen atoms.
In this article, we learn about the balanced equation, product, intermolecular forces, titration, enthalpy, net ionic equation, and many more facts with some FAQs on HCl + Na2S2O3 химическая реакция.
Что является продуктом HCl и Na
2S2O3?The product of HCl + Na2S2O3 is хлористый натрий (NaCl), water (H2O), sulfur dioxide gas (SO2), а также расширение сера (S) metal.
Na2С2О3 + 2 HCl → 2 NaCl + H2О + ТАК2 + S
Какой тип реакции HCl + Na
2S2O3?HCl + Na2S2O3 is a disproportionate or dismutation reaction.
Как сбалансировать HCl + Na
2S2O3?HCl + Na2S2O3 chemical reaction is balanced with the help of the following steps:
- The unbalanced reaction of HCl + Na2S2O3 дается ниже:
- Na2С2О3 + HCl → NaCl + H2О + ТАК2 + S
- We have to multiply HCl on the left-hand side by 2, so we get.
- Na2С2О3 + 2 HCl → NaCl + H2О + ТАК2 + S
- Later we have to multiply Na2S2O3 on the right-hand side by 2, and мы получаем.

- Na2С2О3 + 2 HCl → 2 NaCl + H2О + ТАК2 + S
HCl + Na
2S2O3 титрованиеHCl + Na2S2O3 реакция титрование experiment is done to determine the rate of reaction by applying different concentrations of Na2S2O3 treated with HCl.
Устройство:
- 5 – 100 ml beakers
- 2 – 50 or 100 ml Graduated cylinders.
- 5 – 10 ml Graduated cylinders
- Перманентный маркер
- Lightbox or overhead projector
- Timer or stopwatch
- Стержни для перемешивания
Химические вещества:
- 25 ml, 2 molars, Hydrochloric acid solution
- 150 ml, 0.15 molar, Sodium thiosulfate solution.

- Deionized or distilled water
Процедура:
- Label the entire five 100 ml beakers as 1 to 5 and clean the bottom of every beaker.
- Make a large “X” at the bottom of the beaker and place it on the stage of the lightbox or projector, so the X can be visible.
- Using a separate graduated cylinder, add the 0.15M Na2S2O3 solutions in each of the five beakers as 1 – 50 ml, 2 – 40 ml, 3 – 30 ml, 4 – 20 ml, and 5 – 10 ml.
- Later add the distilled water in the same five beakers 1 – 0 ml, 2 – 10 ml, 3 – 20 ml, 4 – 30 ml, and 5 – 40 ml.
- Now, evaluate the Na2S2O3 final concentration in each beaker from 1 to 5.
- Note the values of volume of Na2S2O3 in a beaker, concentration of Na2S2O3, distilled water volume, reaction time in seconds, and 1/reaction time i.
 e. reaction rate.
e. reaction rate. - Take 5 ml of 2 M HCl solution in each five 10 ml graduated cylinders.
- Add the 5 ml HCl solution in each of the 5 beakers containing Na2S2O3 and distilled water solution, stir it with a stirring rod and immediately start the stopwatch.
- Stop the timer if the “X” on the beaker is not visible. Note the reaction time (sec) and repeat the same procedure with 2 to 5 beakers.
- Calculate the reaction rate for each trial and plot two separate graphs against concentration Vs reaction time and concentration Vs reaction rate.
HCl + Na
2S2O3 чистое ионное уравнение- Игровой автомат чистое ионное уравнение для HCl + Na2S2O3 chemical reaction is.
- 2Na+ + S2O3– + 2H+ + 2Cl– → 2На+ + 2Cl– + H2О + ТАК2 + S
- Cancel the same moieties on both sides we get.

- S2O3– + 2H+ → Н2О + ТАК2 + S
HCl + Na
2S2O3 сопряженные парыHCl + Na2S2O3 is a conjugate pair as HCl donates its proton and acts as conjugate acid, while Na2S2O3 accepts a proton and forms NaCl thus acting как сопряженное основание.
HCl и Na
2S2O3 межмолекулярные силыThe intermolecular forces shown by HCl and Na2S2O3 находятся,
- HCl = dipole-dipole and London dispersion force.
- Na2S2O3 = ионно-дипольная межмолекулярная сила.
HCl + Na
2S2O3 энтальпия реакции- Реакция энтальпия of the HCl + Na2S2O3 reaction is -338.
 916 kJ/mol.
916 kJ/mol. - Enthalpy of HCl is = −92.3 kJ/mol
- Энтальпия Na2S2O3 is = −586.2kJ/mol
- Enthalpy of NaCl is = -821.98 kJ/mol
- Enthalpy of H2O is = -241,826 kJ/mol
- Enthalpy of SO2 is = −296.81kJ/mol
- Enthalpy of S is = −395. 8kJ/mol
- Reaction enthalpy (∆H) of HCl + Na2S2O3 = Enthalpy of product – enthalpy of reactant
- (∆H) of HCl + Na2S2O3 = -1017.416 kJ/mol – (-678.5) kJ/mol
- (∆H) of HCl + Na2S2O3 = -338.916 кДж/моль
HCl + Na
2S2O3 буферный раствор?HCl + Na2S2O3 is not a buffer solution, because the buffer solution is only formed between weak acid and weak base. HCl is a strong acid and Na2S2O3 это соль.
HCl is a strong acid and Na2S2O3 это соль.
HCl + Na
2S2O3 полная реакция?HCl + Na2S2O3 is not a complete reaction as it is not a reversible reaction and cannot achieve equilibrium.
HCl + Na
2S2O3 экзотермическая или эндотермическая реакция?HCl + Na2S2O3 is an exothermic reaction because it has the negative value of enthalpy of formation. The HCl shows exothermic and Na2S2O3 shows endothermic reaction as it is a salt.
HCl + Na
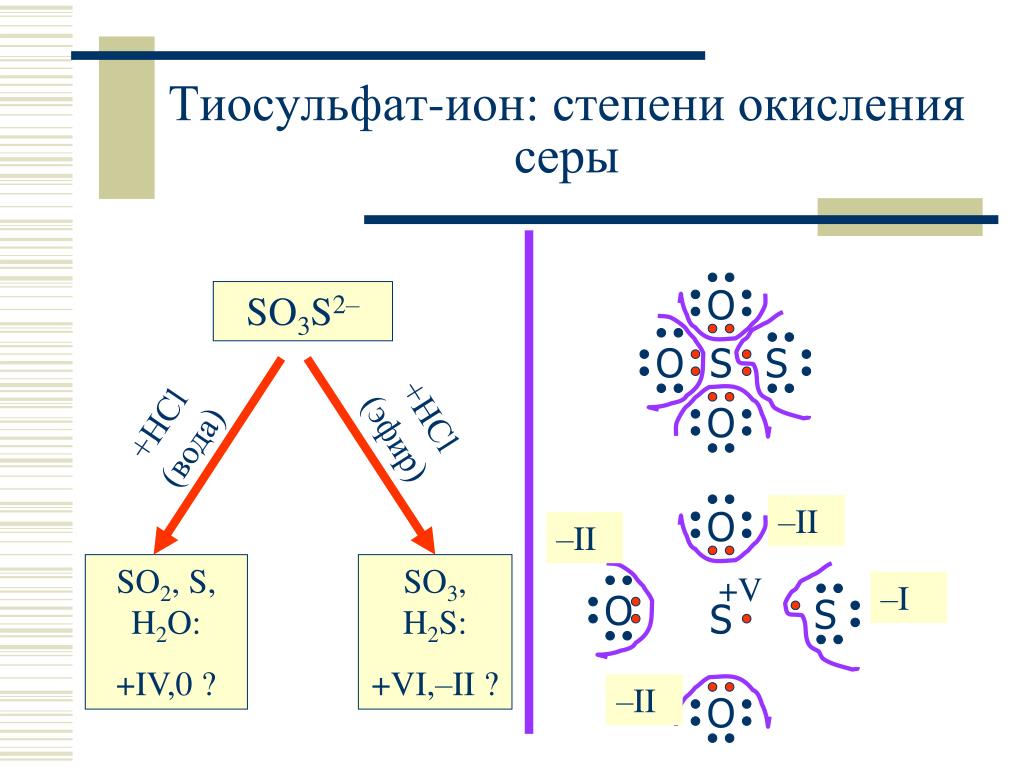
2S2O3 окислительно-восстановительная реакция?HCl + Na2S2O3 is a redox reaction because the oxidation number of sulfur gets changed in the reactant and product.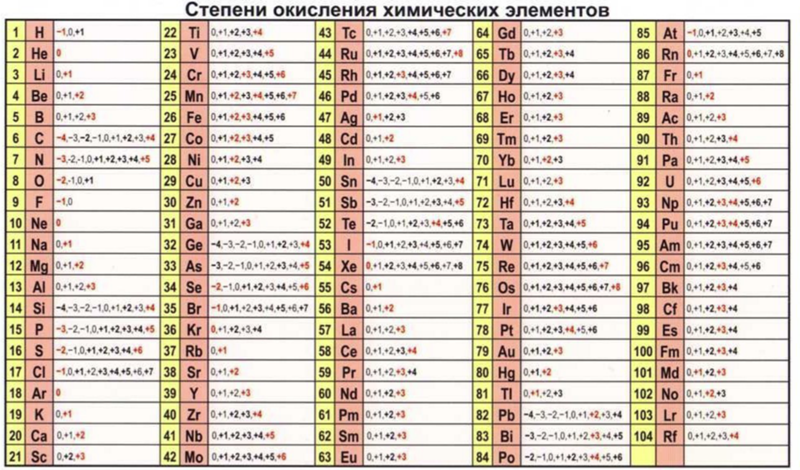 The oxidation number of the S atom in Na2S2O3 is +2, in SO2 is +4, and in sulfur, metal is zero. This is a form of disproportionate reaction.
The oxidation number of the S atom in Na2S2O3 is +2, in SO2 is +4, and in sulfur, metal is zero. This is a form of disproportionate reaction.
HCl + Na
2S2O3 реакция осаждения?HCl + Na2S2O3 is a precipitation reaction because the sulfur metal gets precipitated as a product in the reaction.
HCl + Na
2S2O3 обратимая или необратимая реакция?HCl + Na2S2O3 is an irreversible reaction because in this reaction the product cannot give back the reactants.
HCl + Na
2S2O3 реакция смещения?HCl + Na2S2O3 is a double displacement reaction and not a single displacement reaction. In this reaction, the atoms get exchanged and none of the atoms get displaced with other higher reactive atoms.
Как сбалансировать Na
2S2O3 + КМnО4 + HCl = Na2SO4 + MnCl2 + КСl + Н2O?The steps to the balanced chemical equation of the Na2S2O3 + КМnО4 + HCl reaction are given below.
- Add 5 on LHS and RHS to make the balanced Na atoms we get.
- 5Na2S2O3 + KMnO4 + HCl → 5Na2SO4 + MnCl2 + КСl + Н2O
- Then add 2 on LHS and RHS to balance the K, Mn, and Cl atoms we get.
- 5Na2S2O3 + 2KMnO4 + HCl → 5Na2SO4 + 2MnCl2 + 2KCl + H2O
- Finally, add 6 before HCl and 3 before h3O to balance all atoms of the equation we get.

- 5Na2SO3 + 2KMnO4 + 6HCl → 5Na2SO4 + 2MnCl2 + 2KCl + 3H2O
Как сбалансировать К
2Cr2O7 + На2S2O3 + HCl = KCl + Na2SO4 + CrCl3 + H2O?The balanced chemical equation of the K2Cr2O7 + Na2S2O3 + HCl reaction is given below.
- Add 3 on LHS and RHS to balance the Na atoms on both sides we get.
- K2Cr2O7 + 3Na2S2O3 + HCl → KCl + 3Na2SO4 + Циклический3 + H2O
- Then add 2 on RHS before KCl and Циклический3 and 8 on LHS before HCl we get.

- K2Cr2O7 + 3Na2S2O3 + 8HCl → 2KCl + 3Na2SO4 + 2Циклический3 + H2O
- Finally, add 4 before H2O to balance the whole equation we get.
- K2Cr2O7 + 3На2SO3 + 8HCl → 2KCl + 3Na2SO4 + 2CrCl3 + 4ч2O
Вывод:
HCl + Na2S2O3 reaction forms the products NaCl, H2О, ТАК2, and S metal. It is a double-displacement, redox, and precipitation reaction. It shows an irreversible exothermic reaction. It cannot form a buffer solution and has a reaction enthalpy value of -338.916 kJ/mol.
Два атома серы в $N{a_2}{S_2}{O_3}$ имеют: (A) степени окисления $ — 2$ и $ + 4$ (B) степени окисления $ + 4$ и $ + 6$ (C ) $ + 6$ и $
Ответ
Проверено
171,9 тыс. + просмотров
+ просмотров
Подсказка: Степень окисления определяется как общее количество электронов, потерянных или полученных для образования химической связи с другим атомом. В тиосульфате натрия присутствуют два атома серы. Два типа серы присутствуют в разных формах, т.е. координируют связи между акцепторным атомом серы и центральным атомом серы, из-за чего их степени окисления различны, что необходимо выяснить.
Полный ответ:
Нам дали тиосульфат натрия, имеющий химическую формулу $N{a_2}{S_2}{O_3}$ . Нарисуем структуру тиосульфата натрия
Структура выглядит следующим образом
Здесь мы видим, что существует два типа атома серы, такие как акцепторный атом серы, в котором существует координационная связь между серой. Таким образом, степень окисления акцепторного атома серы $-2$.
И мы должны найти степень окисления другого атома серы.
Пусть степень окисления центрального атома серы в тиосульфате натрия равна x
Тогда мы знаем, что сумма всех степеней окисления составляющих атомов равна нулю. Тогда мы получаем следующее
Тогда мы получаем следующее
$2( + 1) + 3( — 2) + x + 1( — 2) = 0$
$ \Rightarrow x = + 6$
Здесь в уравнении степень окисления акцептора координатной связи атом серы равен $ — 2$
Следовательно, степень окисления атомов серы в $N{a_2}{S_2}{O_3}$ равна $ — 2$ и $ + 6$.
Следовательно, правильный ответ — вариант C.
Примечание:
Когда координационная связь образуется между двумя одинаковыми электроотрицательными элементами, то элемент-донор электронов проявляет степень окисления $ + 2$. Электронодонорный элемент имеет степень окисления $-2$. Кроме того, координатная связь несет два электрона, поэтому акцепторный атом серы имеет заряд $-2$.
Недавно обновленные страницы
Большинство эубактериальных антибиотиков получают из биологии Rhizobium класса 12 NEET_UG
Саламиновые биоинсектициды были извлечены из биологии класса A 12 NEET_UG
Какое из следующих утверждений относительно бакуловирусов класса 12 биологии NEET_UG
Канализационные или городские канализационные трубы не должны быть непосредственно классом биологии 12 NEET_UG
Очистка сточных вод осуществляется микробами A Микробы B Удобрения класса 12 биологии NEET_UG
Ферментная иммобилизация активный фермент класса 12 биологии NEET_UG
Большинство эубактериальных антибиотиков получают из биологии класса 12 ризобий NEET_UG
Саламиновые биоинсектициды были извлечены из биологии класса А 12 NEET_UG
Какое из следующих утверждений относительно бакуловирусов класса 12 биологии NEET_UG
Канализационные или городские канализационные трубы не должны быть непосредственно классом биологии 12 NEET_UG
Очистка сточных вод осуществляется микробами A Микробы B Удобрения класса 12 биологии NEET_UG
Ферментная иммобилизация активный фермент, класс 12, биология NEET_UG
Актуальные сомнения
Студенты также читают
Сера и ее аллотропные формы
Атомы и молекулы
диоксид серы-SO₂
Разница между элементами и атомами
Электронная конфигурация атомов и ионов
Элементы P-блока
2,4-динитрофенилгидразин
Изучение.
Знакомство с элементами p-Block
Почему у нас два глаза?
неорганическая химия. Окисление тиосульфата натрия йодом
спросил
Изменено 3 года, 11 месяцев назад
Просмотрено 8к раз
$\begingroup$
При взаимодействии $\ce{Na2S2O3}$ с $\ce{I2}$ происходит окислительно-восстановительная реакция по типу
$$\ce{2 Na2S2O3 + I2 -> Na2S4O6 + 2 NaI}$$
Сера окисляется из состояния $+2$ в состояние $+2,5$. Почему он не окисляется дальше, скажем, до $3+$, с образованием соединения типа $\ce{Na2HSO3}$?
Я заметил, что в уравнении не участвует водород, но, может быть, реакция происходит в кислой среде?
Может ли кто-нибудь сказать мне, возможен ли описанный выше сценарий и почему?
- неорганическая химия
- редокс
- титрование
$\endgroup$
$\begingroup$
Будет ли соединение $\ce{X}$ восстанавливаться/окисляться и в какой степени, в основном определяется соответствующим окислительно-восстановительным потенциалом данной среды.



 e. reaction rate.
e. reaction rate.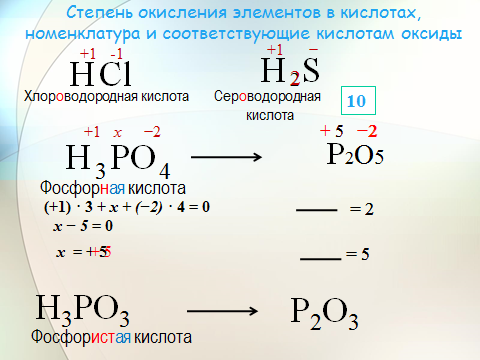
 916 kJ/mol.
916 kJ/mol.
