Самостоятельная работа 1 вариант 1) Определите степень окисления в веществах: NO2, SO3, MgCl2, Na2SO4, KClO4, 2) Напишите формулы веществ: оксид
Нажмите для полного просмотра!
Вы можете ознакомиться и скачать Самостоятельная работа 1 вариант 1) Определите степень окисления в веществах: NO2, SO3, MgCl2, Na2SO4, KClO4, 2) Напишите формулы веществ: оксид . Презентация содержит 11 слайдов. Презентации для любого класса можно скачать бесплатно. Если материал и наш сайт презентаций Вам понравились – поделитесь им с друзьями с помощью социальных кнопок и добавьте в закладки в своем браузере.
Слайды и текст этой презентации
Слайд 1
Описание слайда:
Самостоятельная работа 1 вариант 1) Определите степень окисления в веществах: NO2, SO3, MgCl2, Na2SO4, KClO4, 2) Напишите формулы веществ: оксид натрия, сульфид железа (III), хлорид цинка, нитрид магния, оксид фосфора (V)
Слайд 2
Описание слайда:
Основные классы неорганических соединений
Слайд 3
Описание слайда:
ОКСИДЫ
Слайд 4
Описание слайда:
Na2O, P2O5, CaO, Al2O3, SO3 Рассмотрите формулы веществ, представленных выше, что в них общего? Сколько химических элементов входит в состав этих веществ? Дайте определение классу этих
Слайд 5
Описание слайда:
Оксиды – это соединения, состоящие их двух химических элементов, одним из которых является кислород.
Слайд 6
Описание слайда:
Основные правила современной номенклатуры: = + +
Слайд 7
Описание слайда:
Из предложенных формул выпишите в столбик формулы оксидов, дайте им названия. Na2O, KOH, Cu2O, HCl, P2O5, NaNO3, CaO, Fe(OH)3, Al2O3, Ca3(PO4)2, h3CO3, SO3, CuO, Fe2O3, MgCl2
Слайд 8
Описание слайда:
По названиям написать формулы веществ: Оксид углерода (II) Оксид калия Оксид кремния Оксид железа (II) Оксид азота (V) Оксид цинка Оксид фосфора (III) Оксид водорода
Слайд 9
Описание слайда:
Слайд 10
Описание слайда:
Домашнее задание Параграф 18 Упражнения Определения и правила номенклатуры знать наизусть
Слайд 11
Описание слайда:
Решение задач
Какой объем займут 66г оксида углерода (IV) при н. у.? Какому количеству вещества соответствует данная масса? Сколько молекул углекислого газа содержится в этом объеме? Сколько атомов каждого элемента содержится в данном объеме?
Рассчитайте число молекул, содержащихся в 3,4г аммиака?
у.? Какому количеству вещества соответствует данная масса? Сколько молекул углекислого газа содержится в этом объеме? Сколько атомов каждого элемента содержится в данном объеме?
Рассчитайте число молекул, содержащихся в 3,4г аммиака?
Теги Самостоятельная работа 1 вариант 1) Определите степень окисления в веществах: NO2, SO3, MgCl2, Na2SO4, KClO4, 2) Напишите формулы веществ: оксид
Похожие презентации
Презентация успешно отправлена!
Ошибка! Введите корректный Email!
4. Валентность. Степень окисления химических элементов
Тема № 4. Валентность химических элементов. Степень окисления химических элементов Рекомендованные видеоуроки Валентность химических элементов Степень окисления Валентные возможности углерода Валентные возможности азота Дополнительные видеоуроки, рекомендованные к просмотру Валентные возможности атомов химических элементов Теоретический материал Валентность химических элементов Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле. Валентные возможности атома определяются числом: — неспаренных электронов; — неподеленных электронных пар; — вакантных валентных орбиталей. Правила определения валентности элементов в соединениях 1. Валентность водорода принимают за I (единицу). 2. Кислород в своих соединениях всегда проявляет валентность II. 3. Высшая валентность равна номеру группы. 4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 — № группы. 5. Валентность может быть постоянной или переменной. 6. Валентность простых веществ не равна нулю. Исключение VIII группа главная подгруппа (благородные газы). Валентность элементов не имеет знака. У металлов, находящихся в главных подгруппах, валентность равна номеру группы. У неметаллов в основном проявляются две валентности: высшая и низшая. Пример.
Сера (S) имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор (P) проявляет валентности V и III. Запомни!!! В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. НО!!! СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления +2 HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления +5 Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна +1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II. N2h5 (гидразин) — валентность азота равна III, а степень окисления равна +2. H2I, N2III, O2II, F2I, Cl2I, Br2I, I2I, а степени окисления равны 0. Степень окисления химических элементов Степень окисления – это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента). Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд. Различие понятий степень окисления и валентность Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления. Определение степени окисления конкретного химического элемента Степень окисления простых веществ всегда равна нулю!!! Элементы с постоянной степенью окисления Степень окисления = +№ группы I группа главная подгруппа степень окисления +1. II группа главная подгруппа степень окисления +2. III группа главная подгруппа (бор, алюминий) степень окисления равна +3. Исключения: 1. Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления +1, за исключением Si+4H4—, B2+3H6—, B+3H3—, где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1 (Na+H—, Ca+2h3—). 2. Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2+O2—, Na2+O2—, Ba+2O2— и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2+F2—, O+2F2—. 3. Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе). 4. Серебро (Ag) имеет постоянную степень окисления +1 (хотя расположен в I группе побочной подгруппе). 5. Цинк (Zn) имеет постоянную степень окисления +2 (хотя расположен во II группе побочной подгруппе).
Все остальные элементы (за исключением VIII группы главной подгруппы). Для элементов главных подгрупп: Высшая степень окисления: +№ группы. Низшая степень окисления: +№ группы — 8. Промежуточная степень окисления: +№ группы — 2. Пример: Фосфор (P): Высшая степень окисления: +5. Низшая степень окисления: -3 Промежуточная степень окисления: +3 Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
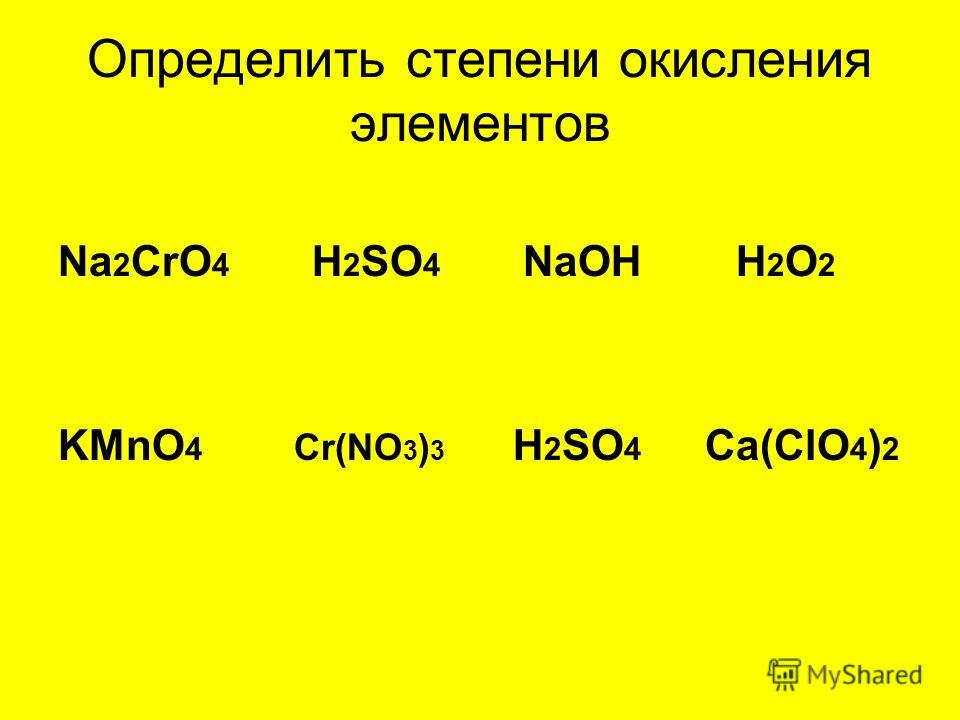
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю. Примеры определения степеней окисления в сложных веществах Пример: Задание. Определите степени окисления всех элементов в соединение N2O5 Решение. В молекуле N2O5 более электроотрицательным является атом кислорода, следовательно, он находится в своей низшей степени окисления -2, а атом азота имеет степень окисления +5. Пример: Задание. Определите степени окисления всех элементов в соединение Na2SO4. Решение. Степень окисления натрия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать. Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + х + 4(-2) = 0. Отсюда х = +6. Пример: Задание. Определите степени окисления всех элементов в соединение K2Cr2O7. Решение. Степень окисления калия равна +1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Хром — это элемент VI группы побочной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать. Степень окисления серы (Cr) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*(+1) + 2*х + 7(-2) = 0. Отсюда х = +6. Использованные интернет-источники https://sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no12-valentnost-himiceskih-elementov http://kakimenno.ru/obrazovanie-i-nauka/srednee-obrazovanie/2607-kak-opredelit-stepen-okisleniya-elementa.html http://westud.ru/opredelyat-valentnost-ximicheskix-elementov/ http://www.tutoronline.ru/blog/chto-takoe-valentnost |
Какова степень окисления серы в молекуле Na(2)SO(4)?
RESONANCE ENGLISH-P BLOCK ELEMENTS-B. L.E
L.E
РЕКЛАМА
Ab Padhai karo bina ads ke
Khareedo DN Про и дехо сари видео бина kisi ad ki rukaavat ke!
Ответить
Пошаговое решение, разработанное экспертами, чтобы помочь вам в решении вопросов и получении отличных оценок на экзаменах.
Стенограмма
привет всем рядом вопрос в том, какова степень окисления серы в любой молекуле 2 S o4 Sohail данное нам соединение необходимо написать любой 2 S o4 так что мы должны найти атомную степень окисления Степень окисления серы в допустимой степени окисления серы BF night Sohail мы знаем, что кислород имеет заряд -2, а натрий X + 1 Soi умножается на плюс один, потому что здесь присутствует атом натрия, поэтому это X + 4 в минус 2 и весь заряд этого соединения нейтрален, поэтому он равен нулю 2 + X — 8 равен нулю х минус 6 равен нулю отсюда значение х плюс 6, которое было степенью окисления серы плюс возбуждение соединение 9(2-)
30708486
इसकी गणना करने के लिए प्रयुक्त नियमो का उल्लेख ख ख Na2S, Na2SO3, Na2SO4, Na2S2O3 तथा Na2S4O6 में S की ऑक्सीकरण संख्या की गान। की गान।
110395836
Степень окисления серы Na2S2O4 равна
127322739
Какая средняя степень окисления серы в продукте, образующемся в данной реакции? Na_(2)SO_(3)+Na_(2)S+I_(2) до . . . .+NaI
. . .+NaI
140291758
Сбалансируйте следующие уравнения методом степени окисления 9(2-) ?
637909070
Что такое степень окисления? Укажите рабочие правила, используемые для расчета степени окисления атома в данном веществе. Рассчитайте степень окисления S в Na_(2)S,Na_(2)SO_(3),Na_(2)SO_(4),Na_(2)S_(2)O_(3) и Na_(2)S_( 4)О_(6) .
643550124
Какая средняя степень окисления серы в продукте, образующемся в данной реакции?
Na2SO3+Na2S+I2→….+NaI
644084529
Какая средняя степень окисления серы в продукте, образующемся в данной реакции?
Na2SO3+Na2S+I2→….+NaI
644087692
Какова степень окисления серы в молекуле Na2SO3?
644531486
Точка NCERT | Собственный капитал знаменитостей, биография Википедия
by NCERT Point Team
Ответ
+1
После этого можно задаться вопросом, как определить степень окисления Na2SO4.

Например, соединение Na2SO4 имеет два атома натрия (Na), каждый из которых имеет заряд окисления плюс 1, что дает общую степень окисления плюс 2. Сложите все степени окисления для всех соединений, которые имеют были идентифицированы. Вычтите сумму суммированных значений из общей суммы заряда соединения. Например, реакция Na2SO4, Na2 дает 2 (плюс 1) + 4 (минус 2) = минус 6 после завершения реакции.
Далее следует вопрос о степени окисления S в na2so3.
Следовательно, степень окисления серы равна +4 (она потеряла четыре электрона на кислород), а степени окисления нашей молекулы таковы: +4 (сера потеряла четыре электрона на кислород). Na — положительное число; S — положительное число; и O является отрицательным числом. Если вы хотите выполнить это алгебраически, вы можете создать уравнение с решением, равным нулю.
Что приводит нас к вопросу о степени окисления S в na2s4o6.
+2,5
Что касается S в k2so4, какова степень окисления S?
Решено: Степень окисления серы для K2SO4 равна +2 +4 +6.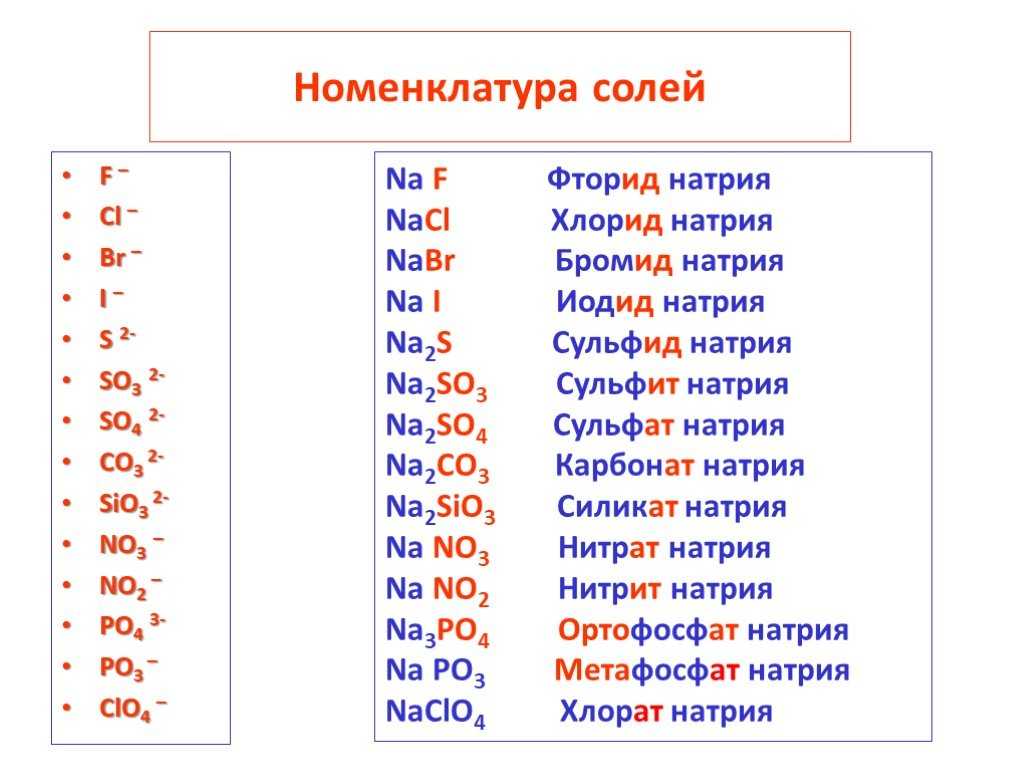 Chegg.com.
Chegg.com.
Найдено 31 связанный вопрос и ответ.
По какой формуле рассчитывают окисление?
Есть только один ответ. В случае свободного элемента степень окисления всегда равна нулю. Заряд одноатомного иона равен количеству окислительных электронов в ионе. Это правда, что степень окисления водорода равна единице, но это отрицательное число в паре с меньшим количеством электроотрицательных элементов. Пероксиды имеют степень окисления -1, в то время как степень окисления O в соединениях обычно равна -2.
Какова степень окисления n2 в этом уравнении?
Из-за того, что молекулярный азот (N) имеет нулевую степень окисления, он считается нейтральной молекулой. В результате, поскольку молекула состоит из двух атомов азота, оба из которых должны находиться в одной и той же степени окисления, каждый из атомов азота также имеет степень окисления, равную нулю.
Можно ли определить степень окисления элемента?
Степень окисления, обычно известная как степень окисления, представляет собой общее количество электронов, которые атом получает или теряет, чтобы установить химическую связь с другим атомом. Рассчитывается как
Рассчитывается как
Степень окисления SO2 соответствует ожидаемой.
Степень окисления серы в SO2 является положительным числом. Чтобы рассчитать эту степень окисления, необходимо понимать, что сумма степеней окисления атомов в соединениях, которые являются нейтральными, должна быть равна нулю, чтобы быть точным. Степень окисления кислорода в молекуле диоксида серы (SO2) – отрицательное число.
Что такое na2so?
Сульфид натрия (или сульфит натрия) с химической формулой Na2SO3 представляет собой натриевую соль сернистой кислоты (сульфит), растворимую в воде. Он также производится как побочный продукт очистки от диоксида серы, которая проводится как часть процесса десульфурации дымовых газов.
Что касается фосфора, какова степень окисления h4po4?
Из раздела (b) мы знаем, что степень окисления атомов фосфора в h4PO4 является положительным числом.
Какова степень окисления S в na2s2o6 и почему она важна?
Сера S имеет степень окисления +5.
Каков заряд na2so4 в батарее?
Сульфат натрия представляет собой ионное соединение, созданное реакцией двух ионов, натрия Na+ и сульфата SO24, с образованием соединения. Заряды этих двух многоатомных ионов должны быть равными и противоположными, чтобы они могли образовать связь. В результате потребуется два иона натрия +1, чтобы противодействовать действию одного иона сульфата -2.
Какова химическая формула na2s4o6?
Он состоит из оксоаниона серы, S. 4O 2 6, который образуется в результате реакции тетратионовой кислоты, h3S4O6, с атомами серы. Примерно половина атомов серы, присутствующих в ионе, находится в степени окисления 0, а другая половина — в степени окисления +5 соответственно.
Что касается cuso4, какова степень окисления серы?
Например, при рассмотрении иона SO42- степень окисления атома серы должна быть +6, так как сумма степеней окисления атомов в этом ионе должна равняться -2.




 Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов. 

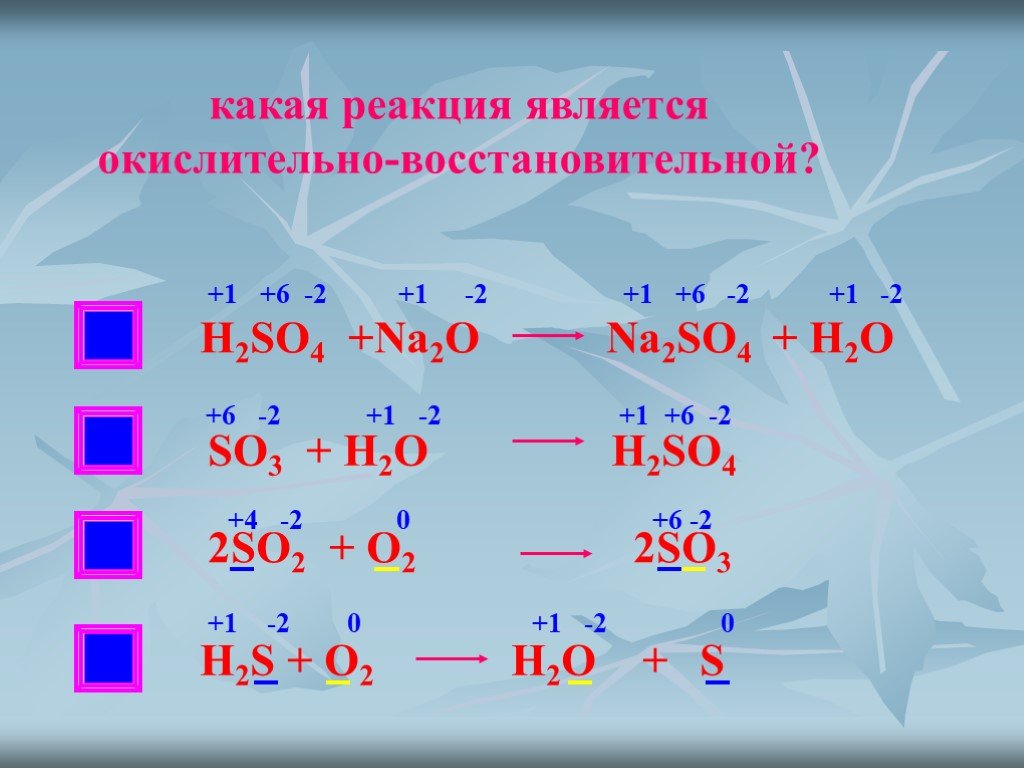 Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.
Полученная алгебраическая сумма степеней окисления будет равняться нулю: 2*(+5) + 5*(-2) = 0.