Допишите сокращённое ионное уравнение химической реакции:NaCl+AgNO3
Согласно теории электролитической диссоциации, реакции в водных растворах электролитов протекают лишь между ионами. Такие реакции изображают в виде ионных уравнений.
Записывая ионное уравнение реакции, следует помнить, что в виде молекул здесь можно указывать лишь:
- малодиссоциированные соединения, например воду Н2О;
- малорастворимые вещества (осадки), обозначаемые символом «↓»;
- газообразные вещества, обозначаемые знаком «↑».
Остальные же вещества, являющиеся сильными растворимыми электролитами, принято записывать в виде ионов. При этом, суммарные электрические заряды, в левой и правой частях уравнения, должны быть одинаковыми.
Электролитическая диссоциация исходных веществ
Итак, в условии задания, в качестве исходных реагентов даны молекула поваренной соли (хлорида натрия) NaCl и молекула нитрата серебра AgNO3. Если открыть таблицу «Растворимость солей, кислот и оснований в воде», расположенную в конце учебника химии, можно выяснить, что оба эти вещества растворимы в воде.
Следовательно, их диссоциация в водном растворе будет происходить следующим образом:
(Na+Cl—)0 ⇄ Na+ + Cl— ;
Ag+(NO3)— ⇄ Ag+ + (NO3)—.
Как видите, оба эти процесса обратимы.
Ионные уравнения реакции
Поскольку речь в задании идет о реакции обмена, происходящей между двумя солями в водном растворе – продуктами данной реакции станут NaNO3 – нитрат натрия и хлорид серебра AgCl. Проверим растворимость этих соединений по таблице растворимости.
Как видно из таблицы, нитрат натрия, как и другие соли натрия, хорошо растворим в воде, а хлорид серебра – соединение нерастворимое. Запишем молекулярное и полное ионное уравнения этой реакции:
NaCl + AgNO3 → NaNO3 + AgCl↓;
Na+ + Cl— + Ag+ + (NO3)— → AgCl↓ + Na+ + (NO3)—.
Сократим полное ионное уравнение, выписав лишь те ионы, благодаря которым химическая реакция прошла полностью, став необратимой:
Cl— + Ag+ → AgCl↓.
Данное уравнение реакции и является ее сокращенным ионным уравнением.
Реакции ионного обмена и условия их осуществления
Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов.
Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
Реакцию обмена в растворе принято изображать тремя уравнениями:

- Na2CO3 + h3SO4 → Na2SO4 + CO2↑ + h3O
- 2Na(+) + CO3(2-) + 2H(+) + SO4(2-) → 2Na(+) + SO4(2-) + CO2↑ + h3O
- 2H(+) + CO3(2-) → CO2↑ + h3O
При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.Для составления уравнений реакций ионного обмена необходимо помнить следующее:
Диссоциации не подвергаются:
- оксиды
- газообразные вещества
- вода
Реакция ионного обмена идет до конца, если образуется газ, осадок или вода:
- Na2CO3 + 2HCl → CO2↑ + 2NaCl + h3O
- 2KOH + CuCl2 → Cu(OH)2↓ + 2KCl
- NaOH + HCl → NaCl + h3O
Полезные ссылки
Источник материала
Реакции ионного обмена (видео)
1.
 Написать молекулярные, ионные, сокращённые уравнения h3OSO4+BaCl2→ AgNO3+NaCl→ HNO3+Ca(OH)→2. Написать уравнения реакций след. Солей, указать тип среды и окраску индикатора: ZnBr2+HOH→ 1. Написать молекулярные, ионные, сокращённые уравнения
Написать молекулярные, ионные, сокращённые уравнения h3OSO4+BaCl2→ AgNO3+NaCl→ HNO3+Ca(OH)→2. Написать уравнения реакций след. Солей, указать тип среды и окраску индикатора: ZnBr2+HOH→ 1. Написать молекулярные, ионные, сокращённые уравненияAgNO3+NaCl→
HNO3+Ca(OH)→
2. Написать уравнения реакций след. Солей, указать тип среды и окраску индикатора:
ZnBr2+HOH→
KNO3+HOH→
РЕШЕНИЕ
1. h3SO4 + BaCl2 → BaSO4 + 2HCl
2H(+) + SO4(2-) + Ba(2+) + 2Cl(-) = BaSO4 + 2H(+) + 2Cl(-)
Ba(2+) + SO4(2-) = BaSO4
AgNO3 + NaCl → AgCl + NaNO3
Ag(+) + NO3(-) + Na(+) + Cl(-) = AgCl + Na(+) + NO3(-)
Ag(+) + Cl(-) = AgCl
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2h3O
2H(+) + 2NO3(-) + Ca(2+) + 2OH(-) = Ca(2+) + 2NO3(-) + 2h3O
2H(+) + 2OH(-) = 2h3O
H(+) + OH(-) = h3O
2. ZnBr2 + HOH → ZnOHBr + HBr (кислая
KNO3 + HOH → KOH + HNO3 (нейтральная
ПОХОЖИЕ ЗАДАНИЯ:
 Запишите уравнение в молекулярном и ионном виде. Исходные вещества: АAgNO3+BaCl2 БBa(NO3)2+h4SO4 ВN…
Запишите уравнение в молекулярном и ионном виде. Исходные вещества: АAgNO3+BaCl2 БBa(NO3)2+h4SO4 ВN…Тема: Реакции ионного обмена
Тема: Оксиды
Тема: Оксиды
Тема: Расставить коэффициенты и определить тип
Тема: По термохимическому уравнению реакции
Ионный Реакции в растворе
Ионные соединения отличаются от соединений, содержащих только ковалентные связи.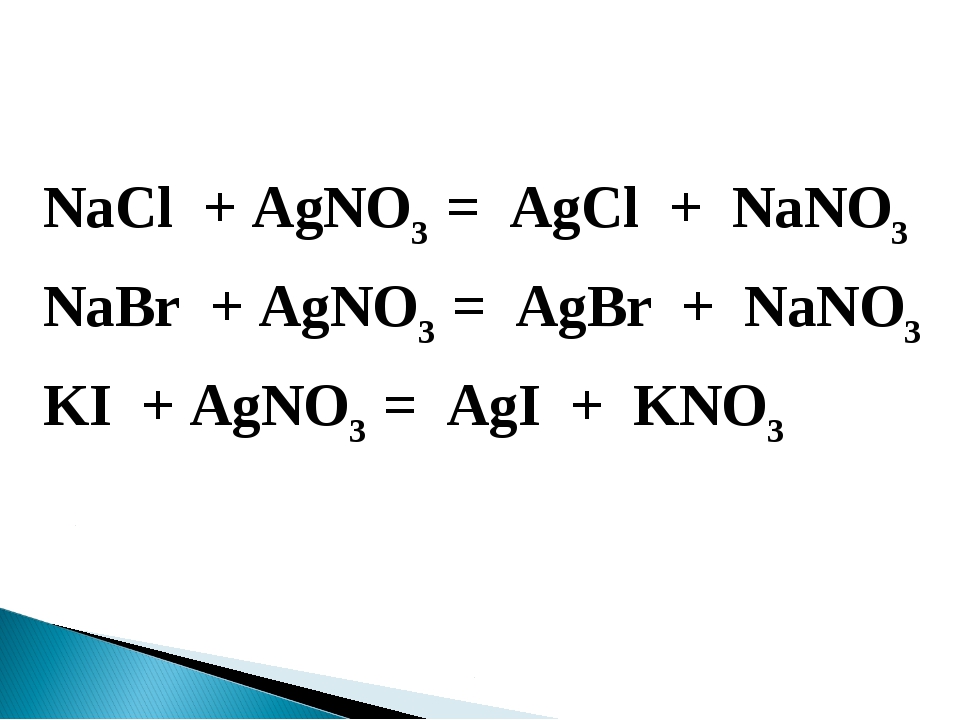
Рассмотрим конкретный пример такого независимого поведения. Предположим, у вас есть два решения. Один содержит ионы серебра и анион, соль серебра которого растворима. Второй содержит ионы хлора и катион, хлорид которого растворим. При объединении двух растворов образуется белый осадок хлорида серебра.Мы можем написать уравнение реакции:
Ag + + Cl — AgCl ()
Остальные ионы все еще присутствуют в растворе, окружающем осадок. (надосадочная жидкость), но они не участвуют в реакции (см. рисунок
11.5а).
(надосадочная жидкость), но они не участвуют в реакции (см. рисунок
11.5а).
Раньше мы писали уравнение иначе. Если предположить, что нитрат был анионом с серебром, а натрий — катионом с хлоридом, уравнение было бы следующим:
AgNO 3 + NaCl AgCl () + NaNO 3
Другой способ записать уравнение показывает ионные соединения в растворе как отдельные ионы:
Ag + + NO 3 — + Na + + Cl — AgCl () + Na + + НЕТ 3 —
Последнее уравнение ясно показывает, что в реакции принимают участие только ионы серебра и хлорида; ионы натрия и нитрата ничего не делают.Эти неучаствующие ионы называются
ионы-зрители,
Это означает, что они не участвуют в реакции — так же, как люди на трибунах на футбольном матче являются зрителями, что означает, что они не участвуют в игре.
Ag + + Класс — AgCl ()
Рассмотрим другую ситуацию.Когда кислота реагирует с гидроксидом, вода и образуются соли. Все кислоты выделяют ионы водорода в растворе. Гидроксидная композиция гидроксид-ионы. Ионы водорода и ионы гидроксида реагируют с образованием воды, ковалентной неионизированная молекула (см. рисунок 11.5b). В уравнение для этой реакции
H + + OH — H 2 O
Раньше мы бы записали эту реакцию нейтрализации, используя полные формулы.Например, уравнение реакции соляной кислоты с гидроксидом натрия будет выглядеть следующим образом:
HCl + NaOH NaCl + H 2 O
Переписав это уравнение, чтобы показать кислоту, гидроксид и соль в виде ионов — именно так эти соединения существуют в растворе, — получится уравнение
H + + Cl — + Na + + OH — Na + + Класс — + H 2 O
Это уравнение ясно показывает, что ионы водорода и гидроксида реагируют
и что ионы натрия и хлора являются ионами-наблюдателями. Они не появятся
в чистом ионном уравнении.
Они не появятся
в чистом ионном уравнении.
| РИСУНОК 11.5 (a) Когда раствор нитрата серебра добавляется к раствору хлорида натрия, ионы серебра объединяются с ионами хлорида с образованием осадка хлорида серебра. Ионы натрия и нитрат-ионы не участвуют в наблюдении. (b) Когда соляная кислота добавляется к раствору нитрата калия, ионы водорода кислоты объединяются с ионами гидроксида гидроксида калия с образованием молекул воды.Ионы хлора и калия не участвующие в спектре ионы. |
Чистые ионные уравнения также полезны для демонстрации реакций замещения. Когда магний добавляется к кислоте, образуются газообразный водород и ионы магния. Это утверждение дает нам достаточно информации, чтобы написать уравнение
мг + 2 ч + Мг 2+ + H 2
Опять же, идентичность аниона кислоты не важна.Он присутствует как ион-наблюдатель, и его не нужно показывать в уравнении.
Как и все уравнения, чистые ионные уравнения должны быть сбалансированы. Раньше нас интересовало только уравновешивание уравнений по количеству и типу атомов. Теперь мы также должны быть уверены, что уравнения уравновешиваются зарядом; то есть общий заряд реагентов должен равняться общему заряду продуктов.
Пример: а.Напишите чистое ионное уравнение образования нерастворимого соединения сульфид меди (II). г. Напишите чистое ионное уравнение образования осадка фосфат кальция. Для каждой реакции назовите соответствующие ионы-наблюдатели. Решение а. Формула сульфида меди (II) — CuS. Катион — Cu 2+ ; анион S 2-. чистое ионное уравнение для образование Cus показало бы только эти два иона. Cu 2+ + S 2- CuS Какой бы анион не был с Cu 2+ и любым катионом
с S 2-; в реагентах не участвуют
реакции и являются ионами-наблюдателями. г. Формула фосфата кальция: Ca 3 (PO 4 ) 2 . Катион — Ca 2+ ; анион PO 4 3-. Чистое ионное уравнение 3 Ca 2+ + 2 PO 4 3- Ca 3 (PO 4 ) 2 Обратите внимание, что чистый заряд реагентов равен нулю, как и заряд продукта. Подходящими ионами-спектрометрами могут быть нитрат в виде аниона, натрий в виде катиона. |
Чистые ионные уравнения могут быть выведены из полных уравнений. Полное уравнение
написано первым. Он исследуется, чтобы определить, было ли изменение
по степеням окисления. Если такое изменение произошло, эти ионы или молекулы
которые содержат атомы, изменяющие степень окисления, изолированы для чистого ионного
уравнение. Если степень окисления не меняется, продукты исследуются, чтобы найти
образовалось ли ковалентное соединение.Если это так, ионы, которые объединились, чтобы сформировать
эта молекула изолирована для чистого ионного уравнения. Если все продукты
ионный, и степень окисления не изменилась, один из продуктов должен быть
осадок. Правила растворимости в таблице 8.3 используются для определения того, какие
продукт представляет собой осадок, а содержащиеся в нем ионы изолируются для чистой
ионное уравнение.
Если такое изменение произошло, эти ионы или молекулы
которые содержат атомы, изменяющие степень окисления, изолированы для чистого ионного
уравнение. Если степень окисления не меняется, продукты исследуются, чтобы найти
образовалось ли ковалентное соединение.Если это так, ионы, которые объединились, чтобы сформировать
эта молекула изолирована для чистого ионного уравнения. Если все продукты
ионный, и степень окисления не изменилась, один из продуктов должен быть
осадок. Правила растворимости в таблице 8.3 используются для определения того, какие
продукт представляет собой осадок, а содержащиеся в нем ионы изолируются для чистой
ионное уравнение.
Пример: Напишите чистое ионное уравнение для следующего: а.реакция между нитратом серебра и сульфатом калия г. реакция серной кислоты с гидроксидом натрия г. отделение брома от бромида натрия хлором Решение а. Степень окисления не изменилась. Ни один из продуктов не является ковалентным.
По правилам растворимости сульфат серебра нерастворим.Изоляция
ионы, которые он содержит, дает чистое ионное уравнение , в котором мы вычеркнули неучаствующие ионы или ионы-наблюдатели. г. Полное уравновешенное уравнение реакции показаны степени окисления, и ни одна из них не изменилась. Вода ковалентна, остальные соединения ионны.Итоговое ионное уравнение реакции должно быть. Написание полного уравнения в ионной форме дает: , а вычеркнутые ионы-наблюдатели показывают, что наш выбор для чистого ионное уравнение было правильным. г. Полное уравнение реакции имеет вид По степеням окисления мы видим, что и бром, и хлорид имеют
изменена степень окисления. Полное ионное уравнение имеет вид Вычеркнутые ионы натрия-наблюдателя дают такое же чистое ионное уравнение. |
Введите чистое ионное уравнение для реакции водного хлорида натрия с водным раствором нитрата серебра.
1. Введите итоговое ионное уравнение для реакции водного раствора хлорида натрия с водным раствором нитрата серебра.
Помните, что в растворе различные ионы просто плавают, ожидая, когда что-то столкнется с чем-то и вступит в реакцию. Иногда некоторые ионы вообще не принимают участия в реакции.Мы называем их ионами-наблюдателями. Чистые ионные уравнения удаляют ионы-наблюдатели, оставляя тех, кто действительно что-то делает. Полное ионное уравнение:
https://answers.yahoo.com/question/index?qid=20081010183917AAmHQ7K
5. Введите итоговое ионное уравнение для реакции водного раствора хлорида натрия с водным раствором нитрата серебра.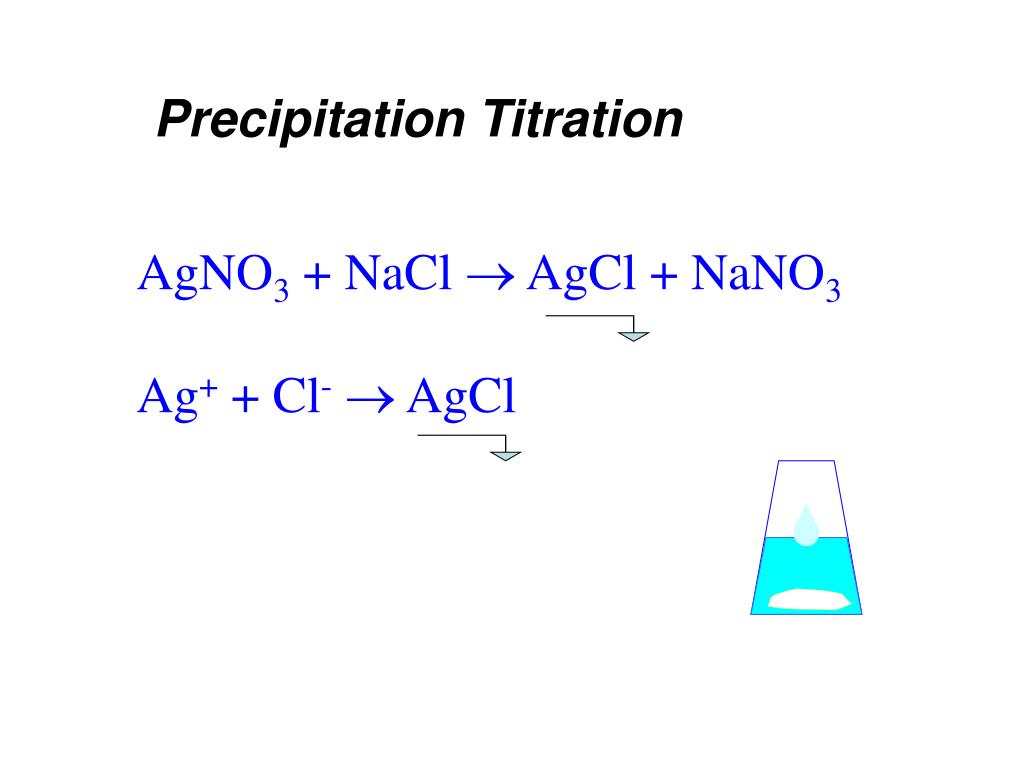
Введите чистое ионное уравнение для реакции водного раствора хлорида натрия с водным раствором нитрата серебра. Выразите свой ответ в виде химического уравнения.Ответить Сохранить. 1 ответ. Актуальность. Лекси Р. Lv 7. 8 лет назад. Любимый ответ. молекулярное уравнение. AgNO3 (водн.) + NaCl (водн.) —> AgCl (s) + NaNO3 (водн.)
https://answers.yahoo.com/question/index?qid=20120628182839AA7ReY9
6. Введите итоговое ионное уравнение для реакции водного раствора хлорида натрия с водным раствором нитрата серебра.
Нерастворимый осадок AgCl твердый. NaNO3 является водным, потому что растворяется в воде. Итак, мы запишем полное ионное уравнение с символами состояния как: AgNO3 (водн.) + NaCl (водн.) -> AgCl (s) + NaNO3 (водн.). AgCl выпал в осадок из раствора, потому что он нерастворим в воде.Мы сначала напишем полное ионное уравнение, прежде чем мы запишем чистую ионную…
https://uk.answers.yahoo.com/question/index?qid=200120532AAhutG0
8. Введите итоговое ионное уравнение для реакции водного раствора хлорида натрия с водным раствором нитрата серебра.
Введите итоговое ионное уравнение для реакции водного раствора хлорида натрия с водным раствором нитрата серебра.
Введите чистое ионное уравнение для реакции водного раствора хлорида натрия с водным раствором нитрата серебра. Ag + (aq) + Cl− (aq) → AgCl (s) S. Представьте, что A и B — катионы, а X, Y и Z — анионы, и что протекают следующие реакции: AX (aq) + BY (aq) → без осадка AX (водн.) + BZ (водн.) → осадок
https: // quizlet.ru / 168071255 / chemistry-exam-4-flash-cards /
9. Введите итоговое ионное уравнение для реакции водного хлорида натрия с водным раствором нитрата серебра.
Чтобы отказаться от этого вопроса, мне придется поместить его в какой-то контекст. Мы знаем, что хлорид серебра совершенно нерастворим в водном растворе, и когда растворимая соль серебра, скажем, AgNO_3 (водн.) Обрабатывается NaCl (водн.), Ионы серебра и ионы хлорида реагируют с образованием творожно-белого осадка AgCl (s ).И мы можем представить уравнением…. AgNO_3 (водн.) + NaCl (водн.) Rarr AgCl (s) darr…
AgNO_3 (водн.) + NaCl (водн.) Rarr AgCl (s) darr…
https://socratic.org/questions/58989fdfb72cff4c58fe0139
Чистых ионных уравнений — AP Chemistry
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как
в виде
ChillingEffects. org.
org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Вы сокращаете чистые ионные уравнения? — Mvorganizing.org
Вы сокращаете чистые ионные уравнения?
Если у вас есть правильное ионное уравнение, легко получить чистое ионное уравнение. Все, что вам нужно сделать, это отменить «ионы-наблюдатели», то есть ионы, которые появляются по обе стороны уравнения. Остается чистое ионное уравнение. Обязательно убедитесь, что коэффициенты уменьшены до самого низкого отношения.
Все, что вам нужно сделать, это отменить «ионы-наблюдатели», то есть ионы, которые появляются по обе стороны уравнения. Остается чистое ионное уравнение. Обязательно убедитесь, что коэффициенты уменьшены до самого низкого отношения.
Что такое ионные и чистые ионные уравнения?
Чистое ионное уравнение показывает только химические частицы, которые участвуют в реакции, в то время как полное ионное уравнение также включает ионы-наблюдатели. Определите и отмените ионы-наблюдатели (ионы, которые появляются по обе стороны уравнения).
Что такое полное ионное уравнение?
Полное ионное уравнение указывает все диссоциированные ионы в химической реакции. Чистое ионное уравнение исключает ионы, которые появляются по обе стороны от стрелки реакции, потому что они по существу не участвуют в интересующей реакции. Компенсированные ионы называются ионами-наблюдателями.
Как уравновесить ионные заряды?
Шаги по уравновешиванию ионных уравнений
- Напишите чистое ионное уравнение несбалансированной реакции.

- Разделите чистое ионное уравнение на две половинные реакции.
- Для одной из полуреакций уравновесите атомы, кроме O и H.
- Повторите это с другой полуреакцией.
- Добавьте h3O, чтобы уравновесить атомы O.
- Баланс.
Входит ли вода в чистые ионные уравнения?
Наиболее распространенными продуктами являются нерастворимые ионные соединения и вода. Это чистое ионное уравнение реакции.
Каково итоговое ионное уравнение реакции MgCl2 с NaOH?
Каково чистое ионное уравнение реакции MgCl2 с NaOH? Выразите свой ответ в виде химического уравнения, включающего фазы.- (водн.) -> MgOH_2 (s), однако это не кажется правильным ответом.
Каково чистое ионное уравнение реакции MgSO4 с SrCl2?
MgSO4 + SrCl2 = MgCl2 + SrSO4 — балансировщик химических уравнений.
Каково чистое ионное уравнение реакции MgSO4 с CaCl2?
CaCl2 + MgSO4 → MgCl2 + CaSO4 — Сбалансированное уравнение | Химические уравнения онлайн!
Реагирует ли MgCl2 с NaOH?
MgCl2 + 2NaOH → Mg (OH) 2 + 2NaCl Реакция взаимодействия хлорида магния и гидроксида натрия с образованием гидроксида магния и хлорида натрия. Гидроксид натрия — разбавленный раствор.
Гидроксид натрия — разбавленный раствор.
Является ли MgCl осадком?
Экстракцию хлорида магния проводили диоксаном. В частности, было обнаружено, что эта соль осаждается в виде тройного соединения MgCl2 · 6h3O · C4H8O2. Чистота получаемого MgCl2 · 6h3O не превышает 99%. Его рентгеновская дифрактограмма не содержит примесей.
Реагирует ли BaCl2 с NaOH?
BaCl2 + 2 NaOH = BaOh3 + 2NaCl | Реакция взаимодействия хлорида натрия и воды.
Является ли NaCl осадком?
Эксперимент с осадками Пример установки для эксперимента с осадками.Вы знаете, что хлорид натрия (NaCl) растворим в воде, поэтому оставшийся продукт (карбонат меди) должен быть нерастворимым. Вот почему во второй реакции не образуется осадка.
Почему образуется осадок?
Образование нерастворимого соединения иногда происходит, когда раствор, содержащий определенный катион (положительно заряженный ион), смешивается с другим раствором, содержащим конкретный анион (отрицательно заряженный ион). Твердое вещество, которое отделяется, называется осадком.
Твердое вещество, которое отделяется, называется осадком.
Является ли BaSO4 осадком?
Поскольку BaSO4 представляет собой осадок, его не нужно расщеплять на ионы. Они называются ионами-наблюдателями и не принимают участия в реакции. Поэтому их можно вычеркнуть из общего ионного уравнения.
Какое вычисленное уравнение для AgNO3 NaCl?
AgNO3 + NaCl = AgCl + NaNO3 — балансировщик химических уравнений.
Какой тип реакции — NaCl AgNO3?
реакция двойного вытеснения
Что происходит, когда к AgNO3 добавляют NaCl?
Хлорид натрия (NaCl) реагирует с нитратом серебра (AgNO3) с образованием хлорида серебра (AgCl) и нитрата натрия (NaNO3).Закон, который удовлетворяет этому уравнению, есть.
Как сбалансировать химические уравнения?
Чтобы сбалансировать химическое уравнение, вам необходимо убедиться, что количество атомов каждого элемента на стороне реагента равно количеству атомов каждого элемента на стороне продукта. Чтобы обе стороны были равны, вам нужно будет умножить количество атомов в каждом элементе, пока обе стороны не станут равными.
Чтобы обе стороны были равны, вам нужно будет умножить количество атомов в каждом элементе, пока обе стороны не станут равными.
Почему вы балансируете химические уравнения?
Ответ: Химические уравнения должны быть сбалансированы, чтобы удовлетворить закону сохранения материи, который гласит, что материя не может быть произведена или разрушена в замкнутой системе.Закон сохранения массы определяет баланс химического уравнения.
Какое самое важное правило для уравновешивания химических уравнений?
A: Все химические уравнения должны быть сбалансированы. Это означает, что по обе стороны стрелки должно быть одинаковое количество атомов каждого типа. Это потому, что в химических реакциях масса всегда сохраняется. Подсчитайте количество атомов водорода и кислорода с каждой стороны стрелки.
Что произойдет, если химическое уравнение не сбалансировано?
Ответ.Если химическое уравнение не сбалансировано, это означает, что либо масса была создана, либо уничтожена, что противоречит закону обмена масс, который гласит, что материя не может быть ни создана, ни разрушена.
Что означает S в химии?
Знак (s) означает, что соединение является твердым. Знак (aq) обозначает водный раствор в воде и означает, что соединение растворено в воде. Наконец, знак (g) означает, что соединение представляет собой газ. Коэффициенты используются во всех химических уравнениях, чтобы показать относительные количества каждого присутствующего вещества.
Почему некоторые элементы заключены в квадратные скобки?
Атомный вес некоторых элементов дается целым числом в скобках. Эти элементы нестабильны; то есть их ядра разлагаются радиоактивно. Число в скобках — это массовое число наиболее стабильного или наиболее известного изотопа этого элемента.
Что означают квадратные скобки в химии?
Сущность относится к рассматриваемому типу частиц, таким как атомы, молекулы, комплексы, радикалы, ионы, электроны и т. Д.Обычно для обозначения концентраций и активности химические молекулярные формулы заключаются в квадратные скобки []. любой или все элементы, составляющие что-то: химия любви.
любой или все элементы, составляющие что-то: химия любви.
Что означает P в уравнениях химии?
масса вещества m, количество молей вещества n, парциальное давление газа в газовой смеси p (или P), некоторая форма энергии вещества (для химии обычно используется энтальпия H), энтропия вещество S.
Уравнения реакции осаждения Учебное пособие по химии
Ключевые понятия
- Осадок представляет собой нерастворимое твердое вещество 1 , которое образуется при смешивании растворов.
Правила растворимости могут использоваться для прогнозирования того, будет ли продукт нерастворимым (образует осадок) 2 в водных растворах при 25 ° C
- Реакция осаждения — это химическая реакция, при которой при смешивании растворов образуется осадок.
- Ионы Spectator — это ионы в растворе, которые не используются для образования осадка.
Зрительские ионы не участвуют в осадках, они «наблюдают» за происходящим, как зрители, наблюдающие за спортом.

- Состояния вещества должны быть включены в химическое уравнение реакции осаждения:
(т) для твердого, осадка
(л) для жидкости
(г) для газа
(водн.) Для веществ в водном растворе - Химические уравнения, описывающие реакции осаждения, можно записать одним из трех способов: 3 :
- Молекулярные уравнения:
Все реагенты и продукты написаны как молекулы:
пример: AB (водн.) + CD (водн.) → AD (водн.) + CB (s) - Ионные уравнения:
Все растворимые реагенты и продукты записываются как ионы, только осадок записывается как молекула:
пример: A + (водн.) + B — (водн.) + C + (водн.) + D — (водн.) → A + (водн. ) + D — (водн.) + CB (s) - Чистые ионные уравнения:
В уравнении записываются только реагенты и продукт, участвующие в образовании осадка, реагенты — как ионы, продукт — как молекула.

Ионы Spectator не включены в уравнение:
пример: B — (водн.) + C + (водн.) → CB (s)
- Молекулярные уравнения:
Молекулярное уравнение
Рассмотрим реакцию между водными растворами хлорида натрия, NaCl (водн.), И нитрата серебра, AgNO 3 (водн.).Мы можем определить возможные продукты реакции, посмотрев на частицы, присутствующие в каждом растворе:
- Водный раствор хлорида натрия, NaCl (водн.) , содержит ионы натрия, Na + (водн.) , и ионы хлора, Cl — (водн.) .
- Водный раствор нитрата серебра, AgNO 3 (водн.) , содержит ионы серебра, Ag + (водн.) , и ионы нитрата, NO 3 — (водн.)
Возможные продукты — соли, состоящие из катиона (положительно заряженный ион) и аниона (отрицательно заряженный ион):
| водный раствор хлорида натрия (NaCl (водн.  ) ) ) ) | |||
|---|---|---|---|
| ионы натрия (Na + (водн.) | хлорид-ионы (Cl — (водн.) ) | ||
| водный раствор нитрата серебра (AgNO 3 (водн.) ) | ионов серебра (Ag + (водн.) ) | без соли (оба катиона) | хлорид серебра (AgCl) |
| нитрат-ионы (NO 3 — (водн.) ) | нитрат натрия (NaNO 3 ) | без соли (оба аниона) | |
Возможными продуктами реакции являются нитрат натрия NaNO 3 и хлорид серебра AgCl.
Из правил растворимости мы находим, что:
- нитрат натрия, NaNO 3 , растворимый
Все ионы группы 1 образуют растворимые соли, нитрат натрия, NaNO 3 (водн.
 ), Растворим.
), Растворим.
Все нитраты растворимы, нитрат натрия NaNO 3 (водн.) Растворим. - Хлорид серебра AgCl (s) нерастворим (хлорид серебра представляет собой осадок).
Все хлориды растворимы, ЗА ИСКЛЮЧЕНИЕМ хлоридов серебра, свинца (II), ртути (I), меди (II) и таллия.
Мы можем записать словесное уравнение для этой реакции осаждения:
| реактивы (растворимые) | → | растворимый продукт | + | осадок | |||
|---|---|---|---|---|---|---|---|
| уравнение слова: | натрия хлорид | + | нитрат серебра | → | нитрат натрия | + | хлорид серебра |
Мы можем рассматривать каждый реагент и каждый продукт как молекулу и подставлять химическую формулу для каждой «молекулы» в словесное уравнение.
Помните, используйте (водный) для «молекул», которые являются растворимыми, и (s) для осадка (нерастворимая соль).
| реактивы (растворимые) | → | растворимый продукт | + | осадок | |||
|---|---|---|---|---|---|---|---|
| уравнение слова: | натрия хлорид | + | нитрат серебра | → | нитрат натрия | + | хлорид серебра |
| химическое уравнение: | NaCl (водн.) | + | AgNO 3 (водн.) | → | NaNO 3 (водн.) | + | AgCl (т) |
Убедитесь, что химическое уравнение сбалансировано!
| химическое уравнение: | NaCl (водн.) | + | AgNO 3 (водн.) | → | NaNO 3 (водн.) | + | AgCl (т) | |
|---|---|---|---|---|---|---|---|---|
| число «атомов» Na | 1 | = | 1 | сбалансированный | ||||
| число «атомов» Cl | 1 | = | 1 | сбалансированный | ||||
| число «атомов» Ag | 1 | = | 1 | сбалансированный | ||||
| число атомов азота | 1 | = | 1 | сбалансированный | ||||
| количество атомов O | 3 | = | 3 | сбалансированный |
Для реакции осаждения, протекающей между водными растворами хлорида натрия и нитрата серебра, сбалансированное молекулярно-химическое уравнение имеет вид:
NaCl (водн.) + AgNO 3 (водн.) → NaNO 3 (водн.) + AgCl (с)
Ионное уравнение
Ионное уравнение — это сбалансированное химическое уравнение, которое НЕ предполагает, что все реагенты и продукты существуют в растворе в виде «молекул».- Виды, которые существуют в растворе в виде ионов, показаны как ионы.
- Осадок (нерастворимая соль) показан как «молекула».
В приведенном выше примере мы обнаружили, что при смешивании водных растворов хлорида натрия NaCl (водн.) и нитрата серебра AgNO 3 (водн.) образуется осадок хлорида серебра AgCl (s) и водный раствор нитрата натрия, NaNO 3 (водн.) , для которого мы написали следующее сбалансированное молекулярно-химическое уравнение:
| реактивы (растворимые) | → | растворимый продукт | + | осадок | |||
|---|---|---|---|---|---|---|---|
| молекулярное уравнение: | NaCl (водн. ) ) | + | AgNO 3 (водн.) | → | NaNO 3 (водн.) | + | AgCl (т) |
Если соль растворима в воде, она растворяется в воде, распадаясь на ионы, которые полностью окружены водой, поэтому частицы в воде являются не «молекулами соли», а катионами и анионами, окруженными молекулами воды:
- Водный раствор хлорида натрия, NaCl (водн.) , содержит ионы натрия, Na + (водн.) , и ионы хлора, Cl — (водн.) .
- Водный раствор нитрата серебра, AgNO 3 (водн.) , содержит ионы серебра, Ag + (водн.) , и ионы нитрата, NO 3 — (водн.)
- Водный раствор нитрата натрия, NaNO 3 (водн.) , содержит ионы натрия, Na + (водн.) , и ионы нитрата, NO 3 — (водн.)
Осадок ДЕЙСТВИТЕЛЬНО существует в виде «молекулярных» частиц, вода не разрушает кристаллическую решетку, поэтому хлорид серебра AgCl (s) существует в виде твердого вещества, НЕ в виде ионов, окруженных молекулами воды.
Итак, мы можем переписать наше сбалансированное молекулярное уравнение, чтобы показать все ионные частицы в водном растворе (то есть мы запишем химическое уравнение как ионное уравнение):
| реактивы (растворимые) | → | растворимый продукт | + | осадок | |||
|---|---|---|---|---|---|---|---|
| молекулярное уравнение: | NaCl (водн.) | + | AgNO 3 (водн.) | → | NaNO 3 (водн.) | + | AgCl (т) |
| ионное уравнение: | Na + (водн.) + Cl — (водн.) | + | Ag + (водн.) + NO 3 — (водн.) | → | Na + (водн.) + NO 3 — (водн. ) ) | + | AgCl (т) |
Убедитесь, что ионное уравнение сбалансировано!
| ионное уравнение: | Na + (водн.) | + | Cl — (водн.) | + | Ag + (водн.) | + | НЕТ 3 — (водн.) | → | Na + (водн.) | + | НЕТ 3 — (водн.) | + | AgCl (т) | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| число «атомов» Na | 1 | = | 1 | сбалансированный | ||||||||||
| число «атомов» Cl | 1 | = | 1 | сбалансированный | ||||||||||
| число «атомов» Ag | 1 | = | 1 | сбалансированный | ||||||||||
| число атомов азота | 1 | = | 1 | сбалансированный | ||||||||||
| количество атомов O | 3 | = | 3 | сбалансированный |
Для реакции осаждения, которая происходит при смешивании водных растворов хлорида натрия и нитрата серебра, сбалансированное ионное уравнение реакции имеет вид:
Na + (водн.) + Cl — (водн.) + Ag + (водн.) + NO 3 — (водн.) → Na + (водн.) + NO 3 — (водн.) + AgCl (s)
Чистое ионное уравнение
Чистое ионное уравнение показывает только те частицы, которые вступают в реакцию с образованием осадка, и образующийся осадок.Нам необходимо идентифицировать ионы, которые вступают в реакцию, и ионы, которые не реагируют с образованием осадка (ионы-наблюдатели).
Выше мы видели, что можем написать ионное уравнение для представления реакции между водными растворами хлорида натрия, NaCl (водн.) , и нитрата серебра, AgNO 3 (водн.) , с образованием осадка (нерастворимой соли) серебра. хлорид, AgCl (т) :
| растворимые реагенты | → | растворимый продукт видов | + | осадок (нерастворимая соль) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ионное уравнение: | Na + (водн. ) ) | + | Cl — (водн.) | + | Ag + (водн.) | + | НЕТ 3 — (водн.) | → | Na + (водн.) | + | НЕТ 3 — (водн.) | + | AgCl (т) | |
Давайте выделим водные частицы, которые встречаются и как реагенты, и как продукты, то есть виды, которые НЕ участвуют в реакции осаждения (ионы-наблюдатели) в красный :
| растворимые реагенты | → | растворимый продукт видов | + | осадок (нерастворимая соль) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ионное уравнение: | Na + (водн.) | + | Cl — (водн. ) ) | + | Ag + (водн.) | + | НЕТ 3 — (водн.) | → | Na + (водн.) | + | НЕТ 3 — (водн.) | + | AgCl (т) | |
Поскольку эти ионы-наблюдатели (Na + (водн.) и NO 3 — (водн.) ) присутствуют как на стороне реагента, так и на стороне продукта уравнения, и они не участвуют в реакция, и мы можем эффективно игнорировать их, поэтому давайте удалим их из ионного уравнения, чтобы получить чистое ионное уравнение:
| растворимые реагенты | → | растворимый продукт видов | + | осадок (нерастворимая соль) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ионное уравнение: | Na + (водн. ) ) | + | Cl — (водн.) | + | Ag + (водн.) | + | НЕТ 3 — (водн.) | → | Na + (водн.) | + | НЕТ 3 — (водн.) | + | AgCl (т) | |
| чистое ионное уравнение: | Cl — (водн.) | + | Ag + (водн.) | → | AgCl (т) | |||||||||
В итоге мы получаем чистое ионное уравнение, представляющее реакцию между водными растворами хлорида натрия, NaCl (водн.) , и нитратом серебра, AgNO 3 (водн.) , с образованием осадка (нерастворимой соли) хлорида серебра, AgCl (т) :
Ag + (водн.) + Cl — (водн.) → AgCl (s)
И это очень интересное уравнение!
Это уравнение говорит нам, что если мы возьмем ЛЮБОЙ водный раствор, содержащий ионы серебра, Ag + (водн.) , и смешаем его с ЛЮБЫМ водным раствором, содержащим ионы хлорида, Cl — (водн.) , осадок ( нерастворимая соль) хлорида серебра AgCl (s) !
То есть, если мы смешаем источник ионов серебра, такой как водный раствор нитрата серебра 4 , AgNO 3 (водн.) (Ag + (водн.) + NO 3 — (водн.) ) с источником хлорид-ионов, затем твердый хлорид серебра, AgCl (s) , выпадет в осадок:
- Если NaCl (водн.) является источником Cl — (водн.) , а AgNO 3 (водн.) является источником Ag + (водн.) , то чистое ионное уравнение имеет следующий вид:
Ag + (водн.
 ) + Cl — (водн.) → AgCl (s)
) + Cl — (водн.) → AgCl (s) - Если KCl (водн.) является источником Cl — (водн.) , а AgNO 3 (водн.) является источником Ag + (водн.) , тогда чистое ионное уравнение имеет следующий вид:
Ag + (водн.) + Cl — (водн.) → AgCl (s)
- Если MgCl 2 (водн.) является источником Cl — (водн.) , а AgNO 3 (водн.) является источником Ag + (водн.) , то чистое ионное уравнение имеет вид:
Ag + (водн.) + Cl — (водн.) → AgCl (s)
- Если CaCl 2 (водн.) является источником Cl — (водн.) , а AgNO 3 (водн.) является источником Ag + (водн.
 ) , тогда чистое ионное уравнение будет следующим:
) , тогда чистое ионное уравнение будет следующим:Ag + (водн.) + Cl — (водн.) → AgCl (s)
- Если CuCl 2 (водн.) является источником Cl — (водн.) , а AgNO 3 (водн.) является источником Ag + (водн.) , то чистое ионное уравнение имеет следующий вид:
Ag + (водн.) + Cl — (водн.) → AgCl (s)
- Если FeCl 2 (водн.) является источником Cl — (водн.) , а AgNO 3 (водн.) является источником Ag + (водн.) , то чистое ионное уравнение имеет следующий вид:
Ag + (водн.) + Cl — (водн.) → AgCl (s)
- Если NH 4 Cl (водн.) является источником Cl — (водн.
 ) , а AgNO 3 (водн.) является источником Ag + (водн.) , то чистый ионный уравнение:
) , а AgNO 3 (водн.) является источником Ag + (водн.) , то чистый ионный уравнение:Ag + (водн.) + Cl — (водн.) → AgCl (s)
- Если HCl (водн.) является источником Cl — (водн.) , а AgNO 3 (водн.) является источником Ag + (водн.) , то чистое ионное уравнение выглядит следующим образом:
Ag + (водн.) + Cl — (водн.) → AgCl (s)
Рабочий пример
Вопрос:Водный раствор нитрата бария, Ba (NO 3 ) 2 (водн.) , смешивают с разбавленной серной кислотой, H 2 SO 4 (водн.) .
Образуется белый осадок.
- Напишите сбалансированное молекулярное уравнение этой реакции осаждения.
- Напишите сбалансированное ионное уравнение этой реакции осаждения.
- Напишите сбалансированное чистое ионное уравнение этой реакции.
Решение:
- Напишите сбалансированное молекулярное уравнение этой реакции осаждения.
Шаг 1: Используйте правила растворимости, чтобы предсказать название и формулу осадка:
водный нитрат бария
(Ba (NO 3 ) 2 (водн.) )ионы бария
(Ba 2+ (водн.) )нитрат-ионы
(NO 3 — (водн.) )водная серная кислота
(H 2 SO 4 (водн.) )ионы водорода
(H + (водн.) )без соли
(оба катиона)азотнокислый водород
(азотная кислота, HNO 3 (водн. ) )
) )сульфат-ионы
(SO 4 2- (водн.) )сульфат бария
(BaSO 4 (т) )без соли
(оба аниона)Правила растворимости: все нитраты растворимы, поэтому нитрат водорода (азотная кислота, HNO 3 (водн.) ) растворим.
Все сульфаты растворимы, ЗА ИСКЛЮЧЕНИЕМ сульфатов серебра, свинца, ртути (I), бария, , стронция и кальция. Итак, сульфат бария нерастворим (BaSO 4 (s) ).Шаг 2: Напишите уравнение слова:
реактивы (растворимые) → растворимый
продукт+ осадок уравнение слова: нитрат бария + серная кислота → азотная кислота + сульфат бария Шаг 3: Замените каждое слово соответствующей химической формулой, включая каждое состояние:
реактивы (растворимые) → растворимый
продукт+ осадок уравнение слова: нитрат бария + серная кислота → азотная кислота + сульфат бария химическая формула: Ba (NO 3 ) 2 (водн.  )
) + H 2 SO 4 (водн.) → HNO 3 (водн.) + BaSO 4 (т) Шаг 4: Уравновесить молекулярное уравнение:
реактивы (растворимые) → растворимый
продукт+ осадок несбалансированное молекулярное уравнение: Ba (NO 3 ) 2 (водн.) + H 2 SO 4 (водн.) → HNO 3 (водн.) + BaSO 4 (т) кол-во «атомов» Ва: 1 = 1 сбалансированный количество атомов N: 2 ≠ 1 несимметричный необходимо 2 молекулы HNO 3 : Ba (NO 3 ) 2 (водн.  )
) + H 2 SO 4 (водн.) → 2HNO 3 (водн.) + BaSO 4 (т) количество атомов N: 2 = 2 сбалансированный количество атомов O: 6 + 4 = 6 + 4 сбалансированный количество атомов H: 2 = 2 сбалансированный количество атомов S: 1 = 1 сбалансированный контрольное число Ba «атомов»:
(в новом уравнении)1 = 1 сбалансированный Шаг 5.
 Напишите сбалансированное молекулярное уравнение:
Напишите сбалансированное молекулярное уравнение:Ba (NO 3 ) 2 (водн.) + H 2 SO 4 (водн.) → 2HNO 3 (водн.) + BaSO 4 (с.)
- Напишите сбалансированное ионное уравнение этой реакции осаждения.
Шаг 1: Напишите сбалансированное молекулярное уравнение:
Ba (NO 3 ) 2 (водн.) + H 2 SO 4 (водн.) → 2HNO 3 (водн.) + BaSO 4 (с.)
Шаг 2: Разделите все растворимые ионные частицы на ионы:
Ba (NO 3 ) 2 (водн.) → Ba 2+ (водн.) + 2NO 3 — (водн.)
H 2 SO 4 (водн.) → 2H + (водн.) + SO 4 2- (водн.)
2HNO 3 (водн.) → 2H + (водн. ) + 2NO 3 — (водн.)
) + 2NO 3 — (водн.)
ПРИМЕЧАНИЕ: нерастворимая соль НЕ просыпается на ионы!
Формула осадка по-прежнему BaSO 4 (s)Шаг 3: Подставьте каждую растворимую «молекулу» в молекулярное уравнение на формулу ее ионов:
реактивов растворимых → растворимый
продукт+ осадок сбалансированное
молекулярное
уравнение:Ba (NO 3 ) 2 (водн.) + H 2 SO 4 (водн.) → 2HNO 3 (водн.) + BaSO 4 (т) ионное уравнение: Ba 2+ (водн.) + 2НО 3 — (водн.) + 2H + + SO 4 2- (водн.  )
) → 2H + (водн.) + 2НО 3 — (водн.) + BaSO 4 (т) Шаг 4: Уравновесить ионное уравнение:
ионное уравнение: Ba 2+ (водн.) + 2НО 3 — (водн.) + 2H + + SO 4 2- (водн.) → 2H + (водн.) + 2НО 3 — (водн.) + BaSO 4 (т) число атомов «Ва»: 1 = 1 сбалансированный количество атомов N: 2 = 2 сбалансированный количество атомов O: 6 + 4 = 6 + 4 сбалансированный количество H «атомов»: 2 = 2 сбалансированный количество атомов S: 1 = 1 сбалансированный Шаг 5: Напишите сбалансированное ионное уравнение реакции осаждения:
Ba 2+ (водн.
 ) + 2NO 3 — (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2H + (водн.) + 2НО 3 — (водн.) + BaSO 4 (с)
) + 2NO 3 — (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2H + (водн.) + 2НО 3 — (водн.) + BaSO 4 (с) - Напишите сбалансированное чистое ионное уравнение этой реакции.
Шаг 1: Напишите вычисленное ионное уравнение:
Ba 2+ (водн.) + 2NO 3 — (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2H + (водн.) + 2НО 3 — (водн.) + BaSO 4 (с)
Шаг 2: Определите иона-наблюдателя , те ионы, которые появляются как в левой, так и в правой частях уравнения как ионы, а не как часть осадка:
Ba 2+ (водн.
 ) + 2НО 3 — (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2H + (водн.) + 2NO 3 — (водн.) + BaSO 4 (с)
) + 2НО 3 — (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2H + (водн.) + 2NO 3 — (водн.) + BaSO 4 (с) Ионы Spectator — NO 3 — (водн. ) и H + (водн.)
Шаг 3: Удалите ионы-наблюдатели из ионного уравнения, чтобы получить чистое ионное уравнение:
ионное уравнение: Ba 2+ (водн.) +
2НО 3 — (водн.)+2H + (водн.)+ SO 4 2- (водн.) →2H + (водн.)+2НО 3 — (водн.)+ BaSO 4 (с)чистый ионный уравнение: Ba 2+ (водн.
 ) + SO 4 2- (водн.) → BaSO 4 (s)
) + SO 4 2- (водн.) → BaSO 4 (s) Шаг 4: Напишите чистое ионное уравнение для реакции осаждения:
Ba 2+ (водн.) + SO 4 2- (водн.) → BaSO 4 (с)
1.«нерастворимый» относится к твердому веществу с чрезвычайно низкой растворимостью.
2. Вы также можете использовать K sp , продукты растворимости, для прогнозирования осаждения.
3. Реакции осаждения можно рассматривать как равновесные системы:
пример: M + (вод.) + X — (вод.) MX (s)
, но положение равновесия находится очень далеко вправо, то есть образование осадка значительно одобрено, чтобы мы могли приблизиться к описанию реакции на:
пример: M + (водн.) + X — (водн.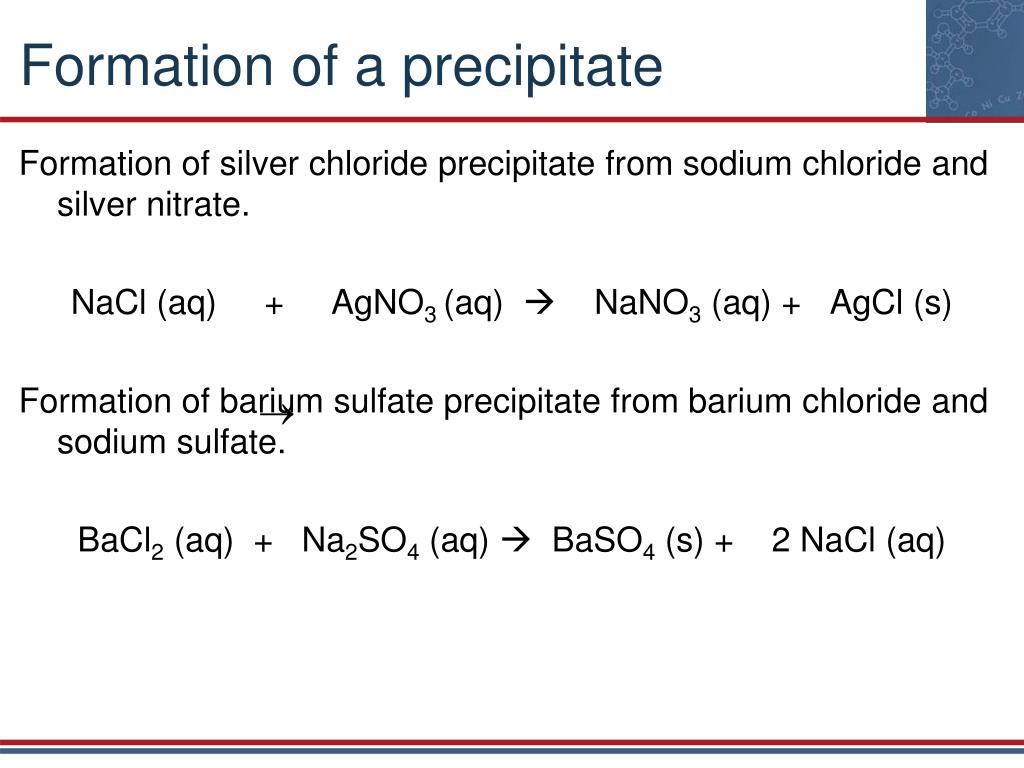 ) → MX (s)
) → MX (s)
4.Вам интересно, почему нитрат серебра обычно используется в качестве источника ионов серебра в реакциях осаждения?
Если вы проверите правила растворимости, вы обнаружите, что, вообще говоря, соли серебра нерастворимы или мало растворимы в воде, ЗА ИСКЛЮЧЕНИЕМ нитрата серебра!
молекулярных и ионных уравнений | Химия для неосновных
Цели обучения
- Определите молекулярные и ионные уравнения.
- Приведите примеры молекулярных и ионных уравнений.
«Небольшой дождь…»
Одним из неприятных побочных продуктов нашего индустриального общества являются кислотные дожди. Двуокись серы при сжигании угля и оксиды азота из выхлопных газов транспортных средств образуют кислоты. Когда эти кислоты вступают в реакцию с известняком (карбонатом кальция), происходят реакции, которые растворяют известняк и выделяют воду и углекислый газ. Со временем конструкциям наносится серьезный ущерб.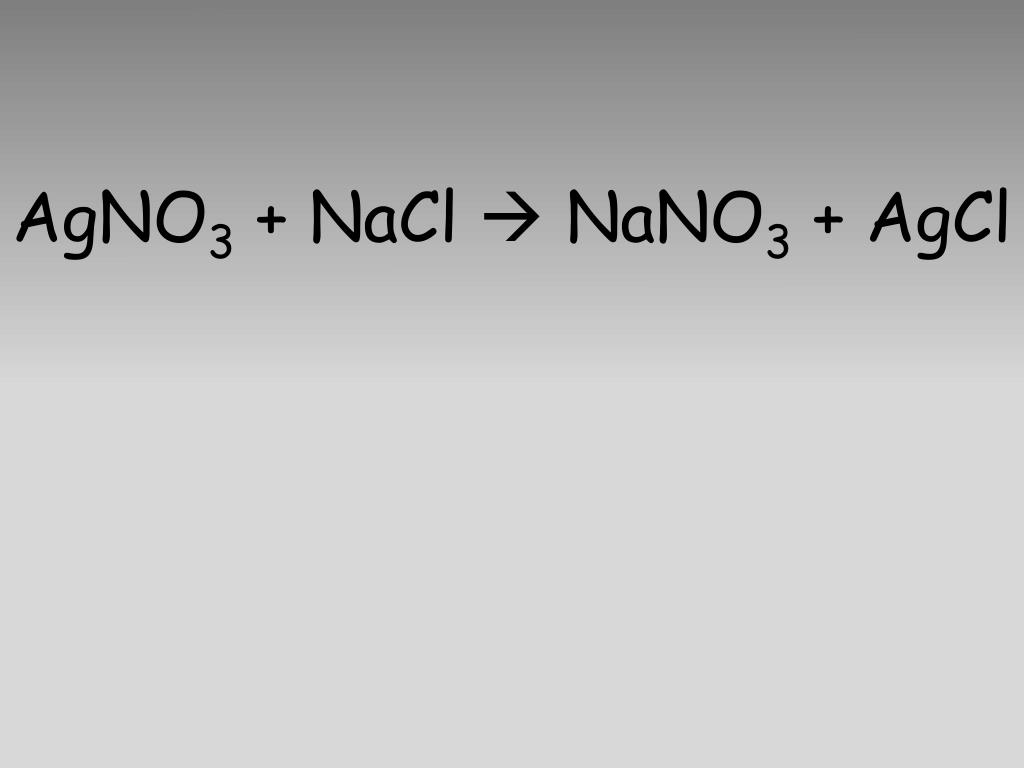
Когда ионные соединения растворяются в воде, полярные молекулы воды разрушают твердую кристаллическую решетку, в результате чего гидратированные ионы равномерно распределяются в воде.Этот процесс называется диссоциацией и является причиной того, что все ионные соединения являются сильными электролитами. Когда два разных ионных соединения, растворенных в воде, смешиваются, между определенными парами гидратированных ионов может происходить химическая реакция.
Рассмотрим реакцию двойного замещения, которая происходит, когда раствор хлорида натрия смешивают с раствором нитрата серебра.
Движущей силой этой реакции является образование осадка хлорида серебра.
Рис. 1. Белый осадок хлорида серебра мгновенно образуется при добавлении раствора нитрата серебра к раствору хлорида натрия. Изображение из Викимедиа.
Это называется молекулярным уравнением. Молекулярное уравнение — это уравнение, в котором формулы соединений записаны так, как будто все вещества существуют в виде молекул. Однако есть лучший способ показать, что происходит в этой реакции. Все водные соединения должны быть записаны как ионы, потому что они присутствуют в воде как отдельные ионы из-за их диссоциации.
Однако есть лучший способ показать, что происходит в этой реакции. Все водные соединения должны быть записаны как ионы, потому что они присутствуют в воде как отдельные ионы из-за их диссоциации.
Это уравнение называется ионным уравнением , уравнением, в котором растворенные ионные соединения показаны как свободные ионы.
Некоторые другие реакции двойного замещения не приводят к образованию осадка в качестве одного из продуктов. Образование газа и / или молекулярного соединения, такого как вода, также может стимулировать реакцию. Например, рассмотрим реакцию раствора карбоната натрия с раствором соляной кислоты (HCl). Продуктами реакции являются водный раствор хлорида натрия, диоксид углерода и вода.Сбалансированное молекулярное уравнение:
Ионное уравнение:
Реакция однократного замещения — это реакция, в которой элемент заменяет другой элемент в соединении. Элемент находится в твердом, жидком или газообразном состоянии и не является ионом. В приведенном ниже примере показана реакция твердого металлического магния с водным раствором нитрата серебра с образованием водного раствора нитрата магния и металлического серебра.
В приведенном ниже примере показана реакция твердого металлического магния с водным раствором нитрата серебра с образованием водного раствора нитрата магния и металлического серебра.
Сбалансированное молекулярное уравнение:
Ионное уравнение:
Этот тип реакции однократного замещения называется замещением металла.Другими распространенными категориями реакций однократного замещения являются замещение водорода и замещение галогена.
Сводка
- Показаны примеры молекулярных и ионных уравнений.
Практика
Прочтите материал по ссылке ниже и решите практические уравнения:
www.chemteam.info/Equations/DoubleReplacement.html
Обзор
- Что обозначают маленькие буквы после соединений?
- Почему важно отображать состояние каждого соединения?
- Что говорят нам ионные уравнения?
Глоссарий
- ионное уравнение: Уравнение, в котором растворенные ионные соединения показаны как свободные ионы.

- молекулярное уравнение: Уравнение, в котором формулы соединений записаны так, как будто все вещества существуют в виде молекул.
Эта страница показывает процедура для прогнозирования возможности смешивания двух водных растворов ионного соединения приведут к реакции осаждения и покажут вам, как писать полные и чистые ионные уравнения для протекающих реакций.В следующее — типичная проблема.
Учебный лист Tip-off — Когда вы
попросили предсказать, имеет ли место реакция осаждения, когда два водных
растворы ионных соединений смешивают и записывают полный и чистый ионный
уравнения для реакции, если она имеет место. Общие шаги Шаг 1: Определите формулы для возможных продуктов с использованием общего уравнения двойного смещения. (Не забудьте учесть заряды ионов при написании ваших формул.)
Шаг 2: Предскажите, будет ли одно из возможных продукты не растворяются в воде. Если какой-либо из возможных продуктов нерастворим, происходит реакция осаждения, и вы продолжите с шага 3.Если ни один из них не растворим, напишите «Нет реакции». Шаг 3. Выполните следующие действия, чтобы написать полную уравнение.
Шаг 4: Выполните следующие действия, чтобы написать чистое ионное уравнение.
| ПРИМЕР 1 — Прогнозирование осадков Реакции: предсказать, выпадет ли осадок образуется, когда водные растворы нитрата серебра, AgNO 3 (водн.) и сульфида натрия, Na 2 S (водн.), Смешивают. Если есть реакция осаждения, напишите полное и чистое ионное уравнение, описывающее реакцию. Решение: Шаг
1 : Определите возможные произведения, используя общее уравнение двойного смещения.
Шаг 2 : Предсказать, является ли какой-либо из возможных продуктов нерастворимым в воде.
Шаг 3 : Запись полное уравнение. (Не забудьте уравновесить уравнение.) 2AgNO 3 (водн.) + Na 2 S (водн.) → Ag 2 S (тв) + 2NaNO 3 (водн.) Шаг 4 : Напишите чистое ионное уравнение.
ПРИМЕР 2 — Прогнозирование реакций осаждения: Предсказать, выпадет ли осадок
образуется, когда водные растворы бария
хлорид, BaCl 2 (водн. Решение: Шаг 1 : Определите возможные произведения, используя общее уравнение двойного смещения.
Шаг 2 : Предсказать, является ли какой-либо из возможных продуктов нерастворимым в воде.
Шаг 3 : Запись полное уравнение. (Не забудьте уравновесить уравнение.) BaCl 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (т) + 2NaCl (водн.) Шаг 4 : Напишите полное ионное уравнение, описывающее водный ионные соединения в виде ионов.Опишите твердое тело как полную формулу. Ba 2+ (водн.) + 2Cl — (водн.) +
2Na + (водн.)
+ SO 4 2− (водн.)
|

 Соответствующие ионы-зрители могут
быть нитратом в качестве аниона и натрием в качестве катиона. Мы выбрали эти ионы, потому что
реагенты должны быть растворимыми, и нитраты и соли натрия всегда
растворимый.
Соответствующие ионы-зрители могут
быть нитратом в качестве аниона и натрием в качестве катиона. Мы выбрали эти ионы, потому что
реагенты должны быть растворимыми, и нитраты и соли натрия всегда
растворимый. Полное сбалансированное уравнение реакции:
Полное сбалансированное уравнение реакции:


 ), Растворим.
), Растворим. 
 ) + AgNO 3 (водн.) → NaNO 3 (водн.) + AgCl (с)
) + AgNO 3 (водн.) → NaNO 3 (водн.) + AgCl (с)  ) + Cl — (водн.) + Ag + (водн.) + NO 3 — (водн.) → Na + (водн.) + NO 3 — (водн.) + AgCl (s)
) + Cl — (водн.) + Ag + (водн.) + NO 3 — (водн.) → Na + (водн.) + NO 3 — (водн.) + AgCl (s)  ) + Cl — (водн.) → AgCl (s)
) + Cl — (водн.) → AgCl (s)  ) + Cl — (водн.) → AgCl (s)
) + Cl — (водн.) → AgCl (s)  ) , тогда чистое ионное уравнение будет следующим:
) , тогда чистое ионное уравнение будет следующим: ) , а AgNO 3 (водн.) является источником Ag + (водн.) , то чистый ионный уравнение:
) , а AgNO 3 (водн.) является источником Ag + (водн.) , то чистый ионный уравнение:
 ) )
) ) )
)  )
) 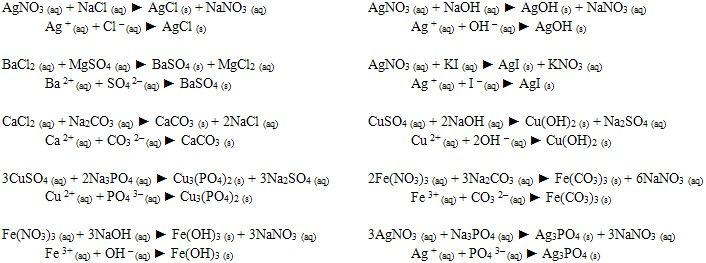 Напишите сбалансированное молекулярное уравнение:
Напишите сбалансированное молекулярное уравнение: ) + 2NO 3 — (водн.)
) + 2NO 3 — (водн.)  )
)  ) + 2NO 3 — (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2H + (водн.) + 2НО 3 — (водн.) + BaSO 4 (с)
) + 2NO 3 — (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2H + (водн.) + 2НО 3 — (водн.) + BaSO 4 (с) 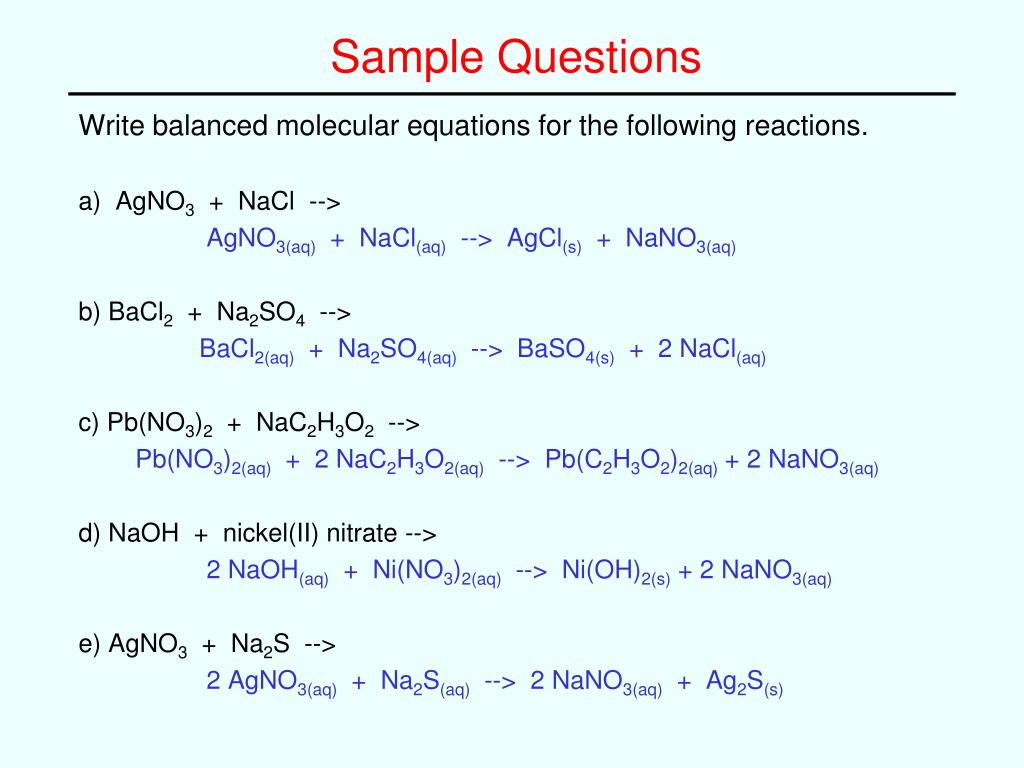 ) + 2НО 3 — (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2H + (водн.) + 2NO 3 — (водн.) + BaSO 4 (с)
) + 2НО 3 — (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2H + (водн.) + 2NO 3 — (водн.) + BaSO 4 (с)  ) + SO 4 2- (водн.) → BaSO 4 (s)
) + SO 4 2- (водн.) → BaSO 4 (s) 

 ).
).

 ), и сульфат натрия,
Na 2 SO 4 (водн.), Смешаны.Если есть реакция осаждения, напишите
полное и чистое ионное уравнение, описывающее реакцию.
), и сульфат натрия,
Na 2 SO 4 (водн.), Смешаны.Если есть реакция осаждения, напишите
полное и чистое ионное уравнение, описывающее реакцию.
