What, How to Balance & FAQs —
By Аджай Шарма
Гипофосфит стронция представляет собой кислую соль. Давайте посмотрим несколько фактов о HCl+ NaH.2PO2.
Гипофосфит стронция имеет молярную массу 87.98 г/моль и плотность 800 кг/м3. Три — это количество акцепторов водородной связи. HCl также называется соляной кислотой и имеет молекулярная масса из 36.46. Он показывает четыре пика в ГХ-МС спектр.
Давайте обсудим тип реакции, энтальпию реакции, количество тепла, выделяющегося в реакции, результирующее ионное уравнение и балансировку в этой статье.
Что является продуктом HCl и NaH2PO2?HCl и NaH2PO2 есть следующие продукты. Гидрофосфат натрия (NaH2PO3), фосфор, газообразный водород и хлорид натрия (NaCl)
6 NaH2PO2 + 2 HCl → 4 NaH2PO3 + 2 П + 3 Н2 + 2 NaCl
Какой тип реакции HCl + NaH2PO2?Реакция между HCl + NaH2PO2 является экзотермической реакцией, поскольку выделяется тепло, и окислительно-восстановительной реакцией.
Эта реакция между HCl + NaH2PO2 не уравновешен, потому что количество молекул в левой и правой частях неодинаково.
- Неа2PO2 + HCl → NaH2PO3 + П + Н2 + NaCl
- следовательно, мы должны уравновесить реакцию впоследствии
- На первом этапе мы должны присвоить коэффициенты каждой молекуле в реакции. Мы присваиваем P, Q, R, S, T и U, потому что у нас есть шесть молекул. Реакция будет выглядеть так,
- P NaH2PO2 + Q HCl → R NaH2PO3 + СП + ТД2 + U NaCl
- Маркированный коэффициенты могут использоваться как алфавиты для реагентов и продуктов.
- Na=P+R, O=2P+3R, H=2P+Q+2R+2T, P=P+S и Cl=Q+U.

- Для расчета значений коэффициентов используется метод исключения Гаусса.
- P = 6, Q = 2, R = 4, S = 2, T = 3 и U = 2
- Итак, уравновешенная эквивалентность реакции:
- 6 NaH2PO2 + 2 HCl → 4 NaH2PO3 + 2 П + 3 Н2 + 2 NaCl
В реакции между HCl и NaH2PO2 титрования не происходит, так как для титрования нельзя использовать сильнодействующие кислоты, такие как HCl, а водный раствор NaH2PO2 растворы могут взорваться испарение.
HCl + NaH2PO2 чистое ионное уравнение?HCl и NaH2PO2 имеют следующее ионное уравнение
- Na1+ + 2H+ + ЗП21- → 2 На1+ + 4H+ + PO33- + Р + Cl–
- Мы должны следовать шагам, чтобы прийти к чистому ионному уравнению.

- Сбалансированное химическое уравнение представляет собой состояния продуктов и реагентов.
- Неа2PO2 (как) + HCl (как) → NaH2PO3 (так как) + Р (г) + Н2 (ж) + NaCl (в виде)
- Кислоты, основания и соли диссоциируют на соответствующие им ионы, тогда как чистые вещества не могут диссоциировать на ионы. Итак, окончательное уравнение диссоциации имеет вид
- Na1+ + 2H+ + ЗП21- → 2 На1+ + 4H+ + ЗП33- + Р + Cl–
HCl + NaH2PO2 имеет следующие сопряженные пары,
- Неа2PO2 не имеет сопряженных пар
- Сопряженная пара HCl представляет собой Cl–.

Реакция между HCl и NaH2PO2 имеет следующие межмолекулярные силы,
- Неа2PO2 имеет ионную силу и водородную связь.
- HCl имеет Диполь-дипольное взаимодействие и дисперсионные силы.
HCl + NaH2PO2 реакции, их энтальпия пока не установлена из-за стехиометрии.
HCl + NaH2PO2 буферный раствор?HCl + NaH2PO2 в качестве буфера невозможно, так как используется сильная кислота (HCl).
HCl + NaH2PO2 полная реакция?HCl + NaH2PO2 представляет собой полную реакцию с гидрофосфатом натрия (NaH2PO3), фосфор, газообразный водород и хлорид натрия (NaCl) в качестве их продуктов.
6 NaH2PO2 + 2 HCl → 4 NaH2PO3 + 2 П + 3 Н2 + 2 NaCl
HCl + NaH2PO2 экзотермическая или эндотермическая реакция?HCl + NaH2PO2 является экзотермической реакцией, так как выделяется тепло.
HCl + NaH2PO2 окислительно-восстановительная реакция?HCl + NaH2PO2 является окислительно-восстановительной реакцией, поскольку происходит изменение степени окисления P. P уменьшается с +5 до +3, то есть приобретается 2 электрона, а H окисляется, поскольку его степень окисления изменяется с -1 до +1.
HCl + NaH2PO2 реакция осаждения?HCl + NaH2PO2 представляет собой реакцию осаждения в виде хлорида натрия (NaCl) и гидрофосфата натрия (NaH2PO3) получают в виде остатка.
HCl + NaH2PO2 является необратимой реакцией, так как выделяются газообразные продукты, которые не могут быть превращены обратно в реагенты.
HCl + NaH2PO2 реакция смещения?HCl + NaH2PO2 не является реакцией замещения, потому что продукты не замещаются, чтобы вернуть реагенты.
Заключение
В заключение, реакция между HCl и NaH2PO2 является окислительно-восстановительной реакцией. Буферный раствор не образуется, и энтальпия его реакции пока не установлена. Неа2PO2 играет важную роль в химическом никелировании. Неа2PO3 восстанавливает ионы металлов до их оснований.
|
Перед тем как начать писать окислительно-восстановительные реакции, необходимо знать какие степени окисления может проявлять тот или иной химический элемент. Элементы с постоянными степенями окисления в сложных соединениях:
Элементы с переменными степенями окисления:1. Водород Водород
2. Кислород Кислород
3.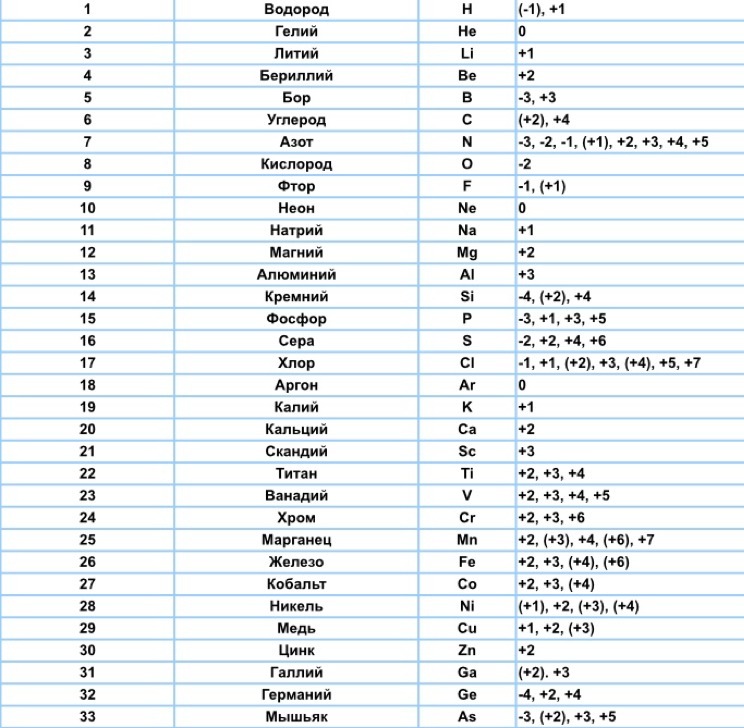 Сера Сера
4. Азот Азот
5. Галогены* Галогены*
* Для фтора только 0 и -1; At также является галогеном, но его не рассматриваем, так как в природе его практически нет.
6. Углерод**
** В органических соединениях углерод проявляет все степени окисления от -4 (например, Ch5) до +3 (например, Ch4COOH).
7. Фосфор
8. Хром Хром
9. Железо Железо
10. Медь Медь
11. Марганец Марганец
12. Кремний Кремний
|
Найдите степень окисления P в $Na{H_2}P{O_4}$.

Последняя обновленная дата: 30 марта 2023 г.
•
Общее представление: 218,6K
•
Просмотры сегодня: 5,94K
Ответ
Проверено
218,6K+ просмот }P{O_4}$ называется дигидрофосфатом натрия или монофосфатом натрия. Это соединение содержит натрий (Na), водород (H), фосфор (P) и кислород (O). Фосфор принадлежит к группе азота, и его атомный номер равен 15. Общая степень окисления натрия равна +1, кислорода равна -2, а водорода равна +1. Итак, используя степени окисления этих атомов, мы собираемся найти степень окисления фосфора.
Полный ответ: Нам дано найти степень окисления P в $Na{H_2}P{O_4}$.
Фосфор является неметаллом и относится к группе 17 th . Его атомный номер — 15.
Степень окисления, также известная как степень окисления, представляет собой общее количество электронов, которые атом либо теряет, либо приобретает для образования связи с другим атомом.
Степень окисления полного соединения всегда равна нулю, что означает, что соединение всегда должно быть нейтральным. Так что и здесь степень окисления $Na{H_2}P{O_4}$ равна нулю, а это означает, что сумма всех степеней окисления атомов, участвующих в образовании $Na{H_2}P{O_4}$, должна составлять нуль.
Мы знаем, что степень окисления натрия +1, водорода +1 и кислорода -2, и пусть степень окисления фосфора в $Na{H_2}P{O_4}$ равна x.
Тогда $1\left( { + 1} \right) + 2\left( { + 1} \right) + x + 4\left( { — 2} \right) = 0$, так как есть 2 атома водорода и 4 атома кислорода
$ \Rightarrow 1 + 2 + x — 8 = 0$
$ \Rightarrow x — 5 = 0$
$\следовательно x = + 5$
Следовательно, степень окисления фосфора в $Na{ H_2}P{O_4}$ равно +5.
Примечание: Фосфор имеет переменную валентность (+5, +3), поэтому его называют поливалентным неметаллом. Не путайте степень окисления с валентностью. Иногда валентность и степень окисления могут быть одинаковыми, а иногда могут различаться. Валентность — нет. электронов, присутствующих в самой внешней оболочке определенного элемента, тогда как степень окисления — нет. электронов, которые элемент потерял или приобрел при образовании определенного соединения.
Валентность — нет. электронов, присутствующих в самой внешней оболочке определенного элемента, тогда как степень окисления — нет. электронов, которые элемент потерял или приобрел при образовании определенного соединения.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
Трендовые сомнения
P4 + NAOH → PH4 + NAH3PO2 Правильное заявление среди следующего —
SELECT Вопрос:
Рекомендованные MCQS — 86 Вопросы Рекомендованные MCQS — 86 ВОПРОСА 9000 2.
 Рекомендованный MCQS — 86 Вопрос
Рекомендованный MCQS — 86 Вопрос. На основе)
Mini Q Bank — окислительно-восстановительные реакции NCERT Решенные примеры на основе MCQ NCERT Упражнения на основе MCQ NCERT Exemplar (Objective) Based MCQs AR & Other Type MCQs Past Year (2019 onward — NTA Papers) MCQs Past Year (2016 — 2018) MCQs Прошлый год (2006 — 2015) MCQS Прошлый год (1998 — 2005).2Правильное утверждение среди следующих —
1. P окисляется только.
2. Только P уменьшается.
3. P окисляется, а также восстанавливается.
4. Na восстановлен.
Q168:
88
% From NCERT
(1)
(2)
(3)
(4)
Subtopic: Balancing уравнений |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th & XII th Физика, химия и биология
Степень окисления бария в пероксиде бария:
1. +6
2. +2
3. 1
4009 4 :70
%от NCERT
(1)
(2)
9000. 9000.9013 9000.
9000.
9000 2
9000 2
9000 2
9000 2
(3) 9000.
 9000. 9013
9000. 90139000 2
9000 2 9000 2
9000 2 9000 2
9000 2 9013 9000 2 9013 9000 2 9013 9000 2 9013
(3). |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th & xii TH Физика, химия и биология
Максимальное состояние окисления Cr равно:
1. 3
2. 4
3. 6
4. 7
Q170:
. 79
% From NCERT
(1)
(2)
(3)
(4)
Subtopic: Oxidizing & Reducing Agents |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.

NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Physics, Chemistry & Biology
Количество окисления CR в K2CR2O7 IS:
1. +6
2. -7
3. +2
4. -2
Q171:
94
%от NCERT
(1)
(2)
(3)
(4)
Subtopic: Oxidizing & Reduciting Agents |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.

NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Физика, химия и биология
x5 перекисное состояние кислорода в кислороде это :
1. -1
2. +1
3. 0
4. -2
Q172:
82
%от NCERT
(1)
79161616168(1)
16916916916169169169169168- 9000 2
.
 2)
2) (3)
(4)
(1)
(2)
(3)
( 4)
(1)
(2)
(3)
(4)
(1)
91891117911171179179179179171791791717917917179178 7
8
8
8
91616168
91616168
161669161668
8
8
8
8
8
89168
916168
8
Подтема: Окислители и восстановители |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите NeetPrep’s Уникальные MCQ Books с онлайн Audio/Video/Text Solutions с помощью Telegram Bot
NEET MCQ Книги для XI TH & XII TH Physics, Chemistry & Biology
2MNO4-3O2+5H3O2+5H3O2+5H3O2+5H3O2+5H3O2+5H3O2. 2 Z+5O2+8h3O. В этой реакции Z:
1. Mn2+
2. Mn4+
3. MnO2
4. Mn
Q173:
77
% From NCERT
Подтема: Балансировка уравнений |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.

NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Физика, химия и биология
5 сильный окислитель?
1. F2
2. Cl2
3. Br2
4. I2
Q174:
84
% From NCERT
Подтема: Окислители и восстановители |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.

NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Физика, химия и биология
5 Показать различные состояния окисления азота диапазон:
1. 0…+5
2. -3…+5
3. от -5 до +3
4. -3 до +3
Q175:
82
%от NCERT
9000 2
17118 9007 (2).
(3)
(4)
Подтема: Окислители и восстановители |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальные книги MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Сколько физика, химия и биология могут быть 7 moles
5 восстановленный 1 моль Sn2+?\
1. 1/3
2. 1/6
3. 2/3
4. 1
Q176:
57
% From NCERT
(1)
(2)
(3)
(4)
Подтема: Эквивалентный вес |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Чтобы просмотреть объяснение, пожалуйста, пройдите пробную версию в курсе ниже.
NEET 2023 — Целевая партия — Арьян Радж Сингх
Пожалуйста, сначала попробуйте ответить на этот вопрос.
Предпочитаете книги для практики вопросов? Получите уникальных книг MCQ от NEETprep с онлайн-решениями для аудио/видео/текста через Telegram Bot
Книги NEET MCQ для XI th и XII th Physics, Chemistry & Biology
5 нейтральная водная среда непропорциональна:
1. 2/3 моля MnO4- и 1/3 моля MnO2
2. 1/3 моль MnO4- и 2/3 моль MnO2
3. 1/3 моль Mn2O7 и 1/3 моль MnO2
4. 2/3 моль Mn2O7 и 1/3 моль of MnO2
Q177:
57
% From NCERT
(1)
(2)
(3)
(4)
Subtopic : Балансировка уравнений | окислительно-восстановительное титрование и тип окислительно-восстановительного потенциала |
Чтобы просмотреть объяснение, пожалуйста, пройдите пробный курс, описанный ниже.




 Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ.
Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ.

 9000. 9013
9000. 9013

 2)
2)