СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
24.10.2022
СУНЦ на конкурсе «Университетская книга»
Издания СУНЦ УрФУ получили высокую оценку на межрегиональном конкурсе.
20.10.2022
УрКОП: шаг вперёд сделан!
Учащийся СУНЦ в составе команды стал победителем командной олимпиады по программированию.
19.10.2022
«Любите общагу!»
Лицеисты, живущие в интернате, поздравили воспитателей.
14.10.2022
СУНЦ как кузница ученых будущего
Лицеист СУНЦ стал победителем международного конкурса в номинации «Математика».
07.10.2022
Все учителя СУНЦ — бриллианты!
Под этим девизом пятого октября в СУНЦ прошел концерт в честь Дня учителя.
29.09.2022
Лицеисты СУНЦ покорили хребет Зюраткуль!
В последние выходные сентября учащиеся СУНЦ побывали в национальном парке «Зюраткуль».
Больше новостей
Видеогалерея:
Концерт к Дню учителя (2022)
Репортаж ТРК «Вести-Урал» о гаджетах у школьника (2022)
Концерт, посвященный Дню Победы (5 мая 2022 года)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями. Обучение производится по авторским программам, разработанным в соответствии с федеральными государственными образовательными стандартами; в составе СУНЦ — 8–11 классы различных профилей.
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9 и 10 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Данилы Зверева ул., 30, Екатеринбург. N56°52´4˝ E60°39´16˝
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 12, 19 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.
Структура нитрата кальция (Ca (NO3) 2), свойства, применение и применение / химия | Thpanorama
нитрат кальция третичная неорганическая соль, химическая формула которой Ca (NO)3)2. Из его формулы известно, что его твердое вещество состоит из ионов Ca2+ и НЕТ3— в соотношении 1: 2. Следовательно, это соединение чисто ионной природы.
Из его формулы известно, что его твердое вещество состоит из ионов Ca2+ и НЕТ3— в соотношении 1: 2. Следовательно, это соединение чисто ионной природы.
Одним из его свойств является его окислительный характер благодаря нитрат-аниону. Он не горючий, то есть не горит при высоких температурах. Будучи негорючим, он представляет собой надежный сейф, с которым можно обращаться без особой осторожности; однако, это может ускорить воспламенение горючих материалов..
Его внешний вид состоит из гранулированного твердого вещества, которое имеет белый или светло-серый цвет (верхнее изображение). Может быть безводным или тетрагидратированным, Ca (NO3)2· 4H2О. Он очень растворим в воде, метаноле и ацетоне.
Нитрат кальция широко используется в качестве удобрения, поскольку он легко перемещается во влажной почве и быстро усваивается корнями растений. Он обеспечивает два важных элемента для питания и роста растений: азот и кальций.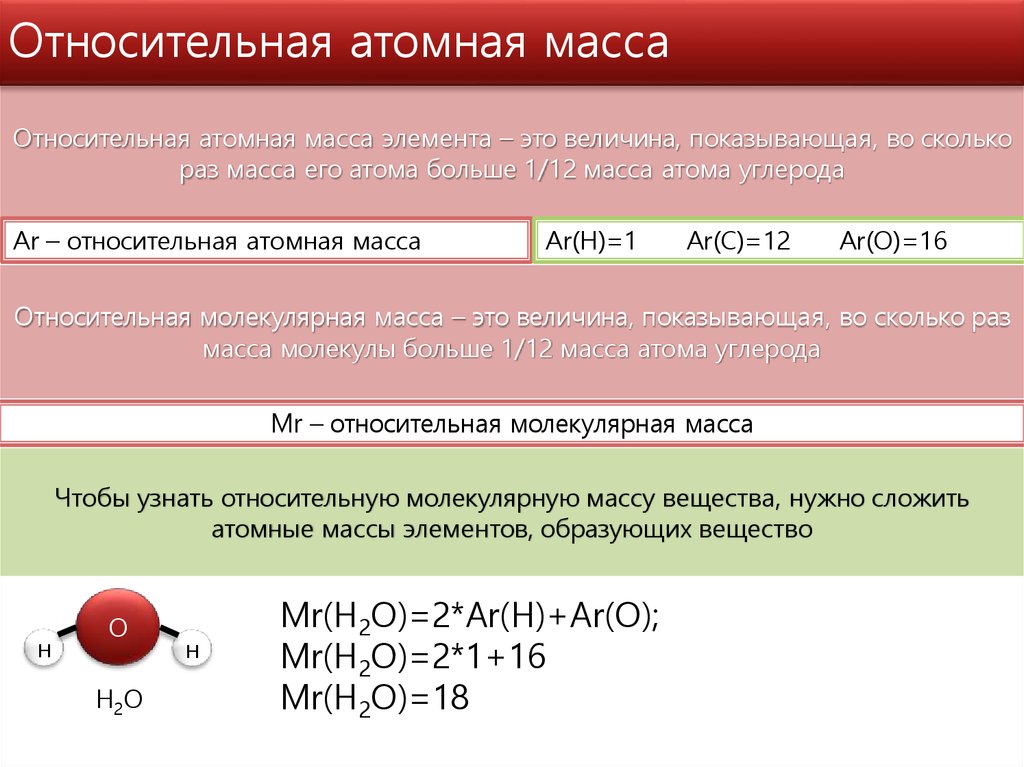
Азот является одним из трех важнейших элементов для развития растений (N, P и K), имеет важное значение в синтезе белков. Между тем, кальций необходим для поддержания структуры клеточной стенки растений. По этой причине Ca (НЕТ3)2 это предназначено много в сады.
С другой стороны, эта соль обладает токсическим действием, особенно при непосредственном контакте с кожей и глазами, а также при вдыхании ее пыли. Кроме того, он может разлагаться при нагревании.
индекс
- 1 Структура нитрата кальция
- 2 Физические и химические свойства
- 2.1 Химические названия
- 2.2 Молекулярная формула
- 2.3 Молекулярный вес
- 2.4 Внешний вид
- 2.5 Точка кипения
- 2.6 Точка плавления
- 2.7 Растворимость в воде
- 2.8 Растворимость в органических растворителях
- 2.9 Кислотность (пКа)
- 2.10 Плотность
- 2.11 Разложение
- 2.12 Реактивный профиль
- 3 использования
- 3.
 1 Сельское хозяйство
1 Сельское хозяйство - 3.2 Бетон
- 3.3 Очистка сточных вод или сточных вод
- 3.4 Приготовление холодных компрессов
- 3.5 Латексная коагуляция
- 3.6 Передача и хранение тепла
- 3.
- 4 анкеты
- 5 ссылок
Структура Ca (NO) показана на изображении выше3)2 в модели сфер и баров. Здесь, однако, есть недостаток: предполагается существование ковалентных связей Ca-O, что противоречит его ионному характеру. Разъяснение этого, действительно взаимодействия имеют электростатический тип.
Катион Са2+ окружен двумя NO анионов3— в соответствии с его пропорциями в кристалле. Азот в форме нитрата преобладает в кристаллической структуре.
Ионы сгруппированы таким образом, что они устанавливают конфигурацию, минимальным выражением которой является элементарная ячейка; который для безводной соли является кубическим. Другими словами, из кубов, содержащих для этих ионов соотношение 1: 2, кристалл воспроизводится полностью.
С другой стороны, тетрагидратированная соль Ca (NO)3)2· 4H2Или это имеет четыре молекулы воды на комплект NO3— Калифорния2+ НЕТ3—. Это изменяет кристаллическую структуру, превращая ее в моноклинную элементарную ячейку.
Следовательно, ожидается, что кристаллы для обеих солей, безводной и тетрагидратированной, будут разными; различия, которые можно определить по их физическим свойствам, например, по точкам плавления.
Физико-химические свойстваХимические названия-Нитрат кальция
-Динитрат кальция
-Nitrocalcita
-Норвежская селитра и известь сальпетро.
Молекулярная формулаCa (НЕТ3)2 или CaN2О6
Молекулярный весБезводный 164,088 г / моль и тетрагидрат 236,15 г / моль. Обратите внимание на влияние воды на молекулярную массу, и им нельзя пренебрегать при соответствующем взвешивании. .
.
Твердые или гранулы белого или светло-серого цвета. Кубические белые кристаллы или распущенные гранулы; то есть они впитывают влагу до такой степени, что они растворяются из-за их высокой растворимости.
Точка кипенияБезводная форма разлагается при нагревании до температуры, которая не позволяет определить ее температуру кипения; в то время как тетрагидратированная форма соли имеет температуру кипения 132 ° С (270 ° F, 405 К).
Точка плавления-Безводная форма: от 561 ºC до 760 мм рт. Ст. (1042 ºF, 834 K).
-Тетрагидратированная форма: 42,7 ºC (109 ºF, 316 K).
Это показывает, как молекулы воды вмешиваются в электростатические взаимодействия между Са2+ и НЕТ3— внутри кристаллов; и, следовательно, твердое вещество плавится при значительно более низкой температуре.
Растворимость в воде-Безводная форма: 1212 г / л при 20 ºC.
-Тетрагидратированная форма: 1290 г / л при 20 ºC.
Вода в кристаллах едва увеличивает растворимость соли.
Растворимость в органических растворителях-В этаноле, 51,42 г / 100 г при 20 ºC.
-В метаноле 134 г / 100 г при 10 ºC.
-В ацетоне, 168 г / 100 г при 20 ºC.
Кислотность (пКа)6,0
плотность2,5 г / см3 при 25 ° С (тетрагидрат).
разложениеКогда нитрат кальция нагревается до ламп накаливания, он разлагается на оксид кальция, оксид азота и кислород.
Реактивный профильЭто сильно окисляющий агент, но он не горючий. Ускоряет воспламенение горючих материалов. Разделение нитрата кальция на мелкие частицы облегчает его взрыв, когда соединение подвергается длительному воздействию огня..
Смеси с алкиловыми эфирами становятся взрывоопасными при образовании алкилнитратных сложных эфиров. Комбинация нитрата кальция с фосфором, хлоридом олова (II) или другим восстановителем может реагировать взрывоопасно.
Он используется в сельскохозяйственных культурах в качестве источника азота и кальция. Нитрат кальция очень хорошо растворяется в воде и легко усваивается корнями растений. Кроме того, он не окисляет почвы, потому что их ионы не могут значительно гидролизовать.
Избегайте смешивания с удобрениями, содержащими фосфор или сульфат, чтобы избежать образования нерастворимых солей. Вследствие своей гигроскопичности его следует хранить в сухом и прохладном месте..
Его использование имеет преимущество перед использованием аммиачной селитры в качестве удобрения. Хотя это последнее соединение вносит азот в растения, оно препятствует усвоению кальция, что может привести к дефициту кальция в растениях..
Кальций способствует поддержанию структуры клеточной стенки растений. При наличии дефицита кальция ткани, образующие растения, такие как кончики корней, молодые листья и кончики почек, часто демонстрируют искаженный рост. .
.
Нитрат кальция уменьшает накопление летучих жирных кислот и фенольных, фитотоксичных соединений, которые накапливаются вследствие разложения остатков соевых культур.
Кроме того, нитрат кальция имеет тенденцию к снижению концентрации аммония в почве, что увеличивает буферную емкость водорода.
бетонНитрат кальция используется для сокращения времени схватывания бетона. Это происходит в результате образования гидроксида кальция, возможно, в результате реакции двойного вытеснения..
Кроме того, нитрат кальция вызывает образование соединения гидроксида железа, защитное действие которого снижает его коррозию. То есть присутствующее железо может реагировать с основными компонентами бетона, такими как сам гидроксид кальция.
Нитрат кальция уменьшает время схватывания, а также прочность бетона, к которому был добавлен вулканический пепел. Для изучения влияния добавления нитрата кальция к бетону были использованы возрастающие концентрации нитрата кальция, от 2% до 10%.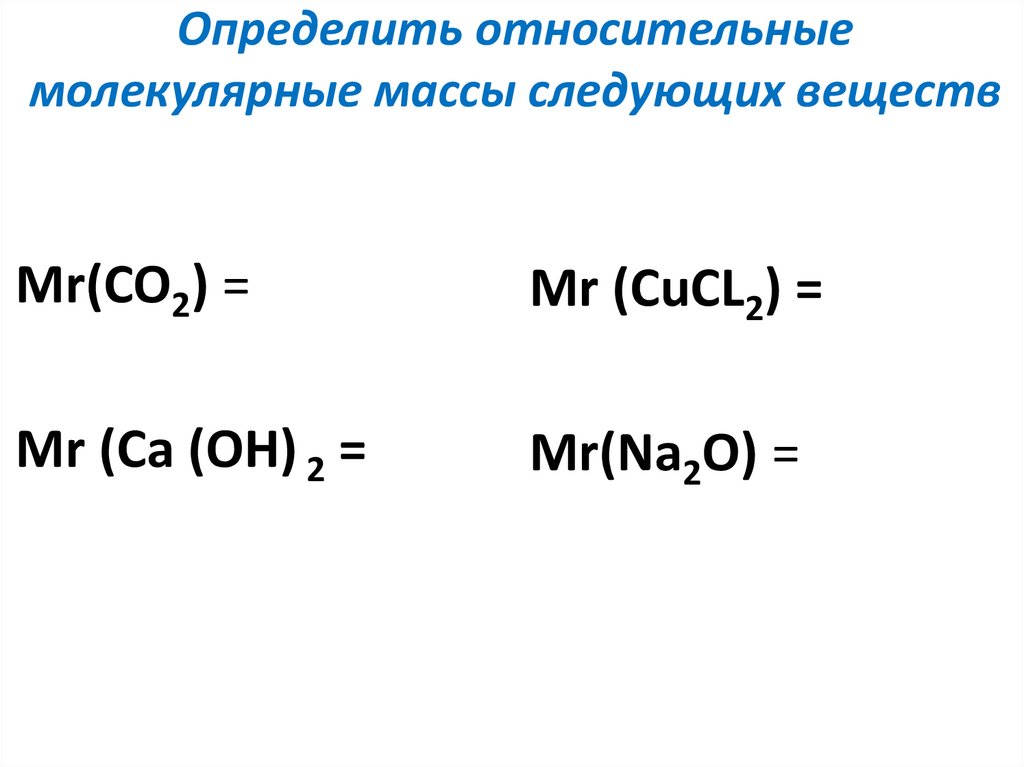 .
.
Наблюдается большее уменьшение времени схватывания, а также увеличение прочности бетона, так как концентрация нитрата кальция увеличилась до 10%..
Сточные воды или очистка сточных водНитрат кальция используется для уменьшения неприятных запахов из сточных вод за счет уменьшения образования сероводорода. Кроме того, органическое вещество, которое генерирует анаэробные условия, потребляется, что препятствует выживанию многих биологических видов..
Приготовление холодных компрессовТетрагидрат нитрата кальция является эндотермическим соединением, то есть обладает способностью поглощать тепло из окружающей среды. Это приводит к охлаждению тел, которые входят в контакт с контейнерами, которые его содержат.
Компрессы повышают их температуру, и для их регенерации достаточно поместить их в морозильник
Латексная коагуляцияНитрат кальция используется в фазе коагуляции латекса. Он является частью иммерсионного раствора, и когда он вступает в контакт с раствором, содержащим латекс, он нарушает его стабилизацию и вызывает его коагуляцию.
Бинарная смесь солей расплавленных нитратов, включая кальций с другими нитратами, используется вместо термального масла на солнечных электростанциях для передачи и хранения тепла..
Анкеты-Применяется нитрат кальция в смеси с почвой в концентрации 1,59 кг на 30,48 м.2, с адекватным поливом. Нитрат кальция растворяется в воде, что позволяет его усвоению корнями растения. В гидропонных культурах растворяется в воде культуры.
-Нитрат кальция также используется в виде спрея для опрыскивания листьев и цветов, что является эффективным средством для предотвращения гниения цветка томата, пятна от пробки и горькой косточки яблока..
-К бетонообразующей смеси добавляется некоторое количество нитрата кальция (цемент, песок, камни и вода), и определяется влияние его добавления на конкретные свойства бетона; такие как установка скорости и сопротивления.
-Нитрат кальция добавляется в подходящей концентрации, чтобы уменьшить запахи из сточных вод или сточных вод до уровня, чтобы запахи были приемлемыми для людей.
- Бонни Л. Грант. (2019). Удобрение нитрата кальция — что делает нитрат кальция для растений. Получено от: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. и Вин, Т.Дж. (1990). Использование нитрата кальция для снижения накопления фитотоксинов при разложении остатков в корп. Канадский журнал почвоведения 70 (4): 723-726.
- Огунбоде, Е. Б. и Хасан, И.О. (2011). Влияние добавления нитрата кальция на селективные свойства бетона, содержащего вулканический пепел. Леонардо Электронный журнал практик технологий 19: 29-38.
- Wikipedia. (2019). Нитрат кальция. Получено с: en.wikipedia.org
- Shiqi Dong & col. (2018). Ингибирование коррозии стали нитратом кальция в обогащенных галогенидами средах для заканчивания. npj Материалы для разложения тома 2, номер артикула: 32.
- Emaginationz Technologies. (2019). Спецификации нитрата кальция. Получено с: direct2farmer.com
- PubChem. (2019). Нитрат кальция.
 Получено из: pubchem.ncbi.nlm.nih.gov
Получено из: pubchem.ncbi.nlm.nih.gov
8.03: Молярная масса — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 178153
Цели обучения
- Определение молярной массы соединения или молекулы.
- Преобразование молей в граммы и граммов в моли.
В предыдущем разделе мы определили молярную массу как массу одного моля чего-либо или массу 6,022 x 10
Молярная масса
Молярная масса определяется как масса одного моля репрезентативных частиц вещества. Глядя на периодическую таблицу, мы можем сделать вывод, что молярная масса лития равна \(6,9{23}\) атомов этого конкретного элемента. Единицами молярной массы являются граммы на моль или \(\text{г/моль}\).
Глядя на периодическую таблицу, мы можем сделать вывод, что молярная масса лития равна \(6,9{23}\) атомов этого конкретного элемента. Единицами молярной массы являются граммы на моль или \(\text{г/моль}\).
Молярные массы соединений
Молекулярная формула соединения двуокиси углерода: \(\ce{CO_2}\). Одна молекула углекислого газа состоит из 1 атома углерода и 2 атомов кислорода. Мы можем рассчитать массу одной молекулы углекислого газа, сложив вместе массы 1 атома углерода и 2 атомов кислорода.
\[12.01 \: \text{аму} + 2 \влево( 16.00 \: \text{аму} \вправо) = 44.01 \: \text{аму}\]
молекулярная масса соединения представляет собой массу одной молекулы этого соединения. Молекулярная масса углекислого газа равна \(44,01 \: \text{аму}\).
Молярная масса любого соединения – это масса в граммах одного моля этого соединения. Один моль молекул углекислого газа имеет массу \(44,01 \: \text{г}\), а один моль формульных единиц сульфида натрия имеет массу \(78,04 \: \text{г}\).
Пример \(\PageIndex{1}\)
Нитрат кальция, \(\ce{Ca(NO_3)_2}\), используется в качестве компонента удобрений. Определите молярную массу нитрата кальция.
Решение:
Шаг 1: Перечислите известные и неизвестные величины и спланируйте задачу .
Известен
- Формула \(= \ce{Ca(NO_3)_2}\)
- Молярная масса \(\ce{Ca} = 40,08 \: \text{г/моль}\)
- Молярная масса \(\ce{N} = 14,01 \: \text{г/моль}\)
- Молярная масса \(\ce{O} = 16.00 \: \text{г/моль}\)
Неизвестно
Молярная масса \(\ce{Ca(NO_3)_2}\)
Сначала нужно проанализировать формулу. Поскольку у \(\ce{Ca}\) нет нижнего индекса, на формульную единицу приходится один атом \(\ce{Ca}\). Цифра 2 за скобками означает, что на формульную единицу приходится два нитрат-иона, и каждый нитрат-ион состоит из одного атома азота и трех атомов кислорода на формульную единицу.
Шаг 2: Рассчитайте
Используйте молярные массы каждого атома вместе с количеством атомов в формуле и сложите вместе.
\[1 \: \text{mol} \: \ce{Ca} \times \frac{40.08 \: \text{g} \: \ce{Ca}}{1 \: \text{mol} \ : \ce{Ca}} = 40,08 \: \text{g} \: \ce{Ca}\]
\[2 \: \text{моль} \: \ce{N} \times \frac{14,01 \: \text{g} \: \ce{N}}{1 \: \text{mol} \: \ce{N}} = 28,02 \: \text{g} \: \ce{N}\]
\[6 \: \text{mol} \: \ce{O} \times \frac{16.00 \: \text{g} \: \ce{O}}{1 \: \text{mol} \ : \се{О}} = 96,00 \: \text{g} \: \ce{O}\]
Молярная масса \(\ce{Ca(NO_3)_2} = 40,08 \: \text{g} + 28,02 \: \text{g } + 96,00 \: \text{g} = 164,10 \: \text{г/моль}\)
Вот еще несколько примеров:
- Масса атома водорода равна 1,0079 а.е.м.; масса 1 моля атомов водорода равна 1,0079 г.

- Элементарный водород существует в виде двухатомной молекулы H 2 . Одна молекула имеет массу 1,0079 + 1,0079 = 2,0158 а.е.м., а 1 моль H 2 имеет массу 2,0158 г.
- Молекула H 2 O имеет массу около 18,01 а.е.м.; 1 моль H 2 O имеет массу 18,01 г.
- Одна единица NaCl имеет массу 58,45 а.е.м.; NaCl имеет молярную массу 58,45 г.
В каждом из этих молей вещества содержится 6,022 × 10 23 единиц:
- 6,022 × 10 23 атомов H
- 6,022 × 10 23 молекулы H 2 и H 2 O,
- 6,022 × 10 23 ед. ионов NaCl.
Эти отношения дают нам массу возможностей для создания коэффициентов пересчета для простых расчетов.
Пример \(\PageIndex{2}\)
Какова молярная масса C 6 H 12 O 6 ?
Решение
Чтобы определить молярную массу, мы просто добавляем атомные массы атомов в молекулярную формулу, но выражаем общее количество в граммах на моль, а не в единицах атомной массы. Массы атомов можно взять из периодической таблицы.
Массы атомов можно взять из периодической таблицы.
| 6 С = 6 × 12,011 | = 72,066 |
| 12 Н = 12 × 1,0079 | = 12,0948 |
| 6 О = 6 × 15,999 | = 95,994 |
| ВСЕГО | = 180,155 г/моль |
По соглашению единица измерения грамма на моль записывается в виде дроби.
Упражнение \(\PageIndex{2}\)
Какова молярная масса AgNO 3 ?
Ответ
169,87 г/моль
Зная молярную массу вещества, мы можем вычислить количество молей в определенной массе вещества и наоборот, как показывают эти примеры. В качестве коэффициента пересчета используется молярная масса.
Пример \(\PageIndex{3}\)
Какова масса 3,56 моля HgCl 2 ? Молярная масса HgCl 2 составляет 271,49 г/моль.
Раствор
Используйте молярную массу в качестве коэффициента преобразования молей в граммы. Поскольку мы хотим отказаться от единицы моль и ввести единицу грамма, мы можем использовать молярную массу как заданную:
\[3,56\, \отменить{моль\, HgCl_{2}}\times \frac{271,49\, г \, HgCl_{2}}{\cancel{mol\, HgCl_{2}}}=967\, g\, HgCl_{2}\]
Упражнение \(\PageIndex{3}\)
Что такое масса 33,7 моль H 2 O?
Ответ
607 г
Пример \(\PageIndex{4}\)
Сколько молей H 2 O содержится в 240,0 г воды (около массы чашки воды)?
Раствор
Используйте молярную массу H 2 O в качестве коэффициента преобразования массы в моли. Молярная масса воды (1,0079 + 1,0079 + 15,999) = 18,015 г/моль. Однако, поскольку мы хотим отказаться от единицы грамм и ввести моли, нам нужно взять обратную величину этого количества, или 1 моль/18,015 г:
\[240,0\, \отменить{g\, H_{2}O}\times \frac{1\, моль\, H_{2}O}{18,015\отменить{g\, H_{2}O} }=13,32\, моль\, H_{2}O\]
Упражнение \(\PageIndex{4}\)
Сколько молей содержится в 35,6 г H 2 SO 4 (молярная масса = 98,08 г/моль)?
Ответ
0,363 моль
Другие коэффициенты преобразования могут быть объединены, например, с определением молярной плотности.
Пример \(\PageIndex{5}\)
Плотность этанола 0,789 г/мл. Сколько молей в 100,0 мл этанола? Молярная масса этанола 46,08 г/моль.
Решение
Здесь мы используем плотность для преобразования объема в массу, а затем используем молярную массу для определения количества молей.
\[100\cancel{мл}\: этанол\times \frac{0,789\, g}{\cancel{ml}}\times \frac{1\, mol}{46,08\, \cancel{g}} =1,71\, моль\, этанол\]
Упражнение \(\PageIndex{5}\)
Если плотность бензола, C 6 H 6 , равно 0,879 г/мл, сколько молей содержится в 17,9 мл бензола?
Ответ
0,201 моль
Перевод массы, молей или атомов соединения в массу, моли или атомы его элементов
Теперь, когда мы знаем, как преобразовать из атомов в молекулы, из молекул в моли и из молей в граммы мы можем объединить эти коэффициенты преобразования для решения более сложных задач.
Пример \(\PageIndex{6}\): Преобразование между граммами и атомами
Сколько атомов водорода содержится в 4,6 г CH 3 OH?
Раствор
Сначала нам нужно определить массу одного моля метана (CH 3 OH).
Используя периодическую таблицу, чтобы найти массу каждого моля наших элементов, мы имеем:
\[1\, моль\, C \,= 1\, \cancel{mol\, C}\,\times \left (\frac{12.011\, g\, C}{1\,\cancel{моль\,C}} \right)\, = 12.011 \, g\, C\]
\[4\, моль\, H \,= 4\, \cancel{моль\,H}\,\times\left(\frac{1.008\,g\,H}{1\,\cancel{моль\,H}}\right)\ , = 4,032 \,g\, Н\]
\[1\, моль\, O \,= 1\, \cancel{моль\, O}\,\times \left(\frac{15.999\, g\, O}{1\,\cancel{ моль\,O}} \right)\, = 15,999 \, г\,O\]
Добавление масс наших отдельных элементов имеет:
\[12,011\, g \,+ \,4,032\,g\, +\, 15,999\, g\, =\,32,042\, g\, CH_{3}OH\]
Как мы вычисляли молярная масса CH 3 OH имеем
\[32,042\, г\, CH_{3}OH\, = \,1\, моль \,CH_{3}OH\]
Что мы можем использовать в качестве коэффициента пересчета
\[\frac{32,042\, г\, CH_{3}OH}{1\, моль\, CH_{3}OH}\, или\, \frac{1\, моль\, СН_{3}ОН}{32,042\, г\, СН_{3}ОН}\] 9{23}\, атомы\, H\]
Упражнение \(\PageIndex{6}\)
Сколько атомов H содержится в 2,06 граммах \(\ce{H_{2}O}\)?
Ответ
1,38 x 10 23 атомов H
Пример \(\PageIndex{7}\): Преобразование граммов в граммы H
3 901 г кислорода содержится в PO 4Раствор
Сначала нужно определить массу одного моля фосфорной кислоты \(\ce{H_{3}PO_{4}}\)
Имеем:
\[3\, моль\, H \,= 3\, \cancel{моль\, H}\,\times \left(\frac{1. 008\, g\, H}{1 \,\отмена{моль\,Н}} \справа)\, = 3,024\,г\, Н\]
008\, g\, H}{1 \,\отмена{моль\,Н}} \справа)\, = 3,024\,г\, Н\]
\[1\, моль\, Р \,= 1\, \отменить{моль\, Р }\,\times \left(\frac{30,974\, g\, P}{1\,\cancel{mol\,P}} \right)\, = 30,974 \,g\, P\]
\ [4\, моль\, O \,= 4\, \cancel{моль\, O}\,\times \left(\frac{15,999\, г\, O}{1\,\cancel{моль\, O}} \right)\, = 63,996 \,g\, O\]
Добавление масс наших отдельных элементов имеет:
\[3.024\, g \,+ \,30.974\,g\, +\, 63.996\, g\, =\,97.994\, g\, H_{3}PO_{4}\]
As мы вычисляли молярную массу CH 3 OH имеем
\[97,994\, г\, H_{3}PO_{4}\, = \,1\, моль \,H_{3}PO_{4 }\]
Которые мы можем использовать в качестве коэффициента преобразования
\[\frac{97,994\, g\, H_{3}PO_{4}}{1\, моль\, H_{3}PO_{4} }\, или\, \frac{1\, моль\, H_{3}PO_{4}}{97,994\, г\, H_{3}PO_{4}}\]
Для расчета молярной массы \(\ce{H_{3}PO_{4}})\ мы использовали идею о том, что у нас есть 3 моля H, 1 моль P и 4 моля O на каждый моль \(\ce{H_{3 }ПО_{4}}). Напоминаем, что мы можем сделать свои собственные коэффициенты пересчета, пока верх и низ равны друг другу. Точно так же я могу дать вам четыре четверти или 1 доллар, если я дам вам моль \(\ce{H_{3}PO_{4}}) Я дал вам 3 моля H, 1 моль P и 4 моля O. Поскольку это правда, существует дополнительный набор коэффициентов преобразования, которые мы можем использовать:
Напоминаем, что мы можем сделать свои собственные коэффициенты пересчета, пока верх и низ равны друг другу. Точно так же я могу дать вам четыре четверти или 1 доллар, если я дам вам моль \(\ce{H_{3}PO_{4}}) Я дал вам 3 моля H, 1 моль P и 4 моля O. Поскольку это правда, существует дополнительный набор коэффициентов преобразования, которые мы можем использовать:
\[\left(\frac{3\, моли\, H}{1\, моль\, H_{3}PO_{4}}\right)\, и \, \left(\frac{1\ , моль\, P}{1\, моль\, H_{3}PO_{4}}\right)\, и\, \left(\frac{4\,moles\, O}{1\, моль\ , H_{3}PO_{4}}\right)\]
Теперь мы можем вернуться к начальному значению, указанному в вопросе:
\[3.45\,\cancel{g\,H_{3}PO_{ 4}}\,\times\,\left(\frac{1\,\cancel{mol\,H_{3}PO_{4}}}{97,994\,\cancel{g\,H_{3}PO_{ 4}}}\right)\times\left(\frac{4\,\cancel{mol\,O}}{1\,\cancel{\,mol\, H_{3}PO_{4}}}\ вправо)\раз\влево(\frac{15.999\, g\, O}{1 \cancel{mol \,O}}\right) = 2,25\, g\, O\]
Упражнение \(\PageIndex{6}\)
Сколько граммов H есть в 3,45 граммах \(\ce{H_{3}PO_{4}}\)?
Ответ
0,106 г H
Резюме
- Молекулярная масса (в а.
 е.м.) – это масса одной молекулы соединения
е.м.) – это масса одной молекулы соединения - Молярная масса (в граммах) – это масса одного моля соединения или элемента.
- Молярная масса является полезным коэффициентом преобразования, который можно использовать для преобразования граммов в моли или молей в граммы.
Авторы
8.03: Молярная масса распространяется по лицензии CC BY-NC, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC
- Показать страницу TOC
- № на стр.

- Теги
- источник-хим-177918
- источник-хим-53767
Рассчитать процентный состав нитрата кальция.
Ответ
Проверено
164,3 тыс.+ просмотров
Подсказка : Отношение количества каждого элемента, присутствующего в соединении, к общему количеству отдельных элементов, присутствующих в соединении, умноженное на 100, называется процентным составом этого конкретного элемент.
Полное пошаговое решение :
Формула нитрата кальция \[{\text{Ca(N}}{{\text{O}}_3}{)_2}\].
Таким образом, общая молекулярная масса соединения определяется как = \[{\text{Атомная масса Ca + (Атомная масса N + Атомная масса}}{{\text{O}}_{\text{3}} {\text{)}} \times {\text{2}}\]
\[ = {\text{ 40 + [ 2}} \times 7{\text{ + 16}} \times {\text{6] }}\]
Формула нитрата кальция \[{\text{ Ca(N}}{{\text{O}}_3}{)_2}\] \[{\text{ = 150}}\]
Формула для расчета процентного состава отдельного элемента:
\[{{\ % X = }}\dfrac{{{\text{Масса X}}}}{{{\text{Общая молекулярная масса соединения}}}}{{ \times 100}}\]
Итак, мы вычисляем % Ca as-
\[{{\% Ca = }}\dfrac{{{\text{Масса Ca}}}}{{{\text{Общая молекулярная масса соединения}}}}{{ \times 100}}\]
\[{{\% Ca = }}\dfrac{{40}}{{150}}{{ \times 100}}\] \[{\text{ = 26}}{\text{. 6}} \]
6}} \]
Для азота, \[{{\% N = }}\dfrac{{14}}{{150}}{{ \times 100 = 9}}{\text{.33}}\]
Для кислорода , \[{{\% O = }}\dfrac{{96}}{{150}}{{ \times 100 = 64}}\]
Итак, в нитрате кальция — кальция 26,6%, азота 9,33%. и кислорода 64%.
Дополнительная информация:
Norges Селитра — другое название нитрата кальция. Это азотнокислая соль, синтезированная по способу Биркеланда-Эйде. Обычно он находится в форме тетрагидрата, то есть \[{\text{Ca(N}}{{\text{O}}_3}{)_2}.{\text{4}}{{\text{H}}_2 }{\text{O}}\] и представляет собой гранулированное твердое вещество, которое хорошо поглощает влагу из воздуха. Он широко используется как окислитель и как удобрение в сельском хозяйстве. Нитрат кальция также полезен при изготовлении взрывчатых веществ и фейерверков. Помимо этих применений, он также используется в качестве исходного соединения при производстве других типов нитратов.
Примечание : Процентный состав соединения используется в химическом анализе. Он также используется для определения эмпирической формулы соединения в органической химии.

 1 Сельское хозяйство
1 Сельское хозяйство Получено из: pubchem.ncbi.nlm.nih.gov
Получено из: pubchem.ncbi.nlm.nih.gov
 е.м.) – это масса одной молекулы соединения
е.м.) – это масса одной молекулы соединения