ICSC 0360 — ГИДРОКСИД НАТРИЯ
ICSC 0360 — ГИДРОКСИД НАТРИЯ« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRGerman — DEHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| ГИДРОКСИД НАТРИЯ | ICSC: 0360 (Май 2010) |
| ЕДКИЙ НАТР | |
| CAS #: 1310-73-2 |
| UN #: 1823 |
| EINECS #: 215-185-5 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. При контакте с влагой или водой может выделяться достаточное количество тепла, чтобы воспламенить горючие материалы. Риск взрыва при контакте с несовместимыми веществами. См. Химические Опасности. При контакте с влагой или водой может выделяться достаточное количество тепла, чтобы воспламенить горючие материалы. Риск взрыва при контакте с несовместимыми веществами. См. Химические Опасности. |
НЕ допускать контакта с водой. НЕ допускать контакта с несовместимыми материалами: См. Химические Опасности | В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. Ощущения жжения. Сбивчивое дыхание. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Немедленно обратиться за медицинской помощью. Немедленно обратиться за медицинской помощью. |
| Кожа | Покраснение. Боль. Серьезные ожоги кожи. Волдыри. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ в течение не менее 15 минут. Обратиться за медицинской помощью. |
| Глаза | Покраснение. Боль. Помутнение зрения. Сильные ожоги. | Использовать маску для лица или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Боль в животе. Ожоги в полости рта и горле. Ощущение жжения в горле и груди. Тошнота. Рвота. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. |
Прополоскать рот. НЕ вызывать рвоту. Через несколько минут после проглатывания можно дать выпить один небольшой стакан воды. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: костюм химической защиты, включая автономный дыхательный аппарат. НЕ допускать попадания этого химического вещества в окружающую среду. ПластиковыеСмести просыпанное вещество в закрытые контейнеры. Тщательно собрать оставшееся. Затем хранить и утилизировать в соответствии с местными правилами. |
Согласно критериям СГС ООН ОПАСНО Вредно при проглатыванииВызывает серьезные ожоги кожи и повреждения глаз Может вызвать раздражение дыхательных путей Транспортировка |
| ХРАНЕНИЕ | |
Отдельно от пищевых продуктов и кормов, сильных кислот и металлов. Хранить только в оригинальной упаковке. Хранить сухим. Хорошо закрывать. Хранить в местах не имеющих сливов или доступа к канализации Хранить только в оригинальной упаковке. Хранить сухим. Хорошо закрывать. Хранить в местах не имеющих сливов или доступа к канализации | |
| УПАКОВКА | |
| Не перевозить с продуктами питания и кормами для животных. |
| ГИДРОКСИД НАТРИЯ | ICSC: 0360 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: NaOH |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия Вещество разъедает глаза, кожу и дыхательные пути. Едкое вещество при приеме внутрь. |
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| TLV: 2 mg/m3 (предельная величина) |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| Это вещество может быть опасным для окружающей среды. Особое внимание следует уделять водным организмам. |
| ПРИМЕЧАНИЯ |
|---|
| Значение предельно-допустимой концентрации не должно превышаться во время любой части профессионального воздействия. NEVER pour water into this substance; when dissolving or diluting always add it slowly to the water.  Other UN number: UN1824 Sodium hydroxide solution, Hazard class 8, packing group II-III. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: C; R: 35; S: (1/2)-26-37/39-45 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
О веществе простыми словами
Уроки химии наполнены разнообразными переживаниями и обилием задач, которые придется решать вне зависимости от вашего желания и настроения. Решение задач по органической химии или неорганической химии требует много времени и хорошего знания всего курса, внимательности, серьезной и детальной работы. Однако изучив секреты наших специалистов, решать задачи по химии станет проще.
Решение задач по органической химии или неорганической химии требует много времени и хорошего знания всего курса, внимательности, серьезной и детальной работы. Однако изучив секреты наших специалистов, решать задачи по химии станет проще.
- Крот: что это?
- Молярный и молекулярный вес
- NaOH: что это такое?
- Как найти молярную массу раствора NaOH?
- Пример Как решить задачу
- Как получают NaOH?
Сегодня мы рассмотрим одну из задач, с которой чаще всего сталкиваются школьники. Мы научим вас, как найти молярную массу NaOH. Прежде чем приступить к изучению примеров, окунемся немного в теорию. Без него вы не поймете, что такое химическая формула и как происходит химическая реакция — запаситесь терпением и силой. Взамен вы получите знания, которые вам не дают учителя.
Крот: что это?
Понятие «крот» появилось не так давно и не имеет физического смысла. Это искусственно введенное значение. Например, в старых учебниках вместо понятия «моль» использовалось понятие «грамм-молекула». Моль – это вещество, содержащее несколько молекул (частиц, ионов, атомов), равных числу Авогадро N A =6*10 23 .
Моль – это вещество, содержащее несколько молекул (частиц, ионов, атомов), равных числу Авогадро N A =6*10 23 .
Число 6,02*10 23 названо числом Авогадро в честь итальянского химика Амедео Авогадро. Почему именно это число выбрано для определения родинки? Дело в том, что ровно столько же атомов содержится в 12 г изотопа углерода 12 C. Те же самые изотопы используются для выбора атомной единицы массы.
Число Авогадро также называют константой Авогадро, и ученые обозначают это специальным символом N A . Эта константа имеет размерность — штук на моль или -1 молей. Таким образом:
N A =6,02*10 23 моль -1
Для приблизительных расчетов число Авогадро можно округлить до 6*10 23 . Зная постоянную Авогадро, мы можем выразить любое количество вещества в молях. Если вещество содержит N молекул, то количество вещества (обозначаемое греческой буквой ν) равно ν=N/NA. Формула работает так же и в обратном порядке. Зная количество вещества в моле, можно найти количество молекул: N=ν*NA. Например:
Формула работает так же и в обратном порядке. Зная количество вещества в моле, можно найти количество молекул: N=ν*NA. Например:
- 1 моль меди содержит N A = 6 * 10 23 атомов.
- 1 моль хлорида натрия — N A = 6*10 23 молекул NaCl.
- 1 моль ионов натрия — N A = 6*10 23 ионов.
Молярный и молекулярный вес
Закон Авогадро можно применить только к газообразным веществам. Однако химикам необходимо знать, сколько молекул содержится в жидкостях и твердых телах. Поэтому для извлечения количества молекул в веществах ученые ввели значение молярной массы. Эта величина означает массу одного моля вещества. Молярная масса обозначается буквой М и численно равна относительной молекулярной массе. Также существует формула веса M = m/v, которую следует использовать во всех химических задачах для расчета молярной массы. Буква m означает массу вещества, а v – количество веществ.
Молекулярная масса означает массу молекулы, выраженную в атомных единицах массы. Молекулярная масса численно равна молярной массе. В химии есть абсолютная молекулярная масса и относительная молекулярная масса. Ученые чаще всего используют безразмерную величину (относительную молекулярную массу), так как эксперименты показывают, во сколько раз масса молекулы превышает 1/12 массы атома углерода. Молекулярную массу принято обозначать символом МР
Однако следует четко понимать разницу между молярной массой и молекулярной массой, понимая, что они равны только численно и отличаются размерностью. Молекулярные массы сложных молекул можно определить, сложив молекулярные массы составляющих их элементов. Например, молекулярная масса воды (H 2 O) представляет собой MH 2 O = 2 MH + MO = 211 + 16 = 18 а.е.м.
NaOH: что это такое?
Молекулярная формула: NaOH.
Молярная и молекулярная масса химического вещества: 39 997 г/моль.
Количество атомов: 3 — Na, O, H.
Температура плавления: 323 °C.
Температура кипения: 1403 °С.
Растворимость в воде: 108,7 г/100 мл.
Предельная концентрация: 0,5 мг/м³.
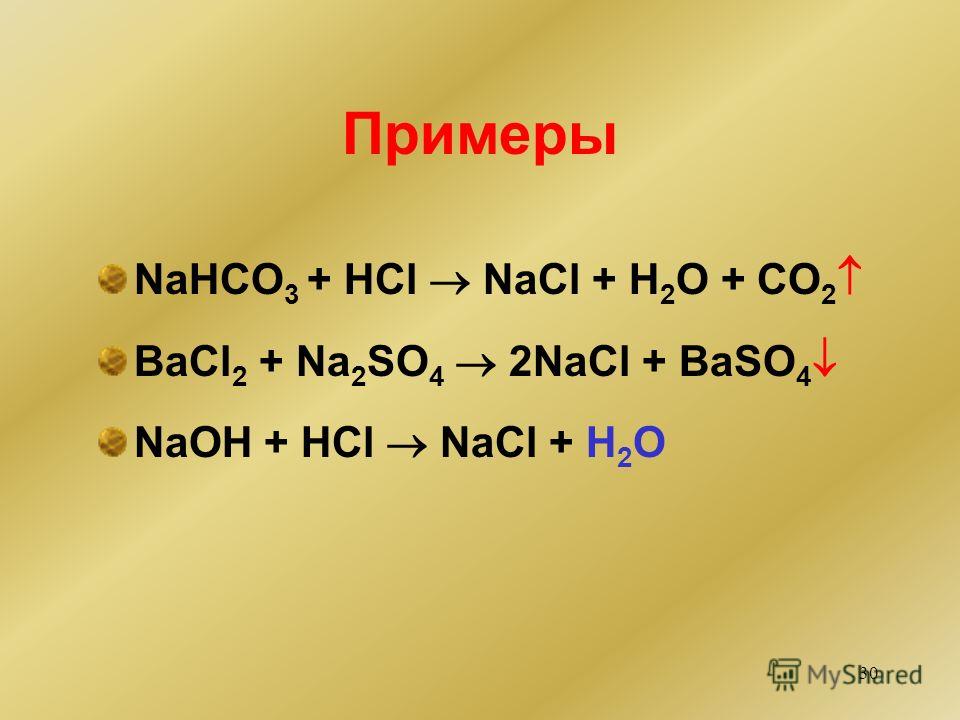
Этот реагент, наиболее распространенная щелочь, более известен под названием едкий натр. Исходя из названия, понятно, что вещество опасно. Поэтому обращаться с ним нужно осторожно. Гидроксид натрия представляет собой бесцветную кристаллическую массу и обладает коррозионной функцией. Раствор гидроксида натрия способен вызывать коррозию органических материалов и некоторых металлов. При контакте с цинком, свинцом, алюминием, оловом и их сплавами выделяется водород — взрывоопасный газ. Не допускайте контакта едкого натра с аммиаком, он пожароопасен. Гидроксид натрия используется для нейтрализации кислот и кислых оксидов. Он также играет роль катализатора в некоторых химических реакциях. Он используется при титровании, травлении алюминия и производстве чистых металлов.
Как найти молярную массу раствора NaOH?
Для расчета молярной массы химического вещества придерживаться следующего алгоритма:
1. Подготовить таблицу Менделеева. Может понадобиться для определения валентности и атомных масс химических элементов.
2. Правильно составить формулу, используя знания об основных классах неорганических химических соединений и их свойствах. Также информация из таблицы Менделеева. Например:
- сода едкая — NaOH;
- гидроксид калия — КОН;
- двуокись углерода — CO 2 ;
- соляная кислота — HCl;
- серная кислота — H 2 SO 4 ;
- хлорид кальция — CaCL 2 ;
- гидроксид алюминия — Al(OH) 3 .
Прежде всего, при составлении составных формул необходимо помнить о валентности элементов, из которых они состоят.
3. Определите молекулярную массу и молярную массу NaOH. Снова возьмем вес атомов в ячейке химического элемента в таблице Менделеева:
Молекулярная масса = M r [NaOH] = Ar[Na] + Ar[O] + Ar[H] = 22,98976928 + 15,9994 + 1,00794 = 39,99710928
Молярная масса = M r [NaOH]: 1000 = 39,99710928 : 1000 = 0,04 кг/моль
Как видно из примера, для выполнения необходимых расчетов достаточно добавить молярная масса Na, O, H — элементов, входящих в состав вещества.
4. Определить массу одной молекулы каждого из этих соединений с помощью числа Авогадро:
m(NaOH) = M r (NaOH)/N A = 39/6,02*10 23 = 6,4*10 23 г
Применив алгоритм, вы быстро найдете количество родинок.
Пример Как решить задачу
Задача: Какая масса гидроксида натрия (NaOH) содержит такое же количество эквивалентов, что и 140 грамм гидроксида калия (КОН)?
Раствор :
Рассчитаем молярную массу эквивалента гидроксида калия (KOH) по формуле:
M экв =M*f экв
Получаем: M экв (КОН)=М( КОН)* f экв
Следовательно, 140 г гидроксида калия (КОН) содержат 140/56 = 2,5 экв.
Рассчитайте молярную массу эквивалента гидроксида натрия (NaOH) по формуле:
M экв (NaOH)=M(NaOH)* f экв
Получаем: M экв (NaOH)=40 * 1=40 (г/моль)
Отсюда: 2,5 эквивалента составляют 40 г/моль *2,5 моль = 100 (г).
Ответ: m NaOH составляет 100 грамм.
Как получают NaOH?
Гидроксид натрия получают в промышленных масштабах электрохимическими и химическими методами. Весь промышленно производимый гидроксид натрия получают электролизом водного раствора NaCl. В процессе также образуются газообразный хлор и водород (это очень сильное основание):
2NaCl + 2H 2 O → 2NaOH + Cl 2 + h3
В электрохимическом методе используется электролиз с твердым катодом и электролиз с жидким ртутным катодом. Ртутный метод имеет существенные недостатки по воздействию на окружающую среду, хотя и значительно проще в технической реализации. Мембранный способ получения гидроксида натрия является наиболее эффективным и наиболее сложным. Мембранный электролиз позволяет получить чистейший гидроксид натрия.
Наиболее распространенными химическими методами получения гидроксида натрия являются известковый и ферритный. Известковый метод заключается во взаимодействии раствора кальцинированной соды с гашеной известью. Ферритный метод требует использования кальцинированной соды и оксида железа. Процесс проходит в два этапа. При прокаливании смеси соды с окисью железа образуется феррит натрия. Образовавшийся раствор гидроксида натрия упаривают, и из одного упаренного раствора получают надежный продукт. Оксид железа возвращается в производственный цикл.
Ферритный метод требует использования кальцинированной соды и оксида железа. Процесс проходит в два этапа. При прокаливании смеси соды с окисью железа образуется феррит натрия. Образовавшийся раствор гидроксида натрия упаривают, и из одного упаренного раствора получают надежный продукт. Оксид железа возвращается в производственный цикл.
Молярная масса – Введение в химию
ЛюменОбучение
Число Авогадро и крот
Моль представлен числом Авогадро, которое составляет 6,022×10 23 атомов или молекул на моль.
ЦЕЛИ ОБУЧЕНИЯ
Определить и запомнить число Авогадро
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые моменты
- Моль позволяет ученым рассчитать количество элементарных частиц (обычно атомов или молекул) в определенной массе данного вещества.
- Число Авогадро является абсолютным числом: в 1 моле содержится 6,022×10 23 элементарных единиц. Это также можно записать как 6,022×10 23 моль -1 .

- Масса одного моля вещества равна молекулярной массе этого вещества. Например, средняя молекулярная масса воды составляет 18,015 атомных единиц массы (а.е.м.), поэтому один моль воды весит 18,015 грамма.
Ключевые термины
- моль : Количество вещества в системе, которое содержит столько элементарных частиц, сколько атомов содержится в 12 г углерода-12.
Химические изменения, наблюдаемые в любой реакции, включают перегруппировку миллиардов атомов. Нецелесообразно пытаться сосчитать или визуализировать все эти атомы, но ученым нужен какой-то способ сослаться на все количество. Им также нужен способ сравнивать эти числа и связывать их с массами веществ, которые они могут измерять и наблюдать. Решением является понятие моля, которое очень важно в количественной химии.
Число Авогадро
Амедео Авогадро: Амедео Авогадро приписывают идею о том, что количество сущностей (обычно атомов или молекул) в веществе пропорционально его физической массе.
Амадео Авогадро впервые предположил, что объем газа при данном давлении и температуре пропорционален числу атомов или молекул,
независимо от типа газа. Хотя он не определил точную пропорцию, ему приписывают идею.
Число Авогадро — это пропорция, которая связывает молярную массу в атомном масштабе с физической массой в человеческом масштабе. Число Авогадро определяется как количество элементарных частиц (молекул, атомов, соединений и т. д.) на моль вещества. Он равен 6,022×10 23 моль -1 и выражается символом N A .
Число Авогадро аналогично понятию дюжины или брутто. Десяток молекул — это 12 молекул. Масса молекул составляет 144 молекулы. Число Авогадро равно 6,022×10 23 молекул. С помощью числа Авогадро ученые могут обсуждать и сравнивать очень большие числа, что полезно, поскольку вещества в повседневных количествах содержат очень большое количество атомов и молекул.
Крот
Моль (сокращенно моль) — это единица измерения СИ количества «химического объекта», такого как атомы, электроны или протоны. Он определяется как количество вещества, которое содержит столько частиц, сколько атомов содержится в 12 граммах чистого углерода-12. Так, в 1 моль содержится 6,022×10 23 элементарных единиц вещества.
Он определяется как количество вещества, которое содержит столько частиц, сколько атомов содержится в 12 граммах чистого углерода-12. Так, в 1 моль содержится 6,022×10 23 элементарных единиц вещества.
Химические вычисления с числом Авогадро и кротом
Число Авогадро имеет фундаментальное значение для понимания как состава молекул, так и их взаимодействий и комбинаций. Например, поскольку один атом кислорода соединяется с двумя атомами водорода, образуя одну молекулу воды ([латекс]\текст{Н}_2\текст{О}[/латекс]), один моль кислорода (6,022×10 23 атомов O) соединится с двумя молями водорода (2 × 6,022 × 10 23 атомов H), чтобы получить один моль [латекса]\text{H}_2\text{O}[/latex] .
Еще одним свойством числа Авогадро является то, что масса одного моля вещества равна молекулярной массе этого вещества. Например, средняя молекулярная масса воды составляет 18,015 атомных единиц массы (а.е.м.), поэтому один моль воды весит 18,015 грамма. Это свойство упрощает многие химические вычисления.
Это свойство упрощает многие химические вычисления.
Если у вас есть 1,25 грамма молекулы с молекулярной массой 134,1 г/моль, сколько у вас молей этой молекулы?
[латекс]\текст{1,25 г} \times \frac{\text{1 моль}}{\text{134,1 г}} = \text{0,0093 моль}[/латекс]
Крот, Авогадро: В этом видео рассказывается о счете по массе, о моле и о том, как он соотносится с атомными единицами массы (АМЕ) и числом Авогадро.
Преобразование молей в атомы
Поняв взаимосвязь между числом молей и числом Авогадро, ученые могут преобразовать число молей в число атомов.
ЦЕЛИ ОБУЧЕНИЯ 9{23}[/латекс] атомы, молекулы, протоны и т. д.
 {23}[/латекс] и количеству элементарных частиц (атомов или молекул), составляющих один моль данного вещества.
{23}[/латекс] и количеству элементарных частиц (атомов или молекул), составляющих один моль данного вещества.Моли и атомы
Как было введено в предыдущем понятии, моль можно использовать для связи масс веществ с количеством атомов в них. Это простой способ определить, какое количество одного вещества может вступить в реакцию с данным количеством другого вещества.
По молям вещества можно также найти количество атомов в образце и наоборот. Мостиком между атомами и молями является число Авогадро, 6,022×10 23 .
Число Авогадро обычно безразмерно, но когда оно определяет моль, его можно выразить как 6,022×10 23 элементарные единицы/моль. Эта форма показывает роль числа Авогадро как коэффициента преобразования между количеством сущностей и количеством молей. Следовательно, учитывая соотношение 1 моль = 6,022 x 10 23 атомов, преобразование между молями и атомами вещества становится простой задачей размерного анализа.
Преобразование молей в атомы
Зная известное число молей (x), можно найти число атомов (y) в этом молярном количестве, умножив его на число Авогадро: 9{23} \text{атомов} } = 5,81 \text{молей}[/latex]
Молярная масса соединения
Молярная масса определенного вещества – это масса одного моля этого вещества.
ЦЕЛИ ОБУЧЕНИЯ
Вычислить молярную массу элемента или соединения
ОСНОВНЫЕ ВЫВОДЫ
Ключевые моменты
- Молярная масса – это масса данного химического элемента или химического соединения (г), деленная на количество вещества (моль).
- Молярная масса соединения может быть рассчитана путем сложения стандартных атомных масс (в г/моль) составляющих его атомов.
- Молярная масса служит связующим звеном между массой материала и количеством молей, поскольку непосредственное измерение количества молей невозможно.
Ключевые термины
- : Масса данного вещества (химического элемента или химического соединения в г), деленная на количество этого вещества (моль).

- моль : Количество вещества в системе, которая содержит столько элементарных частиц, сколько атомов содержится в 12 г углерода-12.
Измерение массы в химии
Химики могут измерить количество вещества с помощью массы, но в химических реакциях часто важно учитывать количество атомов каждого элемента, присутствующего в каждом образце. Даже наименьшее количество вещества будет содержать миллиарды атомов, поэтому химики обычно используют моль в качестве единицы количества вещества.
Один моль (сокращенно моль) равен количеству атомов в 12 граммах углерода-12; это число называется числом Авогадро и измеряется приблизительно как 6,022 x 10 9 .0025 23 . Другими словами, моль — это количество вещества, которое содержит столько сущностей (атомов или других частиц), сколько атомов содержится в 12 граммах чистого углерода-12.
а.е.м. по сравнению с г/моль
Каждый ион или атом имеет определенную массу; точно так же каждый моль данного чистого вещества также имеет определенную массу. Масса одного моля атомов чистого элемента в граммах эквивалентна атомной массе этого элемента в атомных единицах массы (а.е.м.) или в граммах на моль (г/моль). Хотя масса может быть выражена как в а.е.м., так и в г/моль, г/моль является наиболее полезной системой единиц для лабораторной химии.
Масса одного моля атомов чистого элемента в граммах эквивалентна атомной массе этого элемента в атомных единицах массы (а.е.м.) или в граммах на моль (г/моль). Хотя масса может быть выражена как в а.е.м., так и в г/моль, г/моль является наиболее полезной системой единиц для лабораторной химии.
Расчет молекулярной массы
Молярная масса – это масса данного вещества, деленная на количество этого вещества, измеренная в г/моль. Например, атомная масса титана составляет 47,88 а.е.м. или 47,88 г/моль. В 47,88 граммах титана содержится один моль, или 6,022 х 10 23 атомов титана.
Характеристическая молярная масса элемента — это просто атомная масса в г/моль. Однако молярную массу также можно рассчитать, умножив атомную массу в а.е.м. на постоянную молярной массы (1 г/моль). Чтобы вычислить молярную массу соединения с несколькими атомами, просуммируйте все атомные массы составляющих атомов.
Например, молярную массу [латекс]\текст{NaCl}[/латекс] можно рассчитать, найдя атомную массу натрия (22,99 г/моль) и атомную массу хлора (35,45 г/моль) и объединив их. Молярная масса [латекса]\текст{NaCl}[/латекс] составляет 58,44 г/моль.
Молярная масса [латекса]\текст{NaCl}[/латекс] составляет 58,44 г/моль.
Расчет молярной массы – YouTube: в этом видео показано, как рассчитать молярную массу нескольких соединений, используя их химические формулы.
Преобразование массы в количество молей
Молярная масса вещества может использоваться для преобразования массы вещества в количество молей в этом веществе.
ЦЕЛИ ОБУЧЕНИЯ
Преобразование между массой и числом молей и числом атомов в данном образце соединения
ОСНОВНЫЕ ВЫВОДЫ
Ключевые моменты
- Молярная масса соединения равна сумме атомных масс составляющих его атомов в г/моль.
- Хотя физического способа измерения количества молей соединения не существует, мы можем связать его массу с количеством молей, используя молярную массу соединения в качестве коэффициента прямого преобразования.

- Для преобразования массы в количество молей можно использовать молярную массу вещества. Затем вы можете использовать число Авогадро, чтобы преобразовать количество молей в количество атомов.
Ключевые термины
- : Масса данного вещества (химического элемента или химического соединения), деленная на его количество вещества (моль), в г/моль.
- анализ измерений : анализ взаимосвязей между различными физическими величинами путем определения их основных размеров (таких как длина, масса, время и электрический заряд) и единиц измерения (таких как мили против километров или фунты против килограммов) по сравнению с граммами) и отслеживание этих размеров по мере выполнения расчетов или сравнений.
- моль : Количество вещества, которое содержит столько элементарных частиц, сколько атомов содержится в 12 г углерода-12.
Химики обычно используют моль как единицу количества атомов или молекул материала. Один моль (сокращенно моль) равен 6,022×10 23 молекулярных единиц (число Авогадро), и каждый элемент имеет разную молярную массу в зависимости от массы 6,022×10 23 его атомов (1 моль). Молярную массу любого элемента можно определить, найдя атомную массу элемента в периодической таблице. Например, если атомная масса серы (S) равна 32,066 а.е.м., то ее молярная масса равна 32,066 г/моль.
Один моль (сокращенно моль) равен 6,022×10 23 молекулярных единиц (число Авогадро), и каждый элемент имеет разную молярную массу в зависимости от массы 6,022×10 23 его атомов (1 моль). Молярную массу любого элемента можно определить, найдя атомную массу элемента в периодической таблице. Например, если атомная масса серы (S) равна 32,066 а.е.м., то ее молярная масса равна 32,066 г/моль.
Распознав взаимосвязь между молярной массой (г/моль), молями (моль) и частицами, ученые могут использовать размерный анализ для очень легкого преобразования между массой, числом молей и числом атомов.
Определение молярной массы соединения
В соединении [латекс]\текст{NaOH}[/латекс] молярная масса одного натрия составляет 23 г/моль, молярная масса О составляет 16 г/моль, а Н составляет 1 г/моль. Какова молярная масса [латекс]\текст{NaOH}[/латекс]?
[латекс]\текст{Na} + \text{O} + \text{H} = \text{NaOH}[/latex]
[латекс]\text{23 г/моль} + \text{16 г/моль} + \text{1 г/моль} = \text{40 г/моль}[/латекс]
Молярная масса соединения [латекс]\текст{NaOH}[/латекс] составляет 40 г/моль.
Преобразование массы в количество молей
Сколько молей [латекса]\text{NaOH}[/латекс] содержится в 90 г [латекса]\текст{NaOH}[/латекс]?
Поскольку молярная масса [латекса]\text{NaOH}[/латекс] равна 40 г/моль, мы можем разделить 90 г [латекса]\текст{NaOH}[/латекс] на молярную массу (40 г /mol), чтобы найти количество молей [латекса]\text{NaOH}[/латекс]. Это то же самое, что умножить на обратную величину 40 г/моль.
Если уравнение составлено правильно, единицы массы (г) сокращаются и в качестве единицы остаются моли.
[латекс]\text{90 г NaOH} \times \frac{\text{1 моль}}{\text{40 г}} = \text{2,25 моль NaOH}[/latex]
В 90 г [латекса]\text{NaOH}[/latex] содержится 2,25 моль [латекса]\text{NaOH}[/латекс].
Преобразование между массой, числом молей и числом атомов
Сколько молей и сколько атомов содержится в 10,0 г никеля?
Согласно периодической таблице атомная масса никеля (Ni) составляет 58,69.а.е.м., что означает, что молярная масса никеля составляет 58,69 г/моль. {23} \ текст{атомы Ni}[/латекс]
{23} \ текст{атомы Ni}[/латекс]
Зная массу образца и количество молей в этом образце, можно также рассчитать молекулярную массу образца, разделив массу на количество молей для расчета г/моль.
Какова молярная масса метана ([латекс]\текст{СН}_4[/латекс]), если в образце массой 10,0 г содержится 0,623 моля?
[латекс]\frac{\text{10,0 г CH}_4}{\text{0,623 моль CH}_4} = \text{16,05 г/моль CH}_4[/latex]
Молярная масса [латекса]\текст{СН}_4[/латекс] составляет 16,05 г/моль.
ЛИЦЕНЗИИ И АВТОРСТВО
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, ПРЕДОСТАВЛЕННОЕ РАНЕЕ
- Курирование и пересмотр. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, КОНКРЕТНОЕ АВТОРСТВО
- Номер Авогадро и моль. Предоставлено : Веб-сайт Стива Лоуера. Расположен по адресу : http://www.chem1.com/acad/webtext/intro/int-2.
 html#SEC2. Лицензия : CC BY-SA: Attribution-ShareAlike
html#SEC2. Лицензия : CC BY-SA: Attribution-ShareAlike - Моль (ед.). Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Mole_(unit). Лицензия : CC BY-SA: Attribution-ShareAlike
- Постоянная Авогадро. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Avogadro_constant. Лицензия : CC BY-SA: Attribution-ShareAlike
- моль. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/mole. Лицензия : CC BY-SA: Attribution-ShareAlike
- Крот, Авогадро. Расположен по адресу : http://www.youtube.com/watch?v=TqDqLmwWx3A. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube
- Авогадро Амедео.
 Предоставлено : Викимедиа. Расположен по адресу : http://en.wikipedia.org/wiki/Avogadro_constant#mediaviewer/File:Avogadro_Amedeo.jpg. Лицензия : Общественное достояние: неизвестно Авторские права
Предоставлено : Викимедиа. Расположен по адресу : http://en.wikipedia.org/wiki/Avogadro_constant#mediaviewer/File:Avogadro_Amedeo.jpg. Лицензия : Общественное достояние: неизвестно Авторские права - Постоянная Авогадро. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Avogadro_constant. Лицензия : CC BY-SA: Attribution-ShareAlike
- моль. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/mole. Лицензия : CC BY-SA: Attribution-ShareAlike
- Номер Авогадро. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Номер Авогадро. Лицензия : CC BY-SA: Attribution-ShareAlike
- Крот, Авогадро. Расположен по адресу : http://www.
 youtube.com/watch?v=TqDqLmwWx3A. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube
youtube.com/watch?v=TqDqLmwWx3A. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube - Авогадро Амедео. Предоставлено : Викимедиа. Расположен по адресу : http://en.wikipedia.org/wiki/Avogadro_constant#mediaviewer/File:Avogadro_Amedeo.jpg. Лицензия : Общественное достояние: неизвестно Авторские права
- Молярная масса. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Molar_mass. Лицензия : CC BY-SA: Attribution-ShareAlike
- Атомная единица массы. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Atomic_mass_unit. Лицензия : CC BY-SA: Attribution-ShareAlike
- молярная масса. Предоставлено : Википедия.
 Расположен по адресу : http://en.wikipedia.org/wiki/молярная масса. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : http://en.wikipedia.org/wiki/молярная масса. Лицензия : CC BY-SA: Attribution-ShareAlike - моль. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/mole. Лицензия : CC BY-SA: Attribution-ShareAlike
- Крот, Авогадро. Расположен по адресу : http://www.youtube.com/watch?v=TqDqLmwWx3A. Лицензия : Общественное достояние: авторские права неизвестны . Условия лицензии : Стандартная лицензия YouTube
- Авогадро Амедео. Предоставлено : Викимедиа. Расположен по адресу : http://en.wikipedia.org/wiki/Avogadro_constant#mediaviewer/File:Avogadro_Amedeo.jpg. Лицензия : Общественное достояние: нет данных Авторские права
- Расчеты молярной массы – YouTube. Расположен по адресу : http://www.
 youtube.com/watch?v=guAbb_yBSfs. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube
youtube.com/watch?v=guAbb_yBSfs. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube - Число Авогадро и родинка. Предоставлено : Веб-сайт Стива Лоуера. Расположен по адресу : http://www.chem1.com/acad/webtext/intro/int-2.html#SEC2. Лицензия : CC BY-SA: Attribution-ShareAlike
- моль. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/mole. Лицензия : CC BY-SA: Attribution-ShareAlike
- молярная масса. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/молярная масса. Лицензия : CC BY-SA: Attribution-ShareAlike
- Размерный анализ. Предоставлено : Википедия. Расположен по адресу : http://en.






 html#SEC2. Лицензия : CC BY-SA: Attribution-ShareAlike
html#SEC2. Лицензия : CC BY-SA: Attribution-ShareAlike  Предоставлено : Викимедиа. Расположен по адресу : http://en.wikipedia.org/wiki/Avogadro_constant#mediaviewer/File:Avogadro_Amedeo.jpg. Лицензия : Общественное достояние: неизвестно Авторские права
Предоставлено : Викимедиа. Расположен по адресу : http://en.wikipedia.org/wiki/Avogadro_constant#mediaviewer/File:Avogadro_Amedeo.jpg. Лицензия : Общественное достояние: неизвестно Авторские права  youtube.com/watch?v=TqDqLmwWx3A. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube
youtube.com/watch?v=TqDqLmwWx3A. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube Расположен по адресу : http://en.wikipedia.org/wiki/молярная масса. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : http://en.wikipedia.org/wiki/молярная масса. Лицензия : CC BY-SA: Attribution-ShareAlike  youtube.com/watch?v=guAbb_yBSfs. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube
youtube.com/watch?v=guAbb_yBSfs. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube