| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
рН раствора.
 Задачи 150 — 152
Задачи 150 — 152
Задача 150.
Рассчитать рН раствора, полученного добавлением 0,1 моль раствора NaOH и 0,1 моль раствора H3PO4.
Решение:
рКк = 2,12;
M(H3PO4) = 98 г/моль;
M(NaOH) = 40 г/моль;
рК2(H3PO4) = 7,21.
Растворы кислоты и щелочи взяты в разбавленном состоянии, поэтому образуется однозамещенная соль фосфорной кислоты:
Н3РО4 + NaOH = NaH2PO4 + H2O
Из уравнения реакции вытекает, что 1 моль NaOH реагирует с 1 моль h4PO4 и образуется 1 моль NaH2PO4.
Тогда
Со = Ск = Сс = 0,1 моль.
Дигидрофосфат натрия в воде гидролизуется и рН раствора вследствие высвобождающихся ионов гидроксила повышается.
Молекулярно-ионная форма гидролиза соли:
H2PO4(-) + H2O = Н3РО4 + ОН(-)
Для рассчета рН раствора соли NaH2PO4 без учета диссоциации воды, подставим значение константы диссоциации фосфорной кислоты по первой ступени и концентрацию соли в уравнение:
рН = 7 + 1/2рКк + 1/2lgСс, где
рКк — константа диссоциации кислоты; Сс — концентрация соли.
Тогда
рН(NaH2PO4) = 7 + (0,5 . 2,12) + (0,5.lg0,1) = 7,56.
Ответ: 7,56.
Вычисление рН буферной системы
Задача 151.
Найдите pH раствора полученного растворением 5 г хлорида аммония в 200 мл раствора содержащего 7 г гидроксида аммония. Изменением объема при растворении пренебречь. Ko = 1,76.10-5.
Решение:
Kд = 1,76.10-5;
pKд = 4,76;
M(NH4OH) = 35,04 г/моль;
M(NH4Cl) = 53,491 г/моль.
1 Рассчитаем молярную концентрацию веществ, получим:
СM(NH4OH) = [m(NH4OH)/M(Nh5OH)].1000/V(p-pa) = (5/35,04) .1000/200 = 0,71 моль/л;
СM(NH4Cl) = [m(NH4Cl)/M(NH4Cl)]. 1000/V(p-pa) = (7/53,491).1000/200 = 0,65 моль/л.
1000/V(p-pa) = (7/53,491).1000/200 = 0,65 моль/л.
2. Вычислить рН буферной системы
рH = 14 — pKo + lgCo/Cc = 14 — 4,76 + lg0,71/0,65 = 9,2.
Ответ: 9,2.
Определение молекулярной массы гидроксида аммония
Задача 152.
Определить молярную концентрацию гидроксида аммония, если рН = 11, а Кд = 1,8•10-5.
Решение:
NH4OH = NH4+ + OH—
рН = -lg[H+], следовательно 11 = -lg[H+], а [H+] = 1•10-11.
Тогда
[OH—] = Kw/[H+] = 1•10-14/1•10-11 = 1•10-3.
Из выражения константы диссоциации NH
КD = [NH4+].[ОН—]/[NH4OH] находим, что
[NH4OH] = [NH4+]*[ОН—]/KD = CM(NH4OH).
Тогда
CM(NH4OH) = [(1•10-3) . (1•10-3)]/1,8•10-5 = 0,54 моль/л.
Ответ: 0,54 моль/л.
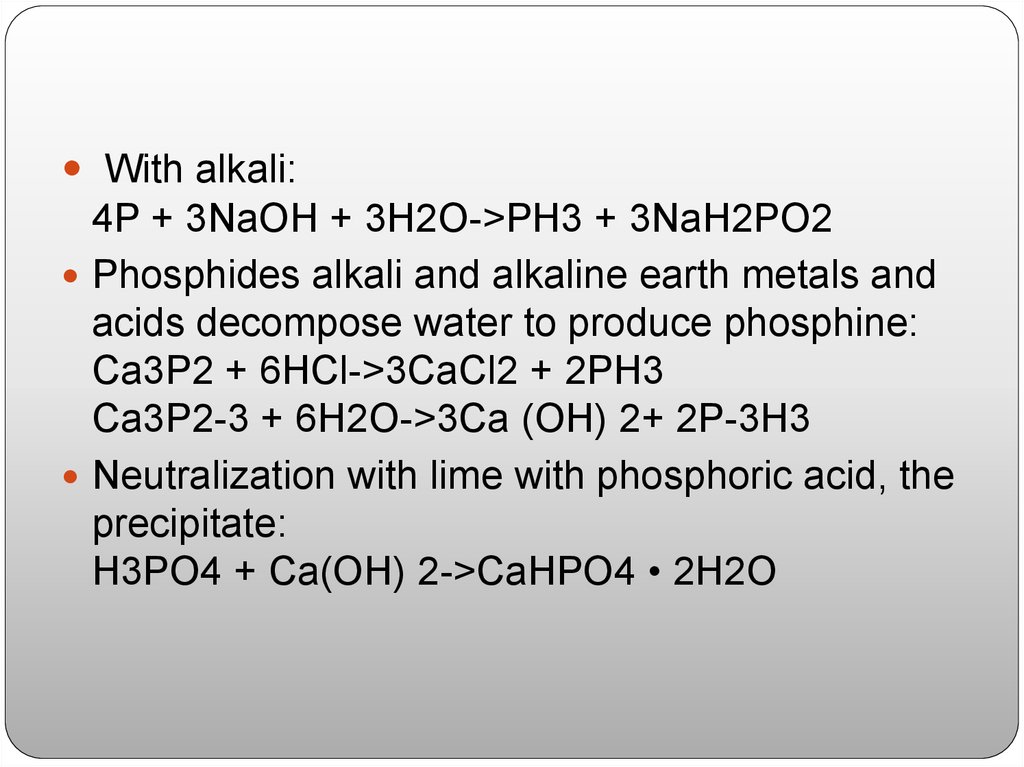
Является ли NaH более сильным основанием, чем NaOH? И мы знаем, что в соответствии с концепцией Бренстеда-Лоури мы определяем основания как те вещества, которые могут принимать электроны.
Полный пошаговый ответ: Здесь в вопросе нас просят прокомментировать, является ли NaH более сильным основанием, чем NaOH. Чтобы получить решение вопроса, сначала мы должны обсудить, что означает основание и виды ионов, образующихся при диссоциации соединений, указанных в вопросе.
Нам хорошо известно, что согласно концепции Бренстеда-Лоури о кислотах и основаниях, основания — это вещества, которые могут принимать протоны, а кислоты — это вещества, которые могут отдавать протоны в реакционном сосуде.
И если мы определим соединение как сильную кислоту или основание, тогда этот вид может подвергнуться полной диссоциации.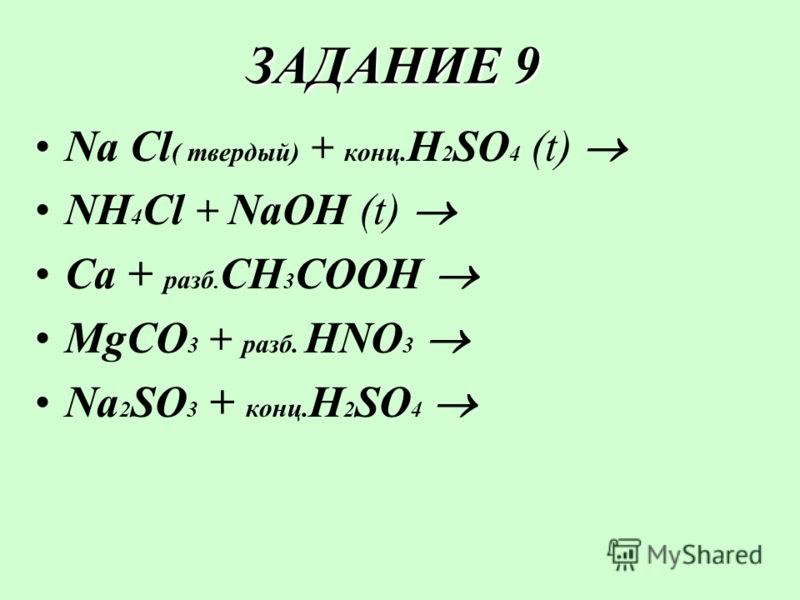
Здесь NaH и NaOH представляют собой интересующие нас соединения, оба соединения являются сильными основаниями, т. е. подвергаются полной реакции диссоциации при растворении в воде. 9{+}}+{{H}_{3}}O$
Но этой реакции не происходит, так как значение электроотрицательности натрия меньше, чем у атома водорода.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из перечисленного ниже является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класс химии JEE_Main
В Индии по случаю бракосочетания фейерверки 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть расположены химический класс 12 JEE_Main
Что из следующего имеет самый высокий электродный потенциал химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химический класс JEE_Main
Тенденции Сомнения
NaOHH-IN SOLID (Журнальная статья) ТВЕРДЫЕ РАСТВОРЫ В СИСТЕМАХ NaOH-NaH И KOH-KH (Журнальная статья) | ОСТИ. GOV
GOVперейти к основному содержанию
- Полная запись
- Другие родственные исследования
Для чистых гидридов характерна резко очерченная температура начала термического разложения: 428°С для KH и 421°C для NaH. Весь водород выделяется при этих температурах. Система NaOH—NaH разлагается перед смешиванием при содержании NaH более 60%, а система KOH—KH — аналогично при содержании KH более 48%. Термограммы показали с увеличением концентрации гидрида повышение температуры плавления и снижение температуры полиморфной конверсии исходных гидроксидов. Рентгеновский анализ показал образование твердых растворов. На перитектических диаграммах показаны ограниченные области твердых растворов. Ожидаются твердые растворы, поскольку NaOH выше 299 c-C и KOR выше 247 c-C превращаются из альфа-модификаций в бета-версии. При комнатной температуре область гомогенности простирается до 18% NaH в системах NaOH-NaH и до 14% KH в системах KOH—KH. Однородная область расширяется с повышением температуры. При растворении гидридов в гидроксидах заметно повышается их термостойкость и расширяется температурная область их применения до 500-550°С. (ТТТ)
При комнатной температуре область гомогенности простирается до 18% NaH в системах NaOH-NaH и до 14% KH в системах KOH—KH. Однородная область расширяется с повышением температуры. При растворении гидридов в гидроксидах заметно повышается их термостойкость и расширяется температурная область их применения до 500-550°С. (ТТТ)
- Авторы:
- Михеева В И; Шкрабкина М М
- Дата публикации:
- Исследовательская организация:
- Исходная исследовательская организация. не идентифицировано
- Идентификатор ОСТИ:
- 4676319
- Номер АНБ:
- НСА-17-025253
- Тип ресурса:
- Журнальная статья
- Название журнала:
- Ж.
 Неорган. хим.
Неорган. хим.
- Дополнительная информация журнала:
- Том журнала: Том: 7; Другая информация: ориг. Дата получения: 31-DEC-63
- Страна публикации:
- Страна неизвестна/код недоступен
- Язык:
- Русский
- Тема:
- ХИМИЯ; АЛЛОТРОПИЯ; РАЗЛОЖЕНИЕ; ВЫСОКАЯ ТЕМПЕРАТУРА; ВОДОРОД; ПЛАВЛЕНИЕ; ГИДРИДЫ КАЛИЯ; КАЛИЯ ГИДРОКСИДЫ; РАДИОГРАФИЯ; ГИДРИДЫ НАТРИЯ; ГИДРОКСИДЫ НАТРИЯ; НАДЕЖНЫЕ РЕШЕНИЯ; РЕШЕНИЯ; СТАБИЛЬНОСТЬ; ТЕМПЕРАТУРА
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Михеева В.И. , Шкрабкина М.М. ТВЕРДЫЕ РАСТВОРЫ В СИСТЕМАХ NaOH-NaH И KOH-KH . Страна неизвестна/Код недоступен: N. p., 1962.
Веб.
, Шкрабкина М.М. ТВЕРДЫЕ РАСТВОРЫ В СИСТЕМАХ NaOH-NaH И KOH-KH . Страна неизвестна/Код недоступен: N. p., 1962.
Веб.
Копировать в буфер обмена
Михеева В.И., Шкрабкина М.М. ТВЕРДЫЕ РАСТВОРЫ В СИСТЕМАХ NaOH-NaH И KOH-KH . Страна неизвестна/код недоступен.
Копировать в буфер обмена
Михеева В.И., Шкрабкина М.М. 1962.
«ТВЕРДЫЕ РАСТВОРЫ В СИСТЕМАХ NaOH-NaH И KOH-KH». Страна неизвестна/код недоступен.
Копировать в буфер обмена
@статья{osti_4676319,
title = {ТВЕРДЫЕ РАСТВОРЫ В СИСТЕМАХ NaOH-NaH И KOH-KH},
автор = {Михеева В.И., Шкрабкина М.М.},
abstractNote = {Чистые гидриды характеризуются резко определенной температурой начала термического разложения, 428°С для КН и 421°С для NaH. Весь водород выделяется при этих температурах. Система NaOH--NaH разлагается перед смешиванием при содержании NaH более 60%, а система KOH--KH - аналогично при содержании KH более 48%. Термограммы показали с увеличением концентрации гидрида повышение температуры плавления и снижение температуры полиморфной конверсии исходных гидроксидов. Рентгеновский анализ показал образование твердых растворов. На перитектических диаграммах показаны ограниченные области твердых растворов. Ожидаются твердые растворы, поскольку NaOH выше 299 c-C и KOR выше 247 c-C превращаются из альфа-модификаций в бета-версии. При комнатной температуре область гомогенности простирается до 18% NaH в системах NaOH-NaH и до 14% KH в системах KOH--KH. Однородная область расширяется с повышением температуры. При растворении гидридов в гидроксидах заметно повышается их термическая стабильность и расширяется температурная область их применения до 500-550°С. (ТТТ)},
Весь водород выделяется при этих температурах. Система NaOH--NaH разлагается перед смешиванием при содержании NaH более 60%, а система KOH--KH - аналогично при содержании KH более 48%. Термограммы показали с увеличением концентрации гидрида повышение температуры плавления и снижение температуры полиморфной конверсии исходных гидроксидов. Рентгеновский анализ показал образование твердых растворов. На перитектических диаграммах показаны ограниченные области твердых растворов. Ожидаются твердые растворы, поскольку NaOH выше 299 c-C и KOR выше 247 c-C превращаются из альфа-модификаций в бета-версии. При комнатной температуре область гомогенности простирается до 18% NaH в системах NaOH-NaH и до 14% KH в системах KOH--KH. Однородная область расширяется с повышением температуры. При растворении гидридов в гидроксидах заметно повышается их термическая стабильность и расширяется температурная область их применения до 500-550°С. (ТТТ)},
дои = {},
URL = {https://www.osti.gov/biblio/4676319},
журнал = {Ж.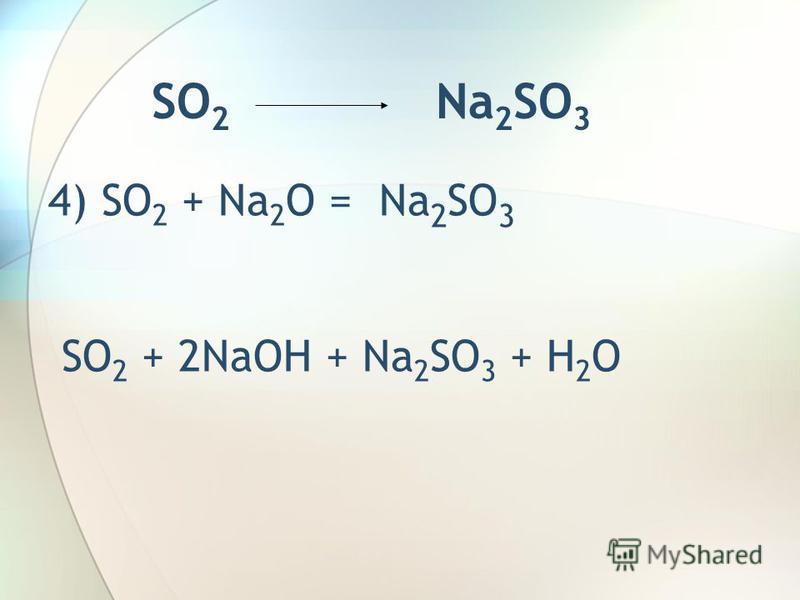

 Неорган. хим.
Неорган. хим.