Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Составить схемы электролиза водных растворов h3SO4, CuCl2, Pb(NO3)2 с платиновыми электродами
В каком году была сформулирована теория — предшественница кислородной теории горения.
Решено
прошу помогите ! к 300 г раствора , содержащего 0,1 массовой доли гидроксида калия , прилили азотную кислоту. сколько граммов соли образовалось
Разложение бертолетовой соли
Пользуйтесь нашим приложением
Тест по химии окислительно восстановительные реакции 8 класс — Тестирование
Тест по химии окислительно восстановительные реакции 8 класс
Тесты по химии 8 класс. Тема: «Окислительно-восстановительные реакции»
Правильный вариант ответа отмечен знаком +
1. Чему равна степень окисления P в оксиде P2O5?
2. Укажите вариант, в котором формула вещества не является окислителем:
3. Как изменяется степень окисления веществ при отдаче электронов?
— никак не изменяется
— нет такого понятия как степень окисления
4. В окислительно-восстановительной реакции, которая протекает согласно уравнению Si h5 + O2 = SiO2 + h3O, суммарный показатель коэффициентов равен:
В окислительно-восстановительной реакции, которая протекает согласно уравнению Si h5 + O2 = SiO2 + h3O, суммарный показатель коэффициентов равен:
5. Окислительное число +2 в соединениях присуще:
+ металлам главной подгруппы второй группы периодической системы Д. И. Менделеева
6. Атомы элементов-металлов являются восстановителями по той причине, что …
+ способны отдавать электроны
— способны как отдавать, так и присоединять электроны
— способны присоединять электроны
— не способны изменять степень окисления
7. Степень окисления атомов простых соединений, а также атомов, находящихся в свободном состоянии, равна:
8. Выберите вариант, в котором указана окислительно-восстановительная реакция:
9. Типичным восстановителем является ион …
Тест 10. Укажите вещество, в котором элементы имеют окислительное число +3 и -1:
11. Выберите ряд, где степень окисления кислорода у всех соединений равна О-2:
Выберите ряд, где степень окисления кислорода у всех соединений равна О-2:
12. Чему равна сумма коэффициентов уравнения реакции Cu + 4HNO3 = Cu (NO3)2 + 2NO2 + 2h3O?
13. Какие химические реакции называются окислительно-восстановительными?
— те, в результате которых наблюдается отдача электронов
— те, при которых происходит отдача протонов и нейтронов
+ те, в ходе которых происходит изменение степеней окисления веществ
— те, в результате которых наблюдается приём электронов
14. Какого типа ОВР не существует?
15. В преобразовании N+5 —> N-3 значение принятых электронов составляет:
16. Окислительное число N в указанных соединениях (N2O5, HNO3, NaNO3, Fe(NO3)3) равно:
17. Нулевую степень окисления Cl как химический элемент имеет в соединении:
18. Какое из веществ выступает наиболее сильным окислителем?
+ электроток на аноде при электролизе
19. Ион, окислительное число которого повышается, называется …:
Ион, окислительное число которого повышается, называется …:
Тест-20. Установите, чему равна степень окисления P в соединении K4P2O7:
21. В гидридах металлов (см. рис.) окислительное число H всегда равно:
22. Учитывая электронную атомарную структуру, выберите ту частицу, которая может быть окислителем:
23. Суть электронного баланса заключается в:
— определении и сравнении молекулярной массы веществ
+ сопоставлении окислительного числа химических элементов
— установлении валентности веществ в соединении
— составлении и написании полуреакций
24. В нитрате железа (II) (Fe(NO3)2) показатель степени окисления Fe равен:
25. Значение степени окисления серы (S) в сульфиде калия (K₂S) составляет:
26. Из предложенных вариантов выберите схему ОВР, где h3O выступает окислителем:
27. ОВР невозможна между:
28. Наименьший показатель степени окисления N имеет в веществе:
Наименьший показатель степени окисления N имеет в веществе:
29. В момент, когда атом вещества принимает электроны, степень его окисления:
— остаётся без изменений
— становится равной нулю
Тест_30. В сульфате железа (II) (FeSO4) окислительное число серы (S) составляет:
Выберите вариант, в котором указана окислительно-восстановительная реакция.
Testua. ru
17.06.2018 10:12:38
2018-06-17 10:12:38
Источники:
Https://testua. ru/testy-po-khimii/176-testy-po-khimii-8-klass/2033-testy-okislitelno-vosstanovitelnye-reaktsii-8-klass-s-otvetami. html
Химия 8: Окислительно-восстановительные реакции » /> » /> .keyword { color: red; }
Тест по химии окислительно восстановительные реакции 8 класс
Химия 8. Окислительно-восстановительные реакции
Рекомендуется вначале прочитать конспекты уроков Химии по теме «Окислительно-восстановительные реакции (ОВР)».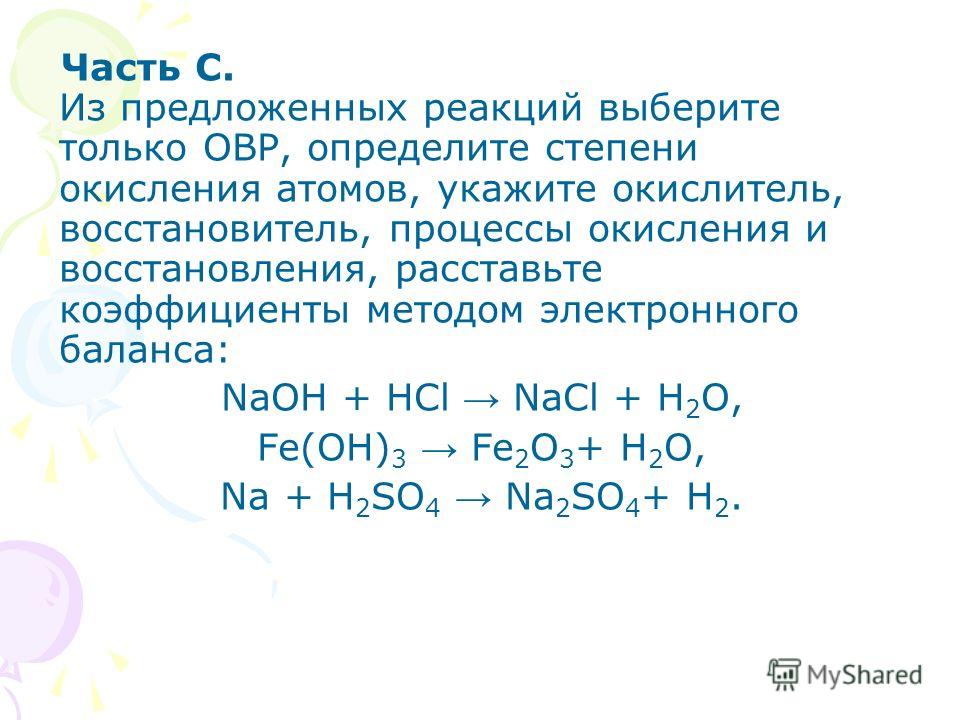 В настоящем тесте 12 вопросов. Нет ограничения по времени. Вначале вопросы с выбором одного ответа из 4-х вариантов. В конце — вопросы повышенной сложности (множественный выбор, сопоставление понятий, заполнить пропуски). Неудовлетворительная оценка за тест «Химия 8 класс: Окислительно-восстановительные реакции» выставляется, если правильных ответов меньше 50% ! Вернуться на страницу «Химия 8 класс».
В настоящем тесте 12 вопросов. Нет ограничения по времени. Вначале вопросы с выбором одного ответа из 4-х вариантов. В конце — вопросы повышенной сложности (множественный выбор, сопоставление понятий, заполнить пропуски). Неудовлетворительная оценка за тест «Химия 8 класс: Окислительно-восстановительные реакции» выставляется, если правильных ответов меньше 50% ! Вернуться на страницу «Химия 8 класс».
В настоящем тесте 12 вопросов.
Xn—80aneebgncbebxz7l. xn--p1ai
01.08.2018 22:35:35
2018-08-01 22:35:35
Источники:
Https://xn--80aneebgncbebxz7l. xn--p1ai/okislitelno-vosstanovitelnye-reak/
Тест по химии Окислительно — восстановительные реакции » /> » /> .keyword { color: red; }
Тест по химии окислительно восстановительные реакции 8 класс
Материал представляет собой тест в 2-х вариантах для контроля знаний по программе Н. С. и И. И. Новошинских.
Описание разработки
Данный тест по теме «ОВР» состоит из двух частей:
Часть 1 представлена заданиями с выбором ответа, которые на базовом уровне проверяют усвоение знаний по данной теме.
Часть 2 включает задание повышенного уровня сложности на установление соответствия позиций, представленных в двух множествах, что позволяет осуществить дифференциацию.
Вариант 1.
А1. Какая из реакций, схемы которых приведены ниже, является окислительно-восстановительной:
А2. Окислительно – восстановительную двойственность проявляет вещество, формула которого:
А3. Определите схему процесса восстановления:
0 +2 -2 +2 +7 +2 -1 0
А4. Расставьте коэффициенты методом электронного баланса:
Сумма коэффициентов в уравнении равна:
А5. Расставьте коэффициенты методом электронного баланса:
Коэффициент перед формулой восстановителя равен:
А6. Вещество проявляет окислительно — восстановительные свойства, если атом, входящий в его состав, может:
1) только отдавать электроны;
2) только присоединять электроны;
3) проявлять промежуточную степень окисления;
4) иметь только постоянную степень окисления.
Весь материал — в документе.
Содержимое разработки
Тест по теме: «ОВР»
Вариант 1.
А1. Какая из реакций, схемы которых приведены ниже, является окислительно-восстановительной:
2) Na2O + 2HCl = 2 NaCl + h3O
А2. Окислительно – восстановительную двойственность проявляет вещество, формула которого:
А3. Определите схему процесса восстановления:
0 +2 -2 +2 +7 +2 -1 0
1) Fe → Fe, 2) O → O, 3) Mn → Mn, 4) 2 Cl → Cl2.
А4. Расставьте коэффициенты методом электронного баланса:
Сумма коэффициентов в уравнении равна:
1) 11; 2) 13; 3) 7; 4) 10.
А5. Расставьте коэффициенты методом электронного баланса:
Коэффициент перед формулой восстановителя равен:
1) 3; 2) 4; 3) 2; 4) 5.
А6. Вещество проявляет окислительно — восстановительные свойства, если атом, входящий в его состав, может:
1) только отдавать электроны
2) только присоединять электроны
3) проявлять промежуточную степень окисления
4) иметь только постоянную степень окисления.
В1. Установите соответствие между схемой превращения веществ и изменением степени окисления окислителя в ней.
СХЕМА ПРЕВРАЩЕНИЯ ИЗМЕНЕНИЕ СТЕПЕНИ
Тест по теме: «ОВР»
Вариант 2.
А1. Какая из реакций, схемы которых приведены ниже, является окислительно-восстановительной:
А2. Окислительно – восстановительную двойственность проявляет вещество, формула которого:
А3. Определите схему процесса окисления:
+3 +2 +2 -2 +5 +2 -1 0
1) Fe → Fe, 2) O → O, 3) Mn → Mn, 4) 2 Cl → Cl2
А4. Расставьте коэффициенты методом электронного баланса:
Коэффициент перед формулой восстановителя равен:
1) 6; 2) 3; 3) 1; 4) 5.
А5. Расставьте коэффициенты методом электронного баланса:
Сумма коэффициентов в уравнении равна:
1) 12; 2) 9; 3) 14; 4) 15.
А6. Вещество проявляет только восстановительные свойства, если атом, входящий в его состав, может:
1) только отдавать электроны
2) только присоединять электроны
3) проявлять промежуточную степень окисления
4) иметь только постоянную степень окисления.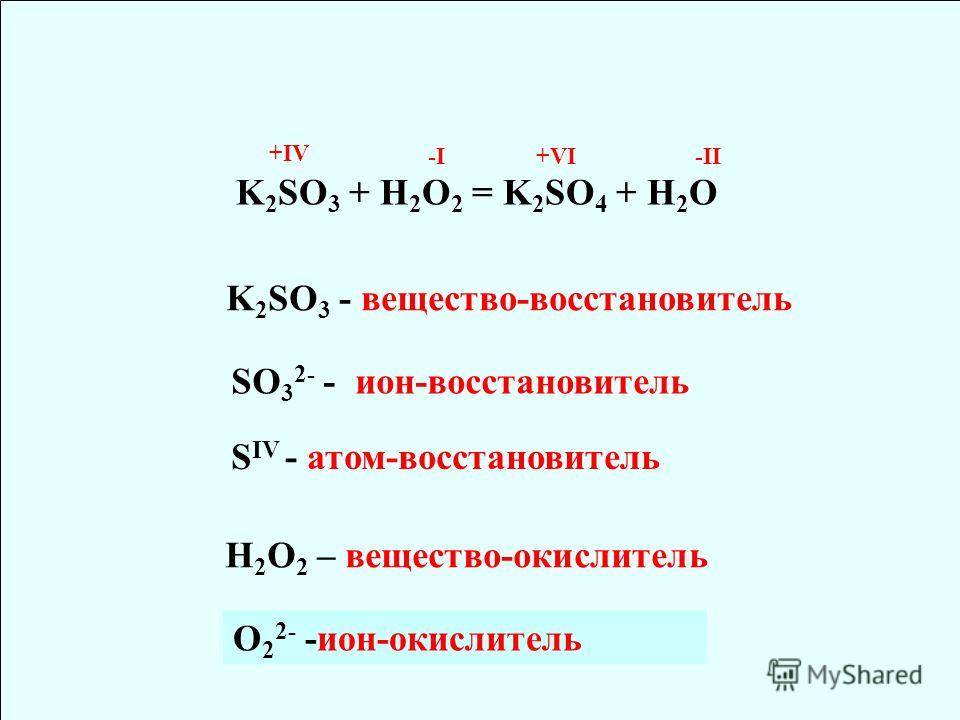
В1. Установите соответствие между схемой превращения веществ и изменением степени окисления окислителя в ней.
4 иметь только постоянную степень окис ления.
Videouroki. net
28.08.2019 14:07:11
2019-08-28 14:07:11
Источники:
Https://videouroki. net/razrabotki/test-po-khimii-okislitelno-vosstanovitelnye-reaktsii. html
Контрольная работа по теме «Химическая связь», 8 класс
Категория: Химия.
Контрольная работа по теме «Химическая связь», 8 класс
Вариант – 141
1. Составьте электронные схемы образования: а) хлорида калия, б) молекулы
азота. Укажите вид химической связи.
2. Выберите окислительно-восстановительные реакции из
нижеприведённых:
а) CaCO3 → СaO + CO2
б) HgO → Hg + O2
в) Na2O + SO2 → Na2SO3
г) СН4 → С + Н2
Ответ обоснуйте. Для одной из окислительно-восстановительных реакций
составьте электронный баланс.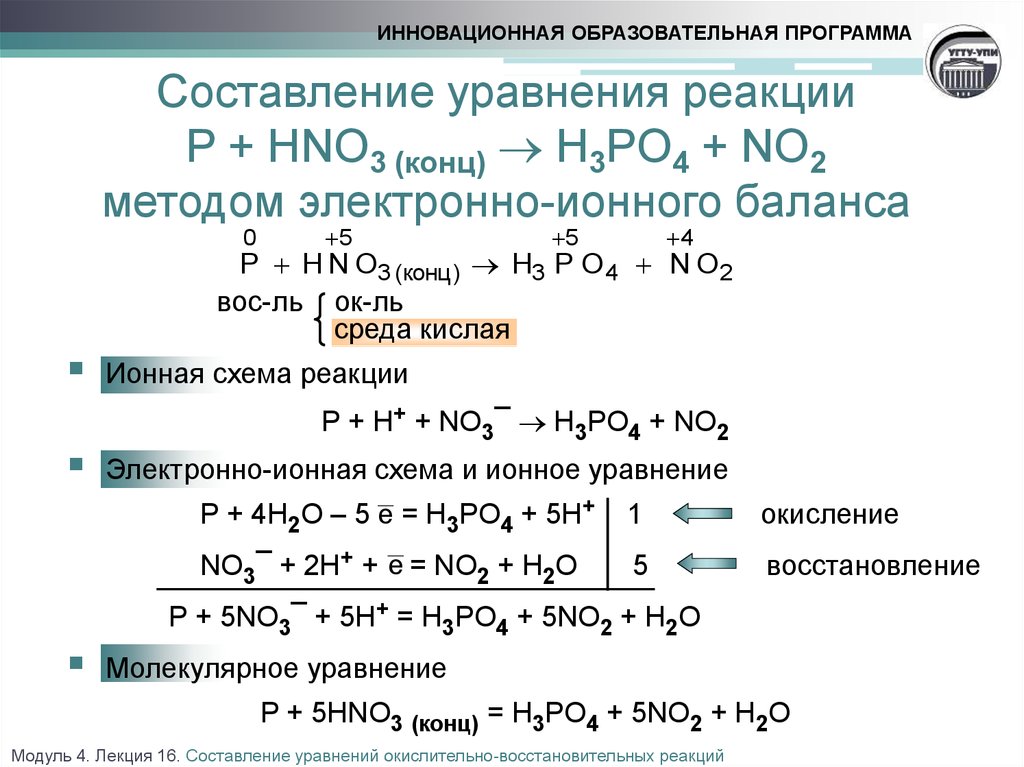
3. Составьте уравнения реакций серы с: а) кислородом, б) водородом,
в) натрием. Расставьте степени окисления всех элементов и укажите вид
химической связи у образовавшихся веществ.
4. При смешивании растворов соли с массовыми долями 10% и 45%
получили 20% раствор этой же соли массой 350г. Определите массы
взятых растворов.
Вариант – 223
1. Определите степени окисления элементов в следующих веществах:
N2, MgCl2, HI, FeBr3, SiF4, Na2SO3, h5P2O7.
2. Определите массовую долю для каждого элемента, входящего в состав
сульфата магния.
3. Приведите по три примера соединений с ионной, ковалентной полярной
и ковалентной неполярной связями. Составьте электронные формулы
соединений для веществ с разными видами связи (по одному примеру).
4. Расставьте коэффициенты в окислительно-восстановительных реакциях методом электронного баланса:
а) MnO2 + HCl → MnCl2 + Cl2 + h3O
б) Ca + Br2 → CaBr2
Вариант – 115
1. Составьте электронные схемы образования: а) бромида магния,
Составьте электронные схемы образования: а) бромида магния,
б) молекулы йода. Укажите вид химической связи.
2. Выберите окислительно-восстановительные реакции из
нижеприведённых:
а) Fe2 O3 + h3 → Fe + h3 O
б) HCl + MgО → MgCl2 + h3О
в) NO + O2 → NO2
г) Na2 CO3 + HI → NaI + h3О + CO2
Ответ обоснуйте. Для одной из окислительно-восстановительных
реакций составьте электронный баланс.
3. Составьте уравнения реакций водорода с: а) кислородом, б) калием,
в) хлором. Расставьте степени окисления всех элементов и укажите
вид химической связи у образовавшихся веществ.
4. При взаимодействии азотной кислоты с 8г оксида меди(II) получили
соль и воду. Рассчитайте массу и количество полученной соли.
Вариант – 238
1. Расставьте коэффициенты в окислительно-восстановительном
уравнении реакции методом электронного баланса:
KClO3 → KCl + O2 .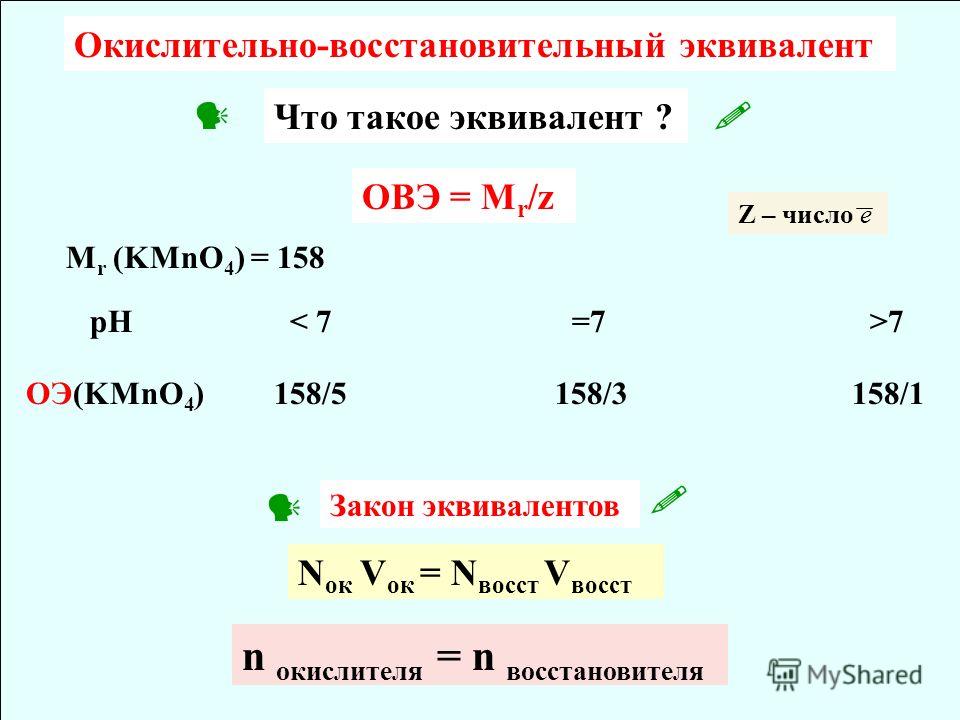 Определите объём и массу кислорода,
Определите объём и массу кислорода,
образовавшегося при разложении 0,4моль KClO3 .
2. Определите степени окисления элементов в следующих веществах:
NО2, СаCl2, КI, Al(NO3)3, h3, Na2CO3, KOH, PCl3.
3. Изобразите электронные формулы соединений элементов с порядковыми
номерами а) 19 и 35; б) 7 и 7; в) 34 и 8. Назовите вещества. Укажите вид химической связи между атомами.
4. Расставьте коэффициенты в окислительно-восстановительных
реакциях методом электронного баланса:
а) S + O2 → SO2
б) Al + O2 → Al2O3
Вариант – 454
1. Определите степени окисления элементов в следующих веществах:Cl2, MgCl2, СCl4, KClO3, KClO4, h3 O, S, HBr.
2. Определите, в каком уравнении окислительно-восстановительной
реакции допущены ошибки:
а) Na+1 + Cl2 → NaCl
б) Fe0 + Br20 → FeBr3
в) KClO3 → KClO4 + KCl-1
Выпишите уравнение реакции, в котором допущены ошибки, исправьте
их, и расставьте коэффициенты в нём методом электронного баланса.
1. Определите тип химической связи в каждом соединении:
h3 , HCl, Al2 S3 , CaO, Cl2, h3S, NaCl , ZnBr2. Для двух любых
соединений напишите схему образования химической связи.
2. Определите, какой объём хлора (н. у. ) необходим для получения
хлороводорода, при растворении которого в воде образуется 73%
раствор соляной кислоты массой 200г.
1. Расставьте коэффициенты в окислительно-восстановительных
реакциях методом электронного баланса:
а) Pb2O3 + h3 → Pb + h3O
б) P + O2 → P2O5
2. Изобразите электронные формулы соединений: MgBr2, I2, CO2.
Укажите тип химической связи в каждом соединении.
3. Определите степень окисления каждого элемента в соединениях:
Al2O3, Na2O, KOH, MgSO4, Al(OH)3, O2.
4. Определите массу сульфата магния и объём воды, необходимые для
приготовления 200мл раствора с концентрацией 0,5моль/л. Плотность
раствора равна 1г/мл.
Вариант – 378
1. Определите тип химической связи в каждом соединении:
F2 , Ch5, Al Cl3 , CO, Cl2, Na2S, HBr. Для двух любых
соединений c разными видами химической связи напишите схему
образования электронных формул.
2. Определите степени окисления элементов в следующих веществах:
СaO, N h4, BaBr2, N2 , h3S, Cг(OH)3, К3РО4.
3. Расставьте коэффициенты в окислительно-восстановительных
реакциях методом электронного баланса:
а) N2 + h3 → Nh4
б) Fe + O2 → Fe2O3
4. К 500г раствора с массовой долей сульфата меди (II), равной
50%, добавили 100г этого же вещества. Определите, какой станет массовая доля соли в полученном растворе.
Вариант – 383
1. Осуществите превращения: Br2 → KBr
↓
Br2O7
Для каждого уравнения реакции составьте электронный баланс.
2. Для сжигания 6г металла второй группы периодической системы
израсходовано 5,6л хлора. Какой это был металл?
Какой это был металл?
3. Определите степень окисления каждого элемента в соединениях:
Pb(OH)2 , P2O3, HgO, Al(NO3)3, S, h3.
4. Составьте молекулярные и электронные формулы соединений
углерода с: а) водородом, б) алюминием, в) кислородом. Укажите
вид химической связи в соединениях.
Вариант – 494
1. Определите степени окисления элементов в следующих веществах:
MnCl2, KCl, K2Cr2O7, KMnO4, P2O5, S, Al2(SO4)3.
2. Расставьте коэффициенты в окислительно-восстановительных
реакциях методом электронного баланса:
а) KBr + Cl2 → KCl + Br2
б) KClO3 + P → KCl + P2O5
3. Определите тип химической связи в каждом соединении:
Br2 , HI, Ni2 S3 , Ca h3, О2, C2h5 , NaCl . Для двух любых
соединений напишите схемы образования химической связи.
4. Определите массу и количество сульфида кальция, который образуется
в результате реакции между кальцием массой 8г и достаточным
количеством серы.
Вариант – 3115
1. Расставьте коэффициенты в окислительно-восстановительных
реакциях методом электронного баланса:
а) Аl2O3 + h3 → Аl + h3O
б) Ca + O2 → CaO
2. Запишите молекулярные формулы соединений бария с кислородом, углерода с водородом. Изобразите их электронные формулы.
Укажите тип химической связи в каждом соединении.
3. Определите степень окисления каждого элемента в соединениях:
Ca3(PO4)2, NaOH, MgSO4, AlСl3, К2О, O2.
4. Вычислите объём хлора (н. у. ), необходимый для вытеснения всего йода,
содержащегося в 400г раствора с массовой долей иодида натрия,
равной
Вариант – 3108
1. Определите тип химической связи в каждом соединении:
h3O , NO, Al Cl3 , O2, F2, NaI, CO2, HBr. Для двух любых соединений c разными видами химической связи напишите схему образования электронных формул.
2. Определите степени окисления элементов в следующих веществах:
LiOH, NO, BaCl2 , Ca3(PO4)2, Mg(NO3)2, О2.
3. Расставьте коэффициенты в окислительно-восстановительных
реакциях методом электронного баланса:
а) Nh4 + О2 → N2 + h3O
б) СuCl2 + Al → AlCl3 + Cu
4. При взаимодействии 9г металла третьей группы периодической
системы с соляной кислотой выделилось 11,2л газа. Какой это был
металл?
Вариант – 3123
1. Расставьте коэффициенты в окислительно-восстановительных
реакциях методом электронного баланса:
а) СuSO4 + Fe → FeSO4 + Сu
б) ZnS + O2 → ZnO + SO2
2. Определите массу соли и количество воды, полученные при
взаимодействии гидроксида меди(II) с соляной кислотой, если
известно, что в растворе массой 365г содержится 10% кислоты.
3. Определите степень окисления каждого элемента в соединениях:
BaCl2 , Ph4, MgO, O2, Fe(NO3)3, Ca(OH)2, HI.
4. Приведите по три примера соединений с ионной, ковалентной поляр–
ной и ковалентной неполярной связями. Составьте электронные
Составьте электронные
формулы соединений для веществ с разными видами связи
(по одному примеру).
В. М. Буданкова, МБОУ Климовская СОШ №1, пгт Климово, Брянская область
Метки: Химия
? => P2O5 (пятиокись фосфора)
| Поиск |
= пятиокись фосфора
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Комбинированная реакция Oxidation-reduction reaction
| 1188612215310164263553.jpg» substance-weight=»31.99880 ± 0.00060″> 5O 2 | + | 4P | → | 2 Рекламное объявлениеДополнительная информация об уравнении 5O2 + 4P → 2P 2 O 5В каких условиях O2 (кислород) реагирует с P (фосфором)?Температура: температура Другое Состояние: избыток кислорода Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Как могут происходить реакции с образованием P2O5 (пентоксид фосфора)?Явление после реакции O2 (кислорода) с P (фосфором)Нажмите, чтобы увидеть явление уравнения Какую другую важную информацию вы должны знать о реакцииМногие неметаллы реагируют с кислородом с образованием оксида кислоты Категории уравненияНажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >> Другие вопросы, связанные с химическими реакциями 5O2 + 4P → 2P 2 O 5Вопросы, связанные с реагентом O2 (кислород)Каковы химические и физические характеристики O2 (кислорода)? в качестве реагента? Вопросы, связанные с реагентом P (фосфор)Каковы химические и физические характеристики P (фосфора)? В каких химических реакциях используется P (фосфор) в качестве реагента? Вопросы, связанные с продуктом P2O5 (пятиокись фосфора)Каковы химические и физические характеристики P2O5 (фосфора)? В каких химических реакциях образуется P2O5 (пятиокись фосфора)? Рекламное объявление 1 результатов найдено Дополнительная информация о веществах, которые используют уравнениеРеакция O2 (окси) реакция с P (фосфо) дает P2O5 (дифотфопентаоксит) , температурный режим nhiệt độ Реакция, в результате которой образуется вещество O2 (oxi) (oxygen)2Cu(NO 3 ) 2 → 2CuO + 4NO 2 + O 2 2KNO 3 → 2KNO 2 + O 2 2H 2 O → 2H 2 + O 2 Реакция с образованием вещества P (photpho) (фосфор)5C + Ca 3 (PO 4 ) 2 + 3SiO 2 → 5CO + 2P + 3CaSiO 3 4P 4 O 6 → 4P + 3P 4 O 8 3Ca + 2PCl 3 → 3CaC 2 1 + 1 2 P2O5 (Diphotpho Penta Oxit) (Phosphorus pentoxide) 5KCLO 3 + 6p → 5Kcl + 3P 2 O 5 5K 2 2 O 7 2 2 O 7 2 2 o 7 + + + + + + + + + + + + + + + + + + + + + + . Окислительно-восстановительный потенциал и гальваника — Уроки WyzantЧем отличаются окислительно-восстановительные реакции? Окислительно-восстановительный потенциал — это термин, используемый для обозначения реакций, в которых Реакции синтеза также являются окислительно-восстановительными Если соединение делится на элементы при разложении, реакция разложения может быть окислительно-восстановительной Единственная реакция замещения Реакция двойного замещения Прежде чем мы углубимся в окислительно-восстановительные процессы, мы должны понять Водород в соединении всегда имеет степень окисления плюс один, Правила определения степени окисления в некоторой степени произвольны и
Сейчас самое время попробовать решить проблемы со степенью окисления Это окислительно-восстановительная реакция? В окислительно-восстановительной реакции выделяется по крайней мере один тип атома Возьмем следующее уравнение: K2(Cr2O7) + KOH Считайте, что металлическая медь в растворе нитрата серебра превращается в Подумайте об этом на числовой прямой. Медь окисляется, потому что Половинные реакции Рассмотрим реакцию: AgNO3 + Cu Полуреакции — это либо окисление, либо восстановление. Только На этот раз материал окисляется, и электроны должны 2( e- + Ag + В полной реакции количество потерянных электронов должно равняться количеству полученных электронов. Количество электронов, используемых в полуреакции восстановления, должно быть равно количеству электронов, образующихся в полуреакции окисления. Все полуреакции должны быть умножены на числа, которые уравняют числа электронов, и окончательная полная сбалансированная химическая реакция должна показать эти числовые соотношения. Одним из важных фрагментов информации, полученным при добавлении половины Выполнив эти математические вычисления для ряда материалов, вы обнаружите, что Восстановление или окисление? Восстановление материала – это приобретение электронов. Окисление Кто-то в порыве порочности решил, что нужно больше
COMING ATTRACTIONS ЭЛЕКТРОЛИЗ ГАЛЬВАНИЧЕСКОЕ ПОКРЫТИЕ ЭЛЕКТРИЧЕСКИЕ ЭЛЕМЕНТЫ Проблемы окислительно-восстановительного потенциала
Проблемы окислительно-восстановительного потенциала Часть 2
Химия на количественном языке: основы общехимических расчетов
CITE ORIAAKHI, Кристофер О. Химия на количественном языке: Основы расчеты общей химии , 2 -е изд. , 18 ноября 2021 г. ), https://doi.org/10.1093/oso/9780198867784.001.0001, , по состоянию на 13 октября 2022 г. Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks) Закрыть Фильтр поиска панели навигации Oxford AcademicChemistry in Quantitative Language: Fundamentals of General Chemistry Calculations (2nd edn)BooksJournals Термин поиска мобильного микросайта Закрыть Фильтр поиска панели навигации Oxford AcademicChemistry in Quantitative Language: Fundamentals of General Chemistry Calculations (2nd edn)BooksJournals Термин поиска на микросайте Расширенный поиск Abstract Химия на языке количественных вычислений — бесценное руководство по решению химических уравнений и расчетов. Ключевые слова: Решение задач, Общая химия, Основные теории, Химические расчеты, Химические реакции Содержание
Вы вошли какВойтиПолучить помощь с доступом Получить помощь с доступомДоступ для учреждений Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Доступ на основе IPКак правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией. Войдите через свое учреждениеВыберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору. Войти с помощью читательского билетаВведите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю. Члены обществаДоступ члена общества к журналу достигается одним из следующих способов: Войти через сайт сообществаМногие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество. Вход через личный кабинетНекоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже. Личный кабинетЛичную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок. Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Просмотр ваших зарегистрированных учетных записейЩелкните значок учетной записи в правом верхнем углу, чтобы:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 12.16
12.16 Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации. 3P 2 O 5 + 5Cr 2 O 3 5FeO + 2P → 5Fe + P 2 O 5
3P 2 O 5 + 5Cr 2 O 3 5FeO + 2P → 5Fe + P 2 O 5  Электролиз воды является окислительно-восстановительной реакцией. Пропустив через нее постоянный электрический ток
Электролиз воды является окислительно-восстановительной реакцией. Пропустив через нее постоянный электрический ток  Неприсоединенные (свободные) атомы
Неприсоединенные (свободные) атомы  Гидрид представляет собой соединение металла и
Гидрид представляет собой соединение металла и  Ионы
Ионы  Как
Как  0025 один в соединениях. Кажется, это имеет смысл, потому что дихромат
0025 один в соединениях. Кажется, это имеет смысл, потому что дихромат  Вы можете сделать математику для дихромат-иона, чтобы увидеть
Вы можете сделать математику для дихромат-иона, чтобы увидеть  Серебро
Серебро  Мы должны удвоить реакцию серебряной половины
Мы должны удвоить реакцию серебряной половины  Этот тип информации из
Этот тип информации из 

 СО
СО Р4О6
Р4О6 N2O
N2O На стенках и на дне пробирки образуется жидкая ртуть, а из пробирки выходит газообразный кислород.
На стенках и на дне пробирки образуется жидкая ртуть, а из пробирки выходит газообразный кислород.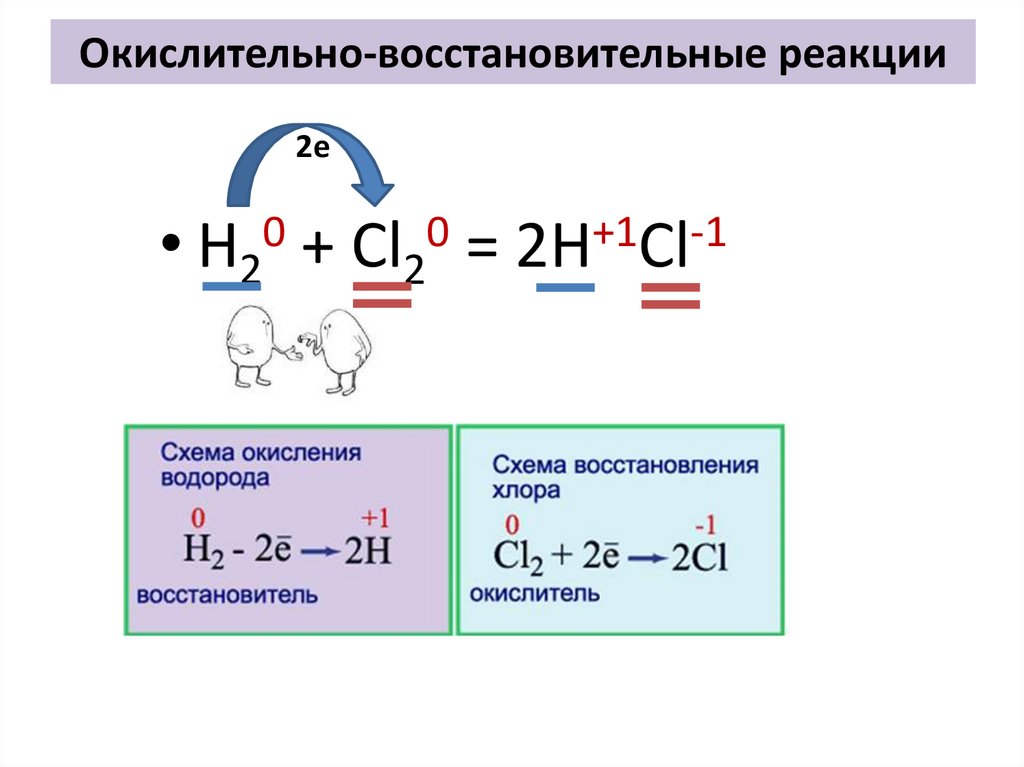
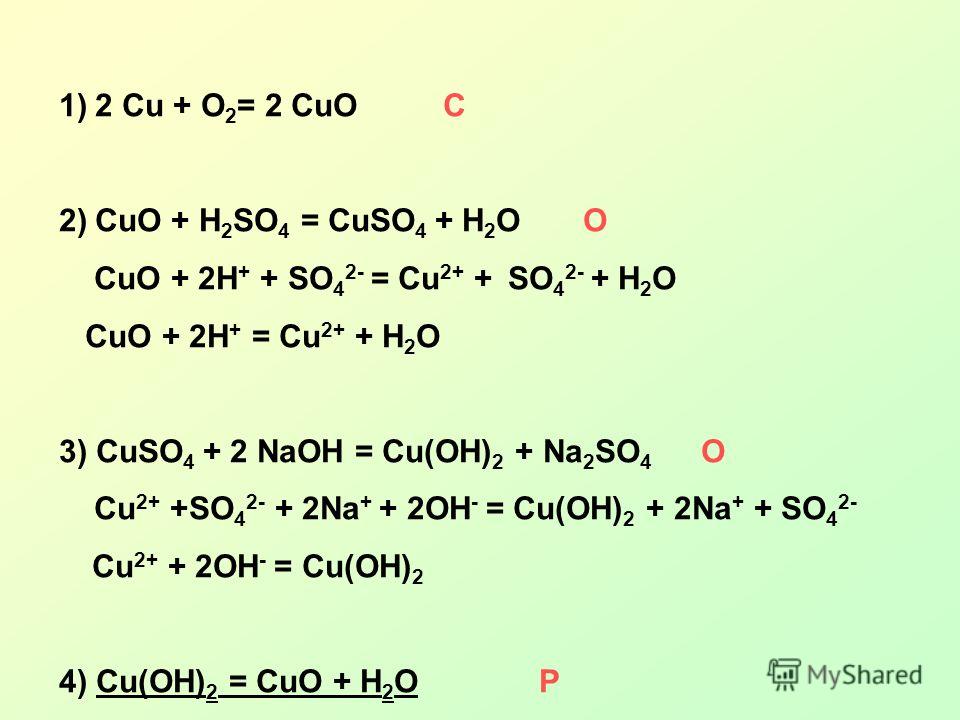
 В растворе серной кислоты перманганат калия будет титроваться щавелевой кислотой с образованием сульфата марганца II, диоксида углерода, воды и сульфата калия в растворе.
В растворе серной кислоты перманганат калия будет титроваться щавелевой кислотой с образованием сульфата марганца II, диоксида углерода, воды и сульфата калия в растворе.










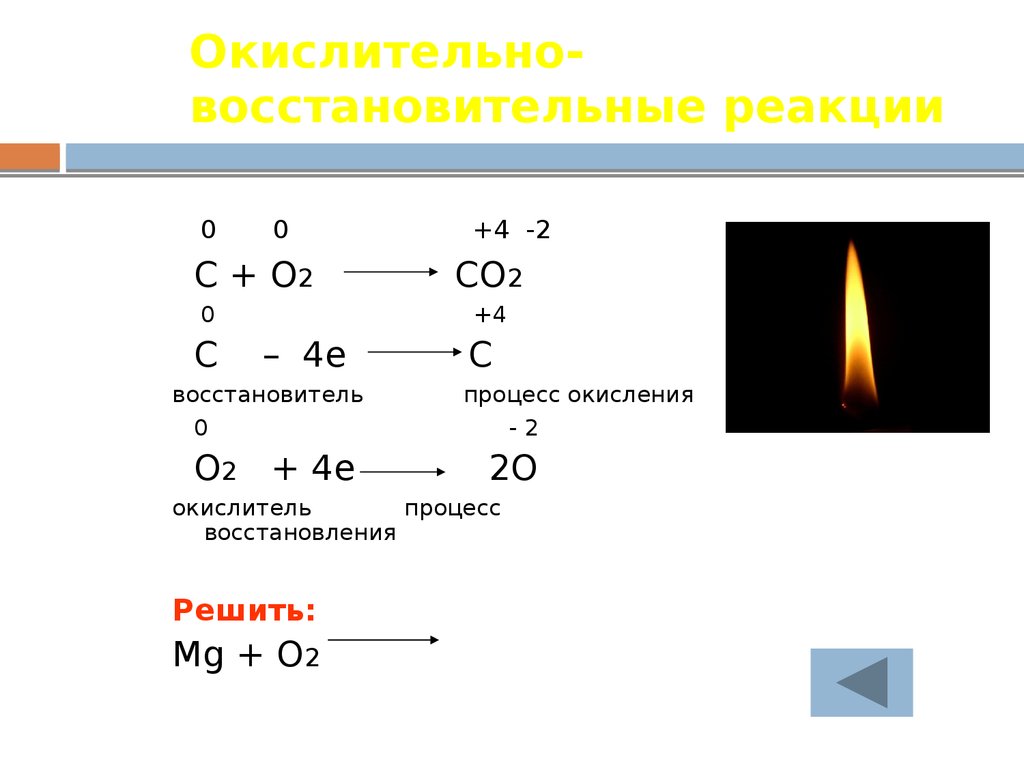
 ,
, Он предоставляет читателям интуитивно понятные и систематические стратегии для выполнения многих видов вычислений, которые они встретят в общей химии. Каждая глава знакомит с основными теориями и концепциями конкретной темы, уделяя особое внимание соответствующим уравнениям. Рабочие примеры освещают каждый тип проблемы с тщательно объясненными пошаговыми решениями. Поскольку задачи по химии могут быть представлены разными способами, примеры включают несколько вариантов каждого вопроса. Чтобы помочь учащимся понять и запомнить процедуры, в решениях обсуждается не только то, какие шаги нужно выполнить для достижения решения, но и почему. Дополнительные задачи с ответами приведены в конце каждой главы. Книга задумана как дополнение к стандартному учебнику по химии, но может использоваться и самостоятельно для ознакомления. Его основная аудитория — студенты первых курсов химии в колледжах и университетах; он также может помочь в подготовке к GCE Advanced Level, предметному тесту GRE, AP Chemistry, MCAT и аналогичным тестам.
Он предоставляет читателям интуитивно понятные и систематические стратегии для выполнения многих видов вычислений, которые они встретят в общей химии. Каждая глава знакомит с основными теориями и концепциями конкретной темы, уделяя особое внимание соответствующим уравнениям. Рабочие примеры освещают каждый тип проблемы с тщательно объясненными пошаговыми решениями. Поскольку задачи по химии могут быть представлены разными способами, примеры включают несколько вариантов каждого вопроса. Чтобы помочь учащимся понять и запомнить процедуры, в решениях обсуждается не только то, какие шаги нужно выполнить для достижения решения, но и почему. Дополнительные задачи с ответами приведены в конце каждой главы. Книга задумана как дополнение к стандартному учебнику по химии, но может использоваться и самостоятельно для ознакомления. Его основная аудитория — студенты первых курсов химии в колледжах и университетах; он также может помочь в подготовке к GCE Advanced Level, предметному тесту GRE, AP Chemistry, MCAT и аналогичным тестам.
 Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов: Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.