8 класс Химия Средняя 31
Смесь двух ближайших гомологов предельных карбоновых кислот массой 37,4 г нагрели с избытком метанола в присутствии следов серной кислоты. После перегонки получили 30,3 г смеси сложных эфиров. Установите качественный и количественный состав исходной смеси, если известно, что выход одного эфира составил 70%, второго — 50%, а количество низшего гомолога кислот в исходной смеси в пять раз больше, чем высшего.
8 класс Химия Средняя 48
Твердое вещество $A$ массой 4 г обработали хлором и получили единственный продукт $Б$, жидкий при нормальных условиях. При внесении продукта $Б$ в избыток воды образуется 3 г исходного вещества $A$. Из получившегося сильнокислого раствора при нагревании выделяется газ $B$ с плотностью по воздуху 2,2. При окислении кислородом исходной навески вещества $A$ можно выделить в 4 раза больше газа $B$, чем из раствора, полученного при внесении $Б$ в воду. Определите вещества $A, Б, B$.
При внесении продукта $Б$ в избыток воды образуется 3 г исходного вещества $A$. Из получившегося сильнокислого раствора при нагревании выделяется газ $B$ с плотностью по воздуху 2,2. При окислении кислородом исходной навески вещества $A$ можно выделить в 4 раза больше газа $B$, чем из раствора, полученного при внесении $Б$ в воду. Определите вещества $A, Б, B$.
8 класс Химия Средняя 45
Металл $X$ находит широкое применение в технике. Основным сырьем для его производства является минерал, в состав которого входит также железо. Металл $X$ получают из руды, используя электротермическое восстановление его коксом. При этом образуются сплавы металла $X$ с железом, которые сами по себе частично используются в промышленности. Чистый металл $X$ получают восстановлением оксида $X_2O_3$ кремнием или алюминием, а также путем электролиза растворов солей $X$. Элемент $X$ образует оксиды $XO$, $X_2O_3$, $XO_2$ и $XO_3$, три из которых применяются в технике.

 з. Какое применение в полиграфической промышленности находит калийная соль, образованная из оксида $XO_3$? Объясните ее применение.
з. Какое применение в полиграфической промышленности находит калийная соль, образованная из оксида $XO_3$? Объясните ее применение.8 класс Химия Средняя 33
Газ, полученный при обжиге 120 г пирита, использовали для полной нейтрализации раствора, содержащего 152 г гидроксида натрия. Определите массовую долю примесей в пирите.
8 класс Химия Средняя 62
Установите формулу кристаллогидрата сульфата железа (II), если известно, что эта соль содержит 45,32% воды по массе.
8 класс Химия Средняя 54
Смесь железа, алюминия и меди массой 5,0 г обработали избытком раствора соляной кислоты, при этом выделился водород объемом $1,900 дм^{3}$ (н.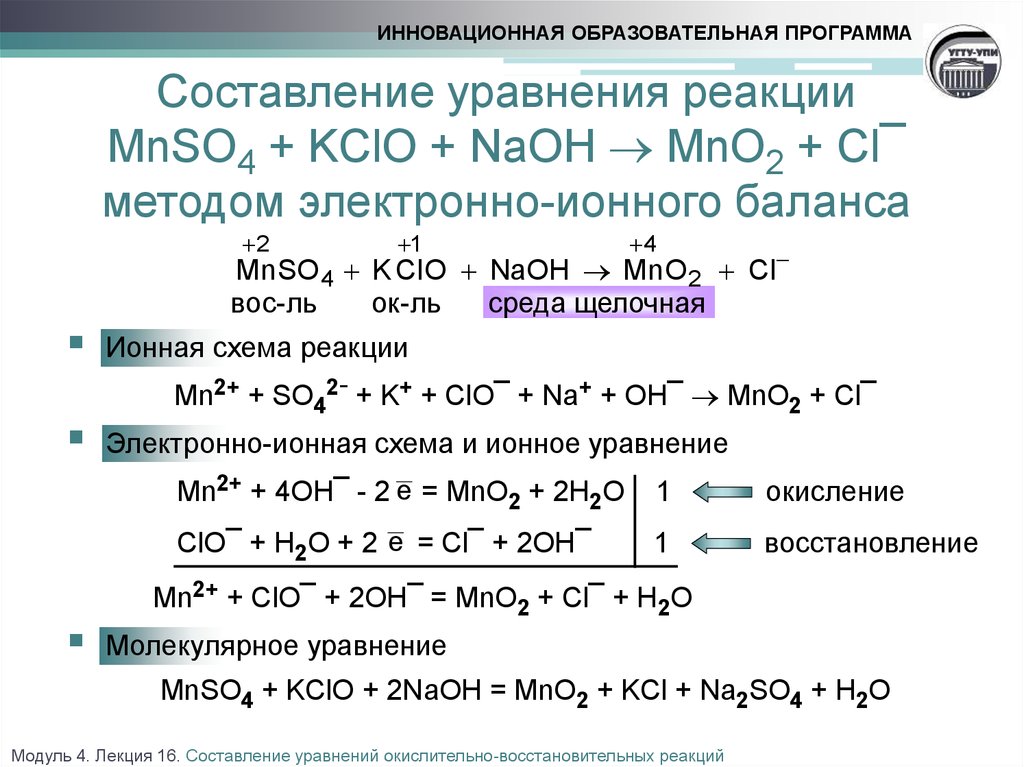 {\circ} С$ и давлении 756 мм рт. ст.
а. Какие металлы входят в состав сплава?
б. Определите их процентное содержание в сплаве.
в. Напишите уравнения проведенных химических реакций.
{\circ} С$ и давлении 756 мм рт. ст.
а. Какие металлы входят в состав сплава?
б. Определите их процентное содержание в сплаве.
в. Напишите уравнения проведенных химических реакций.
8 класс Химия Средняя 43
Определите массу нитрида магния, подвергшегося полному разложению водой, если для солеобразования с продуктами гидролиза потребовалось 150 мл 4 % -ной соляной кислоты ($\rho = 1,02 г/мл$).
8 класс Химия Средняя 33
Если материал понравился Вам и оказался для Вас полезным, поделитесь им со своими друзьями!
Калькулятор константы равновесия химических реакций
Этот калькулятор константы равновесия поможет вам понять обратимые химические реакции, которые являются реакциями, в которых и прямая, и обратная реакции происходят одновременно. Через определенное время устанавливается равновесие, что означает, что скорость превращения реагентов в продукты равна скорости превращения продуктов в реагенты. На данный момент реакция считается стабильной.
Через определенное время устанавливается равновесие, что означает, что скорость превращения реагентов в продукты равна скорости превращения продуктов в реагенты. На данный момент реакция считается стабильной.
Чтобы определить состояние этого равновесия, коэффициент реакции должен оставаться постоянным. С помощью этого инструмента вы можете вычислить значение константы равновесия для реакции, одновременно научившись легко вычислять константу равновесия.
Ниже вы можете найти уравнения обратимой реакции и константы равновесия:
a [A] + b [B] ⇌ c [C] + d [D]
K = ([C] c * [D] d) / ([B] b * [A] a)
где [A] и [B] являются молярными концентрациями реагентов, а [C] и [D] являются молярными концентрациями продуктов.
Вычисление значения константы равновесия для реакции полезно при определении количества каждого вещества, образующегося в равновесии, в виде отношения друг к другу.
Константа не зависит от исходных концентраций реагентов и продуктов, так как такое же соотношение всегда будет достигаться через определенный промежуток времени. Однако на константу могут влиять:
Однако на константу могут влиять:
температура
растворитель
ионная сила
Когда используется константа равновесия?
Константы равновесия полезны, если вы хотите понять биохимические процессы, такие как перенос кислорода гемоглобином или кислотно-щелочной гомеостаз у людей.
Изменения кислотно-основного гомеостаза в основном отражаются на изменениях рН артериальной и венозной крови. Врачи также проверит константу равновесия трансферрина в крови, так как насыщение трансферрина является симптомом железодефицитной анемии.
Это уравнение помогает объяснить, чему будет способствовать равновесие — реагенты или продукты. Это может дать важную информацию о природе реакции и ее механизме. Вы найдете больше по этой теме ниже.
Уравнение константы равновесия
Константа равновесия реакции относится ко всем видам, присутствующим в реакции. Однако в этом калькуляторе мы предполагаем, что имеется максимум два основных реагента и два основных продукта. Для гипотетической реакции:
Для гипотетической реакции:
a [A] + b [B] ⇌ c [C] + d [D]
уравнение константы равновесия имеет следующую формулу:
K = ([C] c * [D] d) / ([B] b * [A] a)
Константа K отражает два измерения количества:
Kc — представляет концентрацию, молярность, выраженную в молях на литр (М = моль / л)
Kp — функция парциальных давлений как реагентов, так и продуктов, обычно в атмосферах, полезная для расчетов в газовой фазе
Если K> 1 — равновесие благоприятствует продуктам
Если К <1 — равновесие благоприятствует реагентам
Если K = 1 — смесь содержит одинаковые количества как продуктов, так и реагентов в равновесии
Калькулятор ионной силы
Наш калькулятор ионной силы поможет вам рассчитать ионную силу раствора . Все, что вам нужно, это концентраций ионов в растворе и их зарядов номер .
Некоторым из вас может быть интересно, что такое ионная сила и зачем ее вычислять. В то же время другим из вас может быть интересно узнать, как рассчитать ионную силу раствора или буфера с помощью полезного уравнения.
У нас есть кое-что для каждого любопытного из вас, от формул расчета ионной силы до примеров и того, как рассчитать ионную силу по молярности. Здесь вы найдете все ответы!
Калькулятор ионной силы
Наш калькулятор ионной силы — эффективный инструмент для всех химиков и любителей химии. Как следует из названия, он вычисляет ионную силу раствора , используя концентрацию ионов и их .0003 номера начислений .
Изучение ионной силы полезно во многих различных исследованиях, от понимания электролиза различных растворов до теории Дебая-Хюккеля (теория, объясняющая поведение электролитов там, где она играет значительную роль).
Наш калькулятор может помочь вам после нескольких простых вводов, используя встроенное уравнение ионной силы. Вам нужно только ввести концентрацию всех ионов, присутствующих в растворе, вместе с их зарядами, и в результате вы получите ионную силу исследуемого раствора.
Что такое ионная сила?
Ионная сила Концентрация ионов в растворе .
Ионные соединения склонны диссоциировать и расщепляться на ионы при растворении в воде. Ионная сила является одним из важнейших свойств электролитического раствора.
Единицей ионной силы является моль/л раствора (моль на литр) или моль/кг растворителя (моль на килограмм). Единица измерения зависит от того, использовали ли вы формулу молярности или формулу моляльности для расчета концентрации ионов. 92zi2 — Заряды ионов в квадрате.
Как рассчитать ионную силу раствора?
Действительно, теперь вы должны понимать, что ионная сила раствора — это концентрация ионов в этом растворе. Его можно найти из уравнения ионной силы.
Теперь вопрос как рассчитать ионную силу раствора?
Две самые важные вещи, которые вам нужны, это концентрация ионов и их заряды . Тогда было бы лучше, если бы вы использовали формулу ионной силы, упомянутую выше:
- Рассчитайте мощность чисел заряда.

- Умножьте квадрат заряда на концентрацию ионов.
- Сложите все произведения концентрации ионов и зарядовых чисел.
- Разделить значение суммы на 2.
- Результатом является ионная сила раствора в моль/кг растворенного вещества или моль/л раствора.
Если у вас возникли проблемы с поиском названия вашего ионного соединения, вам поможет наш калькулятор химического названия.
Пример расчета ионной силы
Ионная сила раствора является важным свойством и изучается по разным причинам. Для лучшего понимания давайте рассмотрим пример расчета ионной силы и несколько других вещей, которые важно знать об ионной силе раствора:
- Рассчитать ионную силу по молярности
В случае, когда у вас нет информации о концентрации ионов, но вместо этого у вас есть молярность или моляльность, вам необходимо умножить количество каждого конкретного атома в молекуле на молярность или моляльность.
 Это даст вам ионную концентрацию.
Это даст вам ионную концентрацию.Например, у вас есть 0,02-молярный раствор ZnCl 2 . В этой ситуации имеется один атом цинка и два атома хлора.
Ионные концентрации будут:
ci(Zn)=0,02∗1=0,02 моль/л\small \text{c}_\text{i}(\text{Zn}) = 0,02 * 1 = 0,02 \text{моль/л} ci(Zn)=0,02∗1=0,02 моль/л
ci(Cl2)=0,02∗2=0,04 моль/л\text{c}_\text{i}(\text{Cl}_2) = 0,02 * 2 = 0,04 \text{ моль/л}ci(Cl2)=0,02∗2=0,04 моль/л
- Пример расчета ионной силы
Рассчитаем ионную силу 1-молярного раствора ZnCl 2 и Na 2 SO 4 .
Сначала вам нужно будет рассчитать концентрации ионов, используя значение молярности и, как упоминалось выше, формулу c i .
ci(элемент)=молярностьмоляльность⋅вид количество\размер сноски \text{c}_\text{i}(\text{элемент}) \!=\! \frac{\text{молярность}}{\text{моляльность}}\! \кдот\! \text{количество видов} ci(элемент)=моляльностьмолярность⋅количество видов
ci(Zn)=1∗1=1 моль/Lci(Cl2)=1∗2=2 моль/Lci(Na2)=1∗2=2 моль/Lci(SO4)=2∗1=2 моль/ L\footnotesize \text{c}_\text{i}(\text{Zn}) = 1 * 1 = 1 \text{моль/л} \\ \text{c}_\text{i}(\text{Cl}_2) = 1 * 2 = 2 \text{моль/л} \\ \text{c}_\text{i}(\text{Na}_2) = 1 * 2 = 2 \text{моль/л} \\ \text{c}_\text{i}(\text{SO}_4) = 2 * 1 = 2 \text{моль/л}ci(Zn)=1∗1=1 моль/Lci(Cl2 )=1∗2=2 моль/Lci(Na2)=1∗2=2 моль/Lci(SO4)=2∗1=2 моль/л
- Далее проверьте заряд ионов:
zi(Zn+)=+2zi(Cl2-)=-1zi(Na2+)=+1zi(SO4-)=-2\footnotesize \text{z}_\text{i}(\text{Zn}^+ ) = +2 \\ \text{z}_\text{i}(\text{Cl}_2^-) = -1 \\ \text{z}_\text{i}(\text{Na}_2^+) = +1 \\ \text{z}_\text{i}(\text{SO}_4^-) = -2zi(Zn+)=+2zi(Cl2-)=-1zi(Na2+)=+1zi( SO4-)=-2 92]) I=21([1⋅(+2)2+2⋅(-1)2]+[2⋅(+1)2+1⋅(-2)2])
I=12([1⋅ 4+2⋅1]+[2⋅1+1⋅4])\footnotesize \text{I} = \frac 1 2 ([ 1 \cdot 4 + 2 \cdot 1] + [2 \cdot 1 + 1 \ cdot 4])I=21([1⋅4+2⋅1]+[2⋅1+1⋅4])
I=12([4+2]+[2+4])\footnotesize \ text{I} = \frac 1 2 ([ 4 + 2] + [2 + 4])I=21([4+2]+[2+4])
I=12(6+6)\ footnotesize \text{I} = \frac 1 2 (6+ 6)I=21(6+6)
I=12⋅12\footnotesize \text{I} = \frac 1 2 \cdot 12I=21 ⋅12
I=6,0 моль/л\footnotesize \bold{\text{I} = 6,0 \text{моль/л}}I=6,0 моль/л 92)I=21∑(ci⋅zi2)
Почему рассчитывается ионная сила?
Ионная сила раствора играет решающую роль во многих других понятиях химии. Наиболее важные исследования приведены ниже:
Наиболее важные исследования приведены ниже:
- Теория Дебая-Хюккеля
Эта теория объясняет необычное поведение электролитов. В этой теории коэффициенты активности ионов рассчитываются на основе разбавленных растворов с заданной ионной силой.
- Теория двойного слоя
Теория двойного слоя объясняет, что два заряженных слоя окружают объект, когда объект помещается в заряженную жидкость. Эта теория справедлива для водных растворов с ионной силой, близкой к воде.
- Электрокинетические и электроакустические явления
Электрокинетические и электроакустические явления возникают при прохождении ультразвуковых волн через ионный раствор с известной и контролируемой ионной силой.
- Определение константы стабильности
Константа стабильности – это константа равновесия комплекса в растворе.
По этой мере мы рассчитываем концентрацию комплекса в ионном растворе. Его значение зависит от конкретных электролитов и их удельной ионной силы.
Некоторые другие соответствующие калькуляторы, которые вы можете изучить позже, — это калькулятор молекулярного веса или калькулятор атомной массы.
Часто задаваемые вопросы
Как рассчитать ионную силу буфера?
Буфер представляет собой тип раствора, и его ионная сила рассчитывается так же, как и для раствора .
Для расчета ионной силы буфера можно использовать следующую формулу:
I = 1/2 × ∑(c i × z i 2 )
Что такое где: ионная сила ZnCl₂, если его ионные концентрации равны 1,2 и 2,2 моль/л для Zn и Cl соответственно? Ионная сила ZnCl 2 составляет 3,5 моль/л или моль/кг (в зависимости от того, как была получена ионная концентрация), если ионная концентрация цинка и хлорида составляет 1,2 и 2,2 соответственно.
Формула для расчета ионной силы раствора:
I = 1/2 × ∑(c i × z i 2 )
Заряды ионов
:z i (Zn + ) = +2
Z I (CL — ) = -1
, а ионные концентрации:
C I (Zn) = 1,2 моль/л
C I (1,2 моль/л
C 1 I (1,2 моль/л
C 1 (Zn) = 1,2 моль/л
C (Zn) = 1,2 моль/л
C (Zn) = 1,2 моль/л. Cl) = 2,2 моль/л
Как рассчитать ионную силу, если вместо концентрации ионов указана молярность?
Если у вас нет концентрации ионов, но вместо этого у вас есть молярность или моляльность, вам необходимо сначала получить концентрацию ионов. Для этого умножьте количество ионов каждого атома/иона на молярность или мораль.
c i (элемент) = молярность/моляльность × количество видов
Затем вы подставляете концентрации ионов в формулу ионной силы, как обычно:
I = 1/2 × ∑(c i × z i 2 )
где:
Как рассчитать ионную силу 0,2 М (молярной) Na₂HPO₄?
Для определения ионной силы 0,2 М Na 2 HPO 4 , следуйте приведенным ниже инструкциям:
Когда образуется раствор Na 2 HPO 4 (динатрийфосфат или гидрофосфат натрия), он состоит из двух ионов натрия (Na + ) и одного гидрофосфатного иона (HPO 4 — ), что дает нам числа зарядов как z i (Na + ) = +2 и z i (HPO 4 — ) = -1 .
Два иона натрия и один ион фосфата. Используя формулу ионных концентраций от молярности/моляльности:
c i (элемент) = молярность/моляльность × количество видов
c i (Na) = 0,2 × 2 = 0,4 моль/л
c i (HPO 4 ) = 0,2 × 1 = 0,2 моль/л
Наконец, используйте формулу для ионной силы:
I = 1/2 × ∑(c i × г я 2 )
чтобы получить:
I = 0,9 моль/л
Ионная концентрация Na 2 HPO 4 составляет 0,9 моль/л .
Как рассчитать ионную силу раствора KCl?
Чтобы определить ионную силу раствора KCl:
Предположим, что ионные концентрации калия и хлора в хлориде калия (KCl) равны одному молю.
При диссоциации образует один ион калия (K + ) и один ион хлорида (Cl — ).
Итак, ионные концентрации составляют:c i (К) = 1 × 1 = 1 моль/л
c i (Cl) = 1 × 1 = 1 моль/л
и оплата:
z i (К + ) = +1
z i (Кл — ) = -1 .
Используя формулу ионной силы для ионной силы:
I = 1/2 × ∑(c i × z i 2 )
получаем:
I = 1 моль/л
Итак, ионная концентрация нашего KCl составляет 1 моль/л .
16.18: Чистые ионные уравнения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53866
На спортивных мероприятиях по всему миру небольшое количество спортсменов яростно соревнуются на полях и стадионах. Они устают, пачкаются и иногда получают травмы, пытаясь выиграть игру. Вокруг них тысячи зрителей, наблюдающих и аплодирующих. Была бы игра другой без зрителей? Определенно! Зрители поддерживают команду и вызывают энтузиазм. Хотя зрители не участвуют в игре, они, безусловно, являются частью процесса. 9-} \left( aq \right) \rightarrow \ce{AgCl} \left( s \right)\nonumber \]
Чистое ионное уравнение — это химическое уравнение, которое показывает только те элементы, соединения и ионы, которые непосредственно участвуют в химической реакции. Обратите внимание, что при написании суммарного ионного уравнения положительно заряженный катион серебра был записан первым со стороны реагента, а затем отрицательно заряженный анион хлорида. Это несколько обычно, потому что именно в этом порядке ионы должны быть записаны в продукте хлорида серебра. Однако нет абсолютной необходимости упорядочивать реагенты таким образом.
Обратите внимание, что при написании суммарного ионного уравнения положительно заряженный катион серебра был записан первым со стороны реагента, а затем отрицательно заряженный анион хлорида. Это несколько обычно, потому что именно в этом порядке ионы должны быть записаны в продукте хлорида серебра. Однако нет абсолютной необходимости упорядочивать реагенты таким образом.
Чистые ионные уравнения должны быть сбалансированы как по массе, так и по заряду. Балансировка по массе означает обеспечение равенства масс каждого элемента на стороне продукта и реагента. Балансировка по заряду означает обеспечение того, чтобы общий заряд был одинаковым в обеих частях уравнения. В приведенном выше уравнении общий заряд равен нулю или нейтральному по обе стороны уравнения. Как правило, если правильно сбалансировать молекулярное уравнение, результирующее ионное уравнение будет сбалансировано как по массе, так и по заряду.
Пример \(\PageIndex{1}\)
При смешивании водных растворов хлорида меди (II) и фосфата калия образуется осадок фосфата меди (II). Напишите сбалансированное суммарное ионное уравнение для этой реакции.
Напишите сбалансированное суммарное ионное уравнение для этой реакции.
Решение
Шаг 1: Спланируйте проблему.Сначала напишите и сбалансируйте молекулярное уравнение, убедившись, что все формулы верны. Затем напишите ионное уравнение, представив все водные вещества в виде ионов. Перенесите любые коэффициенты. Наконец, исключите ионы-спектаторы и напишите суммарное ионное уравнение. 9{3-}} \left( aq \right) \rightarrow \ce{Cu_3(PO_4)_2} \left( s \right)\nonumber \]
Шаг 3: Подумайте о своем результате.Для реакции осаждения результирующее ионное уравнение всегда показывает два иона, которые вместе образуют осадок. Уравнение уравновешивается массой и зарядом.
Резюме
- Ион-спектатор – это ион, не участвующий в химической реакции и находящийся в растворе как до, так и после реакции.
- Суммарное ионное уравнение — это химическое уравнение, которое показывает только те элементы, соединения и ионы, которые непосредственно участвуют в химической реакции.



 Это даст вам ионную концентрацию.
Это даст вам ионную концентрацию. По этой мере мы рассчитываем концентрацию комплекса в ионном растворе. Его значение зависит от конкретных электролитов и их удельной ионной силы.
По этой мере мы рассчитываем концентрацию комплекса в ионном растворе. Его значение зависит от конкретных электролитов и их удельной ионной силы.