7.Относительная атомная и молекулярная масса. Качественный и количественный состав вещества.
1. Относительная атомная масса серы:
1) 32 2) 16 3) 32 4) 16
2. Соотнесите:
формула вещества относительная молекулярная масса
А) BaSO4 В) CuCl2 1) 342 3) 63 5) 133
Б) HNO3 Г) Al2(SO4)3 2) 135 4) 233 6) 66
3. Молекула сернистого газа состоит из атома серы и двух атомов кислорода. Напишите ее формулу и рассчитайте относительную молекулярную массу.
4. Выберите правильную запись расчета относительной молекулярной массы серной кислоты H2SO4:
1) 1 + 32 + 16 2) 14 • 2 + 32 + 16 • 4 3) 1 • 2 + 32 + 16 • 4 4) 1 • 2 + 32 + 16
5. Соотнесите:
Соотнесите:
формулы веществ: относительные молекулярныемассы веществ:
1) Fe2O3 а) 72 д)170
2) MgO б) 180 е) 138
3) AgNO3 в) 100 ж) 40
4) С6Н12O6 г) 160
6*. Выберите правильные записи:
1) Mr (CuO) = 2Mr (NaOH) 3) Mr (CuSO4) >Mr (Fe2O3)
2)Mr(N2) <Mr(O2) 4)Mr(PH3) < 2Mr(NH3)
7*. Соотнесите:
величины относительных молекулярных масс веществ формулы веществ
1) 40 а) КНСO 3 г)СаСО3
2) 100 б)KNO3 д)NaOH
в)MgO е)CaH2
8. Молекула углекислого
газа состоит из атома углерода и двух атомов
кислорода. Напишите ее формулу и
рассчитайте относительную молекулярную
массу.
Молекула углекислого
газа состоит из атома углерода и двух атомов
кислорода. Напишите ее формулу и
рассчитайте относительную молекулярную
массу.
9. Выберите правильную запись расчета относительной молекулярной массы фосфорной кислоты H3PO4:
1) 1 + 31 + 16 2) 1 · 3 + 31 + 16 · 4 3) 14 · 3 + 31 + 16 · 4 4) 1 · 3 + 31 + 16
10. Соотнесите:
формулы веществ относительные молекулярные массы веществ
1) C2H4O2 а) 232 г) 60 ж) 56
2) Na2SO4 б) 29 д) 72
3) CaO в) 71 е) 142
4) Fe3O4
11*. Выберите правильные записи:
1) Мr (KHCO3) <Mr (CaCO3) 3) Mr (Fe2O3) = 2Mr (SO3)
2) Mr (Cl2) >Mr (N2) 4) Mr (H2S) >Mr (SO2)
12*. Соотнесите:
Соотнесите:
величины относительных формулы веществ
молекулярных масс веществ а) CuSO4 г) C2H6
1) 34 б) PH3 д) H2S
2) 160 в) Fe2O3е) AgNO3
13. Рассчитайте относительные молекулярные массы веществ
1) азотной кислоты HNO3 3) карбоната кальция СаСO3
2) оксида магния MgO 4) сульфата натрия Na2SO4
14. Рассчитайте относительные молекулярные массы веществ:
1)
серного ангидрида SO
2) оксида алюминия А12O3 4) фосфата калия К3РO4
15. Выберите формулы веществ, относительная
молекулярная масса которых равна 98:
Выберите формулы веществ, относительная
молекулярная масса которых равна 98:
1) СаСO3 2) С7Н14 3) ВаСl2 4) Na2SO3 5 )Na3PO4 6) H2SO4.
16. Выберите формулы веществ, относительная молекулярная масса которых равна 100:
1) КНСO3 2) Fe2O3 3) MgO 4) Mg3N2 5) AgCl 6) NH3
17. Выберите формулы веществ, относительная молекулярная масса которых равна 40:
1) СаН2 2) MgCO3 3) MgO 4) С3Н4 5) АlСl3 6) NaOH
18. Выберите формулы веществ, относительная молекулярная масса которых равна 142:
1) Na2SO4 2) Н2СO33) Fe2O3 4) С8Н16 5) Na2HP04
19. Рассчитайте относительные молекулярные
массы веществ и поставьте знаки
равенства, «больше» или «меньше» в
следующих записях (место знака отмечено
звездочкой, формулы переставлять
нельзя):
Рассчитайте относительные молекулярные
массы веществ и поставьте знаки
равенства, «больше» или «меньше» в
следующих записях (место знака отмечено
звездочкой, формулы переставлять
нельзя):
1) Mr(SO3) * 2Mr(MgO) 3) 5Мr (СН4) * 2Mr(NaOH)
20. Рассчитайте относительные молекулярные массы веществ и поставьте знаки равенства, «больше» или «меньше» в следующих записях (место знака отмечено звездочкой, формулы переставлять нельзя):
1) Mr(BaSO4) * 2Мг(СаС 3) Мr(K2НРO4) * Mr(Fe3O4)
2)
2Мr (Сl2)
* Mr(Na2SO4)
4) Мr (КНСO3)
* Mr(CuSO4).
21. Установите соответствие.
относительная атомная масса: химический элемент
1) 40 а) фосфор г)серебро
2) 108 б) кальций д) азот
3) 31 в)кислород е) магний
22. Установите соответствие.
формула: расчет относительной молекулярной массы:
1) CO2 а) 12+16 г) 1+14+16
2) HNO3 б) 12*1+16*3 д)1*1+14*1+16*3
в) 12*1+16*2
23.
Установите соответствие.
формула: относительная молекулярная масса:
1) Cl2 а) 48 г) 56
2) SO2 б) 64 д) 71
3) СH4 в) 97 е) 16
ICSC 0952 — СУЛЬФАТ НАТРИЯ
ICSC 0952 — СУЛЬФАТ НАТРИЯ« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRGerman — DEHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| СУЛЬФАТ НАТРИЯ | ICSC: 0952 (Октябрь 2005) |
| CAS #: 7757-82-6 |
| EINECS #: 231-820-9 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. При пожаре выделяет раздражающие или токсичные пары (или газы). При пожаре выделяет раздражающие или токсичные пары (или газы). |
В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Применять вентиляцию. | Свежий воздух, покой. | |
| Кожа | Защитные перчатки. | Ополоснуть и затем промыть кожу водой с мылом. | |
| Глаза | Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
|
| Проглатывание | Тошнота. Рвота. Боль в животе. Диарея. | Не принимать пищу, напитки и не курить во время работы. | Дать выпить один или два стакана воды. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| УПАКОВКА | |
| СУЛЬФАТ НАТРИЯ | ICSC: 0952 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: Na2SO4 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Какова относительная молекулярная масса сульфата натрия? (Относительные атомные массы Na, S и O равны 23u, 32u и 16u соответственно)
Дата последнего обновления: 06 апреля 2023 г.
•
Всего просмотров: 292,2 тыс. Ответ
Проверено
292,2 тыс.+ просмотров
Подсказка: мы знаем, что химическая формула сульфата натрия $\text{N}{{\text{a}}_{2}}\text{S}{{\text {O}}_{4}}$.
Сначала умножьте относительную атомную массу каждого атома на их валентность, а затем добавьте индивидуальное число, и мы получим относительную молекулярную массу. 9{12}\text{C}$) выбран в качестве стандарта. Его масса принята равной ровно 12. Относительные массы атомов и молекул — это количество раз, во сколько каждый атом или молекула тяжелее, чем $\dfrac{1}{12}\text{th}$ массы одного атома C-12. . Часто мы имеем дело с элементами и соединениями, содержащими изотопы различных элементов.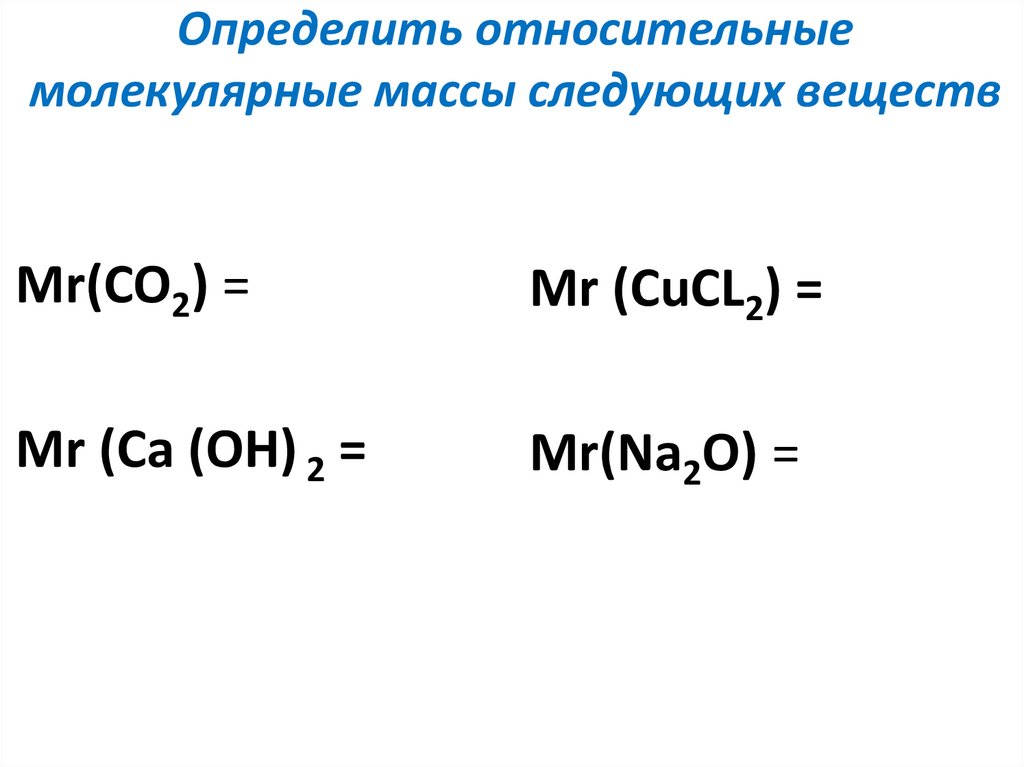 Поэтому мы предпочитаем использовать средние массы атомов и молекул. Таким образом, $\dfrac{1}{12}\text{th}$
Поэтому мы предпочитаем использовать средние массы атомов и молекул. Таким образом, $\dfrac{1}{12}\text{th}$
— Относительная молекулярная масса$=\dfrac{\text{Средняя масса 1 молекулы вещества}}{\dfrac{1}{12}\ text{масса одного атома C-12}}$
— Если мы знаем молекулярную формулу молекулы, мы можем рассчитать ее относительную молекулярную массу, добавив относительные атомные массы всех составляющих ее атомов. Рассчитаем относительную молекулярную массу сульфата натрия, $\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}$.
Относительная молекулярная масса сульфата натрия, $\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}$= $(2 \text{x относительная атомная масса (Na) + относительная атомная масса (S)+4 x относительная атомная масса (O))}$
$\begin{align}
& =(2\text{x 23 + 32+4 x 16)} \\
& \text{=142}u \\
\end{align}$
Следовательно, относительная молекулярная масса сульфата натрия равна 142 ты
Примечание: Эксперименты показывают, что один атом O-16 в 1,333 раза тяжелее одного атома C-12. Таким образом,
Таким образом,
$\text{Относительная атомная масса O-16= 1}\text{.333×12=15}\text{.996}\приблизительно \text{16}\text{.0 }$
Относительная атомная масса одинаковым образом определяются все элементы. Относительные молекулярные массы также могут быть определены экспериментально аналогичным образом. В случае молекулярной формулы молекулы мы можем рассчитать ее относительную молекулярную массу, добавив относительную массу всех составляющих ее атомов. Следует также отметить, что относительные атомная и молекулярная массы являются просто числами и безразмерны.
Недавно обновленные страницы
Рассчитать изменение энтропии, связанное с конверсией класса 11 химии JEE_Main
Закон, сформулированный доктором Нернстом, является первым законом термодинамики класса 11 химии JEE_Main
Для реакции при rm0rm0rmC и нормальном давлении класса A 11 химия JEE_Main
Двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC класс 11 химия JEE_Main
Для реакции rm2Clg в rmCrmlrm2rmg признаки 11 класса химии JEE_Main
Изменение энтальпии перехода жидкой воды в химический класс 11 JEE_Main
Рассчитайте изменение энтропии при переходе в химический класс 11 JEE_Main
Закон, сформулированный доктором Нернстом, представляет собой Первый закон термодинамики 11-го класса химии JEE_Main
Для реакция при rm0rm0rmC и нормальном давлении А химический класс 11 JEE_Main
Двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC химический класс 11 JEE_Main
0003
Изменение энтальпии перехода жидкой воды 11 класс химии JEE_Main
Актуальные сомнения
Вопрос Видео: Расчет молярности раствора по массе и объему
Видео стенограмма Что такое амолярность
9 решение получают путем растворения 21,5 г сульфата натрия Na2SO4 в количестве воды, достаточном для образования 150 миллилитров раствора? Дайте ответ до трех знаков после запятой места.
 Молярная масса кислорода 16
граммов на моль, натрия — 23 грамма на моль, а серы — 32 грамма на моль.
Молярная масса кислорода 16
граммов на моль, натрия — 23 грамма на моль, а серы — 32 грамма на моль.Молярность или молярная концентрация, является одним из нескольких способов выразить количественное количество растворенного вещества в решение. Точнее, молярность выражает количество молей растворенного вещества на литр раствора. Молярность раствора может быть рассчитывается по уравнению 𝑐 равно 𝑛, деленному на 𝑣, где 𝑐 — молярность в молях на литр, 𝑛 — количество растворенного вещества в молях, а 𝑣 — объем раствор в литрах.
В вопросе нам говорят, что
21,5 г сульфата натрия растворяют в воде с образованием раствора. Поскольку сульфат натрия является
растворенное вещество является растворенным веществом в этом растворе. Нам дана масса
растворенного вещества в граммах, но нам нужно знать количество растворенного вещества в молях. Мы можем использовать уравнение 𝑛 равно
нижний регистр 𝑚 разделить на заглавную 𝑀, чтобы преобразовать массу в граммах в количество в
родинки. В этом уравнении 𝑛 представляет собой количество
в молях, строчная 𝑚 — масса в граммах, а заглавная 𝑀 — молярная масса в
грамм на моль. Мы знаем массу, но у нас нет
дана молярная масса сульфата натрия. Нам дали среднее
молярная масса кислорода, натрия и серы. Мы можем использовать эти значения для
рассчитать молярную массу сульфата натрия.
Мы можем использовать уравнение 𝑛 равно
нижний регистр 𝑚 разделить на заглавную 𝑀, чтобы преобразовать массу в граммах в количество в
родинки. В этом уравнении 𝑛 представляет собой количество
в молях, строчная 𝑚 — масса в граммах, а заглавная 𝑀 — молярная масса в
грамм на моль. Мы знаем массу, но у нас нет
дана молярная масса сульфата натрия. Нам дали среднее
молярная масса кислорода, натрия и серы. Мы можем использовать эти значения для
рассчитать молярную массу сульфата натрия.
Одна формульная единица сульфата натрия
содержит два атома натрия, один атом серы и четыре атома кислорода. Каждый атом натрия имеет среднее
молярная масса 23 грамма на моль. Таким образом, два атома натрия будут иметь
средняя молярная масса 46 грамм на моль. Один атом серы имеет в среднем
молярная масса 32 грамма на моль. Один атом кислорода имеет в среднем
молярная масса 16 грамм на моль, поэтому четыре атома кислорода будут иметь среднюю молярную массу.
масса 64 грамма на моль. Складывая эти молярные массы вместе
дает нам молярную массу сульфата натрия, 142 грамма на моль.
Один атом кислорода имеет в среднем
молярная масса 16 грамм на моль, поэтому четыре атома кислорода будут иметь среднюю молярную массу.
масса 64 грамма на моль. Складывая эти молярные массы вместе
дает нам молярную массу сульфата натрия, 142 грамма на моль.
Теперь мы можем заменить массу и молярную массу в уравнении. Единица грамма будет отменена, оставив нас с единицей молей. Выполнение расчета дает нам количество 0,1514 моль. Теперь мы знаем значение 𝑛 в молярное уравнение. Вопрос говорит нам о том, что объем раствора 150 миллилитров. Но для того, чтобы решить для молярности, объем должен быть указан в литрах. Мы можем конвертировать между двумя единицы объема, используя соотношение один литр равен 1000 миллилитров.
Чтобы выполнить преобразование, мы можем
умножьте 150 миллилитров, данные в вопросе, на соотношение, записанное в виде
дробь с единицей миллилитров в знаменателе так, чтобы единицы миллилитров
отмена.


