Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.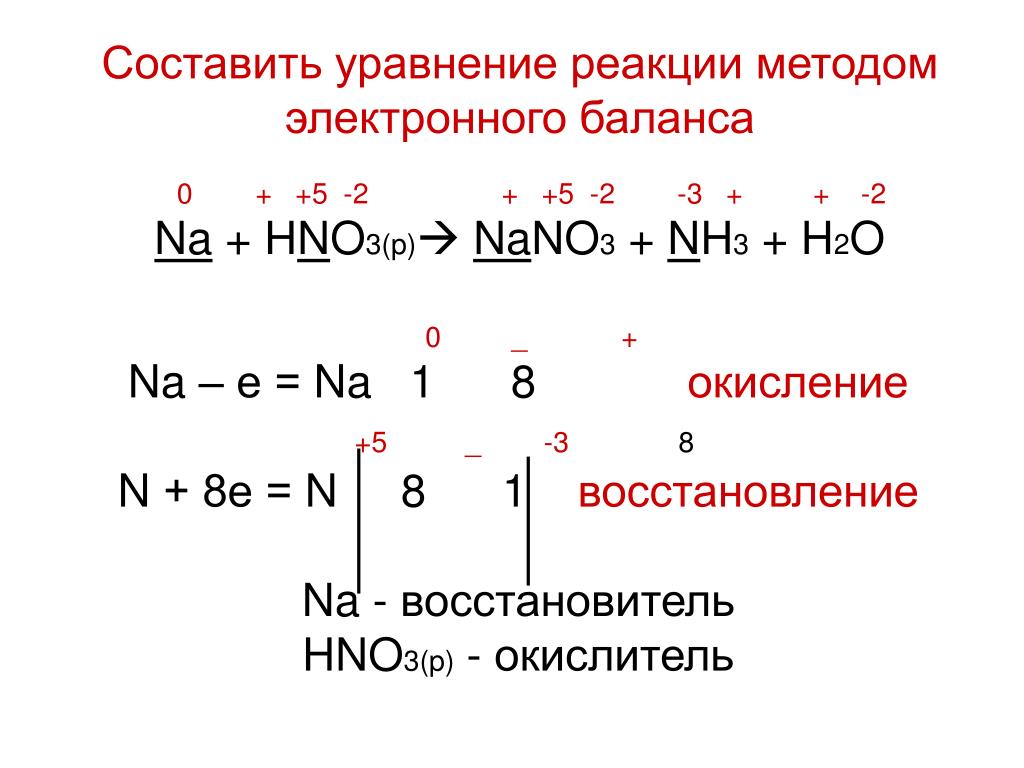 д. Координационные свойства проявляются всеми элементами периодической системы.
д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26. 12.2016 12:02
12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016.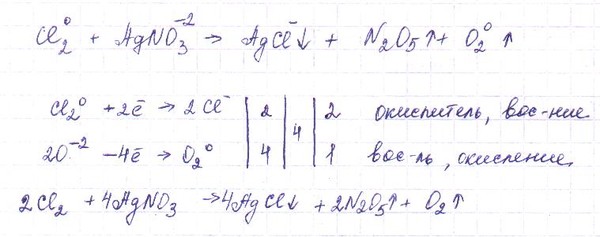 – 23 с.
– 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701.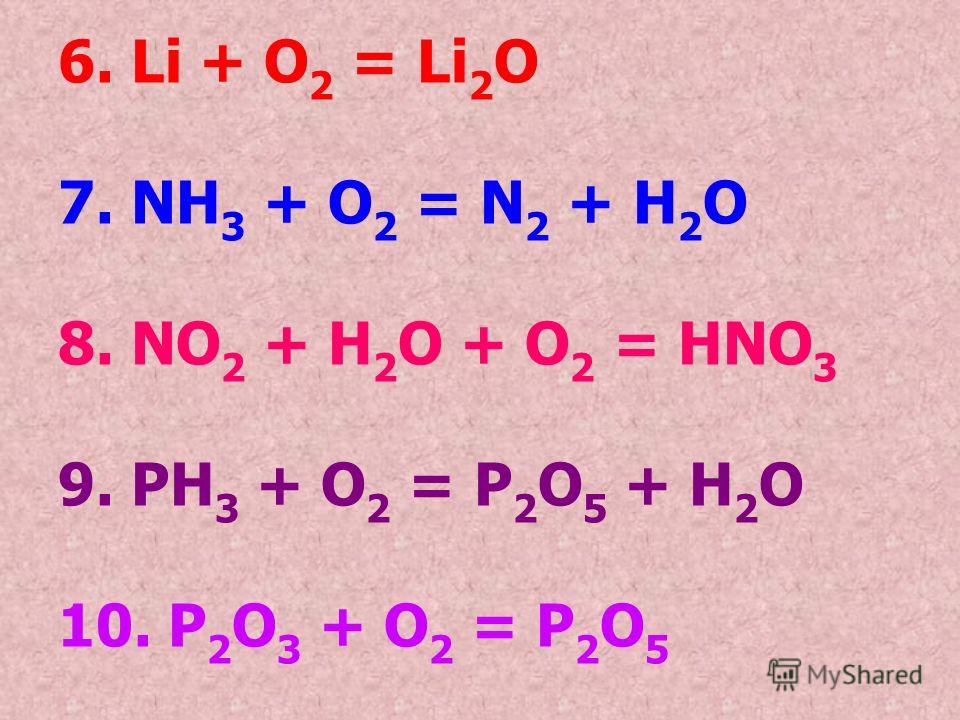 32 kB
32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
Ответы на контрольную работу по теме «Неметаллы»(Габриелян) решебник
Первый уровень
Вариант 1
ЗАДАНИЕ 1
Напишите уравнения реакций для следующих переходов:
С →С02 →СаС03 →СаС12 →СаС03.
Превращение 1 рассмотрите в свете ОВР, 4 — в свете ТЭД.
С→СО2→ СаСО3→ CaCl2 → СаСО3
C+O2 → CO2
C0 -4e= C+4 восстановитель
O2 + 4e= 2O-2 окислитель
CO2+ CaO→CaCO3
CaCO3+2HCl→ CaCl2 +h3O + CO2
CaCl2+Na2CO3=CaCO3+2NaCl
Ca2++CO32-=CaCO3
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
N2 + ЗН2 2Nh4 + Q,
по всем изученным признакам классификации.
Рассмотрите данную реакцию с точки зрения ОВР.
3h3 + N2 2Nh4 + Q
N20 +2*3е→2N-3 окислитель
h30 -2*1е→2H+1 восстановитель
Исходные вещества: 1 моль азота (молекула из 2 атомов азота), 3 моль водорода (молекула из 2 атомов водорода). Продукт реакции – аммиак, 2 моль. Молекула из 1 атома азота и 2 атомов водорода. Исходные вещества продукты реакции – газы.
Экзотермическая.
Окислительно-восстановительная.
Прямая.
Каталитическая.
Обратимая.
ЗАДАНИЕ 3
В схеме ОВР расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Сu + HN03(paз6) → CU(N03)2 + NO + Н20.
ЗАДАНИЕ 4
К раствору, содержащему 16 г сульфата меди (II), прибавили избыток железных опилок. Какая масса меди выделилась при этом?
CuSO4 + Fe = FeSO4 + Cu
n (CuSO4) = 16/160 = 0,1моль
n (CuSO4) = n (Cu) =0,1моль
m(Cu) = 0,1*64= 6,4 г
Вариант 2
ЗАДАНИЕ 1
Напишите уравнения реакций для следующих переходов:
N2 → NO → N02 →HN03 →CU(N03)2.
Превращение 1 рассмотрите в свете ОВР, 4 — в свете ТЭД.
N2 + O2 = 2NO
N20 -4e= 2N+2 восстановитель
O20 +4e= 2O-2 окислитель
2NO + O2 = 2NO2
4NO2 + O2 + 2h3O = 4HNO3
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O
3Cu0 + 8H++8NO3- = 3Cu2+ +6NO3- + 2NO + 4h3O
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
2N0 + 02 2N02 + Q,
по всем изученным признакам классификации.
Рассмотрите данную реакцию с точки зрения ОВР.
2NO + O2 = 2NO2 + Q
N+2 -2e = N+4 восстановитель
O2 +4e = 2O-2 окислитель
Исходные вещества: 2 моль оксида азота 2 (молекула из 1 атома азота и 1 атома кислорода), 1 моль кислорода (молекула из 2 атомов кислорода). Продукт реакции – оксид азота 4, 2 моль (1 атом азота и 2 атома кислорода в молекуле). Исходные вещества продукты реакции – газы.
Реакция:
Экзотермическая.
Окислительно-восстановительная.
Прямая.
Некаталитическая.
Обратимая.
В схеме ОВР расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Сu + НNO3(КОНЦ) → Cu(N03)2 + N02 + Н20.

ЗАДАНИЕ 4
6,5 г цинка обработали достаточным количеством разбавленного раствора серной кислоты. Определите объем выделившегося водорода.
h3SO4 + Zn = Zn SO4 + h3 ↑
n(Zn) = 6,5/65 = 0,1 моль
n(h3) = n(Zn) = 0,1 моль
V(h3) = 0,1*22,4 = 2,24 л
Вариант 3
ЗАДАНИЕ 1
Напишите уравнения реакций для следующих переходов:
S → S02 →S03 h3S04 →BaS04.
Превращение 1 рассмотрите в свете ОВР, 4 — в свете ТЭД.
S+O2→ SO2
S0 -4e = S+4
O02 + 4e = 2O-2
2SO2+O2→2SO3
SO3+h3O→h3SO4
h3SO4+ BaCl2 = BaSO4↓ + 2HCl
SO42-+ Ba2+ = BaSO4↓
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
С02 + С 2СО – Q,
по всем изученным признакам классификации.
Рассмотрите данную реакцию с точки зрения ОВР.
СО2 + С = 2СО– Q
С+4 +2е = С+2 окислитель
С0 -2е =С+2 восстановитель
Исходные вещества: 1 моль оксида углерода 4 (1 атом углерода, 2 атома кислорода) – газ, 1 моль углерода (1 атом углерода) -тв. Продукт реакции – 2 моль оксида углерода 2 (1 атом углерода, 1 атома кислорода) – газ.
Продукт реакции – 2 моль оксида углерода 2 (1 атом углерода, 1 атома кислорода) – газ.
Эндотермическая
ОВР
Прямая
ЗАДАНИЕ 3
В схеме реакции расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Zn + h3S04(KOHц) → ZnS04 + h3S↑ + h30.
Zn + h3SO4(конц.) → ZnSO4 + h3S↑ + h3O
уравнения полуреакций:
Zn0 – 2e– → Zn+2| 2 | 8 | 4 | – восстановитель
S+6 + 8e– → S–2 | 8 | 8 | 1 | – окислитель
4Zn0 + S+6 = 4Zn+2 + S–2
4Zn + 5h3SO4(конц.) = 4ZnSO4 + h3S↑ + 4h3O
Определите количество вещества сульфата калия, полученного при сливании избытка раствора гидроксида натрия с раствором, содержащим 2 моль серной кислоты.
2KOH + h3SO4 = K2SO4 + h3O
n(h3SO4) = n(K2SO4) = 2 моль
Вариант 4
ЗАДАНИЕ 1
Напишите уравнения реакций для следующих переходов:
Si → Si02 →Na2Si03 →h3Si03 →Si02.
Превращение 1 рассмотрите в свете ОВР, 3 — в свете ТЭД.
1) Si + O2 = SiO2
Si0 -4е = Si+4 восстановитель
O20 +4е = 2O2- окислитель
2) SiO2 + Na2O = Na2SiO3
3) Na2SiO3 + 2HCl = h3SiO3 ↓+ 2NaCl
2H+ +SiO3 2- = h3SiO3 ↓
4) h3SiO3 = SiO2 + Н2О
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
Н20(пар) + СО Н2 + С02 – Q,
по всем изученным признакам классификации.
Рассмотрите данную реакцию с точки зрения ОВР.
Н+12О + С+2О = Н02 + С+4О2 – Q
С+2 -2е =С+4 восстановитель
Исходные вещества: 1 моль воды (2 атома водорода, 1 атом кислорода) – газ, 1 моль оксида углерода 2 (1 атом углерода, 1 атом кислорода) -газ. Продукты реакции – 1 моль водорода (2 атома водорода в молекуле) – газ, 1 моль оксида углерода 4 (1 атом углерода, 2 атома кислорода) – газ.
Эндотермическая
ОВР
Прямая
Обратимая
Некаталитическая.
ЗАДАНИЕ 3
В схеме реакции расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Nh4 + CuO→ N2 + Сu + Н20.
2Nh4 + 3CuO -> 3Cu + N2 + 3h3O
N-3 -6е = N20 восстановитель
Cu+2 +2е =Cu0 окислитель
ЗАДАНИЕ 4
10 г оксида магния обработали раствором азотной кислоты. Какая масса соли образовалась?
MgO + 2HNO3 = Mg(NO3)2 + h3O
n (MgO) = 10/40 =0,25 моль
n (MgO) = n (Mg(NO3)2) = 0,25 моль
Второй уровень
Вариант 1
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов:
С → СН4 →С02 →СаС03 →… →СаС03.
Превращение 2 рассмотрите в свете ОВР, 5 — в свете ТЭД.
С + 2Н2 = СН4
СН4 + 2О2 = СО2 + 2Н2О
С-4 – 8е=С+4 восстановитель
О2 о +4е = 2О-2 окислитель
СО2 + СаО = СаСО3
CaCO3 + CO2 + h3O ↔ Ca(HCO3)2
Ca(HCO3)2 = CaCO3↓ + CO2 + h3O
Ca2+ + 2HCO3- = CaCO3↓ + CO2 + h3O
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
2Fe + ЗС12 = 2FeCl3 + Q,
по всем изученным признакам классификации.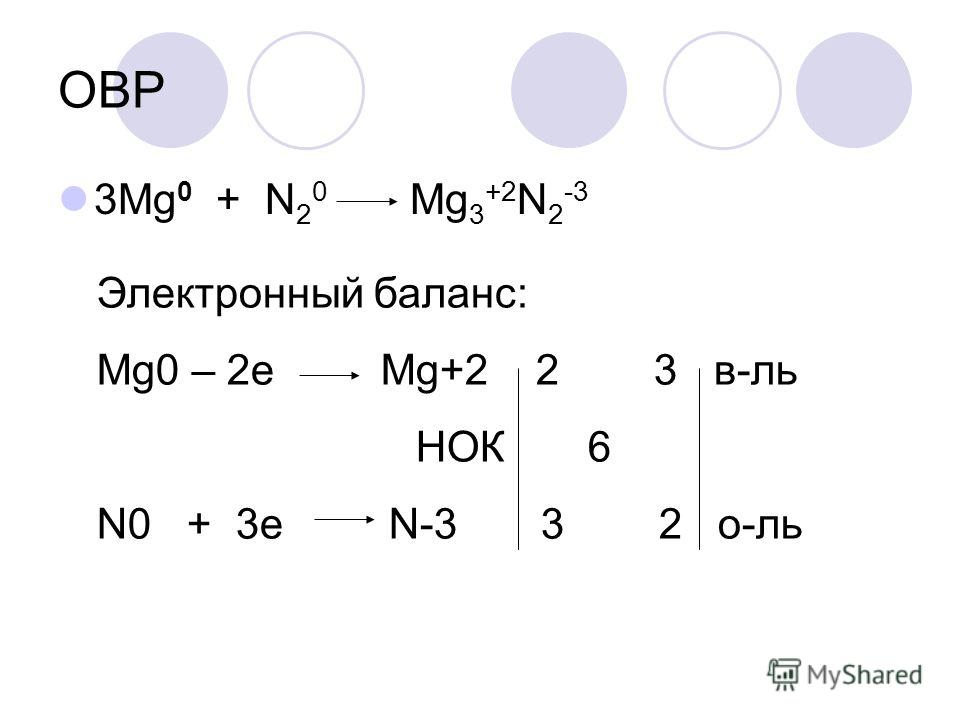
Определите окислитель и восстановитель, процессы окисления и восстановления.
ЗАДАНИЕ 3
В схеме реакции расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Сu + HN03(paз6) →Cu(NO3)2 + … + Н20.
ЗАДАНИЕ 4
К 160 кг 10%-го раствора сульфата меди (II) прибавили железные опилки. Какая масса меди выделилась?
CuSO4 + Fe = FeSO4 + Cu
m (CuSO4) = 160*0,1= 16 г
n(CuSO4) = 16/160 = 0,1 моль
m (Cu) =0,1 * 64 = 6,4 г
Вариант 2
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов:
N2 → Li3N →NO →N02 … →…→ Cu(NO3)2.
Превращение 2 рассмотрите в свете ОВР, 5 — в свете ТЭД.
1)N2+6Li->t,кат. ->2Li3N
2) 4Li3N + 5O2->t->4NO+6Li2O
N-3 -5e =N+2 восстановитель
O20 +4е= 2O-2 окислитель
3)2NO+O2->2NO2
4)4NO2+2h3O+O2->4HNO3
5) Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
Cu0 + 4H+ +2NO3 -= Cu2+ + 2NO2 + 2h3O
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
2А1 + 3S = A12S3 + Q,
по всем изученным признакам классификации.
Рассмотрите данную реакцию с точки зрения ОВР.
2Al + 3S = Al2S3 + Q
Al – 3e– = Al +III восстановитель
S+ 2e– = S –Il окислитель
Экзотермическая
ОВР
Прямая
Необратимая
Некаталитическая
Исходные вещества: 2 моль алюминия – тв., 3 моль серы тв.
Продукт: 1 моль сульфида алюминия (из 2 атомов алюминия, 3 атомов серы) – тв.
ЗАДАНИЕ 3
В схеме ОВР расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Сu + HN03(KOHЦ) → Cu(N03)2 + … + Н20.
ЗАДАНИЕ 4
Достаточное количество цинка обработали 120 кг 10%-го раствора серной кислоты. Определите объем выделившегося газа.
Zn + h3SO4 = ZnSO4 + h3
m (h3SO4) = 120*0,1= 12кг= 12000 г
n(h3SO4) = 12000/98 = 122 моль
n(h3) = n(h3SO4) = 122 моль
V(h3) = 122*22,4 = 2742 л
Вариант 3
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов:
S →FeS →S02 →S03 →…→ BaS04.
Превращение 2 рассмотрите в свете ОВР, 5 — в свете ТЭД.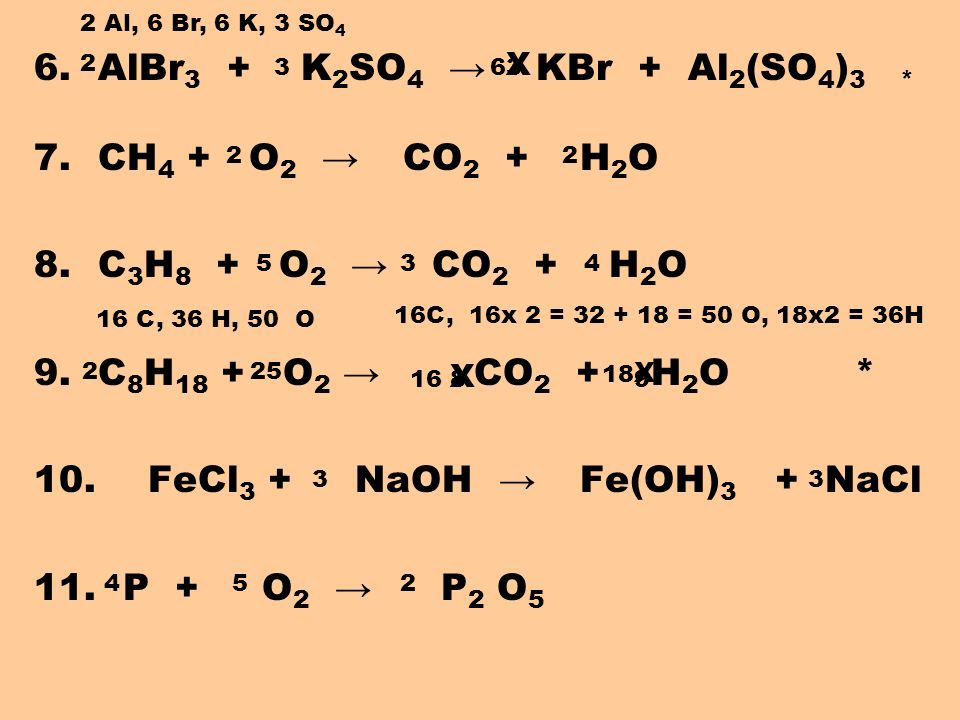
Fe + S = FeS
2FeS + 3O2 = 2FeO + 2SO2
S-2 -6e = S+4 восстановитель
O20 +4е= 2O-2 окислитель
2SO2 + O2 = 2SO3
SO3 + h3O = h3SO4
BaCl2 + h3SO4 → BaSO4↓ + 2HCl
Ba2+ + SO42- → BaSO4↓
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
ЗСа + 2Р = Са3Р2 – Q,
по всем изученным признакам классификации.
Рассмотрите данную реакцию с точки зрения ОВР.
3Са + 2Р = Са3Р2 – Q
Са – 2e– = Са +II восстановитель
Р + 3e– = Р –IlI окислитель
Эндотермическая
ОВР
Прямая
Необратимая
Некаталитическая
Исходные вещества: 2 моль фосфора – тв., 3 моль кальция тв.
Продукт: 1 моль фосфида кальция (из 2 атомов фосфора, 3 атомов кальция) – тв.
ЗАДАНИЕ 3
В схеме ОВР расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
2h3SO4 + Zn = SO2↑ +ZnSO4 + 2h3O
Zn – 2e– = Zn +II восстановитель
S+6 + 2e– = S +4 окислитель
ЗАДАНИЕ 4
Какой объем водорода выделится при взаимодействии достаточного количества цинка с 200 г 10% -го раствора серной кислоты?
h3SO4 + Zn = Zn SO4 + h3 ↑
m (h3SO4) = 200*0,1= 20 г
n(h3SO4) = 20/98 = 0,2 моль
n(h3) = n(h3SO4) = 0,2 моль
V(h3) = 0,2*22,4 = 4,57л
Вариант 4
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов:
Si → Si02 →Na2Si03 →…→ Si02.
Превращение 1 рассмотрите в свете ОВР, 3 — в свете ТЭД.
Si + O2 = SiO2
Si0 -4е = Si+4
O20 +4е= 2O-2 окислитель
SiO2 + Na2O = Na2SiO3
Na2SiO3 + 2HCl = h3SiO3 + 2NaCl
2Н+ +SiO3 2- = h3SiO3 ↓
h3SiO3 = SiO2+ h3O
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
Fe203 + 2А1 = 2Fe + А1203 + Q,
по всем известным признакам классификации.
Рассмотрите данную реакцию с точки зрения ОВР.
Fe2O3 + 2Al = 2Fe + Al2O3 + Q
Al0 – 3e– = Al +III восстановитель
Fe+3 + 3e– = Fe 0 окислитель
Экзотермическая
ОВР
Прямая
Необратимая
Некаталитическая
Исходные вещества: 2 моль алюминия – тв., 1 моль оксида железа 3 (2 атома железа и 3 атома кислорода в ФЕ) тв.
Продукты: 2 моль железа, 1 моль оксида алюминия (из 2 атомов алюминия, 3 атомов кислорода в ФЕ) – тв.
ЗАДАНИЕ 3
В схеме ОВР расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Nh4 + CuO→N2 + Сu + … .
3CuO + 2Nh4 = 3Cu + N2 + 3h3O
Cu+2 + 2е = Cu0 окислитель
2N-3 -6е = N20 восстановитель
ЗАДАНИЕ 4
Достаточное количество оксида магния обработали 40 кг 10%-го раствора азотной кислоты. Какая масса соли образовалась?
2HNO3 + MgO = Mg(NO3)2 + h3O
m (HNO3) = 40000*0,1= 4000 г
n(HNO3) = 4000/63 = 63,5 моль
n(Mg(NO3)2) = n(HNO3)/2 = 31,7 моль
m (Mg(NO3)2) = 31,7*148 = 4698 г = 4,698 кг
Третий уровень
Вариант 1
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов:
С →СН4 → … →CaCO3→ … → CaCO3.
Рассмотрите все реакции в свете ОВР и ТЭД везде, где это имеет место.
С + 2Н2 = СН4
С0 +4е = С-4 окислитель
Н20 -2е = 2Н+1 восстановитель
СН4 + О2 = СО2 + Н2О
С-4 -8е = С+4 восстановитель
О20 +4е = 2О-2 окислитель
СО2 + СаО = СаСОз
CaCO3+2HCl→ CaCl2 +h3O + CO2
CaCO3+2H+→ Ca2+ +h3O + CO2↑
CaCl2+Na2CO3=CaCO3+2NaCl
Ca2++CO32-=CaCO3
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
Zn + 2НС1 = ZnCl2 + h3↑ + Q,
по всем изученным признакам классификации.
Рассмотрите реакцию с точки зрения ТЭД.
Zn+2HCl=ZnCl2+h3 + Q
Исходные вещества: 1 моль цинк, 2 моль соляной кислоты (1 атом водорода, 1 атом хлора в молекуле). Продукты реакции: 1 моль хлорида цинка (1 атом цинка, 2 атома хлора в ФЕ), 1 моль водорода (2 атома водорода).
Экзотермическая реакция
Цинк – тв., соляная кислота – ж., хлорид цинка тв. (раствор), водород – г.
Без катализатора
С изменением степеней окисления
Необратимая
2H++2Cl-+Zn0=Zn2++2Cl-+h30
2H++Zn0=Zn2++h30
ЗАДАНИЕ 3
Закончите уравнение ОВР, расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Сu + HN03(paз6) →.
ЗАДАНИЕ 4
К 160 кг 10%-го раствора сульфата меди (II) прибавили избыток железных опилок. Какая масса меди выделилась, если выход продукта составил 90% от теоретически возможного?
Fe + CuSO4 = FeSO4 + Cu
m (CuSO4) = 160000*0,1= 16000 г
n (CuSO4) = 16000/160= 100 моль
n (CuSO4)= n (Cu) по уравнению (теор. ) = 100 моль
) = 100 моль
n (Cu) = 100/0,9 = 90 моль (пр.)
m (Cu) = 90*64= 5760 г
Вариант 2
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов:
N2 →… →NO →N02 →… →Cu(N03)2.
Рассмотрите все реакции в свете ОВР и ТЭД везде, где это имеет место.
1)N2+3h3->t,кат. ->2Nh4
N20 +2*3е→2N-3 окислитель
h30 -2*1е→2H+1 восстановитель
2)4Nh4+5O2->t,кат. ->4NO+6h3O
N-3 – 5е→N+2 восстановитель
O20 +4e→2O-2 окислитель
3)2NO+O2->2NO2
N+2 – 2е→N+4 восстановитель
O20 +4e→2O-2 окислитель
4)4NO2+2h3O+O2->4HNO3
N+4 – 1е→N+5 восстановитель
O20 +4e→2O-2 окислитель
5)Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
Cu0 + 4H+ +2NO3 -= Cu2+ + 2NO2 + 2h3O
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
2NO + 02 2N02 + Q,
по всем изученным признакам классификации. Рассмотрите данную реакцию в свете ОВР.
2NO + O2 = 2NO2 + Q
N+2 -2e = N+4 восстановитель
O2 +4e = 2O-2 окислитель
Исходные вещества: 2 моль оксида азота 2 (молекула из 1 атома азота и 1 атома кислорода), 1 моль кислорода (молекула из 2 атомов кислорода). Продукт реакции – оксид азота 4, 2 моль (1 атом азота и 2 атома кислорода в молекуле). Исходные вещества продукты реакции – газы.
Продукт реакции – оксид азота 4, 2 моль (1 атом азота и 2 атома кислорода в молекуле). Исходные вещества продукты реакции – газы.
Реакция:
Экзотермическая.
Окислительно-восстановительная.
Прямая.
Некаталитическая.
Обратимая.
ЗАДАНИЕ 3
Закончите уравнение ОВР и расставьте коэффициенты в нем методом электронного баланса, укажите окислитель и восстановитель:
Сu + НNОз(конц.} →.
ЗАДАНИЕ 4
ЦИНК массой 6,5 кг обработали избытком раствора серной кислоты. Определите объем выделившегося газа, если выход продукта реакции составил 80% от теоретически возможного.
h3SO4 + Zn = Zn SO4 + h3 ↑
n(Zn) = 65000/65 = 1000 моль
n(h3) = n(Zn) = 1000 моль (теор.)
n(h3)практ. = 1000*0,8 = 800моль
V(h3) = 800*22,4 = 17920л
Вариант 3
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов:
S →FeS →S02 →… →h3S04 →… .
Рассмотрите все реакции в свете ОВР и ТЭД везде, где это имеет место.
S+ Fe = FeS
S0 + 2e = S-2 окислитель
Fe0 -2e= Fe+2 восстановитель
4FeS + 7O2 → 2Fe2O3 + 4SO2↑
S-2 -6e = S+4 восстановитель
O2 +4e = 2O-2 окислитель
2SO2 + O2 = 2SO3
S +4 – 2е→ S +6 восстановитель
O20 +4e→2O-2 окислитель
SO3 + h3O = h3SO4
SO3 + h3O = 2H+ +SO42-
h3SO4 + 2NaOH = Na2SO4 + h3O
2H+ +2OH- = h3O
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
С02 + С 2СО – Q,
по всем изученным признакам классификации. Рассмотрите данную реакцию в свете ОВР.
Рассмотрите данную реакцию в свете ОВР.
СО2 + С = 2СО– Q
С+4 +2е = С+2 окислитель
С0 -2е =С+2 восстановитель
Исходные вещества: 1 моль оксида углерода 4 (1 атом углерода, 2 атома кислорода) – газ, 1 моль углерода (1 атом углерода) -тв. Продукт реакции – 2 моль оксида углерода 2 (1 атом углерода, 1 атома кислорода) – газ.
Эндотермическая
ОВР
ЗАДАНИЕ 3
Закончите уравнение ОВР и расставьте коэффициенты в нем методом электронного баланса, укажите окислитель и восстановитель:
Zn + h3S04(KOHЦ) →.
Zn + h3SO4(конц.) → ZnSO4 + h3S↑ + h3O
уравнения полуреакций:
Zn0 – 2e– → Zn+2| 2 | 8 | 4 | – восстановитель
S+6 + 8e– → S–2 | 8 | 8 | 1 | – окислитель
4Zn0 + S+6 = 4Zn+2 + S–2
4Zn + 5h3SO4(конц.) = 4ZnSO4 + h3S↑ + 4h3O
ЗАДАНИЕ 4
Какой объем водорода выделится при взаимодействии 13 г цинка с избытком раствора серной кислоты? Объемная доля выхода водорода составляет 90% от теоретически возможного.
h3SO4 + Zn = Zn SO4 + h3 ↑
n(Zn) = 13/65 = 0,2 моль
n(h3) = n(Zn) = 0,2 моль (теор.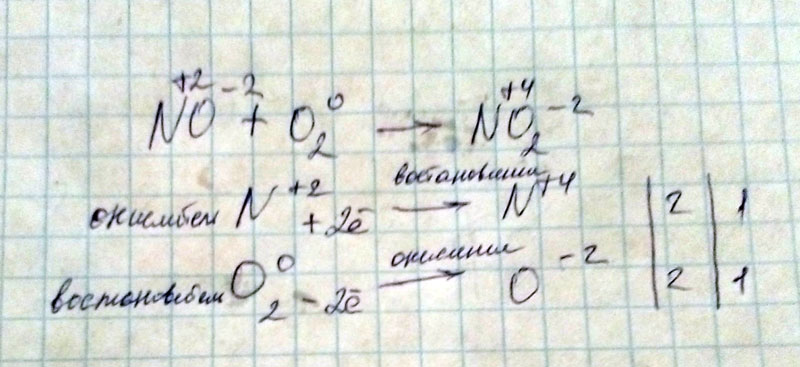 )
)
n(h3)практ. = 0,2*0,9 = 0,18 моль
V(h3) = 0,18*22,4 = 4,032 л
Вариант 4
ЗАДАНИЕ 1
Напишите уравнения реакций для переходов:
Si →…→ Na2Si03 →…→ Si02.
Рассмотрите все реакции в свете ОВР и ТЭД везде, где это имеет место.
Si + O2 = SiO2
S0 -4e = S+4 восстановитель
O2 +4e = 2O-2 окислитель
SiO2 + Na2O = Na2SiO3
SiO2 + Na2O = 2Na+ +SiO32-
Na2SiO3 + 2HCl = h3SiO3 ↓+ 2NaCl
2Н+ + SiO32- = h3SiO3 ↓
h3SiO3 = SiO2 + Н2О
ЗАДАНИЕ 2
Дайте характеристику реакции, уравнение которой
h30(nap) + C0h3 + C02-Q,
по всем изученным признакам классификации.
Рассмотрите данную реакцию в свете ОВР.
Н+12О + С+2О = Н02 + С+4О2 – Q
2Н+1 +2е = Н02 окислитель
С+2 -2е =С+4 восстановитель
Исходные вещества: 1 моль воды (2 атома водорода, 1 атом кислорода) – газ, 1 моль оксида углерода 2 (1 атом углерода, 1 атом кислорода) -газ. Продукты реакции – 1 моль водорода (2 атома водорода в молекуле) – газ, 1 моль оксида углерода 4 (1 атом углерода, 2 атома кислорода) – газ.
Эндотермическая
ОВР
Прямая
Обратимая
Некаталитическая.
ЗАДАНИЕ 3
В схеме ОВР расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель:
Nh4 + CuO→N2 + … + … .
3CuO + 2Nh4 = 3Cu + N2 + 3h3O
Cu+2 + 2е = Cu0 окислитель
2N-3 -6е = N20 восстановитель
ЗАДАНИЕ 4
10 кг оксида магния обработали избытком раствора азотной кислоты. Какая масса соли образовалась, если выход соли составил 80% от теоретически возможного?
2HNO3 + MgO = Mg(NO3)2 + h3O
n(MgO) = 1000/40 = 250 моль
n(Mg(NO3)2) = n(MgO) = 250 моль (теор.)
n(Mg(NO3)2)практ. = 250*0,8 = 200 моль
m (Mg(NO3)2) 200*148 = 29600 г
Вопрос Видео: Сбалансированное уравнение окисления аммиака
Стенограмма видео
Реакция аммиака Nh4 с кислородом дает оксид азота NO и воду в качестве единственных продуктов. Напишите сбалансированное химическое уравнение для этой реакции, используя наименьшие целые числовые коэффициенты для реагентов и продуктов.
Начнем с определения реагентов и продуктов. Проблема начинается «реакцией аммиака с кислородом». Ключевое слово «реакция» указывает на то, что реагентами являются аммиак и кислород. Мы должны написать химическую формулу аммиака и кислорода слева от стрелки реакции. Обратите внимание, что кислород записывается как O в нижнем индексе два. Это связано с тем, что кислород существует в виде двухатомной молекулы в чистом виде. В результате реакции образуются только окись азота и вода. Поэтому мы можем написать NO и h3O на стороне продуктов реакции. Теперь мы можем начать балансировать это химическое уравнение.
Химическое уравнение сбалансировано, если количество атомов каждого элемента одинаково в обеих сторонах реакции. Чтобы сбалансировать это химическое уравнение, мы начнем с определения элементов, участвующих в реакции. В уравнении мы видим элементы азот, водород и кислород. Теперь подсчитаем количество атомов каждого элемента по обе стороны реакции. Мы можем провести пунктирную линию у стрелки, чтобы отделить реагенты от продуктов.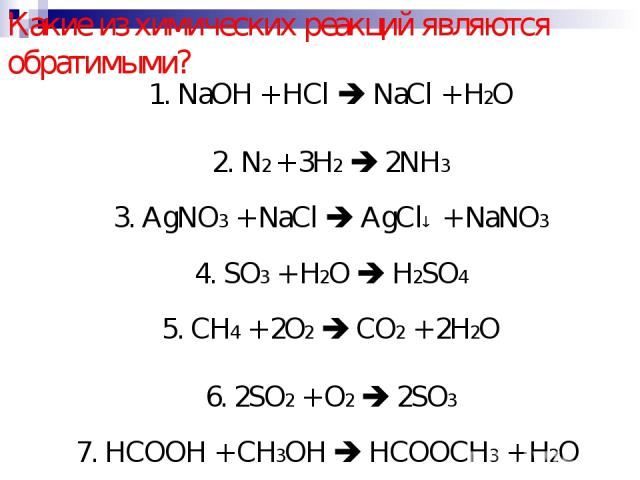
Начнем с подсчета атомов азота. Мы видим один атом азота на стороне реагентов и один атом азота на стороне продуктов. Со стороны реагентов находятся три атома водорода, а со стороны продуктов – два атома водорода. Наконец, давайте посчитаем атомы кислорода. На стороне реагентов находятся два атома кислорода. А со стороны продуктов мы видим один атом кислорода в каждой молекуле оксида азота и один атом кислорода в каждой молекуле воды. Это дает нам в общей сложности два атома кислорода на стороне продуктов.
Глядя на наш список, мы видим, что с обеих сторон реакции присутствует по одному атому азота. Это означает, что атомы азота сбалансированы. Со стороны реагентов имеется три атома водорода, а со стороны продуктов — два атома водорода. Это означает, что атомы водорода неуравновешены. И есть два атома кислорода с обеих сторон реакции, что означает, что атомы кислорода уравновешены.
Теперь мы можем добавить коэффициенты к химическому уравнению, чтобы сбалансировать реакцию. Коэффициенты представляют собой числовые значения, которые можно поставить перед любыми частицами по обе стороны от реакции. У нас есть только один элемент, который находится вне баланса, водород. Есть два варианта того, как мы могли бы сбалансировать атомы водорода. Первый вариант — поместить дробь «три половинки» перед молекулой воды на стороне продуктов. Если в одной молекуле воды два атома водорода, то в трех половинках молекул воды будет всего три атома водорода. Это сбалансирует атомы водорода.
Коэффициенты представляют собой числовые значения, которые можно поставить перед любыми частицами по обе стороны от реакции. У нас есть только один элемент, который находится вне баланса, водород. Есть два варианта того, как мы могли бы сбалансировать атомы водорода. Первый вариант — поместить дробь «три половинки» перед молекулой воды на стороне продуктов. Если в одной молекуле воды два атома водорода, то в трех половинках молекул воды будет всего три атома водорода. Это сбалансирует атомы водорода.
Однако размещение коэффициента перед молекулой влияет на все атомы в молекуле. Это означает, что теперь из молекул воды на стороне продуктов образуется три половины атомов кислорода, и что общее число атомов кислорода на стороне продуктов теперь равно пяти половинам. Хотя мы, возможно, уравновесили атомы водорода, мы разбалансировали атомы кислорода. И нам остается пытаться сбалансировать два атома кислорода на стороне реагента с пятью половинами атомов кислорода на стороне продукта. Это кажется довольно сложным.
Это кажется довольно сложным.
Второй способ сбалансировать атомы водорода — найти наименьшее общее кратное трех и двух. Наименьшее общее кратное трех и двух равно шести. Это говорит нам о том, что мы хотим найти способ получить шесть атомов водорода на стороне реагента и шесть атомов водорода на стороне продукта. Что касается реагента, мы могли бы поставить коэффициент два перед аммиаком. Если в одной молекуле аммиака три атома водорода, то в двух молекулах аммиака будет шесть атомов водорода.
Мы также должны помнить, что размещение коэффициента перед молекулой влияет на все атомы в молекуле. Если одна молекула аммиака имеет один атом азота, то две молекулы аммиака будут иметь два атома азота. Что касается продуктов, мы могли бы поставить перед молекулой воды коэффициент, равный трем. Если в одной молекуле воды два атома водорода, то в трех молекулах воды будет шесть атомов водорода.
Мы также помним, что размещение коэффициента, равного трем, перед молекулой воды также влияет на количество атомов кислорода на стороне продуктов. Теперь три атома кислорода исходят от трех молекул воды и всего четыре атома кислорода со стороны продуктов. Поместив коэффициенты, чтобы получить шесть атомов водорода с обеих сторон реакции, мы уравновесили атомы водорода, но мы также разбалансировали атомы азота и кислорода.
Теперь три атома кислорода исходят от трех молекул воды и всего четыре атома кислорода со стороны продуктов. Поместив коэффициенты, чтобы получить шесть атомов водорода с обеих сторон реакции, мы уравновесили атомы водорода, но мы также разбалансировали атомы азота и кислорода.
Используя метод наименьшего общего кратного вместо дроби пополам, мы разбалансировали большее количество элементов. Тем не менее, мы сохранили все суммы атомов в виде целых чисел, что упрощает их общую балансировку.
Теперь мы можем попытаться сбалансировать атомы азота. Два атома азота находятся на стороне реагента и один атом азота на стороне продукта. Мы можем поставить коэффициент два перед оксидом азота, чтобы получить два атома азота на стороне продукта. Мы также помним, что размещение коэффициента перед молекулой оксида азота также повлияет на количество атомов кислорода на стороне продукта. Это означает, что на стороне продукта теперь всего пять атомов кислорода. С двумя атомами азота по обе стороны реакции баланс атомов азота восстанавливается. Однако атомы кислорода остаются неуравновешенными.
Однако атомы кислорода остаются неуравновешенными.
Теперь нам нужно решить, какой коэффициент поставить перед молекулой кислорода, чтобы с обеих сторон реакции было по пять атомов кислорода. Размещение коэффициента, равного двум половинкам, перед молекулой кислорода, даст нам в общей сложности пять атомов кислорода как со стороны реагента, так и со стороны продукта, таким образом уравновешивая атомы кислорода.
Общая реакция сбалансирована. Однако вопрос просил нас использовать целые числовые коэффициенты. Мы можем избавиться от десятичных дробей и сохранить сбалансированное химическое уравнение, умножив все коэффициенты в уравнении на два. Это дает нам окончательное сбалансированное химическое уравнение реакции 4Nh4 плюс 5O2 с образованием 4NO плюс 6h3O.
ДАНР — WQMAP
Используйте портал доступа к мониторингу качества воды для поиска и просмотра водоемов и связанных с ними станций мониторинга,
а также получить доступ к множеству другой информации, связанной с качеством воды.
- Использование карты
- Интерпретация графиков на панели управления качеством воды
- Интерпретация статуса поддержки
- Доступ и просмотр отчетов об общей максимальной суточной нагрузке (TMDL) и других документов
Использование карты
(вершина)
- Нажмите на озеро или ручей, чтобы просмотреть сводные графики последних данных о качестве воды (Панель управления качеством воды), получить доступ к списку ссылок на отдельные станции мониторинга, где можно просмотреть и загрузить данные (Данные мониторинга), просмотреть отчеты о качестве воды и информацию о проекте ( Projects and Reports), а также см.
 оценки качества воды из последнего Интегрированного отчета Южной Дакоты по оценке качества поверхностных вод (статус поддержки).
оценки качества воды из последнего Интегрированного отчета Южной Дакоты по оценке качества поверхностных вод (статус поддержки). - Точками на карте обозначены станции мониторинга качества воды. Нажмите на станцию, чтобы просмотреть таблицы последних данных с этой станции для выбора параметров качества воды (параметры — это типы данных о качестве воды). Чтобы узнать о параметрах качества воды, нажмите здесь. Таблица не будет отображаться, если нет последних данных. Все данные по всем параметрам независимо от возраста можно загрузить с каждой станции в электронную таблицу Microsoft Excel, нажав кнопку «Загрузить все параметры (Excel)».
- Ищите станции, ручьи, озера и другие объекты с помощью окна поиска и раскрывающегося меню в верхнем левом углу карты.

- Откройте меню легенды, щелкнув крайний левый значок в правом верхнем углу карты. В легенде отображаются символы для типов станций сбора проб (Гражданский мониторинг, Химия и Загрязнение рыбьим мясом). Он также отображает символы озер и ручьев, которые поддерживают все полезные виды использования и, следовательно, соответствуют стандартам качества воды, выделенные синим цветом. Все озера и ручьи, которые не используются во всех полезных целях и, следовательно, не соответствуют стандартам качества воды, показаны красным цветом. Регионы озер отображаются цветами, которые представляют каждый регион.
- Откройте меню слоев, щелкнув средний значок в правом верхнем углу карты.
 Меню слоя позволяет пользователю включать или выключать различные источники информации, отображаемые на карте. В этом меню можно включать и выключать станции, ручьи, озера, дороги и районы озер. Озерные регионы были созданы путем группирования озер в регионы на основе сходства между озерами, что позволило пользователю сравнить данные интересующего их озера с другими аналогичными озерами в том же регионе, представляя статистические значения, включая озеро и региональное среднее (среднее), медиану. , максимальное (макс.) и минимальное (мин.) значение на панели управления качеством воды.
Меню слоя позволяет пользователю включать или выключать различные источники информации, отображаемые на карте. В этом меню можно включать и выключать станции, ручьи, озера, дороги и районы озер. Озерные регионы были созданы путем группирования озер в регионы на основе сходства между озерами, что позволило пользователю сравнить данные интересующего их озера с другими аналогичными озерами в том же регионе, представляя статистические значения, включая озеро и региональное среднее (среднее), медиану. , максимальное (макс.) и минимальное (мин.) значение на панели управления качеством воды.
Интерпретация графиков на панели управления качеством воды
(вершина)
На графиках панели управления качеством воды представлены выборочные данные для каждой единицы оценки. Единицы оценки — это озера или участки рек и ручьев, которые используются для классификации вод штата с целью оценки качества их воды.
Графики включают линии, отображающие стандарты качества воды, где это применимо, и, только для озер, региональные скользящие средние значения для выбранных параметров.
Эти линии можно включать и выключать, установив флажок, связанный с линией стандартной или региональной скользящей средней.
Для параметров качества воды может существовать более одной стандартной строки, если имеется более одного порогового значения.
Стандарты E. coli включают пороговое значение для отдельных образцов и отдельное пороговое значение для среднего геометрического минимума пяти образцов, собранных в
30-дневный период. Стандарты общего содержания взвешенных веществ в большинстве случаев также имеют два пороговых значения — одно для отдельных проб и другое отдельное пороговое значение для
среднее значение 5 проб, собранных в течение 30-дневного периода.
Единицы оценки — это озера или участки рек и ручьев, которые используются для классификации вод штата с целью оценки качества их воды.
Графики включают линии, отображающие стандарты качества воды, где это применимо, и, только для озер, региональные скользящие средние значения для выбранных параметров.
Эти линии можно включать и выключать, установив флажок, связанный с линией стандартной или региональной скользящей средней.
Для параметров качества воды может существовать более одной стандартной строки, если имеется более одного порогового значения.
Стандарты E. coli включают пороговое значение для отдельных образцов и отдельное пороговое значение для среднего геометрического минимума пяти образцов, собранных в
30-дневный период. Стандарты общего содержания взвешенных веществ в большинстве случаев также имеют два пороговых значения — одно для отдельных проб и другое отдельное пороговое значение для
среднее значение 5 проб, собранных в течение 30-дневного периода.
Интерпретация состояния поддержки
(вершина)
Статус поддержки полезного использования для каждого водного объекта представлен на вкладке «Статус поддержки».
Все воды в Южной Дакоте обозначены как полезные виды использования, т.е. виды использования водного объекта, которые считаются соответствующими характеристикам водного объекта.
Примерами полезного использования являются Бытовое водоснабжение (питьевая вода), Орошение, Рекреационные воды с ограниченным контактом (например, катание на лодках, рыбалка, каякинг),
Иммерсионные рекреационные воды (плавание, катание на водных лыжах) и различные полезные виды использования, предназначенные для защиты рыболовства (например, размножение маргинальных рыб в теплых водах,
Постоянное размножение рыб в холодной воде). Каждое полезное использование также устанавливает стандарты качества воды для параметров, которые важны для защиты полезного использования.
Например, полезное использование Immersion Recreation устанавливает стандарт для кишечной палочки для защиты людей, отдыхающих в воде, от заражения бактериями,
и полезное использование для рыболовства устанавливает стандарты растворенного кислорода для защиты рыбы от низкого уровня кислорода, который может привести к гибели рыбы.
Если все стандарты качества воды, связанные с полезными видами использования водного объекта, соблюдаются, считается, что это полностью поддерживает его
полезное использование. Если один или несколько стандартов полезного использования не соблюдаются, этот водный объект не полностью поддерживает свое полезное использование.
Статус поддержки целевого использования оценивается каждые 2 года и доводится до сведения общественности в
Интегрированный отчет Южной Дакоты по оценке качества поверхностных вод.
Каждое полезное использование также устанавливает стандарты качества воды для параметров, которые важны для защиты полезного использования.
Например, полезное использование Immersion Recreation устанавливает стандарт для кишечной палочки для защиты людей, отдыхающих в воде, от заражения бактериями,
и полезное использование для рыболовства устанавливает стандарты растворенного кислорода для защиты рыбы от низкого уровня кислорода, который может привести к гибели рыбы.
Если все стандарты качества воды, связанные с полезными видами использования водного объекта, соблюдаются, считается, что это полностью поддерживает его
полезное использование. Если один или несколько стандартов полезного использования не соблюдаются, этот водный объект не полностью поддерживает свое полезное использование.
Статус поддержки целевого использования оценивается каждые 2 года и доводится до сведения общественности в
Интегрированный отчет Южной Дакоты по оценке качества поверхностных вод.
Доступ и просмотр отчетов об общей максимальной суточной нагрузке (TMDL) и других документов
(вершина)
Воды, которые не полностью поддерживают свое полезное использование, требуют отчета об общей максимальной дневной нагрузке (TMDL) в соответствии с федеральным Законом о чистой воде.
Эти отчеты детализируют источники загрязнения для интересующего параметра и разрабатывают рекомендации относительно того, какое количество загрязняющего вещества может находиться в водоеме.
при этом отвечая стандартам качества воды и поддерживая ее полезное использование. Отчеты TMDL представлены в виде ссылок на вкладке «Проекты и отчеты».
Также доступны другие документы по качеству воды, такие как отчеты по проектам оценки водоразделов, отчеты по проектам улучшения водосборов,
и водосборные стратегические планы.

 оценки качества воды из последнего Интегрированного отчета Южной Дакоты по оценке качества поверхностных вод (статус поддержки).
оценки качества воды из последнего Интегрированного отчета Южной Дакоты по оценке качества поверхностных вод (статус поддержки). 
 Меню слоя позволяет пользователю включать или выключать различные источники информации, отображаемые на карте. В этом меню можно включать и выключать станции, ручьи, озера, дороги и районы озер. Озерные регионы были созданы путем группирования озер в регионы на основе сходства между озерами, что позволило пользователю сравнить данные интересующего их озера с другими аналогичными озерами в том же регионе, представляя статистические значения, включая озеро и региональное среднее (среднее), медиану. , максимальное (макс.) и минимальное (мин.) значение на панели управления качеством воды.
Меню слоя позволяет пользователю включать или выключать различные источники информации, отображаемые на карте. В этом меню можно включать и выключать станции, ручьи, озера, дороги и районы озер. Озерные регионы были созданы путем группирования озер в регионы на основе сходства между озерами, что позволило пользователю сравнить данные интересующего их озера с другими аналогичными озерами в том же регионе, представляя статистические значения, включая озеро и региональное среднее (среднее), медиану. , максимальное (макс.) и минимальное (мин.) значение на панели управления качеством воды.