Упражнение в расстановке коэффициентов в окислительно-восстановительных реакциях методом электронного баланса
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Презентация «Упражнение в
расстановке коэффициентов в
окислительно-восстановительных
реакциях методом электронного
баланса»
Казанцева Евгения Андреевна
учитель химии
МОУ школа №12
г. Жуковский
Алгоритм расстановки коэффициентов в
ОВР методом электронного баланса
Запишите схему реакции:
C + HNO3 → CO2 + NO + h3O
1).Определите степень окисления каждого химического элемента
C⁰ + H⁺N⁺⁵O⁻²3 → C⁺⁴O⁻²2 + N⁺²O⁻² + H⁺2O⁻²
2).
подчеркните их
C⁰ + H⁺N⁺⁵O⁻²3 → C⁺⁴O⁻²2 + N⁺²O⁻² + H⁺2O⁻²
3).Напишите схемы процессов окисления и восстановления
C⁰−4e → C⁺⁴ (ок-ние, в-ль)
N⁺⁵+3e→N⁺² (в-ние, ок-ль)
4).Найдите коэффициенты
3
C⁰−4e → C⁺⁴ (ок-ние, в-ль)
4
N⁺⁵+3e→N⁺² (в-ние, ок-ль)
5). Проставьте найденные коэффициенты в схему реакции
3C⁰ + 4H⁺N⁺⁵O⁻²3 →3 C⁺⁴O⁻²2 + 4N⁺²O⁻² + 2H⁺2O⁻²
6).Убедитесь в правильности проставленных коэффициентов, сделав
проверку по кислороду
12 атомов «О»=12 атомов «О»
Расставьте коэффициенты
методом электронного баланса
1). Nh4 + O2 → NO + h3O
Проверь
N⁻³H⁺3 + O⁰2 →N⁺²O⁻ ²+ H⁺2O⁻²
4 N⁻³−5e→N⁺² (ок-ние, в-ль)
5 O⁰2 +4e→2O⁻² (в-ние, ок-ль)
4 N⁻³H⁺3 + 5O⁰2 →4N⁺²O⁻ ²+ 6H⁺2O⁻²
в-ль
ок-ль
Расставьте коэффициенты
методом электронного баланса
2). Nh4 + O2 →
N2 + h3O
Проверь
N⁻³H⁺3 + O⁰2→N⁰2 + H⁺2O⁻²
2
2N⁻³−6e→ N⁰2 (ок-ние, в-ль)
3 O⁰2 +4e→2O⁻² (в-ние, ок-ль)
4N⁻³H⁺3 + 3 O⁰2→2N⁰2 + 6H⁺2O⁻²
в-ль
ок-ль
Расставьте коэффициенты
методом электронного баланса
3).
 C + h3SO4
C + h3SO4→ CO2 + SO2 + h3O
Проверь
C⁰ + H⁺2S⁺⁶O⁻²4 → C⁺⁴O⁻²2 + S⁺⁴O⁻²2 + H⁺2O⁻²
1 C⁰−4e → C⁺⁴ (ок-ние, в-ль)
2
S⁺⁶+2e→ S⁺⁴ (в-ние, ок-ль)
C⁰ +2 H⁺2S⁺⁶O⁻²4 → C⁺⁴O⁻²2 + 2S⁺⁴O⁻²2 + 2H⁺2O⁻²
в-ль ок-ль
Расставьте коэффициенты
методом электронного баланса
4). Al + V2O5 → Al2O3 + V
Проверь
Al ⁰+ V⁺⁵2O⁻²5 → Al⁺³2O⁻²3 + V⁰
5 Al ⁰−3e → Al⁺³ (ок-ние, в-ль)
3 V⁺⁵+5e→ V⁰ (в-ние, ок-ль)
10Al ⁰+3V⁺⁵2O⁻²5 → 5Al⁺³2O⁻²3 + 6V⁰
в-ль ок-ль
Расставьте коэффициенты
методом электронного баланса
5). Nh4 + SO2 → N2 + S + h3O
• Проверь
N⁻³H⁺3 + S⁺⁴O⁻²2 → N⁰2 + S⁰ + H⁺2O⁻²
2 2N⁻³−6e→ N⁰2 (ок-ние, в-ль)
3
S⁺⁴+ 4e → S⁰ (в-ние, ок-ль)
в-ль
ок-ль
Расставьте коэффициенты
методом электронного баланса
6). MnS + HNO3 → MnSO4 + NO2 + h3O
Проверь
Mn⁺²S⁻² + H⁺N⁺⁵O⁻²3 → Mn⁺²S⁺⁶O⁻²4 + N⁺⁴O⁻²2 + H⁺2O⁻²
1
S⁻² −8e→ S⁺⁶ (ок-ние, в-ль)
8
N⁺⁵ +1e → N⁺⁴ (в-ние, ок-ль)
Mn⁺²S⁻² + 8H⁺N⁺⁵O⁻²3 → Mn⁺²S⁺⁶O⁻²4 + 8N⁺⁴O⁻²2 + 4H⁺2O⁻²
в-ль
ок-ль
Расставьте коэффициенты
методом электронного баланса
7).
 ZnS + O2 → ZnO + SO2
ZnS + O2 → ZnO + SO2Проверь
Zn⁺²S⁻² + O⁰2 → Zn⁺²O⁻² + S⁺⁴O⁻²2
2 S⁻²− 6e→ S⁺⁴ (ок-ние, в-ль)
3 O⁰2 + 4e →2 O⁻² (в-ние, ок-ль)
2 Zn⁺²S⁻² + 3O⁰2 → 2Zn⁺²O⁻² + 2S⁺⁴O⁻²2
в-ль
ок-ль
Расставьте коэффициенты
методом электронного баланса
8). KI + Cu(NO3)2 → CuI + I2 + KNO3
Проверь
K⁺I⁻ + Cu⁺²(N⁺⁵O⁻²3)2 → Cu⁺I⁻ + I⁰2 + K⁺N⁺⁵O⁻²3
1
2I⁻−2e→ I⁰2
(ок-ние, в-ль)
2
Cu⁺²+ 1e→ Cu⁺ (в-ние, ок-ль)
4K⁺I⁻ + 2Cu⁺²(N⁺⁵O⁻²3)2 → 2Cu⁺I⁻ + I⁰2 + 4K⁺N⁺⁵O⁻²3
в-ль
ок-ль
Расставьте коэффициенты
методом электронного баланса
9). FeCl3 + h3S→ FeCl2 + S + HCl
Проверь
Fe⁺³Cl⁻3 + H⁺2S⁻²→Fe⁺²Cl⁻2 + S⁰+ H⁺Cl⁻
2
Fe⁺³+1e→Fe⁺² (в-ние, ок-ль)
1
S⁻²−2e→ S⁰ (ок-ние, в-ль)
2Fe⁺³Cl⁻3 + H⁺2S⁻²→2Fe⁺²Cl⁻2 + S⁰+ 2H⁺Cl⁻
ок-ль
в-ль
Расставьте коэффициенты
методом электронного баланса
10). Nh4 + CuO→ N2 + Cu + h3O
Проверь
N⁻³H⁺3 + Cu⁺²O⁻²→ N⁰2 + Cu⁰ + H⁺2O⁻²
1
2N⁻³−6e→ N⁰2 (ок-ние, в-ль)
3
Cu⁺²+2e→ Cu⁰ (в-ние, ок-ль)
2N⁻³H⁺3 + 3Cu⁺²O⁻²→ N⁰2 + 3Cu⁰ + 3H⁺2O⁻²
в-ль
ок-ль
Расставьте коэффициенты
методом электронного баланса
11).
 Ca3(PO4)2 + C + SiO2 → CaSiO3 + CO + P
Ca3(PO4)2 + C + SiO2 → CaSiO3 + CO + PПроверь
Ca⁺²3(P⁺⁵O⁻²4)2 + C⁰ + Si⁺⁴O⁻²2 → Ca⁺²Si⁺⁴O⁻²3 + C⁺²O⁻² + P⁰
2
P⁺⁵+5e→ P⁰ (в-ние, ок-ль)
5
Ca⁺²3(P⁺⁵O⁻²4)2 +5C⁰ + 3Si⁺⁴O⁻²2→3Ca⁺²Si⁺⁴O⁻²3 +5C⁺²O⁻² + 2P⁰
о-ль
в-ль
Расставьте коэффициенты
методом электронного баланса
12). HCl + HNO3 → Cl2 + NO + h3O
Проверь
H⁺Cl⁻ + H⁺N⁺⁵O⁻²3 → Cl⁰2 + N⁺²O⁻² + H⁺2O⁻²
3
2Cl⁻ −2e→ Cl⁰2 (ок-ние, в-ль)
2 N⁺⁵+3e→N⁺² (в-ние, ок-ль)
6H⁺Cl⁻ + 2H⁺N⁺⁵O⁻²3 → 3Cl⁰2 + 2N⁺²O⁻² + 4H⁺2O⁻²
в-ль
ок-ль
Расставьте коэффициенты
методом электронного баланса
13). CrO3 + h3S + h3SO4 →Cr2(SO4)3 + S + h3O
Проверь
Cr⁺⁶O⁻²3 + H⁺2S⁻² + H⁺2S⁺⁶O⁻²4 →Cr⁺³2(S⁺⁶O⁻²4)3 + S⁰ + H⁺2O⁻²
2 Cr⁺⁶+3e→Cr⁺³ ( в-ние, ок-ль)
3
S⁻²−2e→ S⁰ ( ок-ние, в-ль)
2Cr⁺⁶O⁻²3 + 3H⁺2S⁻² + 3H⁺2S⁺⁶O⁻²4 →Cr⁺³2(S⁺⁶O⁻²4)3 + 3S⁰ + 6H⁺2O⁻²
ок-ль
в-ль
Расставьте коэффициенты
методом электронного баланса
14). CrCl2 + HCl + O2 → CrCl3 + h3O
Проверь
Cr⁺²Cl⁻2 + H⁺Cl⁻ + O⁰2 → Cr⁺³Cl⁻3 + H⁺2O⁻²
4
Cr⁺²−1e→Cr⁺³ (ок-ние, в-ль)
1
O⁰2 +4e→2 O⁻² (в-ние, ок-ль)
4Cr⁺²Cl⁻2 + 4H⁺Cl⁻ + O⁰2 → 4Cr⁺³Cl⁻3 + 2H⁺2O⁻²
в-ль
ок-ль
Расставьте коэффициенты
методом электронного баланса
15).
 P + HNO3 + h3O→ h4PO4 + NO
P + HNO3 + h3O→ h4PO4 + NOПроверь
P⁰ + H⁺N⁺⁵O⁻²3 + H⁺2O⁻²→ H⁺3P⁺⁵O4⁻²+ N⁺²O⁻²
3
P⁰−5e→ P⁺⁵ ( ок-ние, в-ль)
5
N⁺⁵+3e→N⁺² ( в-ние, ок-ль)
3P⁰+5H⁺N⁺⁵O⁻²3 +2H⁺2O⁻²→3H⁺3P⁺⁵O4⁻²+ 5N⁺²O⁻²
в-ль ок-ль
Расставьте коэффициенты
методом электронного баланса
16). KMnO4 + HCl → Cl2 + MnO2 + KOH + h3O
Проверь
K⁺Mn⁺⁷O⁻²4 + H⁺Cl⁻ →Cl⁰2 + Mn⁺² Cl ⁻2 + K⁺ Cl⁻+H⁺2O⁻²
2
Mn⁺⁷+5e → Mn⁺² (в-ние, ок-ль)
5
2Cl⁻ −2e→ Cl⁰2 (ок-ние, в-ль)
2K⁺Mn⁺⁷O⁻²4 +16 H⁺Cl⁻→5Cl⁰2 +2 Mn⁺² Cl ⁻2+ 2K⁺ Cl⁻+8H⁺2O⁻²
ок-ль
в-ль
Расставьте коэффициенты
методом электронного баланса
17). KMnO4 + Nh4 → KNO3 + MnO2 + KOH + h3O
Проверь
K⁺Mn⁺⁷O⁻²4 + N⁻³H⁺3 →K⁺N⁺⁵O⁻²3 + Mn⁺⁴O⁻²2 + K⁺O⁻²H⁺ + H⁺2O⁻²
Mn⁺⁷+3e→ Mn⁺⁴ (в-ние, ок-ль)
3
N⁻³−8e→ N⁺⁵ (ок-ние, в-ль)
8K⁺Mn⁺⁷O⁻²4 + 3N⁻³H⁺3 →3K⁺N⁺⁵O⁻²3 + 8Mn⁺⁴O⁻²2 + 5K⁺O⁻²H⁺
ок-ль
в-ль
+2 H⁺2O⁻
Расставьте коэффициенты
методом электронного баланса
18). Zn + HNO3 → Zn(NO3)2 + Nh5NO3 + h3O
Проверь
Zn⁰+ H⁺N⁺⁵O⁻²3→Zn⁺²(N⁺⁵O⁻²3)2+N⁻³H⁺4N⁺⁵O⁻²3 + H⁺2O⁻²
4
Zn⁰−2e →Zn⁺² (ок-ние,в-ль)
1
N⁺⁵+8e→N⁻³ (в-ние,ок-ль)
4Zn⁰+ 10 H⁺N⁺⁵O⁻²3→4Zn⁺²(N⁺⁵O⁻²3)2+ N⁻³H⁺4N⁺⁵O⁻²3 + 3H⁺2O⁻²
в-ль ок-ль
English Русский Правила
Ответы на контрольную работу по теме «Подгруппа кислорода» (Габриелян) решебник
Вариант 1.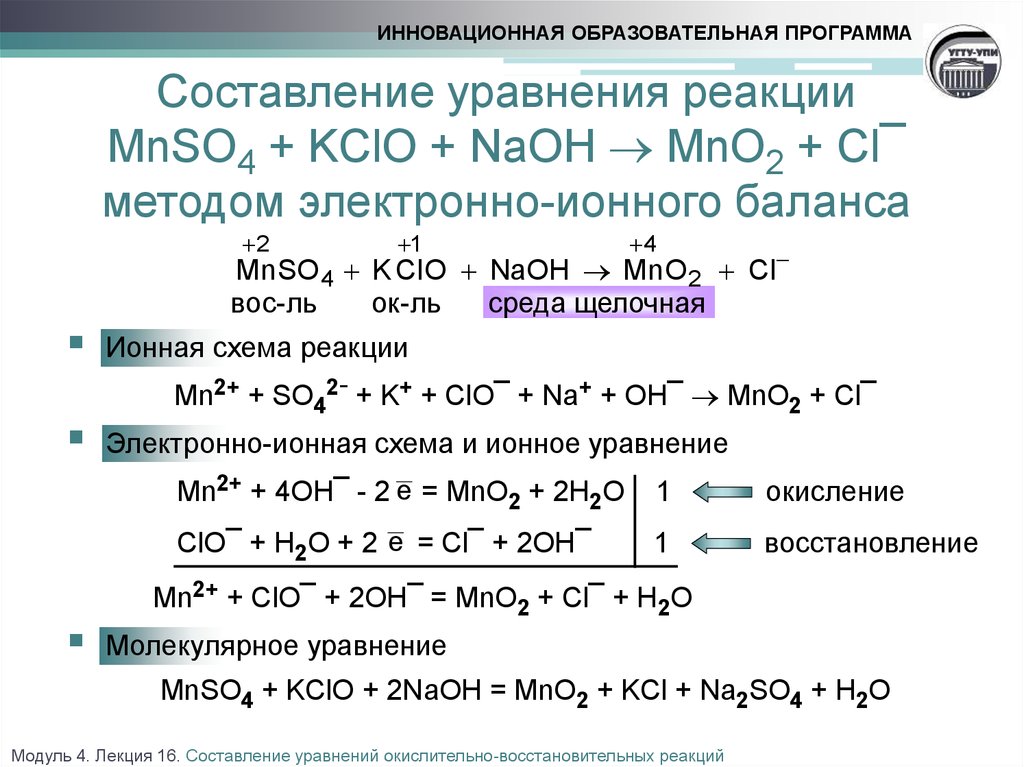
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме кислорода:
А. 2е, 6е.
2. Формула вещества с ковалентной полярной связью:
В. Н2О.
3. Ряд формул веществ, в котором степень окисления серы уменьшается:
В. SО2—S—h3S.
4. Неметаллические свойства в ряду химических элементов О—S—Se—As:
В. Ослабевают.
5. Сумма всех коэффициентов в уравнении реакции, схема которой
h3S + О2 > SО2 + Н2О:
В. 9.
6. Уравнение реакции, в котором элемент сера является восстановителем:
Б. S+O2=SO2
7. Свойство, характерное для серы:
В. Твердое вещество желтого цвета.
8. Массовая доля кислорода наименьшая в соединении с формулой:
А. К2О.
9. Оксид серы (VI) реагирует с веществом, формула которого:
Б. NaOH.
10. Сокращенное ионное уравнение реакции, соответствующее молекулярному
h3S04 + Zn = ZnS04 + Н2↑:
В. 2Н+ + Zn = Zn2+ + Н2↑.
2Н+ + Zn = Zn2+ + Н2↑.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте молекулярные и ионные уравнения реакций для следующей схемы превращений:
S02 -> h3S03 -> Na2SO3 -> MgS03.
1. SO2 + h3O = h3SO3
SO2 + h3O = 2H+ +SO32-
2. h3SO3 + 2NaOH = Na2SO3 + 2h3O
2H+ +2OH- = 2h3O
3. Na2SO3 + MgCl2 = MgSO3↓ + 2NaCl
Mg2+ + SO32- = MgSO3↓
12. Составьте уравнение реакции, схема которой
Сu + h3S04(KOHЦ) —>… + S02↑ + Н20.
Рассмотрите его с точки зрения ОВР.
2h3S+6O4 конц. + Cu0 = S+4O2↑ + Cu+2S+6O4 + 2h3O
Cu0 – 2e →Cu2+ восстановитель
S+6 + 2e →Cu+4 окислитель
13. Дополните фразу: «Газометр служит для…»
для определения количества произведенного или потребленного газа.
14. С помощью какого катиона можно распознать сульфат-ион? Составьте возможное уравнение реакции в молекулярном и ионном виде.
катиона Бария
K2SO4+BаCl2=BаSO4↓+2KCl
Bа2+ + SO42-=BаSO4↓
15. По термохимическому уравнению реакции
По термохимическому уравнению реакции
2Н2(г) + 02(г) = 2Н20(ж) + 572 кДж
рассчитайте объем водорода, необходимого для получения 1144 кДж.
2 моль – 572 кДж, х моль – 1144 кДж.
Х = 4 моль
V = n*Vm
V = 4*22,4 = 89,6 (литра)
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме серы:
В. 2е, 8е, 6е.
2. Формула вещества с ионным типом связи:
В. Na20.
3. Ряд формул веществ, в котором степень окисления кислорода уменьшается:
A. OF2—02—CUO.
4. Неметаллические свойства в ряду химических элементов О—S—Se—Те:
В. Ослабевают.
5. Сумма всех коэффициентов в уравнении реакции, схема которой
СН4 + 02 –> С02 + Н20:
В. 6.
6. Уравнение реакции, в которой элемент кислород является окислителем:
Б. 2Си + 02 = 2СиО.
7. Свойство, характерное для озона:
Б. Бактерициден.
8. Массовая доля серы наименьшая в соединении с формулой:
А. BaS.
9. Разбавленная серная кислота реагирует с веществом, формула которого:
А. Zn.
10. Сокращенное ионное уравнение реакции, соответствующее молекулярному
Na2C03 + h3S04 = Na2S04 + C02↑ + h30:
А. СО3 -2 + 2H+ > C02↑ + h30.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте молекулярные и ионные уравнения реакций для следующей схемы превращений:
S03 -> h3S04 -> Na2S04 -> BaS04.
1. SO3 + h3O = h3SO4
SO3 + h3O = 2H+ +SO42-
2. h3SO4 + 2NaOH = Na2SO4 + 2h3O
2H+ +2OH- = 2h3O
3. Na2SO4 + ВаCl2 = ВаSO4↓ + 2NaCl
Ва2+ + SO42- = ВаSO4↓
12. Составьте уравнение реакции, схема которой
Zn + h3S04(KOHЦ) —>..,+ S + Н20.
Рассмотрите его с точки зрения ОВР.
3Zn0 + 4h3S+6O4 = 3Zn+2S+6O4 + S0 + 4h3O
Zn0 -2е→Zn+2 восстановитель
S+6 +6е→S0 окислитель
13. Дополните фразу: «Оксид — это …»
бинарное соединение атома любого элемента с кислородом.
14. С помощью какого катиона можно распознать сульфит-ион? Составьте уравнение реакции в молекулярном и ионном виде.
катиона Бария
K2SO3+BаCl2=BаSO3↓+2KCl
Bа2+ + SO32-=BаSO3↓
Выпадает осадок сульфит бария
15. Перечислите соединения серы, имеющие наибольшее значение в промышленности. С какой целью они применяются?
руды: для получения металлов. ZnS, Al2S3, CuSи др.
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в ионе кислорода О2-:
Б. 2е, 8е.
2. Формула вещества с ковалентной неполярной связью:
В. 02.
3. Ряд формул веществ, в котором степень окисления серы увеличивается:
A. h3S—S02—S03.
4. Неметаллические свойства в ряду химических элементов О—S—Se—Те:
В. Ослабевают.
5. Сумма всех коэффициентов в уравнении реакции, схема которой
ZnS + 02 –> ZnO + S02:
В. 9.
6. Уравнение реакции, в которой элемент сера является окислителем:
В. Fe + S = FeS.
7. Свойство, не характерное для серы:
А. Растворима в воде.
8. Массовая доля кислорода наибольшая в соединении с формулой:
В. ВеО.
9. Оксид серы (IV) реагирует с веществом, формула которого:
Б. NaOH.
10. Сокращенное ионное уравнение реакции, соответствующее молекулярному
h3S04 + 2NaOH = Na2S04 + 2Н20:
Г. H+ + OH- = h30.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте молекулярные и ионные уравнения реакций для следующей схемы превращений:
S03 -> h3S04 -> NaHS04.
BaS04 /
1. SO3 + h3O = h3SO4
SO3 + h3O = 2H+ +SO42-
2. h3SO4 + NaOH = NaНSO4 + h3O
H+ +2OH- = h3O
3.Н2SO4 + ВаCl2 = ВаSO4↓ + 2НCl
Ва2+ + SO42- = ВаSO4↓
12. Составьте уравнение реакции, схема которой
Нg + h3S04(KOHЦ) —>HgS04 + so2 + … .
Рассмотрите реакцию с точки зрения ОВР.
Hg + 2h3SO4(конц.) = HgSO4 + SO2 + h3O
S(6+) +2e = S(4+) восстановитель
Hg(0) -2e = Hg(2+) окислитель
13. Дополните фразу: «Горение — это реакция, протекающая с выделением … и …».
теплоты и света
14. С помощью какого катиона можно распознать сульфид-ион? Составьте уравнение реакции в молекулярном и ионном виде.
Цинка.
ZnCl2 + Na2S = ZnS↓ + 2NaCl
Zn2+ +S2- = ZnS↓
15. Опишите, что такое кислотные дожди. Какой вред они наносят окружающей среде? Какие соединения способствуют образованию кислотных дождей?
Основная причина выпадения кислотных дождей — наличие в атмосфере за счет промышленных выбросов оксидов серы и азота, хлористого водорода и других кислотообразующих соединений. В результате дождь и снег оказываются подкисленными. Последствия – разрушение почвы, водной и наземной флоры, фауны.
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в ионе серы S2-:
Г. 2е, 8е, 8е.
2е, 8е, 8е.
2. Формула вещества с ионным типом связи:
Б. Na20.
3. Ряд формул веществ, в котором степень окисления кислорода увеличивается:
В. CaO—Н202—OF2.
4. Неметаллические свойства в ряду химических элементов Те—Se—S—О:
Г. Усиливаются.
5. Сумма всех коэффициентов в уравнении реакции, схема которого:
MgS + 02 > MgO + S02:
В. 9.
6. Уравнение реакции, в которой элемент кислород является восстановителем:
В. 2KN03 = 2KN02 + 02.
7. Свойство, не характерное для озона:
Б. Газ легче воздуха.
8. Массовая доля серы наибольшая в соединении с формулой:
А. h3S.
9. Концентрированная серная кислота не взаимодействует с веществом, формула которого:
В. Fe.
10. Сокращенное ионное уравнение реакции, соответствующее молекулярному
2КОН + S03 = K2S04 + Н20:
А. 20Н- + S03 = SO4 2- + Н20.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте молекулярные и ионные уравнения реакций для схемы превращений:
Составьте молекулярные и ионные уравнения реакций для схемы превращений:
h3S04(конц) -> S02 -> Na2S03 -> BaS03.
1. Hg + 2h3SO4(конц.) = HgSO4 + SO2↑ + 2h3O
2H+ + 2НSO4-(конц.) = SO42- + SO2↑ + 2h3O
2. SO2 + Na2O = Na2SO3
SO2 + Na2O = 2Na++SO32-
3. Na2SO3 + ВаCl2 = ВаSO3↓ + 2NaCl
Ва2+ + SO32- = ВаSO3↓
12. Составьте уравнение реакции, схема которой
Са + h3S04(конц) = CaS04 + h3S + … .
Рассмотрите реакцию с точки зрения ОВР.
4Са0 + 5h3S+6O4(конц.) = 4Ca2+SO4 + 4h3S-2 + h3O
Са0 – 2е = Са2+ восстановитель
S+6 + 4e = S-2 окислитель
13. Дополните фразу: «Самым распространенным элементом в земной коре является …»
кислород
14. С помощью какого катиона можно распознать сульфит-ион? Составьте уравнение реакции в молекулярном и ионном виде.
катиона Бария
K2SO3+BаCl2=BаSO3↓+2KCl
Bа2+ + SO32-=BаSO3↓
15. Перечислите токсичные газообразные соединения серы. Чем они опасны для человека? В результате каких природных явлений или какой деятельности человека они могут образоваться?
Газообразные соединения серы выбрасывают в атмосферу предприятия химической, теплоэнергетической, металлургической, нефтегазодобывающей, целлюлозно-бумажной промышленности. Это сероводород, сернистый ангридрид, сернистый газ. Они загрязняют атмосферу, гидросферу, почву; вызывают кислотные дожди, парниковый эффект, смог и др. экологические проблемы. Это приводит к гибели флоры и фауны.
Это сероводород, сернистый ангридрид, сернистый газ. Они загрязняют атмосферу, гидросферу, почву; вызывают кислотные дожди, парниковый эффект, смог и др. экологические проблемы. Это приводит к гибели флоры и фауны.
Цинк — Добыча | Двенадцатый класс Химия
Цинк• Атомный номер → 30• Температура плавления → 420 o C• Температура кипения → 908 o C
Вхождение не происходит в свободном состоянии9
9
9 В комбинированной форме он существует в виде сульфидов, оксидов, карбонатов и т. д. Некоторые руды цинка: → цинковая обманка: Zns → каламит: ZnCO 3 → цинкит или красный оксид цинка: ZnO → Франк Линит: ZnO.Fe 2 O 3 → Виллемит: Zn 2 SiO 4 / 2ZnO.SiO 2
Извлечение цинка Цинк является основной рудой цинка. Оксид цинка, полученный после концентрирования и обжига цинковой обманки, нагревают с коксом с получением паров цинка, из которых при конденсации получается расплавленный цинк, который в дальнейшем при очистке фракционной перегонкой и электролитическим рафинированием дает чистый цинк.ZnS + O2 ——— ———->ZnO + SO2 ↑ZnO + C ——> Zn + CO ↑
Оксид цинка, полученный после концентрирования и обжига цинковой обманки, нагревают с коксом с получением паров цинка, из которых при конденсации получается расплавленный цинк, который в дальнейшем при очистке фракционной перегонкой и электролитическим рафинированием дает чистый цинк.ZnS + O2 ——— ———->ZnO + SO2 ↑ZnO + C ——> Zn + CO ↑
Шаги в металлургия
1. Дробление и измельчение → Руда сначала дробится щековой дробилкой на мелкие кусочки, а затем измельчается или измельчается в шаровых мельницах. Этот процесс дробления и измельчения удаляет каменистый материал из руды.
2. Обогащение → Сульфидная руда обогащается методом пенной флотации. В этом процессе порошкообразную руду бросают в воду, содержащую немного соснового масла, в большом барабане и перемешивают с помощью струи воздуха. Частицы руды выходят на поверхность по ходу и оставляя за собой пену и примеси на дне резервуара.
3. Обжиг Концентрированная сульфидная руда затем подвергается обжигу при температуре около 900 o C в присутствии избытка воздуха. Если используется карбонатная руда, то вместо обжига применяется процесс кальцинирования.Во время этого процесса часть сульфида цинка также превращается в сульфат.Чтобы избежать этого, обжиг производится при температуре выше 900 o C. При этой температуре сульфат снова разлагается до оксида. 2ZnSO 4 —> ZnO + 2SO 2 +O2 ↑ В этом процессе обжига также удаляются летучие примеси в виде их оксидов.
4. Восстановление Оксид цинка, полученный обжигом, нагревают с углеродом в печи, чтобы восстановить оксид до металлической формы.
•
Процесс в вертикальной реторте Порошкообразный оксид из руды (ZnO), полученный в процессе обжига, смешивают с коксом (C) в соотношении 2:1 для получения небольших брикетов, которые подают в реторту. печь через загрузочную дверцу. Это кормление является непрерывным процессом. Реторта нагревается снаружи за счет сжигания генераторного газа (CO + N 2 ) при температуре около 1400-1500
печь через загрузочную дверцу. Это кормление является непрерывным процессом. Реторта нагревается снаружи за счет сжигания генераторного газа (CO + N 2 ) при температуре около 1400-1500
Пары цинка и газообразный оксид углерода, образующиеся в этом процессе, переносят в конденсатор бурным потоком генераторного газа, проходящего через дно печи. Пары цинка конденсируют, и полученный таким образом цинк представляет собой цинковый нагар чистотой 97%.
5. Очистка а.
Фракционная перегонка → Цинковая дробь подвергается перегонке при 1000 o C. Эта температура выше температуры кипения цинка и кадмия. Так, Zn и Cd испаряются, а Fe и Pb остаются в дистилляционном сосуде. Пары Zn и Cd снова нагревают до 800 o С, отгоняют кадмий, оставляя цинк чистотой 99%.
б.
Электролиз→ Электролитическая ячейка состоит из подкисленного раствора ZnSO 4 в качестве электролита, анода из цинкового налета и катода из чистого цинка. Чистый цинк осаждается на катоде, а примеси остаются на дне анода в виде анодной грязи после прохождения электрического тока. на аноде: Zn ————-> Zn ++ + 2E — на катоде: Zn ++ + 2E — ————-> Zn
двенадцать химия
Какая реакция ZnS O2 ZnO SO2? – Easyerwithpractice.com
Какая реакция ZnS O2 ZnO SO2?
2 ZnS + 3 O 2 → 2 ZnO + 2 SO. ZnS — восстановитель, O 2 — окислитель.
Что такое сбалансированное уравнение ZnS O2?
Zns+o2- zno+so2 уравновешивают уравнение, а также определяют окисляющееся и восстанавливающееся в реакции вещество.
Какова химическая формула сульфида цинка?
ZnS
Какой тип реакции дает сульфид цинка?
Zn (т) + S (т) → ZnS (т) Их тщательно перемешивают, и смесь остается стабильной на лабораторном столе. Однако когда к смеси прикасаются нагретым металлическим стержнем, происходит бурная реакция (реакция называется экзотермической, выделяющей тепло), и в качестве продукта образуется сульфид цинка.
Однако когда к смеси прикасаются нагретым металлическим стержнем, происходит бурная реакция (реакция называется экзотермической, выделяющей тепло), и в качестве продукта образуется сульфид цинка.
Является ли сульфид цинка кислотой или основанием?
Очевидно, что ZnS стабилен в кислой среде, когда Eh ниже нуля. Однако при щелочном рН ZnS стабилен при более отрицательном значении Eh. Продуктом окисления ZnS является сульфат цинка в кислой среде и осадок гидроксида цинка в щелочной среде.
Для чего используется сульфид цинка?
Обычно используется в качестве белого пигмента. Детектор альфа-лучей, которые делают его люминесцентным. Инфракрасная оптика. Он используется в качестве люминофора в нескольких приложениях, включая рентгеновские экраны и электронно-лучевые трубки.
Цинк сульфид положительный или отрицательный?
Состояние поверхности сульфида цинка можно схематически изобразить на рисунке 5, черный и белый кружки обозначают ион цинка и сульфид-ион соответственно.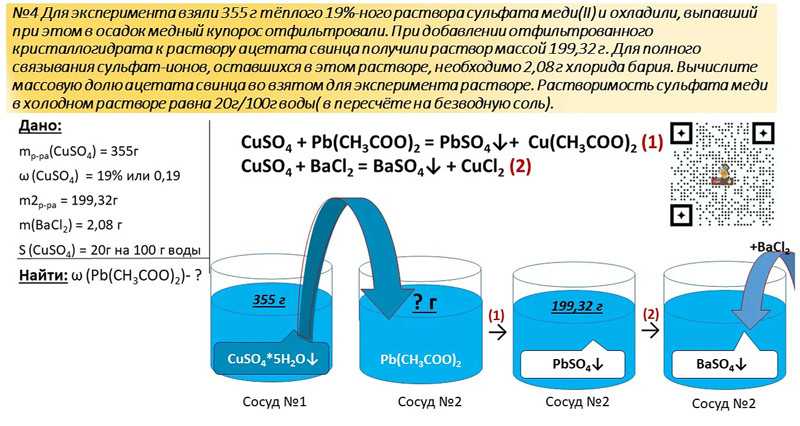 Поверхность, богатая цинком или сульфидом, должна быть либо положительно, либо отрицательно заряжена.
Поверхность, богатая цинком или сульфидом, должна быть либо положительно, либо отрицательно заряжена.
Как получить сульфид цинка?
Сульфид цинка обычно получают из отходов других применений. Типичные источники включают плавильный завод, шлак и травильные растворы. Он также является побочным продуктом синтеза аммиака из метана, где оксид цинка используется для удаления примесей сероводорода из природного газа: ZnO + h3S → ZnS + h3O.
Каково физическое состояние цинка?
Физические свойства: Цинк представляет собой голубовато-белый блестящий металл. Он хрупок при температуре окружающей среды, но пластичен при температуре от 100 до 150°C. Это разумный проводник электричества. Плотность цинка составляет 7,140 г/мл, что означает, что металл тонет в воде и является относительно тяжелым.
Светится ли сульфид цинка в темноте?
Сульфид цинка при добавлении нескольких частей на миллион подходящего активатора проявляет сильную фосфоресценцию и в настоящее время используется во многих областях, от электронно-лучевых трубок до рентгеновских экранов и продуктов, светящихся в темноте. Когда в качестве активатора используется серебро, получается ярко-синий цвет с максимумом при 450 нанометрах.
Когда в качестве активатора используется серебро, получается ярко-синий цвет с максимумом при 450 нанометрах.
Какова плата за сульфид цинка?
0
Что такое цинк и сера?
Цинк — это голубовато-белый металл, используемый для гальванизации железа, а также содержащийся в сплавах, батареях и резине. Сера — желтый хрупкий неметалл; его также можно найти в усиленной форме.
Является ли цинк рудой обманки?
Обычными цинксодержащими минералами являются сульфид цинка, известный как цинковая обманка или сфалерит (ZnS), железосодержащая форма цинковой обманки, известная как марматит [(ZnFe)S], и карбонат цинка, известный как каламин или смитсонит (ZnCO3) .
Какова основная руда цинка?
Важными минералами в цинковых рудах являются сфалерит (ZnS), цинкит (ZnO), франклинит [ZnO(Fe,Mn)2O3], каламин [Zn2(OH)2SiO3] и кузнечный камень (ZnCO3). Цинковые руды обычно содержат 5–15% цинка.
Является ли каламин рудой цинка?
Каламин — это историческое название цинковой руды. Карбонат цинка ZnCO3 или смитсонит и. Силикат цинка Zn4Si2O7(OH)2·h3O или гемиморфит.
Карбонат цинка ZnCO3 или смитсонит и. Силикат цинка Zn4Si2O7(OH)2·h3O или гемиморфит.
Какая руда используется для извлечения цинка?
Цинковая обманка
Какой метод используется для извлечения цинка?
Цинк извлекают из очищенного раствора сульфата цинка путем электролиза, который представляет собой специальную форму электролиза. Процесс работает путем пропускания электрического тока через раствор в ряде ячеек.
Почему уголь используется для извлечения цинка?
Углерод можно использовать для извлечения некоторых металлов из их оксидов путем восстановления. Оксид цинка, ZnO, реагирует с углеродом при очень высоких температурах с образованием расплавленного цинка и монооксида углерода. Это также реакция замещения, и она происходит потому, что углерод более реакционноспособен, чем цинк.
Как цинк получают из цинковой обманки?
Указание: Цинк из цинковой обманки получают путем первого обжига цинка. После обжига проводится процесс восстановления в присутствии углерода, который приводит к образованию свободного металла, т. е. цинка.
е. цинка.
Каково применение цинка?
Большая часть цинка используется для гальванизации других металлов, таких как железо, для предотвращения ржавчины. Оцинкованная сталь используется для кузовов автомобилей, уличных фонарных столбов, барьеров безопасности и подвесных мостов. Большое количество цинка используется для производства литья под давлением, которое играет важную роль в автомобильной, электротехнической и метизной промышленности.
Как извлечение цинка из каламина объяснить с помощью уравнения?
Цинк извлекают из карбонатной руды (каламина), при сильном нагревании каламиновой руды в отсутствие воздуха, т.е. при прокаливании, он разлагается с образованием оксида цинка и диоксида углерода. Затем оксид цинка нагревают с углеродом и получают металлический цинк.
Как вы будете извлекать цинк из цинковой обманки и каламина?
Извлечение цинка из цинковой обманки включает следующие этапы.
- Обогащение: Руда измельчается, а затем концентрируется методом пенной флотации.

- Обжиг: Затем концентрированную руду обжигают в присутствии избытка воздуха при температуре около 1200 К: 2ZnS+3O2→Δ2ZnO+2SO2.
Какова формула каламина?
Каламин
| CID PubChem | 23083748 |
|---|---|
| Структура | Найти похожие структуры |
| Молекулярная формула | Fe2O4Zn |
| Синонимы | Каламин 8011-96-9 Каламин лосьон MFCD00049621 Каламин [USP:JAN] Подробнее… |
| Молекулярный вес | 241,1 |
Какова химическая формула сидерита?
Это ценный минерал железа, так как он на 48% состоит из железа и не содержит серы или фосфора….
| Сидерит | |
|---|---|
| Формула (повторяющаяся единица) | FeCO3 |
| Классификация Штрунца | 5.AB.05 |
| Классификация Дана | 14. 01.01.03 01.01.03 |
| Кристаллическая система | Треугольный |
Является ли каламин кислотным или основным?
Раствор каламина содержит карбонат цинка, который является щелочным по своей природе.
Как еще называется каламин?
Каламин, также известный как каламиновый лосьон, представляет собой лекарство, используемое для лечения легкого зуда. Сюда входят солнечные ожоги, укусы насекомых, ядовитый плющ, ядовитый дуб или другие легкие кожные заболевания… Каламин.
| Комбинация | |
|---|---|
| оксид железа | противозудное |
| Клинические данные | |
| Произношение | KAL-ə-шахта |
| Другие наименования | Лосьон Каламин |
Безопасен ли люминесцентный сульфид цинка?
При воздействии света люминесцентный сульфид цинка создает эффект свечения в темноте. Люминесцентный сульфид цинка является безопасным для кожи красителем. Это сочетание цинка и меди.
Люминесцентный сульфид цинка является безопасным для кожи красителем. Это сочетание цинка и меди.
Безопасен ли сульфид цинка для кожи?
Хронический: Цинксодержащие пары могут вызвать лихорадку металлического дыма. Сульфиды могут вызвать раздражение кожи. Сероводород, если он образуется, токсичен, вызывает сильный раздражитель и легко воспламеняется.
Опасен ли фосфоресцент?
Самые распространенные часы, которые светятся в темноте, называются фосфоресцирующими. По сути, часы покрыты краской, которая поглощает свет, а затем повторно излучает его. Эти часы совершенно безвредны. Второй тип часов называется тритиевым.
Безопасен ли УФ-макияж?
Хотя на кожу можно наносить как флуоресцентные, так и люминесцентные красящие добавки, они не предназначены для повседневного использования и не должны попадать рядом с глазами. Но эксперты отмечают, что дело не только в том, что вы наносите на кожу; это также о том, как и когда вы снимаете все это после окончания вечеринки.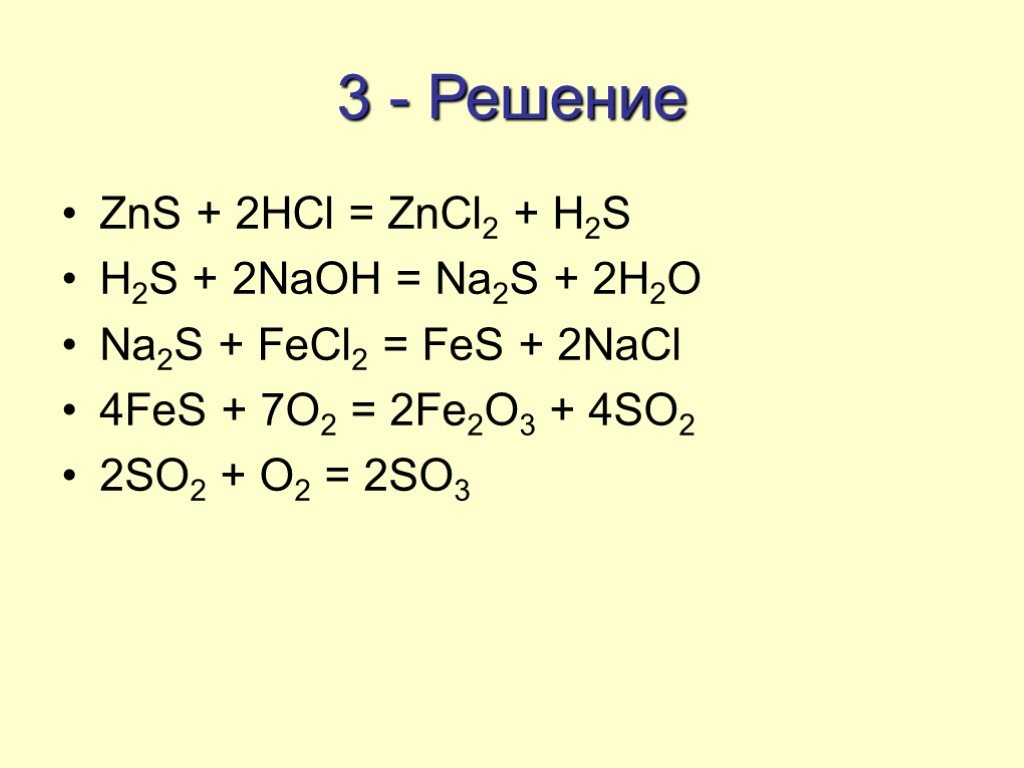
Что такое УФ-макияж?
Сделайте свои собственные творения с помощью УФ-краски для тела; макияж и краска для лица, которая светится в черном свете. Будь то тушь для ресниц, краска для лица, подводка для глаз, лак для ногтей, карандаш для волос, помада или лак для волос, как только вы нанесете черный свет на сияющие цвета, они поразительно сияют. …
Опасна ли ультрафиолетовая краска?
Кроме того, токсична ли УФ-краска? Прозрачные «невидимые» УФ-краски Starglow — это новый вид умных красок, которые прозрачны в сухом виде (непрозрачны), но ярко светятся при воздействии черного УФ-излучения. Сделанные в Великобритании с использованием новейшей невидимой УФ-технологии, они не содержат растворителей и нетоксичны.
Какая косметика светится в темноте?
12 косметических средств, светящихся в темноте, чтобы вас заметили днем и ночью
- Неоновая УФ-губная помада Moon Glow Blacklight.
- Палетка Kryolan Aquacolor UV DayGlow.

- Ярко-розовая краска для волос Manic Panic.
- SUVA Beauty UV Brights Hydra FX Dance Party.
- Splashes & Spills UV Glow Blacklight Eyeliner and Mascara Duo Variety Pack.
Помада какого цвета светится в темноте?
Moon Glow – Губная помада Blacklight Neon UV Lipstick 0,16 унции – Белая – Ярко светится в темноте/ультрафиолетовом свете! Бестселлеры.
Какая натуральная косметика самая лучшая?
Ниже мы перечисляем 13 лучших брендов чистой и органической косметики, которые не жертвуют своим качеством ради списка натуральных ингредиентов.
- RMS Красота. rsbeauty.com
- Кьер Вайс. кьервейс.
- Илья. или красота.
- Ритуэль де Филе. Натуральный и органический: Да.
- Паровая красота. Натуральный и органический: Да.
- W3ll Люди.
- 100% чистота.
- Косас.
Как сделать макияж светящимся в темноте?
Светящаяся в темноте краска для лица Ингредиенты
- 4 столовые ложки кукурузного крахмала (или талька)
- 2 столовые ложки холодного крема или густого лосьона.

- 2 столовые ложки светящегося пигмента [светящийся пигмент на Amazon]
- пищевой краситель или самодельные красители (по желанию)
Светится ли вазелин в темноте?
Вазелин, такой как вазелин, который светится ярко-синим цветом в черном свете.
Какой самый лучший светящийся в темноте порошок?
Наш фосфоресцирующий (светящийся в темноте) порошок Europium UltraGlow® является самым ярким, долговечным, нетоксичным и нерадиоактивным из известных материалов, светящихся в темноте. Порошки UltraGlow® на основе редкоземельного элемента европия представляют собой фосфоресцирующий материал нового поколения с удивительным временем свечения до 30 часов!
Светится ли кокосовое масло в темноте?
Выделившийся хлорофилл светится ярким розовато-красным цветом в черном свете. Измельченный кокос. Этому нет причудливого объяснения: как и все чисто белое, кокос ярко светится в ультрафиолетовом свете.
Светится ли моча человека в черном свете?
Вы можете использовать черный свет для обнаружения биологических жидкостей.



