11 лучших примеров химических изменений в повседневной жизни
Химическое изменение — это процесс, в котором одно или несколько веществ превращаются в одно или несколько новых и разных веществ. Эти вещества могут быть как химическими элементами, так и соединениями.
Химические изменения происходят в результате химических реакций. В ходе химической реакции происходит перегруппировка атомов, и реакция сопровождается изменением энергии, поскольку образуются новые вещества.
Другими словами, химические изменения — это фундаментальные изменения, которые порождают новые комбинации материи. Эти изменения обычно необратимы или обратимы только при дополнительном химическом изменении.
Хотя существуют сотни тысяч различных химических реакций, большинство из них имеют схожие свойства. Эти сходства позволяют нам разделить химические изменения на три широкие категории.
- Органические изменения включают химические реакции сложных углеродных соединений, в которых один или несколько атомов углерода ковалентно связаны с атомами других элементов, чаще всего водорода, азота или кислорода.

- Неорганические изменения — это химические реакции веществ, в которых, как правило, не участвуют атомы углерода. Эти изменения обычно происходят в лабораториях и тяжелой промышленности.
- Биохимические изменения происходят в живых организмах. Они контролируются или регулируются гормонами и ферментами.
Чтобы объяснить этот процесс более подробно, мы перечислили несколько наиболее распространенных примеров химических изменений, которые вы видите в повседневной жизни.
11. Выпечка торта
Тип: неорганическое изменение
Когда вы печете пирог, его ингредиенты (мука, яйцо, сахар, пекарский порошок и т.д.) претерпевают химические изменения. Это происходит в процессе выпечки:
- Тепло позволяет пекарскому порошку образовывать крошечные пузырьки газа, что делает пирог пушистым.
- Под воздействием тепла яичный белок изменяется и делает пирог твердым.
- Масло не дает теплу высушить пирог.

Поскольку этот процесс выпечки требует тепла, это эндотермическая реакция. Она не может быть обращена вспять, поскольку сахар и дрожжи создали новые вещества. Это означает, что после выпечки пирога вы не сможете разделить его на исходные компоненты (муку, яйца, сахар).
10. Сжигание природного газа
Тип: Органическое изменение
Природный газ — это углеводородная смесь, состоящая из множества различных соединений. Его основной компонент — метан (Ch5), соединение с одним атомом углерода и четырьмя атомами водорода. При сгорании метана в присутствии воздуха (кислорода) образуется вода, углекислый газ и тепло (в виде голубого пламени).
9. Взрыв фейерверка
Тип: Неорганические изменения
Фейерверки — это великолепное сочетание науки и инноваций. Они состоят из высокоэнергетических соединений, которые создают взрывы. При выделении достаточного количества тепла (энергии активации) в них происходит несколько химических реакций в быстрой последовательности.
Точнее, высокоэнергетические соединения, плотно упакованные внутри фейерверка, сгорают с кислородом воздуха и превращаются в другие соединения, выделяя при этом звук, тепло и газы (такие, как угарный газ, углекислый газ и азот).
Различные соединения дают разные цвета и оттенки, которые мы видим в темном ночном небе. Например, барий дает зеленый цвет, медь — синий, натрий — желтовато-оранжевый, а стронций — красный.
8. Созревание плодов
Тип: Органическое изменение
Созревание связано с изменениями в составе (например, превращение крахмала в сахар). Это процесс, в результате которого плоды приобретают желаемый вкус, цвет, качество и другие характеристики. По характеру созревания фрукты можно разделить на две группы:
- Климактерические плоды могут созревать после снятия с растения. Например, бананы, манго и яблоки продолжают созревать и не выдерживают жестких условий транспортировки и многократного перемещения.

- Неклимактеричные плоды не могут созревать после сбора урожая. Они производят небольшое количество этилена (гораздо меньше, чем климактерические плоды) и не реагируют на обработку этиленом. В качестве примера можно привести апельсин, виноград, ежевику, гранат и арбуз.
Поскольку созревание включает образование новых углеродсодержащих химикатов, которые приводят к изменению цвета и вкуса, можно смело назвать процесс созревания органическим химическим изменением.
7. Переваривание пищи
Тип: Органическое
В отличие от механического пищеварения, которое начинается во рту с жевания, химическое пищеварение — это сложный процесс, который разбивает пищу на составляющие. Эти строительные блоки в конечном итоге всасываются в плазму крови для питания клеток организма.
Более конкретно, большие молекулы пищи редуцируются до субъединиц, которые достаточно малы для поглощения слизистой оболочкой пищеварительного тракта.
- Белки распадаются на аминокислоты.
- Нуклеиновые кислоты распадаются на нуклеотиды.
- Углеводные сахара распадаются на моносахариды.
- Жиры расщепляются на жирные кислоты и моноглицериды.
Это достигается с помощью различных ферментов (таких, как ферменты слюны, желудка, щеточной каймы и ферменты поджелудочной железы) посредством гидролиза.
6. Гальваническое покрытие металла
Тип: неорганическое изменение
Гальваника — это процесс осаждения материала на твердую подложку с помощью электрического тока. Он используется для улучшения химических, физических и механических свойств подложки.
В этом процессе раствор, содержащий ионы металлов, помещается в резервуар, а подложка, на которую наносится покрытие, подключается к электрической сети, чтобы сделать ее катодом. Ионы металла в растворе движутся к катоду, где они приобретают электроны и образуют металлическое покрытие.
Распространенная форма гальванического покрытия используется для производства монет. Например, американский пенни сделан из цинка, покрытого слоем гальванической меди.
Например, американский пенни сделан из цинка, покрытого слоем гальванической меди.
5. Прокисание молока
Тип: Органическое изменение
Испорченное молоко кислое, с неприятным запахом и вкусом. Со временем оно становится комковатым и свертывается. В процессе скисания образуются новые молекулы, и этот процесс нельзя обратить вспять.
Сырое молоко содержит сахар лактозу. Если оставить молоко на несколько часов при комнатной температуре, содержащиеся в нем бактерии лактобактерии начинают превращать лактозу в молочную кислоту, которая имеет кислый вкус. Бактерии Lactobacillus часто встречаются в молоке, и они не причиняют никакого вреда.
Кислое молоко также получают путем добавления кислоты (с добавлением или без добавления микробных организмов). Такое молоко называется подкисленным. По вкусу оно отличается от молока, полученного путем бактериальной ферментации, поскольку кислоты, добавляемые в процессе промышленного производства, имеют другой вкус, чем молочная кислота.
4. Смешивание кислоты с основанием
Тип: Неорганическое изменение
Смешивание кислоты с основанием — одна из самых распространенных химических реакций, проводимых в химических лабораториях. При смешивании в равных пропорциях они уравновешивают друг друга и образуют соль и воду. Это называется реакцией нейтрализации.
Например, в результате реакции между соляной кислотой (сильная кислота) и гидроксидом натрия (сильное основание) образуется хлорид натрия (поваренная соль).
HCl + NaOH → NaCl + h3O + тепло
В таких реакциях катион H(+) кислоты соединяется с анионом OH(-) основания, образуя соль и воду.
В некоторых реакциях образуются газы. Например, если смешать уксус (слабую кислоту) с пищевой содой (слабым основанием), то вместе с ацетатом натрия (солью) образуется углекислый газ.
3. Ржавое железо
Тип: Неорганическое изменение
Когда железные предметы остаются в воде или влажной атмосфере в течение длительного времени, они покрываются красновато-коричневой чешуйчатой массой, называемой ржавчиной.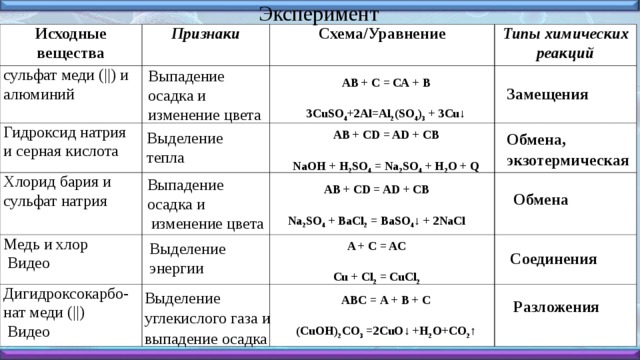 Ржавление — это непрерывный процесс, который постепенно разрушает предметы и делает их бесполезными. Различные факторы, такие как кислотная среда и соленая вода, могут ускорить процесс ржавления железа.
Ржавление — это непрерывный процесс, который постепенно разрушает предметы и делает их бесполезными. Различные факторы, такие как кислотная среда и соленая вода, могут ускорить процесс ржавления железа.
Ржавчина — это не что иное, как оксид железа, соединение, образующееся при реакции железа с кислородом и водой. Хотя это сложный процесс, его химическое уравнение можно записать как:
4Fe + 3O2 + 6H2O → 4Fe(OH)3
Этот процесс также является хорошим примером коррозии, когда металлические поверхности разлагаются на более химически устойчивые оксиды.
2. Варка яйца
Тип: Неорганические изменения
Сырые яйца содержат сложные сети белка и воды. На каждую молекулу белка приходится почти тысяча молекул воды.
Молекулы белка относительно велики и содержат сотни аминокислот, связанных между собой в длинные цепочки. Цепочки складываются в компактные шарики, которые удерживаются вместе слабыми химическими связями (нековалентными).
Когда вы нагреваете яйца, их молекулы движутся быстрее и сталкиваются. При повышении температуры скорость столкновения увеличивается. Слабые связи (которые удерживают цепочки аминокислот) начинают разрываться, и белки яйца разворачиваются. В конце концов, белковые нити запутываются в трехмерную паутину.
В вареном яйце теперь содержится вода, которая диспергируется в белковой паутине, так что она больше не может сливаться воедино. В результате жидкое яйцо превращается в полутвердое.
По сути, вы изменили химические вещества, из которых состоит яйцо, применив тепло. Это необратимое изменение, а значит, вареное яйцо нельзя превратить обратно в сырое.
1. Фотосинтез
Тип: Биохимическое изменение
Фотосинтез — это процесс, используемый растениями и другими организмами для производства пищи. В этом естественном процессе световая энергия (солнечный свет) преобразуется в химическую энергию.
Растения являются основными продуцентами, которые составляют основу нашей экосистемы и подпитывают следующие трофические уровни. Они используют фотосинтез для преобразования солнечного света, воды, углекислого газа в кислород и простой сахар.
Они используют фотосинтез для преобразования солнечного света, воды, углекислого газа в кислород и простой сахар.
6CO2 + 6H2O + Световая энергия → C6H12O6 (сахар) + 6O2
Поскольку для фотосинтеза требуется внешняя энергия (солнечный свет), чтобы привести в движение химические изменения, это эндотермическая реакция. Этот процесс не только используется растениями для получения пищи и роста, но и оказывает огромное влияние на нашу атмосферу и океаны, поскольку поглощает углекислый газ и производит кислород.
Без фотосинтеза на Земле было бы слишком мало кислорода — его не хватало бы для выживания людей.
Часто задаваемые вопросы
В чем разница между химическим изменением и физическим изменением?
Физическое изменение влияет на форму вещества. Он включает в себя изменения таких свойств, как прочность, долговечность, температура плавления, форма кристаллов, объем, плотность, форма, размер, цвет и текстура. Хорошим примером может служить закалка стали для изготовления лезвия ножа.
Хорошим примером может служить закалка стали для изготовления лезвия ножа.
Химическое изменение, с другой стороны, включает в себя изменения в составе вещества. Оно происходит, когда различные вещества соединяются, образуя новые вещества с новыми свойствами. Эти химические реакции необратимы и сопровождаются изменением энергии.
Как определить химическое изменение?
Не всегда легко определить, произошло ли химическое изменение (в отличие от физического). Однако можно обратить внимание на такие признаки, как:
- Изменение цвета или порядка.
- Разложение органических веществ, таких как продукты питания и овощи.
- изменение энергии или температуры, например, потеря (эндотермическая) или выделение (экзотермическая) тепла.
- Образование газов или осадков.
- Изменение состава, например, при сжигании дерева оно превращается в пепел.
- Изменения невозможно обратить вспять.
- Некоторые химические реакции производят свет.
Какое вещество не может быть изменено обычными химическими реакциями?
Элемент — это чистое вещество, которое никогда не может быть уменьшено до более простой формы в результате какой-либо химической реакции. Это означает, что вы не можете превратить элемент в другой элемент или разложить его обычными химическими средствами, такими как электролиз, нагревание или реакция. Кислород, азот, золото и серебро являются примерами чистых веществ.
Это означает, что вы не можете превратить элемент в другой элемент или разложить его обычными химическими средствами, такими как электролиз, нагревание или реакция. Кислород, азот, золото и серебро являются примерами чистых веществ.
Примеры химических реакций в повседневной жизни
Примеры химических реакций в повседневной жизни
Химия происходит в мире вокруг вас, а не только в лаборатории. Материя взаимодействует с образованием новых продуктов в процессе, называемом химической реакцией или химическим изменением . Каждый раз , когда вы готовите или чистая, это химия в действии . Ваше тело живет и растет благодаря химическим реакциям . Есть реакции, когда вы принимаете лекарства, зажигаете спичку и дышите. Эти примеры химических реакций из повседневной жизни представляют собой небольшую выборку из сотен тысяч реакций, которые вы испытываете в течение дня.
фотосинтез
Фрэнк Крахмер / Getty Images
Растения применяют химическую реакцию под названием фотосинтез для превращения углекислого газа и воды в пищу (глюкозу) и кислород. Это одна из самых распространенных повседневных химических реакций, а также одна из самых важных, потому что именно так растения производят пищу для себя и животных и превращают углекислый газ в кислород. Уравнение для реакции:
6 СО 2 + 6 Н 2 О + свет → С 6 Н 12 О 6 + 6 O 2
Аэробное клеточное дыхание
Катерина Кон / Научная фототека / Getty Images
Аэробное клеточное дыхание — это противоположный процесс фотосинтеза, в котором молекулы энергии объединяются с кислородом, которым мы дышим, чтобы высвободить энергию, необходимую нашим клеткам, а также углекислому газу и воде. Энергия, используемая клетками, — это химическая энергия в форме АТФ или аденозинтрифосфата.
Вот общее уравнение для аэробного клеточного дыхания:
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + энергия (36 АТФ)
03из 11
Анаэробное дыхание
Tastyart Ltd Роб Уайт / Getty Images
Анаэробное дыхание — это набор химических реакций, которые позволяют клеткам получать энергию из сложных молекул без кислорода.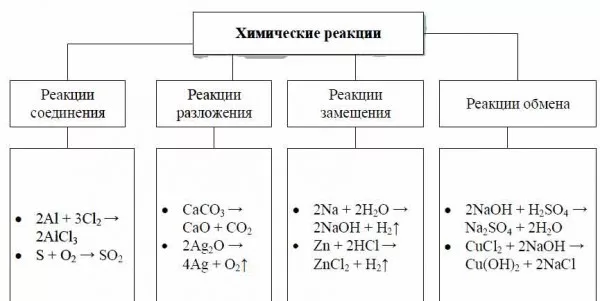 Ваши мышечные клетки выполняют анаэробное дыхание всякий раз, когда вы исчерпываете поступающий к ним кислород, например, во время интенсивных или длительных упражнений. Анаэробное дыхание дрожжами и бактериями используется для брожения с получением этанола, углекислого газа и других химических веществ, которые делают сыр, вино, пиво, йогурт, хлеб и многие другие распространенные продукты.
Ваши мышечные клетки выполняют анаэробное дыхание всякий раз, когда вы исчерпываете поступающий к ним кислород, например, во время интенсивных или длительных упражнений. Анаэробное дыхание дрожжами и бактериями используется для брожения с получением этанола, углекислого газа и других химических веществ, которые делают сыр, вино, пиво, йогурт, хлеб и многие другие распространенные продукты.
Общее химическое уравнение для одной формы анаэробного дыхания:
C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2 + энергия
горение
WIN-инициатива / Getty Images
Каждый раз, когда вы зажигаете спичку, зажигаете свечу, разжигаете огонь или зажигаете гриль, вы видите реакцию горения. Сжигание объединяет энергетические молекулы с кислородом для производства углекислого газа и воды.
Например, уравнение для реакции сгорания пропана, найденного в газовых грилях и некоторых каминах, имеет вид:
C 3 H 8 + 5O 2 → 4H 2 O + 3CO 2 + энергия
Ржавчина
Алекс Дауден / EyeEm / Getty Images
Со временем железо образует красное, слоистое покрытие, называемое ржавчиной. Это пример реакции окисления . Другие повседневные примеры включают образование зелени на меди и потускнение серебра.
Это пример реакции окисления . Другие повседневные примеры включают образование зелени на меди и потускнение серебра.
Вот химическое уравнение для ржавления железа:
Fe + O 2 + H 2 O → Fe 2 O 3 . XH 2 O
метатеза
Ники Дуган Пог / Flickr / CC BY-SA 2.0
Если вы комбинируете уксус и пищевую соду для химического вулкана или молока с разрыхлителем по рецептуре, вы испытываете двойное смещение или реакцию метатезиса (плюс некоторые другие). Ингридиенты рекомбинируют для производства углекислого газа и воды. Углекислый газ образует пузырьки в вулкане и способствует росту выпечки .
Эти реакции кажутся простыми на практике, но часто состоят из нескольких этапов. Вот общее химическое уравнение для реакции между пищевой содой и уксусом:
HC 2 H 3 O 2 (водн.) + NaHCO 3 (вод.) → NaC 2 H 3 O 2 (вод.) + H 2 O () + CO 2 (г)
электрохимия
Антонио М. Росарио / Имидж Банк / Getty Images
Батареи используют электрохимические или окислительно-восстановительные реакции для преобразования химической энергии в электрическую энергию. Спонтанные окислительно — восстановительные реакции протекают в гальванических элементах , в то время как неспонтанные химические реакции принимают место в электролизерах .
Спонтанные окислительно — восстановительные реакции протекают в гальванических элементах , в то время как неспонтанные химические реакции принимают место в электролизерах .
пищеварение
Питер Дазли / Выбор фотографа / Getty Images
Тысячи химических реакций происходят во время пищеварения. Как только вы кладете пищу в рот, фермент в слюне, называемый амилазой, начинает расщеплять сахара и другие углеводы в более простые формы, которые ваш организм может усваивать. Соляная кислота в желудке вступает в реакцию с пищей, что приводит к ее дальнейшему расщеплению, в то время как ферменты расщепляют белки и жиры, поэтому они могут всасываться в кровь через стенки кишечника.
Кислотно-основные реакции
Lumina Imaging / Getty Images
Всякий раз, когда вы объединяете кислоту (например, уксус, лимонный сок, серную кислоту или соляную кислоту ) с основанием (например, пищевая сода , мыло, аммиак или ацетон), вы выполняете кислотно-щелочную реакцию. Эти реакции нейтрализуют кислоту и основание с образованием соли и воды.
Хлорид натрия — не единственная соль, которая может образоваться. Например, вот химическое уравнение для кислотно-щелочной реакции, которая дает хлорид калия, заменитель обычной поваренной соли:
HCl + KOH → KCl + H 2 O
Мыльные и моющие реакции
JGI / Джейми Гриль / Getty Images
Мыло и моющие средства очищаются путем химических реакций . Мыло эмульгирует грязь, что означает, что масляные пятна связываются с мылом, поэтому их можно удалить водой. Моющие средства действуют как поверхностно-активные вещества, снижая поверхностное натяжение воды, чтобы она могла взаимодействовать с маслами, изолировать их и смывать их.
приготовление еды
Дина Беленко Фото / Getty Images
При приготовлении пищи используется тепло, чтобы вызвать химические изменения в пище. Например, при сильном кипении яйца сероводород, полученный при нагревании яичного белка, может реагировать с железом из яичного желтка с образованием серовато-зеленого кольца вокруг желтка .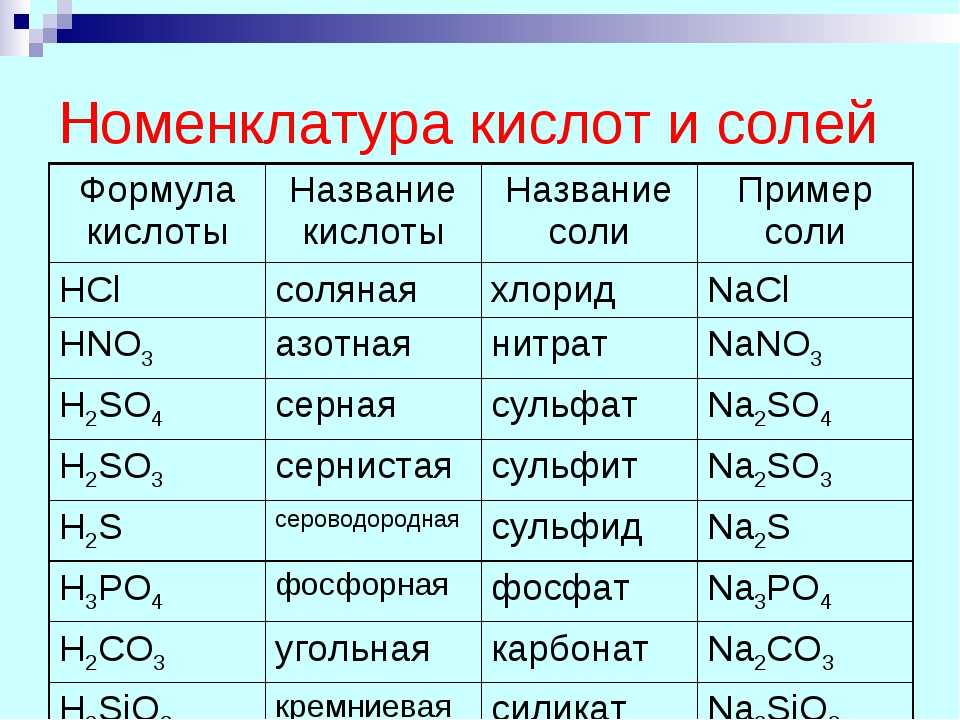
Популярные сообщения из этого блога
Виртуальная реальность (VR) выводит химическое образование на новый уровень
Виртуальная реальность (VR) выводит химическое образование на новый уровень Понимание, а не запоминание Чтобы понять химию, вы должны понимать, что происходит на молекулярном уровне. Просто запоминание формул и фактов недостаточно. И что может быть лучшим способом понять поведение атомов, ионов и молекул, чем вовлечь себя в химические реакции, увидеть все эти частицы своими глазами. Соединяя реальный мир с миром молекул Каждый урок начинается в лаборатории, а затем мы приближаемся к молекулярному уровню.
Далее…
Химия атома
В этом видео Хэнк делает все возможное, чтобы убедить нас, что химия — это не пытка, а удивительная и красивая наука о вещах. Химия может сказать нам, как три крошечные частицы — протон, нейтрон и электрон — объединяются в триллионы комбинаций, образуя … все. В этом первом выпуске Crash Course Chemistry мы начинаем с одной из самых больших идей в химии, когда-либо существовавших — материал сделан из атомов. Более конкретно, мы узнаем о свойствах ядра и почему они важны для определения того, что на самом деле представляет собой атом.
Далее…
Wolfram|Alpha Примеры: Химия
О-о! Wolfram|Alpha не работает без JavaScript.
Пожалуйста, включите JavaScript. Если вы не знаете, как это сделать, вы можете найти инструкции здесь. Как только вы это сделаете, обновите эту страницу, чтобы начать использовать Wolfram|Alpha.
Примеры для
Химия изучает материю, от отдельных атомов и ионов до больших биомолекул. С помощью Wolfram|Alpha вы можете исследовать данные о химических соединениях, реакциях, в которых они участвуют, растворимости и теории химических графов. Он также содержит информацию о химических количествах, преобразовании единиц измерения, расчетах молярности и стехиометрии. Используйте Wolfram|Alpha, чтобы ответить на вопросы по химии, будь то домашнее задание или просто любопытство.
Химические элементыИспользуйте Wolfram|Alpha для изучения элементов периодической таблицы.
Найти количество элементов:
сколько элементов в таблице МенделееваПолучить информацию о химическом элементе:
углеродНайти элементы, отвечающие заданным критериям:
10 самых плотных элементовНачертить свойство для класса элементов:
точек плавления щелочноземельных металловБольше примеровИоны Узнайте о положительно и отрицательно заряженных ионах и их свойствах.
Получить информацию об ионе:
хрома(III)Сравнить несколько ионов:
Nh5+, N-3, PO4-3Сравнить ионы данного элемента:
ионы марганцаНайти конкретное значение свойства для класса ионов :
зарядов многоатомных ионовБольше примеровХимические реакцииИспользуйте Wolfram|Alpha, чтобы сбалансировать химические уравнения, определить стехиометрию реакции и предсказать продукты.
Сбалансируйте химическое уравнение:
октан + O2 -> вода + CO2Рассчитайте стехиометрию реакции:
0,2 моль Ch5 + O2 -> 7 мл h3O + CO2Найти химические реакции с использованием реагентов или продуктов:
водород + кислород ->-> нитратБольше примеровХимияИспользуйте Wolfram|Alpha для изучения химико-информатических свойств с помощью инвариантов графов, таких как индекс J Балабана или индекс Индекс Hosoya для дескрипторов QSAR, таких как количество доноров водорода или самая длинная цепь.
Найдите наибольшую общую подструктуру между двумя молекулами:
максимальная общая подструктура АТФ и кофеинаНайдите ароматические атомы:
какова ароматическая структура 4-метокситрифениламинаНайдите доноров и акцепторов водородных связей:
сколько акцепторов водородных связей в фуретидинеВычислите набор топологических индексов для молекулы:
графические свойства 2-аминомасляная кислотаБольше примеровЯдерная химия Исследуйте ядерную химию с помощью Wolfram|Alpha.
Запишите символ нуклида:
Какой символ нуклида у кислорода-14Найдите номер нейтрона:
кальций-40 номер нейтронаРассчитать энергию связи:
энергия связи тантала-175Исследовать источник элементов:
Откуда взялся вольфрам? Дополнительные примерыХимические соединенияПоиск химических веществ по названию, химической формуле или другому идентификатору.
Получить информацию о химическом соединении:
Указать соединение по химическому идентификатору:
InChI=1/C8H8O3/c1-11-8-4-6(5-9)2-3-7(8)10/h3 -5,10H,1h4Сравните различные органические химические вещества:
оксалилдигидразид и N,N-ди-N-бутилформамидСм. примеры липидов, включая глицерофосфолипиды, жирные кислоты и т. д.:
фосфатидилхолинДругие примерыХимические количестваВычислите экстенсивные свойства химических веществ, которые зависят от количества присутствующего вещества, и преобразуйте количества в различные единицы.
Введите количества по массе:
500 мг нитрата серебра 12 фунтов 4-цианоиндолаНайдите число молей из заданной массы:
2 кг гидрофосфата кальция в молиПереведите количества в объемы: 930 атомов гелия в литрыБольше примеровХимическая термодинамика
Вычисление термодинамических свойств, таких как энтропия, теплоемкость или давление пара, для самых разных химических веществ.
Найти свойства вещества в данной фазе:
газ триметиламинВычислить свойства при заданной температуре:
давление паров этанола при 300KВыполнить расчеты по уравнению Аррениуса:
Уравнение АррениусаОценить термодинамические свойства по методу Джобака:
2,3-метано-5,6-дихлоринденДругие примерыКвантовая химияСвяжите химические свойства с лежащей в основе квантово-механической природой атомов и молекул.
Соберите электронную конфигурацию:
Электронную конфигурацию никеляСоберите орбитальную диаграмму основного состояния:
Орбитальную диаграмму железаНайдите атомный радиус:
Каков атомный радиус S?Подсчитайте количество валентных электронов:
Сколько валентных электронов в Bi?Еще примерыGO Дальнейшее
Пошаговые растворы для химии
Связанные примеры
Исследуйте свойства различных растворов, которые зависят от растворителя, растворенного вещества и концентрации.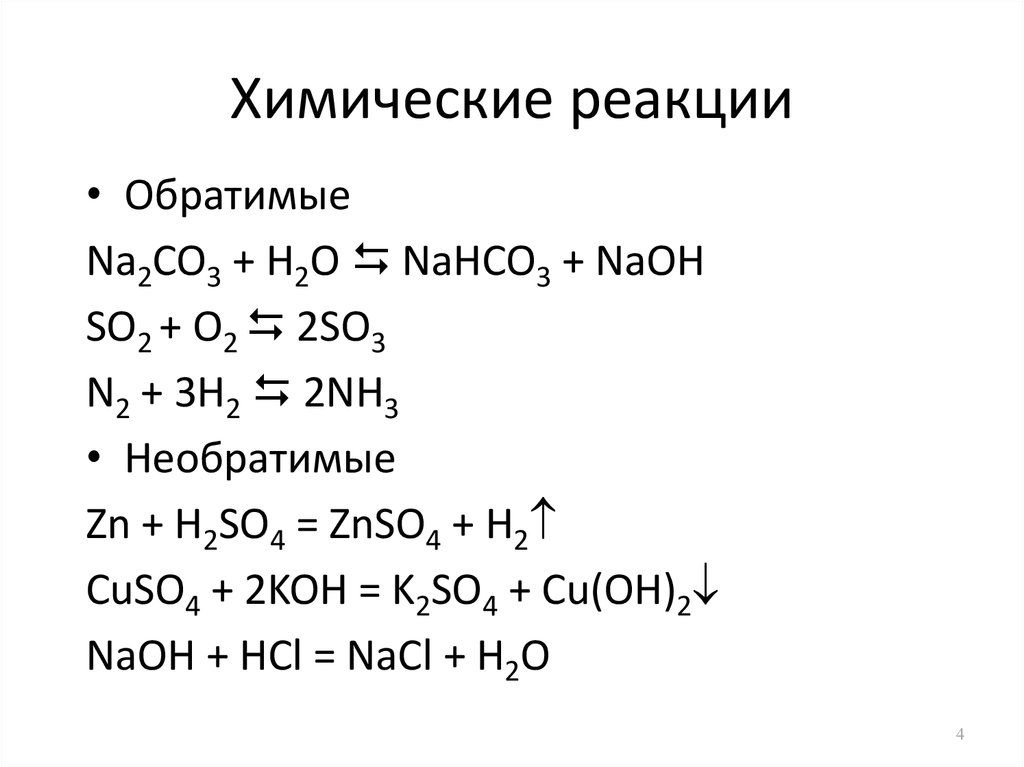
Вычислить свойства химического раствора:
концентрированная уксусная кислотаРасчет свойств количества раствора:
100 мл 1,5 молярного K2CO3 в ТГФВычисления титрования:
титрование сильной кислотой водаБольше примеровФункциональные группыИсследуйте функциональные группы, такие как цианаты, пероксиды, алканы и галогениды.
Получить информацию о функциональной группе:
Нитрильная функциональная группа альдегидная группаПолучить информацию о защитной группе:
Эфир МОМНайдите поведение защитной группы в определенных условиях:
стабильность амида FMOC + цинкДругие примерыСвязи и орбиталиИсследуйте свойства электронных орбиталей и связей, которые они образуют. Найдите связи по составляющим их атомам, по типу связи или по исходному химическому веществу.
Получить сводную информацию о связях для химического вещества:
Информация о связях цис-циклононеновой цепи Какова энергия связи в ацетонитрилеВычислить гибридизацию в соединении:
гибридизация триметиламинаСравните гибридизацию двух соединений:
гибридизация тротила и бензолаБольше примеровХимия в повседневной жизни — WorldOfChemicals
Вы когда-нибудь задумывались, почему химия так важна? Зачем мы изучаем химию? Какова роль химии в жизни?
Мы все сделаны из химических веществ, и все вокруг нас состоит из химических веществ.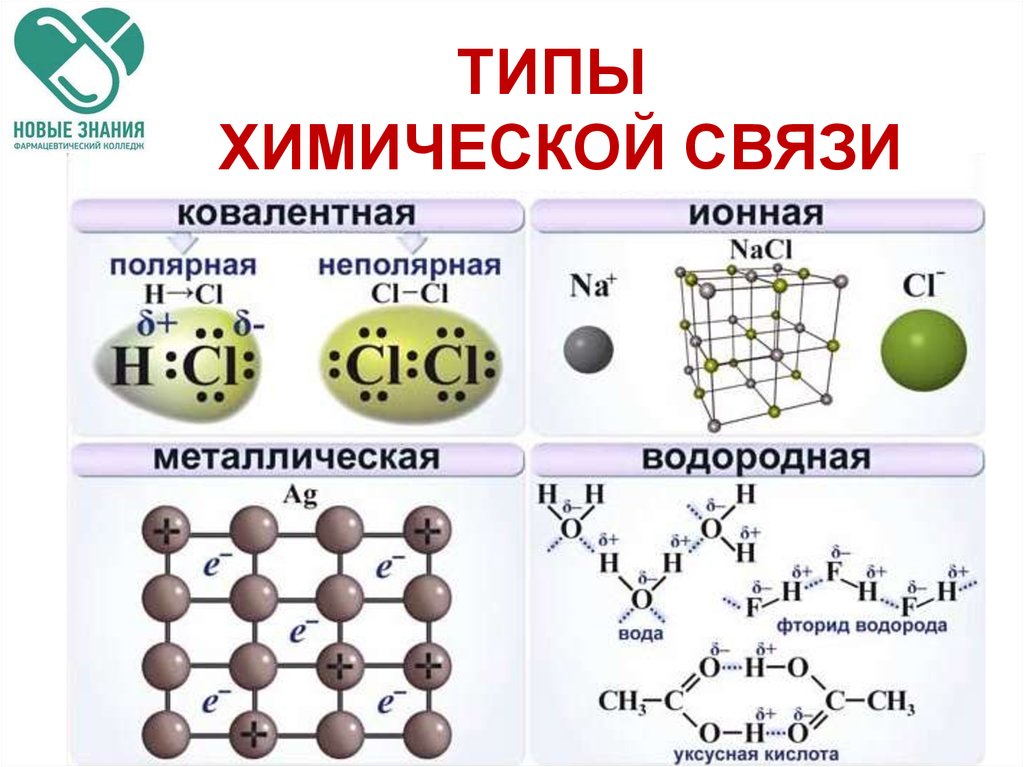 Все, что мы слышим, видим, обоняем, пробуем на вкус и осязаем, связано с химией и химическими веществами (материей). Слух, зрение, вкус и осязание включают в себя сложную серию химических реакций и взаимодействий в нашем теле. Многие изменения, которые мы наблюдаем в окружающем мире, вызваны химическими реакциями. Химия не ограничивается стаканами и лабораториями. Он окружает нас повсюду, и чем лучше мы знаем химию, тем лучше мы познаем наш мир. Химия присутствует во всех аспектах жизни, и несколько примеров химии в повседневной жизни:0004
Все, что мы слышим, видим, обоняем, пробуем на вкус и осязаем, связано с химией и химическими веществами (материей). Слух, зрение, вкус и осязание включают в себя сложную серию химических реакций и взаимодействий в нашем теле. Многие изменения, которые мы наблюдаем в окружающем мире, вызваны химическими реакциями. Химия не ограничивается стаканами и лабораториями. Он окружает нас повсюду, и чем лучше мы знаем химию, тем лучше мы познаем наш мир. Химия присутствует во всех аспектах жизни, и несколько примеров химии в повседневной жизни:0004
1. Небо голубое
Цвет предмета определяется светом, который он отражает. Белый свет солнца содержит все длины волн, но когда он падает на объект, часть его длин волн поглощается, а часть отражается. Синий цвет неба можно объяснить с учетом явления, называемого рэлеевским рассеянием, которое состоит в рассеянии света частицами, намного меньшими, чем его длина волны. Этот эффект особенно силен, когда свет проходит через газы.
2. Плавающий лед на воде
Лед менее плотный, чем жидкая вода. Более тяжелая вода вытесняет более легкий лед, поэтому лед остается на поверхности.
3. Как работает солнцезащитный крем?
Солнцезащитный крем сочетает в себе органические и неорганические химические вещества для фильтрации солнечного света, чтобы меньше его проникало в более глубокие слои кожи. Светоотражающие частицы солнцезащитного крема обычно состоят из оксида цинка или оксида титана.
4. В скороварке блюда готовятся быстрее
Скороварка имеет более сложную крышку, которая полностью закрывает кастрюлю. Когда мы нагреваем воду, она закипает, и пар не может выйти, поэтому он остается внутри и начинает нагнетать давление. Под давлением температура приготовления повышается намного выше, чем в обычных условиях, поэтому пища готовится намного быстрее. Это означает роль химии в нашей повседневной жизни.
Это означает роль химии в нашей повседневной жизни.
5. Химия любви
Роль химии лежит в основе каждого шага в отношениях. Когда мы влюбляемся, наш мозг претерпевает некоторые изменения, а также высвобождаются определенные химические соединения. Любовь управляется этими гормонами: окситоцином, вазопрессином, эндорфинами.
6. Кофе помогает нам уснуть
Кофе помогает нам уснуть из-за присутствия в мозге химического вещества, называемого аденозином. Он связывается с определенными рецепторами и замедляет активность нервных клеток, когда поступает сигнал сна.
7. Овощи окрашены
Многие овощи и фрукты имеют яркую окраску, потому что они содержат особое химическое соединение, называемое каротиноидами. Эти соединения имеют область, называемую хромофором, которая поглощает и испускает свет с определенной длиной волны, создавая цвет, который мы затем воспринимаем.



