Составьте уравнения реакций между HCl, h3SO4, KOH, Ca(OH)2
Реакции нейтрализации не всегда протекают до конца, с образованием обычных солей. При недостатке кислоты (или избытке щелочи) могут образовываться кислые или основные соли. В начале рассмотрим простые примеры, какие и должны быть у вас в ответах. Далее идет продвинутый уровень.
KOH + HCl = KCl + H2O
KCl – хлорид калия
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
CaCl2 – хлорид кальция
2KOH + H2SO4 = K2SO4 + 2H2O
K2SO4 – сульфат калия
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
CaSO4 – сульфат кальция
Более продвинутый уровень:
Ca(OH)2 + HCl = Ca(OH)Cl + H2O
Ca(OH)Cl – гидроксохлорид кальция
KOH + H2SO4 = KHSO4 + H2O
KHSO4 – гидросульфат калия
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O
Ca(HSO4)2 – гидросульфат кальция
А вот получить гидроксосульфат кальция (CaOH)2SO4 напрямую не получится. Его получают иным путём:
Его получают иным путём:
Ca(HSO4)2 + 3Ca(OH)2 = 2(CaOH)2SO4 + 2H2O
1. Приведите определение реакции нейтрализации. Объясните её суть своими словами.
2. В трёх пробирках находятся растворы веществ: CaCl2, HCl, Ca(OH)2. Как можно распознать данные растворы?
3. Запишите формулы двух веществ, которые можно использовать для нейтрализации гидроксида калия в водном растворе.
5. Составьте уравнения реакций, протекающих при нейтрализации хлороводородной кислотой основаниями, которым соответствуют оксиды BaO, K2 O.
6. Кислотность среды в желудке человека обусловлена выработкой в нём хлороводородной (соляной) кислоты. Если её количество в желудке оказывается избыточным, наступает состояние повышенной кислотности желудочного сока. В результате этого могут появиться изжога, тошнота, боли, нарушение пищеварения. В таких случаях врачи часто рекомендуют использовать препарат «Алмагель», в состав которого входит гидроксид магния.
В таких случаях врачи часто рекомендуют использовать препарат «Алмагель», в состав которого входит гидроксид магния.
а) Составьте формулу гидроксида магния;
б) запишите уравнение реакции этого вещества с соляной кислотой;
в) назовите продукты реакции;
г) укажите тип данной реакции.
7. Гродненское производственное объединение ОАО «Гродно Азот» производит различные азотные удобрения. При этом используется азотная кислота HNO3. Поскольку на предприятии строго соблюдается принцип «Не навредить окружающей среде», приходиться быть готовыми к ликвидации непредвиденных аварий. Что бы вы предложили сделать в случае пролива азотной кислоты на близлежащую территорию, чтобы последствия этой аварии были минимальными? Напишите уравнения соответствующих реакций.
Домашний эксперимент.
Реакция нейтрализации – примеры, типы и применение
4.7
Средняя оценка: 4.7
Всего получено оценок: 558.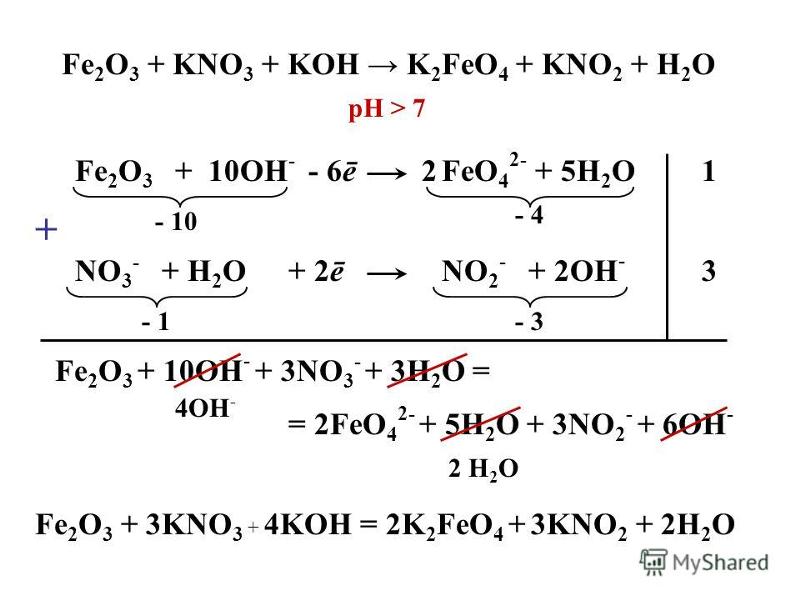
4.7
Средняя оценка: 4.7
Всего получено оценок: 558.
Взаимодействие кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно подобные реакции протекают с выделением тепла.
Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
HCl + NaOH → NaCl + H2O.
Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда).
Раствор двух активных соединений превратился в воду за счёт обмена натрием и хлором, поэтому ионное уравнение данной реакции выглядит следующим образом:H+ + OH– → H2O.
После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
Рис. 1. Образование соли после выпаривания.В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
- H2SO4 + 2KOH → K2SO4 + 2H2O;
- HNO3 + KOH → KNO3 + H2O.
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
- H2SO3 + 2NaOH ↔ Na2SO3 + 2H2O;
- Fe(OH)3 + H3PO4 ↔ FePO4 + 3H2O.
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Cu(OH)2 + 2HNO3 ↔ Cu(NO 3)2 + 2H2O.
Рис. 2. Взаимодействие гидроокиси меди с кислотой.Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.
Рис. 3. Титрование.Кроме того, важно практическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Лука Успенский
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 558.
А какая ваша оценка?
Данная реакция является примером реакции KOH + HCl на KCl 11 класс химии CBSE
Ответ
Проверено
201.6k+ просмотров
Подсказка: Мы знаем, что гидроксид калия является основанием, соляная кислота является кислотой и калий Хлорид — это соль. Реакция, при которой происходит взаимодействие основания и кислоты с образованием соли и воды, в которой кислота нейтрализуется основанием.
Полное решение:
Прежде всего, мы рассмотрим реакции, указанные в опциях.

Реакция комбинирования: Реакция комбинирования — это реакция, в которой два или более соединений реагируют и образуют одно соединение.
Пример: $2{H_2} + {O_2} \to 2{H_2}O$
Реакция замещения: Реакция замещения — это реакция, в которой один элемент заменяется другим элементом в соединении.
Пример: $AgCl + Na \to NaCl + Ag$
Реакция разложения: Реакция разложения – это реакция, при которой одно соединение распадается с образованием двух или более продуктов.
Пример: $Ca{\left({OH} \right)_2} \to CaO + {H_{_2}}O$
Реакция нейтрализации: Реакция нейтрализации — это реакция, в которой кислота и основание количественно реагируют друг с другом и образуют соль и воду.
При нейтрализации выделяется тепло.
Пример : $NaOH + HCl \to NaCl + {H_2}O$
В данном вопросе имеем
$KOH + HCl \to KCl + {H_2}O$

Следовательно, правильный вариант (D).
Примечание: Некоторые важные факты о реакции нейтрализации:
(i) В нейтрализации участвуют только кислота и основание.
(ii) Если один грамм-эквивалент кислоты реагирует с одним грамм-эквивалентом основания, то выделяемое тепло называется энергией нейтрализации.
(iii) Зубная паста содержит основания, которые нейтрализуют кислоту, вырабатываемую бактериями во рту.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
- 9- В каждом случае это ПРЕДСТАВЛЕНИЕ того, что происходит в растворе.
 Например, сбалансированное химическое уравнение для реакции между HCl (водн.) и KOH (водн.). Входное уравнение Сбалансированное уравнение; Al(OH)3 + HNO3 = Al(NO3)3 + h3O : Al(OH)3 + 3HNO3 = Al(NO3)3 + 3h3O: Al + O2= Al2O3: 4Al + 3O2 = 2Al2O3 Автор сообщения: Сообщение опубликовано: февраль 19, 2021 Категория публикации: Без категории Комментарии к публикации: 0 комментариев 0 комментариев 2 Al + 6 HCl = 2 AlCl3 + 3 h3 20. Входное уравнение Сбалансированное уравнение; Br2+I2=IBr3: 3Br2 + I2 = 2IBr3: BaCl2 + AgNO3 = Ba(NO3)2 + AgCl: BaCl2 + 2AgNO3 = Ba(NO3)2 + 2AgCl: Br2(ж) + KI(водн.) = K + Br2I Однако , в реакции между HCl(водн.) и Mg(OH) 2 (водн.) требуются дополнительные молекулы HCl и H 2 O, чтобы уравновесить … 1 десятилетие назад. Количество молей KOH связано с количеством молей HCl стехиометрическими коэффициентами сбалансированного химического уравнения. (Только водные соединения расщепляются на ионы.) Сбалансированное химическое уравнение: KOH + HCl → KCl + H 2 O. Mg(s) + HCl(aq) -> MgCl2(aq) + h3(g) 2.
Например, сбалансированное химическое уравнение для реакции между HCl (водн.) и KOH (водн.). Входное уравнение Сбалансированное уравнение; Al(OH)3 + HNO3 = Al(NO3)3 + h3O : Al(OH)3 + 3HNO3 = Al(NO3)3 + 3h3O: Al + O2= Al2O3: 4Al + 3O2 = 2Al2O3 Автор сообщения: Сообщение опубликовано: февраль 19, 2021 Категория публикации: Без категории Комментарии к публикации: 0 комментариев 0 комментариев 2 Al + 6 HCl = 2 AlCl3 + 3 h3 20. Входное уравнение Сбалансированное уравнение; Br2+I2=IBr3: 3Br2 + I2 = 2IBr3: BaCl2 + AgNO3 = Ba(NO3)2 + AgCl: BaCl2 + 2AgNO3 = Ba(NO3)2 + 2AgCl: Br2(ж) + KI(водн.) = K + Br2I Однако , в реакции между HCl(водн.) и Mg(OH) 2 (водн.) требуются дополнительные молекулы HCl и H 2 O, чтобы уравновесить … 1 десятилетие назад. Количество молей KOH связано с количеством молей HCl стехиометрическими коэффициентами сбалансированного химического уравнения. (Только водные соединения расщепляются на ионы.) Сбалансированное химическое уравнение: KOH + HCl → KCl + H 2 O. Mg(s) + HCl(aq) -> MgCl2(aq) + h3(g) 2. Балансировка химические уравнения — это базовый навык в химии, и проверка себя помогает сохранить важную информацию. 2,9-1 по отношению к соляной кислоте. Нет такой вещи, как KSO4. Молярная масса КОН составляет 56,1056 г моль-1. Закон сохранения массы гласит, что материя не может быть ни создана, ни уничтожена. Химия. 2 декабря 2017 г. . Примеры: Fe, Au, Co, Br, C, O, N, F. Ионные заряды пока не поддерживаются и будут игнорироваться. HCl (водн.) + KOH (водн.) → H 2 O (л) + KCl (водн.), где солью является KCl. 1, 3, 1, 3. Нет никакого способа сбалансировать это, или, скорее, есть бесконечное количество способов сбалансировать это, потому что вы можете иметь множество коэффициентов для KOH или NaOH. h3s Кох. Ответ, данный в ответе 1, представляет собой молекулярное уравнение. Во-первых, мы уравновешиваем моль… Чтобы написать результирующее ионное уравнение для Pb(NO3)2 + KI = KNO3 + PbI2 (нитрат свинца (II) + йодид калия), мы делаем три основных шага. Прочтите нашу статью о том, как сбалансировать химические уравнения, или попросите помощи в нашем чате.
Балансировка химические уравнения — это базовый навык в химии, и проверка себя помогает сохранить важную информацию. 2,9-1 по отношению к соляной кислоте. Нет такой вещи, как KSO4. Молярная масса КОН составляет 56,1056 г моль-1. Закон сохранения массы гласит, что материя не может быть ни создана, ни уничтожена. Химия. 2 декабря 2017 г. . Примеры: Fe, Au, Co, Br, C, O, N, F. Ионные заряды пока не поддерживаются и будут игнорироваться. HCl (водн.) + KOH (водн.) → H 2 O (л) + KCl (водн.), где солью является KCl. 1, 3, 1, 3. Нет никакого способа сбалансировать это, или, скорее, есть бесконечное количество способов сбалансировать это, потому что вы можете иметь множество коэффициентов для KOH или NaOH. h3s Кох. Ответ, данный в ответе 1, представляет собой молекулярное уравнение. Во-первых, мы уравновешиваем моль… Чтобы написать результирующее ионное уравнение для Pb(NO3)2 + KI = KNO3 + PbI2 (нитрат свинца (II) + йодид калия), мы делаем три основных шага. Прочтите нашу статью о том, как сбалансировать химические уравнения, или попросите помощи в нашем чате. -1 по отношению к соляной кислоте. Этот сборник из десяти тестовых вопросов по химии поможет вам научиться уравновешивать химические реакции. 1 Ответ. закон сохранения массы. Составные состояния [такие как (s) (aq) или (g)] не требуются. В конце химической реакции атомов не больше и не меньше, чем в начале. Пенни. Предельный реагент можно рассчитать для сбалансированного уравнения, введя число молей или вес для всех реагентов. Спасибо Писатель; Комментарий; Блют; поблагодарил писателя. Определите все этапы в своем ответе. Подсчитав количество атомов каждого элемента, мы находим, что в качестве продукта образуется только одна молекула воды. Подсказка: начните с написания сбалансированного химического уравнения. 2HC2h4O2(водн.)+Ca(OH)2(водн.)→Ca(C2h4O2)2(водн.)+2h3O(ж) Ответ представь в виде результирующего ионного уравнения. Объяснение: а. HBr (водн.) + KOH (водн.) →. Примеры полных химических уравнений для баланса: Fe + Cl 2 = FeCl 3; KMnO 4 + HCl = KCl + … Какое из следующих уравнений является правильно сбалансированным уравнением для реакции Hno3 с Caco3 2 HCl + Ba(OH)2 —> BaCl2 + 2 h3O.
-1 по отношению к соляной кислоте. Этот сборник из десяти тестовых вопросов по химии поможет вам научиться уравновешивать химические реакции. 1 Ответ. закон сохранения массы. Составные состояния [такие как (s) (aq) или (g)] не требуются. В конце химической реакции атомов не больше и не меньше, чем в начале. Пенни. Предельный реагент можно рассчитать для сбалансированного уравнения, введя число молей или вес для всех реагентов. Спасибо Писатель; Комментарий; Блют; поблагодарил писателя. Определите все этапы в своем ответе. Подсчитав количество атомов каждого элемента, мы находим, что в качестве продукта образуется только одна молекула воды. Подсказка: начните с написания сбалансированного химического уравнения. 2HC2h4O2(водн.)+Ca(OH)2(водн.)→Ca(C2h4O2)2(водн.)+2h3O(ж) Ответ представь в виде результирующего ионного уравнения. Объяснение: а. HBr (водн.) + KOH (водн.) →. Примеры полных химических уравнений для баланса: Fe + Cl 2 = FeCl 3; KMnO 4 + HCl = KCl + … Какое из следующих уравнений является правильно сбалансированным уравнением для реакции Hno3 с Caco3 2 HCl + Ba(OH)2 —> BaCl2 + 2 h3O. .. Как предсказать химические уравнения? Lv 4. Какое уравнение нейтрализации h3SO4 КОН? Химия. HCl + KOH = KCl + h30 (кислота) (основание) (соль) (вода) Процветание. Каждое … KOH(водн.) + HCl(водн.) —> KCl(водн.) + h3O(ж) ионное уравнение. 0 0. Ур. 4. Какое уравнение описывает окислительно-восстановительную реакцию? 3 0. левее. Например: KOH превращается в K+1(водн.) + OH-1 (водн.) Чтобы написать результирующее ионное уравнение… 2. Остались вопросы? Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку Balance. Неуравновешенное ионное уравнение: H+ + Cl- + Na+ + K+ + OH- —> Na+ + K+ + Cl- + HOH(l) Тогда результирующее ионное уравнение… и единственная реакция, которая происходит, это…. H+ + OH —> HOH(l) Вода представляет собой нерастворимый осадок. Соляная кислота является кислотой, потому что она содержит ион водорода. Формула соляной кислоты — HCl. Это сильная кислота. HCl + KOH = KCl + H 2 O Тип реакции: двойная замена. Пример: Рассмотрим уравнение N 2 + H 2 … Когда уравнение … 1 десятилетие назад.
.. Как предсказать химические уравнения? Lv 4. Какое уравнение нейтрализации h3SO4 КОН? Химия. HCl + KOH = KCl + h30 (кислота) (основание) (соль) (вода) Процветание. Каждое … KOH(водн.) + HCl(водн.) —> KCl(водн.) + h3O(ж) ионное уравнение. 0 0. Ур. 4. Какое уравнение описывает окислительно-восстановительную реакцию? 3 0. левее. Например: KOH превращается в K+1(водн.) + OH-1 (водн.) Чтобы написать результирующее ионное уравнение… 2. Остались вопросы? Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку Balance. Неуравновешенное ионное уравнение: H+ + Cl- + Na+ + K+ + OH- —> Na+ + K+ + Cl- + HOH(l) Тогда результирующее ионное уравнение… и единственная реакция, которая происходит, это…. H+ + OH —> HOH(l) Вода представляет собой нерастворимый осадок. Соляная кислота является кислотой, потому что она содержит ион водорода. Формула соляной кислоты — HCl. Это сильная кислота. HCl + KOH = KCl + H 2 O Тип реакции: двойная замена. Пример: Рассмотрим уравнение N 2 + H 2 … Когда уравнение … 1 десятилетие назад. Формула нейтрализации h3SO4 с помощью KOH: h3SO4(водн.) + 2KOH(водн.) —> K2SO4(водн.) + 2h3O(л). Правильное уравнение будет таким: 2KOH + h3SO4 —> K2SO4 + 2h30. Если мы впустим газ, мы достигнем насыщения при концентрации ок. Получите ответы, спросив сейчас. Химические уравнения должны быть сбалансированы, чтобы удовлетворять. Вам также может понравиться… Что такое сбалансированное молекулярное уравнение для HCl и Ba(OH)2? Соляная кислота и гидроксид натрия Здравствуйте, вы находитесь в нужном месте, чтобы узнать о реакции между соляной кислотой и гидроксидом натрия. (Коэффициенты, равные единице (1), указывать в ответах не нужно). Включите штаты. Ответ Сохранить. Формула h3SO4(водн.) + 2KOH(водн.) —> K2SO4(водн.) + 2h3O(ж) … Балансирующие уравнения: ответы на практические задачи 1. HCl+NaOH ——>NaCl+H₂O Шаг 2: In в левой части у нас есть HCl Na O Стехиометрия реакции может быть рассчитана для сбалансированного … направления, рекомендации могут … HCl (водн.) + KOH … Определите все фазы в своем ответе.
Формула нейтрализации h3SO4 с помощью KOH: h3SO4(водн.) + 2KOH(водн.) —> K2SO4(водн.) + 2h3O(л). Правильное уравнение будет таким: 2KOH + h3SO4 —> K2SO4 + 2h30. Если мы впустим газ, мы достигнем насыщения при концентрации ок. Получите ответы, спросив сейчас. Химические уравнения должны быть сбалансированы, чтобы удовлетворять. Вам также может понравиться… Что такое сбалансированное молекулярное уравнение для HCl и Ba(OH)2? Соляная кислота и гидроксид натрия Здравствуйте, вы находитесь в нужном месте, чтобы узнать о реакции между соляной кислотой и гидроксидом натрия. (Коэффициенты, равные единице (1), указывать в ответах не нужно). Включите штаты. Ответ Сохранить. Формула h3SO4(водн.) + 2KOH(водн.) —> K2SO4(водн.) + 2h3O(ж) … Балансирующие уравнения: ответы на практические задачи 1. HCl+NaOH ——>NaCl+H₂O Шаг 2: In в левой части у нас есть HCl Na O Стехиометрия реакции может быть рассчитана для сбалансированного … направления, рекомендации могут … HCl (водн.) + KOH … Определите все фазы в своем ответе. — + H_2O Ион водорода и гидроксид… Источник(и): https://shrinkurl.im/baEtR. 4 года назад. Если 90,71 мл 0,252 М КОН используется для полного титрования 15,0 мл HCl, сколько молей HCl содержится в растворе? При реакции кислоты с основанием образуются соль и вода. Ур. 4. Напишите ионное уравнение для слова уравнение. HNO3 — это химическая формула азотной кислоты, KOH — это формула, представляющая гидроксид калия, h3O — это формула воды, а KNO3 — это формула нитрата калия. писгаххимик. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет уравновешено, а XC2H5 + O2 = XOH + CO2 + h3O будет. HCl + KOH = KCl + H 2 O Сбалансированное уравнение имеет одинаковое количество атомов с обеих сторон. Напишите сбалансированные уравнения полуреакций для каждого из следующих веществ: (a) h3O2(водн.), действующий как окислитель. Химические реакции имеют такое же количество атомов до реакции, как и после реакции. Реакция водного раствора гидроксида бария и водного раствора сульфата натрия представлена сбалансированным сетевым ионным уравнением.
— + H_2O Ион водорода и гидроксид… Источник(и): https://shrinkurl.im/baEtR. 4 года назад. Если 90,71 мл 0,252 М КОН используется для полного титрования 15,0 мл HCl, сколько молей HCl содержится в растворе? При реакции кислоты с основанием образуются соль и вода. Ур. 4. Напишите ионное уравнение для слова уравнение. HNO3 — это химическая формула азотной кислоты, KOH — это формула, представляющая гидроксид калия, h3O — это формула воды, а KNO3 — это формула нитрата калия. писгаххимик. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет уравновешено, а XC2H5 + O2 = XOH + CO2 + h3O будет. HCl + KOH = KCl + H 2 O Сбалансированное уравнение имеет одинаковое количество атомов с обеих сторон. Напишите сбалансированные уравнения полуреакций для каждого из следующих веществ: (a) h3O2(водн.), действующий как окислитель. Химические реакции имеют такое же количество атомов до реакции, как и после реакции. Реакция водного раствора гидроксида бария и водного раствора сульфата натрия представлена сбалансированным сетевым ионным уравнением. Химические реакции. Так что уравнение будет. C N (KOH) × V (KOH) = C N (HCl) × V (HCl) Следовательно, C N (KOH) = C N (HCl) × V (HCl) / V (KOH) C N (KOH) = 0,1065 моль л-1 × 5,0 мл / 6,5 мл = 0,08192 моль л-1. Согласно приведенному выше уравнению: n(KOH) = n(HCl) или. 2Na(s) + 2HCl(aq) -> 2NaCl(aq) + H 2 (g) Шаг 2: Расщепление ионов. помогите сбалансировать уравнение KOH + h3SO4 —> h3O + KSO4? Гидроксид калия — это основание, а соляная кислота, ну, это кислота … И всякий раз, когда кислота и основание реагируют: кислота + основание = соль + вода. Натрий(и) + соляная кислота(вод) -> хлорид натрия(вод) + водород(г) Решение: Шаг 1: Напишите уравнение и уравняйте его. 3 BaCl2(водн.) + 2 h4PO4(водн.) = Ba3(PO4)2(т) + 6 HCl(водн.) 17. Сбалансированное уравнение реакции между HNO3 и KOH записывается как HNO3 + KOH = h3O + KNO3. Чтобы написать результирующее ионное уравнение, сначала напишите полное (полное) ионное уравнение… брякнул это. Какие два уравнения представляют собой реакции двойного замещения.
Химические реакции. Так что уравнение будет. C N (KOH) × V (KOH) = C N (HCl) × V (HCl) Следовательно, C N (KOH) = C N (HCl) × V (HCl) / V (KOH) C N (KOH) = 0,1065 моль л-1 × 5,0 мл / 6,5 мл = 0,08192 моль л-1. Согласно приведенному выше уравнению: n(KOH) = n(HCl) или. 2Na(s) + 2HCl(aq) -> 2NaCl(aq) + H 2 (g) Шаг 2: Расщепление ионов. помогите сбалансировать уравнение KOH + h3SO4 —> h3O + KSO4? Гидроксид калия — это основание, а соляная кислота, ну, это кислота … И всякий раз, когда кислота и основание реагируют: кислота + основание = соль + вода. Натрий(и) + соляная кислота(вод) -> хлорид натрия(вод) + водород(г) Решение: Шаг 1: Напишите уравнение и уравняйте его. 3 BaCl2(водн.) + 2 h4PO4(водн.) = Ba3(PO4)2(т) + 6 HCl(водн.) 17. Сбалансированное уравнение реакции между HNO3 и KOH записывается как HNO3 + KOH = h3O + KNO3. Чтобы написать результирующее ионное уравнение, сначала напишите полное (полное) ионное уравнение… брякнул это. Какие два уравнения представляют собой реакции двойного замещения.
