что, как сбалансировать и часто задаваемые вопросы —
By Падмакши Котоки
Трисульфид сурьмы представляет собой сульфидный минерал с молекулярной формулой Sb.2S3. Рассмотрим различные особенности, связанные с его реакцией с серной кислотой.
Sb2S3 + H2SO4 это необычная реакция, которая образует кислоту с выделением газа. Сб2S3 обычно встречается в природе в виде кристаллического антимонита или антимонита. Он выглядит как орторомбическая кристаллическая структура от сероватого до черного цвета. Не смешивается с водой, которая плавится при 550⁰C. ЧАС2SO4 является эффективным окислителем и дегидратирующим агентом.
В этой статье будут обсуждаться важные аспекты его реакции с Sb.2S3, такие как продукты, тип реакции, окислительно-восстановительный механизм и т. д.
Что является произведением H2SO4 и Сб2S3Сурьмяная кислота ( H3СбО4), диоксид серы (SO2) и вода (H2O) являются основными продуктами, полученными при использовании трисульфида сурьмы (Sb2S3) реагирует с серной кислотой ( H2SO4).
Sb2S3 (Водно) + 11H2SO4(водн.) —> 2H3СбО4(Водно) + 14СО2(Г) + 8H2O (L)
Какой тип реакции Н2SO4 + Сб2S3H2SO4 + Сб2S3 — это реакция одиночного смещения, также известная как реакция одиночного замещения.
Как сбалансировать H2SO4 + Сб2S3Сбалансированное химическое уравнение для H2SO4 + Сб2S3 это:
Sb2S3 + 11H2SO4 = 2H3СбО4 + 14СО2 + 8H2O
Метод проб и ошибок используется для балансировки данного химического уравнения, и шаги следующие:
- Количество атомов элементов для реагентов и продуктов подсчитывается и заносится в таблицу на первом этапе.

| атомы | Сторона реагента | Сторона продукта |
|---|---|---|
| сурьма | 2 | 1 |
| Сера | 4 | 1 |
| Кислород | 4 | 7 |
| водород | 2 | 5 |
- Элемент сурьмы, Sb, уравновешивается путем умножения соединения H3СбО4 по коэффициенту 2.
- Атомы водорода уравновешиваются путем умножения соединений H2O и H2SO4 на коэффициенты 8 и 11 соответственно.
- Наконец, сера уравновешивается путем умножения соединения SO2 на коэффициент 14, который также уравновешивает несбалансированные атомы кислорода.

- Таким образом, сбалансированное химическое уравнение:
- Sb2S3 + 11H2SO4 = 2Н3СбО4 + 14СО2 + 8H2O
Титрование Sb2S3 против Х2SO4 нецелесообразно, потому что трисульфид сурьмы ведет себя как соль сурьмы, а не как основание, не давая значительных результатов.
H2SO4 + Сб2S3 Чистое ионное уравнениеСуммарное ионное уравнение реакции H2SO4 + Сб2S3 это:
22 H+ + 11 СО42- + 2 сбн3+ + 3 с2-= 6 H+ + 2 СбО43- + 14 СО2 + 16H+ + 8 О2-
Ниже приведены шаги для получения чистого ионного уравнения:
- Записывается сбалансированное химическое уравнение, представляющее их соответствующие физические состояния.

- Sb2S3 (водн.) + 11H2SO4 (Водно) = 2H3СбО4 (водн.) + 14SO2 (г) + 8Н2О (л)
- Соединения, существующие в водной фазе, расщепляются на ионы, и, таким образом, сбалансированное результирующее ионное уравнение после диссоциации выглядит следующим образом:
- 22 H+ + 11 СО42- + 2 сбн3+ + 3 с2- = 6 Н+ + 2 СбО43- + 14 СО2 + 16H+ + 8 О2-
H2SO4 + Сб2S3 имеет следующие сопряженные пары:
- Сопряженное основание H2SO4 после отдачи протона HSO4–.
- Сопряженное основание H3СбО4 это Н2СбО4–.

- Сопряженная кислота H3СбО4 SbO43-.
- Дисперсионные силы Ван-дер-Ваальса, диполь-дипольные взаимодействия и водородные связи межмолекулярные силы между молекулами H2SO4.
- Ионные силы участвуют в H3СбО4 молекулы, так как он ионный по своей природе.
Энтальпия реакции H2SO4 + Сб2S3 не был определен, потому что ни о каком термодинамическом процессе не сообщалось.
Н2SO4 + Сб2S3 буферный растворH2SO4 + Сб2S3 смесь не будет образовывать буфер, так как H2SO4 используется.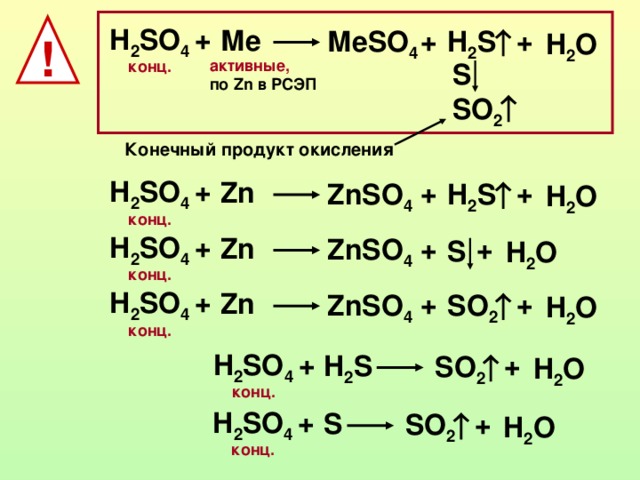 Это сильная кислота, не отвечающая условиям образования буфера.
Это сильная кислота, не отвечающая условиям образования буфера.
H2SO4 + Сб2S3 представляет собой полную реакцию, в которой Sb2S3 сочетается с Н2SO4 чтобы получить полный продукт H3СбО4, с СО2 выпущен в виде газа.
Н2SO4 + Сб2S3 экзотермическая или эндотермическая реакцияH2SO4 + Сб2S3 является экзотермической реакцией из-за выделения тепла в процессе реакции.
Н2SO4 + Сб2S3 окислительно-восстановительная реакцияH2SO4 + Сб2S3 является окислительно-восстановительной реакцией, поскольку наблюдается изменение степени окисления, при этом Sb в степени окисления +3 изменяется на состояние +5, когда мы переходим от реагентов к продуктам.
H2SO4 + Сб2S3 является реакцией осаждения, так как H3СбО4 получается в виде остатка.
Н2SO4 + Сб2S3 Обратимая или необратимая реакцияРеакция Н2SO4 + Сб2S3 носит необратимый характер, потому что образующиеся продукты нельзя обратить в реагенты в тех же условиях реакции.
Н2SO4 + Сб2S3 Реакция смещенияH2SO4 + Сб2S3 является примером реакции с одним замещением, когда сера вытесняется из H2SO4 по Сб.
ЗаключениеВ этой статье резюмируется реакция между H2SO4 и Сб2S3, где в качестве основного продукта образуется сурьмяная кислота вместе с диоксидом серы и водой. Сурьмяную кислоту в ее кристаллической форме можно использовать для регенерации гетерополикислота катализаторы. Диоксид серы в основном используется в качестве восстановителя.
Сурьмяную кислоту в ее кристаллической форме можно использовать для регенерации гетерополикислота катализаторы. Диоксид серы в основном используется в качестве восстановителя.
Какое минимальное количество 6,0 М h3SO4 необходимо для производства 25…
Recent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Микробиология
- Анатомия и физиология
- Генетика
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Financial Accounting
Social Sciences
- Psychology
Начните вводить текст, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
- 6. Химические количества и водные реакции
- Решение Стехиометрия
Задача
Соответствующее решение
2 м
Воспроизвести видео:
Привет, все продавцы спрашивали шоколад объемом 5,6. Мюллер сообщил о кислоте, которая необходима для реакции с музейным металлом для выделения 13,2 г газообразного водорода. . Итак, ниже реакция. Вспомните эту полярность. Это была мышь растворенного вещества. А как насчет лидеров решений? Потому что мы даем гранты на газообразный водород. Нам нужно перевести из граммов. Русский газ в торговых центрах, газ страсти А потом в двух торговых центрах соляная кислота. У нас 13,2 гр. Газ страсти И в одной форме газ страсти. У вас есть молярная масса, которая равна потому, что есть два водорода. Масса водорода, которая составляет 1,008 г. И это дало нам 2,016 г. И у нас есть торговые центры и газ. У вас есть две мили соляной кислоты. Дадим нам 6,55 шара соляной кислоты и теперь у них больше всего соляной кислоты в чистоте.
Связанные видео
Связанная практика
Решение Stoichiometry
By Boylanchemistry
73Views
Решение Stoichiometry — Explicated
Shied Academy
54VIEWS
. Crash Chemistry Academy
от Crash Chemistry Academy
90просмотров
Стехиометрия раствора
от Jules Bruno
184просмотров
раствор стехиометрия — обнаружение молярности, масса и объем
по репетитору органической химии
73Views
Молярность, раствор Stoichiometry и Delution Проблема
83Views070707070707070707070707.shiles 9007.shilememy 9007.shiechemy
707070707070707070707070707070707070707070707. 50views
50views
Решение задач стехиометрии решения
by Jazz Sommers
131views
Решение стехиометрии Пример 1
от Jules Bruno
168views
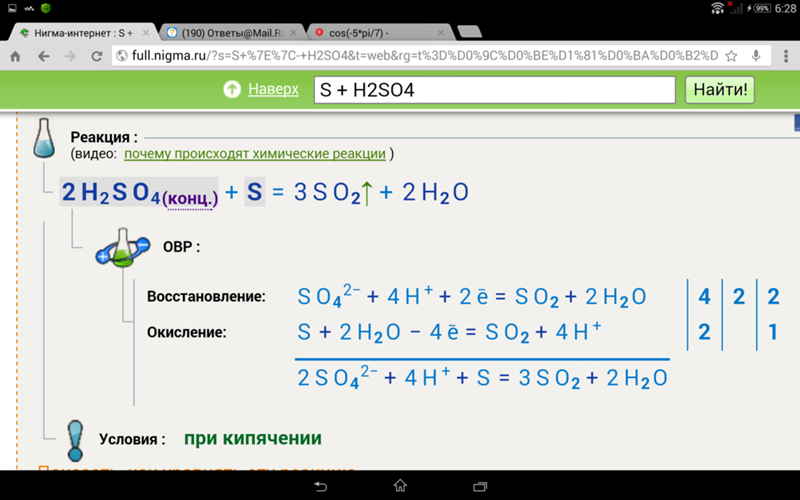
S + h3SO4 в SO2 + h3O.
ICSE-ЯЗЫК ХИМИИ-УПРАЖНЕНИЕ 1 (B)
20 видеоРЕКЛАМА
Ab Padhai каро бина адс ке
Khareedo DN Про и дехо сари видео бина киси ад ки рукаават ке!
Ответить
Пошаговое решение от экспертов, которое поможет вам в решении вопросов и получении отличных оценок на экзаменах.
Расшифровка
h3 S o4 8 телефон для рисования формы вот это таблица это по годам а вот это произведение элементов сера сера гидро
число атома серы здесь один один плюс один здесь и водород здесь к и кислород здесь 4 сера здесь один и водород здесь к и кислород 2 + 2 + 1 SO2 + 1 + 1 в первую очередь кислород вот это 4 тогда, если мы умножим это на то, что кислород является значением, тогда это кислород является балансом, и если мы x
не можем, валентность водорода равна волосу, водород равен 4, водород равен 4, так что значение x до конца также равно четырем, но также и то, что доска, что мир и мир, если мы хотим, чтобы валентная доля водорода была там сбалансирована, но сера там не валентна, поэтому сера в волосах полная это Всего сульфатов Артур 3 год, в этом году присутствует только сера x 3 и
Кальпа — это баланс, и водород также является балансом в обоих b, но это не баланс, потому что если x здесь, то получается X 38 ek число волос кислорода плюс два это плюс два это 88 молекула X в продуктах они есть только как кислород как баланс баланс
Похожие видео
Сбалансируйте следующее уравнение поэтапно.
SO2 (G)+H3S (AQ) → S (S)+H3O (L)
116056526
Текстовое решение
समीकरण को सन्तुलित कीजिए
CU+H3SO4 → H3O+SO2
225661117
Balance the following chemical equations: NaOH+h3SO4+h3O
642833622
निम्नलिखित समीकरणों को संतुलित करें-
S+h3SO4→SO2+h3O
643055996
निम्न रासायनिक समीकरणों को संतुलित करें-
h3S+ O2→h3O+SO2
643530481
Сбалансируйте следующее уравнение
Cu+h3SO4→CuSO4+SO2+h3O
643741884
Сбалансируйте следующее уравнение:
C+h3SO4→CO2+h3O+SO2.
643741986
Балансировать химические уравнения
S+HNO3 → H3SO4+NO2+H3O
643924774
САБЫЛИ Уравнение химических веществ:
CL2+SO2+H3O → H3SO4++HALSO4++HALA4+HALA4+HALA4+HDOSO4+HADO4+HDOSO4+HALA4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDOSO4+HDO.