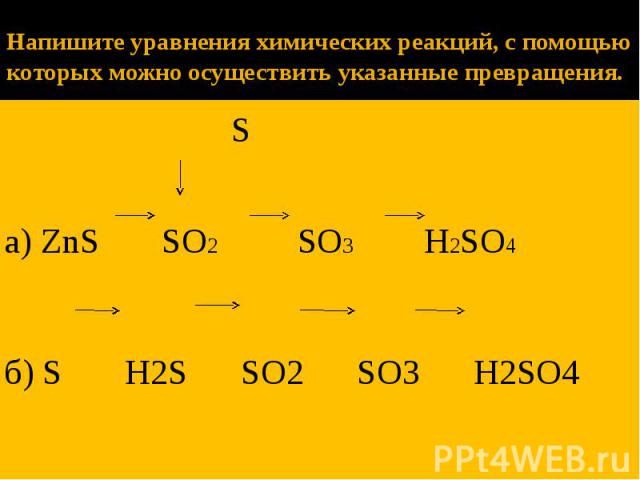
напишите уравнения реакций, удовлетворяющие схеме s-so2-so3-h3so4-na2so4-nahso4 — Знания.site
Последние вопросы
Другие предметы
4 минуты назад
Помогите выбрать! Выберите верное утверждение. Запишите правильный вариант.Химия
4 минуты назад
Сформулируйте следствия из закона Авогадро. Цинк массой 195 г растворили в избытке водного раствора гидроксида натрия. Рассчитайте объём (н.у.) водорода, выделившийся в результате этой реакцииМатематика
4 минуты назад
спростіть вираз -12a-25b+18a+14bЛитература
4 минуты назад
Английский язык
4 минуты назад
ПОМОГИТЕ СРООЧНО!!!! Составьте предложения из слов!История
4 минуты назад
СРОЧНО!!!!!повідомлення про чернечі ордениГеография
4 минуты назад
ПОЖАЛУЙСТА СРОЧНО определите особенности внутренних вод , стран западной азииХимия
4 минуты назад
І. Назва, вказати клас сполук, визначити с.о. кожного елемента..
Визначити масову частку мангану в сполуках:
1) Мn(NO 3 ) 3 -Манган (ІІІ) ?Mn) =
2) Mn 2 (SO 4 ) 3 Мангат (ІІІ) ?)=
Назва, вказати клас сполук, визначити с.о. кожного елемента..
Визначити масову частку мангану в сполуках:
1) Мn(NO 3 ) 3 -Манган (ІІІ) ?Mn) =
2) Mn 2 (SO 4 ) 3 Мангат (ІІІ) ?)=Химия
9 минут назад
Как предумать ник для ютуб канала я хачу снимать видеоРусский язык
9 минут назад
Школы, детские сады, больницы, поликлиники и т. д. Как назвать одним словом?Русский язык
9 минут назад
Русский язык, помогите, пожалуйста9 минут назад
ДАЮ 60 БАЛІВ!!!!!Творче завдання: Переписати речення, виписати дієслова, визначити час, рід (особу), число, вид, спосіб, форму дієслова1. Палкими блискавицями, мечами хотіла б я вас викувать , слова.2. Без людської праці вся земля від краю до краю заросла б бур‘яном.3. До мови доторкнешся — м‘якше м‘яких вона тобі здається.
Палкими блискавицями, мечами хотіла б я вас викувать , слова.2. Без людської праці вся земля від краю до краю заросла б бур‘яном.3. До мови доторкнешся — м‘якше м‘яких вона тобі здається.Математика
9 минут назад
Срочно! Помогите пожалуйста!(История
9 минут назад
Помогите, пожалуйста. Есть варианты ответа. Очень срочно Основой хозяйства средневековой цивилизации Европы являлось: торговля промышленность банковская деятельность ремесло сельское хозяйствоИстория
9 минут назад
Помогите, пожалуйста. Есть варианты ответа. Очень срочно. Первое столкновение русских с монголо-татарами произошло в районе реки
Вожи
Уфы
Оки
Калки
Первое столкновение русских с монголо-татарами произошло в районе реки
Вожи
Уфы
Оки
Калки
Все предметы
Выберите язык и регион
English
United States
Polski
Polska
Português
Brasil
English
India
Türkiye
English
Philippines
Español
España
Bahasa Indonesia
Indonesia
Русский
Россия
How much to ban the user?
1 hour 1 day 100 years
Патент США на способ удаления SO3/h3SO4 из дымовых газов.
 Патент (Патент № 6,803,025, выдан 12 октября 2004 г.)
Патент (Патент № 6,803,025, выдан 12 октября 2004 г.)ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
кислые газы из дымовых газов, таких как выхлопные газы, производимые угольными и мазутными коммунальными и промышленными предприятиями.
2. Описание предшествующего уровня техники
Газожидкостные контакторы и поглотители, или скрубберы, широко используются для удаления диоксида серы (SO2) и кислых газов, таких как триоксид серы (SO3), серная кислота, пары кислоты (h3SO4), паров соляной кислоты (HCl) и плавиковой кислоты (HF) из дымовых газов коммунальных и промышленных предприятий. Скрубберы обычно имеют зону охлаждения, в которой жидкая среда находится в тесном контакте с дымовым газом для удаления кислых газов путем абсорбции. Процесс, посредством которого кислые газы удаляются из дымовых газов таким образом, обычно называется мокрой сероочисткой дымовых газов (мокрая ДДГ).
Двуокись серы обычно присутствует в дымовых газах, производимых угольными и мазутными котлами, в гораздо более высоких концентрациях, чем HCl, HF и SO3. Удаление паров SO3 и серной кислоты из таких дымовых газов помогает уменьшить видимый шлейф, образующийся в результате образования тумана серной кислоты в зоне гашения систем ДДГ. Размер частиц такого тумана обычно находится в субмикронном диапазоне, что достаточно мало, чтобы туман мог проникать в большинство скрубберов ДДГ. Выбросы серной кислоты всего около 5 частей на миллион по объему обычно приводят к образованию видимого шлейфа. Поэтому желательно удалять SO3 из дымовых газов перед системой ДДГ. При сжигании угля большинство хлоридов, присутствующих в угле, превращается в HCl. HCl в дымовых газах очень эффективно удаляется системами удаления SO2 и, как следствие, может сильно концентрироваться в скрубберных растворах. Высокие концентрации хлоридов могут снизить эффективность скруббера и привести к проблемам с утилизацией. Таким образом, удаление HCl перед системой ДДГ также может быть полезным в некоторых случаях.
Удаление паров SO3 и серной кислоты из таких дымовых газов помогает уменьшить видимый шлейф, образующийся в результате образования тумана серной кислоты в зоне гашения систем ДДГ. Размер частиц такого тумана обычно находится в субмикронном диапазоне, что достаточно мало, чтобы туман мог проникать в большинство скрубберов ДДГ. Выбросы серной кислоты всего около 5 частей на миллион по объему обычно приводят к образованию видимого шлейфа. Поэтому желательно удалять SO3 из дымовых газов перед системой ДДГ. При сжигании угля большинство хлоридов, присутствующих в угле, превращается в HCl. HCl в дымовых газах очень эффективно удаляется системами удаления SO2 и, как следствие, может сильно концентрироваться в скрубберных растворах. Высокие концентрации хлоридов могут снизить эффективность скруббера и привести к проблемам с утилизацией. Таким образом, удаление HCl перед системой ДДГ также может быть полезным в некоторых случаях.
В качестве решения вышеизложенного в патенте США No. В патенте № 6126910 Wilhelm et al. , включенном сюда в качестве ссылки, говорится об использовании растворов растворимых сульфитов/бисульфитов, таких как сульфит натрия (Na2SO3), бисульфит натрия (NaHSO3), сульфит калия (K2SO2SO3$2HOH), бисульфит калия (KHSO3). ) и их смеси для удаления SO3 и других кислых газов из дымовых газов без удаления или уменьшения количества диоксида серы, также присутствующего в дымовых газах. Процесс включает в себя впрыскивание (например, распыление) концентрированного раствора, содержащего сульфит/бисульфит, в поток дымовых газов для реакции с кислыми газами (например, HCl, HF и/или SO3) и образования продукта реакции без взаимодействия с диоксидом серы. После удаления кислого(ых) газа(ов) диоксид серы может быть удален из дымового газа дальше по течению с использованием обычных методов очистки, что может быть более технически и/или экономически целесообразным в результате отсутствия SO3. Согласно Wilhelm et al., растворимая бисульфитная соль, такая как бисульфит натрия, избирательно удаляет кислые газы, такие как HCl, HF и SO3, но не удаляет диоксид серы.
, включенном сюда в качестве ссылки, говорится об использовании растворов растворимых сульфитов/бисульфитов, таких как сульфит натрия (Na2SO3), бисульфит натрия (NaHSO3), сульфит калия (K2SO2SO3$2HOH), бисульфит калия (KHSO3). ) и их смеси для удаления SO3 и других кислых газов из дымовых газов без удаления или уменьшения количества диоксида серы, также присутствующего в дымовых газах. Процесс включает в себя впрыскивание (например, распыление) концентрированного раствора, содержащего сульфит/бисульфит, в поток дымовых газов для реакции с кислыми газами (например, HCl, HF и/или SO3) и образования продукта реакции без взаимодействия с диоксидом серы. После удаления кислого(ых) газа(ов) диоксид серы может быть удален из дымового газа дальше по течению с использованием обычных методов очистки, что может быть более технически и/или экономически целесообразным в результате отсутствия SO3. Согласно Wilhelm et al., растворимая бисульфитная соль, такая как бисульфит натрия, избирательно удаляет кислые газы, такие как HCl, HF и SO3, но не удаляет диоксид серы. Вильгельм и др. учить, что, вопреки цели Wilhelm et al. В процессе реагенты, такие как карбонат натрия (Na2CO3) и известь (CaO), удаляют диоксид серы.
Вильгельм и др. учить, что, вопреки цели Wilhelm et al. В процессе реагенты, такие как карбонат натрия (Na2CO3) и известь (CaO), удаляют диоксид серы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет собой процесс, позволяющий использовать растворы карбоната натрия (Na2CO3) и бикарбоната натрия (Na2HCO3) для удаления SO3 и других кислых газов или паров из дымовых газов без удаления или снижения количество диоксида серы также присутствует в дымовых газах. В то время как растворы карбоната натрия ранее использовались для удаления SO2 в скрубберах десульфурации дымовых газов (ДДГ), настоящее изобретение использует гораздо меньшие количества раствора, вводимого в дымовой газ, так что удаление SO3 осуществляется без удаления значительных количеств SO2. Например, считается, что необходимое количество карбоната натрия/бикарбоната натрия составляет менее примерно 10-15% в молярном отношении от количества SO 2 /h3SO4, присутствующего в дымовых газах.
Важным отличием данного изобретения является использование раствора карбоната/бикарбоната натрия вместо твердого материала карбоната натрия или бикарбоната натрия. Путем введения раствора в виде аэрозоля и соответствующего выбора размера распыляемых капель и концентрации раствора аэрозоль высыхает при контакте с дымовым газом, и образующиеся сухие частицы карбоната/бикарбоната натрия имеют достаточно малый размер, чтобы обеспечить достаточную площадь поверхности для реакции. с SO3 и любыми парами h3SO4 и HCl в дымовых газах при низких концентрациях.
Другими растворимыми веществами, которые, как полагают, можно использовать аналогичным образом, являются водные растворы гидроксида натрия (NaOH) и комбинации растворов гидроксида натрия и карбоната натрия. Эти материалы можно также использовать в сочетании с растворами бисульфита, описанными Вильгельмом и др., в частности с растворами сульфита натрия, бисульфита натрия, сульфита калия и/или бисульфита калия. Растворы других щелочных солей, подобных этим соединениям, таких как гидроксид аммония (Nh5OH), гидроксид калия (KOH), карбонат калия (K2CO3) и бикарбонат калия (KHCO3), по отдельности или в комбинации, также могут использоваться в этом процессе для получения SO3. Удаление /h3SO4. В частности, считается, что раствор, содержащий гидроксид натрия, гидроксид аммония, гидроксид калия, карбонат калия и/или бикарбонат калия, с необязательными добавками сульфита натрия, бисульфита натрия, сульфита калия и/или бисульфита калия, также способен вводятся в виде спрея, размер капель и концентрация раствора которого позволяют раствору высыхать при контакте с дымовым газом, после чего они становятся эффективными для взаимодействия с парами SO3, h3SO4 и парами HCl в дымовых газах без удаления диоксида серы.
Удаление /h3SO4. В частности, считается, что раствор, содержащий гидроксид натрия, гидроксид аммония, гидроксид калия, карбонат калия и/или бикарбонат калия, с необязательными добавками сульфита натрия, бисульфита натрия, сульфита калия и/или бисульфита калия, также способен вводятся в виде спрея, размер капель и концентрация раствора которого позволяют раствору высыхать при контакте с дымовым газом, после чего они становятся эффективными для взаимодействия с парами SO3, h3SO4 и парами HCl в дымовых газах без удаления диоксида серы.
Изобретение находит особое применение на электростанциях, работающих на угле и мазуте, и может быть использовано для снижения содержания SO3, паров H3SO4 и, в некоторой степени, HCl в дымовых газах, тем самым уменьшая проблемы с коррозией и непрозрачностью шлейфа. Если добавление карбоната натрия и/или раствора бикарбоната натрия происходит перед первичным устройством контроля твердых частиц (например, ЭСП) системы ДДГ, SO3, парообразный h3SO4 и парообразный HCl могут быть удалены вместе с летучей золой, при этом потребуются минимальные изменения в процесс. Другим вариантом является добавление раствора карбоната/бикарбоната натрия перед секцией подогревателя воздуха ДДГ. Удаление SO3 в этом месте позволит модифицировать систему для снижения температуры на выходе подогревателя. Снижение температуры газа в этой точке может привести к увеличению общего КПД котла.
Другим вариантом является добавление раствора карбоната/бикарбоната натрия перед секцией подогревателя воздуха ДДГ. Удаление SO3 в этом месте позволит модифицировать систему для снижения температуры на выходе подогревателя. Снижение температуры газа в этой точке может привести к увеличению общего КПД котла.
Другие цели и преимущества настоящего изобретения будут лучше оценены из следующего подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Настоящее изобретение будет описано в качестве примера со ссылкой на прилагаемые чертежи, на которых ФИГ. 1 и 2 схематически представляют альтернативные варианты осуществления изобретения.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение представляет собой процесс использования конкретных реагентов для удаления кислых газов, таких как пары SO3, h3SO4 и пары HCl, из дымового газа перед обычным скруббером ДДГ. В изобретении используются водные растворы реагента в ограниченных концентрациях для снижения содержания SO3 в дымовых газах без снижения уровня диоксида серы в дымовых газах. Предпочтительными реагентами являются карбонат натрия и бикарбонат натрия. Считается, что другими подходящими реагентами являются гидроксид натрия, гидроксид аммония, гидроксид калия, карбонат калия и бикарбонат калия. Любой из этих реагентов можно использовать отдельно или в комбинации с необязательными добавками сульфита натрия, бисульфита натрия, сульфита калия и/или бисульфита калия.
Предпочтительными реагентами являются карбонат натрия и бикарбонат натрия. Считается, что другими подходящими реагентами являются гидроксид натрия, гидроксид аммония, гидроксид калия, карбонат калия и бикарбонат калия. Любой из этих реагентов можно использовать отдельно или в комбинации с необязательными добавками сульфита натрия, бисульфита натрия, сульфита калия и/или бисульфита калия.
Со ссылкой на фиг. 1, дымовой газ, содержащий двуокись серы и кислые газы, проходит по воздуховоду 101 к устройству контроля твердых частиц (не показано), например, ЭСО, тканевому фильтру или мокрому скрубберу. Водный раствор, содержащий один или несколько растворенных реагентов по данному изобретению, находится в контейнере 10. Раствор содержит реагент(ы) в количестве, обеспечивающем достижение концентрации реагента менее 15 молярных процентов, предпочтительно менее 10 молярных процентов, от количество диоксида серы в дымовых газах. Раствор подается с помощью насоса 105 по трубе 107 в воздуховод 101, где раствор вводится в виде аэрозоля с помощью распылительной насадки 106. Форсунка 106 распределяет водный раствор так, чтобы максимальный размер капель предпочтительно не превышал примерно от 50 до 100 микрометров, так что водная составляющая раствора быстро испаряется после введения, образуя мелкие твердые частицы из растворенного реагента. Твердые частицы реагента реагируют с SO3/h3SO4 и в некоторой степени с парами HCl, эффективно удаляя эти кислые газы из дымовых газов. Например, если реагент представляет собой карбонат натрия и/или бикарбонат натрия, конечными продуктами реакции являются сульфат натрия и хлорид натрия пропорционально относительным количествам сорбированных веществ. Показано, что дымовой газ и унесенные продукты реакции затем доставляются в рукавный фильтр 102, где высушенные соли 109собираются и удаляются. Из рукавного фильтра 102 дымовой газ проходит через второй канал 103 к расположенному ниже по потоку устройству контроля твердых частиц, где удаляется SO2.
Форсунка 106 распределяет водный раствор так, чтобы максимальный размер капель предпочтительно не превышал примерно от 50 до 100 микрометров, так что водная составляющая раствора быстро испаряется после введения, образуя мелкие твердые частицы из растворенного реагента. Твердые частицы реагента реагируют с SO3/h3SO4 и в некоторой степени с парами HCl, эффективно удаляя эти кислые газы из дымовых газов. Например, если реагент представляет собой карбонат натрия и/или бикарбонат натрия, конечными продуктами реакции являются сульфат натрия и хлорид натрия пропорционально относительным количествам сорбированных веществ. Показано, что дымовой газ и унесенные продукты реакции затем доставляются в рукавный фильтр 102, где высушенные соли 109собираются и удаляются. Из рукавного фильтра 102 дымовой газ проходит через второй канал 103 к расположенному ниже по потоку устройству контроля твердых частиц, где удаляется SO2.
Ввиду вышеизложенного настоящее изобретение предлагает способ, в некоторых отношениях аналогичный патенту США No. № 6126910 Wilhelm et al., в котором описано использование растворов бисульфита для удаления SO3 и HCl. Однако, в отличие от растворов сульфита/бисульфита, описанных Вильгельмом и др., известно, что растворы карбоната/бикарбоната натрия, а также другие щелочные растворы, предлагаемые данным изобретением, удаляют SO2. В соответствии с настоящим изобретением мелкий размер капель и низкая концентрация раствора позволяют водному раствору удалять выбранные кислые газы без уменьшения количества диоксида серы в дымовых газах. В частности, по существу весь SO2, прореагировавший в растворе, в конечном счете преобразуется, так что содержание SO2 в дымовых газах существенно не снижается. Например, SO2 будет реагировать с карбонатом натрия и бикарбонатом натрия с образованием сульфита натрия (Na2SO3) и бисульфита натрия (NaHSO3), которые, в свою очередь, вступают в реакцию с дополнительным количеством SO3 и любой HCl с образованием SO2 и образованием дополнительных количеств хлорида натрия (NaCl) и сульфат натрия (Na2SO4).
№ 6126910 Wilhelm et al., в котором описано использование растворов бисульфита для удаления SO3 и HCl. Однако, в отличие от растворов сульфита/бисульфита, описанных Вильгельмом и др., известно, что растворы карбоната/бикарбоната натрия, а также другие щелочные растворы, предлагаемые данным изобретением, удаляют SO2. В соответствии с настоящим изобретением мелкий размер капель и низкая концентрация раствора позволяют водному раствору удалять выбранные кислые газы без уменьшения количества диоксида серы в дымовых газах. В частности, по существу весь SO2, прореагировавший в растворе, в конечном счете преобразуется, так что содержание SO2 в дымовых газах существенно не снижается. Например, SO2 будет реагировать с карбонатом натрия и бикарбонатом натрия с образованием сульфита натрия (Na2SO3) и бисульфита натрия (NaHSO3), которые, в свою очередь, вступают в реакцию с дополнительным количеством SO3 и любой HCl с образованием SO2 и образованием дополнительных количеств хлорида натрия (NaCl) и сульфат натрия (Na2SO4). Общие реакции с участием карбоната натрия и бикарбоната натрия с SO3 и HCl показаны ниже:
Общие реакции с участием карбоната натрия и бикарбоната натрия с SO3 и HCl показаны ниже:
2nahco3 & plus; SO3 → NA2SO4 & Plus; H3O & Plus; 2CO2 (1)
NA2CO3 & Plus; SO3 → NA2SO4 & Plus; CO2 (2)
NAHCO3 & Plus; HCL → NACL & Plus; H3O & Plus; CO2 (3)
9 и плюс; h3O (4)Возможны также следующие реакции с участием карбоната натрия и бикарбоната натрия с SO2:
2NaHCO3+SO2→Na2SO3+h3O+2CO2 (5)0005
SO2, удаленный в ходе реакций (5) и (6), существенно преобразуется следующим образом: Следует отметить, что гидроксид натрия является еще одним растворимым веществом, которое можно аналогичным образом использовать в водном растворе отдельно или в сочетании с карбонатом натрия для удаления SO3 и HCl. Эти реакции показаны ниже:
2NaOH+SO3→Na2SO4+h3O (9)
NaOH+HCl→NaCl+h3O (10).
Впрыск растворов в соответствии с данным изобретением перед секцией подогревателя воздуха системы котлов, работающих на угле, и связанное с этим удаление SO3 обеспечивают возможность снижения температуры на выходе без создания условий коррозии. Такой вариант осуществления показан на фиг. 2, который представляет по существу ту же самую систему ДДГ, что и на фиг. 1, за исключением того, что раствор впрыскивается непосредственно перед подогревателем 110 воздуха. Подогреватель 110 увеличивает рекуперацию тепла из горячих дымовых газов, так что эффективность котла повышается, что приводит к улучшению экономических показателей. Удаление кислых газов перед подогревателем 110 позволяет избежать образования тумана серной кислоты внутри подогревателя 110 при охлаждении дымовых газов. Дополнительные преимущества, обеспечиваемые настоящим изобретением, включают потенциальное улучшение удаления летучей золы через электрофильтры благодаря улучшенному удельному сопротивлению золы в присутствии дополнительного количества натрия.
Такой вариант осуществления показан на фиг. 2, который представляет по существу ту же самую систему ДДГ, что и на фиг. 1, за исключением того, что раствор впрыскивается непосредственно перед подогревателем 110 воздуха. Подогреватель 110 увеличивает рекуперацию тепла из горячих дымовых газов, так что эффективность котла повышается, что приводит к улучшению экономических показателей. Удаление кислых газов перед подогревателем 110 позволяет избежать образования тумана серной кислоты внутри подогревателя 110 при охлаждении дымовых газов. Дополнительные преимущества, обеспечиваемые настоящим изобретением, включают потенциальное улучшение удаления летучей золы через электрофильтры благодаря улучшенному удельному сопротивлению золы в присутствии дополнительного количества натрия.
Проведены натурные испытания изобретения на электростанции мощностью 250 МВт. Одну половину газа из экономайзера установки обрабатывали распыляемым раствором, содержащим примерно 0,675 моль карбоната натрия на литр, и вводили в поток дымовых газов со скоростью от 0 до примерно 10 галлонов в минуту (от 0 до примерно 38 литров в минуту). Размер капель раствора варьировался в среднем от примерно 10 до 30 микрометров с максимальным размером менее примерно 50-100 микрометров. Измерения кислотной точки росы проводились на входе в воздухонагреватель и на выходе из электрофильтра, чтобы обеспечить измерение концентрации серной кислоты (SO3) в дымовых газах. Без впрыска раствора карбоната натрия кислотная точка росы коррелировала с концентрацией SO3 в дымовых газах примерно 30 частей на миллион. Оптимальная производительность была достигнута при расходе 5,5 гал/мин (около 20,8 л/мин) раствора карбоната натрия, что привело к концентрации SO3 в дымовых газах на выходе из электрофильтра менее примерно 2 ч/млн SO3 (что соответствует удалению примерно 93,3% SO3 из дымовых газов). Измерения перед воздухонагревателем, которые дали гораздо более короткое время реакции, были менее благоприятными, но все же обеспечили удаление примерно от 10 до примерно 40% SO3 в дымовых газах. Рассчитано количество вводимого реагента, достаточное для удаления максимум около 2% диоксида серы в дымовых газах.
Размер капель раствора варьировался в среднем от примерно 10 до 30 микрометров с максимальным размером менее примерно 50-100 микрометров. Измерения кислотной точки росы проводились на входе в воздухонагреватель и на выходе из электрофильтра, чтобы обеспечить измерение концентрации серной кислоты (SO3) в дымовых газах. Без впрыска раствора карбоната натрия кислотная точка росы коррелировала с концентрацией SO3 в дымовых газах примерно 30 частей на миллион. Оптимальная производительность была достигнута при расходе 5,5 гал/мин (около 20,8 л/мин) раствора карбоната натрия, что привело к концентрации SO3 в дымовых газах на выходе из электрофильтра менее примерно 2 ч/млн SO3 (что соответствует удалению примерно 93,3% SO3 из дымовых газов). Измерения перед воздухонагревателем, которые дали гораздо более короткое время реакции, были менее благоприятными, но все же обеспечили удаление примерно от 10 до примерно 40% SO3 в дымовых газах. Рассчитано количество вводимого реагента, достаточное для удаления максимум около 2% диоксида серы в дымовых газах. Однако не было значительного изменения концентрации диоксида серы, измеренной непрерывными мониторами диоксида серы на месте, что свидетельствует о том, что чистый эффект добавления реагента заключался в удалении SO3 без удаления каких-либо значительных количеств диоксида серы.
Однако не было значительного изменения концентрации диоксида серы, измеренной непрерывными мониторами диоксида серы на месте, что свидетельствует о том, что чистый эффект добавления реагента заключался в удалении SO3 без удаления каких-либо значительных количеств диоксида серы.
Хотя изобретение было описано с точки зрения конкретных вариантов осуществления, очевидно, что специалист в данной области техники может принять и другие формы. Соответственно, следует понимать, что изобретение не ограничено конкретными вариантами осуществления, описанными и проиллюстрированными на чертеже. Также следует понимать, что фразеология и терминология, используемые выше, предназначены для целей раскрытия вариантов осуществления и не обязательно служат в качестве ограничения объема изобретения. Вместо этого объем изобретения должен быть ограничен только следующей формулой изобретения.
Преобразование диоксида серы в триоксид серы
Триоксид серы представляет собой химическое соединение, имеющее формулу SO3. В народе его также называют ниссо сульфан.
В народе его также называют ниссо сульфан.
Триоксид серы существует во многих формах. Он присутствует в виде газообразного мономера, кристаллического тримера и твердого полимера. При температурах чуть ниже комнатной он существует в твердом состоянии.
Химическая формула | SO3 |
Плотность | 1,92 г/см сегодня |
Molar Mass | 80,066 г/моль |
Внешний вид | 8 |
. Colourless liquid and gas | |
Solubility | Soluble in water |
Boiling point | 45 °C (113 °F; 318 K) |
Температура плавления | 16,9 °C (62,4 °F; 290,0 K) |
Запах | Пары похожи на диоксид серы; однако туман не имеет запаха. |
Станд. | 256,77 ДжК-1моль-1 |
Станд. энтальпия образования | −395,7 кДж/моль |
Химические реакции триоксида серы
- Гидратация
Триоксид серы (SO3) представляет собой ангидрид серной кислоты (h3SO4). Поэтому он очень уязвим к гидратации:
SO3 + h3O → h3SO4 (ΔHf = −200 кДж/моль)
В газообразном состоянии триоксид серы сильно дымит даже в относительно сухой атмосфере. Это связано с образованием тумана серной кислоты.
SO3 является агрессивно гигроскопичным соединением. Теплоты, образующейся при гидратации, достаточно для воспламенения дерева или хлопка при смешивании с SO3. В этом случае SO3 обезвоживает сами эти углеводы.
- Реакция с основанием
Гидросульфат натрия образуется в результате реакции между триоксидом серы и гидроксидом натрия (основание).
SO3 + NaOH → NaHSO4
Превращение диоксида серы в триоксид серы
Триоксид серы образуется при окислении SO2. Преобразование диоксида серы в триоксид серы происходит естественным образом в атмосфере, и его можно проводить в лаборатории для экспериментов и в коммерческих целях для различных промышленных целей.
Преобразование диоксида серы в триоксид серы происходит естественным образом в атмосфере, и его можно проводить в лаборатории для экспериментов и в коммерческих целях для различных промышленных целей.
В атмосфере в виде кислотного дождя
Двуокись серы выбрасывается в атмосферу при сжигании топлива. Он подвергается окислению в присутствии кислорода в атмосфере с образованием SO3. Триоксид серы при воздействии влаги образует разбавленную серную кислоту, также известную как «кислотный дождь». Эта реакция протекает в очень медленном темпе в природе.
SO2 + 12O2 = SO3 (ΔH = -198,4 кДж/моль)
В экспериментальной лаборатории
Триоксид серы получают в лабораториях посредством двухстадийного пиролиза соединения бисульфата натрия.
Стадия 1:
Когда мы инициируем дегидратацию бисульфата натрия при 315 °C, происходит следующая химическая реакция:
2 NaHSO4 → Na2S2O7 + h3O
В качестве промежуточного продукта образуется пиросульфат натрия (Na2S2O7).
Стадия 2:
Пиросульфат натрия подвергают крекингу при температуре 460 °C, и происходит следующая реакция:
Na2S2O7 → Na2SO4 + SO3
Промышленное получение триоксида серы контактным способом
Серная кислота производится в промышленных масштабах с помощью процесса, известного как контактный процесс. Превращение диоксида серы в триоксид серы является важной стадией этого процесса. Он включает в себя следующие 3 этапа:
Этап 1: Получение диоксида серы
Это делается путем сжигания серы в изобилии воздуха,
S (сера) + O2 (кислород) + Δ (нагрев) → SO2 (диоксид серы)
Этап 2: Преобразование диоксида серы в триоксид серы
Этот этап является наиболее важным во всем процессе. На этом этапе преобразование диоксида серы в триоксид серы осуществляется путем смешивания SO2 с кислородом воздуха для его окисления с образованием SO3 в присутствии V2O5 в качестве катализатора.
2SO2 (диоксид серы) + O2 (кислород) + [V2O5 (катализатор)] → 2SO3 (триоксид серы)
(ΔH = −196 кДж/моль)
Эта реакция протекает при следующих условиях:
- Сера диоксид и кислород (из воздуха) смешиваются в соотношении 1:1 по объему
- Поддерживаемая температура 400-450 oC
- Поддерживаемое давление 1-2 атмосферы
- Катализатор V2O5
серная кислота
На последней стадии триоксид серы абсорбируют концентрированной серной кислотой с получением пиросерной кислоты или олеума. Олеум разбавляют контролируемым количеством воды для получения серной кислоты необходимой концентрации.
Олеум разбавляют контролируемым количеством воды для получения серной кислоты необходимой концентрации.
Превращение диоксида серы в триоксид серы Вопросы
Изучение уравнения превращения диоксида серы в триоксид серы рассмотреть условия, при которых происходит эта реакция, вызывает несколько вопросов.
- Почему SO2 и кислород смешивают в соотношении 1:1, когда уравнение ясно показывает, что для протекания реакции требуется только половина объема кислорода?
Согласно принципу Ле Шателье, когда мы увеличиваем концентрацию кислорода в смеси, мы вызываем сдвиг точки равновесия вправо. Это означает, что он увеличивает производство SO3. Поскольку кислород поступает из воздуха, который относительно свободно доступен, это недорогой способ повысить конверсию диоксида серы в триоксид серы.
- Реакция является экзотермической, поэтому более низкая температура должна способствовать протеканию реакции. Тогда почему мы не снижаем температуру ниже 400 oC?
Снижение температуры действительно поможет сместить равновесие вправо. Однако химическая кинетика говорит нам, что при более низких температурах скорость реакции замедляется. Поскольку контактный процесс используется для промышленного производства серной кислоты, время также становится важным фактором. Таким образом, 400-450 oC является оптимальной температурой, при которой мы получаем достаточно высокое образование SO3 за более короткий период.
Однако химическая кинетика говорит нам, что при более низких температурах скорость реакции замедляется. Поскольку контактный процесс используется для промышленного производства серной кислоты, время также становится важным фактором. Таким образом, 400-450 oC является оптимальной температурой, при которой мы получаем достаточно высокое образование SO3 за более короткий период.
- Поскольку количество образующихся молекул SO3 меньше, чем количество молекул в левой части уравнения, повышение давления должно способствовать протеканию реакции. Однако реакция происходит при давлении, близком к атмосферному. Почему?
Даже при низких давлениях 1-2 атмосферы мы получаем 99,5% конверсию диоксида серы в триоксид серы. Следовательно, дополнительный доход, который мы получим за счет увеличения давления, не сможет оправдать более высокие затраты, которые потребуются для поддержания более высокого давления.
Заключение
В этой статье мы узнали о трехокиси серы и ее свойствах.

 Назва, вказати клас сполук, визначити с.о. кожного елемента..
Визначити масову частку мангану в сполуках:
1) Мn(NO 3 ) 3 -Манган (ІІІ) ?Mn) =
2) Mn 2 (SO 4 ) 3 Мангат (ІІІ) ?)=
Назва, вказати клас сполук, визначити с.о. кожного елемента..
Визначити масову частку мангану в сполуках:
1) Мn(NO 3 ) 3 -Манган (ІІІ) ?Mn) =
2) Mn 2 (SO 4 ) 3 Мангат (ІІІ) ?)= Палкими блискавицями, мечами хотіла б я вас викувать , слова.2. Без людської праці вся земля від краю до краю заросла б бур‘яном.3. До мови доторкнешся — м‘якше м‘яких вона тобі здається.
Палкими блискавицями, мечами хотіла б я вас викувать , слова.2. Без людської праці вся земля від краю до краю заросла б бур‘яном.3. До мови доторкнешся — м‘якше м‘яких вона тобі здається. Первое столкновение русских с монголо-татарами произошло в районе реки
Вожи
Уфы
Оки
Калки
Первое столкновение русских с монголо-татарами произошло в районе реки
Вожи
Уфы
Оки
Калки молярная энтропия
молярная энтропия