Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.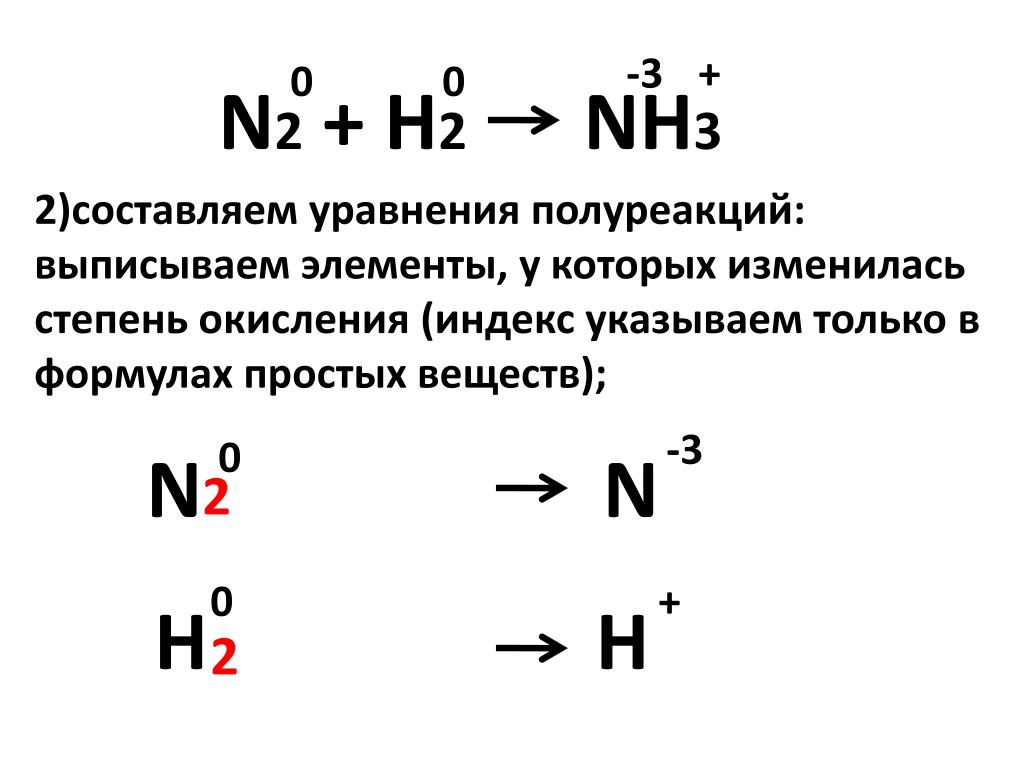
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Степень окисленности азота | Задачи 611
Задача 611.
Указать, в каких из приведенных процессов происходит окисление азота, и в каких — восстановление, как изменяется в каждом случае степень окисленности азота:
Решение:
Окисление – процесс, при котором происходит потеря элементом электронов и наблюдается повышение степени окисленности его. Восстановление – процесс, при котором эле-мент присоединяет электроны и наблюдается при этом понижение степени окисленности его.
Восстановление – процесс, при котором эле-мент присоединяет электроны и наблюдается при этом понижение степени окисленности его.
а) Окисление азота происходит в следующих процессах:
б) Восстановление азота происходит в следующих процессах:
Задача 612.
Какие из следующих реакций относятся к окислительно-восстановительным?
Решение:
Реакции, в к которых происходит изменение степеней окисленности элементов, называются окислительно-восстановительными.
В данной реакции водород повышает степень окисленности 0 до +1, т.е. отдаёт электроны, является восстановителем. Бром понижает свою степень окисленности от 0 до -1, т. е. принимает электроны, является окислителем.
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
Азот повышает степень окисленности от -3 до +1, т. е. является восстановителем. Азот иона нитрата понижает свою степень окисленности от +5 до +1, т. е. является окислителем. Данная реакция относится к окислительно-восстановительным.
е. является восстановителем. Азот иона нитрата понижает свою степень окисленности от +5 до +1, т. е. является окислителем. Данная реакция относится к окислительно-восстановительным.
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
В данной реакции элементы не изменяют свои степени окисленности, значит, реакция не является окислительно-восстановительной.
Железо повышает свою степень окисленности от 0 до +2, является восстановителем; сера понижает свою степень окисленности от 0 до -2, т.е. является окислителем. Таким образом, данная реакция является окислительно-восстановительной.
Ответ: а), в), е).
Задача 613.
Для следующих реакций указать, какие вещества и за счет каких именно элементов играют роль окислителей и какие — восстановителей:
Решение:
Уравнения ионно-молекулярного баланса:
Восстановитель ; процесс окисления;
Окислитель ; процесс восстановления.
В данной реакции оксид серы (IV) SO2 является восстановителем за счёт серы, которая отдаёт электроны и меняет степень окисленности от +4 до +6. Окислителем является бром Br2, в котором атомы брома присоединяют по одному электрону, меняя степень окисленности от 0 до -1.
Уравнения ионно-молекулярного баланса:
Восстановитель ; процесс окисления;
Окислитель ; процесс восстановления.
В данной реакции окислителем является H2SO4, в которой атомы водорода, присоединяя по одному электрону, изменяют степень окисленности от +1 до 0. Магний является восстановителем, потому что его атомы, отдавая по два электрона, изменяют степень окисленности от 0 до +2.
Уравнения ионно-молекулярного баланса:
Восстановитель процесс окисления;
Окислитель процесс восстановления.
В данной реакции окислителем является H2SO4, в котором атом серы изменяет степень окисленности от +6 до +4. Восстановителем в данной реакции является медь, атомы которой отдают по два электрона, изменяя степень окисленности от 0 до +2.
Восстановителем в данной реакции является медь, атомы которой отдают по два электрона, изменяя степень окисленности от 0 до +2.
Уравнения ионно-молекулярного баланса:
Восстановитель ; процесс окисления;
Окислитель ; процесс восстановления.
В данной реакции окислителем и восстановителем является иод I2, в котором атом иода, отдавая пять электронов, изменяет степень окисленности от 0 до +5, и, присоединяя один электрон, изменяет степень окисленности от 0 до -1. в этой реакции происходит одновременно и увеличение, и уменьшение степени окисленности атомов одного и того же элемента, значит, эта реакция относится к реакциям диспропорционирования (самоокисления-самовосстановления).
Какова роль N2 в этих двух реакциях, 3h3 + N2 —>2 Nh4 и O2 + N2 —> 2NO и почему?
Оба являются окислительно-восстановительными реакциями.
Это пример, когда одно и то же вещество действует как окислитель и восстановитель. N2 в реакции [1] является окислителем, а в реакции [2] восстановителем.
N2 в реакции [1] является окислителем, а в реакции [2] восстановителем.
Резюме
Пять важных уроков
(1) Любая химическая реакция, в которой в качестве реагента принимает участие нейтральный элемент или молекула, образующая окислительно-восстановительный потенциал, является окислительно-восстановительным продуктом.
(2) Окислитель – это вещество, которое заставляет другие терять электроны и восстанавливать эти электроны. Восстановитель – это вещество, которое теряет электроны и окисляется.
(3) Относительная окислительная способность элемента зависит от его электроотрицательности.
(4) Несвязанный элемент имеет нулевую степень окисления. Сумма степеней окисления всех атомов или ионов в нейтральном соединении равна нулю . Когда несвязанный элемент вступает в химическую реакцию, его степень окисления изменяется . Окисление включает увеличение степени окисления, а восстановление включает уменьшение степени окисления.
Когда несвязанный элемент вступает в химическую реакцию, его степень окисления изменяется . Окисление включает увеличение степени окисления, а восстановление включает уменьшение степени окисления.
(5) Вещество в присутствии более сильного донора электронов (сильного восстановителя) может действовать как окислитель. Это же вещество в присутствии более сильного акцептора электронов (сильного окислителя) может действовать как восстановитель.
Все вышеперечисленные пять уроков применимы к этим двум простым реакциям.
Давайте посмотрим на эти две реакции:
3 h3 + N2 → 2 Nh4
Разобьем уравнение на две полуреакции.
3h3 = 6H+ + 6e Окислительная реакция
h3 – окислительная с повышением степени окисления
N2 + 6e = 2N — Реакция восстановления
N2 – восстановительная с понижением степени окисления.
В целом N2 является окислителем. Это заставляет h3 терять электроны, которые N2 приобретает и восстанавливает.
O2 + N2 — > 2NO
Разбейте уравнение на две полуреакции.
N2 = 2N ++ + 4e Реакция окисления
N2 окисляется с повышением степени окисления.
O2 + 4e = 2O — Реакция восстановления
O2 восстанавливается с уменьшением степени окисления.
В целом N2 является восстановителем. О2 является окислителем. O2 заставляет N2 терять электроны, которые он приобретает и восстанавливает.
Электроотрицательность H равна 2,2. N равно 3,04, а O равно 3,44 по шкале Полинга.
В первой реакции N2 является окислителем. N2 является более электроотрицательным или более сильным акцептором электронов, чем h3. h3 является более сильным донором электронов (восстановителем), чем N2. Во второй реакции N2 является восстановителем, а O2 является окислителем. O2 является более электроотрицательным или более сильным акцептором электронов, чем N2. N2 является более сильным донором электронов (восстановителем).
N2 является более сильным донором электронов (восстановителем).
Обе эти реакции являются сложными реакциями, поскольку N2 является инертным газом. N2 состоит из двух атомов азота, соединенных тройной связью, для разрыва которой требуется очень большая энергия, поэтому известно, что N2 является инертным газом.
Какова степень окисления азота?
Последняя обновленная дата: 28 января 2023
•
Общее представление: 197,1K
•
Просмотры сегодня: 1,90K
Ответ
Проверено
197,1K+ виды
Hint: 140.1K+
. вопрос, мы должны знать о степени окисления и как их вычислить. Число окисления — это количество электронов, полученных или потерянных или общих для образования соединения из элемента.
Некоторые общие правила, которые следуют за степенью окисления, заключаются в том, что степень окисления свободного элемента всегда равна $ 0 $, степень окисления элемента группы $ 1 $ в соединении равна $ +1 $ , элемента группы $ 2 $ в соединении составляет $ +2 $, а сумма степеней окисления всех атомов в соединении равна общему заряду молекулы.
