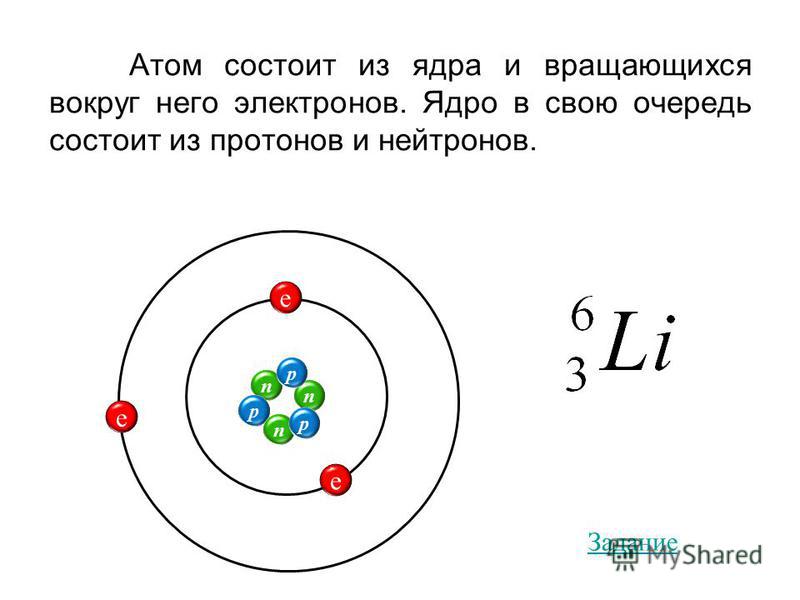
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65. 38
38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree. ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Факты о хлоре — Хлор Элемент неожиданности
Хлор — элемент с уникальными свойствами
- Газообразный элементарный хлор (Cl 2 ) представляет собой желто-зеленый газ при комнатной температуре и имеет резкий запах, похожий на запах отбеливателя, даже при очень высокой температуре. низкие концентрации.
- Хлор имеет атомный номер 17 и атомную массу 35,45, что означает, что атом хлора состоит из 17 протонов, 17 электронов и 18 нейтронов.
- Как представитель семейства галогенов Периодической таблицы, хлор очень активно взаимодействует с металлами и образует соли. Это связано с тем, что галогены имеют семь внешних кольцевых электронов («валентных электронов»), но для формирования стабильной конфигурации им требуется восемь.
 Металлы образуют ионную связь с хлором и отдают электрон галогенам, образуя стабильный «октет».
Металлы образуют ионную связь с хлором и отдают электрон галогенам, образуя стабильный «октет». - Ион хлорида (Cl – ) образует ковалентную связь с самим собой, образуя газ Cl 2 в чистом виде.
- Температура кипения хлора составляет -35⁰C (-31⁰F), а его температура плавления составляет -101⁰C (-149,8⁰F). Плотность хлора составляет 13,0 фунтов на галлон, что делает его более плотным, чем воздух. Высокая плотность газообразного хлора заставляет его тонуть при попадании в окружающую среду.
Распространены на нашей планете и за ее пределами
- Хлор является 19 -м наиболее распространенным элементом в земной коре с распространенностью 1,45 x 10 2 миллиграммов на килограмм.
- В океане хлор является третьим наиболее распространенным элементом с распространенностью 1,94 x 10 4 миллиграммов на килограмм воды.
- В целом, хлор является 23 rd наиболее распространенным элементом во Вселенной.

- В природе хлор встречается в сочетании с другими элементами, например, в солевых соединениях, карналлите и сильвите. Некоторые вулканы выделяют газообразный хлор (Cl 2 ).
- Газообразный элементарный хлор (Cl 2 ) производится с использованием хлорно-щелочного процесса, в котором используется электролиз для преобразования высококонцентрированной соленой воды (рассола) в хлор, гидроксид натрия и водород.
- Коммерческие источники хлора используют морскую воду, различные рассолы и морские залежи солей, известные как «эвапоритовые минералы».
Легко сочетается с образованием этих хорошо известных соединений, среди многих других
- Хлорид натрия (NaCl) — широко известный как обычная поваренная соль, хлорид натрия является важным компонентом рациона как людей, так и животных. Хлорид натрия является основным сырьем для получения хлора в химической промышленности.
- Соляная кислота (HCl) — сильная кислота, соляная кислота чрезвычайно полезна для титрования, взаимодействия с неизвестными основаниями для определения их состава.
 Соляная кислота также имеет множество применений, включая обработку стали и пищевых продуктов, таких как желатин и сахар, а также производство аккумуляторов. У людей он вырабатывается в желудке, чтобы помочь переваривать пищу.
Соляная кислота также имеет множество применений, включая обработку стали и пищевых продуктов, таких как желатин и сахар, а также производство аккумуляторов. У людей он вырабатывается в желудке, чтобы помочь переваривать пищу. - Поливинилхлорид (ПВХ) — большинство компаундов ПВХ изготавливаются с использованием хлорида натрия. Это чрезвычайно полезные термопласты, которые могут заменить резиновые или металлические трубы. Кроме того, они очень легкие и также используются для многих целей в сфере здравоохранения, например, в качестве трубок.
- Хлорид магния (MgCl 2 ) — содержится в морской воде и служит естественным источником металлического магния. Магний не только используется для создания сплавов для производственных процессов, но также является четвертым наиболее распространенным элементом в организме человека и необходим для питания.
Откройте для себя все продукты, которые стали возможными благодаря химии хлора, в наших деревьях продуктов хлора и гидроксида натрия.
Элемент рабочей лошадки с широким спектром важных применений
Ниже приведены некоторые основные области применения хлора:
- Вода в бассейне — убивает микробы в воде бассейна, помогая контролировать распространение болезней, передающихся через воду.
- Питьевая вода. Дезинфицирующие средства на основе хлора, составляющие основную часть процесса очистки воды, обладают остаточной дезинфицирующей активностью, которая предотвращает повторный рост патогенов в системе водоснабжения.
- Дезинфекция — отбеливающие растворы широко используются в ресторанах, школах, больницах, домах и других местах для дезинфекции поверхностей, уничтожения патогенов, включая норовирус, гепатит А, лихорадку Эбола, грипп и многие другие.
- Безопасность пищевых продуктов — дезинфицирует поверхности, контактирующие с пищевыми продуктами, а разбавленные растворы хлорного отбеливателя иногда распыляют на свежие продукты, чтобы уменьшить порчу и потенциальный рост патогенов.

- Растениеводство — используется для производства 89% из 100 самых продаваемых средств защиты растений, продаваемых в Северной Америке.
- Здравоохранение — используется для производства 88% самых продаваемых фармацевтических препаратов, продаваемых в Северной Америке, и имеет важное значение для производства многих видов медицинских изделий, таких как пакеты для крови, трубки, имплантаты и протезы из титанового сплава.
- Производство — используется в процессе производства множества промышленных соединений и продуктов, включая диоксид титана, экологически безопасные хладагенты, сверхчистый кремний, производство оксидов этилена и пропилена, гликолей, синтетического глицерина, тетраэтилсвинца, фосгена и т. д.
- Бумага — используется в качестве окислителя и отбеливателя в целлюлозно-бумажной промышленности.
Хлор — Протоны — Нейтроны — Электроны
Хлор представляет собой желто-зеленый газ при комнатной температуре. Это чрезвычайно реактивный элемент и сильный окислитель: среди элементов он имеет самое высокое сродство к электрону и третье место по величине электроотрицательности, уступая только кислороду и фтору.
Хотя химия хлора, пожалуй, наиболее известна своей ролью в обеспечении чистой питьевой водой, она также помогает производить энергоэффективные строительные материалы, электронику, волоконную оптику, солнечные батареи, 93 процента жизненно важных фармацевтических препаратов, 86 процентов средств защиты растений, медицинские пластмассы и многое другое.
Элементарный хлор в промышленных масштабах производится из рассола путем электролиза, преимущественно в хлорно-щелочном процессе.
Протоны и нейтроны в хлоре
Хлор это химический элемент с атомным номером 17 , что означает, что в его ядре 17 протонов. Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1,602 x 10 -19 кулонов .
Общее количество нейтронов в ядре атома называется номер нейтрона атома и обозначен символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избытка нейтронов : D = N – Z = A – 2Z.
Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избытка нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно существует множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Хлор 35; 37.
Основные изотопы хлора
Хлор имеет два стабильных изотопа, 35Cl и 37Cl. Это единственные два природных изотопа, встречающиеся в большом количестве: 35Cl составляет 76% природного хлора, а 37Cl — оставшиеся 24%. Самый долгоживущий радиоактивный изотоп — 36Cl, период полураспада которого составляет 301 000 лет. Все остальные изотопы имеют период полураспада менее 1 часа, многие менее одной секунды.
Хлор-35 состоит из 17 протонов, 18 нейтронов и 17 электронов.
Хлор-37 состоит из 17 протонов, 20 нейтронов и 17 электронов.
Хлор-36 состоит из 17 протонов, 19 нейтронов и 17 электронов. Следовые количества радиоактивного 36 Cl существуют в окружающей среде в соотношении примерно 7×10 −13 к 1 со стабильными изотопами. 36 Cl образуется в атмосфере в результате расщепления 36 Ar при взаимодействии с протонами космических лучей.
Стабильные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
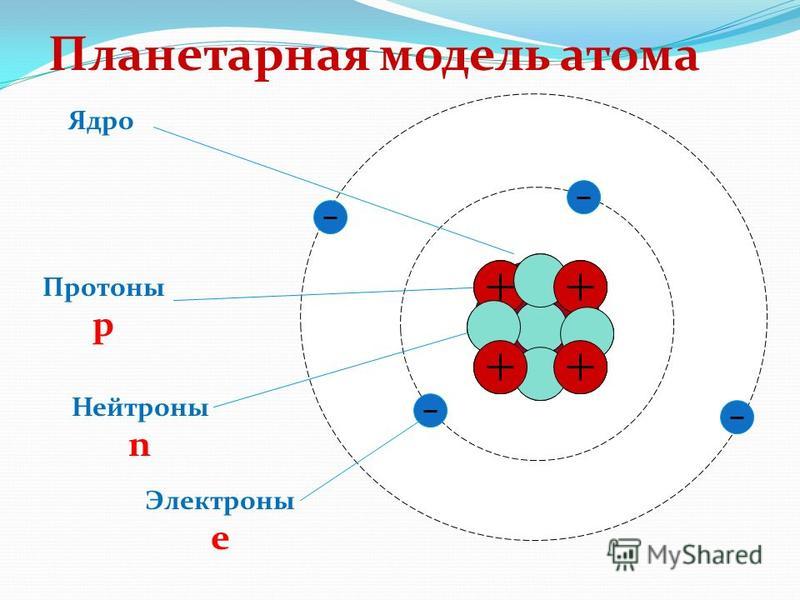
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме Хлора равно 17. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение определяют химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Хлор : [Ne] 3s2 3p5 .
Возможные степени окисления +1,5,7/-1 .
Это чрезвычайно реактивный элемент и сильный окислитель: среди элементов он имеет самое высокое сродство к электрону и третье место по величине электроотрицательности по шкале Полинга, уступая только кислороду и фтору. Из-за его большой реакционной способности весь хлор в земной коре находится в виде ионных соединений хлора, к которым относится и поваренная соль. Это второй по распространенности галоген (после фтора) и двадцать первый по распространенности химический элемент в земной коре.
Обычное соединение хлора
Простейшим соединением хлора является хлористый водород, HCl, основное химическое вещество в промышленности и лаборатории, как в виде газа, так и растворенного в воде в виде соляной кислоты. Его часто получают путем сжигания газообразного водорода в газообразном хлоре или как побочный продукт хлорирования углеводородов. Хлороводородный газ и соляная кислота имеют важное значение в технике и промышленности.
Его часто получают путем сжигания газообразного водорода в газообразном хлоре или как побочный продукт хлорирования углеводородов. Хлороводородный газ и соляная кислота имеют важное значение в технике и промышленности.
О протонах
Протон — это одна из субатомных частиц, из которых состоит материя. Во Вселенной много протонов, составляющих около половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/с 2 ) — немного легче, чем у нейтрона, но почти в 1836 раз больше, чем у нейтрона. раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и это спин — ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонов связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома.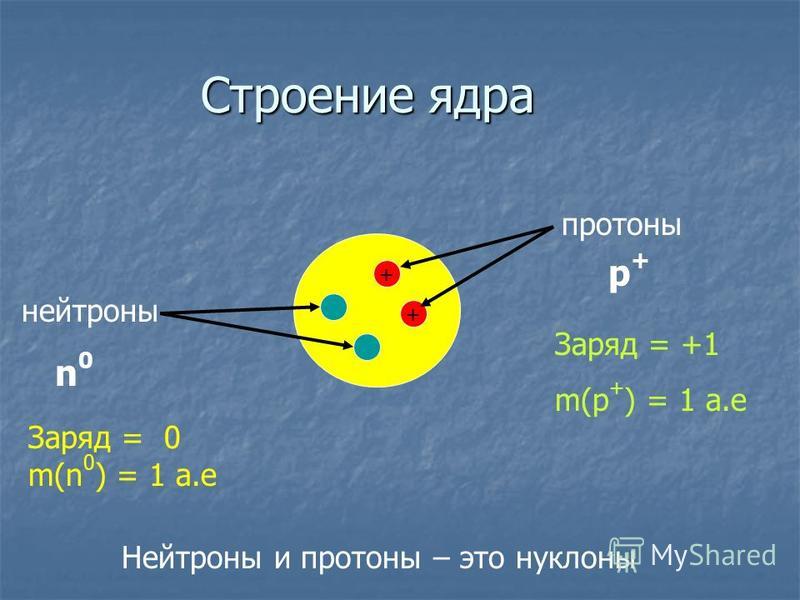 Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон — это одна из субатомных частиц, из которых состоит материя. Во Вселенной нейтронов много, и они составляют 90 103 больше половины 90 104 всей видимой материи. не имеет электрического заряда и имеет массу покоя, равную 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой из-за своего положительного заряда. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильные ядра .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны , что помогает компенсировать электрическое отталкивание между протонами. В результате, по мере увеличения числа протонов требуется возрастающее отношение нейтронов к протонам , чтобы сформировать стабильное ядро. Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или захвату электронов. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующим выбросом гамма-излучения . Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств.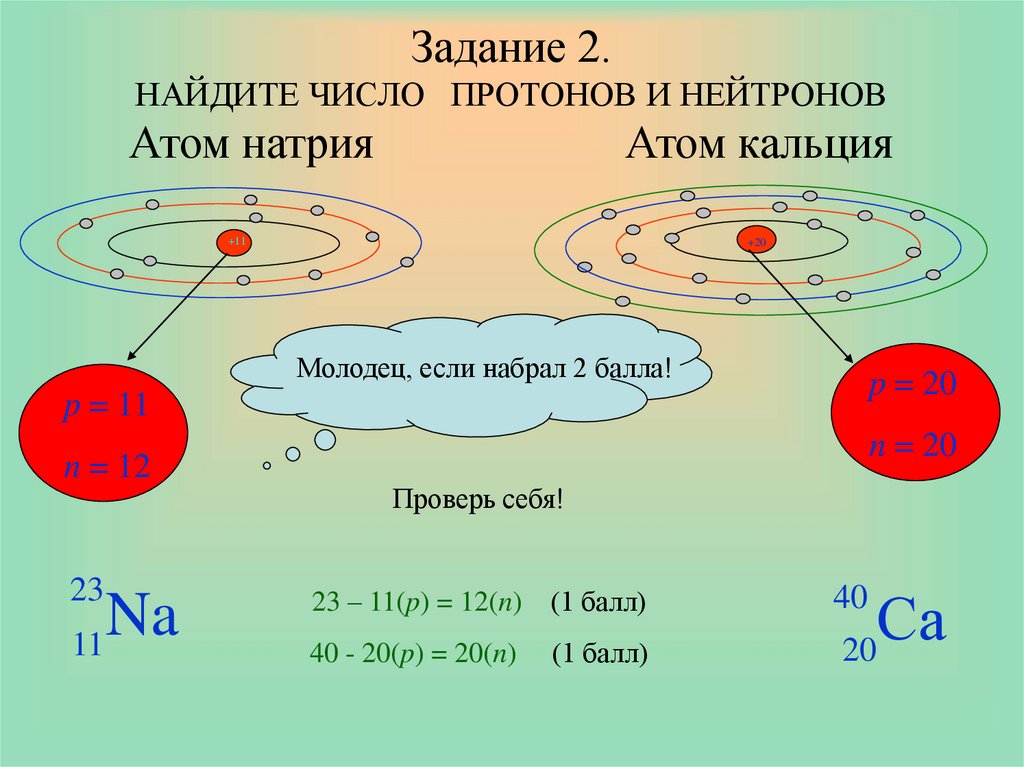 Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронная конфигурация различных атомов полезна для понимания структуры периодической таблицы элементов.
Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронная конфигурация различных атомов полезна для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические свойства атома определяются количеством протонов, фактически количеством и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип запрета Паули , который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии.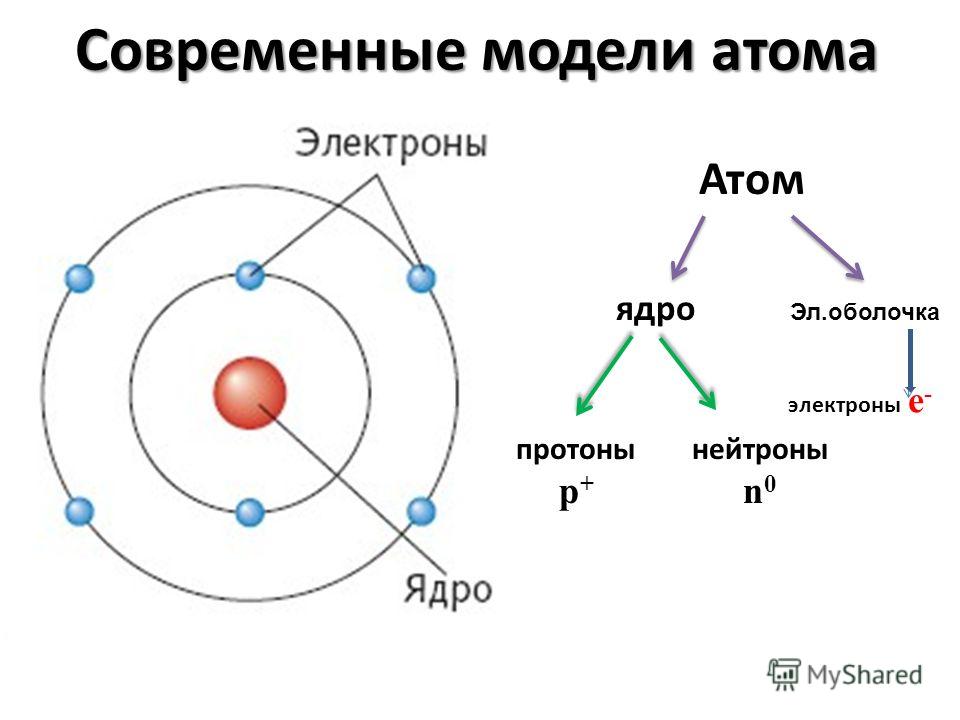 Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочек. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d представляет собой 10 средних столбцов периодической таблицы, а блок f представляет собой раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена как основные электроны, эквивалентные благородному газу предыдущего периода, и валентные электроны (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме.

 Металлы образуют ионную связь с хлором и отдают электрон галогенам, образуя стабильный «октет».
Металлы образуют ионную связь с хлором и отдают электрон галогенам, образуя стабильный «октет».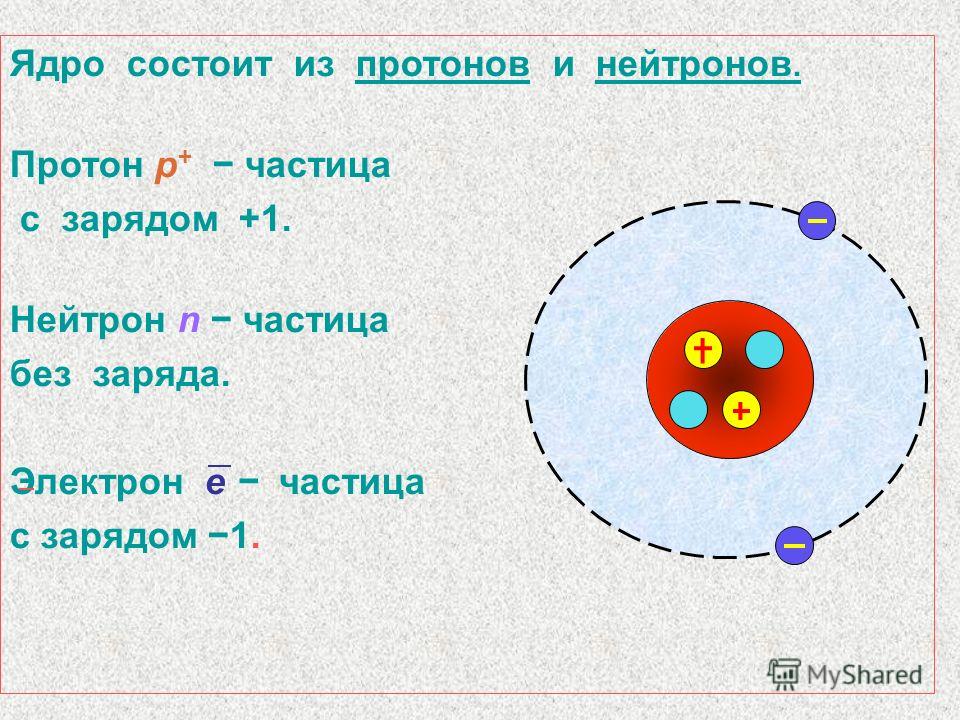
 Соляная кислота также имеет множество применений, включая обработку стали и пищевых продуктов, таких как желатин и сахар, а также производство аккумуляторов. У людей он вырабатывается в желудке, чтобы помочь переваривать пищу.
Соляная кислота также имеет множество применений, включая обработку стали и пищевых продуктов, таких как желатин и сахар, а также производство аккумуляторов. У людей он вырабатывается в желудке, чтобы помочь переваривать пищу.