Как определить число протонов и нейтронов в атоме? Примеры.
Как определить число нуклонов в ядре атома?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как определить число протонов в атоме?
Число протонов в атоме равно заряду его ядра (обозначается как Z) или порядковому номеру элемента в периодической таблице Менделеева.
Как определить число нейтронов в атоме?
Очень просто!
N = A – Z
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а. е.м.
е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Примеры
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а.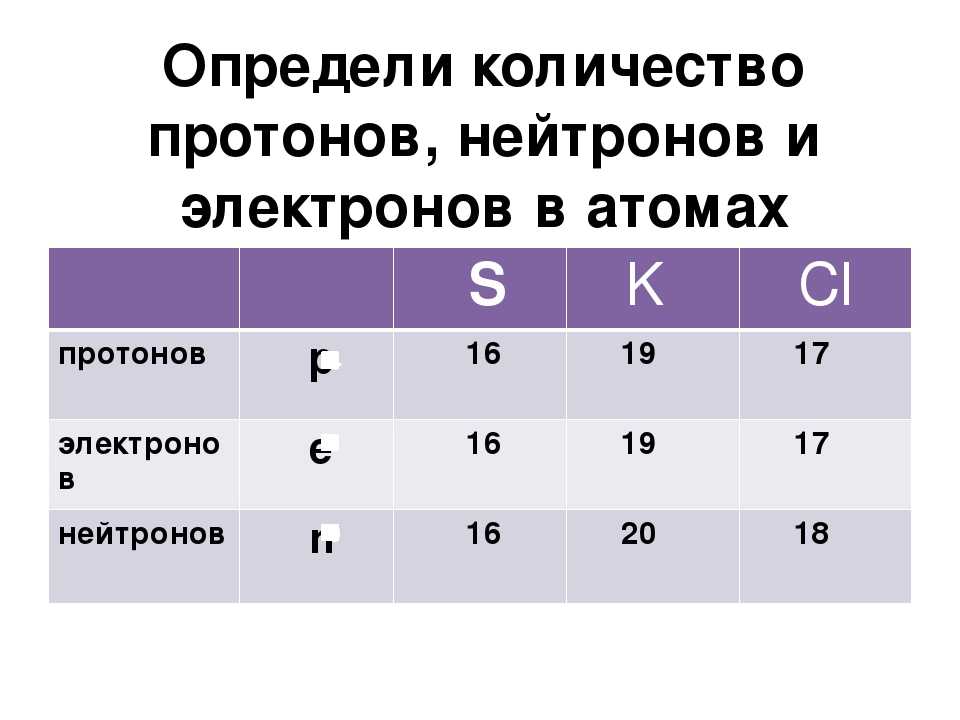 е.м.
е.м.
Z (Na) = 11 (протонов)
N = Ar (Na) – Z (Na) = 23 – 11 = 12 (нейтронов)
Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.
Z (P) = 15 (протонов)
N = Ar (P) – Z (P) = 31 – 15 = 16 (нейтронов)
Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.
Z (Au) = 79 (протонов)
N = Ar (Au) – Z (Au) = 197 – 79 = 118 (нейтронов)
Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.
Z (Si) = 14 (протонов)
N = Ar (Si) – Z (Si) = 28 – 14 = 14 (нейтронов)
Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.
Z (C) = 6 (протонов)
N = Ar (C) – Z (C) = 12 – 6 = 6 (нейтронов)
Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.
Z (K) = 19 (протонов)
N = Ar (K) – Z (K) = 39 – 19 = 20 (нейтронов)
Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.
Z (Fe) = 19 (протонов)
N = Ar (Fe) – Z (Fe) = 56 – 26 = 30 (нейтронов)
Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Ar (Al) = 27 а.е.м.
Z (Al) = 13 (протонов)
N = Ar (Al) – Z (Al) = 27 – 13 = 14 (нейтронов)
Ответ: число протонов в атоме алюминия равно 13, а число нейтронов в атоме алюминия равно 14 .
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.
Z (F) = 9 (протонов)
N = Ar (F) – Z (F) = 19 – 9 = 10 (нейтронов)
Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а. е.м.
е.м.
Z (Cl) = 17 (протонов)
N = Ar (Cl) – Z (Cl) = 35 – 17 = 18 (нейтронов)
Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.
Z (O) = 8 (протонов)
N = Ar (O) – Z (O) = 16 – 8 = 8 (нейтронов)
Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.
Z (S) = 16 (протонов)
N = Ar (S) – Z (S) = 32 – 16 = 16 (нейтронов)
Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.
Z (Mg) = 16 (протонов)
N = Ar (Mg) – Z (Mg) = 24 – 12 = 12 (нейтронов)
Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.
Z (Zn) = 30 (протонов)
N = Ar (Zn) – Z (Zn) = 65 – 30 = 35 (нейтронов)
Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
ЕГЭ. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение атома 11 класс
Тема 2: Строение атома. Периодический закон
Урок 4: ЕГЭ. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение атома
- Видео
- Тренажер
- Теория
Заметили ошибку?
Задания с выбором ответов
|
Вопрос |
Комментарий |
|
А1. Из каких частиц состоит атомное ядро?
|
Атом – это электронейтральная частица, состоящая из протонов, нейтронов и электронов. Правильный ответ 2. |
|
А2. Что такое изотопы?
|
Изотопы – это атомы одного химического элемента. У них одинаковое число электронов и протонов в атоме, но разное число нейтронов и поэтому разная масса. Правильный ответ 3. |
|
А3. Что называется химическим элементом?
|
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Правильный ответ 1. |
|
А4. Какая частица состоит из 8 протонов, 10 нейтронов и 8 электронов?
|
Находим в периодической системе элемент № 8. Это кислород. Прибавив к 8 протонам 10 нейтронов, получим массу атома 18. Это 18О. Правильный ответ 2. |
|
А5. Электронная формула атома химического элемента – 1s22s22p63s23p4. Укажите знак элемента и формулу его высшего оксида.
|
Нужно просуммировать количество электронов, которое равно количеству протонов.
Правильный ответ 3. |
|
А6. Наиболее сильно выражены металлические свойства у:
|
Чем левее и ниже элемент расположен в Периодической системе, тем ярче выражены его металлические свойства. Все приведенные элементы, кроме фосфора, находятся в 6 группе. Фосфор – это типичный неметалл. Теллур (Те) находится ниже всех в группе. Правильный ответ 4. |
|
А7. Число электронов в атоме равно:
|
Атом – это электронейтральная частица, поэтому число электронов равно числу протонов. Правильный ответ 2. |
|
А8. К р-элементам относится:
|
Al находится в III-A группе. Электронное строение внешнего энергетического уровня …3s23p1. Правильный ответ 4. |
|
А9. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
|
По группе сверху вниз атомные радиусы увеличиваются, а по периоду слева направо – уменьшаются.
Правильный ответ 2. |
|
А10. Химический элемент расположен в IV периоде I-A группе.
|
Это 19К. Сумма электронов в ряду должна быть равна 19.
Правильный ответ 3. |
А11. Бром – это элемент
|
Бром – это галоген, элемент главной подгруппы VII группы.
Правильный ответ 3. |
|
А12. Элементу с зарядом ядра +12 соответствует высший оксид:
|
По заряду ядра находим этот элемент в Периодической системе.
Правильный ответ 1. |
А13. Электроное строение внешнего энергeтического уровня атома кремния: 1. …2s22p2 2. …3s23p2 3. …2s22p4 4. …3s23p4 |
Кремний находится в 3-ем периоде, поэтому у него три энергетических уровня. Не учитываем варианты с цифрой 2. Так как Si – в IV группе, то валентных электронов 4. Только во втором варианте сумма электрона равна 4.
Правильный ответ 2. |
Задания на соответствие
Задания с кратким ответом
В3. Химический элемент железо представлен в природе несколькими изотопами: 54Fe, 56Fe, 57Fe, 58Fe. Определить, сколько протонов содержат атомы всех этих изотопов.
Определить, сколько протонов содержат атомы всех этих изотопов.
При обозначении изотопов вверху пишется массовое число, т. е. сумма масс протонов и нейтронов. Для определения числа протонов нужно посмотреть положение железа в Периодической системе. Порядковый номер железа – 26, значит, ядро атома железа содержит 26 протонов.
Правильный ответ 26.
В4. Определить, сколько нейтронов содержит ядро атома изотопа неона-22.
Для определения числа нейтронов нужно посмотреть положение неона в Периодической системе. Порядковый номер неона – 10. Это количество протонов. Вычитаем из массового числа количество протонов, получаем число нейтронов. Это 12.
Правильный ответ 12.
В5. Какой заряд ядра имеют изотопы химического элемента фтора?
Порядковый номер фтора – 9. Значит, заряд его ядра будет равен +9.
Правильный ответ +9
В6. Ядро атома одного из изотопов калия содержит 21 нейтрон. Определить массовое число данного изотопа.
Определить массовое число данного изотопа.
Массовое число равно сумме количества нейтронов и протонов. Нужно сложить число протонов (19) и число нейтронов (21).
Правильный ответ 40.
В7. Определить число нейтронов в ядре атома фосфора -31.
Вычитаем из массового числа (31) его порядковый номер (15) получаем число нейтронов. Это 16.
Правильный ответ 16.
В8. Под номерами 1-3 в колонке слева приведены ряды химических элементов. Укажите, какими буквами в колонке справа обозначены закономерности, на основе которых составлен каждый из этих рядов.
|
1. Na, Mg, Al, Si, P, S, Cl |
А) Электроотрицательность уменьшается |
|
2. F, O, N, Cl |
Б) Изменяется характер химических свойств высших оксидов: основные свойства ослабевают, кислотные усиливаются |
|
3. |
В) Неметалличность свойств простых веществ, образованных химическими элементами, усиливается |
|
|
Г) Степени окисления атомов химических элементов в соединении с кислородом увеличиваются |
|
|
Д) Степени окисления атомов химических элементов в соединении с водородом увеличиваются |
|
|
Е) Радиусы атомов увеличиваются |
|
|
Ж) Степень окисления атомов в высших оксидах одинакова |
Комментарий к В8. При решении этого задания нужно вспомнить таблицу, которая приводилась в предыдущем уроке.
Закономерности изменения периодических свойств приведены в Табл. 1.
1.
|
Параметр |
По группе вниз |
По периоду вправо |
|
Заряд ядра |
Увеличивается |
Увеличивается |
|
Число валентных электронов |
Не меняется |
Увеличивается |
|
Число энергетических уровней |
Увеличивается |
Не меняется |
|
Радиус атома |
Увеличивается |
Уменьшается |
|
Электроотрицательность |
Уменьшается |
Увеличивается |
|
Металлические свойства |
Увеличиваются |
Уменьшаются |
|
Степень окисления в высшем оксиде |
Не меняется |
Увеличивается |
|
Степень окисления в водородных соединениях (для элементов IV-VII групп) |
Не меняется |
Увеличивается |
Табл.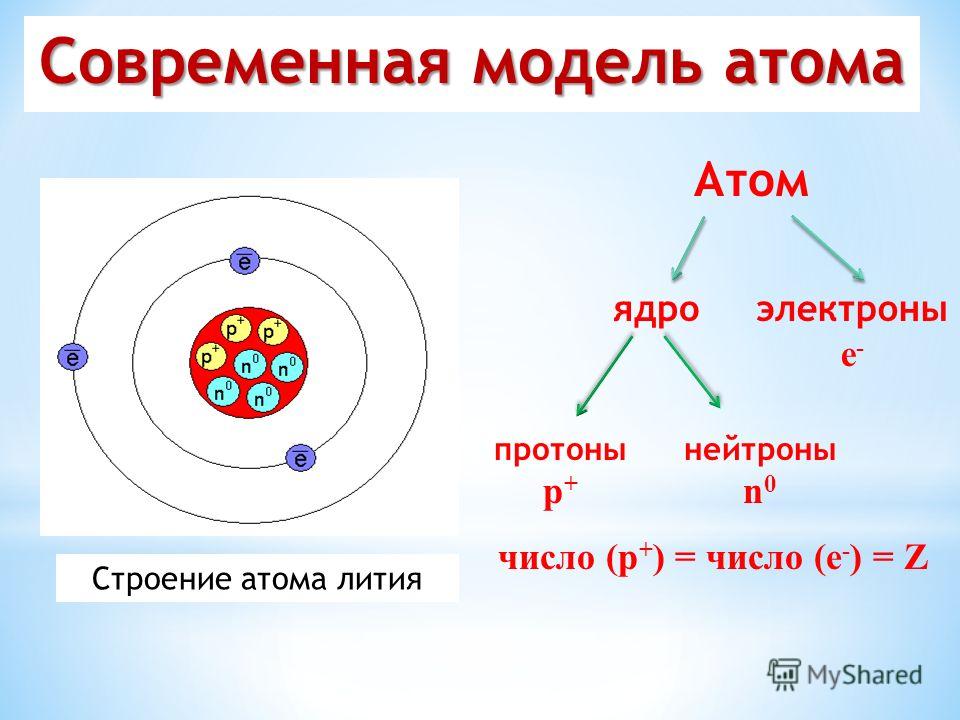 1.
1.
Представленные в вопросе элементы находятся либо в одном периоде, либо в одной группе.
- Na, Mg, Al, Si, P, S, Cl соответствуют варианты Б, В, Г
- F, O, N, Cl не соответствуют ни один из вариантов
- Be, Mg, Ca, Sr, Ba соответствуют варианты А, Е, Ж
Правильный ответ 1-Б В Г; 2-; 3-А Е Ж.
Задания с развернутым ответом
|
Вопрос |
Комментарий |
|
С1. Опишите химические свойства элемента с порядковым номером 23 по его положению в Периодической системе. |
Элемент № 23 – это ванадий V. Это металл, т. к. он находится в побочной подгруппе V группы, в 4-ом периоде. Его электронная конфигурация: 1s22s22p63s23p64s23d3. Летучих водородных соединений не образует. Высший оксид V2O5 – кислотный оксид. Как металл отдает свои валентные электроны. |
|
С2. Элемент образует высший оксид состава ЭО3. В летучем водородном соединении массовая доля водорода составляет 5,88 %. Рассчитайте относительную атомную массу элемента и назовите его. |
По формуле высшего оксида понятно, что элемент находится в VI группе. Формула водородного соединения – Н2Э. Массовая доля равна отношению массы элемента к суммарной массе соединения. Пусть атомная масса элемента будет Х. Тогда , отсюда Х = 200 : 5,88 — 2 = 32. Значит этот элемент – сера S. |
Подведение итога урока
На уроке были рассмотрены задачи ЕГЭ по теме «Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома». Мы научились характеризовать общие свойства химических элементов и их соединений на основе положения в химической системе Д. И. Менделеева.
Список литературы
- Рудзитис Г.
 Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. - Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Учебно-тренировочные материалы для подготовки к единому государственному экзамену. Химия / Каверина А. А., Добротин Д. Ю., Медведев Ю. Н., Корощенко А. С. – М.: Интеллект- Центр, 2011.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Официальный информационный портал Единого Государственного Экзамена (Источник)
- Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «Химик» (Источник)
Домашнее задание
- №№ 1-3 (с. 7) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.
 Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. - Какие закономерности наблюдают в изменении атомных радиусов в периодах слева направо и при переходе от одного периода к другому?
- Высший оксид состава RO3 образует элемент с электронной конфигурацией внешнего электронного слоя: 1) ns2np1; 2) ns2np3; 3) ns2np4; 4) ns2np6. Назовите этот элемент.
Заметили ошибку?
Расскажите нам об ошибке, и мы ее исправим.Видеоурок: ЕГЭ. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение атома по предмету Химия за 11 класс.
Физика атомного ядра
Тип урока: урок повторения, систематизации и обобщения знаний, закрепления умений.
Форма урока: повторительно-обобщающий.
Цель урока:
обеспечение в ходе урока повторения основных
элементов и понятий темы «Физика атомного
ядра»: состав атомного ядра, изотопы, дефект
массы, энергия связи, радиоактивность, — распад, -излучение,
энергия распада, закон радиоактивного распада,
термоядерный синтез, ядерный реактор, ядерное
оружие, биологическое действие радиоактивных
излучений, закрепления умений решать задачи на
расчет дефекта массы.
Задачи:
- диагностировать уровень усвоения учащимися темы «Физика атомного ядра», для планирования последующих этапов учебного процесса;
- развивать познавательные способности учащихся в ходе решения задач и объяснения вопросов, формировать приемы умственной деятельности в процессе решения задач тестового типа по теме «Физика атомного ядра»;
- воспитывать самостоятельность через организацию самостоятельной работы;
- формировать у учащихся оценочные умения, критическое отношение к уровню своей подготовки через самопроверку выполняемых на уроке заданий и заполнение оценочного листа;
- осуществлять подготовку к итоговой аттестации, в ходе повторения ранее изученных тем.
Оборудование: учебник В.А.Касьянова «Физика -
11», компьютер, проектор, слайды с тестовыми
заданиями, ответами на все выполняемые в ходе
урока задания, листы самооценки.
Этапы урока
| Этап | Цель | Время | Методы и приемы обучения | |
| 1 | Организационный момент | Создать положительный настрой на урок | 1 мин | Приветственное слово учителя. |
| 2 | Постановка цели | Сформулировать цель урока | 2 мин | Рассказ. |
| 3 | Актуализация знаний | Выявить уровень знания формул по темам: «Физика атомного ядра», повторить основные формулы по теме «Электродинамика» | 9мин | Физический диктант, самопроверка |
| 4 | Оперирование знаниями и способами деятельности в различных ситуациях | Повторить основное содержание темы «Физика атомного ядра» | 10мин | Фронтальная беседа, коллективная работа по выполнению заданий тестового типа |
| Диагностировать умения учащихся решать задачи по теме «Физика атомного ядра» | 20мин | Самостоятельная работа/ мини ЕГЭ | ||
| 5 | Подведение итогов | Определить пробелы в обучении, мотивировать учащихся с помощью поощрения за успехи в усвоении темы | 2мин | Самопроверка. Заполнение «Листа самооценки» |
| 6 | Домашнее задание | Разъяснить домашнее задание | 1 мин | Сообщение |
Ход урока
1.Организационный момент.
Здравствуйте, ребята. Я рада видеть вас на уроке физики. Вижу полную готовность класса и желание узнать, что же вас ждет сегодня.
2. Постановка цели
Сегодня на уроке я предлагаю вам побывать на
месте пилота, который перед реальным полетом (для
вас — контрольной работой) проходит тестирование
на тренажерах, проверяет свои умения и навыки
действовать как в знакомой, так и не совсем
знакомой ситуации. Для этого каждый из вас
получил «Лист самооценки». В ходе урока вы
самостоятельно будете фиксировать полученные
результаты на каждом этапе урока, причем каждый
балл будет свидетельствовать о качестве ваших
знаний, а в конце урока мы посмотрим, кто же из вас
является самым подготовленным пилотом, т. е.
насколько каждый из вас готов к контрольной
работе. Подпишите свой лист.
е.
насколько каждый из вас готов к контрольной
работе. Подпишите свой лист.
Цель нашего урока проверить знание теоретического материала по теме «Физика атомного ядра», закрепить умения составлять уравнения ядерных реакций, решать задачи на расчет дефекта массы, энергии связи, параметров, характеризующих работу АЭС, закон радиоактивного распада, а так же помочь разобраться с «трудными вопросами» тем учащимся, которые недостаточно усвоили материал.
3. Актуализация знаний
Для достижения цели урока нам необходимо повторить основные формулы по теме «Физика атомного ядра».
«Физический диктант», проводит учитель.
1) Два ученика работают у доски. Остальные в тетрадях.
Записать формулы:
1. Закон радиоактивного распада.
2. Энергия связи нуклонов в ядре.
3.Уравнение альфа-распада ядра атома.
4. Дефект массы.
5. Уравнение бета-распада ядра атома.
Проверка выполнения задания учащимися у доски. Самопроверка.
За каждый правильный ответ 1 балл. Учащиеся проставляют свои результаты в «Листы самооценки»
2) Продолжаем работу, вспомним формулы по теме «Электродинамика».
«Физический диктант», вопросы задают ученики.
Два ученика работают у доски. Остальные в тетрадях.
Записать формулы (например):
1. Закон Кулона.
2. Магнитный поток.
3. Сила Лоренца.
4.Закон Ома для замкнутой цепи.
5.Формула Томсона.
Проверка выполнения задания учащимися у доски. Самопроверка.
За каждый правильный ответ 1 балл. Учащиеся проставляют свои результаты в «Листы самооценки»
4. Оперирование знаниями и способами деятельности
1) Для обобщения и закрепления материала, поработаем устно с тестом (задания на экране). Предварительно вспомним алгоритм решения задач по теме «Физика атомного ядра»
Учащиеся дают ответы с обязательным
комментарием к ним.
Тест.
1. Чему равно число протонов (Z) и нейтронов (N) в атоме фосфора 15 P31?
1) Z= 15, N =31
2) Z= 31, N =15
3) Z=15, N =16
4) Z=16, N =15
2. Во сколько раз заряд изотопа азота с массовым числом 13 и порядковым номером 7 больше заряда протона?
1) 1
2) 13/7
3) 13
4) 7
3. Ядро магния захватило электрон и испустило протон. Каковы заряды и массовые числа ядра, образовавшегося в результате этой реакции?
1) зарядовое число 10, массовое число 20
2) зарядовое число 10, массовое число 21
3) зарядовое число 12, массовое число 20
4) зарядовое число 14, массовое число 22
4. Каково соотношения между массой mя атомного ядра и суммой масс свободных протонов Zmp и свободных нейтронов Nmn, входящих в состав ядра?
1) mя = Zmp + Nmn
2) mя > Zmp + Nmn
3) mя < Zmp + Nmn
4) нельзя сказать однозначно
5. Ниже записана ядерная реакция, а в скобках
указаны массы (в атомных единицах массы)
участвующих в ней частиц.
Ниже записана ядерная реакция, а в скобках
указаны массы (в атомных единицах массы)
участвующих в ней частиц.
Поглощается или выделяется энергия при этой реакции?
1) поглощается
2) выделяется
3) не поглощается и не выделяется
4) для решения недостаточно достаточно
6. Реакция деления ядер урана идет с большим выделением энергии. Эта энергия выделяется в основном в виде
1) энергии радиоактивного излучения
2) энергии -квантов
3) кинетической энергии свободных нейтронов
4) кинетической энергии осколков деления ядер
7. В недрах Солнца температура достигает десятков миллионов градусов. Чем это объясняется?
1) быстрым вращением Солнца вокруг своей оси
2) делением тяжелых ядер
3) термоядерным синтезом легких ядер
4) химической реакцией горения водорода в кислороде
8. Какие из излучений имеют наибольшую ионизирующую способность?
1) бета-излучение
2) альфа-излучение
3) гамма- излучение
4) все три — одинаковую
9. Какие частицы или излучения имеют наибольшую
проникающую способность?
Какие частицы или излучения имеют наибольшую
проникающую способность?
1) альфа- и бета-частицы
2) бета-излучение
3) гамма- излучение
4) альфа-частицы
10. Имеется 109 атомов радиоактивного изотопа йода, период его полураспада 25 мин. Какое примерно количество ядер изотопа испытает радиоактивный распад за 50 мин?
!) 5*108
2) 109
3) 2,5*108
4)7,5*108
11(повторение). Если разность потенциалов между обкладками конденсатора уменьшить в 2 раза, то его электроемкость:
1) увеличится в 2 раза
2) уменьшится в 2 раза
3) не изменится
4) увеличится в 4 раза
12(повторение). Как изменится количество теплоты, выделяющейся на проводнике, если его длину увеличить в 2 раза, а диаметр уменьшить в 2 раза, при неизменной силе тока:
1) увеличится в 8 раз
2) уменьшится в 4 раза
3) увеличится в 4раза
4) уменьшится в 8 раз
Дополнительное задание.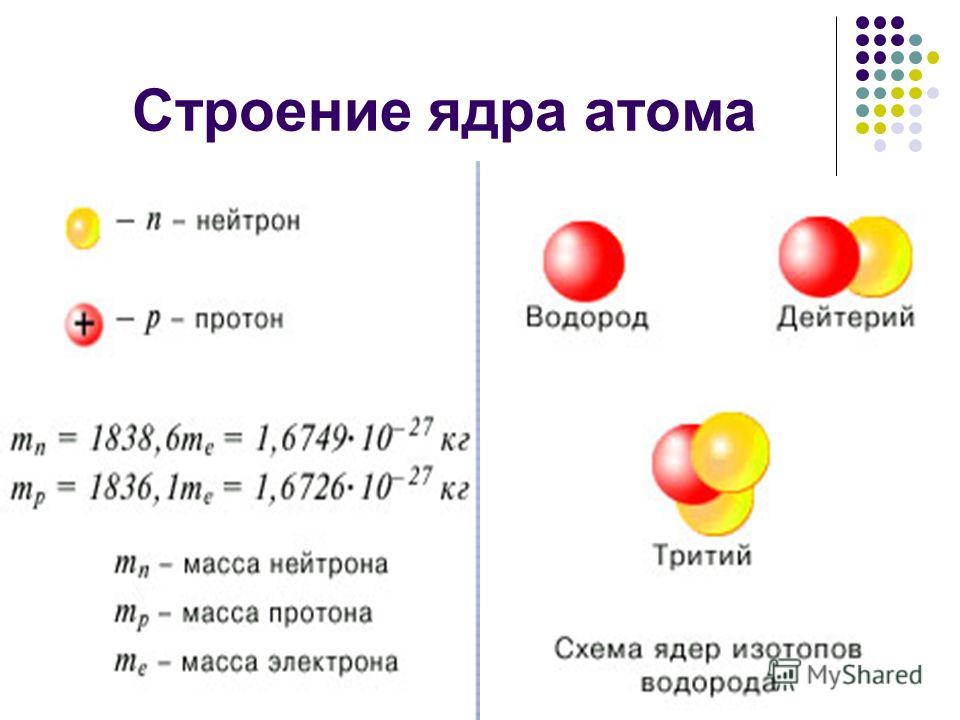
1. Как определить число протонов, содержащихся в 10 г алюминия
Ученик рассказывает ход решения задачи.
Правильные ответы:
| №1 | №2 | №3 | №4 | №5 | №6 | №7 | №8 | №9 | №10 | №11 | №12 |
| 3 | 4 | 1 | 3 | 2 | 4 | 3 | 2 | 3 | 4 | 3 | 1 |
2) Проверим, насколько хорошо вы усвоили
материал, как вы умеете применять его при решении
задач.
Ребята, которые будут сдавать физику в форме ЕГЭ, выполняют его мини-версию, остальные решают самостоятельно задачи по теме. Работа выполняется на листочках, которые после выполнения работы будут сданы учителю на проверку.
Мини-ЕГЭ
А1. Ядро, какого из элементов содержит 10 нейтронов?
А2. Чему равно число электронов в ядре ?
1) 244
2) 122
3) 94
4) 0
А3. Протактиний подвергся двум a— и одному — распадам. Конечным продуктом реакции является:
А4. Период полураспада ядер атомов свинца составляет 3,3ч. Какое утверждение справедливо?
1) за 3,3 часа распадется примерно половина из имеющихся ядер
2) за 3,3 часа распадется в точности половина из имеющихся ядер
3) за 6,6 часа распадутся все имеющиеся ядра
4) каждые 3,3 часа распадется в среднем одно ядро
А5.Укажите, под действием какой частицы протекает ядерная реакция:
1) под действием нейтрона
2) под действием протона
3) под действием ?-частицы
4) под действием ?-кванта
В. Найдите энергию связи (МэВ) между нуклонами
для гелия масса
ядра mя=4,00260 а.е.м.
Найдите энергию связи (МэВ) между нуклонами
для гелия масса
ядра mя=4,00260 а.е.м.
Масса покоя протона mp = 1,007276 а.е.м., масса покоя нейтрона mn = 1,008665 а.е.м.
С. Какое количество урана-235 расходуется в сутки на атомной электростанции мощностью 50 МВт? При распаде одного ядра урана выделяется энергия 200 МэВ, КПД электростанции 17%?
Самостоятельная работа
1. Каков состав ядер
2. Имеется 109 атомов радиоактивного изотопа цезия. Период его полураспада 26 лет. Какое количество ядер изотопа останется через 52 года?
3. При облучении ядер бора — 11 протонами образовались ядра бериллия-8. Какие еще ядра получаются в этой реакции. Напишите уравнение ядерной реакции. Сколько энергии выделяется или поглощается в этой реакции?
4. Чему равна электрическая мощность АЭС,
имеющей КПД 25%, если она расходует 235г урана-235 в
сутки. При делении одного ядра выделяется 3,2*10-11Дж
энергии
При делении одного ядра выделяется 3,2*10-11Дж
энергии
Проведение самопроверки выполненных заданий.
Правильные ответы:
| А1 | А2 | А3 | А4 | А5 | В | С | ||
| Вариант 1 | 4 | 4 | 1 | 1 | 2 | 27,3 | 0,311 кг | |
| Количество баллов | 1б | 1б | 1б | 1б | 1б | 2б | 3б | |
| Самостоятельная работа | №1 | №2 | №3 | №4 | ||||
| p=12 n=13 |
p=9 n=11 |
2,5108 | 8,6 МэВ | 56МВт | ||||
| Количество баллов | 1б | 2б | 3б | 4б | ||||
5. Подведение итогов.
Подведение итогов.
Заполнение «Листа самооценки»
Учащиеся подсчитывают количество баллов, которое они набрали за сегодняшний урок.
Анализ полученных результатов:
- от 28 до 32 баллов — «отлично», так держать!
- от 23 до 27 баллов — «хорошо», попробуй еще лучше!
- от 18 до 22 баллов — «удовлетворительно», поднажми немного!
- менее 18 баллов — пока «неудовлетворительно», встретимся на индивидуальном занятии
Учитель видит полученную картину качества усвоения учащимися материала темы «Физика атомного ядра». Последующая проверка выполненных работ, поможет педагогу выявить ошибки, допущенные учениками, наметить при необходимости индивидуальный план по устранению затруднений у учащихся.
ЛИСТ САМООЦЕНКИ
ученика (цы) 11 «____» класса ___________________________________
фамилия, имя
| № п/п | Задание | Максимальное количество баллов | Полученное количество баллов |
| 1 | Знаю формулы «Физика атомного ядра» | 5 | |
| 2 | Знаю формулы «Электродинамика» | 5 | |
| 3 | Знаю теорию. Выполнение теста Выполнение теста |
12 | |
| 4 | Умею решать задачи Мини-ЕГЭ/ самостоятельная работа |
10 | |
| Итого | 32 | ||
6. Домашнее задание
Повторить основные положения с. 387-389 учебник В.А.Касьянов «Физика-11»
Тем, кто получил за урок
- «5» — № 1646, 1621 *
- «4» — № 1636,1620 *
- «3» — № 1640,1629 *
- «2» — № 1635,1628 *
*Сборник задач по физике В.П.Демкович, Л.П.Демкович
Бета-распад
Бета-распад Явление β-распада состоит в том, что ядро(A,Z)
самопроизвольно испускает лептоны 1-го поколения – электрон (позитрон) и
электронное нейтрино (электронное антинейтрино),
переходя в ядро с тем же массовым числом А, но с атомным номером Z, на единицу большим или меньшим.
Главной особенностью β-распада является то, что он обусловлен слабым взаимодействием.
Бета-распад —
процесс не внутриядерный, а внутринуклонный.
В ядре распадается одиночный нуклон.
β-распад, также как и α-распад, происходит между дискретными состояниями начального
(A,Z)
и конечного (A,Z±1)
ядер. Поэтому долгое время после открытия явления β-распада
было непонятно, почему спектры электронов и позитронов, вылетающих из ядра при β-распаде
были непрерывными, а не дискретными, как спектры α-частиц. Считалось даже, что в β-распаде
не выполняется закон сохранения энергии. Объяснение непрерывного характера β-спектра
было дано В. Паули, который высказал гипотезу, что при β-распаде
вместе с электроном рождается ещё одна частица с маленькой массой,
т.е. β-распад − трехчастичный процесс. В конечном состоянии образуется ядро (A,Z±1),
электрон и лёгкая нейтральная частица – нейтрино (антинейтрино). Т.к. масса ядра
(A,Z±1)
гораздо больше масс электрона и нейтрино, энергия β-распада
уносится лёгкими частицами. Распределение энергии β-распада Qβ между электроном и этой нейтральной частицей приводит к непрерывному β-спектру
электрона. Nν(E) = Ne(Qβ – E), где Nν(E) − число антинейтрино
с энергией Е, Ne(Qβ – E) − число электронов с
энергией (Qβ – E), Qβ − энергия β-распада,
равная суммарной энергии, уносимой электроном и антинейтрино (энергия ядра
отдачи 40Ca не учитывается).
Поэтому появление электрона при β—-распаде
всегда сопровождается образованием антинейтрино.
|
| Спектр электронов, образующихся при β-распаде
в отличие от дискретного спектра α-частиц
имеет непрерывный характер, т.е. их ядра вылетают электроны различных энергий
вплоть до энергии β-распада.
Непрерывный спектр электронов некоторыми физиками интерпретировался как
невыполнение закона сохранения энергии в β-распаде.
Впервые гипотеза о ещё одной частице, которая образуется при β-распаде
высказал В. Паули в 1930 г. в письме участникам физической конференции в г.
Тюбингене. «Дорогие радиоактивные дамы и господа. Имея
в виду… непрерывный β-спектр,
я предпринял отчаянную попытку спасти обменную статистику и закон сохранения
энергии. Именно имеется возможность того, что в ядрах существуют электрически
нейтральные частицы, которые я буду называть «нейтронами» и которые обладают
спином 1/2. После открытия в 1932 г. нейтрона Э.Ферми предложил называть частицу В.Паули «нейтрино». В 1933 г. на Сольвеевском конгрессе В. Паули выступил с докладом о механизме β-распада с участием нейтральной частицы со спином J = 1/2. Гипотеза Паули спасла не только закон сохранения энергии, но и законы сохранения импульса и момента. Антинейтрино было экспериментально обнаружено в 1956 г. в экспериментах Ф. Райнеса и К. Коэна. |
| На малую интенсивность слабых взаимодействий указывает
большое среднее время жизни нейтрона (τ ≈ 15 мин).
В (3.3) не учитываются энергии связи электронов в атомах, т.к. они находятся на границе точности самых прецизионных измерений. Подставив (3.3) в (3.2), получим условия нестабильности атома по отношению к β-распаду
При β+-распаде и электронном захватив ядре происходит один и тот же процесс превращения протона в нейтрон. Поэтому оба эти процесса могут идти для одного и того же ядра и часто конкурируют друг с другом. Из сравнения условий для этих двух видов распада видно, что с энергетической точки зрения электронный захват более выгоден. В частности, если начальный и конечный атомы удовлетворяют неравенствам
то электронный захват разрешен, а β+-распад
запрещен. Такая ситуация имеет место при превращении изотопа бериллия 7Be
в результате е-захвата в изотоп лития 7Li
.
и запрещён позитронный распад, так как различие
масс атомов в энергетической шкале составляет 0.861 МэВ, т. е. меньше, чем 2mеc2 =
1.02 МэВ.
Она заключена в интервале от 18.61 кэВ при распаде трития 3H → 3He + e— + e, до 13.4 МэВ при распаде тяжелого изотопа бора 12B → 12C + e— + e. Кулоновский барьер при β—распаде несуществен. Это обусловлено
тем, что у позитрона и у электрона, массы, а следовательно и импульсы
малы. Поэтому, образовавшись в результате
распада нуклона, они не могут
долго находиться в ядре в соответствии с
соотношением неопределенности.
Кроме того, между образовавшейся при β+-распаде
заряженной частицей e+ действуют кулоновские силы, а не ядерные силы, как в случае α-распада.
Из-за более слабой зависимости от энергии β-распада
по сравнению с α-распадом, β-распад
часто происходит на возбужденные состояния конечного ядра. |
| НОВЫЙ ТИП РАДИОАКТИВНОСТИ Нами было недавно показано методом камеры Вильсона, что некоторые лёгкие
элементы (бериллий, бор, алюминий) испускают положительные электроны при
бомбардировке их α-лучами
полония. 27Al + 4He → 30P + n. Изотоп 30P является радиоактивным с периодом в 3 мин. 15 сек. и испускает положительные электроны согласно реакции 30P → 30Si + e+. |
Переносчиками слабого взаимодействия являются
W+, W— и Z-бозоны. На кварковом уровне внутриядерные превращения в процессах β-распада
имеют вид. На кварковом уровне внутриядерные превращения в процессах β-распада
имеют вид. При β—-распаде один из нейтронов ядра превращается в протон. При этом испускается электрон e— и электронное антинейтрино e. При β+-распаде один из протонов ядра превращается в нейтрон. При этом испускается позитрон e+ и электронное нейтрино νe. При е-захвате в результате взаимодействия протона с электроном атомной оболочки происходит превращение протона в нейтрон с испусканием из ядра электронного нейтрино νe.
|
а) e-захват
возможен, если масса исходного атома атM(A,Z)
больше массы атома |
Зависимость энергий β—-распада Qβ- и β+-распада Qβ+ изотопов Z = 11, Z = 21, Z = 31 от массового числа A. В энергиях β+— и β—-распадов отчётливо проявляются эффекты спаривания тождественных нуклонов. |
В энергиях β+— и β—-распадов отчётливо проявляются эффекты спаривания тождественных нуклонов. |
| Разрешенные и запрещенные β-распады Бета-распады разделяются на разрешенные и
запрещенные, различающиеся вероятностями переходов. wl/w0~ (R/)2l, R − радиус ядра,
− длина волны. pb = . Для прицельного параметра b в классическом приближении должно выполняться условие b = /p < R .. Для лептонов в релятивистском случае c/T < R, T − кинетическая энергия вылетающего лептона. Радиусы даже самых тяжелых ядер меньше 10 Фм. Положив радиус равным 10 Фм, а энергию β-распада 20 МэВ, получим 200 МэВ·Фм/20 МэВ < 10 Фм. Видно, что орбитальный момент вылетающих при бета-распаде лептонов при квазиклассическом рассмотрении может быть только нулевой, а переходы с l ≠ 0 запрещены. Однако квантовые свойства частиц приводят к тому, что такие запрещенные переходы происходят, хотя они и сильно подавлены. wl/w0~ (R/)2l. |
Процесс е-захвата электрона атомной оболочки конкурирует с β+-распадом. ƒ = ƒ(K)/ƒ(β+) для различных энергий β-распада Qβ. |
На примере β-распадов нейтрона, изотопов 3H и 6He можно проследить зависимость периода полураспада β—-излучателей от энергии β—-распада.
|
Если массы начального Mi и конечного Mf ядер удовлетворяют условиям Mf + 2me > Mi > Mf, то в таких ядрах е-захват разрешен, а β+-распад
запрещён. Такая ситуация наблюдается при е-захвате в 7Be. В ядре 7Be
возможен е-захват, а β+-распад
энергетически запрещен, так как различие масс атомов 7Be и 7Li составляет
0. 7Be + e— → 7Li + νe в конечном состоянии образуется изотоп 7Li и нейтрино. Энергия, высвобождающаяся в результате е-захвата, составляет 0.86 МэВ. Изотоп 7Li в 89.7% распадов 7Be образуется в основном состоянии JP = 3/2— и в 10.3% распадов в возбужденном состоянии E* = 0.477 МэВ, JP = 1/2—. Спектр, образующихся при е-захвате нейтрино дискретный. При распаде на основное состояние энергия нейтрино Eν = 0.86 МэВ, при распаде на возбужденное состояние энергия нейтрино Eν = 0.385 МэВ. |
| β-распад β-распад внутринуклонный процесс. Отношение вероятности ωl/ω0 вылета частицы с орбитальными моментами l и 0 из ядра радиуса R определяется соотношением wl/w0~ (R/)2l, что сильно подавляет вылет частиц низких энергий и c большими орбитальными моментами. |
Вероятность β-распада
сильно зависит от структуры начального и образующегося в результате β-распада
ядер. |
При β-распаде ядра с
нечетным массовым числом A
происходит превращение четно-нечетного по
протонам и нейтронам ядра в нечетно-четное или,
наоборот, нечетно-четного в четно-нечетное.
При β-распаде
ядер с четным массовым числом A
происходит превращение четно-четного ядра в нечетно-нечетное или, наоборот,
нечетно-нечетного в четно-четное. (A,Z) → (A,Z+2) + 2e— + 2e, Этот тип радиоактивного распада называется двойным β-распадом. |
В ядрах-изобарах с нечетным массовым числом A,
как правило, существует один стабильный изотоп. В данном случае это изотоп 89Y.
Изотоп 89Y
образуется как в результате β—-распада 89Sr,
так и в результате β+-распада
и е-захвата изотопа 89Zr. |
В ядрах-изобарах с четным массовым числом A возможны два стабильных изотопа. В данном случае это 122Sn (содержание в естественной смеси изотопов 4.63%) и 122Te (содержание в естественной смеси изотопов 2.55%). Изотоп 122Sb распадается в основном в результате β-распада (≈ 97%). β-распады часто происходят на возбужденные состояния ядер-изобар. |
Изотопы 27Al и 27Si
являются зеркальными ядрами, имеющими в основном состоянии JP = 5/2+.
Неспаренный нуклон находится на оболочке 1d5/2.
Зеркальная симметрия изотопов 27Si
и 27Al
увеличивает вероятность внутриядерного распада |
В ядрах-изобарах с массовым числом A = 34
есть только один стабильный изотоп 34S.
Изотоп 34S
образуется как в результате β—-распада 34P,
так и в результате е-захвата и β+-распада 34Cl. |
| Среди ядер изобар A = 73
стабильным изотопом является изотоп 73Ge.
Изотоп 73Ga
распадается в результате β—-распада. |
В тяжелых ядрах α-распад и β-распад
часто конкурируют.
Возбужденное состояние 210Bi E* = 0.268 МэВ JP = 9— распадается практически со 100% вероятностью с испусканием α-частиц. β-распад этого состояния составляет ~0.4%. |
Бета-распад на связанное состояние атома Накопители тяжелых ионов открывают принципиально
новые возможности в исследовании свойств экзотических ядер. Распад на связанное состояние атома был впервые обнаружен в 1992 г.
Наблюдался β—-распад полностью
ионизованного атома
на связанные атомные состояния [H. Jung et al. Phys. Rev. Lett. 69 #15, 1992,
p.2164]. Ядро 163Dy на N-Z
диаграмме атомных ядер помечено черным цветом. Это означает, что оно является
стабильным ядром. Действительно, входя в состав нейтрального атома, ядро 163Dy
стабильно. Его основное состояние (5/2+)
может заселятся в результате e-захвата из основного состояния (7/2+)
ядра163Ho.
Образующийся в результате распада электрон может быть захвачен на вакантную К или L-оболочку иона . В результате распад (3.8) имеет вид → + e— + e (в связанном состоянии). Энергии β-распадов
на K и L-оболочки равны соответственно (50. Так как ионы Ho66+ имеют практически то же отношение M/q, что и ионы первичного пучка Dy66+,
они накапливаются на одной и той же орбите. Время накопления составляло
~ 30 мин. Для того, чтобы измерить период полураспада ядра Dy66+,
накопленный на орбите пучок было необходимо очистить от примеси ионов Ho66+.
Для очистки пучка от ионов
в камеру инжектировалась аргоновая газовая струя плотностью 6·1012 атом/см2,
диаметром 3 мм, которая пересекала накопленный пучок ионов в вертикальном
направлении. → + e— + e (в связанном состоянии). Варьируя интервал времени между очисткой пучка от
примеси Ho66+ и временем регистрации вновь образующихся в пучке примеси ионов Ho66+,
можно измерить период полураспада полностью ионизированного изотопа Dy66+.
Оно оказалось равным ~0.1 года. |
| Несохранение четности в слабых взаимодействиях. Опыт Ву Впервые несохранение пространственной четности в
слабых взаимодействиях было обнаружено в эксперименте Ву и др. в 1957 г. В
эксперименте использовался β–-радиоактивный источник 60Co, помещенный в магнитное поле. Ядро 60Co имеет спин J = 5 и большую величину магнитного момента, что позволяет получить высокую степень
поляризации ядер в магнитном поле. 60Co → 60Ni + e— + e, испущенных по направлению магнитного поля (спинов ядер) и в противоположном
направлении. Вся установка зеркально симметрична относительно плоскости, в
которой расположен круговой ток. ψ |(r,θ,j )|2 = ψ |(r,π-θ,j )|2, следует, что вероятности испускания частиц под углами θ и π-θ равны. |
| Слабые взаимодействия и несохранения четности Первым экспериментом, в котором однозначно установлено несохранение
четности, был эксперимент по изучению углового распределения β-электронов от
ядер поляризованного кобальта-60. Теория является неинвариантной относительно оператора четности
P,
который, по определению, изменяет знаки у всех пространственных координат, но не
переводит частицу в античастицу. Под влиянием этого оператора изменяется на
обратное направление импульса частицы, но не изменяется направление спина
частицы. Так как в двухкомпонентной теории спин и импульс всегда антипараллельны
для нейтрино, то применение оператора P
к нейтринному состоянию переводит нейтрино в несуществующее состояние. УФН, т. 66, вып. 1, стр. 89 (1958) |
| Закон сохранения четности и другие законы симметрии Открытие закона сохранения четности восходит к 1924 г., когда
Лапорт нашел, что в сложных атомах энергетические уровни могут быть разбиты на
два класса: «штрихованные» уровни и «нештрихованные»
уровни, или, говоря современным языком, четные и нечетные уровни. УФН, т. 66, вып. 1, стр. 79 (1958) |
| Hecoхранениe четности Новые недавно выполненные в ядерной физике опыты свидетельствуют о
том, что некоторые основные свойства природы имеют далеко не тот характер,
который им приписывали. В истории физики редко случалось, чтобы изменение
основных принципов следовало из результатов всего лишь нескольких опытов. УФН, т. 66, вып. 3, стр. 435 (1958) |
Законы сохранения
| Характеристика | Взаимодействие | ||
|---|---|---|---|
| Сильное | Электро- магнитное | Слабое | |
| Аддитивные законы сохранения | |||
| Электрический заряд, Q | + | + | + |
| Энергия, E | + | + | + |
| Импульс, p | + | + | + |
| Момент количества движения, J | + | + | + |
| Барионный заряд, B | + | + | + |
| Лептонные заряды Le, Lμ, Lτ | + | + | + |
| Странность, s | + | + | − |
| Charm, c | + | + | − |
| Bottom, b | + | + | − |
| Top, t | + | + | − |
| Изоспин, I | + | − | − |
| Проекция изоспина, I3 | + | + | − |
| Мультипликативные законы сохранения | |||
| Пространственная четность, P | + | + | − |
| Зарядовая четность, C | + | + | − |
| Временная четность, T | + | + | − |
| Комбинированная четность, CP | + | + | − |
| CPT-четность | + | + | + |
| G-четность | + | − | − |
В таблице приведены величины, сохраняющиеся в различных
взаимодействиях. Знак «+» («–») показывает, что данная величина сохраняется (не
сохраняется). В аддитивных законах сохраняется сумма величин, в
мультипликативных законах − произведение величин. Знак «+» («–») показывает, что данная величина сохраняется (не
сохраняется). В аддитивных законах сохраняется сумма величин, в
мультипликативных законах − произведение величин. |
1.2. Строение атомного ядра
Как уже отмечалось, атом состоит из трех видов элементарных частиц: протонов, нейтронов и электронов. Атомное ядро – центральная часть атома, состоящая из протонов и нейтронов. Протоны и нейтроны имеют общее название нуклон, в ядре они могут превращаться друг в друга. Ядро простейшего атома – атома водорода – состоит из одной элементарной частицы – протона.
Диаметр
ядра атома равен примерно 10-13 – 10-12 см и составляет 0,0001 диаметра атома.
Однако, практически вся масса атома
(99,95 – 99,98 %) сосредоточена в ядре. Если
бы удалось получить 1 см3 чистого ядерного вещества, масса его
составила бы 100 – 200 млн. т. Масса ядра
атома в несколько тысяч раз превосходит
массу всех входящих в состав атома
электронов.
т. Масса ядра
атома в несколько тысяч раз превосходит
массу всех входящих в состав атома
электронов.
Протон – элементарная частица, ядро атома водорода. Масса протона равна 1,6721х10-27 кг, она в 1836 раз больше массы электрона. Электрический заряд положителен и равен 1,66х10-19 Кл. Кулон – единица электрического заряда, равная количеству электричества, проходящему через поперечное сечение проводника за время 1с при неизменной силе тока 1А (ампер).
Каждый атом любого
элемента содержит в ядре определенное
число протонов. Это число постоянное
для данного элемента и определяет его
физические и химические свойства. То
есть, от количества протонов зависит,
с каким химическим элементом мы имеем
дело. Например, если в ядре один протон
– это водород, если 26 протонов – это
железо. Число протонов в атомном ядре
определяет заряд ядра (зарядовое число
Z) и порядковый номер элемента в
периодической системе элементов Д.И.
Менделеева (атомный номер элемента).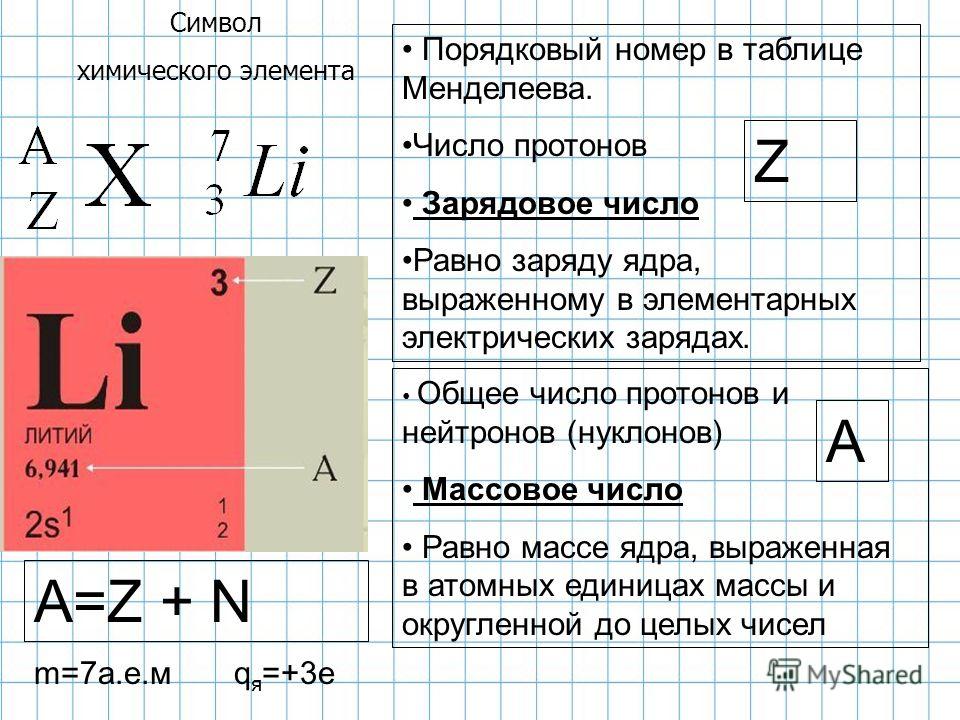
Нейтрон – электрически нейтральная частица с массой 1,6749 х10-27кг, в 1839 раз больше массы электрона. Нейрон в свободном состоянии – нестабильная частица, он самостоятельно превращается в протон с испусканием электрона и антинейтрино. Период полураспада нейтронов (время, в течение которого распадается половина первоначального количества нейтронов) равен примерно 12 мин. Однако в связанном состоянии внутри стабильных атомных ядер он стабилен. Общее число нуклонов (протонов и нейтронов) в ядре называют массовым числом (атомной массой – А). Число нейтронов, входящих в состав ядра, равно разности между массовым и зарядовым числами: N = A – Z.
Электрон – элементарная
частица, носитель наименьшей массы –
0,91095х10-27г
и наименьшего электрического заряда –
1,6021х10-19 Кл.
Это отрицательно заряженная частица.
Число электронов в атоме равно числу
протонов в ядре, т.е. атом электрически
нейтрален.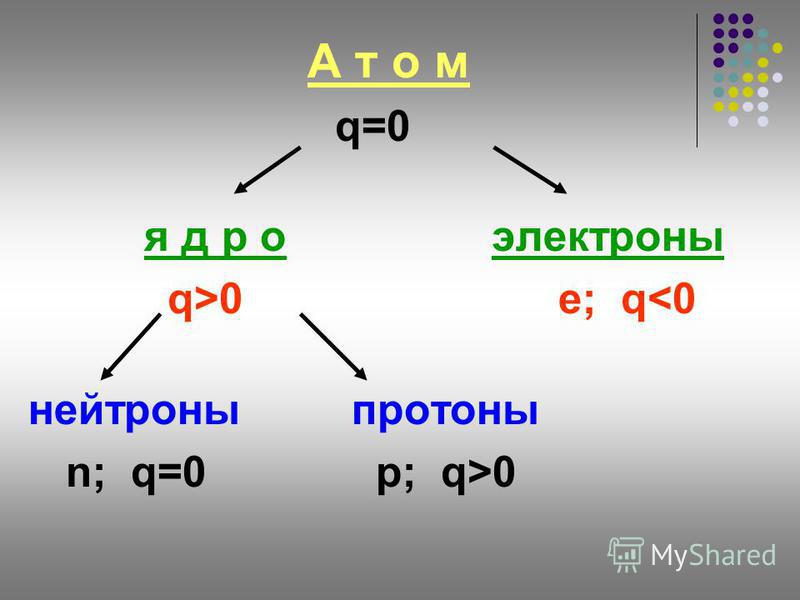
Позитрон – элементарная частица с положительным электрическим зарядом, античастица по отношению к электрону. Масса электрона и позитрона равны, а электрические заряды равны по абсолютной величине, но противоположны по знаку.
Различные
типы ядер называют нуклидами. Нуклид –
вид атомов с данными числами протонов
и нейтронов. В природе существуют атомы
одного и того же элемента с разной
атомной массой (массовым числом): 17 35 Cl, 1737Cl
и т.д. Ядра этих атомов содержат одинаковое
число протонов, но различное число
нейтронов. Разновидности атомов одного
и того же элемента, имеющие одинаковый
заряд ядер, но различное массовое число,
называются изотопами.
Обладая одинаковым количеством протонов,
но различаясь числом нейтронов, изотопы
имеют одинаковое строение электронных
оболочек, т.е. очень близкие химические
свойства и занимают одно и то же место
в периодической системе химических
элементов.
Изотопы обозначают символом соответствующего химического элемента с расположенным сверху слева индексом А – массовым числом, иногда слева внизу приводится также число протонов (Z). Например, радиоактивные изотопы фосфора обозначают 32Р, 33Р или 1532Р и 1533Р соответственно. При обозначении изотопа без указания символа элемента массовое число приводится после обозначения элемента, например, фосфор – 32, фосфор – 33.
Большинство химических элементов имеет по несколько изотопов. Кроме изотопа водорода 1Н-протия, известен тяжелый водород 2Н-дейтерий и сверхтяжелый водород 3Н-тритий. У урана 11 изотопов, в природных соединениях их три (уран 238, уран 235, уран 233). У них по 92 протона и соответственно 146,143 и 141 нейтрон.
В настоящее время
известно более 1900 изотопов 108 химических
элементов. Из них к естественным относятся
все стабильные (их примерно 280) и
естественные изотопы, входящие в состав
радиоактивных семейств (их 46).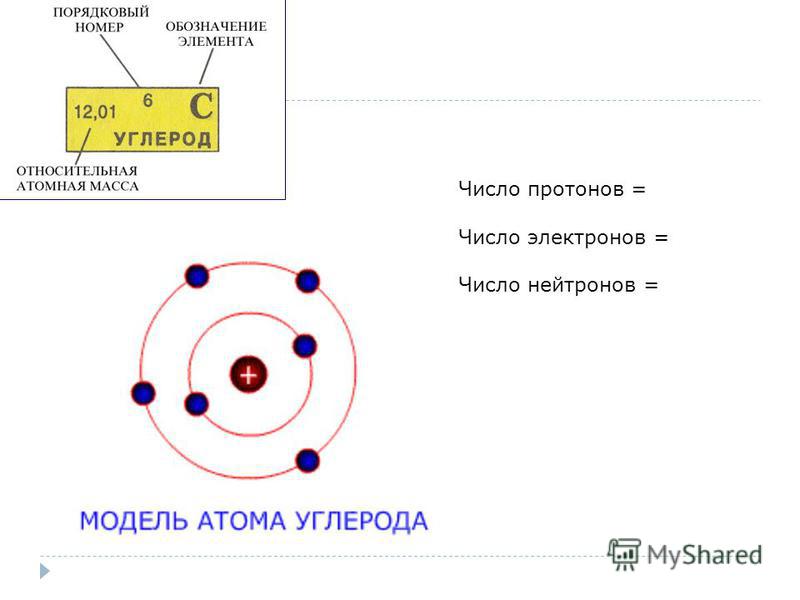 Остальные
относятся к искусственным, они получены
искусственным путем в результате
различных ядерных реакций.
Остальные
относятся к искусственным, они получены
искусственным путем в результате
различных ядерных реакций.
Термин «изотопы» следует применять только в тех случаях, когда речь идет об атомах одного и того же элемента, например, изотопы углерода 12С и 14С. Если подразумеваются атомы разных химических элементов, рекомендуется использовать термин «нуклиды», например, радионуклиды 90Sr, 131J, 137Cs.
Строение атома — материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 и -1/2.
Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 и -1/2.
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов n-го периода заполнены предыдущие n-1 электронные уровни.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов. Распределим эти электроны в соответствии с (●), не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2. Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
Итого получаем1s22s22p63s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий — элемент пятого периода, следовательно, первые четыре энергетических уровня полностью заполнены — 1s22s22p63s23p64s23d104p6.Заполнение пятого уровня начинается с 5s2. Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях.
 Какие валентности способен проявлять хлор?
Какие валентности способен проявлять хлор? - Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Фосфор — Протоны — Нейтроны — Электроны
Фосфор как элемент существует в двух основных формах — белый фосфор и красный фосфор, но из-за его высокой реакционной способности фосфор никогда не встречается на Земле в свободном виде.
Подавляющее большинство добываемых соединений фосфора потребляется в качестве удобрений. Фосфат необходим для замены фосфора, который растения удаляют из почвы, и его ежегодная потребность растет почти в два раза быстрее, чем рост населения.
Преобладающим источником фосфора в наше время является фосфатная порода (в отличие от предшествующего гуано).
Протоны и нейтроны в фосфоре
Фосфор — это химический элемент с атомным номером 15 , что означает, что в его ядре 15 протонов. Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1602 x 10 -19 кулонов .
Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1602 x 10 -19 кулонов .
Общее число нейтронов в ядре атома называется числом нейтронов атома и обозначается символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно используется множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Фосфора равны 31.
Основные изотопы Фосфора
23 известны изотопы фосфора в диапазоне от 25P до 47P. Только 31P является стабильным и, следовательно, присутствует в количестве 100%.
Только 31P является стабильным и, следовательно, присутствует в количестве 100%.
Фосфор-31 состоит из 15 протонов, 16 нейтронов и 15 электронов. Полуцелый ядерный спин и высокое содержание 31P делают спектроскопию ЯМР фосфора-31 очень полезным аналитическим инструментом при исследовании фосфорсодержащих образцов.
Фосфор-32 состоит из 15 протонов, 17 нейтронов и 15 электронов. 32 P, бета-излучатель (1,71 МэВ) с периодом полураспада 14,3 дня, который обычно используется в медико-биологических лабораториях, в основном для производства ДНК- и РНК-зондов с радиоактивной меткой.
Фосфор-33 состоит из 15 протонов, 18 нейтронов и 15 электронов. 33P, бета-излучатель (0,25 МэВ) с периодом полураспада 25,4 дня. Он используется в медико-биологических лабораториях в приложениях, в которых выгодны более низкие энергетические бета-излучения, таких как секвенирование ДНК.
Стабильные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме Фосфора равно 15. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Следовательно, число электронов в нейтральном атоме Фосфора равно 15. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Фосфора : [Ne] 3s2 3p3 .
Возможные степени окисления +3,5/-3 .
Как элемент, фосфор существует в двух основных формах — белый фосфор и красный фосфор — но поскольку он очень реактивен, фосфор никогда не встречается на Земле в виде свободного элемента. Наиболее распространенными соединениями фосфора являются производные фосфата, тетраэдрического аниона. Фосфат представляет собой сопряженное основание фосфорной кислоты, которое производится в больших масштабах для использования в удобрениях.
Наиболее распространенными соединениями фосфора являются производные фосфата, тетраэдрического аниона. Фосфат представляет собой сопряженное основание фосфорной кислоты, которое производится в больших масштабах для использования в удобрениях.
Наиболее распространенное соединение фосфора
Фосфорная кислота — это слабая кислота с химической формулой H 3 PO 4 . Пищевая фосфорная кислота используется для подкисления пищевых продуктов и напитков, таких как различные колы и джемы, для придания им острого или кислого вкуса. Безалкогольные напитки, содержащие фосфорную кислоту, в том числе кока-колу, иногда называют фосфатными газированными напитками или фосфатами.
О протонах
Протон — это одна из субатомных частиц, составляющих материю. Во Вселенной много протонов, составляющих около половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/с 2 ) — немного легче, чем у нейтрона, но почти в 1 836 раз больше, чем у нейтрона. раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и его спин — ½ фермиона.
раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и его спин — ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонов связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются мельчайшими строительными блоками материи.
О нейтронах
Нейтрон – это одна из субатомных частиц, из которых состоит материя. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. не имеет электрического заряда и имеет массу покоя, равную 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой благодаря своему положительному заряду. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны , что помогает компенсировать электрическое отталкивание между протонами. В результате, по мере увеличения числа протонов для формирования стабильного ядра требуется возрастающее отношение нейтронов к числу протонов . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распаду, бета-распаду или захвату электронов. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующим выбросом гамма-излучения . Чистые альфа- или бета-распады очень редки.
Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующим выбросом гамма-излучения . Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронная конфигурация различных атомов полезна для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические свойства атома определяются количеством протонов, фактически количеством и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип запрета Паули , который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочки. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена в виде основных электронов, эквивалентных благородному газу предыдущего периода, и валентных электронов (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Сводка
| Элемент | Фосфор |
| Количество протонов | 15 |
| Число нейтронов (типичные изотопы) | 31 |
| Число электронов | 15 |
| Электронная конфигурация | [Не] 3s2 3p3 |
| Степени окисления | +3,5/-3 |
Источник: www.luciteria.com
Свойства других элементов
Другие свойства фосфора
Сколько протонов, нейтронов и электронов имеет фосфор?
Фосфор является классифицированным неметаллическим элементом, и его символ P. Фосфор является 15-м элементом периодической таблицы, поэтому его атомный номер равен 15.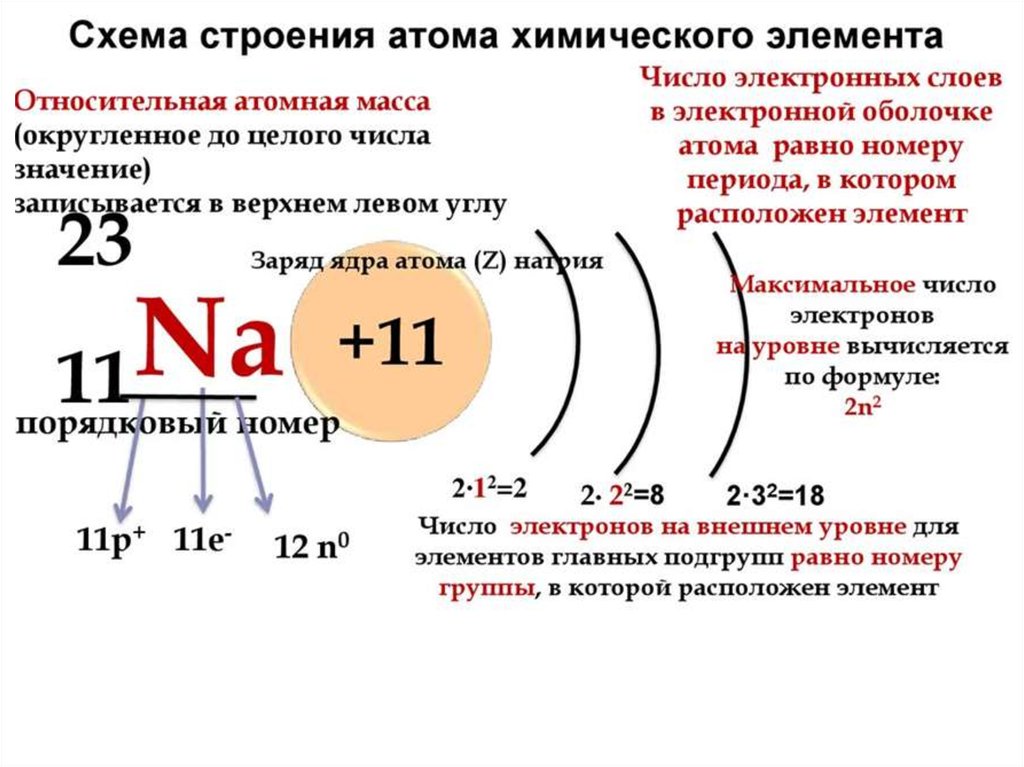 Атомный номер элемента равен количеству протонов и электронов в этом элементе. Следовательно, атом фосфора имеет пятнадцать протонов и пятнадцать электронов. Количество нейтронов в атоме можно определить по разнице между массой атома и количеством протонов.
Атомный номер элемента равен количеству протонов и электронов в этом элементе. Следовательно, атом фосфора имеет пятнадцать протонов и пятнадцать электронов. Количество нейтронов в атоме можно определить по разнице между массой атома и количеством протонов.
Разница между массовым числом атома фосфора и числом протонов равна шестнадцати. Следовательно, атом фосфора имеет шестнадцать нейтронов. Количество нейтронов зависит от изотопа элемента. Атом фосфора имеет один стабильный изотоп.
| Element Name | Phosphorus | ||
| Symbol | P | ||
| Atomic number | 15 | ||
| Atomic weight (average) | 30.974 | ||
| Protons | 15 | ||
| Neutrons | 16 | ||
| Electrons | 15 | ||
| Group | 15 | ||
| Period | 3 | ||
| Block | p-блок | ||
| Электроны на оболочку | 2, 8, 5 | ||
| Электронная конфигурация | [Ne] 3s 2 3p 5 3 40215 Степени окисления | +5, +3, -3 | |
В этой статье подробно обсуждалось, как легко найти число протонов, нейтронов и электронов в атоме фосфора. Также обсуждаются положение электронов, протонов и нейтронов в атоме, число атомных масс и изотопы фосфора. Надеюсь, после прочтения этой статьи вы узнаете подробности по этой теме.
Также обсуждаются положение электронов, протонов и нейтронов в атоме, число атомных масс и изотопы фосфора. Надеюсь, после прочтения этой статьи вы узнаете подробности по этой теме.
Содержание
Где находятся электроны, протоны и нейтроны в атоме?
Атом – это мельчайшая частица элемента, которая не существует самостоятельно, но непосредственно участвует в химических реакциях как мельчайшая единица. Атомы настолько малы, что их невозможно увидеть даже под мощным микроскопом. Диаметр атома водорода составляет 0,1 нм (1,0 нм = 10 — 9 м). Таким образом, если 1000 миллионов атомов водорода расположить рядом друг с другом, его длина составит 1 метр.
Атомная структура атома Однако стало возможным обнаружить атомы, увеличив зрение очень мощного электронного микроскопа в два миллиона раз. В атоме существует множество постоянных и временных частиц. Электроны, протоны и нейтроны находятся в атоме как постоянные частицы. Также нейтрино, антинейтрино, позитрон и масон находятся в атоме как временные частицы.
Атомы обычно можно разделить на две части. Один — ядро, а другой — орбита. Эксперименты разных ученых показали, что ядро атома содержит протоны и нейтроны. Единственным исключением является водород, в ядре которого есть только протоны, но нет нейтронов. Электроны вращаются вокруг ядра по определенной орбите.
Как легко найти количество электронов, протонов и нейтронов в атоме фосфора?
Ученый Генри Гвинн Джеффрис Мосл исследовал рентгеновский спектр различных элементов в период с 1913 по 1914 год. Результаты его экспериментов показывают, что каждый элемент имеет уникальное целое число, равное количеству положительных зарядов в ядре этого элемента. Он назвал это число порядком атомов.
Таким образом, количество положительных зарядов, присутствующих в ядре элемента, называется атомным номером этого элемента. Атомный номер элемента обозначается буквой «Z». Это число равно порядковому номеру таблицы Менделеева. Мы знаем, что протоны находятся в ядре атома в виде положительного заряда.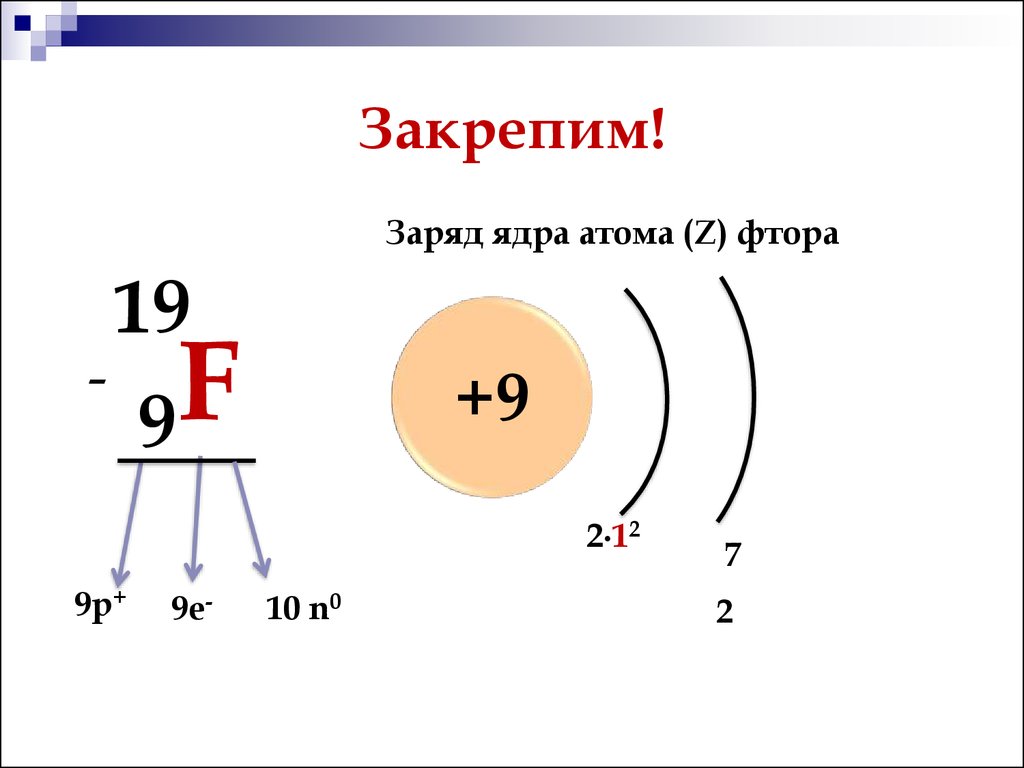
То есть атомный номер — это общее количество протонов. Атом в целом нейтрален по заряду. Следовательно, количество отрицательно заряженных электронов, обращающихся по своей орбите, равно количеству положительно заряженных протонов в ядре.
Атомный номер (Z) = количество зарядов в ядре (p)
Сколько протонов имеет атом фосфора?
Протоны — постоянные частицы ядра атома. Он находится в центре или ядре атома. Когда атом водорода удаляет электрон со своей орбиты, оставшаяся положительно заряженная частица называется протоном. Следовательно, протон выражается как H + . Относительная масса протонов равна 1, что примерно равно массе водорода (1,00757 а.е.м.).
Однако фактическая масса протона составляет 1,6726 × 10 −27 кг. То есть масса протона примерно в 1837 раз больше массы электрона. Протон — положительно заряженная частица. Его фактический заряд составляет +1,602 × 10 −19 кулонов. Диаметр протонной частицы составляет около 2,4 × 10 -13 см.
В периодической таблице 118 элементов, и 15-й из них — фосфор. Элементы в периодической таблице расположены в соответствии с их атомным номером. Поскольку фосфор является 15-м элементом периодической таблицы, атомный номер фосфора равен 15. Мы всегда должны помнить, что атомный номер и число протонов элемента равны. Следовательно, атом фосфора содержит пятнадцать протонов.
Сколько электронов у атома фосфора?
Электроны — постоянные частицы ядра атома. Он находится на определенной орбите атома и вращается вокруг ядра. Свойства элементов и их соединений зависят от электронной конфигурации. В 1897 году ученый Дж. Дж. Томсон обнаружил существование электронов с помощью электронно-лучевого исследования.
Наименьшая из частиц постоянного ядра атома — электрон. Его масса составляет примерно 1/1836 массы атома водорода. Фактическая масса электрона равна 90,1085 × 10 −28 г или 9,1093 × 10 −31 кг. Массой электрона часто пренебрегают, потому что эта масса слишком мала. Электроны всегда дают отрицательный заряд.
Электроны всегда дают отрицательный заряд.
Выражается e – . Заряд электронов составляет –1,609 × 10 –19 кулонов, а относительный заряд – –1. То есть заряд электрона равен заряду протона, но наоборот. Мы также должны помнить, что количество протонов и электронов в элементе одинаково. Следовательно, атом фосфора содержит на своей орбите пятнадцать электронов.
Сколько нейтронов у атома фосфора?
Ученый Чедвик открыл нейтрон в 1932 году. Он находится в ядре в центре атома. Нейтрон является частицей с нейтральным зарядом и выражается через n. Заряд нейтрона равен 0, и относительный заряд также равен 0. Масса нейтрона составляет 1,674 × 10 -27 кг. Количество электронов и протонов в атоме одинаково, но количество нейтронов разное.
Мы уже знаем, что ядро находится в центре атома. В ядре есть два типа частиц. Один из них представляет собой положительно заряженный протон, а другой — нейтрон с нейтральным зарядом. Почти вся масса атома сосредоточена в ядре. Поэтому массу ядра называют атомной массой. Ядро состоит из протонов и нейтронов. Следовательно, атомная масса относится к общей массе протонов и нейтронов.
Почти вся масса атома сосредоточена в ядре. Поэтому массу ядра называют атомной массой. Ядро состоит из протонов и нейтронов. Следовательно, атомная масса относится к общей массе протонов и нейтронов.
Атомная масса (A) = Масса ядра = Суммарная масса протонов и нейтронов (p + n)
Опять же, масса каждого протона и нейтрона составляет около 1 а.е.м. Поэтому общее число протонов и нейтронов называется атомным массовым числом. То есть число атомной массы (А) равно p + n
Таким образом, число нейтронов в элементе получается из разницы между числом атомных масс и числом атомов. То есть число нейтронов (n) = атомное массовое число (A) – атомное число (Z)
| Mass number (A) | Atomic number (Z) | Neutron number = A – Z |
| 30.974 | 15 | 16 |
Мы знаем, что атомный номер фосфора равен 15, а атомное массовое число около 31. Нейтрон = 31 – 15 = 16. Следовательно, атом фосфора имеет шестнадцать нейтронов.
Нейтрон = 31 – 15 = 16. Следовательно, атом фосфора имеет шестнадцать нейтронов.
Основываясь на атомном номере, массовом числе и числе нейтронов элемента, можно рассмотреть три вещи. Это изотоп, изобар и изотон. Количество нейтронов зависит от изотопа атома. Атом фосфора имеет около двадцати трех изотопа.
Количество протонов, электронов и нейтронов для фосфораКак определить количество нейтронов по изотопам фосфора?
Атомы, имеющие одинаковое количество протонов, но разные массовые числа, называются изотопами друг друга. Английский химик Фредерик Соди впервые выдвинул идею изотопов в 1912 году, а ученый Астон в 1919 году определил два атома неона с разными массами ( 20 Ne, 22 Ne).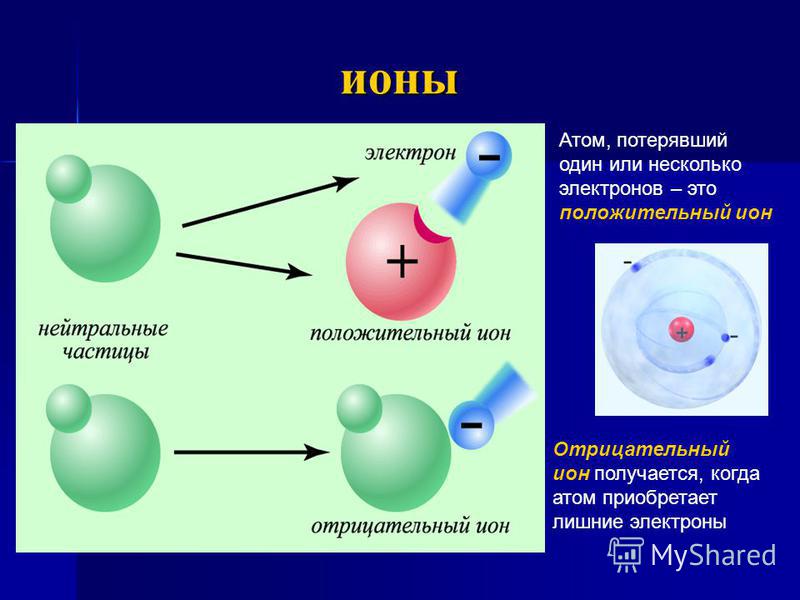 Он назвал атомы одного и того же элемента с разной массой изотопами этого элемента.
Он назвал атомы одного и того же элемента с разной массой изотопами этого элемента.
Количество протонов в атоме изотопа не меняется, но меняется количество нейтронов. Атом фосфора имеет около двадцати трех изотопа. Такие как 25 P, 26 P, 27 P, 28 P, 29 P, 30 P, 31 P, 32 P, 33 P, 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 34 P, 33 9002 П, 35 П, 36 П, 37 П, 38 П, 39 П, 40 П, 41 П, 0024 43 P, 44 P, 45 P, 46 P и 47 P. Среди изотопов 31 P стабилен и образуется естественным путем.
| Isotope | Mass number (A) | Atomic number (Z) | Neutron number = A – Z | ||||
| 25 P | 25.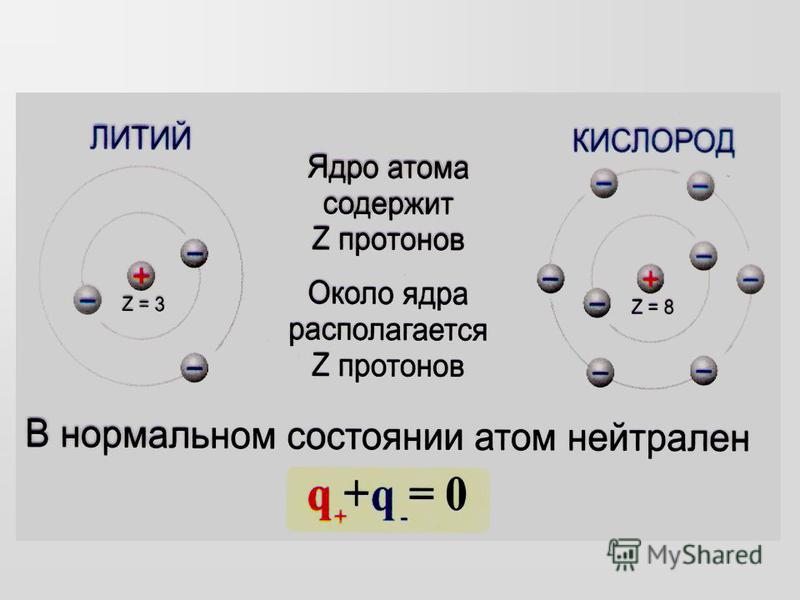 02119 02119 | 15 | 10 | ||||
| 26 П | 26.01178 | 15 | 11 | ||||
| 27 P | 26.999224 | 15 | 12 | ||||
| 28 P | 27.9923266 | 15 | 13 | ||||
| 29 P | 28.9818004 | 15 | 14 | ||||
| 30 P | 29.97831349 | 15 | 15 | ||||
| 31 P | 30. 9737619986 9737619986 | 15 | 16 | ||||
| 32 P | 31.973 | ||||||
| 15 | 17 | ||||||
| 33 P | 32.9717257 | 15 | 18 | ||||
| 34 P | 33.9736459 | 15 | 19 | ||||
| 35 P | 34.9733141 | 15 | 20 | ||||
| 36 P | 35.978260 | 15 | 21 | ||||
| 37 P | 36.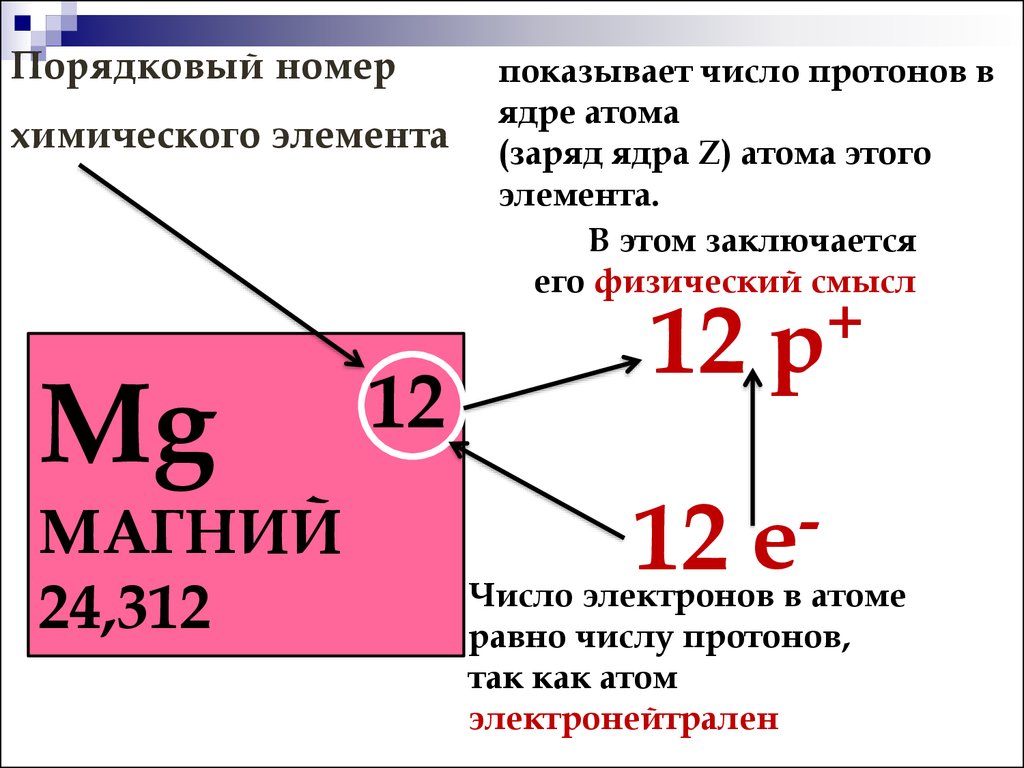 97961 97961 | 15 | 22 | ||||
| 38 P | 37.98430 | 15 | 23 | ||||
| 39 P | 38.98629 | 15 | 24 | ||||
| 40 P | 39.99129 | 15 | 25 | ||||
| 41 P | 40.99465 | 15 | 26 | ||||
| 42 P | 42.00108 | 15 | 27 | ||||
| 43 P | 43. 00502 00502 | 15 | 28 | ||||
| 44 P | 44.01122 | 15 | 29 | ||||
| 45 P | 45.01675 | 15 | 30 | .0281 46.02466 | 15 | 31 | |
| 47 P | 47.03190 | 15 | 32 |
The remaining isotopes of phosphorus are highly unstable and their half-lives очень короткие. Из 23 радиоизотопов фосфора самым долгоживущим является радиоизотоп 33 P с периодом полураспада 25,34 дня и 32 P с периодом полураспада 14,268 дня. Все остальные меньше минуты, большинство меньше секунды. Масса конюшни 31 P составляет около 31 (30,973761).
Все остальные меньше минуты, большинство меньше секунды. Масса конюшни 31 P составляет около 31 (30,973761).
Сколько протонов, нейтронов и электронов имеет фосфид-ион (P
3-)?Когда атом несет отрицательный или положительный заряд, принимая или отталкивая электроны, он называется ионом. Ионные свойства элементов зависят от обмена электронами. В атомарном ионе изменяется только число электронов, но не изменяется число протонов и нейтронов. У фосфора на последней орбите пять электронов.
Атомный номер, атомный вес и заряд фосфид-иона (P 3- )В этом случае атом фосфора может получить электроны на своей последней оболочке. При образовании связи последняя оболочка фосфора получает три электрона и превращается в фосфид-ион (P 3-). В этом случае атом фосфора несет отрицательный заряд.
P + 3e – → P 3-
Здесь электронная конфигурация фосфид-иона (P 3- ) равна 1s 2 2s 9 2 2s 9 2 00024 2 3p 6 . Этот отрицательный фосфид-ион (P 3-) имеет пятнадцать протонов, шестнадцать нейтронов и восемнадцать электронов.
Этот отрицательный фосфид-ион (P 3-) имеет пятнадцать протонов, шестнадцать нейтронов и восемнадцать электронов.
| Phosphorus ion | Protons | Neutrons | Electrons |
| P 3- | 15 | 16 | 18 |
Какими свойствами обладают протоны, нейтроны и электроны?
| Name | Symbol | Relative Mass (amu) | Relative Charge | Actual Mass(kg) | Actual Charge(C) | Location |
| Протон | p | 1. 00757 00757 | +1 | 1.672×10 −27 | 1.602×10 −19 | Inside the nucleus |
| Neutron | n | 1.0089 | 0 | 1.674× 10 −27 | 0 | Inside the nucleus |
| Electron | e – | 5.488×10 −4 | –1 | 9.109×10 −31 | –1.6 ×10 –19 | Вне ядра |
Почему нам важно знать количество электронов и протонов?
Атомный номер — это число, которое несет в себе свойства элемента. Количество электронов и протонов в элементе определяется атомным номером. Также определяется точное положение элемента в периодической таблице. Свойства элемента можно определить по электронной конфигурации.
Количество электронов и протонов в элементе определяется атомным номером. Также определяется точное положение элемента в периодической таблице. Свойства элемента можно определить по электронной конфигурации.
Кроме того, валентность, валентные электроны и ионные свойства элементов определяются электронной конфигурацией. Чтобы определить свойства элемента, необходимо расположить электроны этого элемента. И чтобы расположить электроны, вы должны знать количество электронов в этом элементе.
Чтобы узнать количество электронов, вам нужно знать атомный номер этого элемента. Мы знаем, что в ядре элемента находится равное количество протонов с атомным номером, а электроны, равные протонам, находятся на орбите вне ядра.
Атомный номер (Z) = количество электронов
Атомный номер фосфора равен 15. То есть в атоме элемента фосфора пятнадцать электронов. Итак, по электронной конфигурации можно определить свойства фосфора. Теперь электронная конфигурация фосфора показывает, что на последней орбите пять электронов. Следовательно, валентных электронов фосфора пять.
Следовательно, валентных электронов фосфора пять.
Последняя оболочка фосфора имеет три неспаренных электрона, поэтому валентность фосфора равна 3. Последний электрон фосфора выходит на p-орбиталь. Следовательно, это элемент p-блока. Чтобы знать эти свойства фосфора, нужно знать число электронов и протонов фосфора.
Ссылка
- Википедия
Сколько протонов в атоме фосфора

 Протоны и нейтроны входят в состав ядра атома, а электроны вращаются вокруг.
Протоны и нейтроны входят в состав ядра атома, а электроны вращаются вокруг. Это число 16. Это сера S, формула её высшего оксида – SO3.
Это число 16. Это сера S, формула её высшего оксида – SO3.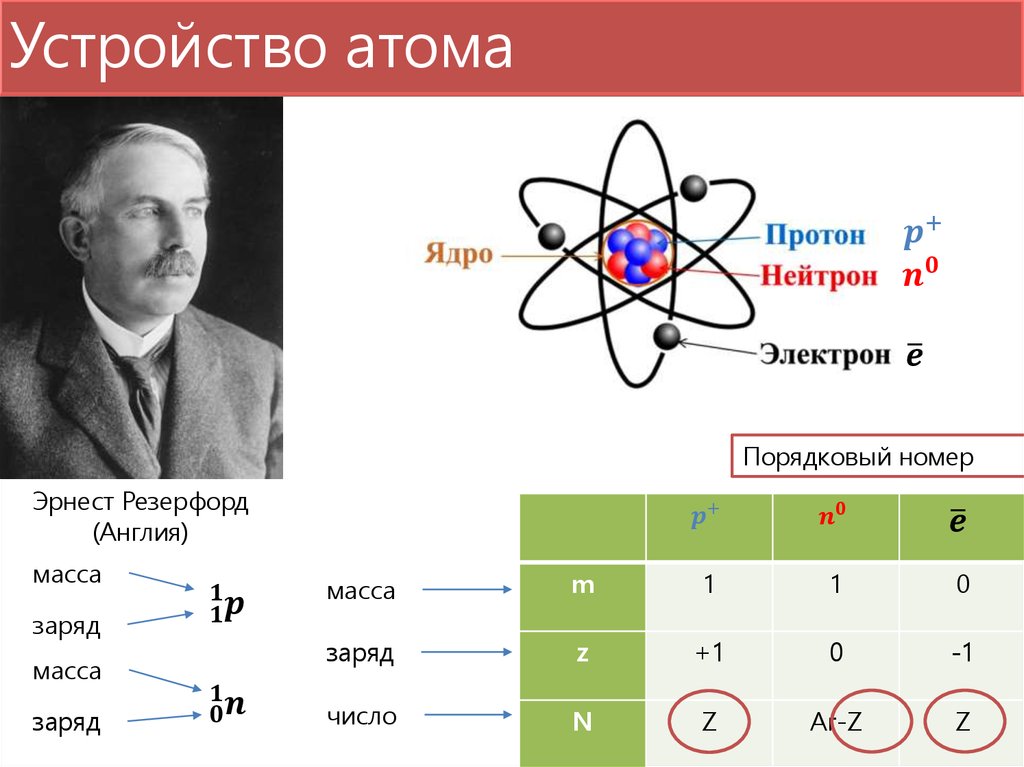
 Распределению электронов в атоме этого элемента соответствует ряд чисел:
Распределению электронов в атоме этого элемента соответствует ряд чисел: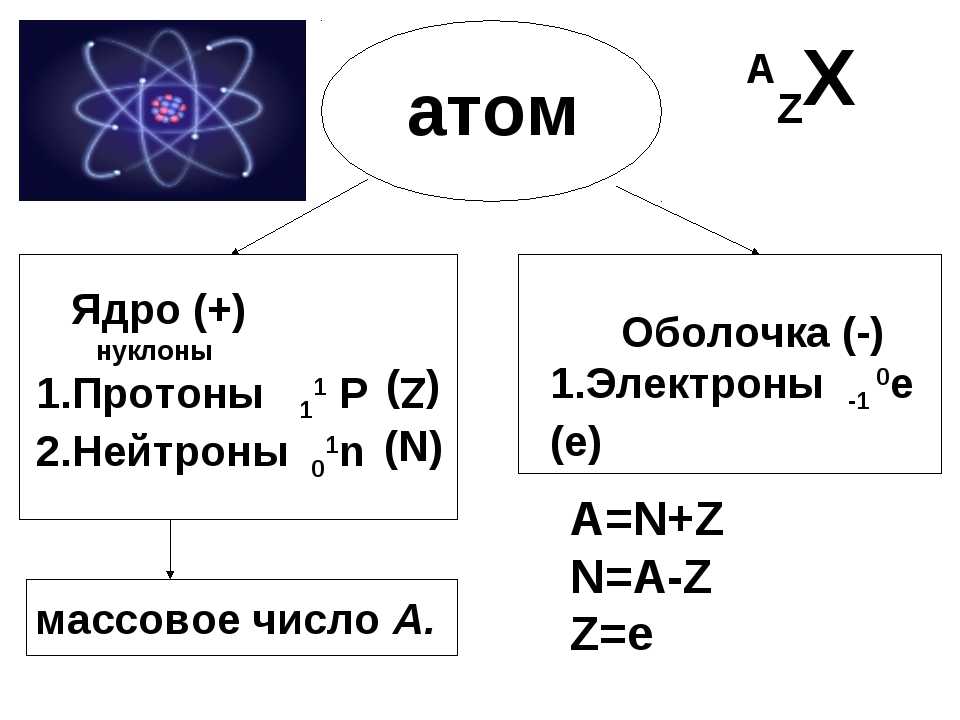 Это Mg. Ему соответствует оксид ЭО.
Это Mg. Ему соответствует оксид ЭО.  Be, Mg, Ca, Sr, Ba
Be, Mg, Ca, Sr, Ba
 Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. При e-захвате ядро поглощает один из электронов
атомной оболочки (обычно из ближайшей к нему K-оболочки),
испуская нейтрино.В литературе для e-захвата
часто используется термин EC (Electron Capture).
При e-захвате ядро поглощает один из электронов
атомной оболочки (обычно из ближайшей к нему K-оболочки),
испуская нейтрино.В литературе для e-захвата
часто используется термин EC (Electron Capture).  Происходящие при
этом внутри ядра превращения нуклонов и энергетические условия β—распада имеют вид (массу нейтрино полагаем нулевой):
Происходящие при
этом внутри ядра превращения нуклонов и энергетические условия β—распада имеют вид (массу нейтрино полагаем нулевой):

 При β+-распаде
образуются позитрон и нейтрино. При е-захвате из ядра вылетают нейтрино.
Так как е-захват – двухчастичный процесс, спектры нейтрино и ядра отдачи
являются дискретными. Наблюдение дискретного спектра ядер отдачи, образующихся
при е-захвате, было первым подтверждением правильности гипотезы Паули.
При β+-распаде
образуются позитрон и нейтрино. При е-захвате из ядра вылетают нейтрино.
Так как е-захват – двухчастичный процесс, спектры нейтрино и ядра отдачи
являются дискретными. Наблюдение дискретного спектра ядер отдачи, образующихся
при е-захвате, было первым подтверждением правильности гипотезы Паули. Они
лежат в интервале T1/2(β) = 10-6 с – 1017 лет.
Они
лежат в интервале T1/2(β) = 10-6 с – 1017 лет. Масса «нейтрона» по порядку величины должна быть сравнимой с массой
электрона и во всяком случае не более 0.01 массы протона. Непрерывный β-спектр
тогда стал бы понятным, если предположить, что при распаде вместе с электроном
испускается ещё и «нейтрон» таким образом, что сумма энергий «нейтрона» и
электрона остаётся постоянной».
Масса «нейтрона» по порядку величины должна быть сравнимой с массой
электрона и во всяком случае не более 0.01 массы протона. Непрерывный β-спектр
тогда стал бы понятным, если предположить, что при распаде вместе с электроном
испускается ещё и «нейтрон» таким образом, что сумма энергий «нейтрона» и
электрона остаётся постоянной».

 В ядре 7Be происходит электронный
захват
В ядре 7Be происходит электронный
захват
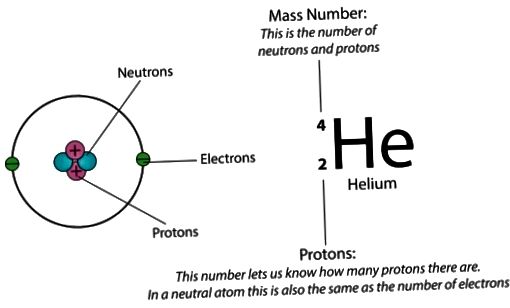
 После облучения в течение
приблизительно 10 минут фольга
помещается над счётчиком Гейгера-Мюллера с окошком,
толщина которого 7/100 мм алюминия. При этом фольга испускает излучение,
интенсивность которого уменьшается экспоненциально со временем с периодом 3 мин.
15 сек. Аналогичные результаты получены с бором и магнием, причём периоды
полураспада различны, а именно: 14 мин. для бора и 2 мин. 30 сек. для магния.
После облучения в течение
приблизительно 10 минут фольга
помещается над счётчиком Гейгера-Мюллера с окошком,
толщина которого 7/100 мм алюминия. При этом фольга испускает излучение,
интенсивность которого уменьшается экспоненциально со временем с периодом 3 мин.
15 сек. Аналогичные результаты получены с бором и магнием, причём периоды
полураспада различны, а именно: 14 мин. для бора и 2 мин. 30 сек. для магния. Вся энергия e-захвата Qe-захв уносится антинейтрино, образующимся при β-распаде. β+-распад
возможен только в том случае, если масса исходного атома атM(A,Z)
превышает массу атома атM(A,Z-1),
образующегося в результате β+-распада
на 2me.
Разность энергий Qβ+ = (Qe-захв − 2me)
равна энергии β+-распада.
Энергия Qβ+ равна максимальной энергии, которую имеет позитрон в результате β+-распада.
Если масса исходного атома атM(A,Z)
больше массы атома атM(A,Z-1),
но разность масс атM(A,Z) − атM(A,Z-1)
не превышает величину 2me, β+-распад
запрещён законом сохранения энергии, а е-захват
возможен.
Вся энергия e-захвата Qe-захв уносится антинейтрино, образующимся при β-распаде. β+-распад
возможен только в том случае, если масса исходного атома атM(A,Z)
превышает массу атома атM(A,Z-1),
образующегося в результате β+-распада
на 2me.
Разность энергий Qβ+ = (Qe-захв − 2me)
равна энергии β+-распада.
Энергия Qβ+ равна максимальной энергии, которую имеет позитрон в результате β+-распада.
Если масса исходного атома атM(A,Z)
больше массы атома атM(A,Z-1),
но разность масс атM(A,Z) − атM(A,Z-1)
не превышает величину 2me, β+-распад
запрещён законом сохранения энергии, а е-захват
возможен. 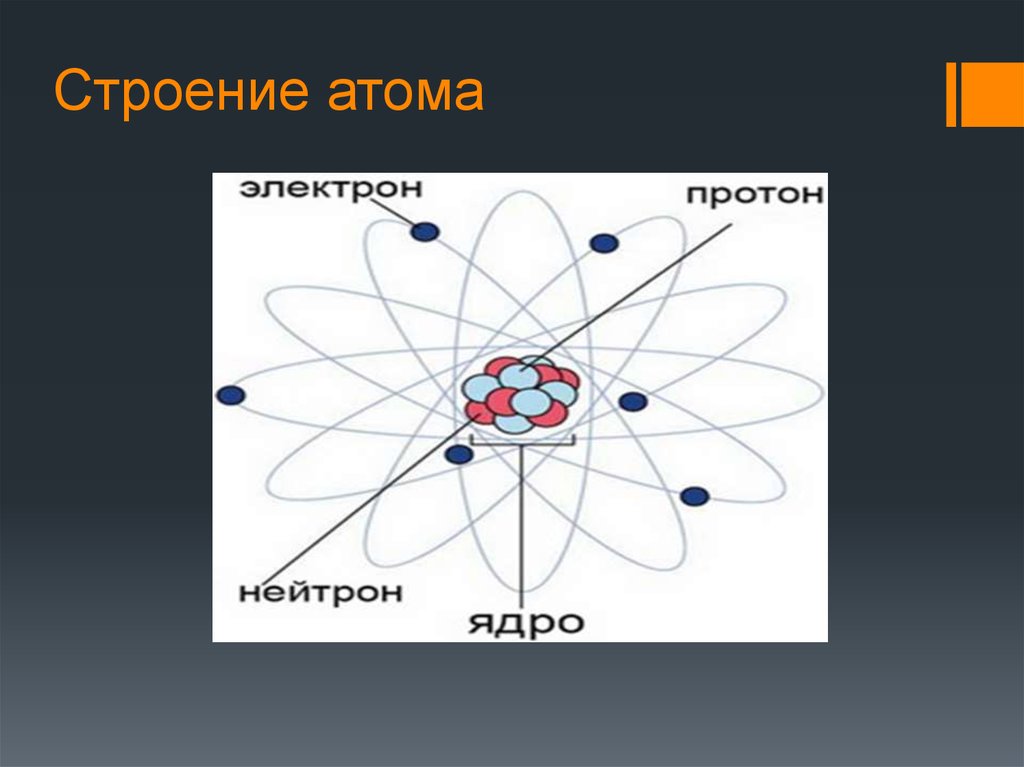
 К разрешенным переходам
относятся переходы, при которых суммарный орбитальный момент l,
уносимый электроном и нейтрино, равен нулю. Запрещенные переходы подразделяются
по порядку запрета, который определяется орбитальным моментом l.
К разрешенным переходам
относятся переходы, при которых суммарный орбитальный момент l,
уносимый электроном и нейтрино, равен нулю. Запрещенные переходы подразделяются
по порядку запрета, который определяется орбитальным моментом l.  Классический момент импульса pb равен
величине орбитального момента
Классический момент импульса pb равен
величине орбитального момента При этом как правило вероятность захвата электрона с K-оболочки
гораздо выше, чем вероятность захвата электрона с L-оболочки.
Процесс е-захвата сопровождается испусканием рентгеновского излучения,
регистрируя которое можно обнаружить процесс е-захвата. На рисунке показано
отношение вероятности K-захвата
к вероятности β+-распада
При этом как правило вероятность захвата электрона с K-оболочки
гораздо выше, чем вероятность захвата электрона с L-оболочки.
Процесс е-захвата сопровождается испусканием рентгеновского излучения,
регистрируя которое можно обнаружить процесс е-захвата. На рисунке показано
отношение вероятности K-захвата
к вероятности β+-распада 02 МэВ
02 МэВ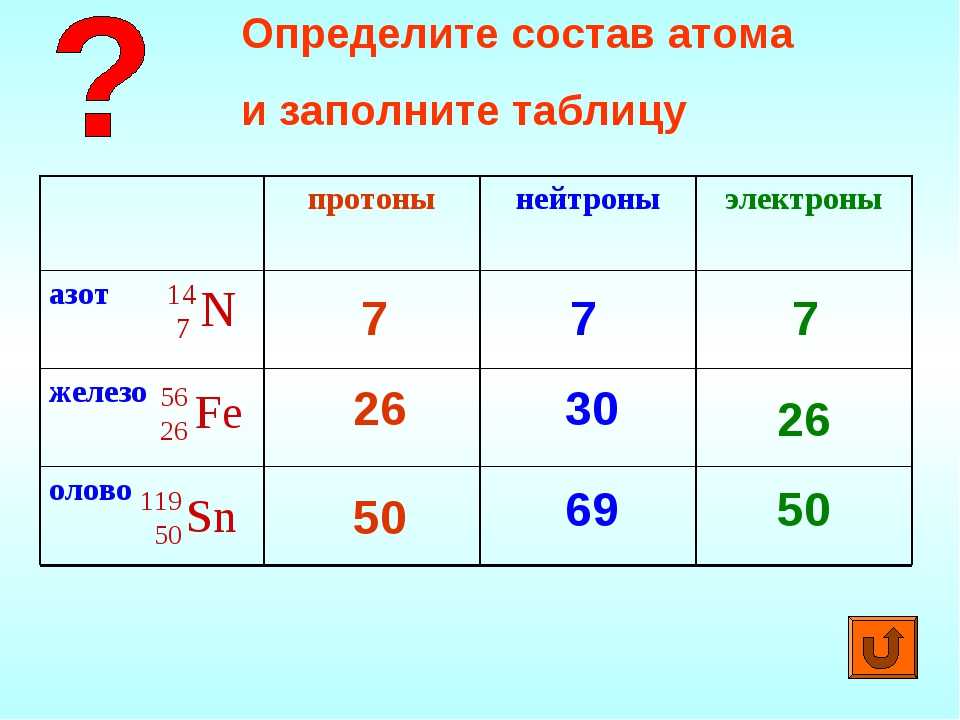 86 МэВ, что меньше, чем 2mec2 = 1.02 МэВ.
86 МэВ, что меньше, чем 2mec2 = 1.02 МэВ. В ядре распадается одиночный нуклон.
Однако в процессе β-распада происходит перестройка ядра. Поэтому период
полураспада а также другие характеристики β-распада в значительной степени
зависят от того насколько сложна эта перестройка. Стабильные по отношению к
β-распаду ядра при всех А располагаются вокруг значений Zравн с возможным небольшим разбросом в обе стороны за счет индивидуальных
особенностей ядер.
В ядре распадается одиночный нуклон.
Однако в процессе β-распада происходит перестройка ядра. Поэтому период
полураспада а также другие характеристики β-распада в значительной степени
зависят от того насколько сложна эта перестройка. Стабильные по отношению к
β-распаду ядра при всех А располагаются вокруг значений Zравн с возможным небольшим разбросом в обе стороны за счет индивидуальных
особенностей ядер. 31 МэВ JP = 0+ образуют изотопический триплет
31 МэВ JP = 0+ образуют изотопический триплет
 Однако при этом появляется принципиальная возможность β-распада
с изменением заряда ядра на 2 единицы с испусканием двух электронов и двух
антинейтрино или двух позитронов и двух нейтрино.
Однако при этом появляется принципиальная возможность β-распада
с изменением заряда ядра на 2 единицы с испусканием двух электронов и двух
антинейтрино или двух позитронов и двух нейтрино. Из вероятностей распада 89Sr
и 89Zr
на различные состояния 89Y
видна сильная зависимость вероятности β-распада
от спинов и четностей состояний, между которыми происходит β-распад.
Из вероятностей распада 89Sr
и 89Zr
на различные состояния 89Y
видна сильная зависимость вероятности β-распада
от спинов и четностей состояний, между которыми происходит β-распад.
 Распад изотопа происходит с вероятностью 100% на основное состояние ядра 34S.
Объясняется это тем, что в основных состояниях оба изотопа имеют одинаковую
спин-четность JP = 0+.
Распад изомерного состояния JP = 3+, E* = 0.145 МэВ изотопа 34Cl
происходит на возбужденные состояния 34S
с энергией E* > 2 МэВ.
Распад изотопа происходит с вероятностью 100% на основное состояние ядра 34S.
Объясняется это тем, что в основных состояниях оба изотопа имеют одинаковую
спин-четность JP = 0+.
Распад изомерного состояния JP = 3+, E* = 0.145 МэВ изотопа 34Cl
происходит на возбужденные состояния 34S
с энергией E* > 2 МэВ. 7 кэВ, JP = 3/2—.
Основное состояние 73Se имеет JP = 9/2+.
Изомерное состояние E* = 0.025 МэВ, JP = 3/2—.
Вероятность изомерного перехода 73mSe
→ 73Se составляет 72.6%, вероятность β-распада
27.4%. β-распад 73Se из основного состояния происходит с вероятностью 100% на возбужденное
состояние E* = 0.42 МэВ JP = 9/2+.
7 кэВ, JP = 3/2—.
Основное состояние 73Se имеет JP = 9/2+.
Изомерное состояние E* = 0.025 МэВ, JP = 3/2—.
Вероятность изомерного перехода 73mSe
→ 73Se составляет 72.6%, вероятность β-распада
27.4%. β-распад 73Se из основного состояния происходит с вероятностью 100% на возбужденное
состояние E* = 0.42 МэВ JP = 9/2+.  На рис. показана энергетическая диаграмма α-
и β-распадов ядер-изобар A = 210 Pb (Z = 82), Bi (Z = 83) и Po
(Z = 84).
На рис. показана энергетическая диаграмма α-
и β-распадов ядер-изобар A = 210 Pb (Z = 82), Bi (Z = 83) и Po
(Z = 84).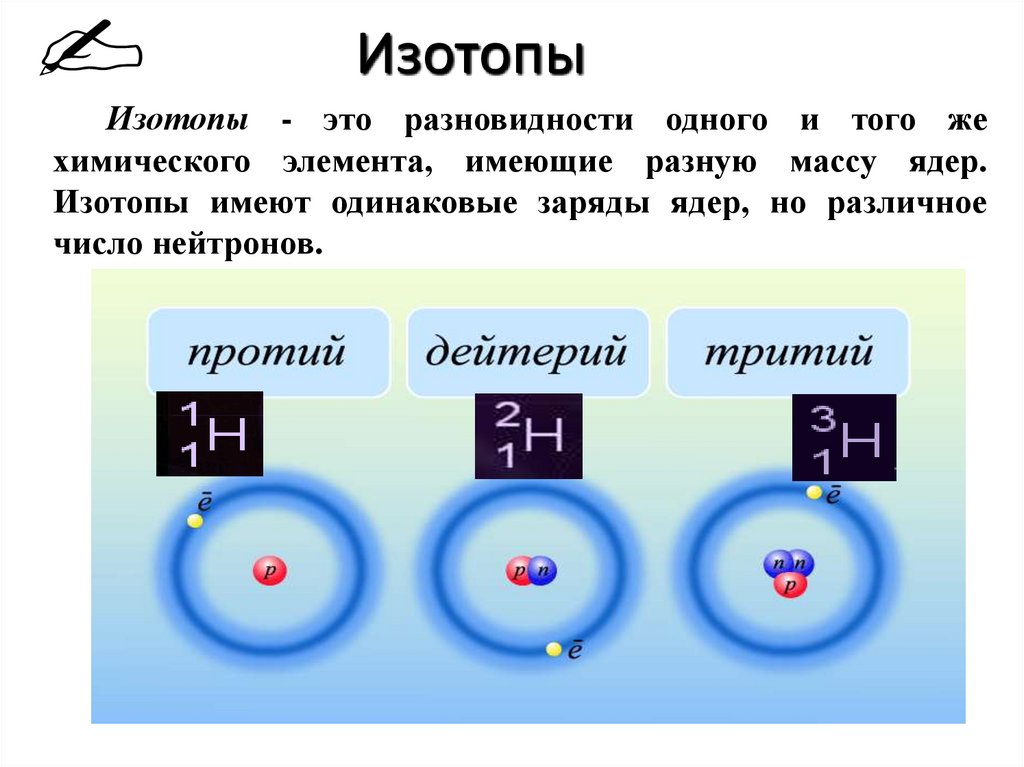 В частности, они
позволяют накапливать и в течение длительного времени использовать полностью
ионизованные атомы – «голые» ядра. В результате становится возможным
исследовать свойства атомных ядер, у которых нет
электронного окружения и в которых отсутствует кулоновское воздействие
внешней электронной оболочкис атомным ядром.
В частности, они
позволяют накапливать и в течение длительного времени использовать полностью
ионизованные атомы – «голые» ядра. В результате становится возможным
исследовать свойства атомных ядер, у которых нет
электронного окружения и в которых отсутствует кулоновское воздействие
внешней электронной оболочкис атомным ядром. Ядро 163Ho,
окруженное электронной оболочкой,β—-радиоактивно
и его период полураспада составляет ~104 лет.
Однако это справедливо только если рассматривать ядро в окружении электронной
оболочки. Для полностью ионизированных атомов картина принципиально другая.
Теперь основное состояние ядра 163Dy оказывается по энергии
выше основного состояния ядра 163Ho
и открывается возможность для распада 163Dy
(рис. 3.2)
Ядро 163Ho,
окруженное электронной оболочкой,β—-радиоактивно
и его период полураспада составляет ~104 лет.
Однако это справедливо только если рассматривать ядро в окружении электронной
оболочки. Для полностью ионизированных атомов картина принципиально другая.
Теперь основное состояние ядра 163Dy оказывается по энергии
выше основного состояния ядра 163Ho
и открывается возможность для распада 163Dy
(рис. 3.2) 3±1) кэВ
и (1.7±1) кэВ. Для наблюдения распада
на связанные состояния K- и L-оболочки в накопительном кольце ESR в GSI было
накоплено 108 полностью ионизированных ядер .
В течение времени накопления в результате β+-распада
образовывались ядра
(рис. 3.3).
3±1) кэВ
и (1.7±1) кэВ. Для наблюдения распада
на связанные состояния K- и L-оболочки в накопительном кольце ESR в GSI было
накоплено 108 полностью ионизированных ядер .
В течение времени накопления в результате β+-распада
образовывались ядра
(рис. 3.3). За счет того, что ионыHo66+ захватывали электроны, они выбывали с равновесной орбиты. Очистка пучка
проходила в течение приблизительно 500 с. После чего газовая струя перекрывалась
и в кольце продолжали циркулировать ионы Dy66+ и вновь образовавшиеся (после выключения газовой струи) в результате распада
ионы Ho66+.
Продолжительность этого этапа менялась от 10 до 85 мин. Детектирование и
идентификация Ho66+ базировались на том,
что Ho66+ можно еще сильнее ионизировать. Для этого на последнем
этапе в накопительное кольцо снова инжектировалась газовая струя. Происходило
обдирание последнего электрона с иона 163Ho66+ и в
результате получался ион 163Ho67+. Рядом с газовой
струей располагался позиционно-чувствительный детектор, которым регистрировались
выбывающие из пучка ионы 163Ho67+.
На рис. 3.4 показана зависимость числа
образующихся в результате β-распада
ядер 163Ho от времени накопления.
За счет того, что ионыHo66+ захватывали электроны, они выбывали с равновесной орбиты. Очистка пучка
проходила в течение приблизительно 500 с. После чего газовая струя перекрывалась
и в кольце продолжали циркулировать ионы Dy66+ и вновь образовавшиеся (после выключения газовой струи) в результате распада
ионы Ho66+.
Продолжительность этого этапа менялась от 10 до 85 мин. Детектирование и
идентификация Ho66+ базировались на том,
что Ho66+ можно еще сильнее ионизировать. Для этого на последнем
этапе в накопительное кольцо снова инжектировалась газовая струя. Происходило
обдирание последнего электрона с иона 163Ho66+ и в
результате получался ион 163Ho67+. Рядом с газовой
струей располагался позиционно-чувствительный детектор, которым регистрировались
выбывающие из пучка ионы 163Ho67+.
На рис. 3.4 показана зависимость числа
образующихся в результате β-распада
ядер 163Ho от времени накопления.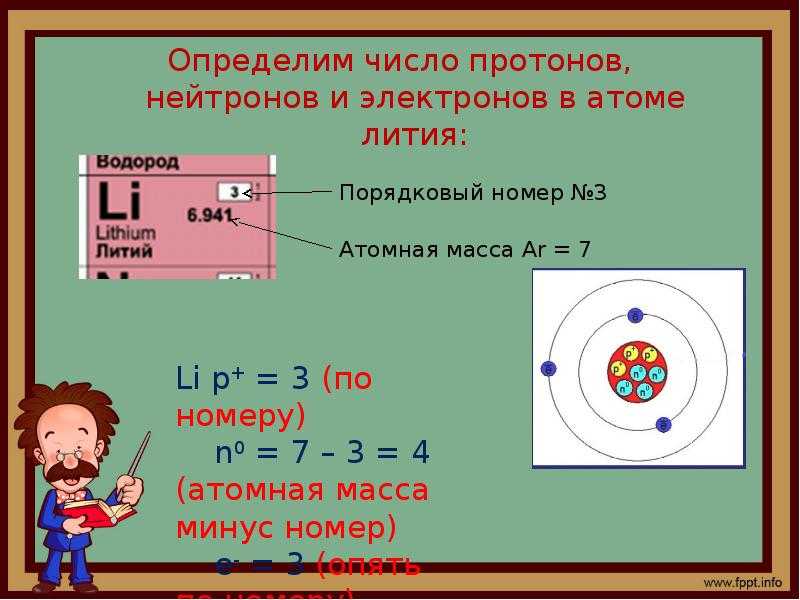 На вставке показано пространственное разрешение позиционно-чувствительного
детектора.
На вставке показано пространственное разрешение позиционно-чувствительного
детектора. Период полураспада 187Re75+ составляет
всего 33±2 года. Поэтому в
астрофизические измерения необходимо вносить соответствующие поправки, т.к. в звездах 187Re чаще всего находится в
ионизированном состоянии.
Период полураспада 187Re75+ составляет
всего 33±2 года. Поэтому в
астрофизические измерения необходимо вносить соответствующие поправки, т.к. в звездах 187Re чаще всего находится в
ионизированном состоянии. Источник 60Co,
помещался в магнитное поле кругового тока, под действием которого спины ядер
выстраивались вдоль направления поля. Для того, чтобы тепловое движение не
уничтожило поляризацию 60Co
охлаждался до низкой температуры ~0.01о K.
Измерялось количество электронов β
-распада
Источник 60Co,
помещался в магнитное поле кругового тока, под действием которого спины ядер
выстраивались вдоль направления поля. Для того, чтобы тепловое движение не
уничтожило поляризацию 60Co
охлаждался до низкой температуры ~0.01о K.
Измерялось количество электронов β
-распада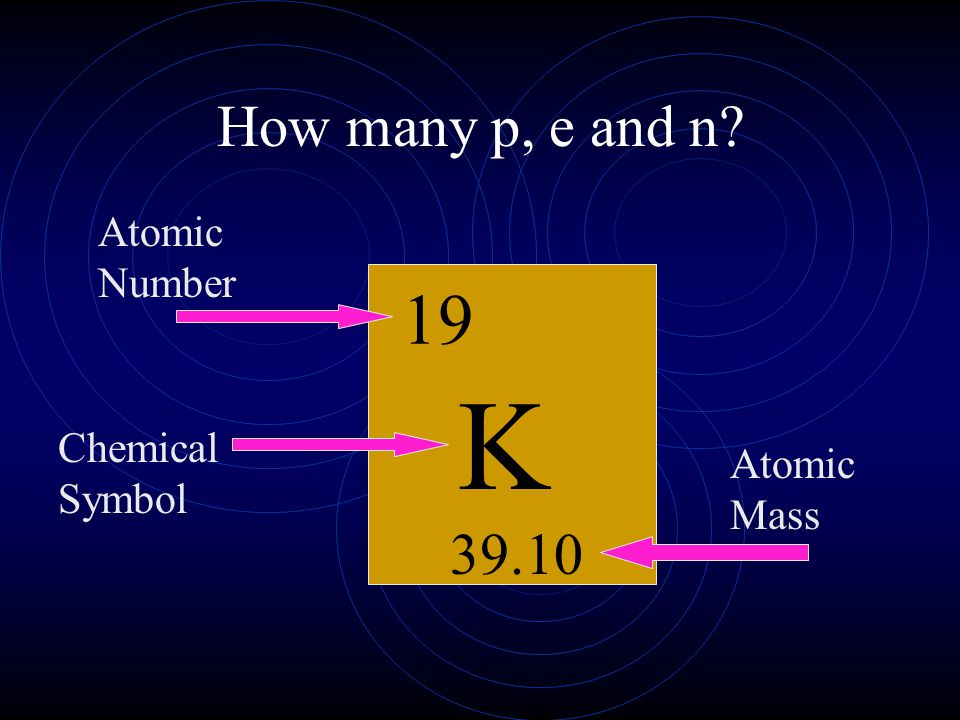 Если бы пространственная четность сохранялась, что эквивалентно
зеркальному отражению, должно было бы регистрироваться одинаковое количество
электронов, как по направлению магнитного поля, так и в противоположном
направлении. Оказалось, что электроны испускаются преимущественно в направлении
противоположном направлению спинов ядер (магнитного поля), т.е. тем самым было
доказано, что в слабых распадах четность не сохраняется. Спин антинейтрино
всегда направлен по импульсу (положительная или правая спиральность), спин
нейтрино − против импульса (отрицательная или левая спиральность).
Если бы пространственная четность сохранялась, что эквивалентно
зеркальному отражению, должно было бы регистрироваться одинаковое количество
электронов, как по направлению магнитного поля, так и в противоположном
направлении. Оказалось, что электроны испускаются преимущественно в направлении
противоположном направлению спинов ядер (магнитного поля), т.е. тем самым было
доказано, что в слабых распадах четность не сохраняется. Спин антинейтрино
всегда направлен по импульсу (положительная или правая спиральность), спин
нейтрино − против импульса (отрицательная или левая спиральность). Ядра кобальта-60 поляризовались в магнитном
поле при очень низких температурах. Действительно, в этом эксперименте
направление кругового электрического тока в соленоиде, создающем поляризующее
магнитное поле, совместно с направлением предпочтительного испускания
β-электронов однозначно отделяют правую систему координат от левой. Таким
образом, несохранение четности (или, другими словами, неинвариаптность
относительно зеркального отражения) может быть установлено без каких-либо
теоретических соображении…
Ядра кобальта-60 поляризовались в магнитном
поле при очень низких температурах. Действительно, в этом эксперименте
направление кругового электрического тока в соленоиде, создающем поляризующее
магнитное поле, совместно с направлением предпочтительного испускания
β-электронов однозначно отделяют правую систему координат от левой. Таким
образом, несохранение четности (или, другими словами, неинвариаптность
относительно зеркального отражения) может быть установлено без каких-либо
теоретических соображении… Следовательно, теория неинвариантна относительно преобразования зеркального
отражения.
Следовательно, теория неинвариантна относительно преобразования зеркального
отражения.  Эта фундаментальная идея быстро вошла в плоть и кровь физики.
Так как наличие и в других взаимодействиях симметрии между правым и левым
не вызывало сомнения, то эта идей была распространена
на другие области физики: на ядерные реакции, β-распад, взаимодействие мезонов и
взаимодействие странных частиц. Почему так случилось, что среди множества
экспериментов по β-распаду – наиболее исчерпывающе исследованному процессу из
числа слабых взаимодействий – не было указаний на сохранение четности в слабых
взаимодействиях? Это случилось благодаря комбинации двух причин. Во-первых,
потому, что у нейтрино отсутствует масса, что приводит к неопределенности, не
позволяющей получить косвенных указаний о выполнении закона сохранения четности
из таких простых экспериментов, как изучение β-спектра. Во-вторых,
чтобы непосредственно проверить выполнение закона сохранения четности в
β-распаде, недостаточно изучать только четности ядерных уровней, как это всегда
делалось. Надо изучать сохранение четности в целом во всем процессе распада.
Эта фундаментальная идея быстро вошла в плоть и кровь физики.
Так как наличие и в других взаимодействиях симметрии между правым и левым
не вызывало сомнения, то эта идей была распространена
на другие области физики: на ядерные реакции, β-распад, взаимодействие мезонов и
взаимодействие странных частиц. Почему так случилось, что среди множества
экспериментов по β-распаду – наиболее исчерпывающе исследованному процессу из
числа слабых взаимодействий – не было указаний на сохранение четности в слабых
взаимодействиях? Это случилось благодаря комбинации двух причин. Во-первых,
потому, что у нейтрино отсутствует масса, что приводит к неопределенности, не
позволяющей получить косвенных указаний о выполнении закона сохранения четности
из таких простых экспериментов, как изучение β-спектра. Во-вторых,
чтобы непосредственно проверить выполнение закона сохранения четности в
β-распаде, недостаточно изучать только четности ядерных уровней, как это всегда
делалось. Надо изучать сохранение четности в целом во всем процессе распада. Другими словами, надо было предложить эксперимент,
который бы проверил симметрию правого и левого в β-распаде. Такие
эксперименты не были сделаны.
Другими словами, надо было предложить эксперимент,
который бы проверил симметрию правого и левого в β-распаде. Такие
эксперименты не были сделаны. Это значит, что природа зеркально
симметрична. Зеркальное изображение любого объекта есть также возможный объект
природы; движение любого объекта, рассматриваемого в зеркале, есть также
движение, разрешаемое законами природы. Любой выполненный в лаборатории опыт
может быть выполнен таким образом, каким он кажется в зеркале, и любой
полученный при этом эффект должен быть зеркальным изображением действительного
эффекта. Выражаясь кратко, законы природы инвариантны относительно отражения.
Это значит, что природа зеркально
симметрична. Зеркальное изображение любого объекта есть также возможный объект
природы; движение любого объекта, рассматриваемого в зеркале, есть также
движение, разрешаемое законами природы. Любой выполненный в лаборатории опыт
может быть выполнен таким образом, каким он кажется в зеркале, и любой
полученный при этом эффект должен быть зеркальным изображением действительного
эффекта. Выражаясь кратко, законы природы инвариантны относительно отражения. Большие открытия всегда связаны с тем, что «очевидное»
подвергается сомнению. В этом случае заслуга принадлежит двум физикам теоретикам
– Ли из Колумбийского университета и Янгу из
Института проблемных исследований, которые указали экспериментаторам на
необходимость этого опыта. Ли и Янг предположили, что для некоторых слабых
взаимодействий, подобных β-распаду, принцип четности может оказаться неверным.
Большие открытия всегда связаны с тем, что «очевидное»
подвергается сомнению. В этом случае заслуга принадлежит двум физикам теоретикам
– Ли из Колумбийского университета и Янгу из
Института проблемных исследований, которые указали экспериментаторам на
необходимость этого опыта. Ли и Янг предположили, что для некоторых слабых
взаимодействий, подобных β-распаду, принцип четности может оказаться неверным. Какие валентности способен проявлять хлор?
Какие валентности способен проявлять хлор?