| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
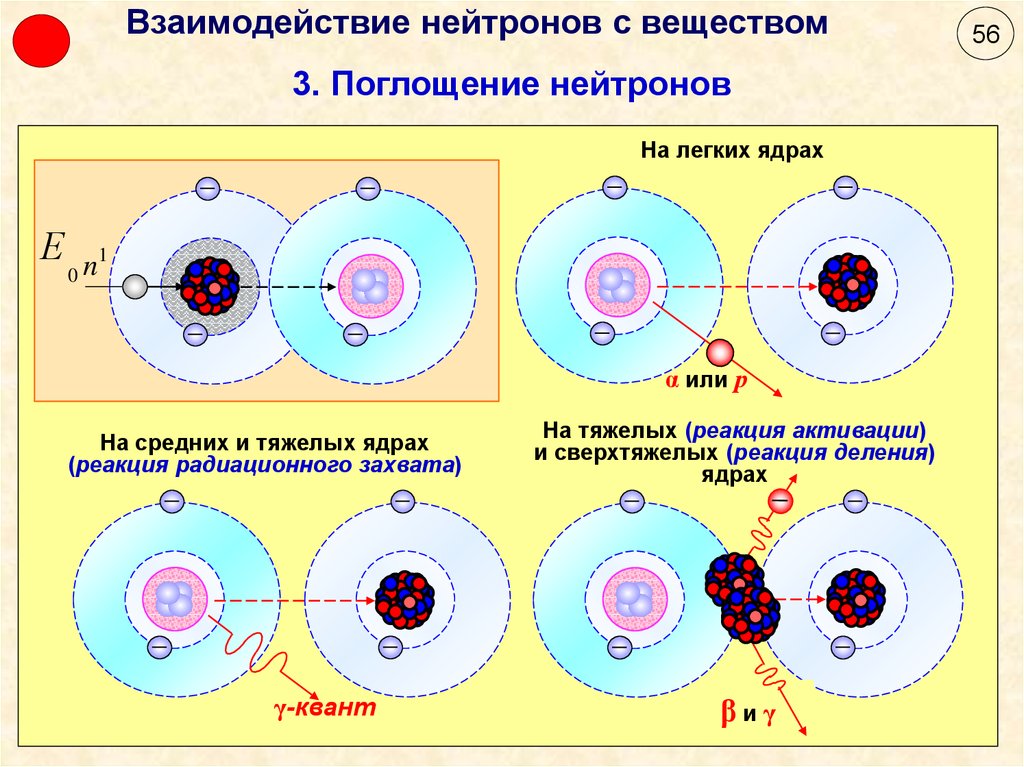
Образование элементов тяжелее железа
Образование элементов тяжелее железа Распространенность элементов, расположенных в области за
железом, относительно слабо зависит от массового числа A. s-процесс. Для того, чтобы в звездах эффективно протекал s-процесс необходимы определенные условия.
Основная проблема при описании s-процесса — источник
нейтронов.
Реакция 13C + α
→ 16O + n эффективно происходит при температуре >108K.
Образование нейтронов в реакции 22Ne + α → 25Mg + n (Q =
-0. 13C + γ
→ 12C + n (Q= -4.95 МэВ), Роль фотонейтронных реакций возрастает с увеличением
температуры. r-процесс. В настоящее время
общепризнано, что многие ядра тяжелее железа, включая все ядра тяжелее
Один из аргументов в подтверждение r-процесса в звездах —
наличие сдвоенных максимумов, коррелирующих с магическими числами нейтронов N =
50, 82 и 126. Как мы уже обсуждали максимумы при A = 90, 138 и 208 характеризуют
ядра, образующиеся в s — процессе. Максимумы, расположенные при меньших
значениях A = 80, 130 и 195 характеризуют ядра, образующиеся в r-процессе.
r-Процесс прекращается, если уменьшаются требуемые концентрации нейтронов или
если в последовательной цепочке ядер образуется ядро, распадающееся в результате
α-распада или деления. Считается, что высокие концентрации нейтронов,
необходимые для r-процесса, образуются при вспышках сверхновых звезд. α +
α + α, При этом легко преодолевается область нестабильных ядер с A = 5 и 8. В
результате этих многочастичных реакций в условиях высокой плотности возникают
ядра в районе железного пика, на которых и будет происходить r-процесс. Было
показано, что удается в едином процессе достаточно хорошо воспроизвести все 3
максимума, образующиеся в результате r-процесса. Более детальные расчеты
r-процесса в качестве исходных ядер используют не только ядра района железного
пика, но и продукты деления, образующиеся в r-процессе. |
На февраль это железо — атомный №26
Год (био)химических элементов
Кира Зейдан
1 февраля 2019 г.
Гемоглобин представляет собой тетрамер, состоящий из четырех полипептидных цепей. Каждый мономер содержит гемовую группу, в которой ион железа связан с кислородом. При железодефицитной анемии сердце работает интенсивнее, чтобы перекачивать больше кислорода через тело, что часто приводит к сердечной недостаточности или заболеванию. Мы отмечаем 150-летие периодической таблицы Менделеева, выделяя каждый месяц один или несколько химических элементов с важными биологическими функциями. в 2019 году. В январе мы представили атом № 1 и проанализировали роль водорода в окислительно-восстановительных реакциях и электрохимических градиентах как движущей силе энергии для клеточного роста и активности.
В феврале мы выбрали железо, самый распространенный элемент на Земле, с химическим символом Fe (от латинского слова «ferrum») и атомным номером 26.
Нейтральный атом железа содержит 26 протонов и 30 нейтронов плюс 26 электронов. в четырех разных оболочках вокруг ядра. Как и в случае с другими переходными металлами, различное количество электронов из двух самых внешних оболочек железа доступно для соединения с другими элементами. Обычно железо использует два (степень окисления +2) или три (степень окисления +3) своих доступных электронов для образования соединений, хотя в природе присутствуют степени окисления железа в диапазоне от -2 до +7.
Железо естественным образом встречается в известной вселенной. Он в изобилии образуется в ядрах массивных звезд при слиянии хрома и гелия при чрезвычайно высоких температурах. Каждая из этих сверхгигантских железосодержащих звезд живет лишь короткое время, прежде чем взорваться как сверхновая, разбрасывая железо в космос и на твердые планеты, такие как Земля. Железо присутствует в земной коре, ядре и мантии, где оно составляет около 35 процентов от общей массы планеты.
Железо имеет решающее значение для выживания всех живых организмов. Биологические системы постоянно подвергаются воздействию высоких концентраций железа в изверженных и осадочных породах. Микроорганизмы могут поглощать железо из окружающей среды, секретируя железохелатирующие молекулы, называемые сидерофорами, или через связанные с мембраной белки, которые восстанавливают Fe+3 (трехвалентное железо) до более растворимого Fe+2 (двухвалентное железо) для внутриклеточного транспорта. Растения также используют механизмы секвестрации и восстановления для получения железа из ризосферы, тогда как животные получают железо из пищевых источников.
Биологические системы постоянно подвергаются воздействию высоких концентраций железа в изверженных и осадочных породах. Микроорганизмы могут поглощать железо из окружающей среды, секретируя железохелатирующие молекулы, называемые сидерофорами, или через связанные с мембраной белки, которые восстанавливают Fe+3 (трехвалентное железо) до более растворимого Fe+2 (двухвалентное железо) для внутриклеточного транспорта. Растения также используют механизмы секвестрации и восстановления для получения железа из ризосферы, тогда как животные получают железо из пищевых источников.
Попав внутрь клетки, железо связывается с белками-носителями и с железозависимыми ферментами. Белки-носители, называемые ферритинами (присутствующие как у прокариот, так и у эукариот), хранят, транспортируют и безопасно высвобождают железо в необходимых областях, предотвращая избыток свободных радикалов, генерируемых высокоэнергетическим железом. Железозависимые ферменты включают бактериальные нитрогеназы, которые содержат железо-серные кластеры, катализирующие восстановление азота (N2) до аммиака (Nh4) в процессе, называемом фиксацией азота. Этот процесс необходим для жизни на Земле, потому что он необходим всем формам жизни для биосинтеза нуклеотидов и аминокислот.
Этот процесс необходим для жизни на Земле, потому что он необходим всем формам жизни для биосинтеза нуклеотидов и аминокислот.
Некоторые железосвязывающие белки содержат гем — порфириновое кольцо, координированное с ионом железа. Белки гема включают цитохромы, каталазу и гемоглобин. В цитохромах железо действует как одноэлектронный челнок, облегчающий реакции окислительного фосфорилирования и фотосинтеза для получения энергии и питательных веществ. Каталаза железа опосредует преобразование вредной перекиси водорода в кислород и воду, защищая клетки от окислительного повреждения. У позвоночных Fe+2 в гемоглобине обратимо окисляется до Fe+3, что позволяет связывать, хранить и транспортировать кислород по всему телу до тех пор, пока он не потребуется для производства энергии путем метаболического окисления глюкозы.
Живые организмы адаптировались к обилию и доступности железа, включив его в биомолекулы для выполнения связанных с металлом функций, необходимых для жизни во всех экосистемах.
Год (био)химических элементов
Читать всю серию:
За январь это атомный номер 1
За февраль это железо — атомный номер 26
За март это почечная тройка -fer: натрий, калий и хлор
Для апреля это медь — атомный № 29
Для мая это в ваших костях: кальций и фосфор
Для июня и июля это атомные номера 6 и 7
Дышите глубже — для августа это кислород
Марганец редко путешествует один
В октябре магний помогает листья остаются зелеными
Ноябрь — это запах серы
Завершение года с помощью никеля и цинка
Приятного чтения ASBMB Today?
Станьте участником, чтобы ежемесячно получать печатное издание и еженедельно цифровое издание.
Узнать больше
Кира Зейдан
Кира Зейдан — координатор ASBMB по образованию и связям с общественностью.
Расскажите свою историю
Новости журнала
Как рыбный патоген преодолевает стресс, вызванный антибиотиками
3 января 2023 г.
При изучении обычной бактерии ученые обнаружили динамический и обратимый механизм устойчивости к антибиотикам.
Подробнее
Новости журнала
Ключевые метаболические регуляторы лекарственной устойчивости при раке поджелудочной железы
1 января 2023 г.
«Понимание того, что существуют адаптации в рамках нескольких путей развития раковых клеток, позволяет нам сосредоточиться на новых препаратах, которые могут бороться с лекарственной устойчивостью», — автор-корреспондент Роберт М. — сказал Штраубинг.
Подробнее
Ежегодное собрание
Что вас интересует?
30 декабря 2022 г.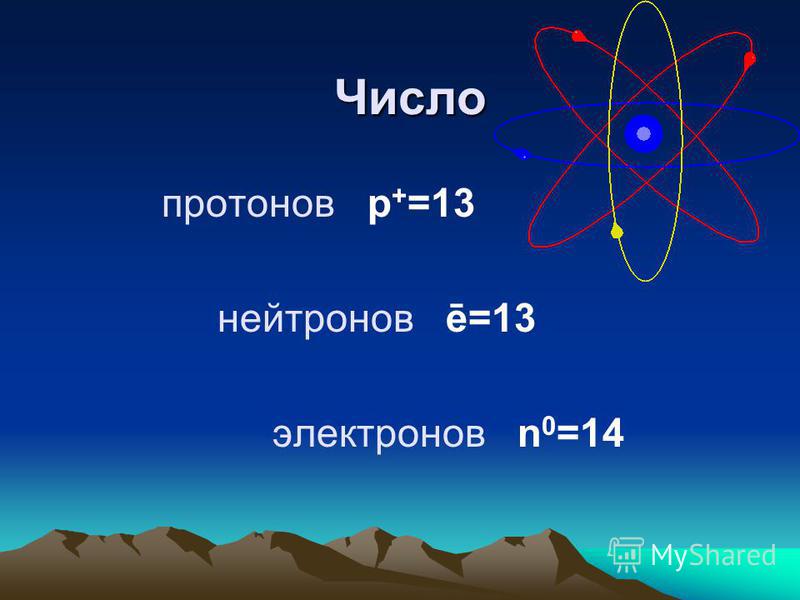
Занятия в группах по интересам на выставке Discover BMB 2023 в Сиэтле соберут участников со схожими научными и педагогическими интересами, чтобы поделиться своими недавними открытиями, обменяться идеями и установить связи.
Подробнее
Новости журнала
Липопротеин(а): тихий убийца или хрустальный шар?
27 декабря 2022 г.
Высокий уровень этого переносчика липидов ускоряет накопление холестерина на стенках артерий, увеличивая риск внезапного снижения кровотока.
Подробнее
Особенность
Жизненно важная взаимосвязь между дыханием и мозгом
22 декабря 2022 г.
Ритм дыхания влияет на широкий спектр поведения, а также на познание и эмоции. Нейробиологи выясняют, как все это работает.
Подробнее
Новости журнала
Нарушение канала регулирования депрессии
21 декабря 2022 г.
Лекарства от большого депрессивного расстройства помогают не всем, но понимание нового межбелкового взаимодействия может открыть новый путь к лечению.
Подробнее
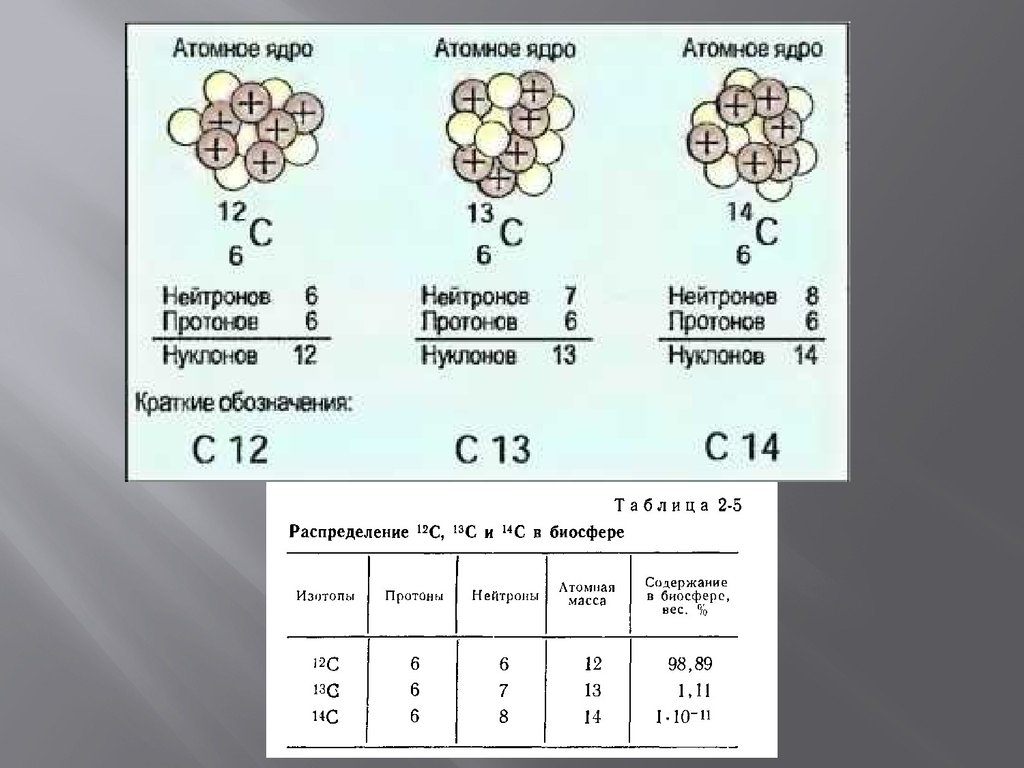
Сколько протонов, нейтронов и электронов в железе? | Бесплатные вопросы и ответы экспертов
Сколько протонов, нейтронов и электронов в железе?
Пояснение:
Железо, относящееся к 8-й группе периодической таблицы, является переходным металлом. Из-за различного количества валентных электронов на его d-орбитали элемент нестабилен, его свойства меняются между элементами s-блока слева и элементами p-блока справа.
Но, как и в случае с любым другим элементом, количество его протонов, нейтронов и электронов можно найти, используя его атомные и массовые числа из периодической таблицы.
Fe в нейтральном атомном состоянии
Чтобы рассчитать количество протонов и электронов в нейтральном атоме железа, сначала необходимо определить его атомный номер из периодической таблицы.
⇒ Атомный номер Fe = 26
Этот атомный номер равен количеству протонов в атоме железа.
Значит, число протонов в одном атоме Fe равно 26.
Далее, число протонов такое же, как число электронов в нейтральном атоме железа.
Таким образом, атом железа имеет 26 электронов.
Теперь, чтобы найти количество нейтронов, нужно найти массовое число Fe из периодической таблицы.
⇒ Массовое число Fe ≈ 56
Поскольку массовое число представляет собой сумму протонов и нейтронов в одном атоме элемента:
Количество протонов в Fe = Массовое число Fe – Протонное число Fe = 56 – 26 = 30
Таким образом, нейтральный атом железа имеет 30 нейтронов.
Нейтральный атом железа имеет 26 протонов, 26 электронов и 30 нейтронов.
Fe в его изотопных формах
Когда рассматриваемая разновидность железа является изотопом, количество электронов и протонов в нем будет таким же, как и в нейтральном атоме, но количество нейтронов будет другим.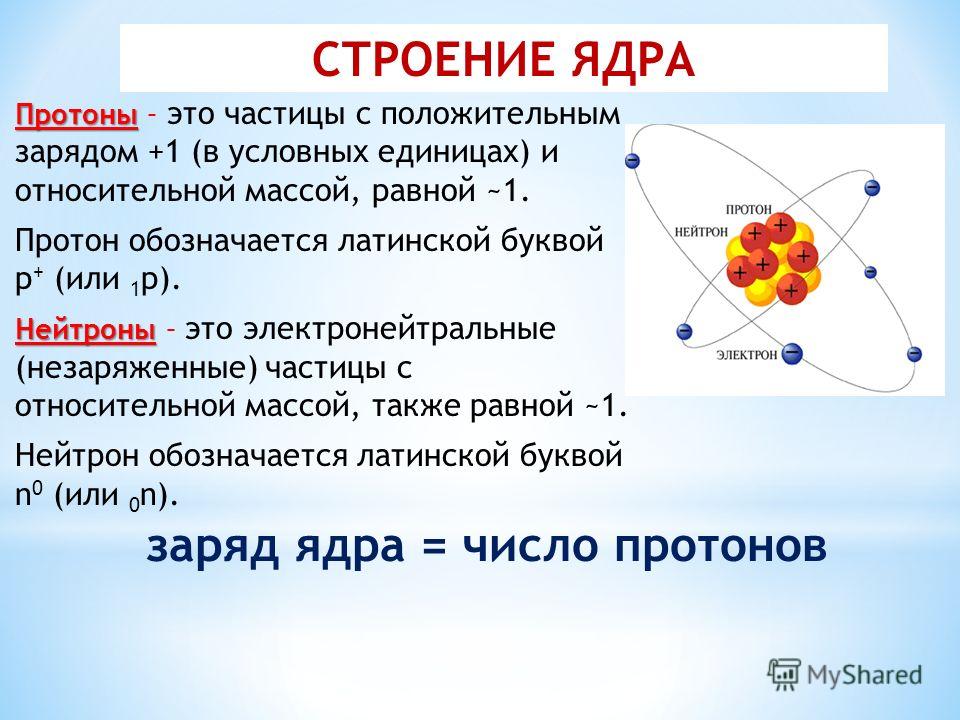
У железа есть 2 других изотопа, кроме ⁵⁶Fe; это ⁵⁷Fe и ⁵⁴Fe. Чтобы найти количество нейтронов в каждом из них, нужно вычесть число протонов из соответствующих массовых чисел.
Таким образом, ⁵⁷Fe будет иметь 57 – 26 = 31 нейтрон, а ⁵⁴Fe будет иметь 54 – 26 = 28 нейтронов. Однако оба вида будут содержать по 26 протонов и 26 электронов каждый.
Fe в его ионной форме
Железо существует в своей ионной форме как Fe²⁺ или Fe³⁺. Они состоят из разного количества электронов, но одинакового количества протонов и нейтронов.
Fe²⁺ образуется в результате потери 2 валентных электронов. Следовательно, у него 26 – 2 = 24 электрона, 26 протонов и 30 нейтронов.
Fe³⁺, с другой стороны, представляет собой ион, образующийся в результате потери 3 валентных электронов. Таким образом, у него 26 – 3 = 23 электрона.
- Ион железа имеет 26 протонов, 30 нейтронов и 23 электрона. Каковы его атомный номер, атомная масса и суммарный заряд?
- Запишите полный символ, включая массовое число и атомный номер, для каждого атома.


 Это свидетельствует об
изменении механизма образования этих элементов.
Это свидетельствует об
изменении механизма образования этих элементов.  Ядра с малыми периодами полураспада исчезают раньше, чем они успевают
захватить следующий нейтрон. Поэтому ясно, что образование тяжелых элементов
должно заканчиваться свинцом и висмутом.
Ядра с малыми периодами полураспада исчезают раньше, чем они успевают
захватить следующий нейтрон. Поэтому ясно, что образование тяжелых элементов
должно заканчиваться свинцом и висмутом.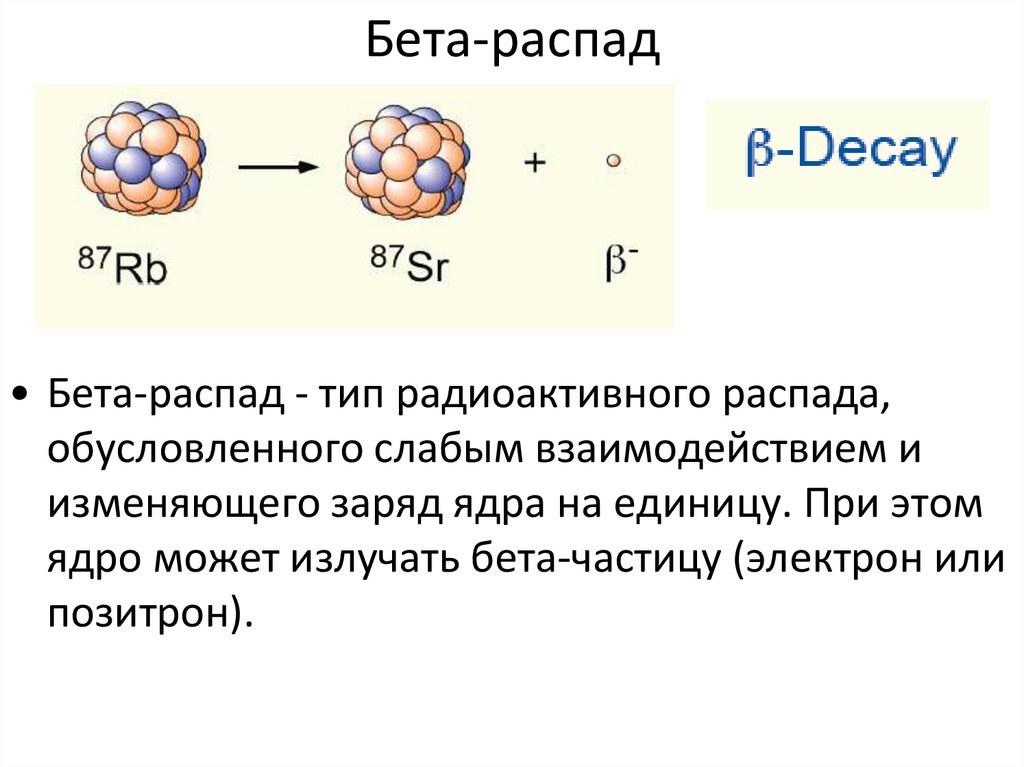 Обычно в качестве источника нейтронов рассматривают две реакции — 13C(α,n)16O и 22Ne(α,n)25Mg. Для
протекания первой реакции требуются условия, при которых происходит совместное
горение водорода и гелия. В качестве механизма, создающего такие условия,
рассматривается соприкосновение конвективной оболочки, в которой происходит
горение гелия, с богатой водородом внешней оболочкой.
Обычно в качестве источника нейтронов рассматривают две реакции — 13C(α,n)16O и 22Ne(α,n)25Mg. Для
протекания первой реакции требуются условия, при которых происходит совместное
горение водорода и гелия. В качестве механизма, создающего такие условия,
рассматривается соприкосновение конвективной оболочки, в которой происходит
горение гелия, с богатой водородом внешней оболочкой. 48 МэВ) зависит от присутствия 14N в зоне горения гелия
(последовательный захват двух α-частиц и β+-распад образовавшегося
ядра 22Na превращает ядро 14N в 22Ne). Для
этого необходимо, чтобы в первоначальном веществе звезды, в которой происходит
горение гелия, уже присутствовал изотоп 14N. Источником ядер 14N
является CNO-цикл.
48 МэВ) зависит от присутствия 14N в зоне горения гелия
(последовательный захват двух α-частиц и β+-распад образовавшегося
ядра 22Na превращает ядро 14N в 22Ne). Для
этого необходимо, чтобы в первоначальном веществе звезды, в которой происходит
горение гелия, уже присутствовал изотоп 14N. Источником ядер 14N
является CNO-цикл.  Поэтому в s-процессе преодолеть эту область Z
невозможно. В то же время в природе существуют ядра с Z = 90 (торий) и Z = 92
(изотопы урана 235U и 238U). Для объяснения существования
этих ядер необходимо предположить их образование в результате быстрого захвата
нейтронов нестабильными ядрами в результате r-процесса.
Поэтому в s-процессе преодолеть эту область Z
невозможно. В то же время в природе существуют ядра с Z = 90 (торий) и Z = 92
(изотопы урана 235U и 238U). Для объяснения существования
этих ядер необходимо предположить их образование в результате быстрого захвата
нейтронов нестабильными ядрами в результате r-процесса. 1).
1).
 Эти ядра дают новую
цепочку ядер, образующихся в r-процессе.
Эти ядра дают новую
цепочку ядер, образующихся в r-процессе.