Ответы / ГДЗ Химия 8 класс Попель П.П., Крикля Л.С., 2016 §18 Степень окисления » Допомога учням
Другие задания здесь…
ПРАВИЛА ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ
Степень окисления элементов в простых веществах равна нулю.
Степень окисления простого иона соответствует его заряду.
Степень окисления Гидрогена в большинстве соединениях равна +1, а в соединениях с металлами (гидридах) равна -1.
Степень окисления Флуора во всех соединениях равна -1.
Степень окисления Оксигена во всех соединениях -2, кроме O+2F2 , Н2+1О2-1.
Степень окисления металлов в соединениях всегда положительная.
Максимальная степень окисления соответствует номеру группы, к которой принадлежит элемент, за исключением Флуора, Оксигена.
Более электроотрицательный элемент всегда имеет отрицательную степень окисления.
Минимальная (отрицательная) степень окисления неметаллического элемента равна номеру группы, в которой он находится, минус 8.
В бинарных соединениях химический элемент, стоящий в ряду электроотрицательности:
F О N Cl Br S Р С Н Si Al Mg Са Na Cs
левее, проявляет отрицательную степень окисления, а тот, что стоит правее, — положительную.
СВОЙСТВО ЭЛЕКТРОНЕЙТРАЛЬНОСТИ: сумма степеней окисления всех атомов в каждом веществе равна нулю, а в сложном ионе — заряду иона.
Упражнение 121 Что такое степень окисления элемента? Условный целочисленный заряд атома в веществе называют степенью окисления элемента.
Упражнение 122 Какие минимальное и максимальное значения может принимать степень окисления:
а) металлического элемента; Атомы металлических элементов могут только отдавать электроны, поэтому в соединениях они проявляют положительные степени окисления. Максимальное значение степени окисления совпадает с номером группы, в которой находится элемент (+1, +2, +3).
б) неметаллического элемента? Атомы неметаллических элементов могут как присоединять электроны, так и отдавать, поэтому могут проявлять как отрицательную, так и положительную степени окисления в зависимости от того, с атомом какого элемента они образуют связь. Максимальное значение степени окисления совпадает с номером группы, в которой находится элемент (+4, +5, +6, +7). Чтобы найти минимальное значение степени окисления неметаллического элемента надо от номера группы вычесть число 8 (-4, -3 -2, -1).
Упражнение 123 Какие максимальные и минимальные значения степеней окисления могут иметь Силиций, Литий, Манган, Селен, Неон, Фосфор?
Силиций является элементом IV группы главной подгруппы, поэтому максимальное значение окисления +4, а минимальное значение окисления -4 (4-8=-4).
Литий является элементом I группы главной подгруппы, поэтому максимальное значение окисления +1, а минимальное значение окисления 0.
Марганец является элементом VII группы побочной подгруппы, поэтому максимальное значение +7, а минимальное +2 (благодаря электронам внешнего энергетического уровня).
Селен является элементом V группы главной подгруппы, поэтому максимальное значение окисления +6, а минимальное значение окисления -2 (6-8=-2).
Неон является инертным элементом, степеней окисления нет.
Фосфор является элементом V группы главной подгруппы, поэтому максимальное значение +5, а минимальное -3 (5-8=-3).
Упражнение 124 Определите и укажите в приведенных формулах веществ степени окисления элементов: NaH, P2S5, O3, OF2, CCl 4, H2S, Li3N, AlP.
Na+H—, P2+5S5-2, O30, O+2F2—, С+4Сl4—, H2+S-2, Li3+N-3, Аl+3P-3.
Степени окисления определяют, используя правила, представленные выше.
Упражнение 125 Составьте формулы оксидов, в которых:
а) Хлор имеет степени окисления +1 и +7; Cl2O, Cl2O7
б) Арсен имеет степени окисления +3 и +5. As2O
Упражнение 126 Определите степени окисления элементов в соединениях с такими формулами: KOH, Н2SO4, Н3PO4, CaCO3, NaNO2, Mg(NO3)2.
К+О-2Н+, H2+S+6O4-2, Н3+Р+5O4-2, Са+2С+4O3-2, Na+N+5O2-2, Mg+2(N+5O3-2)2.
Степени окисления определяют, используя правила, представленные выше.
В соединении KOH степень окисления K(+1), Н(+1). Обозначим степень окисления Оксигена в соединении через х: К+ОхН+, тогда по свойству электронейтральности 1•1+1•х+1•1=0, х+2=0, х=-2, следовательно, степень окисления О(-2)
В соединении Н2SO4 степень окисления О(-2), Н(+1). Обозначим степень окисления Сульфура в соединении через х: Н2+SхO-24, тогда по свойству электронейтральности 2•1+1•х+4•(-2)=0, 2+х-8=0, х=6, следовательно, степень окисления S(+6)
В соединении Н3РO4 степень окисления О(-2), Н(+1). Обозначим степень окисления Фосфора в соединении через х: Н3+РхO-24, тогда по свойству электронейтральности 3•1+1•х+4•(-2)=0, 3+х-8=0, х=5, следовательно, степень окисления Р(+5)
В соединении СаСO3 степень окисления Са(+2), Н(+1). Обозначим степень окисления Карбона в соединении через х: Са2+СхO-23, тогда по свойству электронейтральности 1•2+1•х+3•(-2)=0, 2+х-6=0, х=4, следовательно, степень окисления С(+4)
Обозначим степень окисления Карбона в соединении через х: Са2+СхO-23, тогда по свойству электронейтральности 1•2+1•х+3•(-2)=0, 2+х-6=0, х=4, следовательно, степень окисления С(+4)
В соединении NaNO3 степень окисления Na(+1), O(-2). Обозначим степень окисления Нитрогена в соединении через х: Na+NхO-23, тогда по свойству электронейтральности 1•1+1•x+3•(-2)=0, 1+x-6=0, х=5, следовательно, степень окисления N(+5)
В соединении Mg(NO3)2 степень окисления Mg(+2), O(-2). Обозначим степень окисления Нитрогена в соединении через х: Mg+2(NхO-23)2, тогда по свойству электронейтральности 1•2+2•x+2•3•(-2)=0, 2+2x-12=0, х=5, следовательно, степень окисления N(+5)
Упражнение 127 Чем различаются понятия «валентность» и «степень окисления»? Валентностью называют число ковалентных связей (общих электронных пар), которыми атом соединен с другими атомами, поэтому понятие «валентность» применяют для соединений молекулярного строения. Для всех классов соединений (молекулярного и немолекулярного строения), независимо от вида химических связей (ковалентная, ионная, металлическая), применяется более универсальное понятие «степень окисления». Это понятие условное для веществ молекулярного и атомного строения, для них реального содержания оно не имеет.
Для всех классов соединений (молекулярного и немолекулярного строения), независимо от вида химических связей (ковалентная, ионная, металлическая), применяется более универсальное понятие «степень окисления». Это понятие условное для веществ молекулярного и атомного строения, для них реального содержания оно не имеет.
Валентность определяется только числом ковалентных связей без учета полярности образованных связей, поэтому не имеет знака и приобретает значение от I до VIII. Степень окисления, в отличие от валентности, может иметь положительное (+), отрицательное (-) и нулевое значение. Степень окисления в простых веществах равна нулю, а валентность отличная от нуля.
Упражнение 128 Определите степени окисления элементов в соединениях по графическим формулам их молекул:
а) H–C≡N; б) O=C–Cl; в) Н–N–О–Н.
Сопоставьте найденные степени окисления со значениями валентности элементов в этих соединениях.
|
Графическая формула |
а) H-C=N |
б) О=С-Сl | Cl |
в) H-N-О-H | H |
|
Степени окисления |
а) H+1-C+2=N -3 |
б) О-2=С+4-Сl— | |
в) H+-N—-О-2-H+ | |
| Валентность | а) HI-CIII=NII |
б) ОII=СIV-СlI | |
в) HI-NIII-ОII-HI | |
Другие задания здесь. ..
..
Валентность химических элементов. Степень окисления химических элементов – HIMI4KA
ОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.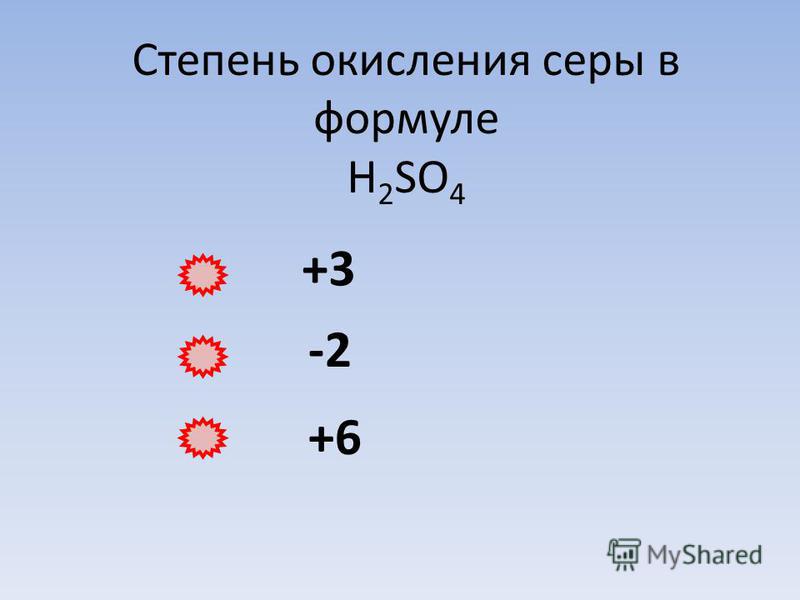
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).

- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т.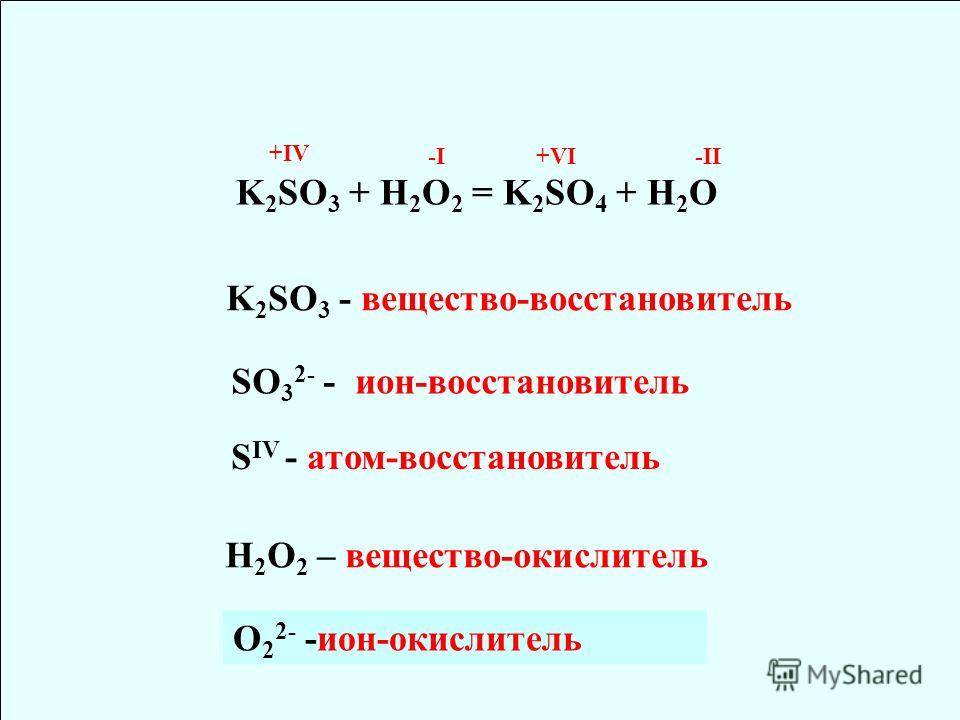 е. степень окисления калия равна +1.
е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Ответы
Чистые вещества и смеси →
← Строение веществ. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая
Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая
WebElements Periodic Table » Алюминий » Фосфид алюминия
- Формула: АлП
- Формула системы Hill: Al 1 P 1
- Регистрационный номер CAS: [20859-73-8]
- Вес формулы: 57,955
- Класс: фосфид
- Цвет: зеленый или желтый
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 2550°C
- Температура кипения:
- Плотность: 2400 кг·м -3
Ниже приведены некоторые синонимы фосфида алюминия :
- фосфид алюминия
- фосфид алюминия(III)
- фосфид алюминия
- фосфид алюминия(III)
Степень окисления алюминия в фосфиде алюминия 3 .
Синтез
Нет в наличии
Твердотельная структура
- Геометрия алюминия: 4 координата: тетраэдрическая
- Прототип структуры: ZnS (сфалерит, цинковая обманка)
Элементный анализ
В таблице показано процентное содержание элементов для AlP (фосфид алюминия).
| Элемент | % |
|---|---|
| Ал | 46,56 |
| Р | 53,44 |
Изотопная схема AlP
На приведенной ниже диаграмме показана рассчитанная изотопная картина для формулы 9.0004 AlP с наиболее интенсивным ионом, установленным на 100%.
Каталожные номера
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.

- Н.Н. Гринвуд и А. Эрншоу в Химия элементов , 2-е издание, Баттерворт, Великобритания, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- Р.В.Г. Wyckoff, in Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Donnay, (ed.) in Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лиде, (редактор) в справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996.

- Дж.В. Меллор в Всеобъемлющий трактат по неорганической и теоретической химии , тома 1–16, Longmans, Лондон, Великобритания, 1922–1937 гг.
- Дж. Э. Макинтайр (редактор) в Словаре неорганических соединений , тома 1-3, Chapman & Hall, Лондон, Великобритания, 1992.
Изучите периодические свойства по этим ссылкам
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найти электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Весы | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите количество нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определите, растворимо ли соединение в воде | Н_2О | |
| 17 | Найти электронную конфигурацию | На | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найти электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определите, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/самую простую формулу | Н_2О | |
| 27 | Найдите числа окисления | Н_2О | |
| 28 | Найти электронную конфигурацию | К | |
| 29 | Найти электронную конфигурацию | мг | |
| 30 | Найти электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | На | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите числа окисления | Х | |
| 43 | Весы | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | Ос | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найти электронную конфигурацию | Fe | |
| 51 | Найти электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | На | |
| 55 | Найдите количество нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | 92О|||
| 60 | Упростить | ч*2р | |
| 61 | Определите, растворимо ли соединение в воде | Х | |
| 62 | Определение плотности на STP | Н_2О | |
| 63 | Найдите числа окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов | Pd | |
| 70 | Найдите количество нейтронов | рт. |



