so3, h4P, Ba3N2, N2O, HMnO — Знания.site
Последние вопросы
Химия
36 минут назад
назовите минусы фарфораХимия
51 минут назад
Помогите, пожалуйста, разобраться в задании по химииХимия
51 минут назад
Для синтезу естеру із запахом яблука (метилбутаноат) було використано бутанова кислота масою 200 г з масовою часткою 8,8 %. Визнач масу одержаного естеру.Химия
51 минут назад
Під час кислотного гідролізу етилетаноату утворюються.
Химия
1 час назад
Химия 8 классХимия
1 час назад
Помогите с химиейХимия
1 час назад
Помогите по химии !!!! составить уравнение реакции для гидроксида меди 2Химия
1 час назад
де більше міститься молекул у 4,6 л сульфуру 4 оксиду SO4 або в 11,2л кисню O2Химия
2 часа назад
Помогите , пожайлуста.
 Записати рівняння реакцій між металами з порядковими номерами 3, 13, 20, 25, 26, 28, 30, 37, 47, 56 з водою і сульфатною кислотою.
Записати рівняння реакцій між металами з порядковими номерами 3, 13, 20, 25, 26, 28, 30, 37, 47, 56 з водою і сульфатною кислотою.Химия
2 часа назад
Решить методом ПОЛУРЕАНЦИИ!!Химия
2 часа назад
При взаємодії магнію з сульфатною кислотою виділився газ обʼємом 6,72 л. Які ° маси магнію та сульфатної кислоти прореагували?Химия
2 часа назад
Спалили фосфор масою 6,2г. Який обʼєм кисню витратився?Химия
2 часа назад
Яка маса розчину з масовою часткою солі 18% містить 34г солі? РЕШИТЕ ПЛИЗХимия
2 часа назад
Задачи по химииХимия
2 часа назад
Чёрный чай взбадривает также как и кофк?
Все предметы
Выберите язык и регион
EnglishUnited States
Polski
Polska
Português
Brasil
English
India
Türkçe
Türkiye
English
Philippines
Español
España
Bahasa Indonesia
Indonesia
Русский
Россия
How much to ban the user?
1 hour 1 day 100 years
Тест «Щелочные и щелочноземельные металлы»
Тест « Щелочные и щелочноземельные металлы»
(контрольный срез знаний)
Цель: проверить знания и умения учащихся то теме «Щелочные и щелочноземельные металлы»
Умения:
определять положение металлов в периодической системе Д. И. Менделеева;
И. Менделеева;
определять строение атома;
определять степень окисления;
составлять полные и сокращенные ионные уравнения
определять продукты реакции;
решать цепочки уравнений;
определять окислитель и восстановитель, писать электронный баланс;
расставлять коэффициенты;
определять молярную массу и молярный объем;
составлять пропорцию.
Знания:
тривиальные названия соединений;
химические свойства металлов, оксидов и гидроксидов;
качественные реакции;
историю открытия металлов.
Предлагаемые тестовые задания содержат теоретические и практические вопросы, соответствующие требованиям государственного стандарта химического образования: основные понятия, законы химии, строение, свойства, получение важнейших классов веществ, изучаемых в 8 классе и 9 классе (I и II четверть)
Количество вариантов: 2
На решение варианта, состоящего из 15 заданий, отводится 40 минут.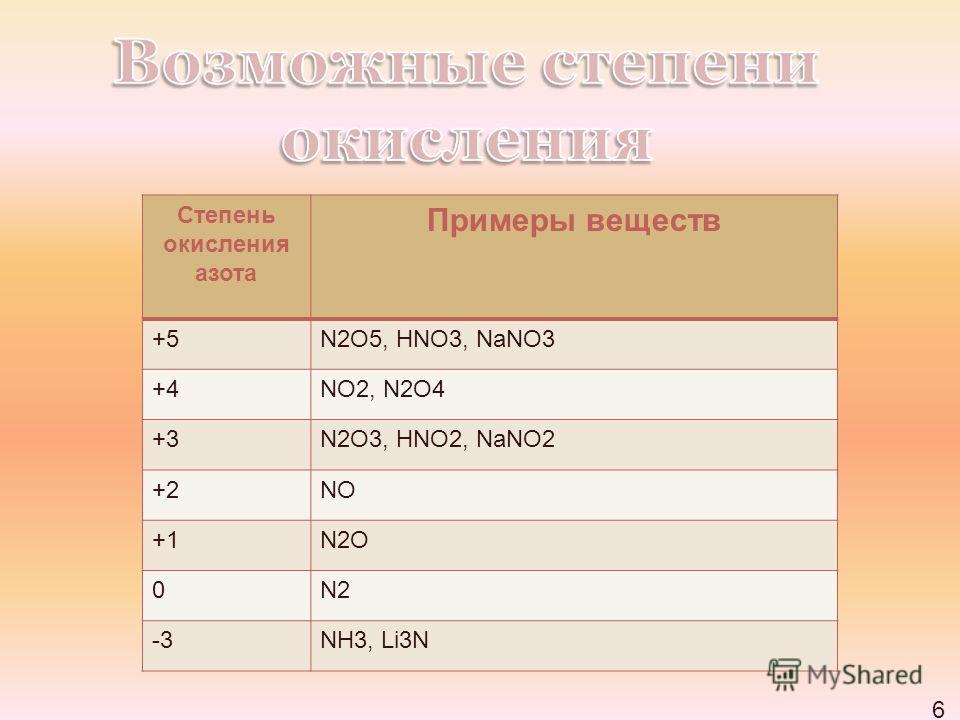 Тесты состоят из части А (13 заданий )– с выбором правильного ответа из предложенных, и части В (2 задания – цепочка превращений и задача) — ответы учащиеся должны предложить сами.
Тесты состоят из части А (13 заданий )– с выбором правильного ответа из предложенных, и части В (2 задания – цепочка превращений и задача) — ответы учащиеся должны предложить сами.
Оценивание заданий:
Часть А – 1 балл
Часть Б:
Цепочка превращений:
— получение оксида – 1 балл;
— получение гидроксида – 1 балл;
— получение соли – 1 балл;
— метод электронного баланса – 2 балла;
— ионные уравнения – 1 балл.
Задача:
— составление уравнения – 1 балл;
— определение молярной массы – 1 балл;
— определение молярного объема – 1 балл;
— составление пропорции – 1 балл;
— ответ – 1 балл;
— оформление задачи – 1 балл.
Критерии для оценивания тематического теста:
«2» — менее 12 баллов
«3» — 12 — 17 баллов
«4» — 18 — 23 баллов
«5» — 24 — 25 баллов
Тест «Щелочные и щелочноземельные металлы»
Вариант I
Ученик (ца)_____________________________________________________________
Класс ___________________
Дата ____________________
ФИО учителя ___________________________________________________________
№ п/п | Задание | Ответ |
Блок А (1 балл) Выберите правильный вариант ответа | ||
1 | Щелочноземельные металлы находятся в: 1) I A группе; 2) II А группе; 3) IV А группе 4) VIII А группе | 2 |
2 | Какой из указанных металлов является щелочным: 1) Mg; 2) Zn; 3) Ba; 4) K | 4 |
3 | Степень окисления щелочных металлов: 1) +1; 2) +2; 3) -2; 4) +3 | 1 |
4 | Распределение электронов по энергетическим уровням в атоме магния: 1) 2,8,2; 2) 2,8,1; 3) 2,8,8,1; 4) 1,8,8,1 | 1 |
5 | Щелочноземельные металлы: А. Б. Легко режутся ножом. В. Неактивные металлы. 1) Все утверждения не верны; 2) Верны А и Б; 3) Верны А и С | 2 |
6 | При взаимодействии с кислородом натрий образует: 1) оксид; 2) пероксид; 3) натрий не реагирует с кислородом. | 2 |
7 | Каустическая сода: 1) NaOH; 2) KOH; 3) Mg (OH)2; 4) NaCl | 1 |
8 | С каким из следующих веществ реагирует кальций? 1) Na2O; 2) NaCl; 3) Cu; 4) h3O | 4 |
9 | С каким из следующих веществ реагирует гидроксид калия? 1) СO2; 2) NaCl; 3) KNO3; 4) Ba(OH)2 | 1 |
10 | Какой осадок образуется при взаимодействии растворов солей Na3PO4 и Ca(NO3)2 1) NaNO3; 2) Ca (OH)2; 3) Ca3(PO4)2; 4) NaOH | 3 |
11 | Какая из следующих реакций относится к реакциям ионного обмена? 1) CaO + h3O → Ca (OH)2 2) Ba (NO3)2 + Na2SO4 → BaSO4 + 2 NaNO3 3) 2 Mg + TiO2 → 2 MgO + Ti 4) 3 Ba + N2 → Ba3N2 | 2 |
12 | Соли калия окрашивают пламя в: 1) зеленый цвет; 2) красный цвет; 3) желтый цвет; 4) фиолетовый цвет | 4 |
13 | Английский химик впервые получивший магний в 1808г. 1) Г.Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон | 1 |
Блок Б
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (6 баллов):
Ba → BaO → Ba(OH)2 → BaSO4
В первом уравнении определите окислитель и восстановитель (метод электронного баланса), третье уравнение напишите в ионном виде
1) 2 Ba0 + O02 → 2 Ba+2O-2
Ba0 – 2e → Ba+2 2 (восстановитель/окисление)
4
O2 + 4e → 2O-2 1 (окислитель/восстановление)
2) BaO + h3O → Ba(OH)2
3) Ba(OH)2 + h3SO4 → BaSO4 + 2 h3O
Ba2+ + 2OH- + 2H+ + SO42- → BaSO4 + 2 h3O
2. Решите задачу (6 баллов). При взаимодействии натрия массой 10 г с водой выделился водород. Определите объём водорода (н.у.).
Дано | Решение |
m(Na) = 10г | 0. 2Na + 2 h3O → 2NaOH + h3 2 моль 1 моль 1) 2) х = 0,215 (моль) 3) Ответ: V(h3) = 4.816 (л) |
Найти: V(h3) — ? |
Тест «Щелочные и щелочноземельные металлы»
Вариант II
Ученик (ца)_____________________________________________________________
Класс ___________________
Дата ____________________
ФИО учителя ___________________________________________________________
№ п/п | Задание | Ответ |
Блок А (1 балл) Выберите правильный вариант ответа | ||
1 | Щелочные металлы находятся в: 1) I A группе; 2) III А группе; 3) VII Б группе 4) VI А группе | 1 |
2 | Какой из указанных металлов является щелочноземельным: 1) Sr; 2) Cs; 3) Na; 4) Al | 1 |
3 | Степень окисления щелочноземельных металлов: 1) +2; 2) +4; 3) +3; 4) -1 | 1 |
4 | Распределение электронов по энергетическим уровням в атоме калия: 1) 2,8,7,2; 2) 2,8,8,1; 3) 2,8,1; 4) 1,8,8,2 | 2 |
5 | Щелочные металлы: А. Б. Легко режутся ножом. В. Неактивные металлы. 1) Все утверждения верны; 2) Верны А и Б; 3) Верны А и В | 2 |
6 | Реакция сжигания магния сопровождается: 1) взрывом; 2) вспышкой; 3) нет ярко выраженных признаков химической реакции. | 2 |
7 | Английская соль: 1) CaSO4; 2) Ca (OH)2; 3) MgSO4; 4) CaCO3 | 3 |
8 | С каким из перечисленных веществ реагирует калий? 1) Na2O; 2) h3O; 3) Ca (OH)2; 4) Mg | 2 |
9 | С каким веществом реагирует гидроксид кальция? 1) NaOH; 2) Na2O; 3) HCl; 4) h3O | 1 |
10 | Какой осадок образуется при взаимодействии растворов солей Ba (NO3)2 и Na2SO4 1) NaNO3; 2)BaSO4; 3)NaHSO4; 4) Ba (OH)2 | 2 |
11 | Какая из следующих реакций выражается сокращенным ионным уравнением H + + OH — → h3O 1) 2 HCl + Cu (OH)2 → CuCl2 + 2 h3O 2) HBr + KOH → KBr + h3O 3) h3SO3 + 2 RbOH → Rb2SO3 + 2 h3O | 2 |
12 | Соли натрия окрашивают пламя в: 1) зеленый цвет; 2) красный цвет; 3) желтый цвет; 4) фиолетовый цвет | 3 |
13 | Шведский химик, открывший литий в 1817г: 1) Г. | 4 |
Блок Б
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (6 баллов):
Li → Li2O→ LiOH → Li3PO4
В первом уравнении определите окислитель и восстановитель (метод электронного баланса), третье уравнение напишите в ионном виде.
1) 4 Li0 + O02 → 2 Li+2O-2
Li0 – 1e → Li+ 4 (восстановитель/окисление)
4
O2 + 4e → 2O-2 1 (окислитель/восстановление)
2) Li2O + h3O → 2 LiOH
3) 3LiOH + h4PO4 → Li3PO4 + 3 h3O
3 Li+ + 3OH- + 3H+ + PO43- → Li3PO4 + 3 h3O
2. Решите задачу (6 баллов). При взаимодействии магния с хлором объемом 11,2 л (н.у.), образуется хлорид магния. Определите массу хлорида магния.
Дано | Решение |
V(Cl2) = 11. | 0.5 моль х моль 2Mg + Cl2 → MgCl2 1 моль 1 моль 1) 2) х = 0,5 (моль) 3) Ответ: m(MgCl2) = 45.5 (г) |
Найти: m(MgCl2) — ? |
The Periodic Table at KnowledgeDoor
Ссылки (Нажмите рядом со значением выше, чтобы увидеть полную информацию о цитировании для этой записи)
Allred, A.L. «Значения электроотрицательности на основе термохимических данных». Журнал неорганической и ядерной химии, том 17, номера 3–4, 1961 г., стр. 215–221. doi:10.1016/
Андерс, Эдвард и Николя Гревесс. «Изобилие элементов:
Метеоритный и солнечный.» Geochimica et Cosmochimica Acta, том 53, номер 1, 1989, стр. 197–214. doi:10.1016/ -X
Андерсен Т., Х.К. Хауген и Х. Хотоп. «Энергии связи в атомных отрицательных ионах: III». Журнал физических и химических справочных данных, том 28, номер 6, 1999 г., стр. 1511–1533.
Хотоп. «Энергии связи в атомных отрицательных ионах: III». Журнал физических и химических справочных данных, том 28, номер 6, 1999 г., стр. 1511–1533.
Барсан, Майкл Э., редактор. Карманный справочник NIOSH по химическим опасностям. Цинциннати, Огайо: Публикации NIOSH, 2007.
Бацанов С.С. «Ван-дер-Ваальсовы радиусы элементов». Неорганические материалы, том 37, номер 9, 2001 г., стр. 871–885. См. аннотацию
Бонди, А. «Объемы и радиусы Ван-дер-Ваальса». Журнал физической химии, том 68, номер 3, 1964 г., стр. 441–451. doi: 10.1021/
Боуэн, Х. Дж. М. Экологическая химия элементов. Лондон: Academic Press, Inc., 1979.
Брач, Стивен Г. «Пересмотренные электроотрицательности Малликена: I. Расчет и преобразование в единицы Полинга». Журнал химических
Образование, том 65, номер 1, 1988 г., стр. 34–41. дои: 10.1021/
Кэмпбелл, Дж. Л. «Урожайность флуоресценции и вероятности Костера-Кронига для атомных подоболочек L. Часть II: Новый взгляд на подоболочку L1». атомный
Таблицы данных и ядерных данных, том 95, номер 1, 2009 г., стр. 115–124. doi: 10.1016/
Часть II: Новый взгляд на подоболочку L1». атомный
Таблицы данных и ядерных данных, том 95, номер 1, 2009 г., стр. 115–124. doi: 10.1016/
Кэмпбелл, Дж. Л. «Урожайность флуоресценции и вероятности Костера-Кронига для атомных L подоболочек». Атомные данные и таблицы ядерных данных,
том 85, номер 2, 2003 г., стр. 291–315. дои: 10.1016/
Кардарелли, Франсуа. Справочник по материалам: краткий настольный справочник, 2-е издание. Лондон: Springer-Verlag, 2008.
Клементи, Э., Д.Л. Раймонди и В.П. Рейнхардт. «Константы атомного экранирования из функций SCF. II. Атомы с 37–86 электронами». Журнал химической физики, том 47, номер 4, 1967 г., стр. 1300–1307. doi:10.1063/
Коэн, Э. Ричард, Дэвид Р. Лайд и Джордж Л. Тригг, редакторы. Справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации IUPAC 2005. Кембридж: RSC Publishing, 2005.
Хаттон. Номенклатура неорганической химии: Рекомендации IUPAC 2005. Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверриа, Эдуард Кремадес, Флавия Барраган и Сантьяго Альварес. «Возвращение ковалентных радиусов». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. doi:10.1039/
Кокс, П. А. Элементы: их происхождение, изобилие и распространение. Оксфорд: Издательство Оксфордского университета, 1989.
Кронан, Д.С. «Базальные металлоносные отложения восточной части Тихого океана». Бюллетень Геологического общества Америки, том 87,
№ 6, 1976 г., стр. 928–934. doi:10.1130/
де Подеста, Майкл. Понимание свойств материи, 2-е издание. Лондон: Тейлор и Фрэнсис, 2002.
Дебессай, М., Дж. Дж. Хэмлин и Дж. С. Шиллинг. «Сравнение зависимостей Tc от давления в трехвалентных d-электронных сверхпроводниках Sc, Y, La и Lu до давлений в мегабарах». Physical Review B, том 78, номер 6, 2008 г., стр. 064519.–1 до 064519–10. doi:10.1103/
Physical Review B, том 78, номер 6, 2008 г., стр. 064519.–1 до 064519–10. doi:10.1103/
Дронсковски, Ричард. Вычислительная химия твердотельных материалов. Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Эббинг, Даррелл Д. и Стивен Д. Гэммон. Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005.
Эмсли, Джон. Строительные блоки природы: Путеводитель по А-Я элементы. Оксфорд: Издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание. Оксфорд: Издательство Оксфордского университета, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С. Ширли с помощниками редактора Корал М. Бэглин, С. Ю. Фрэнк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc., 1996.
Галассо, Фрэнсис С. Структура и свойства Неорганические твердые вещества. Oxford: Pergamon Press, 1970.
Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, 1997.
Оксфорд: Баттерворт-Хайнеманн, 1997.
Гвин Уильямс. Энергии связи электронов. http://
Хо, С.Ю., Р.В. Пауэлл и П.Е. Лили. «Теплопроводность элементов: всесторонний обзор». Журнал физических и химических справочных данных, том 3, приложение 1, 1974 г., стр. с I–1 по I–796.
Хорват, А.Л. «Критическая температура элементов и периодическая система». Журнал химического образования, том 50, номер 5, 1973 г., стр. 335–336. doi:10.1021/
Хотоп Х. и В. К. Линебергер. «Энергии связи в атомных отрицательных ионах: II». Журнал физических и Химические справочные данные, том 14, номер 3, 1985 г., стр. 731–750.
Хьюи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы строения и реакционной способности, 4-е издание. Нью-Йорк: Издательство HarperCollins College Publishers, 1993.
Ихде, Аарон Дж. Развитие современной химии.
Международная организация труда (МОТ). Международный
Карта химической безопасности для таллия. http://
Международная организация труда (МОТ). Международная карта химической безопасности для таллия. http://
Jr., Элберт Дж. Литтл и Марк М. Джонс. «Полная таблица электроотрицательностей». Журнал химического образования, том 37, номер 5, 1960 г., стр. 231–233. doi: 10.1021/
Кинг, Х. В. «Аллотропные структуры элементов, зависящие от давления». Бюллетень фазовых диаграмм сплавов, том 4, номер 4, 1983, стр. 449–450. doi: 10.1007/
В. «Аллотропные структуры элементов, зависящие от давления». Бюллетень фазовых диаграмм сплавов, том 4, номер 4, 1983, стр. 449–450. doi: 10.1007/
Кинг, Х.В. «Температурно-зависимые аллотропные структуры элементов». Бюллетень фазовых диаграмм сплавов, том 3, номер 2, 1982 г., стр. 275–276. doi:10.1007/
Киттель, Чарльз. Введение в физику твердого тела, 8-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Киттель, Чарльз. Введение в физику твердого тела, 5-е издание. Нью-Йорк: John Wiley & Sons, Inc., 1976.
Ли, Ю.-Х. и Дж. Э. Шунмейкеры. «Химический состав и минералогия Морские отложения». Стр. 1–36 в «Осадочных породах, диагенезе и осадочных породах». Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Либофф, Ричард Л. Введение в квантовую механику, 3-е издание. Рединг, Массачусетс. : Addison Wesley Longman, Inc., 1998.
Лиде, Дэвид Р., редактор CRC Handbook of Chemistry and Physics, 88th edition. Бока-Ратон, Флорида: Taylor & Francis Group,
2008.
Бока-Ратон, Флорида: Taylor & Francis Group,
2008.
Манн, Джозеф Б., Терри Л. Мик и Леланд С. Аллен. «Конфигурационные энергии элементов основной группы». Журнал Американского химического общества, том 122, номер 12, 2000 г., стр. 2780–2783. doi:10.1021/
Мануэль О., изд. Происхождение элементов в Солнечной системе: последствия наблюдений после 1957 года. Нью-Йорк: Kluwer Academic Publishers, 2000.
Маршалл, Джеймс Л. Открытие элементов: поиск фундаментальных принципов Вселенной, 2-е издание. Бостон, Массачусетс: Pearson Custom Publishing, 2002.
Мартин В.К. «Электронная структура элементов». Европейский физический журнал C — Частицы и поля, том 15, номера 1–4, 2000 г., стр. 78–79. doi: 10.1007/
McDonough, WF «Композиционная модель ядра Земли». стр. 547–568 в «Мантии и ядре». Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Мечтли, Юджин А. «Свойства материалов». стр. 4–1–4–33 в Справочные данные для инженеров: радио, электроника, компьютер и связь. Мак Э. Ван Валкенбург, под редакцией Венди М. Миддлтон. Woburn, MA: Butterworth-Heinemann, 2002. doi: 10.1016/
Мак Э. Ван Валкенбург, под редакцией Венди М. Миддлтон. Woburn, MA: Butterworth-Heinemann, 2002. doi: 10.1016/
Мислер, Гэри Л. и Дональд А. Тарр. Неорганическая химия, 3-е издание. Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004.
Мур, Шарлотта Э. Потенциалы ионизации и пределы ионизации, полученные на основе анализа оптических спектров. Вашингтон, округ Колумбия: Национальный Бюро стандартов, 1970.
Нэгл, Джеффри К. «Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112, номер 12, 19.90, стр. 4741–4747. doi:10.1021/
Национальный институт охраны труда и здоровья (NIOSH). Международная карта химической безопасности для таллия. http://
Национальный институт охраны труда и здоровья (NIOSH).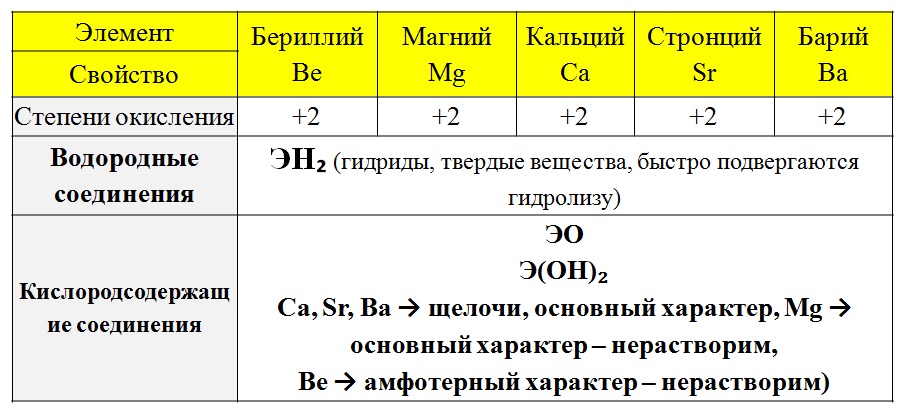 Международная карта химической безопасности для таллия. http://
Международная карта химической безопасности для таллия. http://
Национальный институт охраны труда и здоровья (NIOSH). Реестр токсического действия химических веществ на таллий. http://
Орем, У. Х. и Р. Б. Финкельман. «Углеобразование и геохимия». стр. 191–222 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Окстоби, Дэвид В., Х. П. Гиллис и Алан Кэмпион. Основы современной химии, 6-е издание. Бельмонт, Калифорния: Thomson Brooks/Cole, 2008.
Пальме, Х. и Х. Бир. «Метеориты и состав солнечной
Фотосфера». Стр. 204–206 в Ландольте-Бёрнштейне — Группа VI: Астрономия и астрофизика. Под редакцией HH Voigt. Нью-Йорк: Springer-Verlag, 1993. doi: 10.1007/
Пальме, Х. и Хью. Сент-К. О’Нил «Космохимические оценки мантии».
Состав». С. 1–38 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
и Хью. Сент-К. О’Нил «Космохимические оценки мантии».
Состав». С. 1–38 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Полинг, Лайнус. Природа химической связи, 3-е издание. Итака, Нью-Йорк: Издательство Корнельского университета, 1960.
Пирсон, Ральф Г. «Абсолютная электроотрицательность и твердость: приложение к неорганической химии». Неорганическая химия, том 27, номер 4, 1988 г., стр. 734–740. doi:10.1021/
Пекка Пюйккё. Самосогласованные ковалентные радиусы 2009 года. http://
Прохаска, Томас, Йоханна Ирргехер, Жаклин Бенефилд, Джон К. Бёлке, Лесли А. Чессон, Тайлер Б. Коплен, Типинг Динг, Филип Дж. Х. Данн, Манфред Грёнинг, Норман Э. Холден, Харро А. Дж. Мейер, Хайко Муссен, Антонио Посоло, Йошио Такахаши, Йохен Фогль, Томас Вальчик, Джун Ван, Майкл Э. Визер, Сигеказу Йонеда,
Сян-Кун Чжу и Юрис Мейджа. «Стандартные атомные массы элементов 2021 г. (Технический отчет IUPAC)». Чистая и прикладная химия, том 94, номер 5, 2022 г., стр. 573–600. дои: 10.1515/
«Стандартные атомные массы элементов 2021 г. (Технический отчет IUPAC)». Чистая и прикладная химия, том 94, номер 5, 2022 г., стр. 573–600. дои: 10.1515/
Пюикко, Пекка и Митико Атсуми. «Ковалентные радиусы молекулярных двойных связей для элементов Li-E112». Химия — Европейский журнал, том 15, номер 46, 2009 г., стр. 12770–12779. doi:10.1002/
Пьюкко, Пекка и Мичико Атсуми. «Ковалентные радиусы молекулярных одинарных связей для элементов 1-118». Химия — Европейский журнал, том 15, номер 1, 2009 г., стр. 186–197. doi:10.1002/
Pyykkö, Pekka, Sebastian Riedel, and Michael Patzschke. «Ковалентные радиусы тройной связи». Химия — Европейский журнал, том 11, номер 12, 2005 г., стр. 3511–3520. дои: 10.1002/
Рорер, Грегори С. Структура и связь в кристаллических материалах. Кембридж: Издательство Кембриджского университета, 2001.
Самсонов Г.В., изд. Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968.
Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968.
Сандерсон, Р. Т. Простые неорганические вещества. Малабар, Флорида: Robert E. Krieger Publishing Co., Inc., 1989.
Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I. Общая природа». Журнал химического образования, том 65, номер 2, 1988, стр. 112–118. doi:10.1021/
Сандерсон, Р. Т. Полярная ковалентность. Нью-Йорк: Academic Press, Inc., 1983.
Сансонетти, Дж. Э. и У. К. Мартин. «Справочник по основным данным атомной спектроскопии». Журнал физических и химических справочных данных, том 34, номер 4, 2005 г., стр. 1559–2259. doi:10.1063/
Научная группа Thermodata Europe (SGTE). Чистый
Вещества: Часть 1 — Элементы и соединения от AgBr до Ba3N2. Под редакцией И. Уртадо и Д. Нойшюца. Берлин: Springer-Verlag, 19.99. doi:10.1007/
Шеннон, Р. Д. «Пересмотренные эффективные ионные радиусы и систематические исследования
Межатомные расстояния в галогенидах и халькогенидах». Acta Crystallographica Section A, том 32, номер 5, 1976 г., стр. 751–767. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Acta Crystallographica Section A, том 32, номер 5, 1976 г., стр. 751–767. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Сингман, Чарльз Н. «Атомный объем и аллотропия элементов». Журнал химического образования, том 61, номер 2. , 1984, стр. 137–142. doi: 10.1021/
Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал химической физики, том 41, номер 10, 1964 г., стр. 3199–3204. doi: 10.1063/
Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга». Журнал химического образования, том 67, номер 11, 1990 г., стр. 911–914. doi:10.1021/
Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии. Кембридж: Издательство Кембриджского университета, 1990.
Стюарт, Г. Р. «Измерение низкотемпературной удельной теплоемкости». Обзор научных инструментов, том 54, номер 1, 1983 г. , стр. 1–11. doi: 10.1063/
, стр. 1–11. doi: 10.1063/
Стюарт, Г. Р. «Измерение низкотемпературной удельной теплоемкости». Обзор научных инструментов, том 54, номер 1, 1983 г., стр. 1–11. doi:10.1063/
Тари А. Удельная теплоемкость вещества при низких температурах. Лондон: Imperial College Press, 2003.
Министерство транспорта США (DOT), Transport Canada (TC), Секретариат транспорта и коммуникаций Мексики (SCT) и Centro de Información Química para Emergencias (CIQUIME). 2008 Чрезвычайная ситуация Руководство по ответу.
Вайнштейн, Борис К., Владимир М. Фридкин и Владимир Л. Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2. Под редакцией Бориса К. Вайнштейна, А.А. Чернова и Л.А. Шувалова. Берлин: Springer-Verlag, 1995.
Voigt, HH, редактор. Ландольт-Бёрнштейн — Группа VI Астрономия и астрофизика. Берлин: Springer-Verlag, 1993.
Вабер, Дж. Т. и Дон Т. Кромер. «Орбитальные радиусы атомов и ионов». Журнал химической физики, том 42, номер 12, 1965 г., стр. 4116–4123. дои: 10.1063/
Журнал химической физики, том 42, номер 12, 1965 г., стр. 4116–4123. дои: 10.1063/
Вагман, Дональд Д., Уильям Х. Эванс, Вивиан Б. Паркер, Ричард Х. Шумм, Ива Халоу, Сильвия М. Бейли, Кеннет Л. Чёрни и Ральф Л. Наттолл. «Теплопроводность элементов: всесторонний обзор». Журнал физических и химических справочных данных, том 11, приложение 2, 1982 г., стр. 2–1–2–392.
Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э. Троски и Джошуа Дж. Пирсон. «Отбор в процентах на основе эффективного заряда ядра Слейтера как универсальный инструмент для изучения периодических тенденций». Журнал химического образования, том 78, номер 5, 2001 г., стр. 635–639.. doi:10.1021/
Уикс, Мэри Эльвира и Генри М. Лестер. Открытие элементов, 7-е издание. Истон, Пенсильвания: Журнал химического образования, 1968.
Йос, Карл Л. «Плотность элементов в жидкости». Химическая инженерия, том 114, номер 12, 2007 г., стр. 44–46.
Yaws, Карл Л. Справочник Yaws по физическим свойствам углеводородов и химических веществ. Хьюстон, Техас: Gulf Publishing Company, 2005.
Справочник Yaws по физическим свойствам углеводородов и химических веществ. Хьюстон, Техас: Gulf Publishing Company, 2005.
Химический элемент: Азот (N)
Химический элемент: Азот (N)| Atomic Number: | 7 | ||||
| Element Symbol: | N | ||||
| Element Name: | Nitrogen | ||||
| Atomic Weight: | 14.0067 | ||||
| Номер группы: | 15 | ||||
| Название группы: | Pnictogen | ||||
| 4 Номер периода 40: | |||||
| Block: | p-block | ||||
| Ground State Configuration: | 1s2 2s2 2p3 | ||||
| Ground State Level: | 4So3/2 | ||||
| Standard State : | Газ | ||||
| Общие валеня: | 3 | ||||
| Длина Бонда: | 109. 76 76 | Длина Бонда: | 09.76976 | .0340 | 65 |
| Atomic Radius Calculated: | 56 | ||||
| Covalent Radius Empirical: | 75 | ||||
| Vander Waals Radius: | 155 | ||||
| Electron Affinity : | 7 | ||||
| Энергия первой ионизации: | 1402.3 | ||||
| Полинг Электроотрицательность: | 000342 3.|||||
| Sanderson Electronegativity: | 3.19 | ||||
| Allred Rochow Electronegativity: | 3.07 | ||||
| Mulliken Jaffe Electronegativity: | 2.90 | ||||
| Allen Electronegativity: | 3,066 | ||||
| Молярный объем: | 13,54 | ||||
| Скорость звука: | 333.6 | ||||
| Refractive Index: | 1. 000298 (gas; liquid 1.197) 000298 (gas; liquid 1.197) | ||||
| Melting Point: | -210.1 | ||||
| Boiling Point: | -195.79 | ||||
| Критическая температура: | -146,9 | ||||
| Теплопроводность: | 0,02583 | ||||
| 0.36 (per mol N atoms) | |||||
| Enthalpy Of Vaporization: | 2.79 (per mole N atoms) | ||||
| Enthalpy Of Atmization: | 473 | ||||
| Most Common Oxidation Numbers : | 5,3, -3 | ||||
| Цвет: | Классификация | ||||
| Классификация: | |||||
| : | 7: | 7: | |||
| : | |||||
| : | |||||
| : | |||||
. Discovered By: Discovered By: | Daniel Rutherford | ||||
| Discovered At: | Scotland | ||||
| Discovered When: | 1772 | ||||
| Origin Of Name: | From the Greek words nitron genes означает нитр и образование и латинское слово nitrum (нитр – это общее название нитрата калия, KNO#) |
Рассчитайте молекулярную массу азота или молекулярная масса N.
См. также полный список химических элементов и атомных весов.
Acetanilide C6H5NH(COCh4)
Acetonitrile Ch4CN
Ethidium Bromide C21h30BrN3
Ethylamine Ch4Ch3Nh3
Glycine Nh3Ch3COOH
Histidine C6H9N3O2
Lysine HO2CCH(Nh3)(Ch3)4Nh3
Phenacetin Ch4CONHC6h5OC2H5
Valine C5h21NO2
Aluminium Nitride AlN
Aluminium Nitrate Al(NO3) 3
Аммиак Nh4
Ацетат аммония Ch4COONh5
Бикарбонат аммония (Nh5)HCO3
Ammonium Chloride Nh5Cl
Ammonium Hydroxide Nh5OH
Ammonium Nitrate Nh5NO3
Ammonium Sulfate (Nh5)2SO4
Barium Nitrate Ba(NO3)2
Boron Nitride BN
Cadmium Nitrate Cd(NO3)2
Calcium Cyanamide CaCN2
Carboplatin C6h22N2O4Pt
Cyanogen (CN )2
Цианогенхлорид CNCl
Цианурхлорид C3Cl3N3
Нитрид галлия GaN
Гидразин N2h5
Гидразиновая кислота HN3
Нитрид индия Mercury InN
Нитрат лития0671 Nitric Acid HNO3
Nitric Oxide NO
Nitrogen Dioxide NO2
Nitrosylsulfuric Acid NOHSO4
Nitrous Acid HNO2
Nitrous Oxide N2O
Potassium Nitrate KNO3
Rubidium Nitrate RbNO3
Silver Nitrate AgNO3
Sodium Cyanide NaCN
Sodium Nitrate NaNO3
Sodium Nitrite NaNO2
Strontium Нитрат Sr(NO3)2
Сульфаминовая кислота h4NSO3
Тетранитрид тетрасеры S4N4
Нитрид титана TiN
Тринитротолуол C6h3(NO2)3Ch4
Тринитроглицерин C3H5(NO3)3
Uranyl Nitrate UO2(NO3)2
Zinc Cyanide Zn(CN)2
Zirconium Nitride ZrN
Acetaminophen C8H9NO2
Acridine C13H9N
Acrylamide C3H5NO
Cadaverine Nh3(Ch3)5Nh3
Cinnoline C8H6N2
Cytosine C4H5N3O
Epinephrine C9h23NO3
Hexamine (Ch3) 6N4
Метиленовый синий C16h28N3SCl
N-Метилпирролидон C5H9NO
Нитроглицерин C3H5(NO3)3
Фенилтиокарбамид C7H8N2S
Клавуланат калия C8H8KNO5
Путресцин 4Ch30671 Pyridine C5H5N
Tetryl C7H5N5O8
Tyrosine C9h21NO3
Urea CO(Nh3)2
Uric Acid C5h5N4O3
Yohimbine Hydrochloride C21h36N2O3.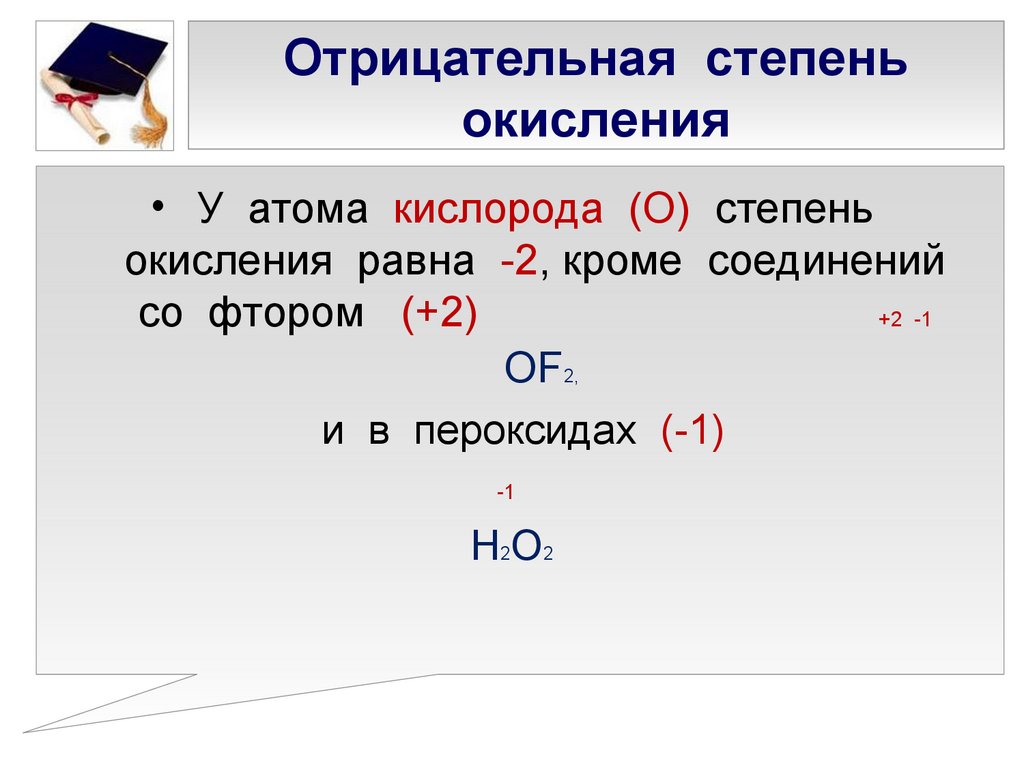 HCl
HCl
Ammonium Carbonate (Nh5)2CO3
Magnesium Nitride Mg3N2
Lead Nitrate Pb(NO3)2
Alanine Ch4CH(Nh3 ) COOH
Аммоний NH5
Аргинин C6H24N4O2
Нитроглицерина C3H5 (NO3) 3
MAGITRINE C6H5NH3
CAFFEIN0671 Calcium Nitrate Ca(NO3)2
Sulfanilic acid C6H7NO3S
Methyl isocyanate C2h4NO
Silver Cyanide AgCN
Silver Azide AgN3
Silver Fulminate AgONC
Silver Thiocyanate AgSNC
Gold(I) Cyanide AuCN
Barium Cyanide Ba(CN)2
Barium Nitrite Ba(NO2)2
Азид бария BaN6
Тиоцианат бария Ba(SCN)2
Нитрид бария Ba3N2
Нитрат бериллия Be(NO3)2
Тетрагидрат нитрата бериллия Be(NO3)2.4h3O
Тригидрат нитрата бериллия 93hNO3O2 .Be(NO3)2 .Be0671 Нитрид бериллия Be3N2
Оксинитрат висмута(III) BiONO3
Субнитрат висмута(IV) Bi5O(OH)9(NO3)4
Азид брома BrN3
Цианид кальция Ca(7CN)2
Цианид кадмия Cd(CN)2
Азид кадмия Cd(N3)2
Нитрид кадмия Cd3N2
Нитрид церия(III) CeN
Цианид кобальта(II) Co(CN)2
Нитрат кобальта(II) 9Co(06712) Гексагидрат нитрата кобальта(II) Co(NO3)2,6h3O
Нитрат кобальта(III) Co(NO3)3
Феррицианид кобальта(II) Co3(Fe(CN)6)2
Пиколинат хрома(III) Cr(C6h5NO2)3
Нитрид хрома(III) CrN
Нитрат хрома(III) Cr(NO3)3
Цианид цезия CsCN
Цезий Амид CsNh3
Нитрит цезия CsNO2
Нитрат цезия CsNO3
Азид цезия CsN3
Цианид меди (I) CuCN
Цианид меди (II) Cu(CN)2
Азид меди (I) (CuN3) Азид меди (Nu3)
Тиоцианат меди(I) CuSCN
Ферроцианид меди(II) Cu2Fe(CN)6
Нитрид диспрозия(III) DyN
Нитрид эрбия(III) ErN
Нитрид европия(III) EuN
Нитрат фтора FNO3
Нитрат железа(II) Fe(NO3)2
Ферроцианид железа(III) Fe4(Fe(CN)6)3
Нитрат галлия(III) Ga(NO3)3
Нитрид гадолиния(III) GdN
Нитрид германия(IV) Ge3N4
Нитрид гафния HfN
Нитрат ртути(II) Hg(NO3)2
Тиоцианат ртути(II) Hg(SCN)2
Нитрид гольмия 90 6 HoN Моноазид йода IN3
Цианид калия KCN
Цианат калия KCNO
Диметилдитиокарбамат калия KC3H7NS2
Potassium Nitrite KNO2
Potassium Azide KN3
Potassium Thiocyanate KSCN
Potassium Ferricyanide K3(Fe(CN)6)
Lanthanum Nitride LaN
Lithium Diisopropylamide LiN(C3H7)2
Lithium Amide LiNh3
Lithium Azide LiN3
Lithium Nitride Li3N
Lutetium Nitride LuN
Нитрат лютеция Lu(NO3)3
Нитрат марганца(II) Mn(NO3)2
Нитрид молибдена(III) MoN
Трибромид азота NBr3
Трихлорид азота NCl3
Трифторид азота NF3
Nitrogen Triiodide NI3
Dinitrogen Difluoride N2F2
Dinitrogen Tetrafluoride N2F4
Dinitrogen Trioxide N2O3
Dinitrogen Tetroxide N2O4
Dinitrogen Pentoxide N2O5
Sodium Cyanoborohydride NaBh4CN
Sodium Cyanate NaCNO
Sodium Hydromethylglycinate NaC3H6NO3
Sodium Amide NaNh3
Sodium Azide NaN3
Sodium Thiocyanate NaSCN
Sodium Нитрит кобальта Na3Co(NO2)6
Ферроцианид натрия Na4Fe(CN)6
Нитрид ниобия(III) NbN
Нитрид неодима(III) NdN
Нитрат неодима(III) Nd(NO3)3
Цианид никеля(II) Ni(CN)2
Нитрат никеля(II) Ni(NO3)2
Нитрид нептуния(III) NpN
Свинец( II) Цианид Pb(CN)2
Тиоцианат свинца(II) Pb(SCN)2
Азид свинца(II) Pb(N3)2
Цианид палладия(II) Pd(CN)2
Нитрат палладия(II) Pd(NO3) )2
Нитрид празеодима(III) PrN
Цианид платины(II) Pt(CN)2
Нитрид плутония(III) PuN
Нитрат радия RaNO3
Нитрат родия(III) Rh(NO3)3
Тринитрид SBN
SCN
(III) NITRATE SC (NO3) 3
Силиконовый нитрид Si3n4
нитрит стронция (NO2) 2
Thiocyanate Srscn
Tantalum (III) nitride tan 9067.


 Записати рівняння реакцій між металами з порядковими номерами 3, 13, 20, 25, 26, 28, 30, 37, 47, 56 з водою і сульфатною кислотою.
Записати рівняння реакцій між металами з порядковими номерами 3, 13, 20, 25, 26, 28, 30, 37, 47, 56 з водою і сульфатною кислотою. Серебристо – белые.
Серебристо – белые. :
: 43 моль х моль
43 моль х моль Серебристо – белые.
Серебристо – белые. Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон
Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон 2 л
2 л 04
04