Свойства хлорида бария (BaCl2) (25 фактов, которые вы должны знать) —
By Сарнали Мукерджи
Свойства хлорида бария показывают образование хлорида бария из атомов бария (Ba) и хлора (Cl). Ниже опишем свойства хлорида бария.
Свойства хлорида бария относятся к определенным химическим и физическим свойствам, которыми обладает соединение. Сочетание бария и Атомы хлора придали этому соединению уникальные свойства. Свойства определяют такие факты, как температуры плавления и кипения, вязкость, реакции и другие.
Свойства хлорида бария могут указывать на образование соединения, иллюстрируя внутренние процессы, происходящие между атомами бария и хлора. Два атома хлора и один атом бария соединяются друг с другом, образуя хлорид бария. Свойства будут описаны на протяжении всей статьи.
Хлорид бария название IUPAC
Компания ИЮПАК Хлорид бария такой же, как «хлорид бария» и «дихлорид бария».
Химическая формула хлорида бария
Химическая формула хлорида бария BaCl. 2, что означает, что два атома хлора создают связи с центральным атомом бария.
2, что означает, что два атома хлора создают связи с центральным атомом бария.
Номер CAS хлорида бария
КАС (Химическая абстрактная служба) регистрационный номер, присвоенный BaCl2 10361-37-2.
Хлорид бария ChemSpider ID
Идентификационный номер хлорида бария ChemSpider — 23540.
Химическая классификация хлорида бария
Химическая классификация хлоридов бария следующая:
- Хлорид бария встречается в виде неорганического соединения.
- Хлорид бария считается слабой солью.
- Установлено, что хлорид бария гигроскопичен по своей природе.
- Хлорид бария хорошо растворим в воде.
Молярная масса хлорида бария
Молярная масса хлорида бария составила 208.23 г/моль.
Цвет хлорида бария
Хлорид бария имеет чистый белый цвет. При соприкосновении с огнем дает светло-зеленый цвет пламени.
Вязкость хлорида бария
Вязкость Хлористый барий не был рассчитан должным образом, так как это соединение полностью растворимо в воде.
Молярная плотность хлорида бария
Молярная плотность безводного хлорида бария 3.856 г/см.3 тогда как молярная плотность дигидратной формы хлорида бария составляет 3.0979 г / см .3.
Температура плавления хлорида бария
Температура плавления хлорида бария была получена равной 960°С.
Температура кипения хлорида бария
Удельная температура кипения хлорида бария была определена как 1560 °С.
Состояние хлорида бария при комнатной температуре
Хлорид бария находится в твердом состоянии при комнатной температуре.
Ионная связь хлорида бария
Хлорид бария состоит из ионной связи между одним катионом бария и двумя анионами хлора.
BaCl2 Ионные связиИонный радиус хлорида бария
Ионный радиус бария в хлориде бария составляет 222 пм.
Электронные конфигурации хлорида бария
Электронная конфигурация определяется как расположение электронов на атомных орбиталях отдельных элементов. Идентифицируем электронную конфигурацию атомов Ba и Cl в BaCl2.
Электронная конфигурация бария 1с2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2. Кроме того, электронная конфигурация хлора равна 1 с.2 2s2 2p6 3s2 3p5.
Степень окисления хлорида бария
В хлориде бария степень окисления бария равна +2, а степень окисления каждого атома хлора равна -1.
Кислотность / щелочность хлорида бария
Хлорид бария не является ни кислым, ни щелочным с нейтральным уровнем pH.
Хлористый барий не имеет запаха?
Хлорид бария явно не имеет запаха.
Является ли хлорид бария парамагнитным?
Парамагнитные элементы замечено, что они обладают неспаренными электронами в своих электронных оболочках. То же самое и для соединения. Найдем, если BaCl2 парамагнетик или нет.
Хлорид бария не является парамагнитным соединением, которое полностью заполнено спаренными электронами на орбиталях как атомов бария, так и атомов хлора.
Гидраты хлорида бария
Ниже приведены три типа гидратов хлоридов бария:
- Хлорид бария безводный ( BaCl2)
- Гидрат хлорида бария ( BaCl2, H2O)
- Дигидрат хлорида бария (BaCl22H2O)
Кристаллическая структура хлорида бария
Хлорид бария имеет кристаллическую структуру.
Полярность и проводимость хлорида бария
- Хлорид бария оказался полярным соединением.
 Определенное количество дипольного момента возникает в хлориде бария из-за огромной разницы в электроотрицательности между атомами бария и хлора.
Определенное количество дипольного момента возникает в хлориде бария из-за огромной разницы в электроотрицательности между атомами бария и хлора. - Обнаружено, что хлорид бария обладает электропроводностью, поскольку полностью растворяется в воде.
Реакция хлорида бария с кислотой
Реакция хлорида бария с H2SO4 выделяет соляную кислоту.
BaCl2 + H2SO4 = BaSO4 + 2НСl
В реакции с азотной кислотой хлорид бария дает нитрат бария и соляную кислоту.
2ХНО3 + BaCl2 = Ва(НЕТ3)2 + 2НСl
Реакция хлорида бария с основанием
Хлорид бария образует осадок гидроксида бария после поздней реакции с гидроксидом натрия. BaCl2 + NaOH = Ва(ОН)2 + NaCl.
Реакция хлорида бария с оксидом
Хлорид бария не очень надежен в реакции с различными оксидами. Только в реакции хлорида бария с NO2, Нитрат бария имеет место как продукт.
Только в реакции хлорида бария с NO2, Нитрат бария имеет место как продукт.
BaCl2 + НЕТ2 = Ва(НЕТ2)2 + Кл2
Реакция хлорида бария с металлом
В реакциях с различными металлами, такими как железо и медь, барий идентифицируется как главный продукт реакций.
- Fe + BaCl2 = Ba + FeCl
- Cu + BaCl2 = CuCl + Ва
Заключение
Хлорид бария представляет собой простое водорастворимое неорганическое соединение в химии. Это подходит для предоставления общих знаний о реакционной природе солей хлорида. Определенная структура BaCl2 замечено, что он охватывает общеизвестные сведения об активном участии в различных химических реакциях.
Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
h3SO4+KOH=
Решено
Привести к нормальным условиям газ,. ..
..
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
формула вещества, реагирующего с раствором гидроксида кальция
Решите пожалуйста
Пользуйтесь нашим приложением
Свойства хлорида бария (BaCl2) (25 фактов, которые вы должны знать) Ниже опишем свойства хлорида бария.
Свойства хлорида бария относятся к определенным химическим и физическим свойствам соединения. Сочетание атомов бария и атомов хлора обеспечивает уникальные свойства соединения. Свойства определяют такие факты, как температуры плавления и кипения, вязкость, реакции и другие.
Свойства хлорида бария могут указывать на образование соединения, иллюстрируя внутренние процессы, происходящие между атомами бария и хлора. Два атома хлора и один атом бария соединяются друг с другом, образуя хлорид бария. Свойства будут описаны на протяжении всей статьи.
Хлорид бария Название IUPAC
Название IUPAC хлорида бария такое же, как «хлорид бария» и «дихлорид бария».
Хлорид бария химическая формула
Химическая формула хлорида бария BaCl 2 означает, что два атома хлора образуют связи с центральным атомом бария.
Хлорид бария Номер CAS
Регистрационный номер CAS (Chemical Abstract Service), присвоенный BaCl 2 : 10361-37-2.
Хлорид бария ChemSpider ID
Идентификационный номер ChemSpider хлорида бария 23540.
Химическая классификация хлорида бария
Химическая классификация хлоридов бария следующая:
- Хлорид бария встречается как неорганическое соединение.
- Хлорид бария считается слабой солью.
- Хлорид бария гигроскопичен по своей природе.
- Хлорид бария хорошо растворим в воде.

Молярная масса хлорида бария
Молярная масса хлорида бария составила 208,23 г/моль.
Цвет хлорида бария
Хлорид бария чисто белого цвета. При соприкосновении с огнем дает светло-зеленый цвет пламени.
Вязкость хлорида бария
Вязкость хлорида бария рассчитана неправильно, так как это соединение полностью растворимо в воде.
Молярная плотность хлорида бария
Молярная плотность безводного хлорида бария составляет 3,856 г/см 3 , тогда как молярная плотность дигидратной формы хлорида бария определена как 3,0979 г/см 3 .
Температура плавления хлорида бария
Температура плавления хлорида бария составляет 960 °C.
Температура кипения хлорида бария
Определенная температура кипения хлорида бария составляет 1560 °C.
Состояние хлорида бария при комнатной температуре
Хлорид бария находится в твердом состоянии при комнатной температуре.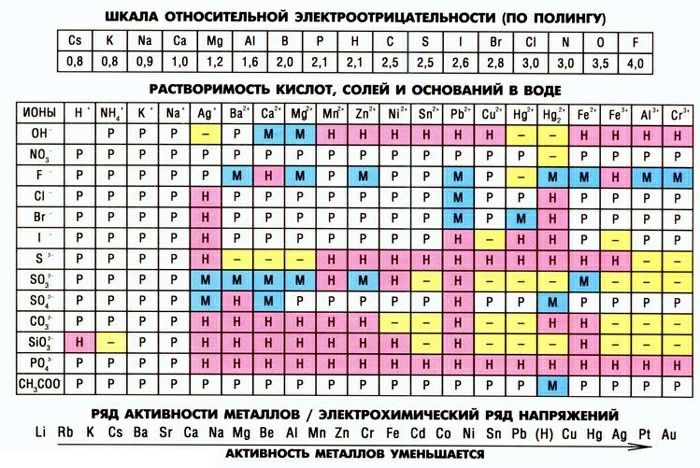
Ионная связь хлорида бария
Хлорид бария состоит из ионной связи между одним катионом бария и двумя анионами хлора.
BaCl 2 Ионные связиИонный радиус хлорида бария
Ионный радиус бария в хлориде бария составляет 222 пм.
Электронные конфигурации хлорида бария
Электронная конфигурация определяется как расположение электронов на атомных орбиталях отдельных элементов. Идентифицируем электронную конфигурацию атомов Ba и Cl в BaCl 2 .
Electron configuration of barium is 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6с 2 . Кроме того, электронная конфигурация хлора: 1s 2 2s 2 2p 6 3s 2 3p 5 .
Степень окисления хлорида бария
В хлориде бария степень окисления бария равна +2, а степень окисления каждого атома хлора равна -1.
Хлорид бария Кислотность/щелочность
Хлорид бария не является ни кислотным, ни щелочным с нейтральным уровнем pH.
Хлорид бария не имеет запаха?
Хлорид бария явно не имеет запаха.
Является ли хлорид бария парамагнитным?
Парамагнитные элементы имеют неспаренные электроны в своих электронных оболочках. То же самое и для соединения. Найдем, если BaCl 2 является парамагнитным или нет.
Хлорид бария не является парамагнитным соединением, которое полностью заполнено спаренными электронами на орбиталях как атомов бария, так и атомов хлора.
Гидраты хлорида бария
Три типа гидратов хлоридов бария обнаружены ниже:
- БАРИЯ ХОЛОРИД. О)
- Дигидрат хлорида бария (BaCl 2 , 2H 2 O)
Кристаллическая структура хлорида бария
Хлорид бария имеет кристаллическую структуру.
Полярность и электропроводность хлорида бария
- Хлорид бария является полярным соединением. Определенное количество дипольного момента возникает в хлориде бария из-за огромной разницы в электроотрицательности между атомами бария и хлора.
- Хлорид бария обладает электропроводностью, так как полностью растворяется в воде.
Реакция хлорида бария с кислотой
Реакция хлорида бария с H 2 SO 4 дает соляную кислоту.
BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCl
2HNO 3 + BaCl 2 = Ba(NO 3 ) 2 + 2HCl
Barium chloride reaction with base
Barium chloride makes a precipitate of Barium hydroxide after a late reaction with гидроксид натрия. BaCl 2 + NaOH = Ba(OH) 2 + NaCl.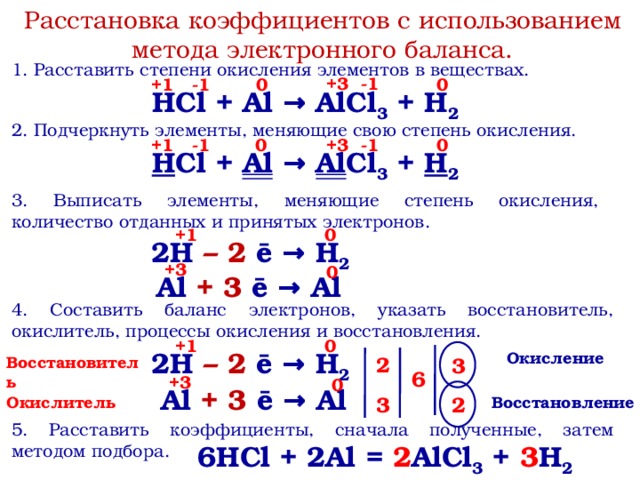
Реакция хлорида бария с оксидом
Хлорид бария не очень надежен в реакции с различными оксидами. Только в реакции хлорида бария с NO 2 , Нитрат бария имеет место как продукт.
Bacl 2 + NO 2 = BA (№ 2 ) 2 + CL 2
Гребная реакция бария с металлом
В реакциях с разными металлами, как иду, так же, как нит. , Барий идентифицируется как главный продукт реакций.
- Fe + BaCl 2 = Ba + FeCl
- Cu + BaCl 2 = CuCl + Ba
Заключение
Хлорид бария — простое водорастворимое неорганическое соединение в химии. Это подходит для предоставления общих знаний о реакционной природе солей хлорида. Замечено, что определенная структура BaCl 2 включает общеизвестные сведения об активном участии в различных химических реакциях.
Структура Льюиса Bacl2, характеристики: 13 быстрых фактов, которые нужно знать —
Эта тема посвящена Bacl2 и тому, как нарисовать структуру Льюиса bacl2, резонанс, форму, формальный заряд, угол, правило октетов, неподеленные пары, валентные электроны, гибридизацию и связанные с ними свойства.
Неорганическая соль хлорида бария состоит из катионов и анионов. Хлорид бария представляет собой водорастворимую твердую соль белого цвета. Это желто-зеленый цвет, когда подвергается пламени. Формула хлорида бария: BaCl 2 . Хлорид бария токсичен.
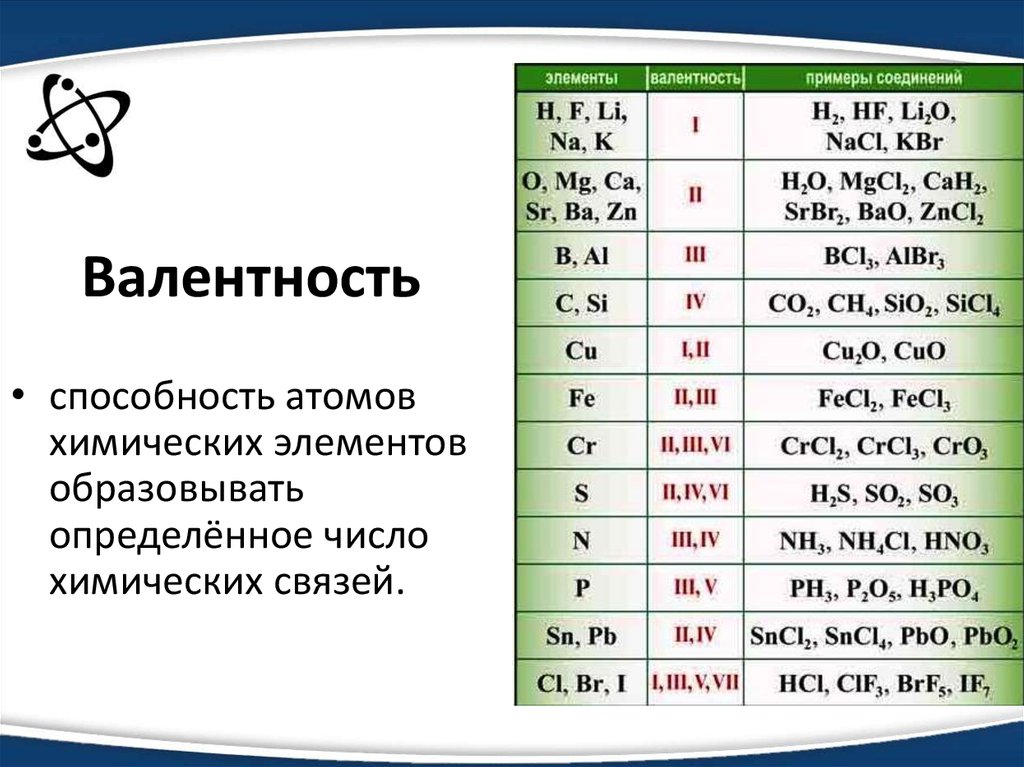
Как нарисовать структуру bacl2 lewis?Элемент группы 2 периодической таблицы содержит элементы Ba, имеющие 2 валентных электрона, так что Ba имеет две структуры точек Льюиса.
Атом хлора имеет 7 валентных электронов в своей самой внешней оболочке, чтобы завершить свой октет, он получит один электрон и приобретет один отрицательный заряд, и когда они объединяются, происходит образование ионных соединений.
В ионных соединениях нет обмена электронами, происходит только передача электронов.
Резонанс структуры Льюиса Bacl2Барий, являющийся металлом, и хлор, являющийся неметаллом, при соединении металла и неметалла образуют ионное соединение.
Ba +2 объединяется с Cl -1 с образованием BaCl 2 , представляющего собой ионное соединение белого цвета.
Bacl2 форма структуры ЛьюисаBacl2 в природных условиях существует в виде белых кристаллов. Это кристаллическое твердое вещество существует в ортогональной структуре.
Структура Bacl2 Bacl2 структура льюиса формальный зарядЗаряды или формальные заряды присваиваются атомам в молекулах. Барий с электронной конфигурацией = [Xe] 6s 2 , содержит два валентных электрона на последней оболочке.
Таким образом, барий — это металл, принадлежащий ко 2-й группе элементов, который всегда проявляет степень окисления +2. Таким образом, в Bacl2 Ba обладает зарядом +2, который теряет электроны, а два хлора приобретают 1 электрон, имея заряд -1. Таким образом, формальный заряд Bacl2 = Ba = +2, а 2Cl = -1.
Таким образом, в Bacl2 Ba обладает зарядом +2, который теряет электроны, а два хлора приобретают 1 электрон, имея заряд -1. Таким образом, формальный заряд Bacl2 = Ba = +2, а 2Cl = -1.
Подробнее о сильных электролитах Примеры
Структурный угол Льюиса Bacl2Молекулы Bacl2 имеют линейную форму с валентным углом 180°.
Это ионное соединение с зарядом Ba +2 и Cl -1 .
Bacl2 правило октета структуры ЛьюисаХлорид бария является ионным соединением. Этот барий является исключением, потому что он следует правилу октетов и до сих пор не имеет 8 электронов на своей внешней оболочке.
Когда Ba теряет 2 электрона и становится стабильной электронной конфигурацией благородного газа, как Ba= [Xe]6s 2 , он превращается в Ba=[Kr] 5s 2 ,4d 10 ,5p 6 . Таким образом, нет. валентных электронов вокруг окружающего металла меньше 8.
Таким образом, нет. валентных электронов вокруг окружающего металла меньше 8.
Согласно структуре точек Льюиса bacl2, Ba имеет 2 валентных электрона, а Cl имеет 7 валентных электронов. Bacl2 образуется в результате переноса электронов от Ba к cl, после чего остаются неподеленные пары только на хлоре.
Таким образом, хлор содержит 6 неподеленных пар, и в целом все соединения являются ионными.
Валентные электроны Bacl2Валентные электроны — это те, которые присутствуют в самой внешней оболочке атома.
Сколько валентных электронов содержится в Bacl2?Барий относится ко 2 группе в периодической таблице, поэтому состоит из 2 валентных электронов на внешней оболочке.
Таким образом, барий имеет валентность +2, а в случае хлора он имеет 7 валентных электронов на внешней оболочке.
Ba= 2 валентных электрона
Cl = 7 валентных электронов
Гибридизация Bacl2 Графический и математический метод определения связи в молекуле называется гибридизацией.
Гибридизация – это смешивание атомных орбиталей с одинаковой энергией с образованием новой гибридной орбитали.
В молекулах Bacl2 есть Sp Гибридные орбитали образованы линейной структурой и углом 180°. Итак, гибридизация Bacl2 — это Sp 9.0007 .
Гибридизация Bacl2 Растворимость Bacl2- В воде барий ведет себя иначе и образует электролиты в воде в соотношении 1:2.
- Растворяется в воде и разделяется на катион (Ba +2 ) и анион (Cl -1 ).
- Растворимость хлорида бария в воде = 358 г/л при 20℃.
- Хлорид бария, таким образом, растворим в воде при различных температурах, так как Bacl2 образует в воде катион и анион, а вода имеет H + и OH – , поэтому он легко растворяется в воде. Хлорид бария также растворяется в метаноле, но не в этаноле.

Да, ионная неорганическая соль Bacl2.
Хлорид бария образуется при соединении металлов и неметаллов, обычно при соединении металлов с неметаллами происходит образование ионной связи.
Здесь передача электронов от Ba +2 в Cl -1 и за счет этого переноса происходит образование ионной связи. Степень окисления Ba равна +2, а степень окисления хлора -2.
Как Bacl2 является ионным?Обычно при соединении металлов с неметаллами образуется ионная связь. Есть еще одна причина, по которой Bacl2 является ионным, — это различия в их электроотрицательности.
Как мы видим в таблице Менделеева Ba +2 имеют электроотрицательность 0,89что меньше, чем Cl -1 , которые имеют 3.16. Таким образом, эта разница в электроотрицательности больше 2,0, что означает, что соединение является ионным.
Bacl2 полярен из-за растворимости в воде, а полярность хлорида бария обусловлена разницей в электроотрицательности между атомами бария и хлора.
Геометрия молекул отличается, так как их Гибридизация является sp и они обладают кристаллической структурой, поэтому их дипольный момент не компенсирует друг друга, генерируя диполь, и он становится полярным.
Является ли Bacl2 кислотой?Соединение хлорида бария не является кислым.
Причина:Потеряв два электрона, барий становится катионом, а хлор становится анионом, образуя ионное соединение. Поэтому, когда мы готовили водный раствор, он растворялся в воде в виде водорастворимых солей. Таким образом, Bacl2 не является кислым.
Почему Bacl2 нейтрален? Хлорид бария нейтрален из-за его водного раствора, а в водном растворе образуются катионы и анионы, которые делают раствор электрически нейтральным, и рН раствора становится нейтральным.

 Определенное количество дипольного момента возникает в хлориде бария из-за огромной разницы в электроотрицательности между атомами бария и хлора.
Определенное количество дипольного момента возникает в хлориде бария из-за огромной разницы в электроотрицательности между атомами бария и хлора.