Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем.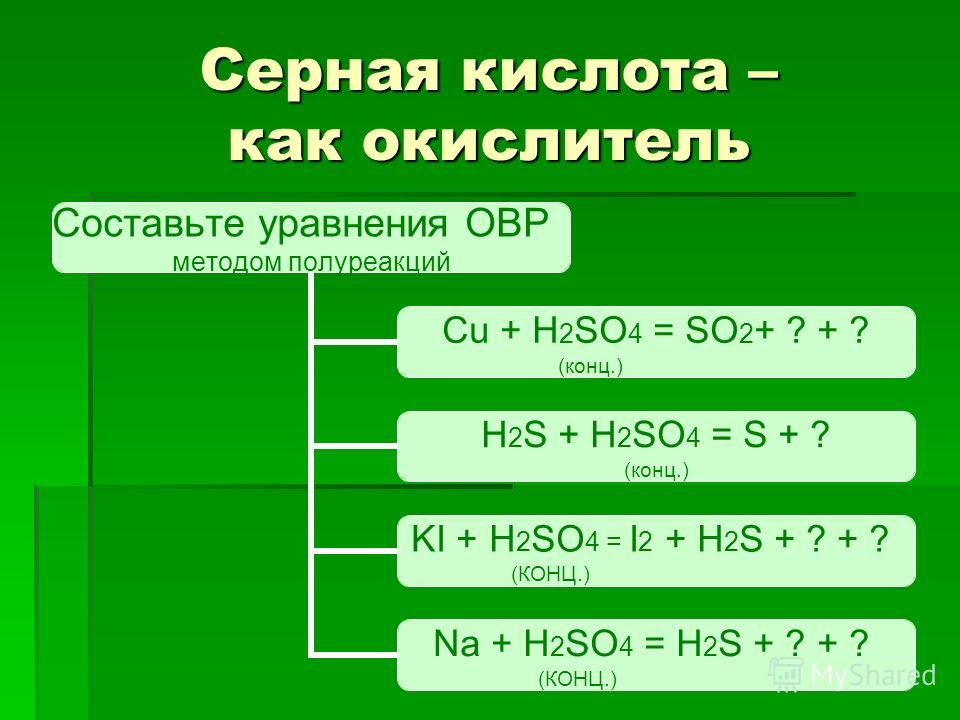 Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Хром. Нахождение хрома в природе презентация, доклад
ХРОМ
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит.
В 1797 французский химик Л. Н. Воклен открыл в сибирской
красной свинцовой руде новый элемент хром и в 1798 году
получил его в свободном состоянии.
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Положение хрома в ПСХЭ Д.И. Менделеева. Строение атома.
период
группа
порядковый номер
Cr
металл
24
4
VIB
+24
4
2
1
8
валентные электроны
13
1s2
2s22p6
4s1
3s23p6
3d 5
Cr0 ─ 2e → Cr+2
Cr0 ─ 3e → Cr+3
Cr0 ─ 6e → Cr+6
Нахождение хрома в природе
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
хромит
крокоит
Физические свойства
Плотность 7,19 г/см3;
t плавления 1890°С;
t кипения 2480°С.
В свободном виде — голубовато- белый металл.
Хром (с примесями) является одним из самых твердых металлов.
Очень чистый хром достаточно хорошо поддаётся механической обработке, пластичен.
Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома (III) Cr2O3.
Химические свойства
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, h3,Cu,Hg,Ag,Au
Cr
Cr
+
+
+
+
h3SO4 (конц.),
растворы солей
+ неметаллы
О2
растворы HCl, h3SO4
h3O
+
щелочные расплавы окислителей
+
HNO3
При комнатной температуре хром химически мало активен
из-за образования на его поверхности тонкой прочной
оксидной пленки.
При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами, например:
кислородом, галогенами, азотом, серой.
Преиимущественно
образуются соединения
со степенью
окисления +3
В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3h3O = Cr2O3 + 3h3
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, h3,Cu,Hg,Ag,Au
Cr
В ряду напряжений хром находится левее
водорода и поэтому
в отсутствии воздуха
может вытеснять водород из растворов
соляной и серной кислот,
образуя соли хрома (II).
Cr0 + H+1Cl = Cr+2Cl2 + h30
Cr0 – 2e → Cr+2 1
2H+ + 2e → h30 1
2
Cr0 – восстановитель, процесс окисления
HCl (за счет Н+1) – окислитель, процесс восстановления
Cr0 + h3+1SO4 = Cr+2SO4 + h30
Cr0 – 2e → Cr+2 1
2H+ + 2e → h30 1
Cr0 – восстановитель, процесс окисления
h3SO4(за счет Н+1) – окислитель,
процесс восстановления
В присутствии кислорода
хром реагирует с растворами
кислот c образованием
солей хрома (III)
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O
Концентрированные серная и азотная
кислоты на холоду пассивируют хром
При сильном нагревании кислоты
pастворяют хром с образованием
cолей хрома (III)
Cr + h3SO4 → Cr2(SO4)3 + SO2 + h3O
Cr + HNO3 → Cr(NO3)3 + NO2 + h3O
Хром способен вытеснять многие металлы, например
медь, олово, серебро и другие, из растворов их солей:
Cr0 + Cu+2SO4 → Cr+2SO4 + Cu0
Cr0 – 2e → Cr+2 1
Cu+2+ 2e → Cu0 1
Cr + CuSO4 = CrSO4 + Cu
Cr0 – восстановитель, процесс окисления
CuSO4 (за счет Cu+2) – окислитель, процесс
восстановления
Cr + KClO3 + KOH K2CrO4 + KCl + h3O
Растворы щелочей на хром практически
не действуют.
Хром реагирует с щелочными расплавами
окислителей.
При взаимодействии с щелочными расплавами
окислителей хром образует соли
анионного типа, в которых проявляет
высшую степень окисления.
сплавление
Хром — постоянная составная часть растительных и животных организмов. В крови содержится от 0,012 до 0,0035 % хрома. Хром имеет большое значение в метаболизме углеводов и жиров, а также участвует в процессе синтеза инсулина. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови Элемент способствует нормальному формированию и росту детского организма. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Хром важный компонент во многих легированных сталях.
Используется в качестве износоустойчивых и красивых
гальванических покрытий (хромирование)
Хром применяется для производства сплавов:
хром-30 и хром-90, незаменимых для производства сопел
мощных плазмотронов и в авиакосмической промышленности.
Соединения хрома
Соединения хрома (II)
Соединения хрома (III)
Соединения хрома (VI)
оксид
гидроксид
соли
оксид
гидроксид
соли
соли
гидроксид
оксид
Соединения хрома (II)
CrO
Оксид хрома (II) – кристаллы черного цвета,
имеет основный характер
При осторожном нагревании
гидроксида хрома (II) в отсутствии кислорода получают оксид хрома (II). Составьте уравнение реакции.
Cr(OH)2 = CrO + h3O
3CrO = Cr + Cr2O3
При более высоких температурах оксид хрома (II)
диспропорционирует:
700°
Оксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до оксида
хрома (III)
4CrO + O2 = 2Cr2O3
Cr(OH)2
Гидроксид хрома (II)
Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на соли хрома (II) без доступа воздуха.
CrCl2 + 2NaOH = Cr(OH)2 ↓ + 2NaCl
Cr2+ + 2Cl– + 2Na+ + 2OH– = Cr(OH)2 ↓ + 2Na+ + 2Cl–
Cr2+ + 2OH– = Cr(OH)2 ↓
Гидроксид хрома (II) обладает основными свойствами.
Cr(OН)2 + 2HCl = CrCl2 + 2h3O
Гидроксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до гидроксида хрома (III)
4Cr(OН)2 + O2 + 2Н2О = 4Cr(OН)3
Соли хрома (II)
Водные растворы солей хрома (II) получают без доступа
воздуха растворением металлического хрома в разбавленных
кислотах в атмосфере водорода или восстановлением цинком
в кислой среде солей трехвалентного хрома.
Безводные соли хрома (II) белого цвета, а водные растворы и
кристаллогидраты — синего цвета.
Соединения хрома (II) – сильные восстановители. Легко окисляются.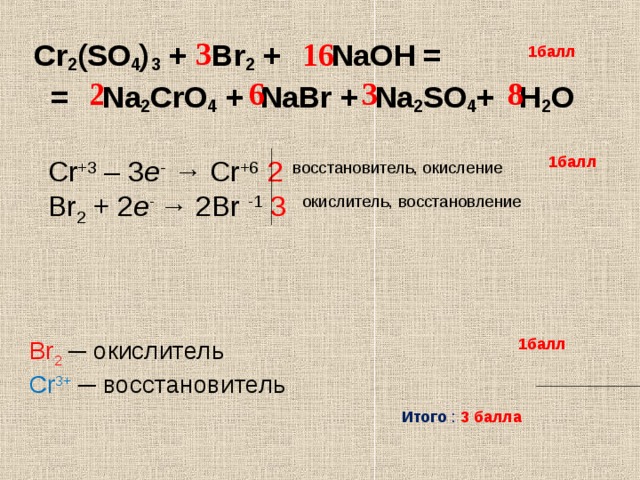 Именно поэтому очень трудно получать и хранить соединения двухвалентного хрома.
Именно поэтому очень трудно получать и хранить соединения двухвалентного хрома.
Реагируют с концентрированными серной и азотной кислотами:
CrCl2 + O2 + HCl → CrCl3 + h3O
CrCl2 + h3SO4 → Cr2(SO4)3 + SO2↑ + HCl↑ + h3O
CrCl2 + HNO3 → Cr(NO3)3 + NO2↑ + HCl↑ + h3O
Cr+2Cl2 + O20 + HCl → Cr+3Cl3 + h3O–2
Cr+2 – 1e → Cr+3 4
O20 + 4e → 2O–2 1
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2h3O
Соединения хрома (III)
Cr2O3
Оксид хрома – тугоплавкий порошок темно-зеленого цвета.
Оксид хрома (III) обладает амфотерными свойствами
Cr2O3 + 6HCl = 2CrCl3 + 3h3O
Сr2O3 + Ba(OH)2 = Ba(CrO2)2 + h3O
В окислительно-восстановительных реакциях оксид хрома (III)
ведет себя как восстановитель:
Cr2O3 + KOH + KMnO4 → K2CrO4 + MnO2 + h3O
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Cr2O3 + KOH + Сa(ClO)2 → K2CrO4 + CaCl2 + h3O
Cr2O3 + O2 + Na2CO3 → Na2CrO4 + CO2
Cr2O3 + KClO3 + Na2CO3 → Na2CrO4 + KCl + CO2
Cr2O3 + NaNO3 + Na2CO3 → Na2CrO4 + NaNO2 + CO2
Оксид хрома (III) – катализатор
В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота.
Гидроксид хрома (III)
Cr(OH)3
Получают гидроксид хрома (III) действием
растворов щелочей или аммиака на растворы
солей хрома (III).
CrCl3 + 3(Nh4·h3O) = Cr(OH)3 + 3Nh5Cl
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте раствор соляной кислоты, а к другой –
щелочь. Что происходит?
Что происходит?
Какими свойствами обладает гидроксид хрома (III)?
Cr(OH)3
CrCl3
Na3[Cr(OH)6]
NaOH
HCl
+h3SO4
+NaOH
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте серной кислоты, а к другой – щелочь.
Что происходит?
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3–
Cr(OH)3 + 3OH– = [Cr(OH)6]3–
2Cr(OH)3 = Cr2O3 + 3h3O
t°
Гидроксид хрома (III) растворяется в щелочах
При нагревании гидроксид хрома (III) разлагается:
гексагидроксохромат (III) натрия
(изумрудно-зеленый)
Соединения хрома (III) могут проявлять как окислительные,
так и восстановительные свойства.
K3[Cr(OH)6] + Br2 + KOH → K2CrO4 + KBr + h3O
CrCl3 + h3O2 + KOH → K2CrO4 + KCl + h3O
KCrO2 + PbO2 + KOH → K2CrO4 + K2PbO2 + h3O
Cr2(SO4)3 + Cl2 + NaOH → Na2CrO4 + NaCl + h3O + Na2SO4
CrCl3 + Zn → CrCl2 + ZnCl2
Получают CrO3 действием избытка
концентрированной серной кислоты
на насыщенный водный раствор
дихромата натрия:
Na2Cr2O7 + 2h3SO4 = 2CrO3 + 2NaHSO4 + h3O
Оксид хрома (VI) очень ядовит.
4CrO3 → 2Cr2O3 + 3O2↑.
При нагревании выше 250 °C разлагается:
Оксид хрома (VI) CrO3 — хромовый ангидрид,
представляет собой темно-красные
игольчатые кристаллы.
CrO3 — кислотный оксид.
С избытком воды образуется хромовая
кислота h3CrO4
CrO3 + Н2O = Н2CrO4
При большой концентрации CrO3 образуется дихромовая
кислота Н2Cr2О7
2CrO3 + Н2O = Н2Cr2O7
которая при разбавлении переходит в хромовую кислоту:
Н2Cr2О7 + Н2О = 2Н2CrO4
При растворении в воде образует кислоты.
Эти кислоты – неустойчивые. Существуют только в растворе.
Между ними в растворе устанавливается равновесие
2Н2CrO4 ↔ Н2Cr2O7 + Н2O
При взаимодействии CrO3 со щелочами образуются хроматы
CrO3 + 2KOH → K2CrO4 + h3O.
CrO3 является сильным окислителем
Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним.
Окисляет йод, серу, фосфор, уголь.
4CrO3 + 3S = 2Cr2O3 + 3SO2↑.
CrO3 + C2H5OH → CO2 + Cr2O3 + h3O
C2H5OH + 3h3O – 12e → 2CO2 + 12H+ 1
2CrO3 + 6H+ + 6e → Cr2O3 + 3h3O 2
4CrO3 + C2H5OH → 2CO2 + 2Cr2O3 + 3h3O
C2H5OH + 3h3O + 4CrO3 + 12H+ = 2CO2 + 12H+ + 2Cr2O3 + 6h3O
Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов CrO3; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет
Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет
хроматы – соли хромовой кислоты устойчивы в щелочной среде, при
подкислении переходят в оранжевые
дихроматы, соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается.
2CrO42– + 2H+ ↔ Cr2O72– + h3O
хроматы
дихроматы
соли
ОН–
Н+
Лабораторный опыт № 3
К раствору дихромата калия добавьте гидроксид калия.
Как изменилась окраска? Чем это вызвано?
К полученному раствору добавьте
серной кислоты до восстановления
желтой окраски.
Напишите уравнения реакций.
2K2CrO4 + h3SO4(разб.) = K2Cr2O7 + K2SO4 + h3O
K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
2K2CrO4 + 2HCl(разб. ) = K2Cr2O7 + 2KCl + h3O
) = K2Cr2O7 + 2KCl + h3O
2K2CrO4 + h3O + CO2 = K2Cr2O7 + KHCO3
Взаимопревращение хроматов и дихроматов
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия K2CrO4 и дихромат калия K2Cr2O7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым.
2K2CrO4 + h3SO4 = K2Cr2O7 + K2SO4 + h3O
В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы.
K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
Соединения хрома (VI) –
сильные окислители
Cr2O72–
Cr3+
Cr(OH)3
[Cr(OH)6]3–
H+
h3O
OH–
Cr2O72– + 14H+ + 6e → 2Cr3+ + 7h3O
Cr2O72– + 7Н2О + 6e → 2[Cr(OH)6]3– + 2ОН–
Окислительные свойства дихроматов
Дихроматы, например дихромат калия K2Cr2O7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия.
Под действием восстановителей дихроматы в кислой среде переходят в соли хрома (III). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия.
K2Cr2O7 +3Na2SO3+4h3SO4 =Cr2(SO4)3 + 3Na2SO4+ K2SO4 + 4h3O
Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома (III) зеленого цвета. Соли хрома — ярко окрашены, именно поэтому элемент получил такое название: «хром», что в переводе с греческого означает «цвет, краска».
Zn + K2Cr2O7 + h3SO4 → ZnSO4 + Cr2(SO4)3 + K2SO4 +h3O
K2Cr2O7 + h3S + h3SO4 → S + Cr2(SO4)3 + K2SO4 +h3O
K2Cr2O7 + h3O2 + h3SO4 → O2 + Cr2(SO4)3 + K2SO4 +h3O
K2Cr2O7 + h3O + h3S → S + Cr(OH)3 + KOH
K2Cr2O7 + h3O + K2S → S + K3[Cr(OH)6] + KOH
Дихроматы проявляют окислительные свойства не только в
растворах, но и в твердом виде:
K2Cr2O7 + S → K2SO4 + Cr2O3
K2Cr2O7 + С → K2СO3 + СО + Cr2O3
K2Cr2O7 + Al → Cr + KAlO2 + Al2O3
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
K2Cr2O7 + KOH + (Nh5)2S → S + K3[Cr(OH)6] + Nh4
Дихромат калия (хромпик) широко применяется как окислитель
органических соединений:
3С2H5OH + K2Cr2O7 + 4h3SO4 Ch4– CHO + Cr2(SO4)3 + K2SO4 + 7h3O
3С3H7OH + K2Cr2O7 + 4h3SO4 3Ch4– C–Ch4 + Cr2(SO4)3 + K2SO4 + 7h3O
║
O
Хроматы щелочных металлов плавятся без разложения, а
дихроматы при высокой температуре превращаются в хроматы.
Дихромат аммония разлагается при нагревании:
(Nh5)2Cr2O7 Cr2O3 + N2 + 4h3O
180°C
В ряду гидроксидов хрома различных степеней окисления
Cr(ОН)2 — Cr(ОН)3 — Н2CrО4
закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства.
В этом же ряду последовательно усиливаются окислительные свойства.
Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III).
Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III).
Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
Степень окисления хромa +2 +3 +6
Оксид CrO Cr2O3 CrO3
Гидроксид Cr(OH)2 Cr(OH)3 h3CrO4
h3Cr2O7
Кислотные и окислительные свойства возрастают
Основные и восстановительные свойства возрастают
Соединения хрома
Презентация по химии Окислительно- восстановительные реакции (11 класс) доклад, проект
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация на тему Презентация по химии Окислительно- восстановительные реакции (11 класс), предмет презентации: Химия. Этот материал в формате pptx (PowerPoint) содержит 19 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Этот материал в формате pptx (PowerPoint) содержит 19 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Окислительно- восстановительные реакции
ОВР – это реакции, протекающие с изменением степени окисления элементов
Окислители- это атомы элементов, которые принимают электроны.
Восстановители – это атомы элементов, которые отдают электроны.
Основные окислители:
Типичные неметаллы (F2 ,Cl2 ,Br2 ,I2 ,O2 ,O3).
Кислородсодержащие кислоты и соли (h3SO4 ,HNO3 ,KMnO4 K2CrO4,K2Cr2O7 , HClO ,HClO3 ,HBrO3).
Водород (Н)в степени окисления +1
Ионы металлов, находящихся в высшей степени окисления (Fe3+ ,Cu2+ ,Hg2+)
Неметаллы- окислители
Галогены, выступая в качестве окислителей приобретают степень окисления -1
F2 →F-1, Cl2 →Cl-1, I2 →I-1
Кислород, выступая в качестве окислителя приобретает степень окисления -2 (h3O ,
OH- или О-2)
O2 →h3O O2 →OH-1
Озон
О3→О2+О-2
Перманганат калия KMnO4
Хромат калия K2CrO4 и дихромат калия K2Cr2O7
Серная кислота h3SO4 (концентрированная)
Пассивирует на холоде Fe, Cr, Al
При нагревании Fe, Cr, Al:
Me+ h3SO4→Me2(SO4)3+SO2+h3O
Щелочные и щелочноземельные металлы
Me+ h3SO4→Me SO4+h3S+h3O
Цинк
Zn + h3SO4→ ZnSO4+h3O +h3S(SO2 ,S )
Не реагирует с платиновыми и благородными металлами
Все остальные металлы
Me+ h3SO4→MeSO4+SO2+h3O
Неметаллы
Нем + h3SO4 →кислота+SO2+h3O
Азотная кислота HNO3 (сильно разбавленная)
Металлы в ряду активности от лития до цинка
Me+HNO3 →MeNO3+h3O+Nh5NO3
Железо
Fe+HNO3 →Fe(NO3)3+h3O+N2
Азотная кислота HNO3 (разбавленная)
Металлы
Me+HNO3 →MeNO3+h3O+NO
Не реагирует с золотом и платиновыми металлами
Неметаллы
Нем+HNO3 →кислота+h3O+NO
Азотная кислота HNO3 (концентрированная)
Не реагирует с золотом и платиновыми металлами
На холоде пассивирует железо, алюминий, хром
Железо, алюминий, хром при нагревании
Me+HNO3 →Me(NO3)3+h3O+NO2
S- элементы I и II группы
Me+HNO3 →MeNO3+h3O+N2O
Все остальные металлы
Me+HNO3 →MeNO3+h3O+NO2
Неметаллы
Нем+HNO3 →кислоты+h3O+NO2
Соли азотной кислоты
Кислородсодержащие кислоты галогенов
Кислородсодержащие кислоты галогенов и их соли, действуя в качестве окислителей, восстанавливаются до степени окисления галогенов -1 (хлор или бром) или 0 (йод)
Водород Н+1
Водород в степени окисления +1 выступает как окислитель преимущественно в растворах кислот (при взаимодействии кислоты и металла) или в составе воды
Me+HCl →MeCl+h3
K+h3O → KOH+h3
Ионы металлов в высшей степени окисления
Выполняя функцию окислителей, ионы металлов , находящиеся в высшей степени окисления , превращаются в ионы с более низкой степенью окисления:
Cu+2+1e → Cu+1
Hg+2+1e → Hg+1
Fe+3+1e → Fe+2
Cr+3+1e → Cr+2
Основные восстановители
Металлы
Ме0-е=Ме+
Гидриды металлов I,II A групп
2МеН-2е=Н2 МеН2-2е=Н2
Катионы металлов в низшей + степени окисления:
Cu+1-1e → Cu+2
Hg+1-1e → Hg+2
Fe+2-1e → Fe+3
Cr+2-1e → Cr+3
Основные восстановители
Неметаллы IV-VII A групп (чаще всего h3,C,P,S)
h3-2e=2H+
C0-2e=C+2
C0-4e=C+4
P0-3e=P+3
P0-5e=P+5
S0-4e=S+4
Соединения неметаллов в низшей степени окисления
2Hal-1-2e=Hal20
h3S-ne=S(SO2,h3SO4)
2Nh4-6e=N2O
Окислители и восстановители
Только окислители- это атомы элементов в своей положительной высшей степени окисления.
Только восстановители – это атомы элементов в своей низшей отрицательной степени окисления.
Окислительно- восстановительную двойственность проявляют атомы элементов с промежуточной валентностью.
Окислительно- восстановительная двойственность
Йод
I2+h3S=2HI+S (окислитель)
I2+5Cl2+6h3O=2HIO3+10HCl (восстановитель)
Пероксид водорода
5h3O2+I2=2HIO3+4h3O (окислитель)
3h3O2+2KMnO4=2MnO2+2KOH+
3O2+2h3O (восстановитель)
Окислительно- восстановительная двойственность
Азотистая кислота и ее соли
2NaNO2+2NaI+2h3SO4=2NO+I2+2Na2SO4+2h3O (окислитель)
5HNO2+2KMnO4+3h3SO4=5HNO3+2MnSO4+K2SO4+3h3O (восстановитель)
Галогены в щелочной среде участвуют в реакциях диспропорционирования
Cl2+2KOH=KOCl+KCl+h3O (холод)
3Cl2+6KOH=KClO3+5KCl+3h3O (при нагревании)
Окислительно- восстановительная двойственность
Реакции конпропорционирования
2h3S+SO2=3S+2h3O
Реакции диспропорционирования
3S+6NaOH=2Na2S+Na2SO3+3h3O
Внутримолекулярное окисление и восстановление
2KClO3=2KCl+3O2
(катализатор MnO2)
Скачать презентацию
 ru?
ru?Это сайт презентаций, где можно хранить и обмениваться своими презентациями, докладами, проектами, шаблонами в формате PowerPoint с другими пользователями. Мы помогаем школьникам, студентам, учителям, преподавателям хранить и обмениваться учебными материалами.
Для правообладателей
Обратная связь
Email: Нажмите что бы посмотреть
Бутин-2, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Реакция с несколькими соединениями – Lambda Geeks
Неорганическая реакция (KOH + Cr2O3) дает KCrO2 в виде порошка.
В этой статье мы видим реакцию различных компонентов с Cr2O3 в основной среде, KOH, где Cr2O3 действует как восстановитель.
Что такое Cr2O3 + Koh?При определенном давлении и температуре оксид хрома (III) и гидроксид калия реагируют, и в результате мы получаем KCrO2 и воду (h3O), где степень окисления остается такой же для хрома (Cr), который равен (3+) .
Что является продуктом Cr2o3 + Koh?В реакции KCrO2 и воды (h3O), образующихся после реакции Cr2O3 и KOH, если мы сбалансируем реакцию как по реагентам, так и по продуктам, мы получим 2KOH + Cr2O3 = h3O + 2 KCrO2, где степень окисления хрома (Кр) есть (3+).
Реакция Cr2O3 + KOH Как сбалансировать Cr2o3 + Koh? Если мы уравновешиваем реакцию, мы можем найти, сколько молекул требуется для получения продукта, для этого мы обозначаем каждый компонент реакции a, b, c, d и т. д. в виде коэффициентов, скажем, как для a KOH + b Cr2O3 = c h3O + d KCrO2.
д. в виде коэффициентов, скажем, как для a KOH + b Cr2O3 = c h3O + d KCrO2.
Затем создайте уравнения с помощью коэффициентов, так как количество компонентов соответствует как; (1) a = d для «K», (2) 2b = d для «Cr», (3) a + 3b = c + 2d для кислорода и (4) a = 2c для водорода. После этого, решая решения, мы получаем числа.
Здесь a = d = 2b = 2c, поэтому, если мы рассматриваем a и d как 2, тогда b и c становятся равными, и мы получаем коэффициенты компонентов реакции.
Какой тип реакции Cr2o3 + Koh?Химическая реакция CrO3 + KOH является реакцией нейтрализации, поскольку реагентная среда является щелочной, где оксид хрома (CrO3) реагирует с основным KOH с образованием KCrO2 с молекулой воды (h3O).
Cr2O3+Koh+h3o В этой реакции образуется гексагидроксохромат(III) калия, представляющий собой молекулу сложного типа, балансируя реагент и продукт, мы получаем, Cr2O3 + 6 KOH + 3 h3O = 2 K3[Cr(OH)6].
Если мы проверим степень окисления хрома (Cr) на стороне реагента, а на стороне продукта она изменится с (3+) на (6+), степень окисления увеличится, что означает, что Cr высвобождает больше трех электронов, поэтому он действует как восстановитель.
В продукте [Cr(OH)6](3-) является координационным элементом , где Cr(III) является центральным атомом, так как к нему присоединены лиганды 6 (-OH), поэтому координационное число будет 6, поскольку такое количество лигандов связано с центральным атомом.
cr2o3+koh+kclo3В реакции образуются хромат калия (K2CrO4), хлорид калия (KCl) и вода (h3O), где уравновешивая реакцию получаем, KClO3 (водн.) + Cr2O3 (тв) + 4 KOH (водн.) = KCl (водн.) + 2 K2CrO4 (водн.) + 2 h3O (ж.).
Если мы проверим степени окисления хрома (Cr) и хлора (Cl), мы обнаружим, что они меняются со стороны реагента на сторону продукта, поскольку Cr2O3 переходит в K2CrO4, где степень окисления хрома увеличивается с (+3) до ( +6), так как два Cr(+3) освобождают шесть электронов.
Таким образом, Cr2O3 является восстановителем в реакции, так как эти высвобождающие шесть электронов принимаются хлором KClO3 и изменяют свою степень окисления с (+5) на (-1), поэтому KClO3 действует как окислитель здесь.
реакция KClO3 с Cr2O3 + KOH Cr2o3+Koh+Kno3со стороны продукта получаем, 3 KNO3 (водн.) + Cr2O3 (тв) + 4 KOH (водн.) = 3 KNO2 (водн.) + 2 K2CrO4 (водн.) + 2 h3O (ж.).
В окислительно-восстановительной реакции реакция восстановления происходит, когда KNO3 превращается в KNO2, где степень окисления атома азота переходит из (+5) в (+3) за счет принятия всего 6 электронов для трех атомов азота из Cr (III ), поэтому KNO3 является окислителем.
Одновременно происходит процесс окисления (процесс переноса электронов), где Cr2O3 действует как восстановитель , поскольку хром увеличивает свою степень окисления с (+3) до (+6), когда Cr2O3 переходит в K2CrO4, высвобождающиеся электроны восстанавливают азот KNO3.
В реакции образуются хлорид калия (KCl), хромат калия (K2CrO4) и вода (h3O), уравновешивая как реагент, так и продукт, получаем, 3 Cl2 (г) + Cr2O3 (т) + 10 КОН (водн.) = 2 K2CrO4 (водн.) + 5 ч3О (л).
В процессе окисления, когда происходит перенос электрона с атомной орбитали на акцептор, Cr2O3 действует как восстановитель, поскольку хром меняет свою степень окисления с (+3) на (+6) путем переноса электронов при переносе Cr2O3 на хромат калия.
В процессе восстановления, когда атомная вакантная орбиталь принимает электроны, Cl2 действует как окислитель, поскольку хлор снижает свою степень окисления с нуля (0) до (-1) путем принятия электронов, когда 3 молекулы хлора (Cl) образуют 6 молекул хлорида калия.
cr2o3+koh+ca(clo)2 В окислительно-восстановительной реакции образуются хромат калия (K2CrO4), хлорид кальция (CaCl2) и вода (h3O), где уравновешивая обе стороны реакции получаем, 3 Ca(ClO)2 (т) + 2 Cr2O3 (т) + 8 KOH (водн. ) = 3 CaCl2 (водн.) + 4 K2CrO4 (водн.) + 4 h3O (ж).
) = 3 CaCl2 (водн.) + 4 K2CrO4 (водн.) + 4 h3O (ж).
Если мы проверим степени окисления хрома (Cr) и хлора (Cl), мы обнаружим, что они меняются со стороны реагента на сторону продукта, поскольку оксид хрома (III) переходит в K2CrO4, где степень окисления хрома изменяется с (+3 ) до (+6) представляет собой реакцию окисления.
Таким образом, Cr2O3 действует как восстановитель в реакции, так как эти высвобождающие шесть электронов принимаются атомом хлора трех Ca(ClO)2 и изменяют свою степень окисления с (+1) на (-1), поэтому Ca(ClO) 2 действует здесь как окислитель, принимая электроны от Cr(III).
cr2o3+koh+o2В реакции образуются хромат калия (K2CrO4) и вода (h3O) при уравновешивании как реагента, так и продукта, получаем, 3 O2 (г) + 2 Cr2O3 (т) + 8 КОН (водн.) = 4 K2CrO4 (водн.) + 4 ч3О (л).
В процессе окисления, когда добавляется кислород или переносится электрон от атома, Cr2O3 действует как восстановитель, поскольку хром увеличивает свою степень окисления с (+3) до (+6) за счет переноса электронов, когда Cr2O3 переносится на K2CrO4.
В процессе восстановления, когда добавляется водород или атом принимает электроны, O2 действует как окислитель, поскольку кислород снижает свою степень окисления с нуля (0) до (-2), принимая электроны, когда 3 молекулы кислорода образуют 4 молекулы воды (h3O) .
реакция O2 с Cr2O3 + KOH cr2o3+koh+h3o2В реакции образуются хромат калия (K2CrO4) и вода (h3O), где уравновешивая реагент и продукт, получаем, 3 h3O2 ( водн.) + Cr2O3 (тв) + 4 KOH (водн.) = 2 K2CrO4 (водн.) + 5h3O (ж.).
В процессе окисления, когда к атому добавляется кислород, Cr2O3 действует как восстановитель, поскольку хром увеличивает свою степень окисления с (+3) до (+6) за счет переноса электронов при переходе Cr2O3 в K2CrO4, где реакция восстановления также происходит одновременно .
В процессе восстановления, когда водород добавляется к атому или кислород удаляется из атома, h3O2 действует как окислитель, поскольку кислород снижает свою степень окисления с (-1) до (-2), принимая электроны, когда молекулы перекиси водорода образуют воду (h3O) молекул.
В реакции образуется комплексное соединение K4[Fe(CN)6], хромат калия (K2CrO4) и вода (h3O), где уравновешивается реакции получаем, 6 K3[Fe(CN)6] (водн.) + Cr2O3 (тв) + 10 KOH (водн.) = 6 K4[Fe(CN)6] (водн.) + 2 K2CrO4 (водн.) + 5 h3O ( л).
Если мы проверим степени окисления хрома (Cr) и железа (Fe), мы обнаружим, что они меняются от стороны реагента к стороне продукта, поскольку Cr2O3 производит K2CrO4, где степень окисления хрома (Cr) увеличивается с (+3) к (+6), поскольку Cr(+3) высвобождает еще три электрона.
So Cr2O3 является восстановителем в реакции, поскольку эти высвобождающие шесть электронов принимаются шестью Fe (III) комплексного соединения и изменяют свою степень окисления с (+3) на (+2), поэтому K3[Fe(CN )6] действует здесь как окислитель, принимая электрон.
реакция K3[Fe(CN)6] с Cr2O3 + KOH kclo4+cr2o3+koh В реакции образуются хромат калия (K2CrO4), хлорид калия (KCl) и вода (h3O), где уравновешивая реакцию получаем, 3 KClO4 (водн. ) + 4 Cr2O3 (тв) + 16 KOH (водн.) = 3 KCl (водн.) + 8 K2CrO4 (водн.) + 8 h3O (ж).
) + 4 Cr2O3 (тв) + 16 KOH (водн.) = 3 KCl (водн.) + 8 K2CrO4 (водн.) + 8 h3O (ж).
Если мы проверим степени окисления на стороне реагента по сравнению со стороной продукта хрома (Cr) и хлора (Cl), мы обнаружим, что они меняются, поскольку 4 Cr2O3 переходит в 8 K2CrO4, где степень окисления Cr увеличивается с (+3) к (+6), так как два Cr(+3) высвобождают шесть электронов.
Таким образом, Cr2O3 является восстановителем в реакции, так как они высвобождают шесть электронов, которые переходят на орбиталь хлора KClO4 и изменяют свою степень окисления с (+7) на (-1), образуя молекулу KCl, поэтому KClO4 действует как окислитель агент здесь.
kclo+cr2o3+kohВ окислительно-восстановительной реакции образуются хромат калия (K2CrO4), хлорид калия (KCl) и вода (h3O), где уравновешивая обе стороны реакции получаем, 3 KClO (л) + Cr2O3 (т) + 4 KOH (водн.) = 3 KCl (водн.) + 2 K2CrO4 (водн.) + 2 h3O (ж.).
Если мы проверим степени окисления хрома (Cr) и хлора (Cl), мы обнаружим, что они меняются со стороны реагента на сторону продукта, поскольку оксид хрома (III) переходит в K2CrO4, где степень окисления хрома увеличивается с (+ 3) в (+6), так как два Cr(+3) высвобождают шесть электронов.
Таким образом, Cr2O3 действует как восстановитель в реакции, так как эти высвобождающие шесть электронов принимаются хлором трех KClO3 и изменяют свою степень окисления с (+1) на (-1), поэтому KClO действует здесь как окислитель, принимая электроны.
nai+cr2o3+kohПосле реакции с NaI и KOH образуются KI и NaOH. KI может реагировать с Cr2O3 в кислой среде, как h3SO4, но реакция не наблюдается в щелочной среде, такой как NaOH.
kcl+cr2o3+kohРеакция Cr2O3 наблюдается с хлоратом калия или перхлоратом калия, но не наблюдается с хлоридом калия.
cr2o3+nano3+kohВ реакции образуются нитрит натрия (NaNO2), хромат калия (K2CrO4) и вода (h3O), уравновешивая реакцию получаем, 3 NaNO3 (водн.) + Cr2O3 (тв. ) + 4 KOH (водн.) = 3 NaNO2 (водн.) + 2 K2CrO4 (водн.) + 2 h3O (ж.).
В окислительно-восстановительной реакции реакция восстановления происходит, когда NaNO3 превращается в NaNO2, при этом степень окисления атома азота меняется с (+5) на (+3) за счет принятия всего 6 электронов на три атома азота, поэтому NaNO3 окислитель.
Одновременно процесс окисления также протекает с реакцией восстановления, в которой Cr2O3 переходит в K2CrO4, в которой степень окисления хрома увеличивается с (+3) до (+6), так как два Cr(+3) высвобождают шесть электронов (по три на каждый), поэтому Cr2O3 является восстановителем.
cr2o3+br2+kohВ реакции образуются бромид калия (KBr), хромат калия (K2CrO4) и вода (h3O), что является окислительно-восстановительной реакцией, при которой окисление и восстановление компонентов реагентов образуются одновременно.
Уравновешивая обе стороны реакции, получаем Cr2O3 (т) + 3 Br2 (водн.) + 10 KOH (водн.) = 6 KBr (водн.) + 2 K2CrO4 (водн.) + 5 h3O (л), где ( s) указывает на твердую молекулу, (aq) указывает на то, что компонент находится в водной среде, а (l) показывает, что компонент находится в жидком состоянии.
В реакции степень окисления Br (окислителя) изменяется от 0 до (-1), поэтому образование Br2 в KBr является восстановительным процессом, где изменение степени окисления Cr с (+3) до (+4) означает, что он переходит еще один электрон, который является реакцией окисления, Cr2O3 является восстановителем.
Из изучения вышеприведенных реакций мы можем сказать, что Cr2O3 является хорошим восстановителем, может отдавать электроны и проявлять множество степеней окисления хрома (Cr), что возможно, поскольку Cr имеет d-орбиталь.
Хромат калия (K₂CrO₄) – Введение, структура, свойства, применение и часто задаваемые вопросы
Введение в хромат калия
Хромат калия можно описать как неорганическое соединение, имеющее химическую формулу K2CrO4. Хромат калия представляет собой желтое кристаллическое твердое вещество, растворимое в воде. Главной опасностью является экологическая опасность, при которой принимаются немедленные меры по ее распространению; ограничение на настройку должно быть принято. В химическом анализе он используется в качестве фунгицида, делая пигменты для чернил и красок и создавая другие соединения хрома.
Хромат калия – это вещество, которое является признанной причиной возникновения рака у человека. Это также связано с повышенной опасностью развития рака придаточных пазух носа и рака легких.
Это также связано с повышенной опасностью развития рака придаточных пазух носа и рака легких.
Что такое хромат калия?
Хромат калия можно определить как неорганическое соединение, имеющее химическую формулу K2CrO4. Его также можно назвать либо двукалиевым хроматом, либо двукалиевым монохроматом. Он выглядит как кристаллическое твердое вещество желтого цвета. На вкус горький и не имеет запаха. Когда это соединение нагревается, оно выделяет токсичные пары хрома. Он также подвергается разложению при нагревании и выделяет токсичные пары оксида калия.
Когда это неорганическое соединение вступает в контакт, оно может воздействовать на наш нос, легкие, горло, вызывая бронхит, изъязвления, одышку, пневмонию и астму. Это также может повлиять на нашу печень, почки, желудочно-кишечный тракт, в том числе на иммунную систему. Он удерживает ионы хромата и калия в соотношении 1:2. Его можно широко использовать в качестве лабораторного химиката, и он является сильным окислителем. Он также очень агрессивен. Химическое название K2CrO4 – хромат калия.
Он также очень агрессивен. Химическое название K2CrO4 – хромат калия.
Структура хромата калия – K2CrO4
Хромат калия содержит 1 анион хромата (ион CrO42-) и 2 положительно заряженных катиона калия (ионы K+). Анион хромата состоит из 1 атома хрома и 4 атомов кислорода. В многоатомном ионе центральный атом хрома дважды связан с 2 атомами кислорода и одинарно связан с 2 атомами кислорода, тогда как одинарно связанные атомы кислорода имеют заряд -1 (это позволяет им получить полные конфигурации октетов).
[Изображение будет загружено в ближайшее время]
Некоторые важные свойства хромата калия представлены в таблице ниже.
Properties of Potassium Chromate K2CrO4
IUPAC Name or K2CrO4 chemical name | Potassium chromate |
Chemical Formula | K2CrO4 |
Molecular Weight или Молярная масса | 194,1896 г/моль |
Температура кипения | 1000°C |
Melting Point | 968°C |
Density | 2. |
K2CrO4 Compound Name | Potassium Chromate |
Некоторые другие важные свойства соединений хромата калия перечислены ниже.
Это соединение выглядит как порошок желтого цвета без запаха.
При температуре 20⁰C в воде растворимость этого соединения составляет 629 граммов на литр.
При повышении температуры до 100⁰C растворимость хромата калия в воде увеличивается до 792 граммов на литр.
K2CrO4 также кристаллизуется в ромбической решетке.
Хромат калия получают путем обработки дихромата калия, включая гидроксид калия. И наиболее распространенная степень окисления хрома составляет +2, +3, +6, а электронная конфигурация хрома указана как 3d54s1 с атомным номером 24. Соединение хромата калия является сильным окислителем и чрезвычайно агрессивно. Этот материал можно использовать в производстве красителей и в процедурах окрашивания текстиля. Химическая формула хромата калия: K2CrO4.
Соединение хромата калия является сильным окислителем и чрезвычайно агрессивно. Этот материал можно использовать в производстве красителей и в процедурах окрашивания текстиля. Химическая формула хромата калия: K2CrO4.
Применение K2CrO4 (хромат калия)
Важные применения хромата калия перечислены ниже.
Может использоваться в качественном неорганическом анализе при обнаружении ионов в водном растворе.
Мы можем использовать его в качестве окислителя в процессе органического синтеза.
Может использоваться в производстве красителей.
Мы можем использовать его в процессе окрашивания текстиля.
Он также используется в качестве индикатора при титровании осадков.

Может использоваться для изготовления пигментов и чернил для красок.
Это соединение можно использовать для получения многих других соединений хрома.
Также используется как фунгицид.
Может использоваться в процессе выщелачивания.
Опасность для здоровья от K2CrO4
Индикатор хромата калия
Хромат калия можно описать как индикатор металлохрома. Количественная оценка ионов: хлорида, бромида и цианида путем титрования стандартным раствором азотнокислого серебра с несколькими миллилитрами хромата калия в качестве индикатора составляет основу метода Мора. Кроме того, желтый раствор хромата калия в точке эквивалентности превращается в кирпично-красный осадок хромата серебра.
При использовании в качестве индикатора соединения хромата калия после погашения иона хлорида ионы серебра реагируют с ионами хромата, произведение растворимости хромата серебра превышается, и он начинает образовывать осадок красновато-коричневого цвета.
При осадительном титровании отбирают известный объем раствора галоида в коническую колбу, куда добавляют 1-2 мл индикатора хромата калия и титруют стандартным раствором азотнокислого серебра, который набирают в бюретку. Затем индикатор дает красный осадок хромата серебра в конечной точке при добавлении избытка капель нитрата серебра.
Пищевые продукты, содержащие натуральный карбонат калия
Карбонат калия, который можно использовать для размягчения, выпечки, буферизации, дается как синтетический. Это соединение более полезно и может быть использовано для общего самочувствия. Он также синтетический и доступен в виде добавок. Тем не менее, есть много источников пищи, богатых карбонатом калия, таких как печеная картофельная кожура, бананы, семена подсолнечника и миндаль.
Что произойдет, если карбонат калия сильно нагреть?
Соединение карбоната калия плавится при 891°С. Он дает обозначение «d» для его температуры кипения, что означает разложение, но нет никаких данных о конкретной температуре. Продуктом его разложения будет диоксид углерода, в том числе форма оксида калия (K2O3, K2O и др.), где более стабильной формой оксида калия является K2O3. Это единственное соединение, которое не разлагается при нагревании.
Поскольку при разложении образуется калий, который не является оксидом, металлический калий не остается дольше в неизменном виде на воздухе. Обычно его хранят в минеральном масле, чтобы защитить его от кислорода и воды. В воздухе, который содержит влагу, калий имеет тенденцию превращаться в гидроксид или оксид.
Разница между хроматом калия и дихроматом калия
Основное различие между хроматом калия и дихроматом калия заключается в том, что хромат калия имеет желтый цвет, тогда как дихромат калия имеет оранжевый цвет .
Хромат калия и дихромат калия являются близкородственными неорганическими соединениями, имеющими аналогичную химическую структуру. Ион дихромата в дихромате калия состоит из комбинации двух ионов хромата.
СОДЕРЖАНИЕ
1. Обзор и ключевые различия
2. Что такое хромат калия
3. Что такое дихромат калия
4. Сходства между хроматом калия и дихроматом калия
5. Сид и хромат калия в сравнении друг с другом – сравнение хромата калия Форма
6. Резюме
Что такое хромат калия?
Хромат калия представляет собой неорганическое соединение, имеющее химическую формулу K2CrO4. Он имеет желтый цвет и существует в твердом состоянии при комнатной температуре. Это калиевая соль хромат-аниона. Это обычное химическое вещество в лаборатории.
Рисунок 01: Хромат калия
Существуют две кристаллические формы хромата калия: орторомбическая структура и тетраэдрическая структура. Среди них орторомбическая бета-структура является наиболее распространенной формой, которая может превращаться в альфа-форму при высоких температурах.
Мы можем легко получить хромат калия, обработав дихромат калия гидроксидом калия. Другой способ производства – сплавление гидроксида калия с оксидом хрома.
В природе хромат калия встречается в минеральной форме «тарапакайт». Этот минерал встречается как редкое вещество на Земле.
Хромат калия считается канцерогенным веществом. Это характерно для большинства известных соединений хрома, где хром находится в степени окисления +6. Кроме того, это соединение вызывает коррозию и может вызвать повреждение или слепоту глаз при контакте.
Что такое дихромат калия?
Дихромат калия представляет собой неорганическое соединение, имеющее химическую формулу K 2 Cr 2 O 7 . Он имеет яркий красно-оранжевый цвет. Кроме того, дихромат калия является окислителем. Поэтому существует множество применений этого соединения. Однако, как и многие другие соединения хрома, дихромат калия очень вреден для нашего здоровья.
Рисунок 02: Дихромат калия
Что касается производства дихромата калия, то существует два способа производства этого вещества. Один из методов заключается в реакции между хлоридом калия и дихроматом натрия. Второй метод заключается в обжиге хромовой руды с гидроксидом калия.
Один из методов заключается в реакции между хлоридом калия и дихроматом натрия. Второй метод заключается в обжиге хромовой руды с гидроксидом калия.
Кроме того, дихромат калия хорошо растворяется в воде, а при растворении подвергается ионизации. При рассмотрении приложений он используется в качестве прекурсора для калий-хромовых квасцов (химическое вещество, используемое в кожевенной промышленности). Кроме того, он также используется для очистки, в строительстве, в фотографии и т. д.
Каковы сходства между хроматом калия и дихроматом калия?
- Хромат калия и дихромат калия являются ионными соединениями.
- Оба являются солями калия.
- Эти соединения содержат хроматную химическую группу.
- Оба вещества в основном важны для качественного и количественного анализа образцов с помощью окислительно-восстановительных реакций или титрования.
В чем разница между хроматом калия и дихроматом калия?
Хромат калия представляет собой неорганическое соединение, имеющее химическую формулу K2CrO4, тогда как дихромат калия представляет собой неорганическое соединение, имеющее химическую формулу K 2 Cr 2 O 7 . Ион дихромата в дихромате калия состоит из комбинации двух ионов хромата. Основное различие между хроматом калия и дихроматом калия заключается в том, что хромат калия имеет желтый цвет, а дихромат калия — оранжевый. Кроме того, хромат калия создается путем обработки дихромата калия гидроксидом калия, а дихромат калия создается в результате реакции между хлоридом калия и дихроматом натрия. Итак, это еще одно различие между хроматом калия и дихроматом калия.
Ион дихромата в дихромате калия состоит из комбинации двух ионов хромата. Основное различие между хроматом калия и дихроматом калия заключается в том, что хромат калия имеет желтый цвет, а дихромат калия — оранжевый. Кроме того, хромат калия создается путем обработки дихромата калия гидроксидом калия, а дихромат калия создается в результате реакции между хлоридом калия и дихроматом натрия. Итак, это еще одно различие между хроматом калия и дихроматом калия.
Кроме того, хромат калия используется для лабораторных работ, в качестве окислителя, в качественном анализе неорганических веществ, в качестве индикатора при титровании осадков и т. д., тогда как дихромат калия используется в качестве прекурсора для калий-хромовых квасцов (химическое вещество, используемое в кожевенном производстве). промышленности), в целях очистки, в строительстве, в фотографии и т. д.
Ниже в табличной форме представлена сводка различий между хроматом калия и дихроматом калия.
Резюме – Хромат калия и дихромат калия
Хромат калия и дихромат калия являются близкородственными неорганическими соединениями, имеющими сходную химическую структуру. Основное различие между хроматом калия и дихроматом калия заключается в том, что хромат калия имеет желтый цвет, а дихромат калия — оранжевый.
Основное различие между хроматом калия и дихроматом калия заключается в том, что хромат калия имеет желтый цвет, а дихромат калия — оранжевый.
Артикул:
1. «Хромат калия». Википедия , Фонд Викимедиа, 29 марта 2021 г., доступно здесь.
Изображение предоставлено:
1. «Образец-хромата калия» Benjah-bmm27 — собственная работа (общественное достояние) через Commons Wikimedia
2. «Образец-дихромата калия» Benjah-bmm27 — собственная работа (общественное достояние) ) via Commons Wikimedia
T3DB: Potassium chromate
| Record Information | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Version | 2.0 | |||||||||||||||||||||||||||||||||||||||||||||||
| Creation Date | 2009-03-26 20:31:52 UTC | |||||||||||||||||||||||||||||||||||||||||||||||
| Update Date | 2014-12-24 20:22:36 UTC | |||||||||||||||||||||||||||||||||||||||||||||||
| Accession Number | T3D0705 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identification | ||||||||||||||||||||||||||||||||||||||||||||||||
| Common Name | Potassium chromate | |||||||||||||||||||||||||||||||||||||||||||||||
| Class | Small Molecule | |||||||||||||||||||||||||||||||||||||||||||||||
| Описание | Хромат калия представляет собой химическое соединение калия и шестивалентного хрома. Он встречается в природе в виде минерала тарапакайт и используется в качестве химического индикатора ионов хлора. Шестивалентный хром относится к химическим соединениям, содержащим элемент хром в степени окисления +6. Хром (VI) более токсичен, чем другие степени окисления атома хрома, из-за его большей способности проникать в клетки и более высокого окислительно-восстановительного потенциала. (7, 8) Он встречается в природе в виде минерала тарапакайт и используется в качестве химического индикатора ионов хлора. Шестивалентный хром относится к химическим соединениям, содержащим элемент хром в степени окисления +6. Хром (VI) более токсичен, чем другие степени окисления атома хрома, из-за его большей способности проникать в клетки и более высокого окислительно-восстановительного потенциала. (7, 8) | |||||||||||||||||||||||||||||||||||||||||||||||
| Тип соединения |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Structure | ||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyms |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | CrK 2 O 4 | |||||||||||||||||||||||||||||||||||||||||||||||
| Средняя молекулярная масса | 194. 190 g/mol 190 g/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Monoisotopic Mass | 193.848 g/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| CAS Registry Number | 7789-00-6 | |||||||||||||||||||||||||||||||||||||||||||||||
| IUPAC Name | dioxo-2,4-dioxa-3- хрома-1,5-дипотасапентан | |||||||||||||||||||||||||||||||||||||||||||||||
| Традиционное название | диоксо-2,4-диокса-3-хрома-1,5-дипотасапентан | |||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | [K]O[Cr]=(K]O[Cr]=(K)O[Cr]= (=O)O[K] | |||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор ИнЧИ | ИнЧИ=1S/Cr.2K.4O | |||||||||||||||||||||||||||||||||||||||||||||||
| Код ИнЧИ | ИнЧИКей=FICHTBNFNNLKNB-UHFFFAOYSA-N | |||||||||||||||||||||||||||||||||||||||||||||||
| Химическая таксономия | ||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | относится к классу различных нехроматических соединений. Это неорганические соединения, в которых наибольшим металлическим оксоанионом является хромат, с которым либо не связан атом, либо атом неметалла. | |||||||||||||||||||||||||||||||||||||||||||||||
| Королевство | Неорганические соединения | |||||||||||||||||||||||||||||||||||||||||||||||
| Суперкласс | Mixed metal/non-metal compounds | |||||||||||||||||||||||||||||||||||||||||||||||
| Class | Miscellaneous mixed metal/non-metals | |||||||||||||||||||||||||||||||||||||||||||||||
| Sub Class | Miscellaneous metallic oxoanionic compounds | |||||||||||||||||||||||||||||||||||||||||||||||
| Direct Parent | Miscellaneous chromates | |||||||||||||||||||||||||||||||||||||||||||||||
| Alternative Родители |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Molecular Framework | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| External Descriptors | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| Biological Properties | ||||||||||||||||||||||||||||||||||||||||||||||||
| Status | Detected and Not Quantified | |||||||||||||||||||||||||||||||||||||||||||||||
| Origin | Exogenous | |||||||||||||||||||||||||||||||||||||||||||||||
| Расположение клеток |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Biofluid Locations | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| Tissue Locations | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| Pathways | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| Applications | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| Biological Roles |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Химические роли |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Состояние | 955555512 | |||||||||||||||||||||||||||||||||||||||||||||||
. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Экспериментальные свойства |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Predicted Properties |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | ||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Toxicity Profile | ||||||||||||||||||||||||||||||||||||||||||||||||
| Route of Exposure | Inhalation (7) ; оральный (7) ; кожный (7) | |||||||||||||||||||||||||||||||||||||||||||||||
| Механизм токсичности | Канцерогенное действие шестивалентного хрома обусловлено его метаболитами, пятивалентным и трехвалентным хромом. Повреждение ДНК может быть вызвано гидроксильными радикалами, образующимися при реокислении пятивалентного хрома присутствующими в клетке молекулами перекиси водорода. Трехвалентный хром также может образовывать комплексы с пептидами, белками и ДНК, что приводит к поперечным связям ДНК-белков, разрывам нитей ДНК, межцепочечным поперечным связям ДНК-ДНК, аддуктам хром-ДНК, хромосомным аберрациям и изменениям в клеточных сигнальных путях. Было показано, что он вызывает канцерогенез за счет чрезмерной стимуляции клеточных регуляторных путей и повышения уровня перекиси путем активации определенных митоген-активируемых протеинкиназ. Он также может вызывать репрессию транскрипции за счет перекрестного связывания комплексов гистондеацетилазы 1-ДНК-метилтрансферазы 1 с хроматином промотора CYP1A1, ингибируя модификацию гистонов. Хром может повышать собственную токсичность, модифицируя фактор транскрипции 1, регулирующий металл, вызывая ингибирование транскрипции металлотионеина, индуцированной цинком. Повреждение ДНК может быть вызвано гидроксильными радикалами, образующимися при реокислении пятивалентного хрома присутствующими в клетке молекулами перекиси водорода. Трехвалентный хром также может образовывать комплексы с пептидами, белками и ДНК, что приводит к поперечным связям ДНК-белков, разрывам нитей ДНК, межцепочечным поперечным связям ДНК-ДНК, аддуктам хром-ДНК, хромосомным аберрациям и изменениям в клеточных сигнальных путях. Было показано, что он вызывает канцерогенез за счет чрезмерной стимуляции клеточных регуляторных путей и повышения уровня перекиси путем активации определенных митоген-активируемых протеинкиназ. Он также может вызывать репрессию транскрипции за счет перекрестного связывания комплексов гистондеацетилазы 1-ДНК-метилтрансферазы 1 с хроматином промотора CYP1A1, ингибируя модификацию гистонов. Хром может повышать собственную токсичность, модифицируя фактор транскрипции 1, регулирующий металл, вызывая ингибирование транскрипции металлотионеина, индуцированной цинком. (1, 7, 2, 3, 4) (1, 7, 2, 3, 4) | |||||||||||||||||||||||||||||||||||||||||||||||
| Метаболизм | Хром всасывается при пероральном, ингаляционном или кожном воздействии и распространяется почти во все ткани, при этом самые высокие концентрации обнаруживаются в почках и печени. Кость также является основным местом хранения и может способствовать долгосрочному удержанию. Сходство шестивалентного хрома с сульфатом и хроматом позволяет ему транспортироваться в клетки с помощью механизмов транспорта сульфата. Внутри клетки шестивалентный хром восстанавливается сначала до пятивалентного, а затем до трехвалентного хрома многими веществами, включая аскорбат, глутатион и никотинамидадениндинуклеотид. Хром практически полностью выводится с мочой. (1, 7) | |||||||||||||||||||||||||||||||||||||||||||||||
| Значения токсичности | LD50: 180 мг/кг (перорально, крыса) (6) LD50: 32 мг/кг (внутрибрюшинно, мышь) (6) LD50: 11 мг/кг (внутримышечно, кролик) (6) | |||||||||||||||||||||||||||||||||||||||||||||||
| Смертельная доза | От 1 до 3 граммов для взрослого человека (шестивалентный хром). (5) (5) | |||||||||||||||||||||||||||||||||||||||||||||||
| Канцерогенность (классификация IARC) | 1, канцероген для человека. (10) | |||||||||||||||||||||||||||||||||||||||||||||||
| Использование/Источники | Хромат калия используется в качестве химического индикатора ионов хлора. (8) | |||||||||||||||||||||||||||||||||||||||||||||||
| Минимальный уровень риска | Средний Пероральный: 0,005 мг/кг/день (9) Хроническая пероральная доза: 0,001 мг/кг/день (9) | |||||||||||||||||||||||||||||||||||||||||||||||
| Воздействие на здоровье | Шестивалентный хром является известным канцерогеном. Хроническое вдыхание особенно связано с раком легких. Также известно, что шестивалентный хром вызывает дефекты репродуктивной функции и развития. (1) | |||||||||||||||||||||||||||||||||||||||||||||||
| Симптомы | Вдыхание шестивалентного хрома может вызвать раздражение слизистой оболочки носа, язвы в носу, насморк и проблемы с дыханием, такие как астма, кашель, одышка или свистящее дыхание. Проглатывание шестивалентного хрома вызывает раздражение и язвы в желудке и тонкой кишке, а также анемию. Контакт с кожей может вызвать кожные язвы. (7) (7) | |||||||||||||||||||||||||||||||||||||||||||||||
| Лечение | Противоядие от отравления хромом неизвестно. Воздействие обычно лечится симптоматическим лечением. (7) | |||||||||||||||||||||||||||||||||||||||||||||||
| Normal Concentrations | ||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| Abnormal Concentrations | ||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| External Links | ||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank ID | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| HMDB ID | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| PubChem Compound ID | 24597 | |||||||||||||||||||||||||||||||||||||||||||||||
| ChEMBL ID | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| ChemSpider ID | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| KEGG ID | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| UniProt ID | Нет в наличии | |||||||||||||||||||||||||||||||||||||||||||||||
| OMIM ID | ||||||||||||||||||||||||||||||||||||||||||||||||
| ЧЭБИ ID | Нет в наличии | |||||||||||||||||||||||||||||||||||||||||||||||
| BioCyc ID | 5 Нет в наличии0258||||||||||||||||||||||||||||||||||||||||||||||||
| CTD ID | C027373 | |||||||||||||||||||||||||||||||||||||||||||||||
| Stitch ID | Potassium chromate | |||||||||||||||||||||||||||||||||||||||||||||||
| PDB ID | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| ACToR ID | 12212 | |||||||||||||||||||||||||||||||||||||||||||||||
| Wikipedia Link | Not Available | |||||||||||||||||||||||||||||||||||||||||||||||
| Ссылки | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылка на синтез | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||
| MSDS | T3D0705. pdf pdf | |||||||||||||||||||||||||||||||||||||||||||||||
| General References |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Генная регуляция | ||||||||||||||||||||||||||||||||||||||||||||||||
| Гены с повышающей регуляцией | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||
| Гены с понижающей регуляцией | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||
Сколько всего атомов содержится в K2CrO4? – Easyerwithpractice.
 com
comСколько всего атомов содержится в K2CrO4?
Процентный состав по элементам
| Элемент | Символ | Количество атомов |
|---|---|---|
| Хром | Кр | 1 |
| Кислород | О | 4 |
| Калий | К | 2 |
Что такое атомарность K2CrO4?
Ответ: В случае k2Cr2O7 имеется 2 атома калия(K), атомы хрома(Cr) и 7 атомов кислорода (O). Таким образом, атомность k2Cr2O7 равна 11.
Сколько молекул содержится в 1 г K2CrO4?
Ответ: 194.1903. Мы предполагаем, что вы конвертируете между граммами K2CrO4 и молями. Вы можете просмотреть более подробную информацию о каждой единице измерения: молекулярная масса K2CrO4 или моль. Это соединение также известно как хромат калия.
Какова относительная формула массы K2CrO4?
Хромат калия
| Наименования | |
|---|---|
| Химическая формула | К 2CrO 4 |
| Молярная масса | 194,189 г·моль−1 |
| Внешний вид | Желтый порошок |
| Запах | без запаха |
Почему K2CrO4 желтый?
При добавлении гидроксида натрия к раствору хромата калия оранжевый цвет снова становится желтым.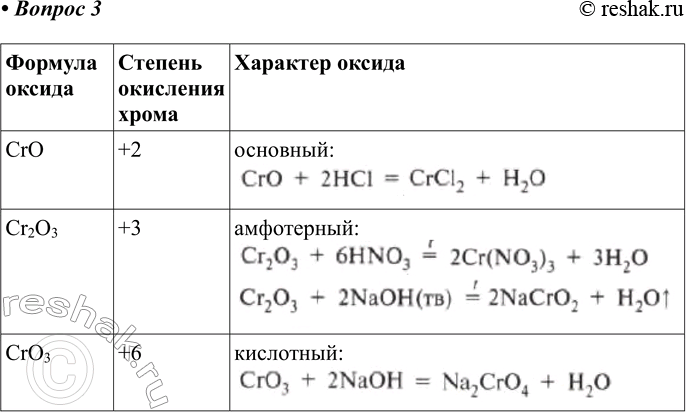 Гидроксид натрия реагирует с ионами водорода, удаляя их из раствора.
Гидроксид натрия реагирует с ионами водорода, удаляя их из раствора.
Какого цвета CrO4 2?
желтый
Является ли cr3+ цветом?
Что касается реакций окисления между хроматом и Cr (III), он образует в растворе зеленый цвет, но когда я искал в Интернете в разных источниках, мне кажется, что на самом деле он фиолетовый.
Какого цвета Zn?
В естественном состоянии цинк представляет собой голубовато-серый металл. В технически чистом виде цинк доступен в виде листов различных размеров, отливок и экструзии с малым поперечным сечением. Поверхность мельницы яркая, ребристая. Имеет серебристый цвет.
Какого цвета Ni 2+?
Цвет. Большинство обычных солей никеля имеют зеленый цвет из-за присутствия иона гексаакваникеля (II), Ni(h3O)62+.
Какого цвета хром?
| Хром | |
|---|---|
| Внешний вид | серебристый металлик |
Стандартный атомный вес Ar, станд. (Cr) (Cr) | 51.9961(6) |
| Хром в периодической таблице | |
Обнаружен ли хром в организме человека?
Хром — важный минерал, который не вырабатывается организмом. Он должен быть получен из рациона.
Почему хром окрашен?
Это изменение цвета связано с образованием хромата калия K2CrO4, в котором хром находится в степени окисления VI. В настоящее время известно, что соединения хрома (VI) токсичны и могут вызывать рак, но ранее они были популярны в таких пигментах, как PbCrO4 и Pb2OCrO4 (желтый хром и красный хром соответственно).
Где в мире встречается хром?
Хром содержится главным образом в хромите. Эта руда находится во многих местах, включая Южную Африку, Индию, Казахстан и Турцию. Металлический хром обычно получают восстановлением хромита углеродом в электродуговой печи или восстановлением оксида хрома (III) алюминием или кремнием.
Какой хром токсичен?
Трехвалентный хром или хром (III) представляет собой форму хрома, необходимую для здоровья человека. Шестивалентный хром, или хром (VI), является однозначно токсичной формой.
Шестивалентный хром, или хром (VI), является однозначно токсичной формой.
Кто нашел хром?
Луи Николя Воклен
Из чего сделан хром?
В настоящее время хром в основном получают путем нагревания минерального хромита (FeCr2O4) в присутствии алюминия или кремния. Хром — это бело-голубой металл, твердый, хрупкий и очень устойчивый к коррозии.
Является ли хром твердой жидкостью или газом?
Этот элемент является твердым. Хром классифицируется как «переходный металл», который находится в группах 3-12 периодической таблицы.
Для чего в быту используется хром?
Хром — это элемент, который имеет множество применений. Из-за высокой температуры плавления хром используется для изготовления форм для кирпича. Он также используется во многих красках и красках, и когда его наносят поверх других металлов, чтобы придать им блеск, его часто называют просто хромом.
Каковы преимущества приема хрома?
Пиколинат хрома представляет собой форму хрома, обычно встречающуюся в пищевых добавках.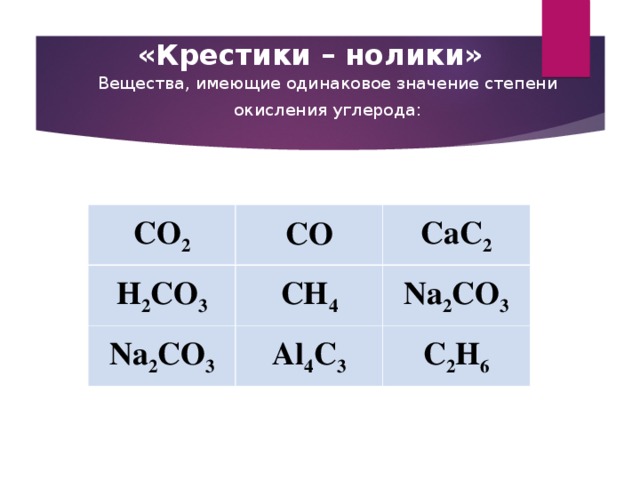 Это может быть эффективно для улучшения реакции организма на инсулин или снижения уровня сахара в крови у людей с диабетом. Более того, это может помочь уменьшить голод, тягу и переедание.
Это может быть эффективно для улучшения реакции организма на инсулин или снижения уровня сахара в крови у людей с диабетом. Более того, это может помочь уменьшить голод, тягу и переедание.
В чем уникальность Chromium?
Хром — блестящий, хрупкий, твердый металл. Его цвет серебристо-серый, и он хорошо полируется. На воздухе не тускнеет, при нагревании загорается и образует зеленый оксид хрома. Хром нестабилен в кислороде, он сразу образует тонкий оксидный слой, непроницаемый для кислорода и защищающий металл под ним.
Почему хром остается блестящим?
При контакте с воздухом на поверхности образуется тонкий слой оксида хрома, который защищает металл от дальнейшей реакции с воздухом. Хром можно полировать, чтобы получить блестящую зеркальную поверхность, устойчивую к коррозии. Хром известен своими многочисленными красочными соединениями.
Какой самый прочный металл в мире?
Пять самых прочных металлов
- Осмий.


 7320 g/cm³
7320 g/cm³
 74 ų
74 ų 1999;37(2):173-94. [10382554]
1999;37(2):173-94. [10382554]