Определите степень окисления каждого элемента: Fe2O3; FeO… -reshimne.ru
Новые вопросы
Ответы
Похожие вопросы
Ядро атома Нe состоит из:1) трех протонов, 3) двух протонов и одного электрона, 2) двух протонов и одного нейтрона, 4) трех нейтронов и одного протона.
…
Вкажіть групу речовин, які реагують з натрій гідроксидом
а)HNO3, CO2,SO3
б)SO2, K2O, HCI
в) MgO, СO2, h3SO4
г)Al2O3, K2O, HNO3
д)SiO2,h3O,KCI…
Напишите формулу получения пентапептида…
Хелп,хелп,хелп,являются ли гомологами 2-метилпропен и 2-метипентен-1 ?????????????????????????????????????????????????????????????????????????????????????????????.
Найдите массу воды и соли, необходимых для приготовления 250г 20%-ного раствора….
HELLLLPPPP!!!!!!!!!!…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
ЭкономикаМузыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Ответы на итоговую контрольную работу по теме «Неметаллы»(Габриелян) решебник
Вариант 1.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Символ элемента, образующего простое вещество — неметалл:
А. Вг.
2. Распределение электронов по энергетическим уровням в ионе серы S2-:
А. 2е, 8е, 8е.
3. Формулы высшего оксида и летучего водородного соединения элемента Э с распределением электронов по энергетическим уровням 2е, 5:
Б. Э205 и ЭН3.
4. Способность атомов принимать электроны увеличивается в ряду:
Б. Те—Se—S—О.
5. Коэффициент перед формулой вещества X в схеме превращения
Н2 + N2 -> X:
Б. 2.
6. Закономерность изменения неметаллических свойств атомов химических элементов в пределах периода с увеличением порядкового номера:
A. Увеличиваются.
7. Оксид углерода (IV) не взаимодействует с веществом, формула которого:
Б. S02.
8. Схеме превращения
Р -3 ► Р +5
соответствует химическое уравнение:
Г. Са3Р2 + 402 = Р205 + ЗСаО.
9. Простое вещество сера взаимодействует с каждым из веществ группы:
В. 02, Mg, Н2.
10. Ион СО3 -2 можно обнаружить с помощью раствора, содержащего:
Б. Катион водорода.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте формулы водородных соединений: хлора, серы, углерода. Выберите из них соединение с наиболее ярко выраженными кислотными свойствами.
HCl, h3S, Ch5
12. Дайте характеристику вещества с формулой Nh4 по следующему плану:
1) качественный состав;
2) количественный состав;
3) степень окисления каждого элемента;
4) относительная молекулярная и молярная массы;
5) массовая доля каждого элемента;
6) отношение масс элементов.
1. азот, водород
2. 1 атом азота и 3 атома водорода
3. азот -3, водород +1
4. Mr=17 и М=17г/моль
5. W(N)=14*1/17=0,8235=82,35%
W(H)=1-W(N)=1-0,8235=0,1765=17,65%
6. соотношение масса азот: водород = 14:3
13. Запишите химические формулы и названия веществ А и В в схеме превращений:
NO —> А —> В.
А- NO2 оксид азота 4,
B- HNO3 азотная кислота
14. По уравнению реакции N2 + 02 = 2N0 рассчитайте объемы исходных веществ для получения 1 моль газа оксида азота (II).
n(N2) = n(O2) = 0.5 моль(NO2) = 0.5 моль
V (N2) = V (O2) = 0.5*22.4= 11.2л
15. Запишите формулы и названия аллотропных модификаций кислорода.
кислород О2 и озон О3
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Символ элемента, образующего простое вещество — неметалл:
В. С.
2. Распределение электронов по энергетическим уровням в ионе хлора Сl-:
А. 2е, 8е, 8е.
3. Формулы высшего оксида и летучего водородного соединения элемента Э с распределением электронов по энергетическим уровням 2е, 6е:
В. Э03 и Н2Э.
4. Способность атомов принимать электроны уменьшается в ряду:
A. F—CI—Br—I.
5. Коэффициент перед формулой вещества X в схеме превращения
N2 + 02 -> X:
Б. 2.
2.
6. Закономерность изменения неметаллических свойств атомов химических элементов в пределах главной подгруппы с увеличением порядкового номера:
Б. Уменьшается.
7. Оксид серы (VI) не взаимодействует с веществом, формула которого:
А. С02.
8. Схеме превращения
N +2 -> N +4
соответствует химическое уравнение:
Г. 2NO + 02 = 2N02.
9. Сера взаимодействует с каждым из веществ группы:
В. 02, Н2, Си.
10. Ион SiO3 2- можно обнаружить с помощью раствора, содержащего катион:
Б. Водорода.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте формулы водородных соединений химических элементов-неметаллов: азота, иода, кислорода. Укажите соединение с наиболее ярко выраженными кислотными свойствами.
Nh4, HI, h3O
12. Составьте характеристику вещества, формула которого С02, по плану:
1) качественный состав;
2) количественный состав;
3) степень окисления каждого элемента;
4) относительная молекулярная и молярная массы;
5) массовая доля каждого элемента;
6) отношение масс элементов;
7) название.
1.углерод, кислород
2. 1 атом углерода, 2 атом кислорода
3. углерод +4, кислород -2
4. Mr=44 и М=44 г/моль
5. ω(с) = 12/44 *100%=27,3%. ω(о) = 32/44 *100%=72,7%
6.С: О = 12: 32 = 3:8
7. углекислый газ, оксид углерода 4.
13. Запишите химические формулы и названия веществ А и В в схеме превращений:
SO2 -> A -> B.
А – SO3 окид серы 6,
В – h3SO4 серная кислота
14. По уравнению реакции 2СО + 02 = 2С02
рассчитайте объемы исходных веществ (н. у.) для получения 1,5 моль газа оксида углерода (IV).
n(CO) = n(CO2) = 1,5 моль
V(CO) = 1,5*22,4 =33,6 л
n(O2) = 0,5 *n(CO2) = 0,75 моль
V(O2) = 0,75*22,4 = 16,8 л
15. Запишите названия аллотропных модификаций серы.
пластическая, ромбическая, моноклинная.
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Символ элемента, образующего простое вещество — неметалл:
Г. F.
2. Распределение электронов по энергетическим уровням в ионе азота N3-:
Г. 2е, 8е.
2е, 8е.
3. Формулы высшего оксида и летучего водородного соединения элемента Э с распределением электронов по энергетическим уровням 2е, 8е, 7е:
Г. Э207 и НЭ.
4. Способность атомов принимать электроны уменьшается в ряду:
A. F—О—N—С.
5. Коэффициент перед формулой вещества X в схеме превращения
Р + 02 -> X:
Б. 2.
6. Закономерность изменения электроотрицательности атомов химических элементов в пределах периода с увеличением порядкового номера:
A. Увеличивается.
7. Аммиак взаимодействует с веществом, формула которого:
А. НСl.
8. Схеме превращения
S -2 -> S +4
соответствует химическое уравнение:
Г. 2h3S + 302 = 2S02 + 2Н20.
9. Простое вещество азот взаимодействует с каждым из веществ группы:
В. Li, Н2, 02.
10. Ион можно обнаружить с помощью раствора, содержащего катион:
А. Бария.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте формулы водородных соединений химических элементов-неметаллов: фосфора, кислорода, брома. Укажите соединение с наиболее ярко выраженными кислотными свойствами.
Составьте формулы водородных соединений химических элементов-неметаллов: фосфора, кислорода, брома. Укажите соединение с наиболее ярко выраженными кислотными свойствами.
Ph4, h3O, HBr
12. Составьте характеристику вещества, формула которого СН4, по следующему плану:
1) качественный состав;
2) количественный состав;
3) степень окисления каждого элемента;
4) относительная молекулярная и молярная массы;
5) массовая доля каждого элемента;
6) отношение масс элементов.
1. углерод, водород
2. 1 атом углерода, 4 атома водорода
3. С-4, Н+1
4. Mr=16 и М=16 г/моль
5. W=n*Ar*100%/Mr
W(H)=4*1*100%/16=25%
W(С)=12*100/16=75%
6. С:Н = 12:4 = 3:1
13. Запишите химические формулы и названия веществ А и В в схеме превращений: P -> A -> B.
А – Р2О5 – оксид фосфора 5,
В – Н3РО4 – фосфорная кислота
14. По уравнению реакции
Н2 + Сl2 = 2НСl
рассчитайте объемы исходных веществ (н. у.), которые необходимы для получения 3 моль газа хлороводорода.
n(h3) = n(Cl2) = 0,5*m(HCl) = 1,5 моль
V(h3) = V(Cl2) = 1,5*22,4 = 33,6 л
15. Запишите названия аллотропных модификаций фосфора.
белый, красный и черный.
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Символ элемента, образующего простое вещество — неметалл:
В. О.
2. Распределение электронов по энергетическим уровням в ионе кислорода О2-:
Г. 2е, 8е.
3. Формулы высшего оксида и летучего водородного соединения элемента Э с распределением электронов по энергетическим уровням 2е, 4е:
А. Э02 и ЭН4.
4. Способность атомов принимать электроны увеличивается в ряду:
В. Si—Р—S—Сl.
5. Коэффициент перед формулой вещества X в схеме превращения S02 + 02 -> X:
Б. 2.
6. Закономерность изменения электроотрицательности атомов химических элементов в пределах главной подгруппы с увеличением порядкового номера:
Б. Уменьшается.
7. Оксид серы (IV) не взаимодействует с веществом, формула которого:
Оксид серы (IV) не взаимодействует с веществом, формула которого:
В. С02.
8. Схеме превращения С 0-> С +4 соответствует химическое уравнение:
Г. С + 2Н2 = СН4.
9. Простое вещество фосфор взаимодействует с каждым из веществ группы:
Б. 02, Сl2, Са.
10. Ион SO4 2-можно обнаружить с помощью раствора, содержащего катион:
А. Бария.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте формулы водородных соединений химических элементов-неметаллов: кремния, азота, серы. Укажите соединение с наиболее ярко выраженными кислотными свойствами.
Sih5, Nh4, h3S
12. Составьте характеристику вещества с формулой Н20 по следующему плану:
1) качественный состав;
2) количественный состав;
3) степень окисления каждого элемента;
4) относительная молекулярная и молярная массы;
5) массовая доля каждого элемента;
6) отношение масс элементов.
1.водород, кислород
2. один атом кислорода, два атома водорода
3. водород +1, кислород -2
водород +1, кислород -2
4. Mr=18 и М=18 г/моль
5. w ( H ) = 2 / 18 = 0,11 = 11%
w ( O ) = 16 / 18 = 0,89 = 89 %
6. О:Н = 16:2 = 8:1
13. Запишите химические формулы и названия веществ А и В в схеме превращений:
Cl2 -> A -> B.
HCl хлороводород, AgCl хлорид серебра (HNO2 азотистая кислота)
14 . По уравнению реакции N2 + ЗН2 2Nh4
рассчитайте объемы исходных веществ (н. у.), необходимые для получения 2 моль аммиака.
n(h3) = 1,5*n(Nh4) = 3 моль
V (h3) = 3*22,4 = 67,2 л
n(N2) = 0,5 *n(Nh4) = 1 моль
V (N2) = 1*22,4 = 22,4 л.
15. Запишите названия аллотропных модификаций углерода.
графит, карбин, алмаз, фуррелены
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/WzNbdAhBPak» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/qEFVz-qrPmc» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Степени окисления азота — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 765
- Уильям Ройш
- Университет штата Мичиган
При сравнении химии аминов со спиртами и эфирами мы обнаруживаем много классов родственных соединений, в которых азот принимает более высокие степени окисления, в отличие от ограниченных степеней окисления кислорода.
В этом контексте имейте в виду, что степень окисления элементарного кислорода (O 2
 Некоторые из этих классов соединений были описаны; другие будут обсуждаться позже.
Некоторые из этих классов соединений были описаны; другие будут обсуждаться позже.Степень окисления | _ 3 | _ 2 | _ 1 | 0 | +1 | +3 |
|---|---|---|---|---|---|---|
| Формулы (имена) | Р 3 Н (амины) (аммоний) (имины) (нитрилы) | Р 2 Н–НР 2 (гидразины) (гидразоны) | РН=НР (азосоединение) (гидроксиламин) (оксид амина) | Н 2 (азот) (диазоний) | R–N=O (нитрозо) | Р-НО 2 (нитро) (нитритовый эфир) |
Оксиды аминов и Cope Исключение
Оксиды аминов получают путем окисления 3º-аминов или пиридинов перекисью водорода или надкислотами (например, ZOOH, где Z=H или ацил). {(–)} + ZOH\]
{(–)} + ZOH\]
Оксиды аминов являются относительно слабыми основаниями, pK a ок. 4,5 по сравнению с исходным амином. Координатно-ковалентная функция N–O полярна, при этом кислород является мощным акцептором водородной связи. Если один из алкильных заместителей состоит из длинной цепи, такой как C 12 H 25 , образующийся аминоксид является амфотерным поверхностно-активным веществом и находит применение в шампунях и других мягких чистящих средствах.
Реакция отщепления, дополняющая реакцию отщепления Хофмана, происходит при нагревании оксидов 3º-амина при температуре от 150 до 200 ºC. Эта реакция известна как Cope Elimination. Обычно его проводят путем добавления по каплям раствора оксида амина в нагретую трубку, наполненную мелкими стеклянными шариками. Поток газообразного азота, протекающий через колонну, переносит летучие алкеновые продукты в охлаждаемый приемник. Азотсодержащий продукт представляет собой гидроксиламин. В отличие от элиминации Хофмана, эта реакция происходит путем согласованной циклической реорганизации, как показано на следующей диаграмме. Для такого механизма фрагменты бета-водорода и оксида амина обязательно имеют син-связь.
Для такого механизма фрагменты бета-водорода и оксида амина обязательно имеют син-связь.
Удаление диастереомерных оксидов амина, таких как те, что показаны в примерах № 2 и 3 выше, обеспечивает доказательство син-отношения групп бета-водорода и оксида амина. Эти примеры также демонстрируют сильную региоселективность в пользу более стабильной двойной связи.
Пиролитическое син-элиминирование
Оксиды аминов — не единственные функции, которые подвергаются мономолекулярному син-элиминированию при нагревании. Чтобы увидеть примеры других случаев, нажмите здесь
Нитроксидные радикалы
2º-Амины, лишенные α-водорода, окисляются пероксидами (ZOOH) до нитроксильных радикалов удивительной стабильности. В примере, показанном в верхней части следующей диаграммы, следует отметить, что резонансная делокализация неспаренного электрона способствует образованию полярной связи N–O. Соединение R=H, известное под аббревиатурой TEMPO, представляет собой относительно стабильное твердое вещество красного цвета. Было получено много других нитроксидов, три из которых нарисованы в правом нижнем углу. Если один или несколько атомов водорода присутствуют на соседнем углероде, нитроксил разлагается на смеси, включающие аминооксиды и нитроны, как показано внизу слева. Нитроксиды окисляются галогенами до нестабильных катионов оксаммония.
Было получено много других нитроксидов, три из которых нарисованы в правом нижнем углу. Если один или несколько атомов водорода присутствуют на соседнем углероде, нитроксил разлагается на смеси, включающие аминооксиды и нитроны, как показано внизу слева. Нитроксиды окисляются галогенами до нестабильных катионов оксаммония.
Спин неспаренного электрона нитроксила можно изучить с помощью метода, называемого электронным парамагнитным резонансом (ЭПР или ЭПР). Эксперименты такого рода показали, что спектры ЭПР чувствительны к заместителям в радикале, а также к его непосредственному окружению. Это привело к стратегии спиновой маркировки для исследования конформационных структур макромолекул, таких как белки. Таким образом, сайт-направленная спиновая маркировка (SDSL) стала ценным методом для картирования элементов вторичной структуры на уровне основной складки в широком диапазоне белков, включая те, которые не поддаются структурной характеристике с использованием классических структурных методов. такие как ядерный магнитный резонанс и рентгеновская кристаллография.
такие как ядерный магнитный резонанс и рентгеновская кристаллография.
Фосфорные аналоги аминов
Фосфор находится ниже азота в периодической таблице. Чтобы увидеть примеры фосфорорганических соединений и их химии, нажмите здесь
Авторы
- Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), Виртуальный учебник органической химии
Эта страница под названием «Степени окисления азота» распространяется по незаявленной лицензии, автором, ремиксом и/или куратором которой является Уильям Ройш.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Уильям Ройш
- Показать страницу TOC
- № на стр.

- Теги
Азот – информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к кислороду >
| Группа | 15 | Точка плавления | -210,0 ° С, -346,0 ° F, 63,2 К |
| Период | 2 | Температура кипения | -195,795 ° С, -320,431 ° F, 77,355 К |
| Блок | п | Плотность (г см -3 ) | 0,001145 |
| Атомный номер | 7 | Относительная атомная масса | 14. 007 007 |
| Состояние при 20°C | Газ | Ключевые изотопы | 14 Н |
| Электронная конфигурация | [Он] 2s 2 2p 3 | Номер КАС | 7727-37-9 |
| ХимПаук ID | 20473555 | ChemSpider — бесплатная база данных химической структуры. | |
Символ снопа пшеницы и молния отражают важность азота для живых существ. Азот важен для роста растений и может быть «закреплен» молнией или добавлен в почву в виде удобрений.
Бесцветный газ без запаха.
Азот важен для химической промышленности. Из него делают удобрения, азотную кислоту, нейлон, красители и взрывчатые вещества. Чтобы получить эти продукты, азот должен сначала вступить в реакцию с водородом для получения аммиака. Это делается с помощью процесса Габера. Ежегодно таким образом производится 150 миллионов тонн аммиака.
Газообразный азот также используется для создания нереакционноспособной атмосферы. Он используется таким образом для сохранения пищевых продуктов, а также в электронной промышленности при производстве транзисторов и диодов. Большие количества азота используются при отжиге нержавеющей стали и других сталелитейных изделий. Отжиг — это термическая обработка, которая облегчает обработку стали.
Отжиг — это термическая обработка, которая облегчает обработку стали.
Жидкий азот часто используется в качестве хладагента. Он используется для хранения спермы, яйцеклеток и других клеток для медицинских исследований и репродуктивных технологий. Он также используется для быстрой заморозки продуктов, помогая им сохранять влажность, цвет, вкус и текстуру.
Азот естественным образом циркулирует в живых организмах через «азотный цикл». Он поглощается зелеными растениями и водорослями в виде нитратов и используется для создания оснований, необходимых для построения ДНК, РНК и всех аминокислот. Аминокислоты являются строительными блоками белков.
Животные получают азот, потребляя другие живые существа. Они расщепляют белки и ДНК на составляющие их основания и аминокислоты, преобразуя их для собственного использования.
Микробы в почве превращают соединения азота обратно в нитраты для повторного использования растениями. Запас нитратов также пополняется азотфиксирующими бактериями, которые «фиксируют» азот непосредственно из атмосферы.
Урожайность можно значительно увеличить, добавив в почву химические удобрения, изготовленные из аммиака. При небрежном использовании удобрение может просочиться из почвы в реки и озера, что приведет к быстрому росту водорослей. Это может блокировать свет, препятствуя фотосинтезу. Растворенный кислород быстро расходуется, и река или озеро умирают.
Азот составляет 78% воздуха по объему. Его получают перегонкой жидкого воздуха. Ежегодно добывается около 45 миллионов тонн. Он содержится в виде соединений во всех живых существах и, следовательно, также в угле и других ископаемых видах топлива.
История элементов и периодической таблицы
Азот в форме хлорида аммония, NH 4 Cl, был известен алхимикам как нашатырный спирт. Его изготавливали в Египте путем нагревания смеси навоза, соли и мочи. Сам газообразный азот был получен в 1760-х годах Генри Кавендишем и Джозефом Пристли, и они сделали это, удалив кислород из воздуха.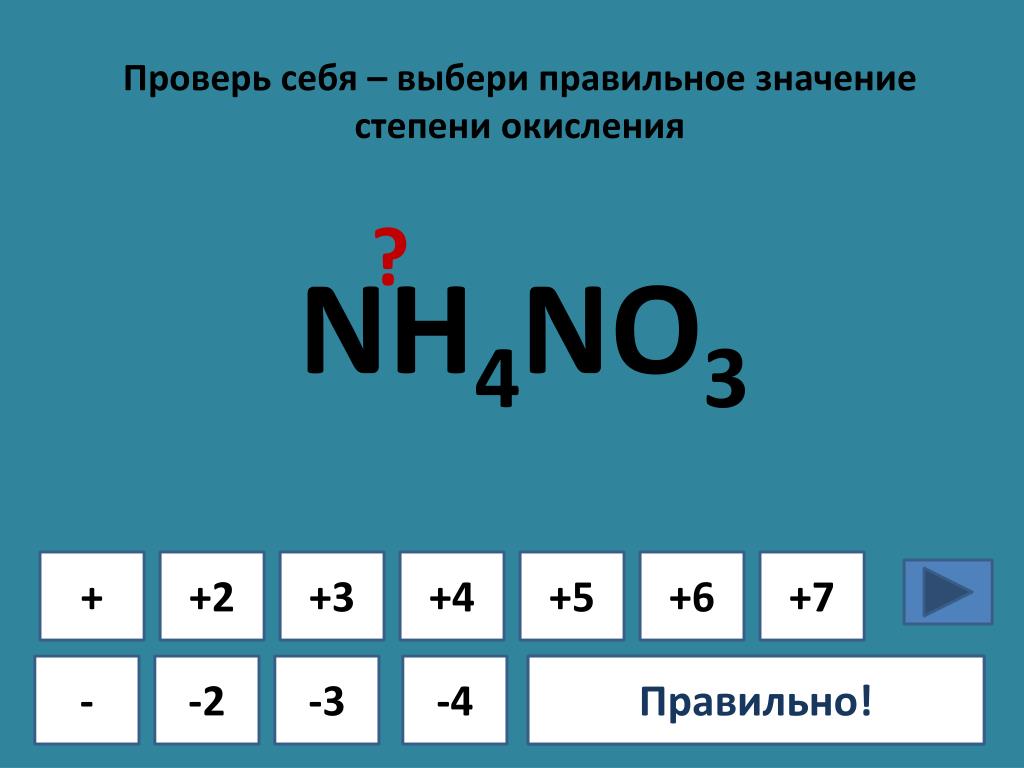 Они отметили, что он погасил зажженную свечу и что мышь, дышащая им, скоро умрет. Ни один из мужчин не сделал вывод, что это был элемент. Первым, кто предположил это, был молодой студент Дэниел Резерфорд в своей докторской диссертации в сентябре 1772 года в Эдинбурге, Шотландия.
Они отметили, что он погасил зажженную свечу и что мышь, дышащая им, скоро умрет. Ни один из мужчин не сделал вывод, что это был элемент. Первым, кто предположил это, был молодой студент Дэниел Резерфорд в своей докторской диссертации в сентябре 1772 года в Эдинбурге, Шотландия.
| Атомный радиус, несвязанный (Å) | 1,55 | Ковалентный радиус (Å) | 0,71 |
| Сродство к электрону (кДж моль -1 ) | Нестабильный | Электроотрицательность (шкала Полинга) | 3. 04 04 |
| Энергии ионизации (кДж моль −1 ) | 1 ст 1402.328 2 -й 2856.092 3 рд 4578,156 4 -й 7475. 5 -й 9444,969 6 -й 53266.835 7 -й 64360,16 | ||
|
| Общие степени окисления | 5, 4, 3, 2, -3 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 14 Н | 14. 003 003 | 99,636 | — | — | |
| 15 Н | 15.000 | 0,364 | — | — | |
|
|
| Удельная теплоемкость (Дж кг -1 К -1 ) | 1040 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | Неизвестный | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте подкаст азота |
Стенограмма: (Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Привет! На этой неделе мы взрываем подушки безопасности, душим животных и добираемся до сути пороха, потому что химик из Кембриджа Питер Уотерс исследовал историю азота. Питер Уотерс Газообразный азот составляет около 80% воздуха, которым мы дышим. Это, безусловно, самый распространенный элемент в своей группе в периодической таблице, и все же он является последним открытым членом своего семейства. Другие элементы этой группы, фосфор, мышьяк, сурьма и висмут, были обнаружены, использовались и подвергались злоупотреблениям по крайней мере за 100 лет до того, как стало известно об азоте. На самом деле, только в 18 -м -м веке люди сосредоточили свое внимание на химии воздуха и свойствах приготовления различных газов. Мы можем по-настоящему понять открытие азота, только отметив также открытие некоторых из этих других газов. Роберт Бойль заметил в 1670 году, что когда к железным опилкам добавляли кислоту, смесь сильно нагревалась и извергала обильные зловонные пары. Углекислый газ был также известен под названием чумной воздух, что означает вредный или ядовитый. Это название, очевидно, произошло от его свойства уничтожать жизнь, так как он быстро душит любых погруженных в него животных. Здесь начинается путаница с газообразным азотом, так как чистый газообразный азот также удушает животных. Решающим экспериментом в открытии азота стало понимание того, что в этом чумном воздухе есть как минимум два разных вида удушливых газов. Это было сделано путем пропускания смеси газов через раствор щелочи, которая поглотила углекислый газ, но оставила газообразный азот. Таким образом Кавендиш получил газообразный азот. Он пропускал воздух туда и обратно над раскаленным углем, который превращал кислород воздуха в углекислый газ. Затем углекислый газ растворялся в щелочи, оставляя после себя инертный газообразный азот, который, как он правильно заметил, был немного менее плотным, чем обычный воздух. К сожалению, Кавендиш не опубликовал свои выводы. Он только что сообщил об этом в письме коллеге-ученому Джозефу Пристли, одному из первооткрывателей газообразного кислорода. А как насчет названия, азот? В конце 1780-х годов химическая номенклатура претерпела большую революцию под руководством французского химика Антуана Лавуазье. Именно он и его коллеги предложили многие из названий, которые мы используем до сих пор, включая слово «водород», которое происходит от греческого слова, означающего «образующий воду», и «кислород» от греческого «производитель кислоты», поскольку Лавуазье ошибочно полагал, что кислород является ключевым компонентом все кислоты. Однако в свой список известных тогда элементов Лавуазье включил термин азот или азотный газ для обозначения того, что мы сейчас называем азотом. Крис Смит Питер Уотерс из Кембриджского университета рассказывает историю открытия азота. Марк Пеплоу В то время как другие ученые пытались создать способы упорядочения известных элементов, Менделеев создал систему, которая могла предсказывать существование еще не открытых элементов. Когда он представил миру таблицу в 1869 г., он содержал четыре заметных пробела. Один из них был чуть ниже марганца, и Менделеев предсказал, что будет найден элемент с атомным весом 43, чтобы заполнить этот пробел, но только в 1937 году группа итальянских ученых наконец нашла недостающий элемент, который они назвали технецием. Крис Смит И вы можете услышать рассказ Марка Пеплоу о технеции в выпуске Chemistry in its element за следующую неделю. Я Крис Смит, спасибо, что выслушали. Увидимся в следующий раз. (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists. (Конец акции) |
Нажмите здесь, чтобы просмотреть видеоролики об азоте
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W. M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95-е издание, Интернет-версия 2015 г. , по состоянию на декабрь 2014 г.
, по состоянию на декабрь 2014 г.
Таблицы физических и химических констант, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсбург, Мэриленд, по состоянию на ноябрь 2016 г.
Т. Л. Коттрелл, Прочность химических связей , Butterworth, London, 1954.
Джон Эмсли, Строительные блоки природы: руководство по элементам от А до Я , Oxford University Press, New York, 2nd Edition, 2011.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.0084 Частично получено из материалов, предоставленных Британской геологической службой © NERC.
ИСТОРИЯ ТЕКСТ
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podcasts
. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Видео с вопросами: сбалансированное уравнение окисления аммиака
Стенограмма видео
Реакция аммиака Nh4 с кислородом дает оксид азота, NO и воду в качестве единственных продуктов. Напишите сбалансированное химическое уравнение для этой реакции, используя наименьшие целые числовые коэффициенты для реагентов и продуктов.
Начнем с определения реагентов и продуктов. Проблема начинается «реакцией аммиака с кислородом». Ключевое слово «реакция» указывает на то, что реагентами являются аммиак и кислород. Мы должны написать химическую формулу аммиака и кислорода слева от стрелки реакции. Обратите внимание, что кислород записывается как O в нижнем индексе два. Это связано с тем, что кислород существует в виде двухатомной молекулы в чистом виде. В результате реакции образуются только окись азота и вода. Поэтому мы можем написать NO и h3O на стороне продуктов реакции. Теперь мы можем начать балансировать это химическое уравнение.
Химическое уравнение сбалансировано, если количество атомов каждого элемента одинаково в обеих сторонах реакции. Чтобы сбалансировать это химическое уравнение, мы начнем с определения элементов, участвующих в реакции. В уравнении мы видим элементы азот, водород и кислород. Теперь подсчитаем количество атомов каждого элемента по обе стороны реакции. Мы можем провести пунктирную линию у стрелки, чтобы отделить реагенты от продуктов.
Начнем с подсчета атомов азота. Мы видим один атом азота на стороне реагентов и один атом азота на стороне продуктов. Со стороны реагентов находятся три атома водорода, а со стороны продуктов – два атома водорода. Наконец, давайте посчитаем атомы кислорода. На стороне реагентов находятся два атома кислорода. А со стороны продуктов мы видим один атом кислорода в каждой молекуле оксида азота и один атом кислорода в каждой молекуле воды. Это дает нам в общей сложности два атома кислорода на стороне продуктов.
Глядя на наш список, мы видим, что с обеих сторон реакции присутствует по одному атому азота. Это означает, что атомы азота сбалансированы. Со стороны реагентов имеется три атома водорода, а со стороны продуктов — два атома водорода. Это означает, что атомы водорода неуравновешены. И есть два атома кислорода с обеих сторон реакции, что означает, что атомы кислорода уравновешены.
Теперь мы можем добавить коэффициенты к химическому уравнению, чтобы сбалансировать реакцию.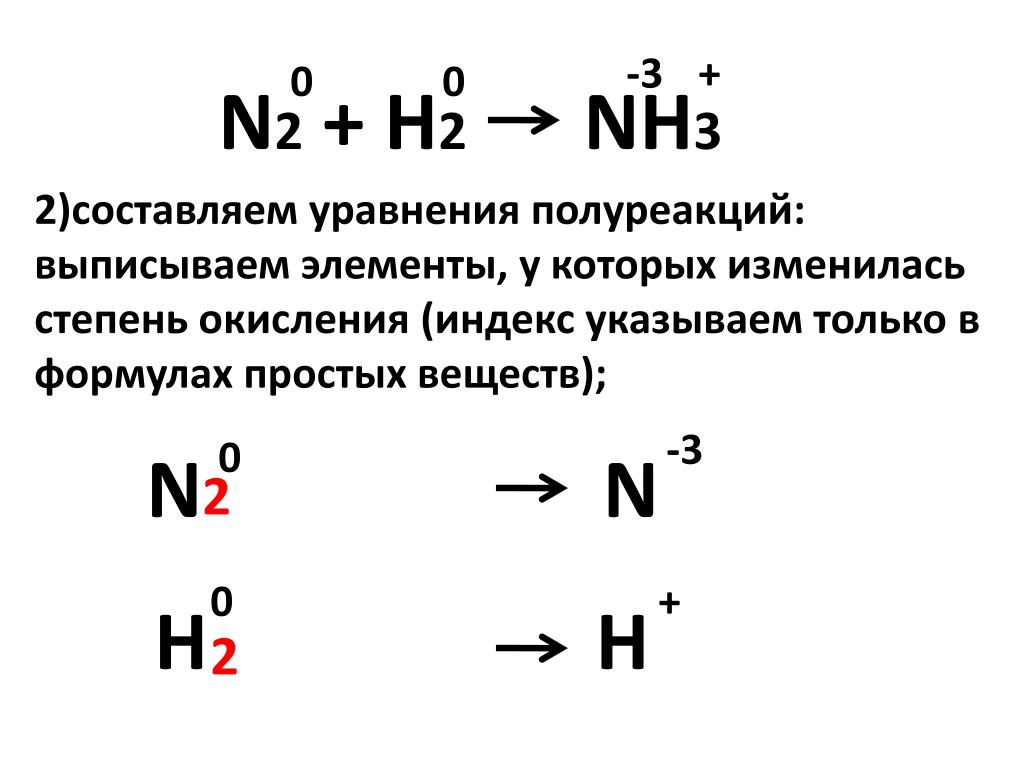 Коэффициенты представляют собой числовые значения, которые можно поставить перед любыми частицами по обе стороны от реакции. У нас есть только один элемент, который находится вне баланса, водород. Есть два варианта того, как мы могли бы сбалансировать атомы водорода. Первый вариант — поместить дробь «три половинки» перед молекулой воды на стороне продуктов. Если в одной молекуле воды два атома водорода, то в трех половинках молекул воды будет всего три атома водорода. Это сбалансирует атомы водорода.
Коэффициенты представляют собой числовые значения, которые можно поставить перед любыми частицами по обе стороны от реакции. У нас есть только один элемент, который находится вне баланса, водород. Есть два варианта того, как мы могли бы сбалансировать атомы водорода. Первый вариант — поместить дробь «три половинки» перед молекулой воды на стороне продуктов. Если в одной молекуле воды два атома водорода, то в трех половинках молекул воды будет всего три атома водорода. Это сбалансирует атомы водорода.
Однако размещение коэффициента перед молекулой влияет на все атомы в молекуле. Это означает, что теперь три половины атомов кислорода исходят от молекул воды на стороне продуктов, и что общее число атомов кислорода на стороне продуктов теперь составляет пять половин. Хотя мы, возможно, уравновесили атомы водорода, мы разбалансировали атомы кислорода. И нам остается пытаться сбалансировать два атома кислорода на стороне реагента с пятью половинами атомов кислорода на стороне продукта.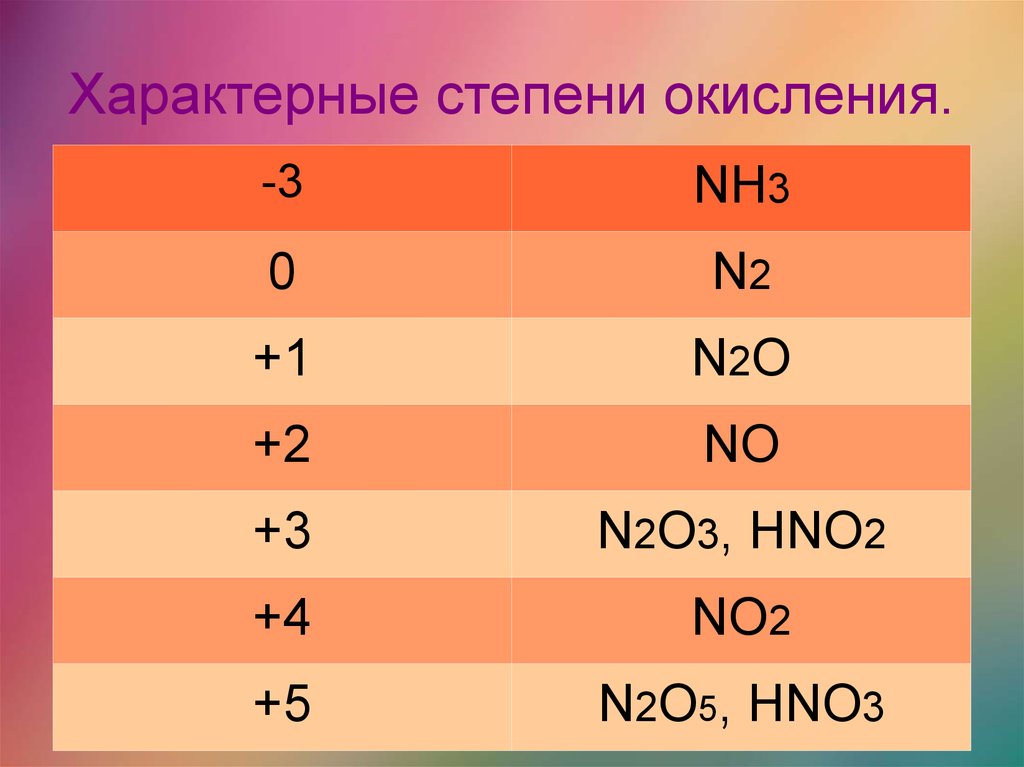 Это кажется довольно сложным.
Это кажется довольно сложным.
Второй способ сбалансировать атомы водорода — найти наименьшее общее кратное трех и двух. Наименьшее общее кратное трех и двух равно шести. Это говорит нам о том, что мы хотим найти способ получить шесть атомов водорода на стороне реагента и шесть атомов водорода на стороне продукта. Что касается реагента, мы могли бы поставить коэффициент два перед аммиаком. Если в одной молекуле аммиака три атома водорода, то в двух молекулах аммиака будет шесть атомов водорода.
Мы также должны помнить, что размещение коэффициента перед молекулой влияет на все атомы в молекуле. Если одна молекула аммиака имеет один атом азота, то две молекулы аммиака будут иметь два атома азота. Что касается продуктов, мы могли бы поставить перед молекулой воды коэффициент, равный трем. Если в одной молекуле воды два атома водорода, то в трех молекулах воды будет шесть атомов водорода.
Мы также помним, что размещение коэффициента, равного трем, перед молекулой воды также влияет на количество атомов кислорода на стороне продуктов. Теперь три атома кислорода исходят от трех молекул воды и всего четыре атома кислорода со стороны продуктов. Поместив коэффициенты, чтобы получить шесть атомов водорода с обеих сторон реакции, мы уравновесили атомы водорода, но мы также разбалансировали атомы азота и кислорода.
Теперь три атома кислорода исходят от трех молекул воды и всего четыре атома кислорода со стороны продуктов. Поместив коэффициенты, чтобы получить шесть атомов водорода с обеих сторон реакции, мы уравновесили атомы водорода, но мы также разбалансировали атомы азота и кислорода.
Используя метод наименьшего общего кратного вместо дроби пополам, мы разбалансировали большее количество элементов. Тем не менее, мы сохранили все суммы атомов в виде целых чисел, что упрощает их общую балансировку.
Теперь мы можем попытаться сбалансировать атомы азота. Два атома азота находятся на стороне реагента и один атом азота на стороне продукта. Мы можем поставить коэффициент два перед оксидом азота, чтобы получить два атома азота на стороне продукта. Мы также помним, что размещение коэффициента перед молекулой оксида азота также повлияет на количество атомов кислорода на стороне продукта. Это означает, что на стороне продукта теперь всего пять атомов кислорода. С двумя атомами азота по обе стороны реакции баланс атомов азота восстанавливается.


 057
057
 Он был настолько огнеопасен, что при приближении к нему зажженной свечи достаточно легко воспламенялся и горел голубоватым и несколько зеленоватым пламенем. Водород был более тщательно подготовлен и собран блестящим, но замкнутым ученым-миллионером Генри Кавендишем около 100 лет спустя. Кавендиш назвал этот газ горючим воздухом из металлов в знак признания этого поразительного свойства. Он также изучал газ, который мы знаем под названием двуокись углерода, впервые полученный шотландским химиком Джозефом Блэком в 1750-х годах. Блэк называл углекислый газ фиксированным воздухом, поскольку считалось, что он заперт или закреплен в определенных минералах, таких как известняк. Его можно было освободить из каменной тюрьмы под действием тепла или кислот.
Он был настолько огнеопасен, что при приближении к нему зажженной свечи достаточно легко воспламенялся и горел голубоватым и несколько зеленоватым пламенем. Водород был более тщательно подготовлен и собран блестящим, но замкнутым ученым-миллионером Генри Кавендишем около 100 лет спустя. Кавендиш назвал этот газ горючим воздухом из металлов в знак признания этого поразительного свойства. Он также изучал газ, который мы знаем под названием двуокись углерода, впервые полученный шотландским химиком Джозефом Блэком в 1750-х годах. Блэк называл углекислый газ фиксированным воздухом, поскольку считалось, что он заперт или закреплен в определенных минералах, таких как известняк. Его можно было освободить из каменной тюрьмы под действием тепла или кислот.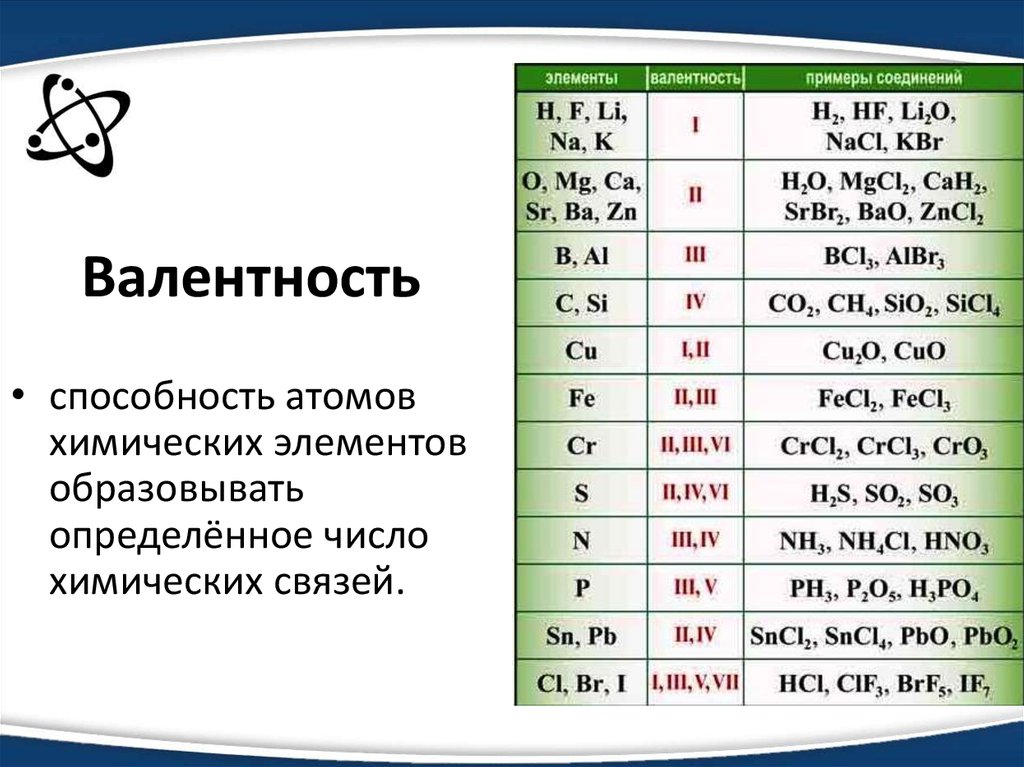 Если кислород в закрытом количестве воздуха израсходован либо путем сжигания в нем свечи, либо путем заточения животного, большая часть кислорода превращается в углекислый газ, который смешивается с газообразным азотом, присутствующим в воздухе. Эта ядовитая смесь больше не поддерживает жизнь и поэтому была названа чумной.
Если кислород в закрытом количестве воздуха израсходован либо путем сжигания в нем свечи, либо путем заточения животного, большая часть кислорода превращается в углекислый газ, который смешивается с газообразным азотом, присутствующим в воздухе. Эта ядовитая смесь больше не поддерживает жизнь и поэтому была названа чумной.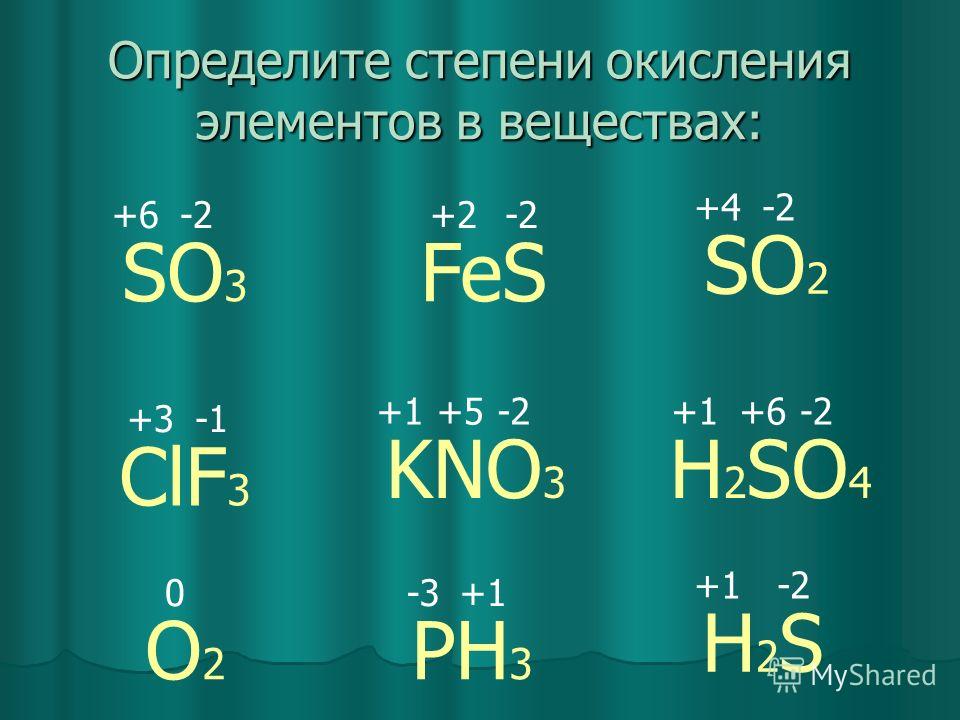 Следовательно, открытие азота обычно приписывают одному из учеников Джозефа Блэка, шотландскому ученому Дэниелу Резерфорду, который также приходится дядей писателю и поэту сэру Вальтеру Скотту. Резерфорд опубликовал свои выводы, которые были аналогичны выводам Кавендиша в его докторской диссертации, озаглавленной «Вступительная диссертация о эфире, называемом фиксированным или мефитическим» в 1772 году.0032
Следовательно, открытие азота обычно приписывают одному из учеников Джозефа Блэка, шотландскому ученому Дэниелу Резерфорду, который также приходится дядей писателю и поэту сэру Вальтеру Скотту. Резерфорд опубликовал свои выводы, которые были аналогичны выводам Кавендиша в его докторской диссертации, озаглавленной «Вступительная диссертация о эфире, называемом фиксированным или мефитическим» в 1772 году.0032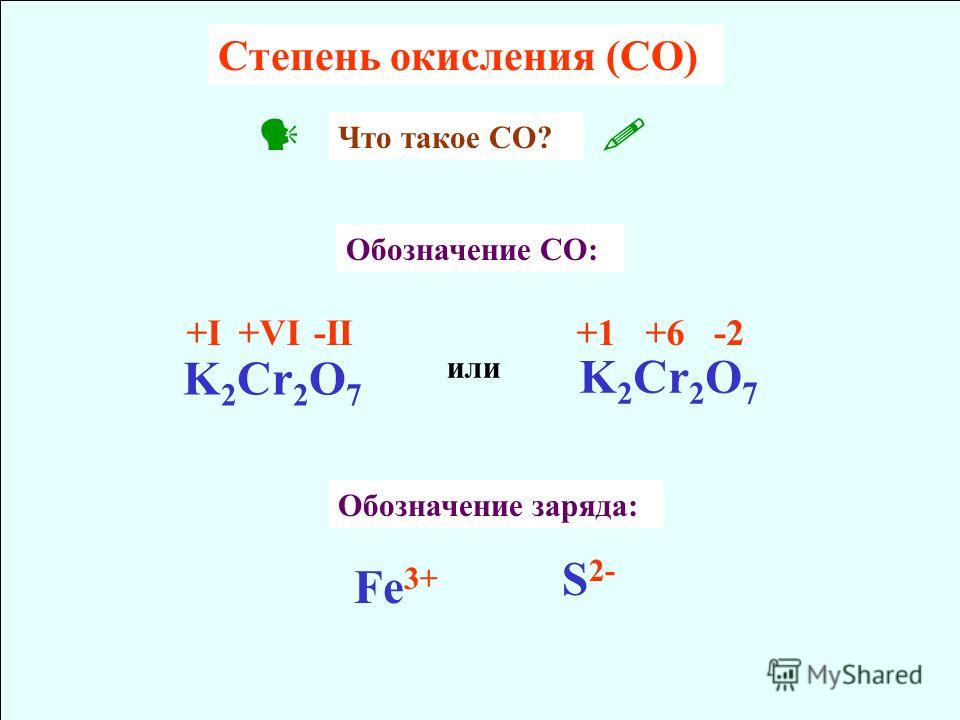 Это снова происходит от греческих слов, на этот раз означающих отсутствие жизни, еще раз акцентируя внимание на ее мерзостных качествах. Вскоре было указано, что существует много ядовитых газов, фактически ни один другой газ, кроме кислорода, не может поддерживать жизнь. Таким образом, название «азот» было предложено на основании наблюдения, снова впервые сделанного Кавендишем, что если газы искрятся кислородом, а затем образовавшиеся газы диоксида азота проходят через щелочь, образуется селитра, иначе известная как селитра или нитрат калия. Таким образом, слово «азот» означает нитрообразователь. Производные от слова азот сохранились до сих пор. Соединение, используемое для взрывного наполнения автомобильных подушек безопасности газом, представляет собой азид натрия, соединение только натрия и азота. При срабатывании это соединение взрывается, высвобождая газообразный азот, который надувает мешки. Это азотистое соединение не только не уничтожило жизнь, но спасло тысячи людей.
Это снова происходит от греческих слов, на этот раз означающих отсутствие жизни, еще раз акцентируя внимание на ее мерзостных качествах. Вскоре было указано, что существует много ядовитых газов, фактически ни один другой газ, кроме кислорода, не может поддерживать жизнь. Таким образом, название «азот» было предложено на основании наблюдения, снова впервые сделанного Кавендишем, что если газы искрятся кислородом, а затем образовавшиеся газы диоксида азота проходят через щелочь, образуется селитра, иначе известная как селитра или нитрат калия. Таким образом, слово «азот» означает нитрообразователь. Производные от слова азот сохранились до сих пор. Соединение, используемое для взрывного наполнения автомобильных подушек безопасности газом, представляет собой азид натрия, соединение только натрия и азота. При срабатывании это соединение взрывается, высвобождая газообразный азот, который надувает мешки. Это азотистое соединение не только не уничтожило жизнь, но спасло тысячи людей. В следующий раз о химии в ее стихии, о том, как такие химики, как Менделеев, справлялись как с известным, так и с неизвестным.
В следующий раз о химии в ее стихии, о том, как такие химики, как Менделеев, справлялись как с известным, так и с неизвестным. com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements.
com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements.