Структура и характеристики Льюиса N2O5 (13 полных фактов) – Lambda Geeks
Н2O5 или пятиокись азота является сильным окислителем с молекулярной массой 108.01 г/моль. Обсудим молекулярное свойство N2O5 в деталях.
N2O5 представляет собой оксид азота, где N имеет степень окисления +5, которая максимальна в стабильной форме. Молекула существует как форма разделения ионов, каждый N содержит положительный заряд, а два O содержат отрицательный заряд. Он очень нестабилен и реактивен из-за присутствия в молекуле электроотрицательных атомов.
N2O5 является хорошим реагентом для органической химии для включения нитрогруппы в любую молекулу, поэтому его можно использовать во многих органических реакциях. Теперь мы обсудим молекулярные свойства, а также структуру Льюиса, гибридизацию и полярность N.2O5 подробно в следующем разделе с надлежащим объяснением.
1. Как нарисовать букву N
2O5 структура Льюиса?С помощью правила октетов, валентности и валентных электронов мы можем изобразить структуру Льюиса N2O5 в несколько шагов. Нарисуем структуру Льюиса N2O5.
Подсчет валентных электронов
На первом этапе рисования структуры Льюиса необходимо подсчитать общее количество валентных электронов. Подсчет валентных электронов для молекулы означает подсчет валентных электронов для отдельных атомов. Общее количество валентных электронов для N2O5 равны 40, в которые N и O вносят свои валентные электроны.
Выбор центрального атома
2nd шаг для рисования структуры льюиса — выбрать один атом в качестве центрального атома среди всех, а другие атомы должны быть связаны через связь с этим центральным атомом. N выбран здесь в качестве центрального атома, потому что он имеет больший размер и меньшую электроотрицательность, чем O, оба атома N здесь являются центральными.
Удовлетворение октета
Каждый атом в N2O5 удовлетворяется до октета, заполняя валентную оболочку электронами. N и O оба завершают свою валентную оболочку на 8 электронов, поскольку они принадлежат p-блоку. Общее количество электронов, необходимых для октета в N2O5 7 * 8 = 56, и это количество электронов накапливается за счет общих связей.
Удовлетворение валентности
При образовании связи путем удовлетворения октета каждый атом должен удовлетворяться своей стабильной валентностью. Электроны, необходимые в соответствии с октетом, удовлетворяются их валентностью для образования связей. Избыточные электроны должны быть размещены дополнительными связями, и эти связи должны быть оправданы стабильной валентностью каждого атома.
Назначьте одинокие пары
После создания подходящих связей атомами, если на валентной орбитали присутствуют избыточные электроны, она назначается неподеленной парой над конкретным атомом. N образует больше связей, чем его валентность, поэтому он не содержит неподеленных пар, но каждый атом O содержит четыре неподеленные пары электронов.
N образует больше связей, чем его валентность, поэтому он не содержит неподеленных пар, но каждый атом O содержит четыре неподеленные пары электронов.
2. Н
2O5 валентные электроныВалентные электроны для N2O5 представляют собой комбинацию валентных электронов N, а также O. Подсчитаем общее количество валентных электронов, присутствующих в N2O5.
N2O5 имеет 46 валентных электронов, где и N, и пять O вносят свои валентные электроны по отдельности. Электронная конфигурация N и O: [He]2s22p3 и [He]2s22p4 соответственно. Таким образом, валентные электроны, считая каждый N, имеют 5, а O имеет 6 электронов, а затем складывают их вместе, чтобы получить валентные электроны.
- Валентные электроны, которые вносят вклад в N, равны 5 (подтверждено электронной конфигурацией)
- Валентные электроны, которые вносят вклад в O, равны 6 (подтверждено электронной конфигурацией)
- Общее количество валентных электронов для двух N и пяти O для N2O5 то есть (5*2) + (6*6) = 46.

3. Н
2O5 Одинокие пары структуры ЛьюисаВ то2O5 только атом O содержит неподеленные пары, но N здесь не содержит неподеленных пар. Вычислим неподеленные пары над N2O5.
N2O5 содержит 10 пар неподеленных пар, и все неподеленные пары присутствуют только над пятью атомами O. Поскольку каждый O имеет больше электронов, чем валентных электронов, чем связывающих электронов, N заставляет связи превышать его валентность, поэтому у него нет электронов, которые могли бы существовать в виде неподеленных пар. Сложите их вместе, чтобы получить общее количество одиноких пар.
- Всего неподеленных пар, присутствующих в N2O5 рассчитываются по формуле: неподеленные пары = электроны, присутствующие на валентной орбитали, – электроны, участвующие в образовании связи.
- Неподеленные пары, присутствующие над атомами N, составляют 5-4 = 1.
- Неподеленные пары, присутствующие над атомами O, равны 6-2 = 4.

- Неподеленные пары, присутствующие над концевыми атомами O, равны 7-1 = 6.
- Таким образом, общее количество неподеленных пар, присутствующих на N2O5 4 * 2 + 6 * 2 = 20 электронов, что означает 10 пар неподеленных пар.
- У N остался только один электрон, поэтому у него нет пары электронов.
4. Н
2O5 Правило октета структуры ЛьюисаВ то2O5 молекулы, N и O следуют октету во время образования связи, выполняя свою валентную оболочку. Дайте нам знать об октете N2O5.
Электроны, необходимые для октета N2O5 равны 56, а валентных электронов 46, поэтому избыточные 56-46 = 10 электронов должны быть заполнены связями 10/2 = 5, но в N2O5 будет присутствовать 8 связей из-за удовлетворения их валентности, хотя N выполняют его октет из-за валентности получает положительный заряд.
Концевые атомы О образуют только одну связь, поэтому он получает больше электронов в своей валентной оболочке и по этой причине получает отрицательный заряд, но валентность здесь не выполняется.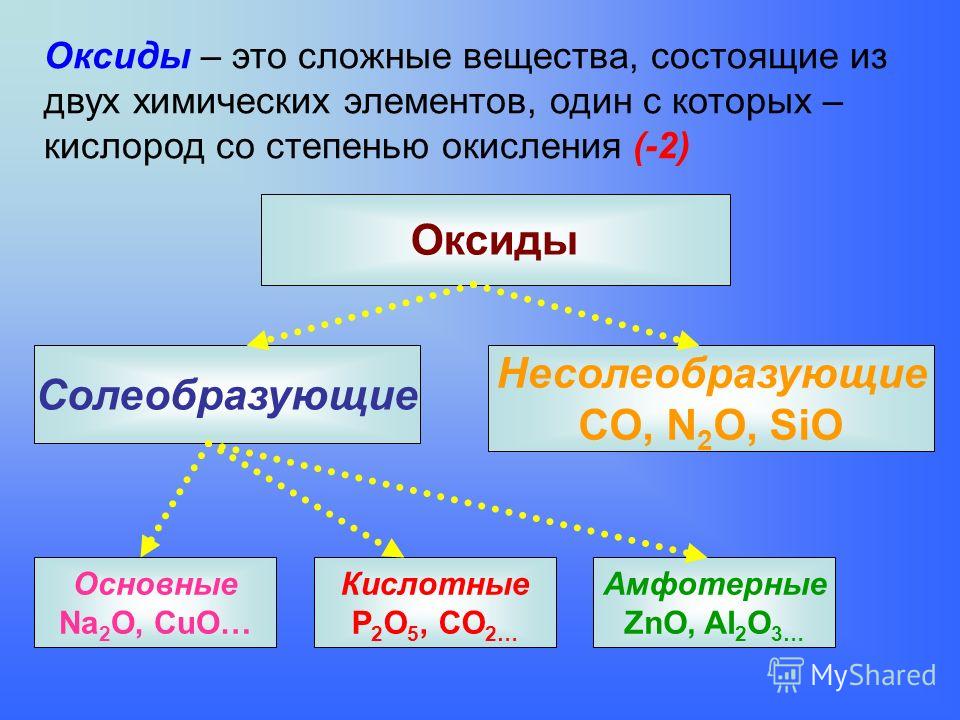 O имеет стабильную двухвалентность, но концевые атомы O образуют только одну связь и получают отрицательный заряд над ней, чтобы завершить октет.
O имеет стабильную двухвалентность, но концевые атомы O образуют только одну связь и получают отрицательный заряд над ней, чтобы завершить октет.
5. Н
2O5 форма структуры ЛьюисаМолекулярная форма N2O5 — это ориентация атомов N и O при правильном расположении для получения определенной формы. Предскажем форму N2O5.
Молекулярная форма N2O5 является тригонально-плоским вокруг обоих центральных атомов N, что может быть подтверждено следующей таблицей,
| Молекулярный Формула | Количество пары связей | Количество одинокие пары | Форма | Геометрия |
| AX | 1 | 0 | Линейные приводы | Линейные приводы |
| AX2 | 2 | 0 | Линейные приводы | Линейные приводы |
| AX | 1 | 1 | Линейные приводы | Линейные приводы |
| AX3 | 3 | 0 | треугольный плоскостной | треугольный Planar |
| AX2E | 2 | 1 | изогнутый | треугольный Planar |
| AX2 | 1 | 2 | Линейные приводы | треугольный Planar |
| AX4 | 4 | 0 | четырехгранный | четырехгранный |
| AX3E | 3 | 1 | треугольный пирамидальный | четырехгранный |
| AX2E2 | 2 | 2 | изогнутый | четырехгранный |
| AX3 | 1 | 3 | Линейные приводы | четырехгранный |
| AX5 | 5 | 0 | треугольный бипирамидальный | треугольный бипирамидальный |
| AX4E | 4 | 1 | неустойчиво | треугольный бипирамидальный |
| AX3E2 | 3 | 2 | Т-образный | треугольный бипирамидальный |
| AX2E3 | 2 | 3 | линейный | треугольный biпирамидальный |
| AX6 | 6 | 0 | восьмигранный | восьмигранный |
| AX5E | 5 | 1 | площадь пирамидальный | восьмигранный |
| AX4E2 | 4 | 2 | площадь пирамидальный | восьмигранный |
N2O5 это ТОПОР3 молекула типа, потому что она трехкоординирована и согласно теории VSEPR (отталкивание пар электронов валентной оболочки) молекула AX3 принял тригональную плоскую геометрию, если над центральным атомом нет одиночных пар, таких как N2O5.
6. Н
2O5 угол структуры ЛьюисаУгол, образуемый атомами в определенной геометрии, является правильным расположением атома без стерического отталкивания. Вычислим валентный угол N2O5.
Валентный угол НЕ равен 1120 в то2O5 молекула, потому что это тригональная плоская молекула, и для этого типа молекулы общий валентный угол составляет 1200. Но существует отталкивание между неподеленными парами и парами связей, по этой причине молекула изменяет свой валентный угол на такой, что отталкивание будет минимальным.
N2O5 Бонд Угол- Валентный угол можно рассчитать по величине гибридизации центрального атома.
- Формула валентного угла согласно правилу Бента: COSθ = s/(s-1).
- Центральный атом N представляет собой sp2 гибридизированы, поэтому символ s здесь равен 1/3rd
- Итак, валентный угол равен COSθ = {(1/3)} / {(1/3)-1} =-( ½)
- Θ = COS-1(-1/2) = 1200
- Но по стерическим причинам валентный угол уменьшился от его фактического значения до 112°.
 0.
0.
7. Н
2O5 Формальное обвинение структуры ЛьюисаНаличие заряда над любым атомом в молекуле определяется формальным зарядом в предположении равной электроотрицательности. Рассчитаем формальный заряд для N2O5.
Формальное обвинение N2O5 молекула равна нулю, но N и конец O имеют заряд над ними, поэтому присутствует равный и противоположный заряд, который может нейтрализовать молекулу. Но по отдельности эти атомы заряжены или заряд присутствует над этими атомами в N2O5. Таким образом, их связь будет более полярной.
- Формальное обвинение N2O5 можно рассчитать по формуле FC = Nv — NЛ.П. -1/2 Нбп
- Формальный заряд, присутствующий на каждом атоме N, равен 5-0-(8/2) = +1.
- Формальный заряд каждого терминального атома О равен 6-6-(2/2) = -1.
- Формальный заряд атома O с двойной связью равен 6-4-(4/2) = 0.

- Итак, есть два N, содержащих формальный заряд +1, и два O, содержащих формальный заряд -1, поэтому они могут нейтрализовать друг друга своим формальным зарядом и сделать молекулу нейтральной.
report this ad
Хотя N и O принадлежат к одному и тому же, орбитальная энергия различна, и по этой причине они подвергаются гибридизации, чтобы образовать правильную связь. Давайте посмотрим на гибридизацию N2O5.
Центральный N в N2O5 это зр2 гибридизированы, и это может быть подтверждено следующей сказкой,
| Структура | Гибридизация ценностное | Государство гибридизация центрального атома | Бондовый угол |
| 1.Линейный | 2 | сп/сд/пд | 1800 |
2. Планировщик Планировщиктреугольный | 3 | sp2 | 1200 |
| 3. Тетраэдрический | 4 | sd3/сп3 | 109.50 |
| 4.Тригональный бипирамидальный | 5 | sp3д/дсп3 | 900 (осевой), 1200(экваториальный) |
| 5.Восьмигранный | 6 | sp3d2/ д2sp3 | 900 |
| 6.Пятиугольный бипирамидальный | 7 | sp3d3/d3sp3 | 900, 720 |
- Мы можем рассчитать гибридизацию по общепринятой формуле H = 0.5 (V + M-C + A),
- Таким образом, гибридизация центрального N такова: ½ (4 + 2 + 0 + 0) = 3 (sp2)
- В гибридизации участвуют одна s-орбиталь и две p-орбитали N.

- Двойная связь между N и O в гибридизации не участвует.
9. Н
2O5 растворимостьЧтобы проверить растворимость N2O5 мы использовали другой тип растворителя, в котором они могут полностью диссоциировать и растворяться. Теперь мы видим растворимость N2O5.
N2O5 не растворяется в воде, а реагирует с водой с образованием азотной кислоты. Поскольку пятиокись азота представляет собой газообразную молекулу, а для газообразной молекулы ее очень трудно растворить в полярных молекулах воды, ее можно адсорбировать, но здесь она может реагировать с молекулой воды с образованием молекулы кислоты.
N2O5 может быть растворим в других следующих растворителях
- Незначительно в CCl4
- Частично растворим в CHCl3
- Или любой органический растворитель
10. Н
2O5 твердое или жидкое?Физическое состояние N2O5 зависит от силы притяжения между атомами и приложенной температуры. Посмотрим, является ли N2O5 является твердым или жидким.
Посмотрим, является ли N2O5 является твердым или жидким.
N2O5 представляет собой твердую молекулу, она выглядит как белое твердое вещество, потому что оксид содержит больше двойных связей, поэтому сила притяжения Ван-дер-Ваальса здесь очень высока, и все атомы присутствуют рядом. Таким образом, он может существовать в твердом состоянии при комнатной температуре.
В твердой форме он имеет гексагональную кристаллическую структуру, и этот тип кристалла не такой прочный, поэтому он может плавиться при нормальной температуре, поэтому его температура плавления очень низкая.
11. Н
2O5полярный или неполярный?Полярность молекулы зависит от результирующего значения дипольного момента и разности электроотрицательностей между атомами. Посмотрим, является ли N2O5 полярный или нет.
N2O5 является полярным, поскольку имеет постоянный дипольный момент, равный 1. 4. Этот постоянный дипольный момент создается из-за разницы в электроотрицательности между атомами N и O, а также это асимметричная молекула, поэтому направление дипольного момента не может быть противоположным другим. Итак, молекула полярна.
4. Этот постоянный дипольный момент создается из-за разницы в электроотрицательности между атомами N и O, а также это асимметричная молекула, поэтому направление дипольного момента не может быть противоположным другим. Итак, молекула полярна.
Из-за разницы в электроотрицательности существует поток дипольного момента, который возникает от электроположительного N к электроотрицательному атому O. Но направление дипольного момента не зависит от других и создает здесь постоянный дипольный момент.
12. Н
2O5 кислотный или основной?Кислотная или основная природа оксида определяется, когда он реагирует с водой и какой тип молекулы образуется. Давайте посмотрим, является ли он кислотным или основным.
N2O5 является кислотным оксидом, потому что при взаимодействии с водой образуется азотная кислота, которая является сильной кислотой. Кроме того, степень окисления азота здесь +5, поэтому он существует в более высокой степени окисления, а при более высоком окислении он не может быть дополнительно окислен и ведет себя как кислая среда. Кроме того, оксиды неметаллов являются кислотными.
Кроме того, оксиды неметаллов являются кислотными.
Но по теории Аррениуса его нельзя высвободить H+ или ОН– поскольку в нем отсутствуют оба иона, поэтому он сам не может быть ни кислым, ни основным.
13. Н
2O5 электролит?Для проверки электролитической природы N2O5 мы должны увидеть механизм ионизации молекулы в водном растворе. Проверим, если N2O5 электролит или нет.
N2O5 не является электролитом, так как при растворении в воде вступает с ней в реакцию и образует другую молекулу. Таким образом, мы не можем предсказать механизм ионизации N2O5 в водном растворе. Таким образом, мы не можем сделать вывод, является ли это электролитом, потому что он не растворяется в воде.
Но кислота, которую он образует, азотная кислота, может диссоциировать в водном растворе с образованием заряженных частиц и может проводить электричество, поэтому ее продукт реакции с водой может быть электролитом.
14. Н
2O5 ионный или ковалентный?Молекула является ковалентной или ионной, известной по механизму связи, независимо от того, образована ли она за счет совместного использования электронов или отдачи электронов. Посмотрим, ионная она или ковалентная.
N2O5 является чистой ковалентной молекулой, потому что она образуется за счет обмена электронами между атомами N и O, хотя в связи присутствует частичный полярный характер, поскольку оба являются электроотрицательными атомами. Но центральный N подвергается гибридизации, чтобы образовать правильную ковалентную связь.
Согласно правилу Фаяна ни одна молекула не является ковалентной или ионной, ионная молекула может быть ковалентной или наоборот, это зависит от теории поляризуемости.
Заключение
Пентаоксид диазота — очень опасный и нестабильный оксид. Он может реагировать с различными типами молекул, а в органической химии он может включать нитрогруппу в другие функциональные группы.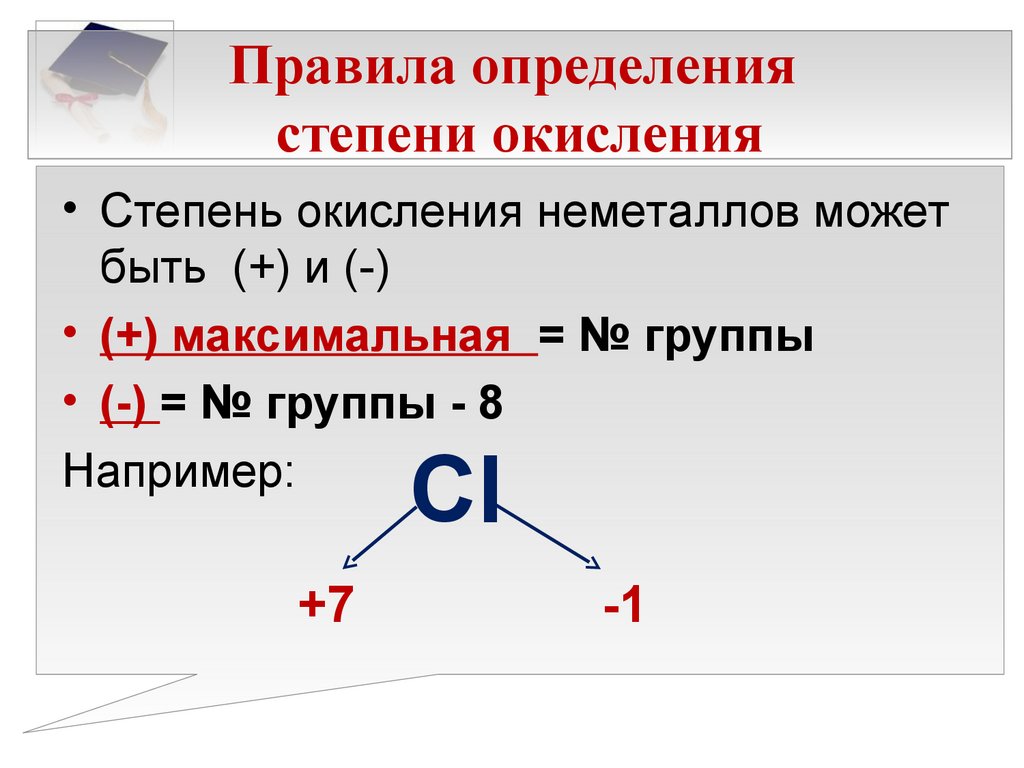 N находится в степени окисления +, поэтому его также можно использовать в качестве сильного окислителя.
N находится в степени окисления +, поэтому его также можно использовать в качестве сильного окислителя.
Оксид азота(V) n2o5.
Это вещество очень неустойчиво и в течение нескольких часов распадается, при нагревании — со взрывом:
2N2O5 = 4NO2 + O2
При растворении N2O5 в воде образуется азотная кислота.
Высший оксид азота является сильным окислителем, например:
N2O5 + I2 = I2O5 + N2
Азотная кислота HNO3. Азотная кислота HNO3 — одна из важнейших неорганических
кислот.
Это летучая бесцветная жидкость, с
резким запахом, смешивается с водой в
любых пропорциях. При переливании ее
на воздухе образуется туман, состоящий
из мельчайших капелек азотной кислоты,
поэтому чистую (100 %-ю) HNO3 называют дымящей.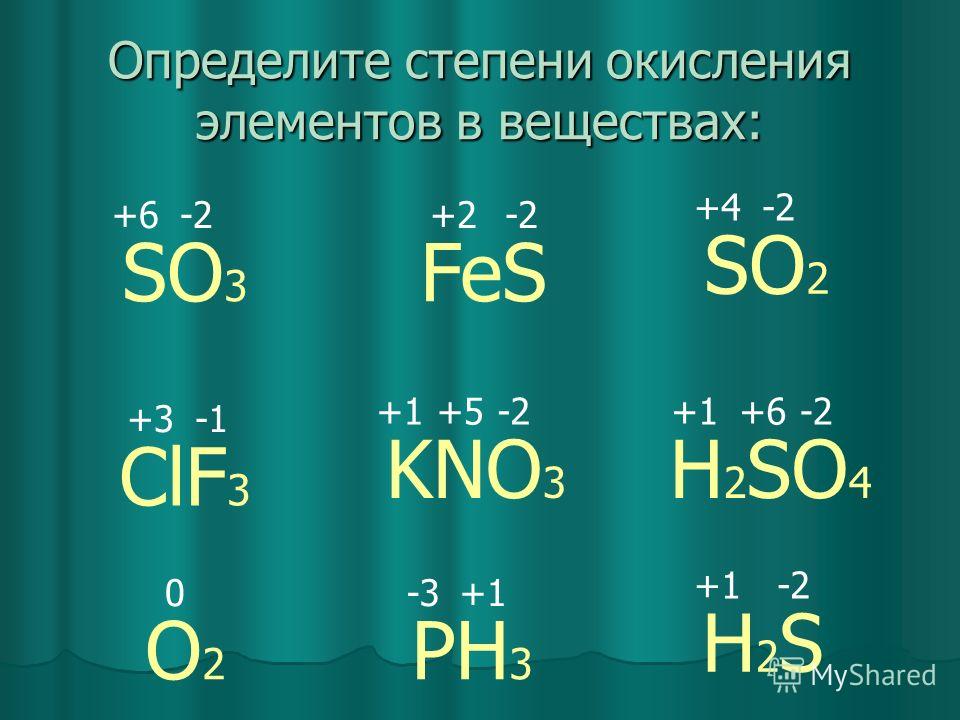
4NH3 + 5O2=6H2O + 4NO
с последующим окислением NO: 2NO + O2 = 2NO2
и поглощением образующегося NO2 водой при избытке воздуха:
4NO2 + O2 + 2H2O = 4HNO3
Дымящая или концентрированная HNO3 при хранении на свету вскоре приобретает
бурую окраску за счет растворения оксида азота(IV), образующегося при ее разложении: 2HNO3 = 2NO2 + Н2O + l/2 O2
Такую кислоту хранят в темных склянках.
Молекулы
HNO 3 как в газовой, так и в жидкой и твердой
фазах имеют плоское строение. Отличительной
особенностью HNO3 является ее высокая окислительная
способность. Азотная кислота при
нагревании легко окисляет многие
неметаллы: иод,
Отличительной
особенностью HNO3 является ее высокая окислительная
способность. Азотная кислота при
нагревании легко окисляет многие
неметаллы: иод,
серу, уголь, фосфор, а на холоде — иодоводород, сероводород и их соли:
6HI + 2HNO3 = 3I2 + 2NO + 4Н2O
+HNO3 | ||
Разб. Конц. | ||
Актив. Ме (в том числе и Al, Zn, Mg) | N2 | N2O |
Сред. Актив. Ме | NO или N2 | NO2 |
Неактив. | NO | NO2 |
Азотистая кислота в чистом виде не выделена и существует лишь в растворах, которые получают на холоде подкислением растворов ее солей:
Ba(NO2)2 + H2SO4 = 2HNO2 + BaSO4
Эти растворы имеют голубую окраску, они относительно устойчивы при 0 °С, а при нагревании до комнатной температуры разлагаются: 3HNO 2= HNO3 + 2NO + H2O
Азотистая кислота легко диспропорционирует.
Окислительные
свойства и прочность HNO3 и HNO2 удобно сопоставить с помощью диаграммы
вольт-эквивалент — степень окисления.
Легко заметить, что значение
вольт-эквивалента HNO2 лежит выше прямой, соединяющей значения
вольт-эквивалентов NO
и HNO3.
Следовательно, G реакции
диспропорционирования оказывается
меньше нуля, иными словами, HNO2 является неустойчивой кислотой и
стремится диспропорционировать на NO
и HNO3. Кроме того, в разбавленных растворах
одинаковой концентрации (0,1 М) HNO2 оказывается
сильным окислителем, по силе превосходящим
даже HNO3.
Так,0,05
М HNO2,
мгновенно окисляет иодид калия:
Кроме того, в разбавленных растворах
одинаковой концентрации (0,1 М) HNO2 оказывается
сильным окислителем, по силе превосходящим
даже HNO3.
Так,0,05
М HNO2,
мгновенно окисляет иодид калия:
а азотная кислота той же концентрации с KI не реагирует. Это следует и из диаграммы вольт-эквивалент—степень окисления. Действительно, наклон прямой, соединяющей значения вольт-эквивалентов HNO2 и NO, оказывается круче, чем в случае пары HNO3 и NO. Атом азота в HNO2 находится в промежуточной степени окисления, поэтому для азотистой кислоты и ее солей характерны не только окислительные, но и восстановительные свойства. Так, нитриты обесцвечивают подкисленный раствор перманганата калия: 5KNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
Нитриты
щелочных, щелочноземельных металлов и
аммония — бесцветные или желтоватые
кристаллические вещества, хорошо
растворимые в воде и плавящиеся без
разложения.
Отношение нитратов металлов к нагреванию.
Ме находящиеся левее Mg (кроме Li): МеNO2+O2
Ме находящиеся между [Mg и Cu] (и Li): MeO+NO2+O2
Ме находящиеся правее Cu: Ме+NO2+O2
Азотноватистая (гипоазотистая) кислота H2N2O2. Бесцветные кристаллы. Азотноватистая кислота — слабая и очень неустойчивая. Она и ее соли проявляют восстановительные свойства. При обезвоживании H2N2O2 концентрированной H2SO4 образуется оксид азота N2
Нитроксиловая
кислота H4N2O4. В свободном
виде она неустойчива.
В свободном
виде она неустойчива.
Все щелочные металлы взаимодействуют с водой, выделяя водород:
2Ме+2H2O=2МеOH+H2
Эта экзотермическая реакция протекает очень быстро, натрий часто воспламеняется, а более тяжелые металлы реагируют со взрывом. Относительно низкая активность лития по отношению к воде определяется прежде всего кинетическими, а не термодинамическими причинами: литий наиболее твердый из щелочных металлов и имеет самую высокую температуру плавления, поэтому он медленнее дробится на капли и реагирует спокойнее других щелочных металлов.
Состав
продуктов, образующихся при сгорании
щелочных металлов на воздухе или в
кислороде, зависит от природы металла.
Так, литий образует оксид Li2O,
натрий — пероксид Na2O2,
калий, рубидий и цезий — супероксиды
(надпероксиды) КO2,
RbO2,
CsO2. Все эти вещества имеют ионную
кристаллическую решетку. Пероксиды:
ст.окисл. -1, а супероксиды (надпероксиды)
ст.окисл
.
Все эти вещества имеют ионную
кристаллическую решетку. Пероксиды:
ст.окисл. -1, а супероксиды (надпероксиды)
ст.окисл
.
Взаимодействие с серой: При сплавлении натрия с серой образуются персульфиды типа Na2S2, Na2S3, Na2S4 и Na2S5.
Li не образует полисульфидов. Остальные образуют: K2S+nS=K2Sn
Э2S гидролизуются медленно, окисляются до тиосульфатов:
Взаимодействие с водородом:
Получают: Li(расплав)+H2=2LiH
NaH,KH,Cs,Rb разлагаются при нагревании. Все гидролизуются в воде: 2LiH+2H2O=2LiOH+H2
Взаимодействие с галогенами:
LiF-
малорастворим. LiCl,LiBr,LiI-гигроскопичны,
образуют кристаллогидраты.
LiCl,LiBr,LiI-гигроскопичны,
образуют кристаллогидраты.
NaГ, KГ, CsГ, RbГ- хорошо растворимые соли.
Прочность связи Li-Г в ряду F, Cl, Br, I уменьшается, причина- сильное поляризующее влияние иона лития.
Взаимодействие с азотом:
Li3N синтезируется при обычных условиях. Остальные нитриды получают действием тихого электрического разряда на пары щелочных металлов в атмосфере азота. Они не устойчивы. В воде гидролизуются: Li 3N+3H2O=3LiOH+NH3
Оксиды, гидроксиды, соли.
Оксиды М2O их можно получить путем дозированного окисления металлов, однако в
этом случае конечный продукт будет содержать примеси. Цвет оксида изменяется
от
белого (Li2O
и Na2O)
к желтому (K2O,
Rb2O)
и оранжевому (Cs2O). Удобным способом получения оксида
натрия является взаимодействие натрия
с расплавленным едким натром: 2NaOH +
2Na=2Na2O
+ H2
Удобным способом получения оксида
натрия является взаимодействие натрия
с расплавленным едким натром: 2NaOH +
2Na=2Na2O
+ H2
Для всех щелочных металлов получены озониды МO3, в состав которых входит парамагнитный ион [O3]—
Все озониды представляют собой оранжево-красные кристаллические вещества. Они чрезвычайно взрывоопасны и неустойчивы.
Пероксиды, надпероксиды и озониды щелочных металлов при нагревании pазлагаются. Их термическая устойчивость увеличивается с ростом радиуса катиона. Пероксиды, надпероксиды и озониды являются сильными окислителями:
Na2O2 + CO = Na2CO3
Гидроксиды
элементов первой группы являются
сильными основаниями.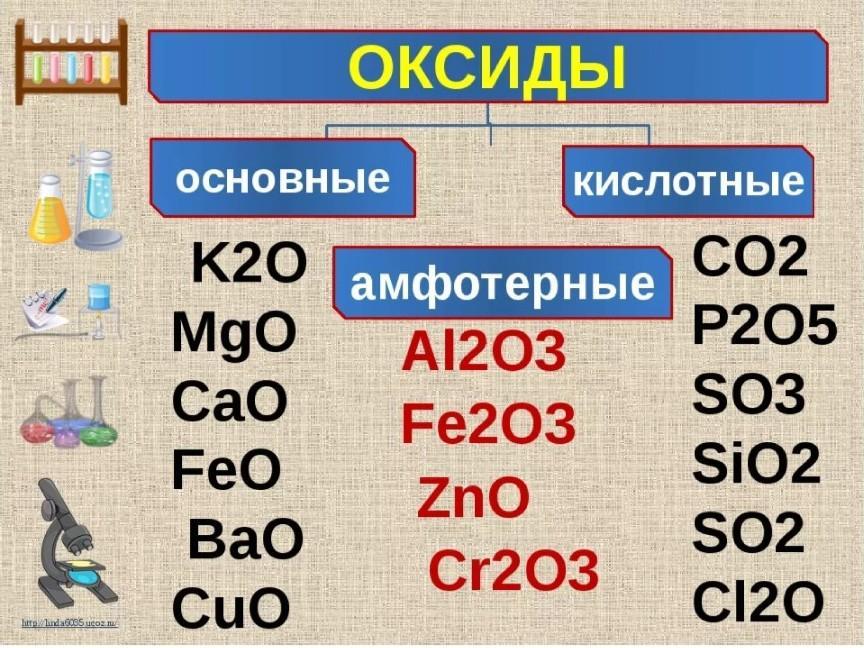 Они представляют
собой бесцветные гигроскопичные
вещества, легко расплывающиеся на
воздухе и постепенно превращающиеся в
карбонаты. Гидроксиды щелочных металлов
прекрасно растворимы в воде.
Они представляют
собой бесцветные гигроскопичные
вещества, легко расплывающиеся на
воздухе и постепенно превращающиеся в
карбонаты. Гидроксиды щелочных металлов
прекрасно растворимы в воде.
Гидроксиды натрия, калия, рубидия и цезия плавятся без разложения, в то время как LiOH при прокаливании выделяет воду: 2LiOH = Li2O + Н2O
Взаимодействие гидроксидов щелочных металлов с кислотами и кислотными оксидами приводит к образованию солей.
Нитраты щелочных Ме при нагревании разлагаются:
4LiNO3=2Li2O+4NO2+O2
Но остальные: 2NaNO3=2NaNO2+O2
Na2CO3*10H2O – кристаллическая сода
NaHCO3 – питьевая сода (Получение- аммиачный способ, метод Сольве:
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
2NaHCO3= Na2CO3+CO2+H2O (при нагревании)
Литий
Li от остальных щелочных металлов отличает
большее значение энергии ионизации и
небольшой размер атома и иона. Литий по
свойствам напоминает магний (диагональное
сходство в периодической системе).
Литий по
свойствам напоминает магний (диагональное
сходство в периодической системе).
В окислительно-восстановительном процессе всегда участвуют две (сопряженные)
пары,
каждая из которых включает окислитель
и восстановитель. Процессу образования
ионов способствует увеличение энтропии
(энтропия ионов в растворе гораздо
больше, чем энтропия металла) и образование
гидратов, а препятствуют процессы
ионизации (энергия ионизации достаточно
высока) и разрушения кристаллической
решетки. В состоянии равновесия на
пластинке локализуется положительный
заряд, который компенсируется
противоионами, находящимися в растворе.
Так возникает двойной
электрический слой, характеризующийся
некоторым скачком потенциала который зависит от природы металла,
температуры и концентрации ионов металла
в растворе. Величину
, нельзя ни измерить, ни рассчитать.
Однако, если такой полуэлемент соединить
проводником с другим полуэлементом
(например,
то
между ними будет протекать электрический
ток, обусловленный разностью потенциалов. Электродвижущая сила (Е) процесса,
например реакции:
Электродвижущая сила (Е) процесса,
например реакции:
будет равна с высокой степенью приближения разности потенциалов полуэлементов:
Е = 1.
Вот эту величину — электродвижущую силу — измерить можно! Поэтому для характеристики полуэлементов (окислительно-восстановительных пар) используют величину ЭДС между данным полуэлементом и так называемым электродом сравнения. За электрод сравнения принят стандартный водородный электрод
2Н+(р)+2e—=H20
Условно принято считать, что = 0 при давлении водорода, равном 1 атм,
и активности Н+, равной 1. ЭДС цепи, составленной из стандартного водородного электрода и изучаемого электрода, называют электродным потенциалом последнего. Если активности (концентрации) ионов равны единице, то этот потенциал называют
стандартным
(Е°). Так,
для окислительно-восстановительной
пары Cu2+/Cu°,
при
Так,
для окислительно-восстановительной
пары Cu2+/Cu°,
при
[Си2+] = 1 моль/л: Е = = Е° (Cu2+/Cu°).
Уравнение 1. для окислительно-восстановительного процесса в целом можно записать так:
или в более общем виде: E=Eок-Евос
где Еок — электродный потенциал пары, выступающей в качестве окислителя; Евос — электродный потенциал пары, выступающей как восстановитель.
Билет №9
Реакционная способность Р оказывается более высокой, чем азота. С металлами Р взаимодействуют с образованием фосфидов. Их получают нагреванием смеси пниктогена с металлом в инертной атмосфере или в запаянной ампуле.
Гидролиз фосфида: Mg3P2+6H2O=2PH3+3Mg(OH)2
Mg3P2+6HCl=2PH3+3MgCl2
Фосфор диспропорционирует
Р4 + 6Н2O = РН3 + ЗН3PO2
В
кислой и нейтральной средах равновесие
сильно смещено влево, и реакция практически
не протекает. Равновесие смещается
вправо под действием
Равновесие смещается
вправо под действием
щелочей: Р4 + ЗКОН + ЗH2O=PH3 + ЗКН2PO2
Фосфин образует с воздухом взрывчатые смеси, а при поджигании сгорает, превращаясь в метафосфорную кислоту: РН3 + 2O2=НРО3 + Н2O
Фосфин плохо растворим в воде. Реагирует только с очень сильными кислотами (HI, HClO4)
Алотропия фосфора.
Белый фосфор. Мягкое кристаллическое вещество с неприятным чесночным запахом, практически не растворим в воде, мало растворим в бензоле, хорошо растворим в сероуглероде. Он сильно ядовит, на воздухе горит. Имеет молекулярную решетку в узлах которой находятся тетраэдрические молекулы
P4. Высокая реакционная способность.
Красный
фосфор.P∞ Образуется при нагревании белого до
320 градусов без доступа воздуха. Он не
растворим в сероуглероде, но растворяется
в расплавленном висмуте и свинце.
Он не
растворим в сероуглероде, но растворяется
в расплавленном висмуте и свинце.
Черный фосфор. При нагревании 200 оС и давлении 1200 атм. Красный переходит в черный фосфор- термодинамически более выгодную форму. Напоминает графит.
Оксиды.
Оксиды Э2O3 получают при взаимодействии простых веществ с кислородом. Оксид фосфора(III) представляет собой белый рыхлый кристаллический порошок, легко возгоняющийся. Оксид фосфора(III) называют фосфористым ангидридом, так как он взаимодействует с холодной водой с образованием фосфористой кислоты:
Р4O6+6Н2O = 4Н3PO3
Оксиды фосфора(III) проявляют кислотные свойства
Оксиды Э2O5 (Э4О10). Оксид фосфора(V) (или фосфорный ангидрид) представляет
собой
рыхлый белый порошок. Оксид фосфора(V)
чрезвычайно жадно присоединяет воду.
Реакция сопровождается сильным
разогреванием и приводит к образованию
Оксид фосфора(V)
чрезвычайно жадно присоединяет воду.
Реакция сопровождается сильным
разогреванием и приводит к образованию
сложной смеси, состоящей из метафосфорных кислот разного состава, которые при кипячении гидролизуются до ортофосфорной кислоты Н3PO4.
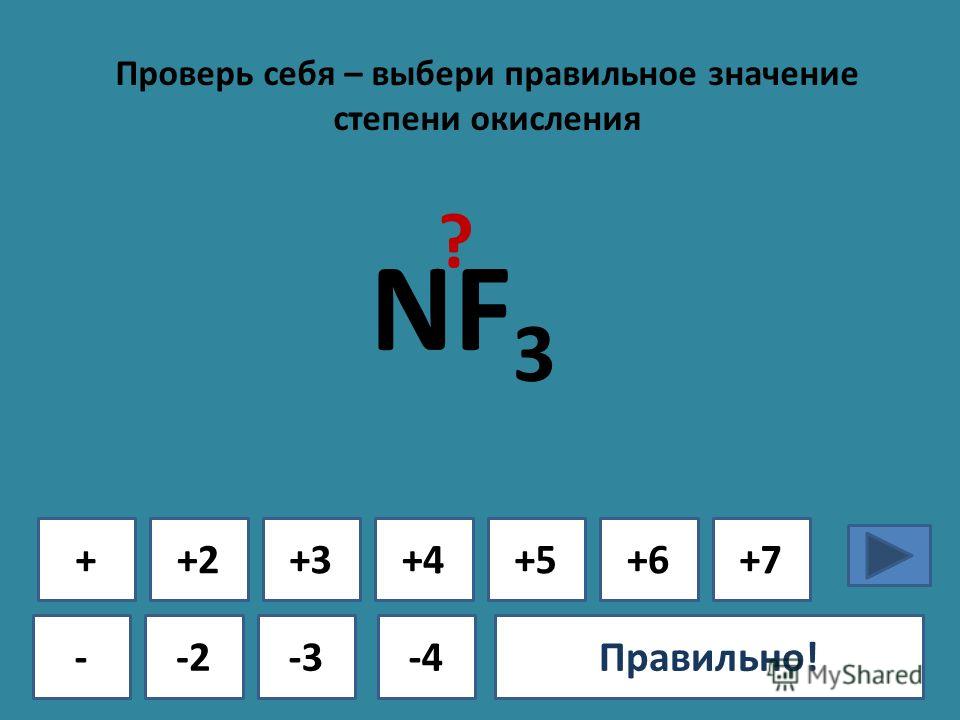
Какова степень окисления азота в ${{N}_{2}}{{O}_{5}}$?
Последняя обновленная дата: 08 -й января 2023
•
Общее представление: 192K
•
Просмотры сегодня: 1,92K
Ответ
Проверено
192K+ вид
HINT: . степень окисления, которая описывает степень окисления, т.е. потерю электронов атомом в химическом соединении. Концептуально степень окисления может быть положительной, отрицательной или нулевой.
Полный ответ:
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. В некоторых случаях средняя степень окисления элемента представляет собой дробь.
В некоторых случаях средняя степень окисления элемента представляет собой дробь.
Вещество, отдающее электроны в процессе окисления, известно как окисленное вещество. Чтобы определить, в каком соединении азот имеет наибольшую степень окисления, мы должны рассчитать степень окисления азота в данном атоме, которую можно рассчитать следующим образом:
${{N}_{2}}{{O}_{5}}$Степень окисления кислорода всегда равна двум, и в соединении присутствует отрицательный заряд, что соответствует тому, что кислород будет иметь степень окисления -2, теперь у нас есть 2 атома азота и пять атомов кислорода присутствуют в данном соединении, поэтому степень окисления азота можно рассчитать, используя следующий метод:
Предположим, что степень окисления азота равна x
${{N}_{2}}{ {O}_{5}}=2x-5\times 2=2x-10$
Теперь значение x можно рассчитать по формуле:
$2x-10=0;x=5$, что соответствует степени окисления азот в ${{N}_{2}}{{O}_{5}}$ равен 5,
Примечание:
Увеличение степени окисления атома в результате химической реакции известно как окисление; уменьшение степени окисления известно как восстановление. Такие реакции включают формальный перенос электронов: чистый прирост электронов представляет собой восстановление, а чистая потеря электронов представляет собой окисление. Для чистых элементов степень окисления равна нулю.
Такие реакции включают формальный перенос электронов: чистый прирост электронов представляет собой восстановление, а чистая потеря электронов представляет собой окисление. Для чистых элементов степень окисления равна нулю.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
WebElements Periodic Table » Азот » пятиокись азота
- Формула: N 2 O 5
- Формула системы Hill: N 2 O 5
- Регистрационный номер CAS: [10102-03-1]
- Вес формулы: 108.
 01
01 - Класс: оксид
- Цвет: белый
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 30°C
- Температура кипения: 47°C
- Плотность: 2050 кг·м -3
Ниже приведены некоторые синонимы пятиокиси азота :
- пятиокись азота
- оксид азота(V)
- оксид азота
- пятиокись азота
Степень окисления азота в пятиокиси азота составляет 5 .
Синтез
Нет в наличии
Твердотельная структура
- Геометрия азота:
- Прототип конструкции:
Элементный анализ
В таблице показано процентное содержание элементов для N 2 O 5 (пятиокись азота).
| Элемент | % |
|---|---|
| Н | 25,94 |
| О | 74.06 |
Изотопная схема N
2 O 5На приведенной ниже диаграмме показана рассчитанная изотопная картина для формулы N 2 O 5 с наиболее интенсивным ионом, установленным на 100%.
Ссылки
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.



 0.
0.
 Ме (Cu,Hg,
Ag)
Ме (Cu,Hg,
Ag)