Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию. =>>
=>>
v
Теллур полупроводниковой чистоты (фото сайта periodictable.ru)
История открытия:
Открыт Ф.Мюллером в 1782 г. Название элемента происходит от латинского tellus, родительный падеж telluris, Земля (название предложил М.Г. Клапрот, который выделил элемент в виде простого вещества и определил его важнейшие свойства).
Получение:
В природе существует как смесь 8 стабильных изотопов (120, 122-126, 128, 130). Содержание в земной коре 10-7%. Основные минералы — алтаит (PbTe), теллуровисмутит (Bi 2Te3), тетрадимит (Bi2Te2S), содержится во многих сульфидных рудах.
Получают из шламов производства меди выщелачиванием раствором NaOH в виде Na2TeO3, откуда теллур выделяется электролитически. Дальнейшая очистка — сублимацией и зонной плавкой.
Физические свойства:
Компактный теллур серебристо-серое вещество с металлическим блеском, имеющее гексагональную кристаллическую решетку (плотность 6,24 г/см3, температура плавления — 450°С, кипения — 990°С). Из растворов осаждается в виде коричневого порошка, в парах состоит из молекул Te2.
Из растворов осаждается в виде коричневого порошка, в парах состоит из молекул Te2.
Химические свойства:
На воздухе при комнатной температуре теллур устойчив, при нагревании реагирует с кислородом. Взаимодействует с галогенами, со могими металлами вступает в реакцию при нагревании.
При нагревании теллур окисляется водяным паром с образованием оксида теллура(II), взаимодействует с концентрированными серной и азотной кислотами. При кипячении в водных растворах щелочей диспропорционирует аналогично сере:
В соединениях проявляет степени окисления -2, +4, +6, реже +2.
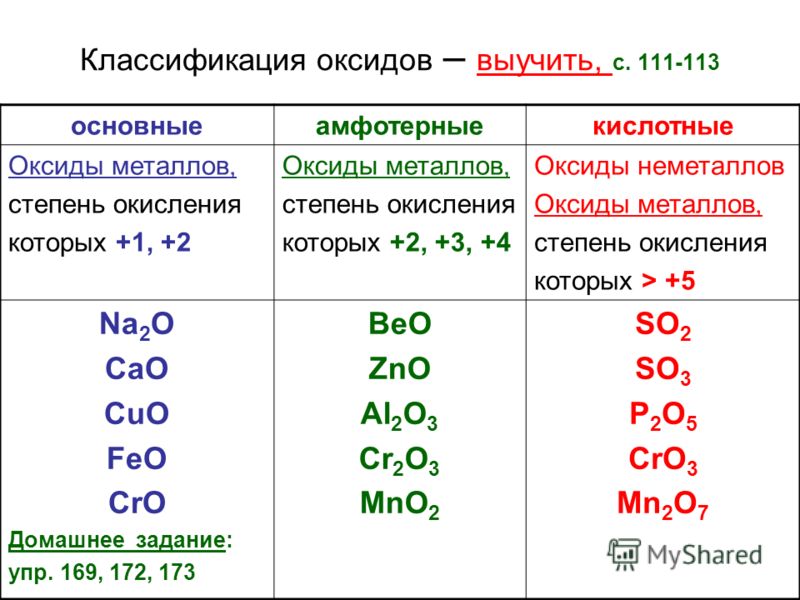
Важнейшие соединения:
Оксид теллура(IV), диоксид теллура, TeO2, плохо растворим в воде, кислотный оксид, реагирует со щелочами, образуя соли теллуристой кислоты. Применяется в лазерной технике, компонент оптических стекол.
Оксид теллура(VI), триоксид теллура, TeO3, желтое или серое вещество, в воде практически не растворимо, при нагревании разлагается образуя диоксид, реагирует со щелочами.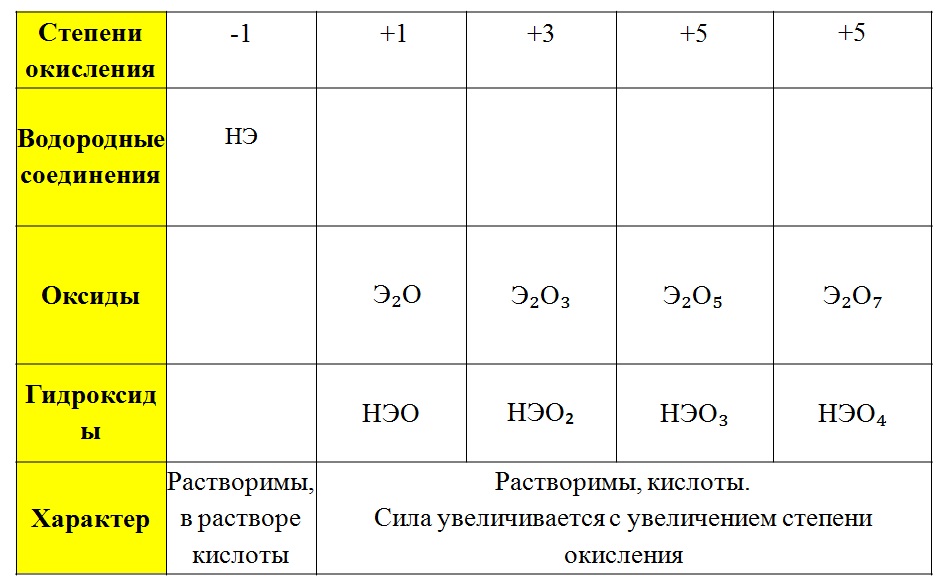 Получают разложением теллуровой кислоты.
Получают разложением теллуровой кислоты.
Теллуристая кислота, H2TeO3, малорастворима, склонна к полимеризации, поэтому обычно представляет собой осадок с переменым содержанием воды
TeO 2*nH2O. Соли — теллуриты (M2TeO3) и полителлуриты (M2Te2O5 и др.), обычно получают спеканием карбонатов с TeO2, применяются как компоненты оптических стекол.
Теллуровая кислота, H6TeO6, белые кристаллы, хорошо растворима в горячей воде. Очень слабая кислота, в растворе образует соли состава MH5TeO6 и M2H4TeO6. При нагревании в запаянной ампуле была получена также метателлуровая кислота H2TeO4, которая в растворе постепенно превращается в теллуровую.
Соли — теллураты. Получают также сплавлением оксида теллура(IV) со щелочами в присутствии окислителей, сплавлением теллуровой кислоты с карбонатом или оксидом металла.
Теллуроводород, H2Te — ядовитый газ с неприятным запахом, получают гидролизом теллурида алюминия. Сильный восстановитель, в растворе быстро окисляется кислородом до теллура. В водном растворе кислота, более сильная чем серо- и селеноводородная. Соли — теллуриды, получают обычно взаимодействием простых веществ, теллуриды щелочных металлов растворимы. Многие теллуриды p- и d- элементов — полупроводники.
Галогениды. Известны галогениды теллура(II), например TeCl2, солеподобные, при нагревании и в растворе диспропорционируют на Te и соединения Te(IV). Тетрагалогениды теллура — твердые вещества, в растворе гидролизуются с образованием теллуристой кислоты, легко образуют комплексные галогениды (например K2[TeI6]). Гексафторид TeF6, бесцветный газ, в отличие от гексафторида серы легко гидролизуется, образуя теллуровую кислоту.

Применение:
Компонент полупроводниковых материалов; легирующая добавка к чугуну, сталям, сплавам свинца.
Мировое производство (без СССР) — около 216 т/год (1976).
Теллур и его соединения токсичны. ПДК около 0,01 мг/м3.
См. также: Теллур // Википедия. (дата обращения: 23.12.2019).
«Открытие элементов и происхождение их названий».Теллур
Что такое степень окисления Te в TeO3
ПУБЛИКАЦИЯ CHETANA-Элементы групп 16, 17 и 18-УПРАЖНЕНИЕ
21 видеоРЕКЛАМА
Аб Падхай каро бина адс ке
Харидо ки адки сари видео DN Pro и дехо сари видео рукаават ке!
Похожие видео
Твердый SeO_3 (триоксид селена) и TeO_3 существуют соответственно как
11479582
01:41
Расположите SO3, SeO3 и TeO3 в порядке возрастания кислотной силы.
11482112
01:55
948447545
03:47
निम्नलिखित में ऑक्सीकरण अवस्थाओं के प परिवर्तन के क्रम का व व व व व 9003
(I) P में Bi
(II) से व 9003
(i) P में
(II) से
6716. 6316. कितनी हैं?
6316. कितनी हैं?
11
7202:42
Почему хлор, бром и йод имеют степени окисления +3, +5 и +7 в дополнение к -1 и +1 степени окисления?
234825009
04:59
The common oxidation sta te of lanthanides and actinides is-
234829445
02:02
The common oxidation sta te of lanthanides and actinides is-
234829741
05:41
Каково состояние окисления P в PH4
380727274
01:58
Каково состояние окисления P в H4PO4
380727275
01:52
Какова.
637909359
00:53
फॉस्फोरस की न्यूनतम ऑक्सकीकरण अवस्था किसमें है
642737027
01:53
. Elemnets S, Se, Se, Te Cantation States? Что одно из следующих — правильное:
643010566
03:11
Что представляет собой состояние окисления в S H3SO4
643019186
02:27
SOU3 (Selenium Trioxide) и Teo3.
01:45
Реклама
Четана публикационные элементы групп 16, 17 и 18-образных упражнений
Что такое состояние окисления TE в TEO3
03:29
, который в следующем.
 максимальная энтальпия электронного усиления ?
максимальная энтальпия электронного усиления ?02:18
Гидриды группы 16 слабокислые. Правильный порядок кислотности…
02:25
Какой из следующих элементов не проявляет степень окисления +4?
01:48
HI кислота при нагревании с конц. h3S04 формирует
01:57
Озоновый слой разрушается
02:16
Что из следующего происходит в жидком состоянии при комнатной температуре?
02:00
В пиросернистой кислоте степень окисления серы
02:36
Стабильность межгалогенных соединений имеет порядок
01:5908
BrCl реагирует с водой с образованием
01:29
Хлор реагирует с избытком фтора с образованием.
01:53
В межгалогенных соединениях какой из следующих галогенов никогда не…
02:30
- Какой из следующих
имеет одну неподеленную пару электронов?
01:45
В какой из следующих пар молекулы соединены со своими соотв.
 ..
..01:42
Какой благородный газ является наиболее распространенным?
00:42
Озон-:
01:12
Максимальная ковалента сульфу:
03:37
IS Oxygen Shipite-1.
Фтор может находиться в состоянии окисления.
01:23
Максимальное содержание элементов в земной коре:0003
03:29
РЕКЛАМА
РЕКЛАМА
Теллур | химический элемент | Британика
теллур
См. все материалы
- Связанные темы:
- химический элемент элемент кислородной группы
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
 Теллур — серебристо-белый элемент со свойствами, промежуточными между металлами и неметаллами; он составляет примерно одну часть на миллиард земной коры. Подобно селену, он реже встречается в несвязанном виде, чем в виде соединений таких металлов, как медь, свинец, серебро или золото, и получается в основном как побочный продукт рафинирования меди или свинца. Большого применения теллуру не нашли.
Теллур — серебристо-белый элемент со свойствами, промежуточными между металлами и неметаллами; он составляет примерно одну часть на миллиард земной коры. Подобно селену, он реже встречается в несвязанном виде, чем в виде соединений таких металлов, как медь, свинец, серебро или золото, и получается в основном как побочный продукт рафинирования меди или свинца. Большого применения теллуру не нашли.
| atomic number | 52 |
|---|---|
| atomic weight | 127.60 |
| masses of stable isotopes | 120, 122, 123, 124, 125, 126, 128, 130 |
| melting point | 449.8 °C (841.6 °F) |
| boiling point | 989.9 °C (1,813.8 °F) |
| oxidation states | −2, +2, +4, +6 |
| electron configuration | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 S 2 4 P 6 4 D 10 5 S 2 5 P 4 3 P 4 3 P 4 394949494 . Элемент теллур был выделен до того, как стало известно, что он представляет собой элементарную разновидность. Около 1782 года австрийский минералог Франц Йозеф Мюллер фон Райхенштейн работал с рудой, называемой немецким золотом. Из этой руды он получил материал, неподдающийся его попыткам анализа и названный им 9.0310 проблемный металл Викторина «Британника» Викторина «118 названий и символов периодической таблицы» Возникновение и подготовка Спрос на теллур не соответствует спросу на селен. Эти два элемента вместе встречаются во многих рудах; их можно выделить, применяя процессы, описанные в связи с селеном, получая растворы, содержащие соли как селенистой, так и теллуровой кислот, H 2 SeO 3 и H 2 TeO 3 . Япония, США и Канада являются крупнейшими производителями теллура в мире. Физические и химические свойстваВ теллуре практически отсутствует ковалентная связь, необходимая для образования больших кольцевых и цепных молекул за счет катетенации. Элемент кристаллизуется в ромбоэдрической форме. Он серебристо-белый и изоморфен серому селену, т. е. строение и размеры кристаллов очень похожи. Он хрупкий, но не очень твердый. Атомы теллура образуют в кристалле спиральные цепочки с расстояниями Te–Te 3,74 Å. Элемент плохо проводит тепло и хорошо проводит электричество. Теллур горит на воздухе или в кислороде сине-зеленым пламенем, образуя двуокись (TeO 2 ). Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас Несмотря на то, что запасы этого элемента достаточны, не было разработано ни одного одноразового применения, создающего большой спрос на него. Небольшие количества теллура повышают пластичность алюминиевых сплавов, твердость и прочность на растяжение сплавов олова, обрабатываемость нержавеющей стали и меди; в свинце и в марганцево-магниевых сплавах повышает коррозионную стойкость. Теллурид висмута и теллурид свинца представляют собой полупроводниковые материалы, которые использовались в термоэлектрических устройствах либо в качестве источников электричества, либо для целей охлаждения. |

 максимальная энтальпия электронного усиления ?
максимальная энтальпия электронного усиления ? ..
.. При обработке этих растворов серной кислотой из-за малой растворимости выделяется диоксид теллура TeO 2 , а селенистая кислота остается растворенной. Диоксид теллура можно превратить в элементарный теллур обработкой диоксидом серы; электролитический процесс используется для очистки продукта.
При обработке этих растворов серной кислотой из-за малой растворимости выделяется диоксид теллура TeO 2 , а селенистая кислота остается растворенной. Диоксид теллура можно превратить в элементарный теллур обработкой диоксидом серы; электролитический процесс используется для очистки продукта.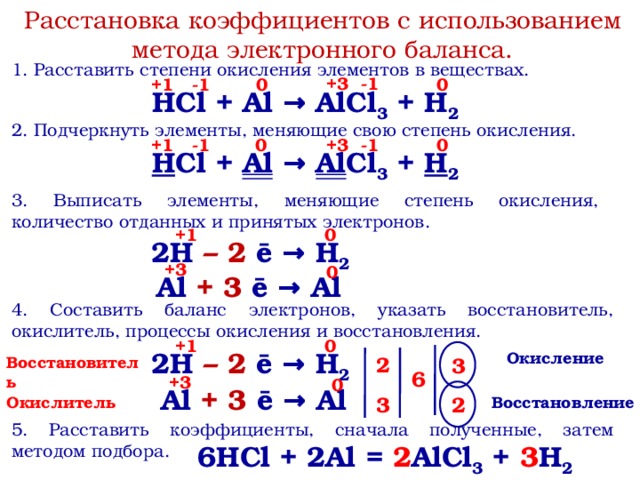 На него не действует соляная кислота, но азотная кислота или царская водка (смесь азотной и соляной кислот) окисляют его до теллуровой кислоты (H 2 TeO 3 ). Он реагирует с галогенами (фтором, хлором, бромом и йодом) с образованием галогенидов и соединяется с большинством металлов при повышенных температурах с образованием теллуридов.
На него не действует соляная кислота, но азотная кислота или царская водка (смесь азотной и соляной кислот) окисляют его до теллуровой кислоты (H 2 TeO 3 ). Он реагирует с галогенами (фтором, хлором, бромом и йодом) с образованием галогенидов и соединяется с большинством металлов при повышенных температурах с образованием теллуридов.