Контрольная работа по «Химии»
Контрольная работа № 4
№11
Какова степень окисления кислорода в молекуле h3O2.?привести примеры реакций в которых проявляются окислительные свойства пероксида водорода
Ответ:
Пероксид водорода (перекись водорода), h3O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата h3O2•2h3O.
Вследствие несимметричности
молекула h3O2 сильно полярна (μ = 0,7·10−29
Кл·м). Относительно высокая вязкость
жидкого пероксида водорода обусловлена
развитой системой водородных связей.
Поскольку атомы кислорода
Химические свойства
Оба атома кислорода
находятся в промежуточной  Наиболее характерны
для них окислительные
Наиболее характерны
для них окислительные
Na_2SO_3 + H_2O_2 = Na_2SO_4 + H_2O
Mn(OH)_2 + H_2O_2 =MnO(OH)_2 + H_2O
При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:
2AgNO_3 + H_2O_2 =2Ag + O_2 + 2HNO_3
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому h3O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на h3O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
2H_2O_2 =2H_2O + O_2
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10−12), и поэтому диссоциирует по двум ступеням:
H_2O_2 ->H^+ +HO_2^-; HO_2^- = H^+ +O_2^{2-}}
При действии концентрированного
раствора Н2O2 на некоторые гидроксиды
в ряде случаев можно выделить
пероксиды металлов, которые можно
рассматривать как соли пероксида
водорода (Li2O2, MgO2 и др. (-2)+H_2O
(-2)+H_2O
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или перекидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная h4PO5 и пероксидисерная h3S2O8 кислоты.
Окислительно-
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
H_2O_2 + 2KI + H_2SO_4 = I_2 + K_2SO_4 + 2H_2O}
При действии сильных окислителей h3O2 проявляет восстановительные свойства, выделяя свободный кислород:
{O_2^{2-} = O_2 + 2e^-}
например:
{3H_2O_2 + 2KMnO_4 = 2MnO_2 + 2KOH + 3O_2 + 2H_2O}
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
5H_2O_2 + 2KMnO_4 + 3H_2SO_4 = 5O_2 + 2MnSO_4 + K_2SO_4 + 8H_2O}
Окисление органических соединений
пероксидом водорода (например, сульфидов
и тиолов) целесообразно проводить
в среде уксусной кислоты.
№23
ЧЕМ ОБЪЯСНЯЕТЬСЯ высокая устойчивость молекулы cl2?Постройте энергетическую диаграмму молекулярных орбиталей для молекулы cl2?
Ответ:
Термическая устойчивость
молекул увеличивается при  Вследствие
этого между атомами в молекулах С12, Вг2
и J2 возникает дополнительное взаимодействие
невалентного характера. Поскольку на
внешнем электронном слое атомов фтора
нет свободных d — ячеек, то в молекулах
F2 дативные связи существовать не могут.
[1]
Вследствие
этого между атомами в молекулах С12, Вг2
и J2 возникает дополнительное взаимодействие
невалентного характера. Поскольку на
внешнем электронном слое атомов фтора
нет свободных d — ячеек, то в молекулах
F2 дативные связи существовать не могут.
[1]
Термическая устойчивость молекул в ряду HF, HC1, НВг, HI резко падает, HI — соединение эндотермическое, разлагается при слабом нагревании. [2]
Термическая устойчивость молекул в ряду HF, HC1, HBr, HI резко падает, HI — соединение эндотермическое, разлагается при слабом нагревании. [3]
Термическая устойчивость молекул в ряду HF, HC1, НВг, HI резко падает, Hi — соединение эндотермическое, разлагается при слабом нагревании. [4]
Термическая устойчивость
молекул увеличивается при  Уменьшение устойчивости
молекул в ряду С 2 — 1з объясняется увеличением
радиусов атомов галогенов, а следовательно,
увеличением длины связи и понижением
ее энергии. [5]
Уменьшение устойчивости
молекул в ряду С 2 — 1з объясняется увеличением
радиусов атомов галогенов, а следовательно,
увеличением длины связи и понижением
ее энергии. [5]
Несмотря на термическую устойчивость молекул, вода весьма активна в химическом отношении. Оксиды многих металлов и неметаллов, соединяясь с водой, образуют основания и кислоты. [6]
Экспериментально было установлено, что термическая устойчивость молекул, содержащих эти связи, меняется в ряду: парафиновые олефиновые ацетиленовые. [7]
Органические ПАВ, вследствие их уникальной дифильности, оказываются поверхностно-активными на большинстве межфазных границ, разумеется, в области термической устойчивости молекул ПАВ. [8]
Термическая устойчивость
молекул в ряду ЬЬО-ЬЬРо падает, реакции
разложения обратимы. Температуры плавления
и кипения, плотность воды ле подчиняются
общей закономерности изменения этих
свойств в ряду FbS-FhPo. Аномальные свойства
воды связаны с малым размером молекул
ЬЬО и образованием водородных связей
между ними.
Термическая устойчивость молекул в ряду НаО — НгРо падает, реакции разложения обратимы. Температуры плавления и кипения, плотность воды не подчиняются общей закономерности изменения этих свойств в ряду HaS-НаРо. Аномальные свойства воды связаны с малым размером молекул НаО и образованием водородных связей между ними. [10]
Термическая устойчивость молекул в ряду ШО-ШРо падает, реакции разложения обратимы. Температуры плавления и кипения, плотность воды ле подчиняются общей закономерности изменения этих свойств в ряду bhS — НзРо. Аномальные свойства воды связаны с малым размером молекул НзО и образованием водородных связей между ними. [11]
Из приведенных примеров
видно, что в каждом отдельном
случае должны быть подобраны условия
процесса десорбции адсорбата. При
этом следует учитывать как термическую
устойчивость молекул адсорбированного
вещества в полостях цеолитов ( если адсор-бат
является целевым продуктом), так и порог
термической устойчивости цеолитов.
Необычно изменяется в ряду галогенов и их термическая устойчивость. Как видно из значений энергий диссоциации, приведенных выше, термическая устойчивость молекул галогенов при переходе от F2 к С12 увеличивается, а затем в ряду С1 — Ь постепенно уменьшается. Последнее легко объясняется возрастанием радиусов атомов в ряду С1 Вг I, вследствие чего ослабляется притяжение электронов, осуществляющих связь в молекуле, к ядрам атомов. Повышение же устойчивости молекул при переходе от Fa к С12 вызвано особенностями химической связи. В то время как в молекуле F2 связь осуществляется только одной парой валентных электронов, в молекулах С12, Вг2 и 12 наряду с этой связью возникают также донорно-акцептор-ные связи. [13]
№35
Какие кислородные соединения образуют сера(6) ,селен(6) ,теллур(6)?
Их получение, строение молекул и свойства. Как изменяют кислотные свойства оксидов ЭО3 и сила соответствующих им кислот в ряду S-Se-Te?
Ответ:
В подгруппу кислорода
входит пять элементов: кислород, сера,
селен, теллур и полоний (радиоактивный
металл). Это р-элементы VI группы периодической
системы Д.И.Менделеева. Они имеют групповое
название – халькогены, что означает «образующие
руды».
Это р-элементы VI группы периодической
системы Д.И.Менделеева. Они имеют групповое
название – халькогены, что означает «образующие
руды».
Свойства элементов подгруппы кислорода
У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns2nр4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно -2 и в соединении со фтором +2. Такие значения степеней окисления следуют из электронного строения халькогенов
У атома кислорода на
2р-подуровне два неспаренных
электрона. Его электроны не могут
разъединяться, поскольку отсутствует
d-подуровень на внешнем (втором) уровне,
т. е. отсутствуют свободные  Таковы же валентность и степени
окисления у атома серы в невозбужденном
состоянии. При переходе в возбужденное
состояние (что имеет место при подводе
энергии, например при нагревании) у атома
серы сначала разъединяются Зр-, а затем
3s-электроны (показано стрелками). Число
неспаренных электронов, а, следовательно,
и валентность в первом случае равны четырем
(например, в SO2), а во втором — шести (например,
в SO3). Очевидно, четные валентности 2, 4,
6 свойственны аналогам серы — селену,
теллуру и полонию, а их степени окисления
могут быть равны -2, +2, +4 и +6.
Таковы же валентность и степени
окисления у атома серы в невозбужденном
состоянии. При переходе в возбужденное
состояние (что имеет место при подводе
энергии, например при нагревании) у атома
серы сначала разъединяются Зр-, а затем
3s-электроны (показано стрелками). Число
неспаренных электронов, а, следовательно,
и валентность в первом случае равны четырем
(например, в SO2), а во втором — шести (например,
в SO3). Очевидно, четные валентности 2, 4,
6 свойственны аналогам серы — селену,
теллуру и полонию, а их степени окисления
могут быть равны -2, +2, +4 и +6.
Водородные соединения
элементов подгруппы кислорода
отвечают формуле Н2R (R — символ элемента):
Н2О, Н2S, Н2Sе, Н2Те. Они называются хальководородами.
При растворении их в воде образуются
кислоты. Сила этих кислот возрастает
с ростом порядкового номера элемента,
что объясняется уменьшением энергии
связи в ряду соединений Н2R. Вода, диссоциирующая
на ионы Н+ и ОН-, является амфотерным электролитом.
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RО2 и RО3-. Им соответствуют кислоты типа Н2RО3 и Н2RО4-. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа Н2RО3 также и восстановительные.
Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства. Так, кислород и теллур — неметаллы, но последний обладает металлическим блеском и проводит электричество.
Оксид серы (VI)— бесцветная жидкость, затвердевающая при температуре 16,8°С в твердую кристаллическую массу. Он очень сильно поглощает влагу, образуя серную кислоту: SO3+Н2O= h3SO4
Таблица 20. Свойства оксидов серы
Растворение оксиды серы (VI)
в воде сопровождается выделением значительного
количества теплоты. Оксид серы (VI) очень
хорошо растворим в концентрированной
серной кислоте. Раствор SO3 в безводной
кислоте называется олеумом. Олеумы
могут содержать до 70% SO3.
Раствор SO3 в безводной
кислоте называется олеумом. Олеумы
могут содержать до 70% SO3.
Получение
1. Оксид серы (VI) получают
окислением сернистого газа
2SO2+O2=2SO3
2. Другим способом окисления
SO2 до SO3 является использование в
качестве окислителя оксида
Образующийся оксид азота (II) при взаимодействии с кислородом воздуха легко и быстро превращается в оксид азота (IV): 2NO+О2=2NO2
который вновь может использоваться в окислении SO2. Следовательно, NO2 выполняет роль переносчика кислорода. Этот способ окисления SO2 до SO3 называется нитрозным. Молекула SO3 имеет форму треугольника, в центре которого
находится атом серы:
Такое строение обусловлено
взаимным отталкиванием связывающих
электронных пар. На их образование
атом серы предоставил шесть внешних
электронов.
Химические свойства
1. SO3 — типичный кислотный оксид.
2. Оксид серы (VI) обладает
свойствами сильного
Применение
Оксид серы (VI) используют для производства серной кислоты. Наибольшее значение имеет контактный способ получения
серной кислоты. По этому способу можно получить h3SO4 любой концентрации, а также олеум. Процесс состоит из трех стадий: получение SO2; окисление SO2 в SO3; получение h3SO4.
Институт неорганической химии СО РАН
Защиты
Брылева Ю.А. (26)
Кабанова Н.А. (17)
Мартынова С.А. (21)
Жданов А.А. (17)
ПОчтарь А.А. (24)
Коротаев Е.В. (19)
Федоренко А.Д. (19)
Федоренко А.Д. (3)
Коротаев Е.В. (4)
Автореферат Чеплаковой А.М. от 24.01.2020г.
Скачать
Уведомление о замене официального оппонента
Скачать
Автореферат Савков Б.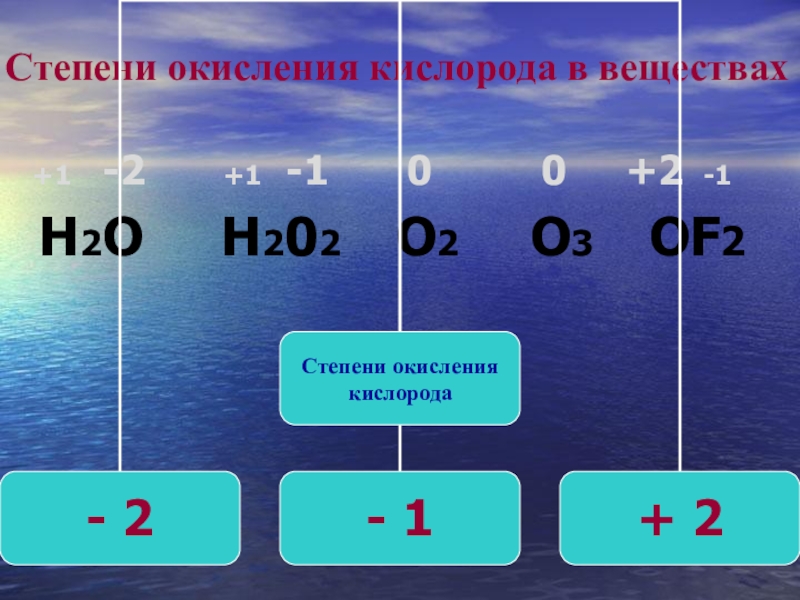 Ю. от 28.11.2017г.
Ю. от 28.11.2017г.
Скачать
Автореферат Абрамова П.А. от 4.06.2019г.
Скачать
Автореферат Барсуковой М.О. от 28.03.2018г.
Скачать
Автореферат Баскаковой К.И. от 13.12 2022 г.
Скачать
Автореферат Берёзина А.С. от 16.02.2018г.
Скачать
Автореферат Брылева К.А. от 17.01.2018г.
Скачать
Автореферат Бурлака П.В. от 14.12.2022 г.
Скачать
Автореферат Бушуева М.Б. от 21.02.2019г.
Скачать
Автореферат ВОЛЖЕНИНА А.В. от 10.10.2019г.
Скачать
Автореферат Галлямова М.Р. от 18.10.2017
Скачать
Автореферат Галлямова М.Р. от 18.10.2017г.
Скачать
Автореферат Городецкого Д.В. от 11.01.2019г.
Скачать
Автореферат Колодина А.Н. от 14.03.2018г.
Скачать
Автореферат Колодина А.Н. от 15.03.2018г.
Скачать
Автореферат Колодина Алексея Никитича от 15.03.2018г.
Скачать
Автореферат Купцова А.В. от 19.10.2018г.
Скачать
Автореферат Ластовка А. В. от 24.01.2020г.
В. от 24.01.2020г.
Скачать
Автореферат Лесникова М.К. от 19.04.2019г.
Скачать
Автореферат Литвиновой Ю.М. от 18.10.2018г.
Скачать
Автореферат Лобяка Е.В. от 11.01.2019г.
Скачать
Автореферат Михайлова А.А. от 14.02.2020г.
Скачать
Автореферат Муравьевой В.К. от 27.09.2019г.
Скачать
Автореферат Огиенко Д.С. от 14.04.2018г.
Скачать
Автореферат от 07.04.2017г.
Скачать
Автореферат от 08.04.2016
Скачать
Автореферат от 13.09.2017г.
Скачать
Автореферат от 20.10.2016г.
Скачать
Автореферат от 24.08.2016
Скачать
Автореферат от 24.08.2016г.
Скачать
Автореферат от 28.09.2016г.
Скачать
Автореферат от 29.06.2017г
Скачать
Автореферат от 29.06.2017г
Скачать
Автореферат Пирязева Д.А. от 23.01.2019г.
Скачать
Автореферат Полюхова Д.М. от 01.04.2021г.
Скачать
Автореферат Порываева А.С. от 01.04.2021г.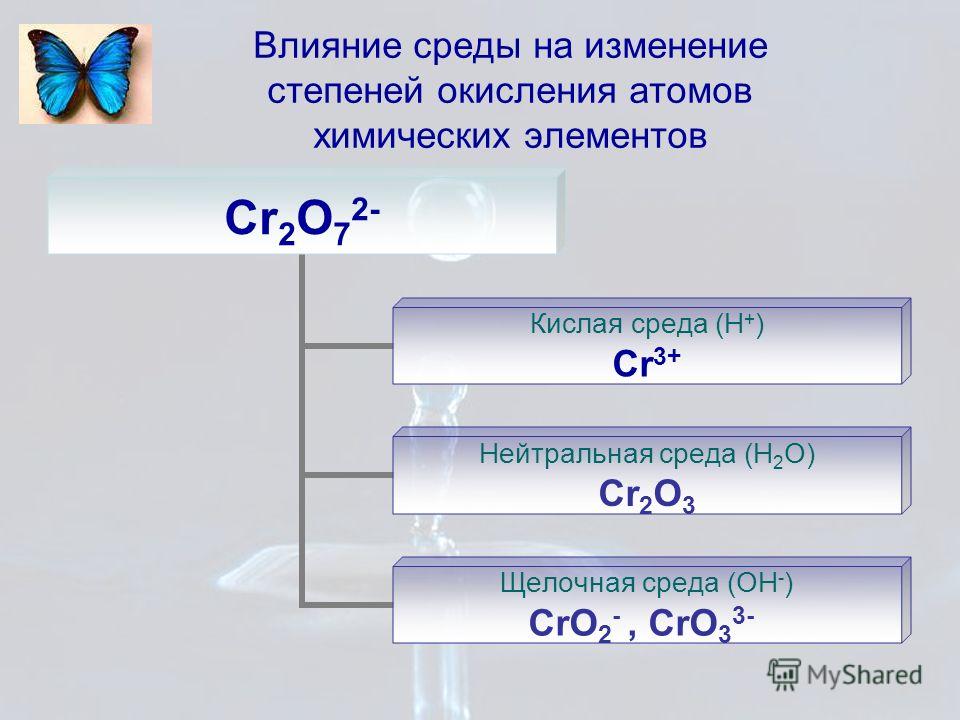
Скачать
Автореферат Ромадиной Е.И. от 05.10.2022 г.
Скачать
Автореферат Сапьяника А.А. от 28.03.2018г.
Скачать
Автореферат Семериковой А.Н. от 23.01.2019г.
Скачать
Автореферат Сотникова А.В. от 04.02.2019г.
Скачать
Автореферат Сыроквашина М.М. от 10.06.2022г.
Скачать
Автореферат Топчиян П.А. от 14.12.2022 г.
Скачать
Автореферат Трифонова В.А. от 18.10.2017
Скачать
Автореферат Фоменко Я.С. от 17.02.2020г.
Скачать
Автореферат Шамшурина М.В. от 12.10.2022
Скачать
Автореферат Шестопалова М.А. от 19.03.2020г.
Скачать
Диссертация в виде научного доклада Аксенова С.М. от 13.12.2022 г.
Скачать
Закллючение диссертационного совета от 19.02.2020г.
Скачать
Заключение диссертационнного совета от 29.01.2020г.
Скачать
Powered by Phoca Download
Видео с вопросами: Определение степени окисления кислорода в перекиси водорода
Стенограмма видео
Какова степень окисления кислорода в перекиси водорода?
Степень окисления элемента, такого как кислород, описывает степень его
окисление. Мы можем думать о степени окисления как о количестве электронов, удаленных из этого
элемент. Степени окисления, иногда называемые степенями окисления, часто либо отрицательные, либо отрицательные.
положительный. Когда степень окисления отрицательная, электроны были получены. Но когда степень окисления положительна, электроны удаляются.
Мы можем думать о степени окисления как о количестве электронов, удаленных из этого
элемент. Степени окисления, иногда называемые степенями окисления, часто либо отрицательные, либо отрицательные.
положительный. Когда степень окисления отрицательная, электроны были получены. Но когда степень окисления положительна, электроны удаляются.
Существует набор правил степени окисления, которые мы можем использовать для предсказания степени окисления
разные элементы. Когда элемент вступает в реакцию в своей элементарной форме, такой как кислород, существующий
как молекулярный кислород, его степень окисления равна нулю. Степень окисления иона — это его заряд, поэтому ион натрия плюс один будет иметь
степень окисления плюс один. Когда элементы образуют нейтральное соединение, сумма степеней окисления должна быть
нуль. Степень окисления щелочных металлов в соединении плюс один. Степень окисления щелочноземельных металлов в соединении плюс два.
Когда галогены появляются в соединениях, их степени окисления чаще всего минус один, с некоторыми исключениями. Когда водород появляется в соединении, его степень окисления часто равна плюс единице. Однако в гидридах металлов, таких как гидрид магния, водород подвергается окислению. состояние минус один. Кислород чаще всего имеет степень окисления минус два, например, в соединении вода. В h3O присутствуют два атома водорода со степенями окисления плюс один и кислород имеет степень окисления минус два. В целом сумма степеней окисления для этого нейтрального соединения будет равна нулю.
Однако мы обнаружили, что кислород иногда принимает другие степени окисления в
пероксиды, супероксиды и дифторид кислорода. В перекисном ионе O2 2- кислород имеет степень окисления минус один. В супероксидах, таких как супероксид натрия, кислород имеет степень окисления минус
одна половина. В дифториде кислорода кислород имеет необычную степень окисления плюс один.
Используя эти правила, определим степень окисления кислорода в водороде перекись. Перекись водорода имеет химическую формулу h3O2. Водород будет иметь степень окисления плюс один. Как следует из названия, это соединение является перекисью, поэтому кислород будет иметь степень окисления минус один.
Мы можем подтвердить это, найдя сумму степеней окисления, начиная с двух присутствуют водороды. Общий вклад водородов плюс два. Два атома кислорода в перекиси имеют степени окисления минус один. Это дает общий вклад кислорода минус два. Сумма этих степеней окисления должна давать ноль для этого нейтрального соединения. Получаем, что сумма плюс два и минус два равна нулю. Следовательно, степень окисления кислорода в перекиси водорода равна минус единице.
Степень окисления кислорода в \\[{H_2}{O_2}\\] равна :A . $ + 1$В . $ — 1$С. $ + 2$D .
долл. США определяется как общее число электронов, которое атом отдает или принимает для образования химической связи с другим атомом. Когда степень окисления любого атома изменяется во время реакции, это означает, что он дает информацию о переносе электронов. Элемент может иметь несколько степеней окисления.
Когда степень окисления любого атома изменяется во время реакции, это означает, что он дает информацию о переносе электронов. Элемент может иметь несколько степеней окисления.
Полный пошаговый ответ:
Атомы водорода обычно имеют степень окисления $ + 1$, за исключением гидридов металлов, где она равна $ — 1$, а степень окисления атомов кислорода обычно равна $ — 2$, но это не одно и то же во всех молекулах. В перекиси водорода степень окисления водорода составляет $ + 1$, но его степень окисления равна $-1$, когда водород соединяется с менее электроотрицательными элементами. Так как здесь в перекиси водорода атом кислорода более электроотрицателен, чем водород, то степень окисления атома водорода будет $ + 1$. Теперь рассчитаем степень окисления кислорода в перекиси водорода.
Пусть степень окисления атомов кислорода в перекиси водорода равна x. Мы знаем, что сумма степеней окисления всех атомов в нейтральном соединении равна нулю. Мы можем рассчитать степень окисления атома кислорода в \[{H_2}{O_2}\], взяв сумму степеней окисления всех атомов \ [{H_2}{O_2}\].
