Характеристика химических свойств железа и его соединений: Fe2O3, Fe3O4, Fe(OH)2
Железо — восьмой элемент четвёртого периода в таблице Менделеева. Его номер в таблице (также его называют атомным) 26, что соответствует числу протонов в ядре и электронов в электронной оболочке. Обозначается первыми двумя буквами своего латинского эквивалента — Fe (лат. Ferrum — читается как «феррум»). Железо — второй по распространённости элемент в земной коре, процентное содержание — 4,65% (самый распространённый — алюминий, Al). В самородном виде данный металл встречается достаточно редко, чаще его добывают из смешанной руды с никелем.
ВконтактеFacebookTwitterGoogle+Мой мир
Какова же природа данного соединения? Железо как атом состоит из металлической кристаллической решётки, за счёт чего обеспечивается твёрдость соединений, содержащих этот элемент, и молекулярная стойкость. Именно в связи с этим данный металл — типичное твёрдое тело в отличие, например, от ртути.
Железо как простое вещество — металл серебристого цвета c типичными для этой группы элементов свойствами: ковкость, металлический блеск и пластичность. Помимо этого, железо обладает высокой реакционной активностью. О последнем свойстве свидетельствует тот факт, что железо очень быстро подвергается коррозии при наличии высокой температуры и соответствующей влажности. В чистом кислороде этот металл хорошо горит, а если раскрошить его на очень мелкие частицы, то они будут не просто гореть, а самовозгораться.
Помимо этого, железо обладает высокой реакционной активностью. О последнем свойстве свидетельствует тот факт, что железо очень быстро подвергается коррозии при наличии высокой температуры и соответствующей влажности. В чистом кислороде этот металл хорошо горит, а если раскрошить его на очень мелкие частицы, то они будут не просто гореть, а самовозгораться.
Зачастую железом мы называем не чистый металл, а его сплавы, содержащих углерод ©, например, сталь (<,2,14% C) и чугун (>,2,14% C). Также важное промышленное значение имеют сплавы, в которые добавляются легирующие металлы (никель, марганец, хром и другие), за счёт них сталь становится нержавеющей, т. е. легированной. Таким образом, исходя из этого становится понятным, какое обширное промышленное применение имеет этот металл.
Содержание
Характеристика Fe
- M (молярная масса) железа — 55, 872 а. е. м. В школьной химии это значение часто округляют: M (Fe) = 56 г/моль
- Электронная конфигурация валентного уровня: 3d6 4s2.
 Это значит, что на четвёртом электронном s-уровне находятся 2 электрона, а на третьем d-уровне — 6. Соответственно, наиболее устойчивым состоянием, с химической точки зрения, является: изначальное (все электроны атома находятся на своих электронных орбиталях), промежуточное (два или три электрона с валентного уровня переходят на электронные орбитали окислителя), в этом случае электроны могут как бы «метаться», не зная оставаться ли им на орбитали железа или переходить на электронное облако окислителя, сильно окисленное (все электроны переходят на электронные орбитали окислителя)
Это значит, что на четвёртом электронном s-уровне находятся 2 электрона, а на третьем d-уровне — 6. Соответственно, наиболее устойчивым состоянием, с химической точки зрения, является: изначальное (все электроны атома находятся на своих электронных орбиталях), промежуточное (два или три электрона с валентного уровня переходят на электронные орбитали окислителя), в этом случае электроны могут как бы «метаться», не зная оставаться ли им на орбитали железа или переходить на электронное облако окислителя, сильно окисленное (все электроны переходят на электронные орбитали окислителя) - Степени окисления железа: 0, +2, +3, +6
- Температура плавления железа — 1812 K (1538,85 °C)
- Температура кипения — 3134 K (2861 °C)
Химические свойства железа
Рассмотрим подробнее особенности этого элемента.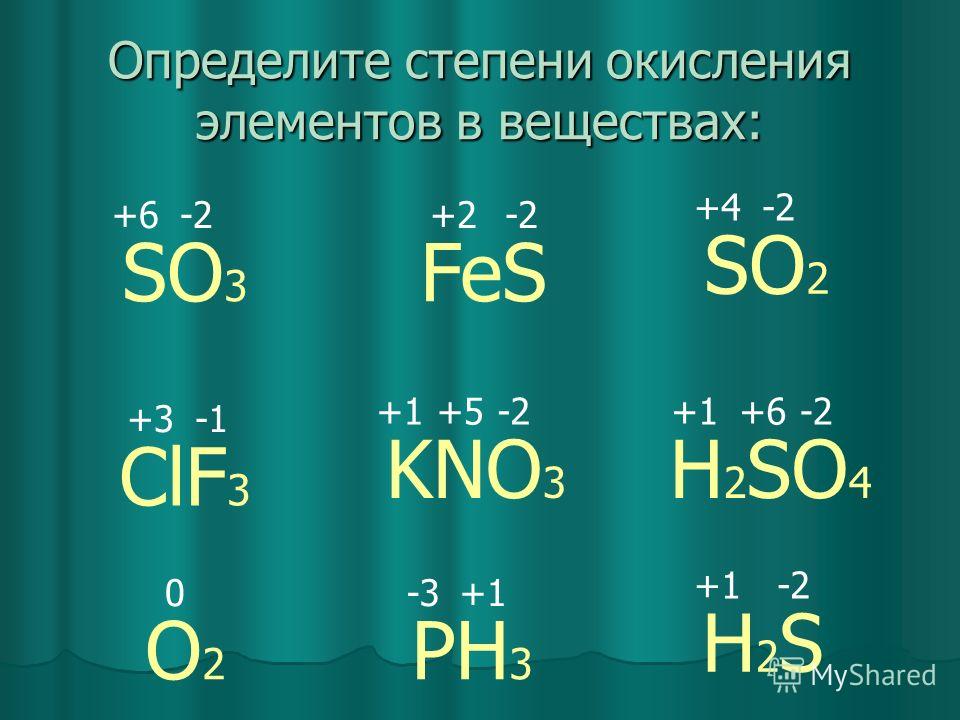
Свойства простого вещества
- Окисление на воздухе при высокой влажности (коррозийный процесс):
4Fe+3O2+6h3O = 4Fe (OH)3 — гидроксид (гидроокись) железа (III)
- Горение железной проволоки в кислороде с образованием смешанного оксида (в нём присутствует элемент и со степенью окисления +2, и со степенью окисления +3):
3Fe+2O2 = Fe3O4 (железная окалина). Реакция возможна при нагревании до 160 ⁰C.
- Взаимодействие с водой при высокой температуре (600−700 ⁰C):
3Fe+4h3O = Fe3O4+4h3
- Реакции с неметаллами:
а) Реакция с галогенами (Важно! При данном взаимодействии приобретает степень окисления элемента +3)
2Fe+3Cl2 = 2FeCl3 — хлорид трёхвалентного железа
2Fe+3Br2 = 2FeBr3 — бромид железа (III)
б) Реакция с серой (Важно! При данном взаимодействии элемент имеет степень окисления +2)
Fe+S = FeS
Сульфид железа (III) — Fe2S3 можно получить в ходе другой реакции:
Fe2O3+ 3h3S=Fe2S3+3h3O
в) Образование пирита
Fe+2S = FeS2 — пирит. Обратите внимание на степень окисления элементов, составляющих данное соединение: Fe (+2), S (-1).
Обратите внимание на степень окисления элементов, составляющих данное соединение: Fe (+2), S (-1).
- Взаимодействие с солями металлов, стоящими в электрохимическом ряду активности металлов справа от Fe:
Fe+CuCl2 = FeCl2+Cu — хлорид железа (II)
- Взаимодействие с разбавленными кислотами (например, соляной и серной):
Fe+HBr = FeBr2+h3
Fe+HCl = FeCl2+ h3
Обратите внимание, что в этих реакция получается железо со степенью окисления +2.
- В неразбавленных кислотах, которые являются сильнейшими окислителями, реакция возможна только при нагревании, в холодных кислотах металл пассивируется:
Fe+h3SO4 (концентрированная) = Fe2 (SO4)3+3SO2+6h3O
Fe+6HNO3 = Fe (NO3)3+3NO2+3h3O
- Амфотерные свойства железа проявляются только при взаимодействии с концентрированными щелочами:
Fe+2KOH+2h3O = K2[Fe (OH)4]+h3 — тетрагидроксиферрат (II) калия выпадает в осадок.
youtube.com/embed/hsB98LzxUHA» allowfullscreen=»allowfullscreen»>Процесс производства чугуна в доменной печи
- Обжиг и последующее разложение сульфидных и карбонатных руд (выделение оксидов металла):
FeS2 >, Fe2O3 (O2, 850 ⁰C, -SO2). Эта реакция также является первым этапом промышленного синтеза серной кислоты.
FeCO3 >, Fe2O3 (O2, 550−600 ⁰C, -CO2).
- Сжигание кокса (в избытке):
С (кокс)+O2 (возд.) >, CO2 (600−700 ⁰C)
CO2+С (кокс) >, 2CO (750−1000 ⁰C)
- Восстановление руды, содержащий оксид, угарным газом:
Fe2O3 >, Fe3O4 (CO, -CO2)
Fe3O4 >, FeO (CO, -CO2)
FeO >, Fe (CO, -CO2)
- Науглероживание железа (до 6,7%) и расплавление чугуна (t⁰плавления — 1145 ⁰C)
Fe (твёрдый)+С (кокс) >, чугун. Температура реакции — 900−1200 ⁰C.
В чугуне всегда присутствует в виде зёрен цементит (Fe2C) и графит.
Характеристика соединений, содержащих Fe
Изучим особенности каждого соединения отдельно.
Fe3O4
Смешанный или двойной оксид железа, имеющий в своём составе элемент со степенью окисления как +2, так и +3. Также Fe3O4 называют железной окалиной. Это соединение стойко переносит высокие температуры. Не вступает реакцию с водой, парами воды. Подвергается разложению минеральными кислотами. Может быть подвергнуто восстановлению водородом либо железом при высокой температуре. Как вы могли понять из вышеизложенной информации, является промежуточным продуктом в цепочке реакция промышленного производства чугуна.
Непосредственно же железную окалину применяют в производстве красок на минеральной основе, цветного цемента и изделий из керамики. Fe3O4 — это то, что получается при чернении и воронении стали. Получают смешанный оксид путём сгорания железа на воздухе (реакция приведена выше). Руда, содержащая оксиды, является магнетитом. Если у вас возникло желание насладиться безупречным секс досугом, вас определенно заинтересуют топовые индивидуалки Краснодара .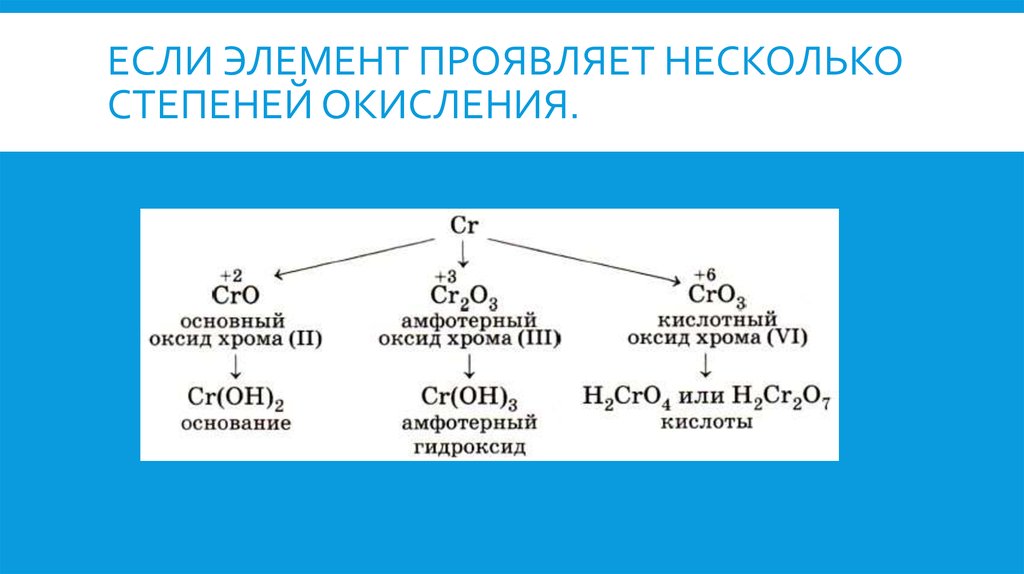 Вы можете фильтровать шлюх по обширному каталогу параметров, указывая их габариты, размер бюста, а также район!
Вы можете фильтровать шлюх по обширному каталогу параметров, указывая их габариты, размер бюста, а также район!
Fe2O3
Оксид железа (III), тривиальное название — красный железняк, соединение красно-коричневого цвета. Устойчиво к воздействию высоких температур. В чистом виде не образуется при окислении железа кислородом воздуха. Не вступает в реакцию с водой, образует гидраты, выпадающие в осадок. Плохо реагирует с разбавленными щелочами и кислотами. Может сплавляться с оксидами других металлов, образуя шпинели — двойные оксиды.
Красный железняк применяется в качестве сырья при промышленном получении чугуна доменным способом. Также ускоряет реакцию, то есть является катализатором, в аммиачной промышленности. Применяется в тех же областях, что и железная окалина. Плюс к этому использовался как носитель звука и картинки на магнитных лентах.
FeOh3
Гидроксид железа (II), соединение, обладающее как кислотными, так и основными свойствами, преобладают последние, то есть, является амфотерным. Вещество белого цвета, которое быстро окисляется на воздухе, «буреет», до гидроокиси железа (III). Подвержено распаду при воздействии температуры. Вступает в реакцию и со слабыми растворами кислот, и со щелочами. В воде не растворим. В реакции выступает в роли восстановителя. Является промежуточным продуктом в реакции коррозии.
Вещество белого цвета, которое быстро окисляется на воздухе, «буреет», до гидроокиси железа (III). Подвержено распаду при воздействии температуры. Вступает в реакцию и со слабыми растворами кислот, и со щелочами. В воде не растворим. В реакции выступает в роли восстановителя. Является промежуточным продуктом в реакции коррозии.
Обнаружение ионов Fe2+ и Fe3+ («качественные» реакции)
Распознавание ионов Fe2+ и Fe3+ в водных растворах производят с помощью сложных комплексных соединений — K3[Fe (CN)6], красная кровяная соль, и K4[Fe (CN)6], жёлтая кровяная соль, соответственно. В обеих реакциях выпадает осадок насыщенного синего цвета с одинаковым количественным составом, но различным положением железа с валентностью +2 и +3. Этот осадок также часто называют берлинской лазурью или турнбуллевой синью.
Реакция, записанная в ионном виде
Fe2++K++[Fe (CN)6]3- K+1Fe+2 [Fe+3 (CN)6]
Fe3++K++[Fe (CN)6]4- K+1Fe+3 [Fe+2 (CN)6]
Хороший реактив для выявления Fe3+ тиоцианат-ион (NCS-)
Fe3++ NCS- [Fe (NCS)6]3- эти соединения имеют ярко-красную («кровавую») окраску.
Этот реактив, например, тиоцианат калия (формула — KNCS), позволяет определить даже ничтожно малую концентрацию железа в растворах. Так, он способен при исследовании водопроводной воды определить, не заржавели ли трубы.
ВконтактеFacebookTwitterGoogle+Мой мир
Железо — Химики
Железо — элемент восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe. Один из самых распространённых в земной коре металлов. Простое вещество железо— ковкий металл серебристо-белого
цвета с высокой химической реакционной способностью: железо быстро корродирует
при высоких температурах или при высокой влажности на воздухе. Собственно, железом обычно называют его сплавы с малым содержанием примесей, которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь и чугун, а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека. В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет большую часть земного ядра.
ПОЛЧЕНИЕ В промышленности железо получают из железной руды, в основном из гематита и магнетита. Существуют различные способы извлечения железа из руд.
Наиболее распространённым является доменный процесс. Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха. В печи углерод в виде кокса окисляется до монооксида углерода. Данный оксид образуется при горении в недостатке кислорода: 2C+O2 = 2CO В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через оксид железа(III): 3CO+Fe2O3 = 2Fe+3CO2 Флюс добавляется для избавления от нежелательных примесей в добываемой руде. Типичный флюс содержит известняк и доломит.Для устранения других примесей используют другие флюсы. Действие флюса заключается в том, что при его нагревании он разлагается до его оксида: CaCO3 = CaO+CO2 Оксид кальция соединяется с диоксидом кремния, образуя шлак — метасиликат кальция: CaO+SiO2 = CaSiO3 Шлак, в отличие от диоксида кремния, плавится в печи.
Излишки углерода и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используются и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо: Fe2O3+3h3=2Fe+3h3O При этом не происходит загрязнения железа такими примесями,
как сера и фосфор, которые являются обычными примесями в каменном угле. Химически чистое железо получается электролизом растворов его солей.
ФИЗИЧЕСКИЕ СВ-ВА Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов,обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности. Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения. Железо относится к умеренно тугоплавким металлам. В ряду
стандартных электродных потенциалов железо стоит до водорода и легко реагирует
с разбавленными кислотами. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
ХИМИЧЕСКИЕ СВ-ВА Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель. Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe3+ нацело гидролизуются даже в кислой среде. Fe(OH)3 растворяется (и то не полностью), только в концентрированных щелочах. Fe2O3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли не существующей в свободном виде кислоты HFeO2): Fe2O3 + 2NaOH =2NaFeO2 + h3O Железо (+3) чаще всего проявляет слабые окислительные свойства. Степени окисления +2 и +3 легко переходят между собой при
изменении окислительно-восстановительных условий. Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe+2(Fe+3O2)2. Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями. Известны также степени окисления −2 (тетракарбонилферрат натрия), −1, 0 (пентакарбонил железа), +1, +4, +5.
Свойства простого вещества
При хранении на воздухе при температуре до 200 °C железо
постепенно покрывается плотной плёнкой оксида, препятствующей дальнейшему
окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины,
который не препятствует доступу кислорода и влаги к металлу и его разрушению.
Ржавчина не имеет постоянного химического состава, приближённо её химическую
формулу можно записать как Fe2O3·xh3O.
Взаимодействует с кислотами С соляной кислотой: Fe + 2HCl =FeCl2 + h3 С разбавленной серной кислотой: Fe + h3SO4 =FeSO4 + h3 Концентрированные азотная и серная кислоты пассивируют железо. C концентрированной серной кислотой взаимодействует только при нагревании: 2Fe + 6h3SO4 = Fe2(SO4)3 + 3SO2 + 6h3O Взаимодействие с кислородом: Железо горит в кислороде, нагретое горит на воздухе, пирофорное — на воздухе без нагревания: 3Fe + 2O2 = Fe3O4 Пропускание кислорода или воздуха через расплавленное железо: 2Fe + O2 =2FeO Взаимодействие с порошком серы при нагревании: Fe + S = FeS Взаимодействие с галогенами при нагревании: Горение в хлоре: 2Fe + 3Cl2 =2FeCl3 При повышенном давлении паров брома: 2Fe + 3Br2 = 2FeBr3 Взаимодействие с йодом: 3Fe + 4I2 =Fe3I8 Взаимодействие с неметаллами: С азотом при нагревании: 6Fe + N2 =2Fe3N С фосфором при нагревании: Fe + P = FeP 2Fe + P =Fe2P 3Fe + P = Fe3P С углеродом: 3Fe + C = Fe3C С кремнием: Fe + = FeSi Взаимодействие раскалённого железа с водяным паром: 3Fe + 4h3O = Fe3O4 + 4h3 Железо восстанавливает металлы, которые в ряду активности стоят правее него, из растворов солей: Fe + CuSO4 =FeSO4 + Cu Железо восстанавливает соединения железа(III): Fe + 2FeCl3 = 3FeCl2 При повышенном давлении металлическое железо реагирует с
оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко
летучий пентакарбонил железа Fe(CO)5. Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
Соединения железа (II) Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II): 4FeCl2 + O2 + 2h3O =4Fe(OH)Cl2 Из солей железа(II) в водных растворах устойчива соль Мора —
двойной сульфат аммония и железа(II) (Nh5)2Fe(SO4)2·6Н2O. Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок гексацианоферрата (III) калия-железа (II) (берлинская лазурь),который внутримолекулярно перегруппировывается в гексацианоферрат (II) калия-железа (III). Фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9)[23].
Соединения железа (III) Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами: 2Fe(OH)3 + 3h3SO4 = Fe2(SO4)3 + 6h3O Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+, как правило, окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет. Ион Fe3+ полностью гидролизуется даже в кислой среде. При pH>4 этот ион практически полностью осаждается в виде Fe(OH)3: Fe+ 3h3O = Fe(OH)3 + 3H При частичном гидролизе иона Fe3+ образуются многоядерные
оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет. Кислотные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей: Fe(OH)3 + 3KOH = K3[Fe(OH)6] Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3. При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты: Fe2O3 + 2NaOH = 2NaFeO2 + h3O Соединения железа(III) в растворах восстанавливаются металлическим железом: Fe + 2FeCl3 = 3FeCl2 Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (Nh5)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений
железа(III) используют качественную реакцию ионов Fe3+ с неорганическими
тиоцианатами SCN−. При этом образуется смесь ярко-красных роданидных комплексов
железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]-[25]. Количественно ионы Fe3+ определяют по образованию красных (в слабокислой среде) или жёлтых (в слабощелочной среде) комплексов с сульфосалициловой кислотой. Эта реакция требует грамотного подбора буферов, так как некоторые анионы (в частности, ацетат) образуют с железом и сульфосалициловой кислотой смешанные комплексы со своими оптическими характеристиками.
Соединения железа (VI) Ферраты — соли не существующей в свободном виде железной кислоты h3FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи[26]: 2Fe(OH)3 + 3Cl2 + 10KOH= 2K2FeO4 + 6KCl + 8h3O Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде: Fe + 2KOH + 2h3O=K2FeO4 + 3h3 Ферраты — сильные окислители. 4FeO4+ 20H= 4Fe+ 3O2 + 10h3O Окислительные свойства ферратов используют для обеззараживания воды.
ПРИМЕНЕНИЕ Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса. Уникальные ферромагнитные свойства ряда сплавов на основе
железа способствуют их широкому применению в электротехнике для магнитопроводов
трансформаторов и электродвигателей. Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат. Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах. Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий. |
Железо. Химия железа и его соединений
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Положение железа в периодической системе химических элементов
Электронное строение железа
Физические свойства
Нахождение в природе
Способы получения
Качественные реакции
Химические свойства
1. Взаимодействие с простыми веществами
1.1. Взаимодействие с галогенами
1.2. Взаимодействие с серой
1.3. Взаимодействие с фосфором
1.4. Взаимодействие с азотом
1.5. Взаимодействие с углеродом
1.6. Горение
2. Взаимодействие со сложными веществами
2.1. Взаимодействие с водой
2.2. Взаимодействие с минеральными кислотами
2.3. Взаимодействие с серной кислотой
2.4. Взаимодействие с азотной кислотой
2.5. Взаимодействие с сильными окислителями
2.6. Взаимодействие с оксидами и солями
Оксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами
2. Взаимодействие с кислотами
Взаимодействие с кислотами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Взаимодействие с кислотами
6. Взаимодействие с восстановителями
Оксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с щелочами и основными оксидами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (III)
6. Взаимодействие с солями более летучих кислот
Оксид железа (II, III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с сильными кислотами-окислителями
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (II, III)
Гидроксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
Взаимодействие с кислотными оксидами
3. Восстановительные свойства
4. Разложение при нагревании
Гидроксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Взаимодействие с щелочами
4. Разложение при нагревании
Соли железа
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии:
+26Fe 1s22s22p63s23p64s23d6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.
(изображение с портала vchemraznica.ru)
Температура плавления 1538оС, температура кипения 2861оС.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).
(изображение с портала karatto.ru)
Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.
(изображение с портала livemaster.ru)
Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс. Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
3CO + Fe2O3 → 3CO2 + 2Fe
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
3Fe2O3 + CO → 2Fe3O4 + CO2
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Fe3O4 + CO → 3FeO + CO2
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
CaCO3 → CaO + CO2
Оксид железа (II) опускается в область с более высоких температур (до 1200oC), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO
(изображение с портала 900igr. net)
net)
2. Также железо получают прямым восстановлением из оксида водородом:
Fe2O3 + 3H2 → 2Fe + 3H2O
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами. При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например, хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами. При этом образуется бурый осадок гидроксида железа (III).
Например, хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например, хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно, но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами.
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 → FeI2
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
3Fe + 2O2 → Fe3O4
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900оС с водяным паром:
3Fe0 + 4H2+O → Fe+33O4 + 4H20
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
2. 2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например, железо бурно реагирует с соляной кислотой:
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe + 4HNO3(разб.гор.) → Fe(NO3)3 + NO + 2H2O
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe + 30HNO3(оч. разб.) → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например, при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe + 2KOH + 3KNO3 → 3KNO2 + K2FeO4 + H2O
2.6. Железо восстанавливает менее активные металлы из оксидов и солей.
Например, железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример: простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3 + Fe → 3Fe(NO3)2
2FeCl3 + Fe → 3FeCl2
Fe2(SO4)3 + Fe → 3FeSO4
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами:
1. Частичным восстановлением оксида железа (III).
Например, частичным восстановлением оксида железа (III) водородом:
Fe2O3 + H2 → 2FeO + H2O
Или частичным восстановлением оксида железа (III) угарным газом:
Fe2O3 + CO → 2FeO + CO2
Еще один пример: восстановление оксида железа (III) железом:
Fe2O3 + Fe → 3FeO
2. Разложение гидроксида железа (II) при нагревании:
Fe(OH)2 → FeO + H2O
Химические свойстваОксид железа (II) — типичный основный оксид.
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например, оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли.
Например, оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например, при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
FeO + 4HNO3(конц.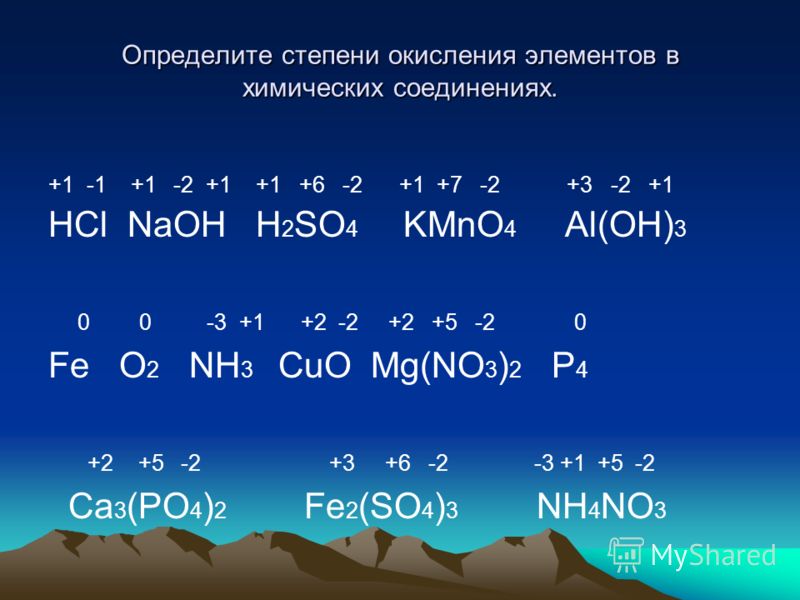 ) → NO2 + Fe(NO3)3 + 2H2O
) → NO2 + Fe(NO3)3 + 2H2O
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
3FeO + 10HNO3(разб.) → 3Fe(NO3)3 + NO + 5H2O
5. Оксид железа (II) проявляет слабые окислительные свойства.
Например, оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами:
1. Окисление оксида железа (II) кислородом.
4FeO + O2 → 2Fe2O3
2. Разложение гидроксида железа (III) при нагревании:
Разложение гидроксида железа (III) при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Химические свойства
Оксид железа (III) – амфотерный.
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например, оксид железа (III) взаимодействует с азотной кислотой:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит).
Например, оксид железа (III) взаимодействует с гидроксидом натрия:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
3. Оксид железа (III) не взаимодействует с водой.
Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например, хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
5. Оксид железа (III) проявляет окислительные свойства.
Например, оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Fe2O3 + 3СO → 2Fe + 3CO2
Также оксид железа (III) восстанавливается водородом:
Fe2O3 + 3Н2 → 2Fe + 3H2O
Железом можно восстановить оксид железа только до оксида железа (II):
Fe2O3 + Fe → 3FeO
Оксид железа (III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
Fe2O3 + 2Al → 2Fe + Al2O3
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например, с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами:
1. Горение железа на воздухе:
3Fe + 2O2 → Fe3O4
2. Частичное восстановление оксида железа (III) водородом или угарным газом:
3Fe2O3 + Н2 → 2Fe3O4 + H2O
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
3Fe + 4H2O(пар) → Fe3O4 + 4H2
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например, оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Еще пример: оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
Fe3O4 + 4H2SO4(разб.) → Fe2(SO4)3 + FeSO4 + 4Н2О
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например, железная окалина окисляется концентрированной азотной кислотой:
Fe3O4 + 10HNO3(конц. ) → NO2↑ + 3Fe(NO3)3 + 5H2O
) → NO2↑ + 3Fe(NO3)3 + 5H2O
Разбавленной азотной кислотой окалина окисляется при нагревании:
3Fe3O4 + 28HNO3(разб.) → 9Fe(NO3)3 + NO + 14H2O
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
2Fe3O4 + 10H2SO4(конц.) → 3Fe2(SO4)3 + SO2 + 10H2O
Также окалина окисляется кислородом воздуха:
4Fe3O4 + O2(воздух) → 6Fe2O3
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
выше).
5. Железная окалина проявляет окислительные свойства.
Например, оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Fe3O4 + 4CO → 3Fe + 4CO2
Также железная окалина восстанавливается водородом:
Fe3O4 + 4H2 → 3Fe + 4H2O
Оксид железа (II, III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
3Fe3O4 + 8Al → 9Fe + 4Al2O3
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например, с йодоводородом:
Fe3O4 + 8HI → 3FeI2 + I2 + 4H2O
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например, хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например, хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства, а именно реагирует с кислотами. При этом образуются соответствующие соли.
При этом образуются соответствующие соли.
Например, гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
Fe(OH)2 + SO3 → FeSO4 + 2H2O
3. Гидроксид железа (II) проявляет сильные восстановительные свойства, и реагирует с окислителями. При этом образуются соединения железа (III).
При этом образуются соединения железа (III).
Например, гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Гидроксид железа (II) взаимодействует с пероксидом водорода:
2Fe(OH)2 + H2O2 → 2Fe(OH)3
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2 + 4H2SO4(конц.) → Fe2(SO4)3 + SO2 + 6H2O
4. Гидроксид железа (II) разлагается при нагревании:
Fe(OH)2 → FeO + H2O
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe3+ + H2O ↔ FeOH2+ + H+
II ступень: FeOH2+ + H2O ↔ Fe(OH)2+ + H+
III ступень: Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Fe2(SO4)3 + 6NaHSO3 → 2Fe(OH)3 + 6SO2 + 3Na2SO4
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + CO2↑ + 6NaBr
2Fe(NO3)3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaNO3 + 3CO2↑
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
Fe2(SO4)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например: хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами.
Например, хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы. Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее. Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например, хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
2FeCl3 + Cu → 2FeCl2 + CuCl2
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
2Fe(NO3)3 + 3Zn → 2Fe + 3Zn(NO3)2
Понравилось это:
Нравится Загрузка. ..
..
между Fe2O3 и FE3O4
Основное различие — FE
2 O 3 против FE 3 O 4 Fe 2 O 3 и Fe 3 O 4 — это два общих. оксиды железа, встречающиеся в природе вместе с некоторыми примесями. Fe 2 O 3 также известен как гематит, минерал, из которого путем обработки может быть получен чистый Fe 2 O 3 , а Fe 3 O 4 известен как магнетит по той же причине. Эти минералы являются сырьем для производства чистого металлического железа. Есть много физических и структурных различий между Fe 2 O 3 и Fe 3 O 4 . Основное различие между Fe 2 O 3 и Fe 3 O 4 заключается в том, что Fe 2 O 3 является парамагнитным минералом, имеющим только степень окисления Fe 2+ 0. O 4 представляет собой ферромагнитный материал, имеющий степени окисления Fe 2+ и Fe 3+ .
O 4 представляет собой ферромагнитный материал, имеющий степени окисления Fe 2+ и Fe 3+ .
Основные сферы деятельности
1. Что такое Fe 2 O 3
— Определение, свойства и применения
2. Что является Fe 3 O 4
— Определение, химические свойства
3. Различи O 3 и Fe 3 O 4
– Сравнение основных различий
Основные термины: ферромагнитный, гематит, оксид, оксид9 железа, магнетит0077
Что такое Fe
2 O 3 Fe 2 O 3 оксид железа(III). Это неорганическое соединение (один из трех основных оксидов железа). Fe 2 O 3 встречается в природе в виде минерала гематита. Гематит является основным источником железа для сталелитейной промышленности.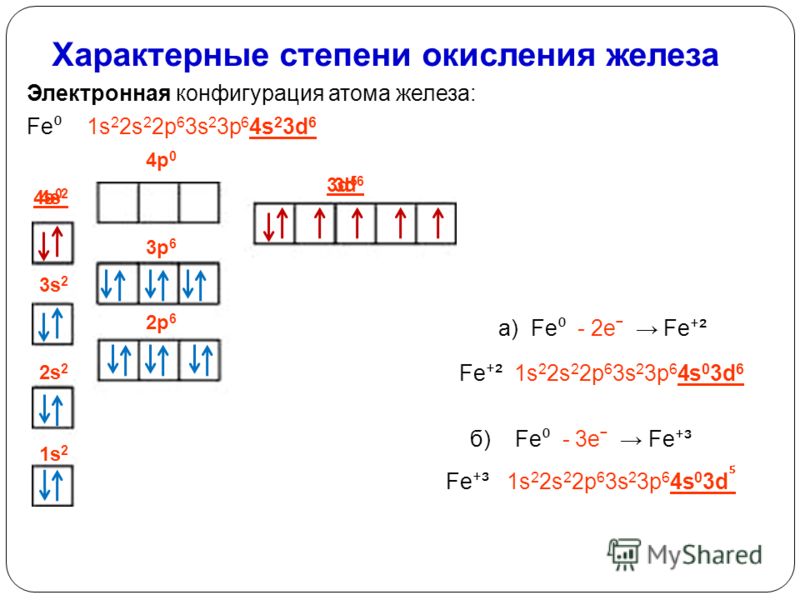 Fe 2 O 3 представляет собой темно-красное (кирпично-красное) твердое вещество без запаха. Fe 2 O 3 является парамагнитным. Это означает, что его может притягивать сильное внешнее магнитное поле. Это соединение легко подвергается воздействию кислот. Альтернативное название Fe 2 O 3 «ржавчина».
Fe 2 O 3 представляет собой темно-красное (кирпично-красное) твердое вещество без запаха. Fe 2 O 3 является парамагнитным. Это означает, что его может притягивать сильное внешнее магнитное поле. Это соединение легко подвергается воздействию кислот. Альтернативное название Fe 2 O 3 «ржавчина».
Рис. 1: Чистое Fe 2 O 3 Частицы
Молярная масса Fe 2 O 3 составляет 159,687 г/моль. Температура плавления этого соединения 1565 o °С; при более высоких температурах он обычно разлагается. Fe 2 O 3 хорошо растворим в кислотах и растворах сахаров. Он нерастворим в воде.
Fe 2 O 3 существует в двух основных полиморфах; альфа-фаза и гамма-фаза. Альфа Fe 2 O 3 имеет ромбоэдрическую структуру. Эта структура является наиболее распространенной формой Fe 2 O 3 . Это форма, в которой существует гематит. Гамма Fe 2 O 3 имеет кубическую структуру и встречается реже. Эта структура образуется из альфа-фазы при высоких температурах. Другие фазы Fe 2 O 3 включают бета-фазу, эпсилон-фазу и т. д., которые встречаются редко.
Это форма, в которой существует гематит. Гамма Fe 2 O 3 имеет кубическую структуру и встречается реже. Эта структура образуется из альфа-фазы при высоких температурах. Другие фазы Fe 2 O 3 включают бета-фазу, эпсилон-фазу и т. д., которые встречаются редко.
Основное применение Fe 2 O 3 занимается производством железа. Там Fe 2 O 3 используется в качестве сырья для доменной печи (в которой железо производится в виде расплавленного железа). Кроме того, очень мелкие частицы Fe 2 O 3 , известные как румяна, используются при полировке ювелирных изделий для окончательной отделки изделия.
Что такое Fe
3 O 4 Fe 3 O 4 оксид железа(II,III). Он назван так, поскольку содержит как Fe 2+ и Fe 3+ . Это делает Fe 3 O 4 ферромагнитным. Это означает, что Fe 3 O 4 может притягиваться даже к слабому внешнему магнитному полю. Минералогическое название Fe 3 O 4 — магнетит. Это один из основных оксидов железа, встречающихся в природе на Земле.
Минералогическое название Fe 3 O 4 — магнетит. Это один из основных оксидов железа, встречающихся в природе на Земле.
Рисунок 2: Частицы чистого Fe3O4
Fe 3 O 4 имеет темный (черный) цвет. Молярная масса Fe 3 O 4 составляет 231,531 г/моль. Температура плавления этого соединения составляет 1597· o °С, а температура кипения 2623· o °С. При комнатной температуре это твердый черный порошок без запаха. При рассмотрении кристаллической системы Fe 3 O 4 она имеет кубическую структуру обратной шпинели.
Fe 3 O 4 является хорошим электропроводником (электропроводность примерно в 10 6 раз выше, чем у Fe 2 O 3 ). При правильной индукции частицы Fe 3 O 4 могут действовать как крошечные магниты. Это соединение используется в качестве черного пигмента и известно как марсианский черный. Используется в качестве катализатора в процессе Габера (для производства аммиака). Частицы Nano-Fe 3 O 4 используются при МРТ-сканировании (в качестве контрастных веществ).
Используется в качестве катализатора в процессе Габера (для производства аммиака). Частицы Nano-Fe 3 O 4 используются при МРТ-сканировании (в качестве контрастных веществ).
Разница между Fe
2 O 3 и Fe 3 O 4Определение
Fe 2 O 3 : Fe 2 O 3 представляет собой оксид железа (III), также известный как гематит.
Fe 3 O 4 : Fe 3 O 4 представляет собой оксид железа(II,III), также известный как магнетит.
Внешний вид
Fe 2 O 3 : Fe 2 O 3 выглядит как темно-красный или кирпично-красный твердый порошок.
Fe 3 O 4 : Fe 3 O 4 выглядит как черный твердый порошок.
Степень окисления железа.

Fe 3 O 4 : Fe 3 O 4 имеет обе степени окисления Fe 2+ и Fe 3+ .
Молярная масса
Fe 2 O 3 : Молярная масса Fe 2 O 3 составляет 159,687 г/моль.
Fe 3 O 4 : Молярная масса Fe 3 O 4 составляет 231,531 г/моль.
Петирование точки
FE 2 O 3 : Точка плавления Fe 2 O 3 — 1565 ° C
FE 3 O 4: Malting Point FE 3 O 4 0004: . 3 O 4 is 1597°C
Температура кипения
Fe 2 O 3 : Fe 2 O 3 разлагается при высоких температурах.
Fe 3 O 4 : Температура кипения Fe 3 O 4 составляет 2623°C.
Магнитные свойства
Fe 2 O 3 : Fe 2 O 3 является парамагнитным.
Fe 3 O 4 : Fe 3 O 4 является ферромагнитным.
Притяжение к магнитному полю
Fe 2 O 3 : Fe 2 O 3 может притягиваться к сильному внешнему магнитному полю.
Fe 3 O 4 : Fe 3 O 4 могут притягиваться даже слабым внешним магнитным полем.
Кристаллическая структура
Fe 2 O 3 : Fe 2 O 3 существуют в двух основных полиморфных модификациях; альфа-фаза, гамма-фаза и некоторые другие фазы. Альфа-фаза имеет ромбоэдрическую структуру, а гамма-Fe 2 O 3 имеет кубическую структуру.
Fe 3 O 4 : Fe 3 O 4 имеет кубическую инверсную структуру шпинели.
Электропроводность
Fe 2 O 3 : Fe 2 O 3 обладает меньшей электропроводностью по сравнению с Fe 4 O 9
Fe 3 O 4 : Fe 3 O 4 является хорошим электрическим проводником, проводимость около 10 6 раз выше, чем у Fe 2 O 3 .
Заключение
Гематит и магнетит являются основными источниками железа в промышленных процессах производства металлического железа. Эти полезные ископаемые используются в качестве сырья для этого производства. Гематит в основном содержит железо в форме Fe 2 O 3 , тогда как магнетит содержит железо в форме Fe 3 O 4 . Эти соединения являются основными оксидами железа, встречающимися в природе. Основное отличие Fe 2 O 3 and Fe 3 O 4 is that Fe 2 O 3 is a paramagnetic mineral having only Fe 2+ oxidation state whereas Fe 3 O 4 is a ферромагнитный материал, имеющий обе степени окисления Fe 2+ и Fe 3+ .
Ссылка:
1. «Железо(III) оксид». Википедия, Фонд Викимедиа, 11 февраля 2018 г., доступно здесь.
2. «Железо(II,III) оксид». Википедия, Фонд Викимедиа, 10 февраля 2018 г., доступно здесь.
Изображение предоставлено:
1. «Образец оксида железа (III)» Benjah-bmm27 — собственная работа (общественное достояние) через Commons Wikimedia
2. «Fe3O4» Лейем — собственная работа (CC BY-SA 4.0 ) через Commons Wikimedia
[PDF] Трехмерная визуализация состояния окисления железа в нанокубах ядро-оболочка FeO/Fe3O4 по данным томографии с потерями энергии электронов.
- DOI:10.1021/acs.nanolett.6b01922
- Идентификатор корпуса: 206735386
@article{Torruella20163DVO,
title={3D-визуализация состояния окисления железа в нанокубах ядро-оболочка FeO/Fe3O4 по данным томографии с потерями энергии электронов. },
автор = {Пау Торруэлла и Рауль Ареналь, и Франсиско де ла Пена, и Зинеб Саги, и Л. Йедра, и Альберто Эльхаррат, и Льюси, Льюпес-Конеса, и Марта Эстрадер, и Альберто Лёпес-Ортега и Джерман Салазар-Альварес, Хосеп Ногус, Катерина Дукати, Пол А. Мидгли и Франческа Пейро и С. `o} nia Estrad {\ 'e}},
журнал = {нанобуквы},
год = {2016},
объем={16 8},
страницы={
5068-73
}
}
},
автор = {Пау Торруэлла и Рауль Ареналь, и Франсиско де ла Пена, и Зинеб Саги, и Л. Йедра, и Альберто Эльхаррат, и Льюси, Льюпес-Конеса, и Марта Эстрадер, и Альберто Лёпес-Ортега и Джерман Салазар-Альварес, Хосеп Ногус, Катерина Дукати, Пол А. Мидгли и Франческа Пейро и С. `o} nia Estrad {\ 'e}},
журнал = {нанобуквы},
год = {2016},
объем={16 8},
страницы={
5068-73
}
} - P. Torruella, R. Arenal, S. Estradé
- Опубликовано 8 июля 2016 г.
- Материаловедение
- Нанобуквы
Физико-химические свойства, используемые в многочисленных передовых наноструктурированных устройствах, напрямую контролируются степенями окисления их компонентов. . В этой работе мы комбинируем спектроскопию потерь энергии электронов, разделение слепых источников и компьютерную томографию, чтобы реконструировать в трех измерениях распределение ионов Fe(2+) и Fe(3+) в наночастицах FeO/Fe3O4 в форме ядра/оболочки. с нанометрическим разрешением. Результаты подчеркивают резкость границы раздела между обоими оксидами и…
Результаты подчеркивают резкость границы раздела между обоими оксидами и…
Посмотреть в PubMed
diposit.ub.eduОболочечный контроль химии поверхности высокостехиометрических наночастиц магнетита.
- Габриэль С. Лаворато, А. Руберт, М. Фонтичелли
Материаловедение
Наномасштаб
- 2020
Новая стратегия управления химией поверхности наночастиц а3 нм с помощью наночастиц а3 нм 2 Предложено толстое эпитаксиальное покрытие Zn-феррита в наноструктурах ядро/оболочка.
Определение инверсии катионов в наночастицах оксидов на основе шпинели в атомном масштабе.
- P. Torruella, A. Ruiz-Caridad, S. Estradé
Материаловедение
Нанобуквы
- 2018
Введены два метода выполнения локальной оценки решеток позволяют определять параметр инверсии в ядре из оксида железа и оболочке из оксида марганца, а также обнаруживать пространственные вариации этого параметра с атомарным разрешением.
Исследование изменчивости степеней окисления наночастиц магнетита с помощью спектроскопии одиночных частиц
- А. Ф. Родригес, К. Мойя, М. Эскода-Торроэлла, А. Ромеро, А. Лабарта, X. Батлле
Физика
- 1 2018
Мы изучили электронные и химические свойства различных ансамблей наночастиц Fe3O4, выбранных по размеру и форме, с одночастичной чувствительностью с помощью синхротронного рентгеновского излучения…
Дефицит Fe2+, субдомены FeO и Структурные дефекты благоприятствуют действию магнитной гипертермии нанокубов оксида железа во внутриклеточную среду.
- A. Lak, Marco Cassani, T. Pellegrino
Материаловедение
Нанобуквы
- 2018
В этой работе определяется состав среды, при котором вязкость магнитного нагрева нанокубов не зависит и агрегации, а также демонстрирует наибольшую эффективность нагрева, о которой сообщалось на сегодняшний день, для наночастиц оксида железа размером 23 нм во внутриклеточных условиях.
Электронная микроскопия высокого разрешения для исследования гетерогенного катализа
- Yong Zhu, Mingquan Xu, Wu Zhou
Химия
- 2018
Гетерогенные катализаторы являются наиболее важными катализаторами в промышленных реакциях. Нанокатализаторы размером от сотен нанометров до атомного масштаба обладают активностью, близкой к…
Усовершенствованная спектроскопия потерь энергии электронов для исследований аккумуляторов
- Zu-Wei Yin, Wenguang Zhao, F. Pan
Науки об окружающей среде
Усовершенствованные функциональные материалы
- 2021
Являясь мощным инструментом для анализа химического состава, спектроскопия потерь энергии электронов (EELS) может предоставить множество информации о состоянии электронов на атомном уровне в различных…
Магнитные наночастицы : От наноструктуры к физическим свойствам
- Х. Батлле, К. Мойя, М. Эскода-Торроэлла, Т.
 Iglesias, Arantxa Fraile Rodríguez, A. Labarta
Iglesias, Arantxa Fraile Rodríguez, A. Labarta Материаловедение
Journal of Magnetism and Magnetic Materials
- 2022
A Review on Fabrication Methods, Characterization and Applications of Magnetic Iron Oxide Nanomaterials
- T. Mandal, D. Roy
Materials Science
- 2020
Магнитные наноматериалы на основе оксида железа (МИОН) были тщательно исследованы для различных важных приложений. Соосаждение, гидротермальное, высокотемпературное разложение органики…
Electron Tomography: A Unique Tool Solving Intricate Hollow Nanostructures
- Hao Song, Yannan Yang, Jing Geng, Zhengying Gu, J. Zou, Chengzhong Yu
Materials Science
Advanced materials
- 2018
The Различная информация, полученная в результате анализа ЭТ, выделяется и сравнивается с традиционными методами анализа, а современный метод ЭТ предлагает большие возможности и перспективы в разработке полых наноматериалов.
Assessing Oxygen Vacancies in Bismuth Oxide through EELS Measurements and DFT Simulations
- P. Torruella, C. Coll, S. Estradé
Materials Science
- 2017
Pioneering electron energy loss spectroscopy (EELS) measurements of α-Bi2O3 проводят на трех образцах, полученных разными методами синтеза. Экспериментальные EELS с низкими потерями и потерями в сердечнике…
ПОКАЗАНЫ 1–10 ИЗ 49 ССЫЛОК
0065
Трехмерное картирование валентности в нанокристаллах церия.
- B. Goris, S. Turner, S. Bals, G. van Tendeloo
Материаловедение
ACS nano
- 2014
отображать валентность ионов Ce в нанокристаллах CeO2-x в трех измерениях, что позволяет проводить трехмерное исследование множества специфических для материала физических свойств, таких как валентность, химический состав, координация кислорода или длина связи.
Картирование с высоким разрешением уменьшения поверхности наночастиц церия.

- S. Turner, S. Lazăr, G. van Tendeloo
Материаловедение
Наномасштаб
- 2011
- 2011
Преобладающее восстановление поверхности {1011111 типа оксида церия} изучается с использованием {10} поверхностного восстановления нанооктаэдров церия} сочетание просвечивающей электронной микроскопии (ПЭМ) с коррекцией аберраций и пространственных…
Трехмерная морфология наночастиц оксида железа с реакционноспособными вогнутыми поверхностями. Подход с использованием сжатой электронной томографии (CS-ET).
- Z. Saghi, D. Holland, P. Midgley
Материаловедение
Нанобуквы
- 2011
томографическая реконструкция и устойчивая работа алгоритма CS-ET с данными с недостаточной выборкой должны обеспечить быстрый прогресс в трехмерных наноразмерных исследованиях с временным разрешением, трехмерных изображениях с атомным разрешением и криотомографии наноразмерных клеточных структур.
Расширение анализа данных спектральной визуализации EELS от картирования элементов до карт связей в сложных наноструктурах.
- R. Arenal, F. de la Peña, C. Colliex
Физика
Ультрамикроскопия
- 2008
Происхождение большой дисперсии магнитных свойств в наноструктурах Fed3Op/O оксидов как тематическое исследование.
- М. Эстрадер, А. Лопес-Ортега, Х. Ногес
Материаловедение
Наномасштаб
- 2015
Показана четкая корреляция между магнитоструктурными свойствами крупных (45 нм) и малых (9 нм) наночастиц ядра/оболочки FexO/Fe3O4, которая может объяснить распространение магнитных свойств.
Спектроскопическая томография EEL: к новому измерению в анализе наноматериалов.
- Л. Йедра, А. Эльяррат, Ф. Пейро
Физика
Ультрамикроскопия
- 2012
Oxide Wizard: приложение EELS для характеристики белых линий краев переходных металлов
Этот сценарий для цифровой микрофотографии характеризует структуру потерь энергии вблизи краев и положение краев переходных металлов в спектре потерь энергии электронов, который может быть связаны со степенями окисления переходных металлов с высоким пространственным разрешением.
Отличие ядра от оболочки в наночастицах MnO(x)/MnO(y) и FeO(x)/MnO(x) ядро/оболочка с помощью количественного анализа спектроскопии потерь энергии электронов (EELS).
- S. Estradé, L. Yedra, F. Peiró
Материаловая наука, химия
Micron
- 2012
СТАВИТЕЛЬНЫЕ ПЕРЕСОВОГО НА ФОРИС-ЖЕЛЕЗОВА. , P. Buseck
Геология
Природа
Минералы со смешанной валентностью широко распространены и образуются во многих различных типах горных пород. Они могут содержать, например, Fe2+–Fe3+ и Mn2+–Mn3+–Mn4+, причем соотношения степеней окисления отражают…
Трехмерное изображение локализованных поверхностных плазмонных резонансов металлических наночастиц
- Оливия Николетти, Ф. Д. Л. Пеня, Р. Лири, Д. Холланд, К. Дукати, П. Мидгли
Физика
1 6 03012 Природа 5
3D-изображения, связанные с LSPR отдельного серебряного нанокуба, могут быть реконструированы с помощью визуализации спектра потерь энергии электронов, картирования возбуждения в диапазоне ориентаций с новой комбинацией неотрицательной матричной факторизации, сжатого зондирования и электронного томография.
Настройка давления упорядочения заряда в оксиде железа
%PDF-1.4 % 1 0 объект > эндообъект 11 0 объект /Заголовок /Предмет /Автор /Режиссер /Ключевые слова /CreationDate (D:20221003172727-00’00’) /CrossMarkDomains#5B1#5D (springer.com) /CrossMarkDomains#5B2#5D (springerlink.com) /ModDate (D:20181105135853+01’00’) /дои (10.1038/s41467-018-06457-х) >> эндообъект 2 0 объект > эндообъект 3 0 объект > эндообъект 4 0 объект > эндообъект 5 0 объект > эндообъект 6 0 объект > эндообъект 7 0 объект > эндообъект 8 0 объект > ручей приложение/pdfdoi:10.1038/s41467-018-06457-x
 1038/s41467-018-06457-x
1038/s41467-018-06457-x org/0000-0003-3285-445X
org/0000-0003-3285-445X adobe.com/xap/1.0/mm/xmpMMXMP Схема управления мультимедиа
adobe.com/xap/1.0/mm/xmpMMXMP Схема управления мультимедиа MajorVersionDateText
MajorVersionDateText Если в качестве требуемого dc:identifier используется альтернативный уникальный идентификатор, то DOI следует указывать как голый идентификатор только в пределах prism:doi.
Если необходимо указать URL-адрес, связанный с DOI, то prism:url можно использовать вместе с prism:doi для предоставления конечной точки службы (т. е. URL-адреса).
текст
Если в качестве требуемого dc:identifier используется альтернативный уникальный идентификатор, то DOI следует указывать как голый идентификатор только в пределах prism:doi.
Если необходимо указать URL-адрес, связанный с DOI, то prism:url можно использовать вместе с prism:doi для предоставления конечной точки службы (т. е. URL-адреса).
текст Примечание. Название публикации можно использовать, чтобы различать печатный журнал и онлайн-версию, если названия различаются, например «magazine» и «magazine.com».
публикацияNameText
Примечание. Название публикации можно использовать, чтобы различать печатный журнал и онлайн-версию, если названия различаются, например «magazine» и «magazine.com».
публикацияNameText

 Это значит, что на четвёртом электронном s-уровне находятся 2 электрона, а на третьем d-уровне — 6. Соответственно, наиболее устойчивым состоянием, с химической точки зрения, является: изначальное (все электроны атома находятся на своих электронных орбиталях), промежуточное (два или три электрона с валентного уровня переходят на электронные орбитали окислителя), в этом случае электроны могут как бы «метаться», не зная оставаться ли им на орбитали железа или переходить на электронное облако окислителя, сильно окисленное (все электроны переходят на электронные орбитали окислителя)
Это значит, что на четвёртом электронном s-уровне находятся 2 электрона, а на третьем d-уровне — 6. Соответственно, наиболее устойчивым состоянием, с химической точки зрения, является: изначальное (все электроны атома находятся на своих электронных орбиталях), промежуточное (два или три электрона с валентного уровня переходят на электронные орбитали окислителя), в этом случае электроны могут как бы «метаться», не зная оставаться ли им на орбитали железа или переходить на электронное облако окислителя, сильно окисленное (все электроны переходят на электронные орбитали окислителя) В чистом
кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на
воздухе.
В чистом
кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на
воздухе.
 Более
лёгкий, чем железо, шлак плавает на поверхности — это свойство позволяет
разделять шлак от металла. Шлак затем может использоваться при строительстве и
сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит
довольно много углерода (чугун). Кроме таких случаев, когда чугун используется
непосредственно, он требует дальнейшей переработки.
Более
лёгкий, чем железо, шлак плавает на поверхности — это свойство позволяет
разделять шлак от металла. Шлак затем может использоваться при строительстве и
сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит
довольно много углерода (чугун). Кроме таких случаев, когда чугун используется
непосредственно, он требует дальнейшей переработки.






 Состав смеси (а
значит, и интенсивность её окраски) зависит от различных факторов, поэтому для
точного качественного определения железа этот метод неприменим.
Состав смеси (а
значит, и интенсивность её окраски) зависит от различных факторов, поэтому для
точного качественного определения железа этот метод неприменим. В кислой среде разлагаются с
выделением кислорода[27]:
В кислой среде разлагаются с
выделением кислорода[27]:
 },
автор = {Пау Торруэлла и Рауль Ареналь, и Франсиско де ла Пена, и Зинеб Саги, и Л. Йедра, и Альберто Эльхаррат, и Льюси, Льюпес-Конеса, и Марта Эстрадер, и Альберто Лёпес-Ортега и Джерман Салазар-Альварес, Хосеп Ногус, Катерина Дукати, Пол А. Мидгли и Франческа Пейро и С. `o} nia Estrad {\ 'e}},
журнал = {нанобуквы},
год = {2016},
объем={16 8},
страницы={
5068-73
}
}
},
автор = {Пау Торруэлла и Рауль Ареналь, и Франсиско де ла Пена, и Зинеб Саги, и Л. Йедра, и Альберто Эльхаррат, и Льюси, Льюпес-Конеса, и Марта Эстрадер, и Альберто Лёпес-Ортега и Джерман Салазар-Альварес, Хосеп Ногус, Катерина Дукати, Пол А. Мидгли и Франческа Пейро и С. `o} nia Estrad {\ 'e}},
журнал = {нанобуквы},
год = {2016},
объем={16 8},
страницы={
5068-73
}
}  Iglesias, Arantxa Fraile Rodríguez, A. Labarta
Iglesias, Arantxa Fraile Rodríguez, A. Labarta