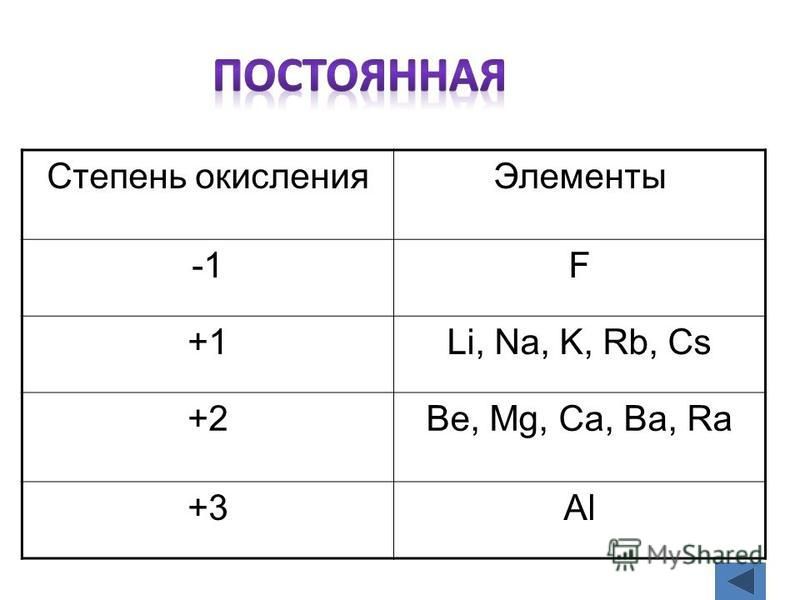
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Задания ОГЭ по химии.
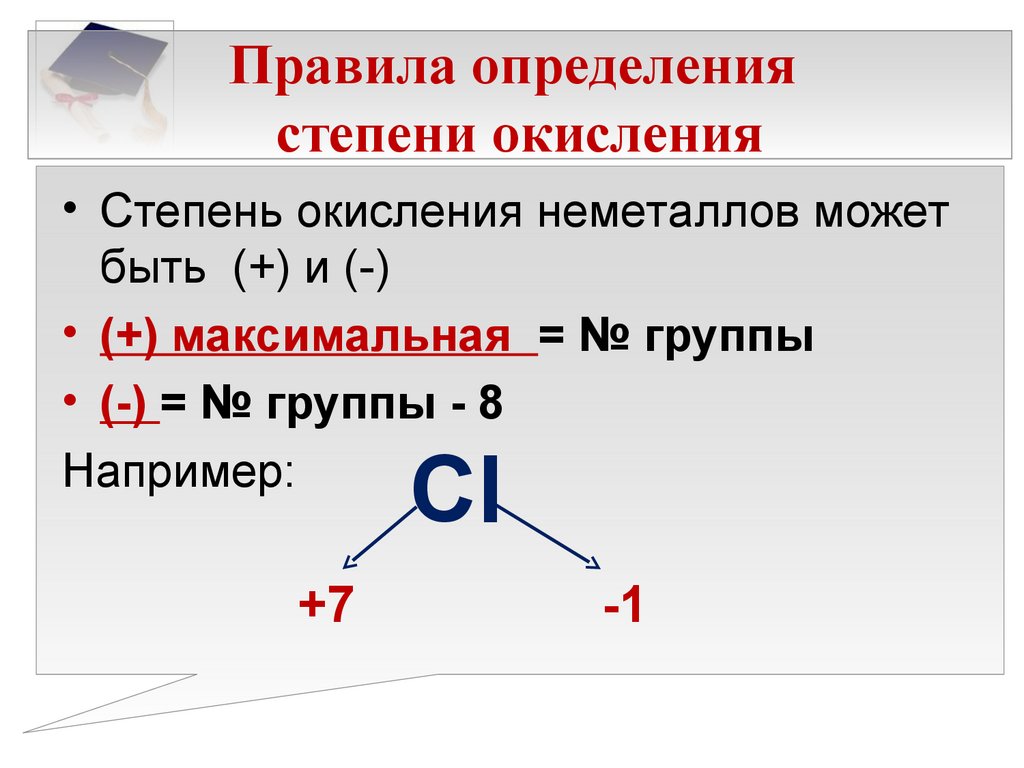
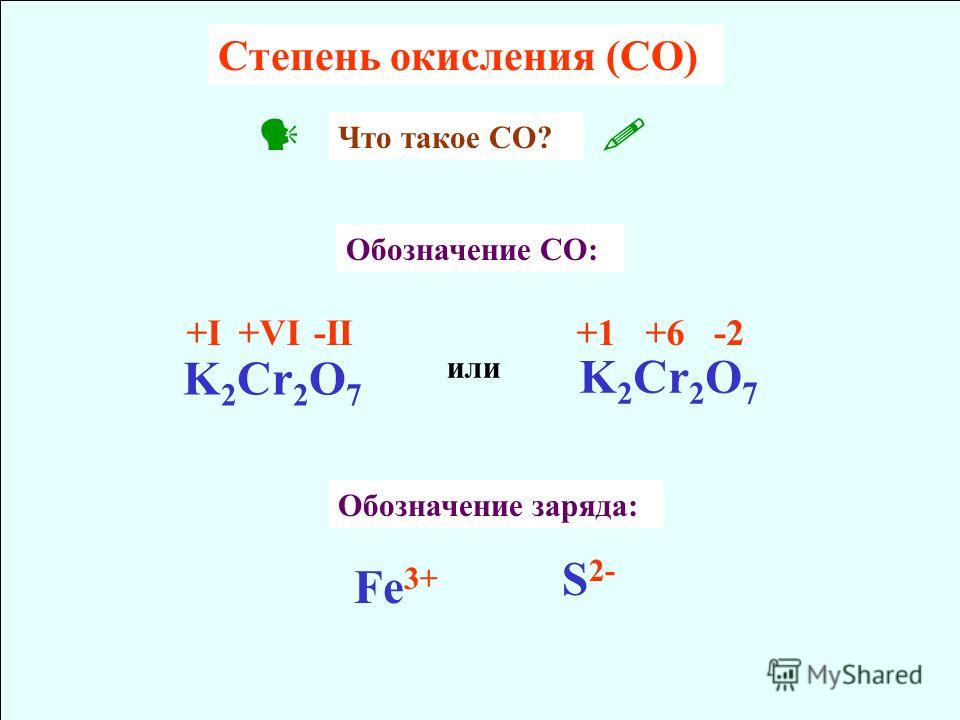
 Тема «Степень окисления»
Тема «Степень окисления»Степень окисления
Одинаковую степень окисления атомы хлора имеют в соединениях:
1) Cl2O7 и HClO4 2) CaCl2 и Mg(ClO2)2 3) HCl и KClO3 4) Cl2O и NaClO2
Степень окисления +1 хлор проявляет в соединении
1) HClO 2) CaCl2 3) CCl4 4) Ca(ClO2)2
Такую же степень окисления, как и в CuS, сера имеет в соединении
1) H2SО4 2) (NH4)2S 3) SO3 4) Li2SO3
Низшую степень окисления азот проявляет в соединении, формула которого
1) N2O 2) NO 3) NH3 4) NCl3
В каком из соединений степень окисления хлора равна +7?
1) NH4Cl 2) KClO 3) Ca(ClO3)2 4) HClO4
Такую же степень окисления, как и в N2O5, азот имеет в соединении
1) NO2 2) HNO3 3) NH3 4) NH4Cl
Такую же степень окисления, как и в SO2, сера имеет в соединении
1) K2SO4 2) H2SO3 3) (NH4)2S 4) SO3
Степени окисления атома азота в соединениях NH3 и NO соответственно равны
1) +5 и +2 2) –1 и +1 3) –3 и +3 4) –3 и +2
Степень окисления –1 водород проявляет в соединении с
1) хлором 2) калием 3) углеродом 4) кислородом
Высшую степень окисления углерод имеет в соединении
1) СО 2) СН4 3) Na4C 4) Na2СO3
В каком из соединений степень окисления азота равна –3?
1) (NH4)2SO4 2) HNO3 3) Ba(NO2)2 4) N2O3
Атомы азота и углерода имеют одинаковую степень окисления в соединениях
1) NH3 и CO 2) NO2 и ССl4 3) N2O3 и СО2 4) Na3N и CH4
Одинаковую степень окисления фосфор проявляет в каждом из двух соединений:
1) P2O3 и Ca3P2 2) P4 и H3PO4 3) PH3 и H3PO3 4) P2О5 и H3PO4
Такую же степень окисления, как у хлора в Cl2O5, азот имеет в соединении
1) KNO3 2) NO2 3) (NH4)3PO4 4) Mg(NO2)2
В каком из соединений степень окисления серы равна +4?
1) K2SO3 2) H2SO4 3) (NH4)2S 4) Fe2(SO4)3
В каком соединении степень окисления углерода равна –4?
1) CaCO3 2) CaC2 3) CH4 4) NaHCO3
Такую же степень окисления, как и в CH4, углерод имеет в соединении
1) CO 2) Al4C3 3) CaCO3 4) CO2
Высшую степень окисления хлор проявляет в соединении
1) KClO2 2) KClO4 3) СCl4 4) MgCl2
Такую же степень окисления, как и вSO2, сера имеет в соединении
1) K2SO4 2) H2SO3 3) (NH4)2S 4) SO3
Атомы азота и углерода имеют одинаковую степень окисления в соединениях
1) NH3 и CO 2) NO2 и ССl4 3) N2O3 и СО2 4) Na3N и CH4
Одинаковую степень окисления атомы азота имеют в соединениях N2O3 и
1) Ca(NO2)2 2) (NH4)2S 3) KNO3 4) NH3
В каком из соединений степень окисления фосфора равна –3?
1) K3Р 2) Na3PO3 3) HPO3 4) Ca3(PO4)2
В каких соединениях атомы азота и фосфора имеют одинаковое значение степени окисления?
1) NH3 и PCl3 2) NH3 и Ca3P2 3) NO2 и P2O5 4) NO2 и P2O3
Значения высших степеней окисления элементов увеличиваются в рядах:
1) Al → P → Cl 2) Se → S → O 3) C → Si → Ge
4) Ge → As → Se 5) Be → Mg → Ca
Степень окисления хлора в соединении KClO3 равна
1) –1 2) +3 3) +5 4) +7
В каком соединении степень окисления хлора равна +7?
1) HCl 2) Cl2O 3) KClO3 4) HClO4
Низшую степень окисления фосфор имеет в соединении
1) Ca3P2 2) K3PO4 3) H3PO3 4) P2O3
Высшую степень окисления азот имеет в соединении
1) Ca3N2 2) (NH4)2S 3) NO2 4) KNO3
В каком из соединений степень окисления азота равна +3?
1) NH4Cl 2) Ca(NO2)2 3) Al(NO3)3 4) NH3
Высшую степень окисления элемент имеет в оксиде
1) N2O 2) Al2O3 3) SO2 4) FeO
Одинаковую степень окисления +5 атомы фосфора имеют в соединениях
1) P2O3 и PH3 2) P2O5 и H3PO4 3) PH3 и P2O5 4) PH3 и Na3PO4
Разную степень окисления атомы серы и углерода имеют в соединениях
1) K2SO4 и CO2 2) SO2 и H2CO3 3) Na2SO3 и CO2 4) H2SO3 и CaCO3
Одинаковую степень окисления азот имеет в соединениях
1) NH3 и NO 2) NO и NO2 3) NO2 и N2O5 4) N2O5 и HNO3
В каком соединении углерод проявляет низшую степень окисления?
1) карбонат натрия 2) метан 3) оксид углерода (II) 4) оксид углерода (IV)
В каком соединении кислород проявляет положительную степень окисления?
1) H2O2 2) NO2 3) OF2 4) KClO3
Такую же степень окисления, как и в HCl, хлор имеет в соединении
1) Cl2O 2) NH4Cl 3) HClO 4) Cl2O7
Высшую степень окисления элемент имеет в оксиде
1) CaO 2) NO2 3) P2O3 4) Cl2O
В каком веществе степень окисления азота равна +3?
1) N2O5 2) Ca3N2 3) HNO2 4) KNO3
Степень окисления алюминия в соединении AlCl3 такая же, как у азота в соединении
1) NO 2) N2O3 3) N2O 4) N2O5
Степень окисления +3 хлор имеет в соединении
1) HClO3 2) NH4Cl 3) KClO 4) Ca(ClO2)2
Такую же степень окисления, как и в Cl2O7, хлор имеет в соединении
1) HCl 2) NH4ClO4 3) Ca(ClO3)3 4) HClO2
Минимальную и максимальную степень окисления атомы азота проявляют в веществах:
1) NH3, N2O5 2) N2O, N2O3 3) NO2, NO 4) NH3, NO
Атом серы имеет отрицательную степень окисления в соединении
1) H2S 2) H2SO3 3) SO2 4) Na2SO4
Высшая и низшая степени окисления углерода равны соответственно
1) +6 и –2 2) +4 и –2 3) +4 и –4 4) +6 и –4
Степень окисления углерода равна –4 в соединении
1) CCl4 2) CO2 3) CH4 4) CS2
В каком соединении сера проявляет валентность VI?
1) H2S 2) SO3 3) Na2S 4) SO2
Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
– 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т. д. Координационные свойства проявляются всеми элементами периодической системы.
д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26. 12.2016 12:02
12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.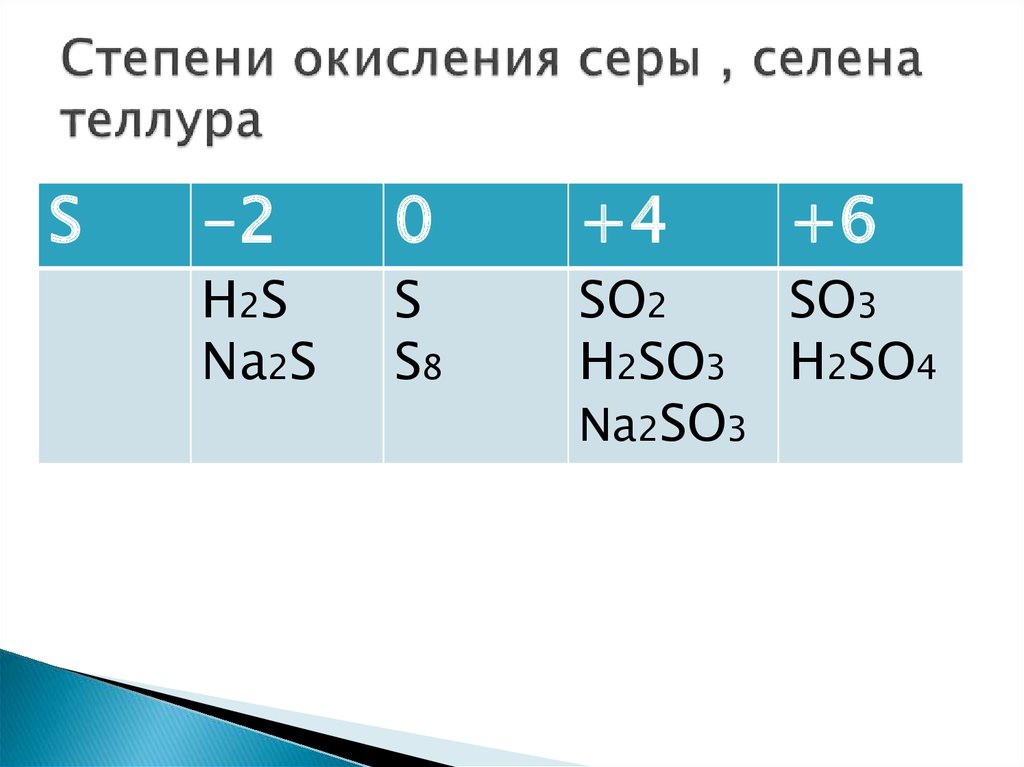
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
– 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701. 32 kB
32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
Хлор
| Хлор | |
|---|---|
| Атомный номер | 17 |
| Внешний вид простого вещества | Газ жёлто-зеленого цвета с резким запахом. Ядовит. |
| Свойства атома | |
|
Атомная масса (молярная масса) |
35,4527 а.е.м.(г/моль) |
| Радиус атома | 100 пм |
|
Энергия ионизации (первый электрон) |
1254. 9(13.01) 9(13.01) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p5 |
| Химические свойства | |
| Ковалентный радиус | 99 пм |
| Радиус иона | (+7e)27 (-1e)181 пм |
|
Электроотрицательность (по Полингу) |
3.16 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 6, 5, 4, 3, 1, −1 |
| Термодинамические свойства простого вещества | |
| Плотность |
(при −33.6 °C)1,56 г/см³ |
| Молярная теплоёмкость |
21. 838 Дж/(K·моль) 838 Дж/(K·моль) |
| Теплопроводность | 0.009 Вт/(м·K) |
| Температура плавления | 172.2 K |
| Теплота плавления | 6.41 кДж/моль |
| Температура кипения | 238.6 K |
| Теплота испарения | 20.41 кДж/моль |
| Молярный объём | 18.7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a=6,29 b=4,50 c=8,21 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| CI | 17 |
| 35,4527 | |
| [Ne]3s23p5 | |
| Хлор | |
Хлор (χλωρός — зелёный) — элемент главной подгруппы седьмой группы, третьего периода периодической системы химических элементов Д.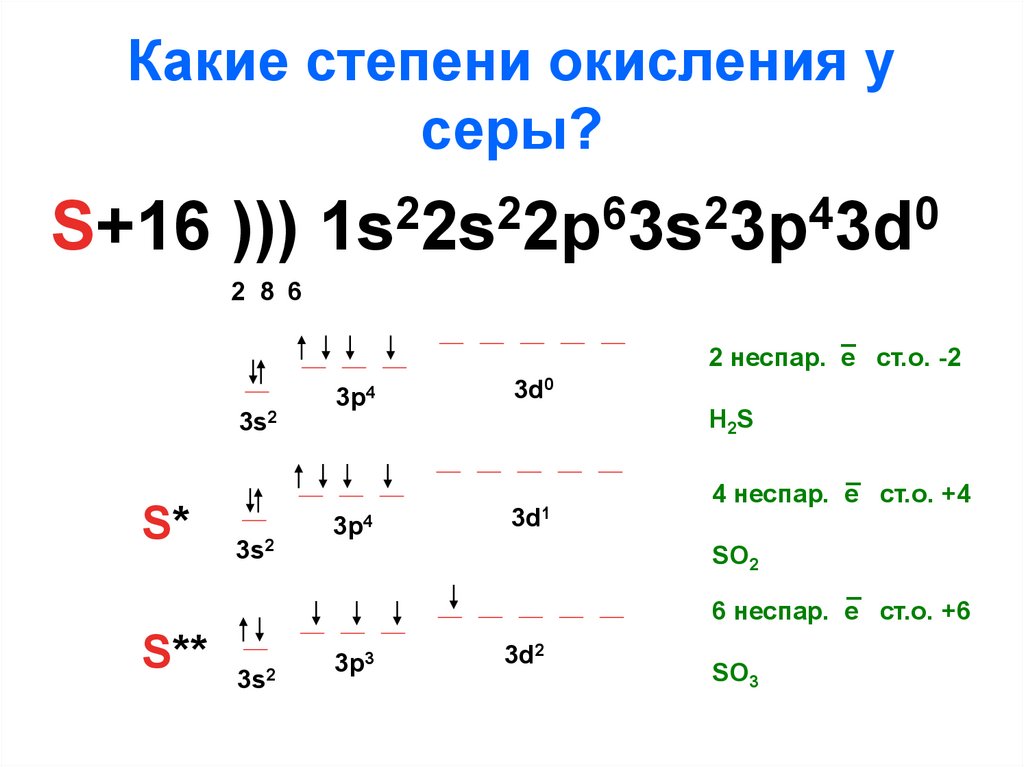 И. Менделеева, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора [дословно «галоген» переводится как солерод], но оно не прижилось, и впоследствии стало общим для VII группы элементов, в которую входит и хлор).
И. Менделеева, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора [дословно «галоген» переводится как солерод], но оно не прижилось, и впоследствии стало общим для VII группы элементов, в которую входит и хлор).
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Схема атома хлора
Впервые хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
- 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Распространение в природе
В природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6h3O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,19%, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Изотопный состав
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 %.
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин |
|---|---|---|---|---|
| 35Cl | 34.968852721 | Стабилен | — | 3/2 |
| 36Cl |
35. 9683069 9683069 |
301000 лет | β-распад в 36Ar | 0 |
| 37Cl | 36.96590262 | Стабилен | — | 3/2 |
| 38Cl | 37.9680106 | 37,2 минуты | β-распад в 38Ar | 2 |
| 39Cl | 38.968009 | 55,6 минуты | β-распад в 39Ar | 3/2 |
| 40Cl | 39.97042 | 1,38 минуты | β-распад в 40Ar | 2 |
| 41Cl |
40. 9707 9707 |
34 c | β-распад в 41Ar | |
| 42Cl | 41.9732 | 46,8 c | β-распад в 42Ar | |
| 43Cl | 42.9742 | 3,3 c | β-распад в 43Ar |
Физические и физико-химические свойства
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Некоторые его физические свойства представлены в таблице.
| Свойство | Значение |
|---|---|
| Температура кипения | −34 °C |
| Температура плавления | −101 °C |
|
Температура разложения (диссоциации на атомы) |
~1400°С |
Плотность (газ, н.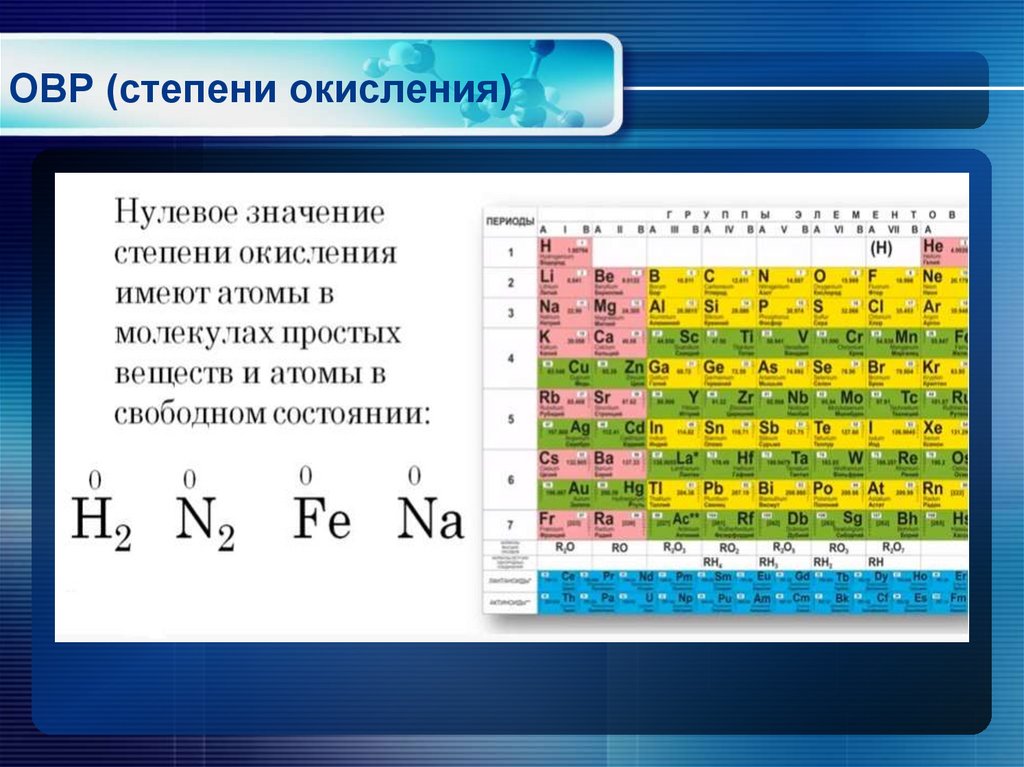 у.) у.) |
3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоемкость (298 К, газ) | 34,94 (Дж/моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 (кДж/моль) |
| Стандартная энтропия образования (298 К, газ) | 222,9 (Дж/моль·K) |
| Энтальпия плавления | 6,406 (кДж/моль) |
| Энтальпия кипения | 20,41 (кДж/моль) |
При охлаждении хлор превращается в жидкость при температуре около 239 К, а затем ниже 113 К кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å.
Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å.
Растворимость
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Степень диссоциации молекулы хлора Cl2 → 2Cl. При 1000 К равна 2,07*10-4%, а при 2500 К 0,909 %.
При 1000 К равна 2,07*10-4%, а при 2500 К 0,909 %.
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
В реестре CAS — номер 7782-50-5.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Химические свойства
Строение электронной оболочки
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1S² 2S² 2p6 3S² 3p5, поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие валентности. Схема образования возбуждённых состояний атома:
| Валентность |
Возможные степени окисления |
Электронное состояние валентного уровня |
Пример соединений |
|---|---|---|---|
| I | +1, −1 | 3s2 3p5 | NaCl, NaClO |
| III | +3 | 3s2 3p4 3d1 | NaClO2 |
| V | +5 | 3s2 3p3 3d2 | NaClO3 |
| VII | +7 | 3s1 3p3 3d3 | NaClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Взаимодействие с металлами
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
- Cl2 + 2Na → 2NaCl
- 3Cl2 + 2Sb → 2SbCl3
- 3Cl2 + 2Fe → 2FeCl3
Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C. :
:
- Cl2 + H2 → 2HCl
- 5Cl2 + 2P → 2PCl5
- 2S + Cl2 → S2Cl2
С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl2O, ClO2, Cl2O6, Cl2O7. Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
При реакции с фтором, образуется не хлорид, а фторид:
- Cl2 + 3F2 (изб.) → 2ClF3
Другие свойства
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
- Cl2 + 2HBr → Br2 + 2HCl
- Cl2 + 2NaI → I2 + 2NaCl
При реакции с монооксидом углерода образуется фосген:
- Cl2 + CO → COCl2
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли:
- Cl2 + H2O → HCl + HClO
- 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Хлорированием сухого гидроксида кальция получают хлорную известь:
- Cl2 + Ca(OH)2 → CaCl(OCl) + H2O
Действие хлора на аммиак можно получить трёххлористый азот:
- 4NH3 + 3Cl2 → NCl3 + 3NH4Cl
Окислительные свойства хлора
Хлор очень сильный окислитель.
- Cl2 + H2S → 2HCl + S
Реакции с органическими веществами
С насыщенными соединениями:
- CH3-CH3 + Cl2 → C2H6-xClx + HCl
Присоединяется к ненасыщенным соединениям по кратным связям:
- CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
- C6H6 + Cl2 → C6H5Cl + HCl
Хлор способы получения хлора
Промышленные методы
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
- MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
- 4HCl + O2 → 2H2O + 2Cl2
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли:
- 2NaCl + 2H2О → H2↑ + Cl2↑ + 2NaOH
- Анод: 2Cl— — 2е— → Cl20↑
- Катод: 2H2O + 2e— → H2↑ + 2OH—
Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом:
- 1,80 NaCl + 0,50 H2O → 1,00 Cl2↑ + 1,10 NaOH + 0,03 H2↑
Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Диафрагменный метод с твердым катодом
Полость электролизера разделена пористой асбестовой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом. В анодное пространство диафрагменного электролизера непрерывно поступает поток насыщенного анолита (раствора NaCl). В результате электрохимического процесса на аноде за счёт разложения галита выделяется хлор, а на катоде за счёт разложения воды — водород. При этом прикатодная зона обогащается гидроксидом натрия.
Мембранный метод с твердым катодом
Мембранный метод по сути, аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной полимерной мембраной. Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении.
Ртутный метод с жидким катодом
Процесс проводят в электролитической ванне, которая состоит из электролизера, разлагателя и ртутного насоса, объединённых между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизера служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизер непрерывно течет поток анолита — раствора хлорида натрия. В результате электрохимического разложения хлорида на аноде образуются молекулы хлора, а на катоде выделившийся натрий растворяется в ртути образуя амальгаму.
Лабораторные методы
В лабораториях для получения хлора обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
- K2Cr2O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Хранение хлора
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Стандарты качества хлора
Согласно ГОСТ 6718-93 «Хлор жидкий. Технические условия» производятся следующие сорта хлора
| Наименование показателя ГОСТ 6718-93 | Высший сорт | Первый сорт |
|---|---|---|
| Объемная доля хлора, не менее, % | 99,8 | 99,6 |
| Массовая доля воды, не более, % | 0,01 | 0,04 |
| Массовая доля треххлористого азота, не более, % | 0,002 | 0,004 |
| Массовая доля нелетучего остатка, не более, % | 0,015 | 0,10 |
Применение
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
-
В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы.
 Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.
Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан. - Отбеливающие свойства хлора известны с давних времен, хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты: Cl2 + H2O → HCl + HClO → 2HCl + O•. Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков.
- Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет — в 30-х годах нашего столетия.
-
Использовался как боевое отравляющее вещество, а так же для производства других боевых отравляющих веществ: иприт, фосген.

-
Для обеззараживания воды — «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительно-восстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. СанПиН 2.1.4.1074-01 устанавливает следующие пределы (коридор)допустимого содержания свободного остаточного хлора в питьевой воде централизованного водоснабжения 0.3 — 0.5 мг/л. Ряд учёных и даже политиков в России критикуют саму концепцию хлорирования водопроводной воды, но альтернативы дезинфицирующему последействию соединений хлора предложить не могут. Материалы, из которых изготовлены водопроводные трубы, по разному взаимодействуют с хлорированной водопроводной водой. Свободный хлор в водопроводной воде существенно сокращает срок службы трубопроводов на основе полиолефинов: полиэтиленовых труб различного вида, в том числе сшитого полиэтилена, большие известного как ПЕКС (PEX, PE-X).
 В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. Положительную реакцию в части долговечности при взаимодействии с хлорированной водой демонстрируют медные трубы.
В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. Положительную реакцию в части долговечности при взаимодействии с хлорированной водой демонстрируют медные трубы. - В пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
- В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
- В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
- Как индикатор солнечных нейтрино в хлор-аргонных детекторах.
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Биологическая роль хлора
Солерос
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов.
У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путём снижения потенциала действия. В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3— (кислотно-щелочной баланс).
Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na+/K+ — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3— (кислотно-щелочной баланс).
Человек потребляет 5-10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки на которых нет конкуренции. Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредством листопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхнисти от солнечного света. В России галофиты произрастают на соляных куполах, выходах соляных отложений и засоленных понижениях вокруг соляных озёр Баскунчак, Эльтон.
Среди микроорганизмов, так же известны галофилы — галобактерии — которые обитают в сильносоленых водах или почвах.
Особенности работы и меры предосторожности
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т. е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
Дополнительная информация
Производство хлора в России
Хлорид золота
Хлорная вода
Хлорная известь
Хлорид первого основания Рейзе
Хлорид второго основания Рейзе
Соединения хлора
Гипохлориты
Перхлораты
Хлорангидриды
Хлораты
Хлориды
Хлорорганические соединения
Анализ хлора, выявление хлора — анализируется
— При помощи аналитического лабораторного оборудования, лабораторных и промышленных электродов, в частности: электродов сравнения ЭСр-10101 анализирующих содержание Cl— и К+.
Хлорные запросы, нас находят по запросам хлор
Взаимодействие, отравление, воде, реакции и получение хлора
- оксид
- раствор
- кислоты
- соединения
- свойства
- определение
- диоксид
- атом
- формула
- масса
- активный
- жидкий
- вещество
- применение
- действие
- степень окисления
- соли
- гидроксид
Галогены. Химия галогенов и их соединений
1. Положение галогенов в периодической системе химических элементов
2. Электронное строение галогенов
3. Физические свойства и нахождение в природе
4. Соединения галогенов
5. Способы получения галогенов
6. Химические свойства
Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с серой
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.1.6. Взаимодействие с галогенами
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с водой
6.2.2. Взаимодействие с щелочами
6.2.3. Взаимодействие с солями и галогеноводородами
6.2.4. Взаимодействие с восстановителями
Галогеноводороды
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Диссоциация
3.3. Взаимодействие с солями
3.4. Восстановительные свойства
3.5. Взаимодействие с оксидом кремния (IV)
Соли-галогениды
Способы получения галогенидов
Химические свойства галогенидов
Кислородсодержащие кислоты галогенов
1. Хлорноватистая кислота и ее соли
Хлорноватистая кислота и ее соли
2. Хлористая кислота и ее соли
3. Хлорноватая кислота и ее соли
4. Хлорная кислота и ее соли
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns2np5.
Например, электронная конфигурация фтора:
Электронная концигурация хлора:
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s22p5 | … 3s23p5 | … 4s24p5 | … 5s25p5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220оС | –101оС | –7оС | 113,5оС |
| Т кипения | –188оС | –34оС | 58оС | 185оС |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
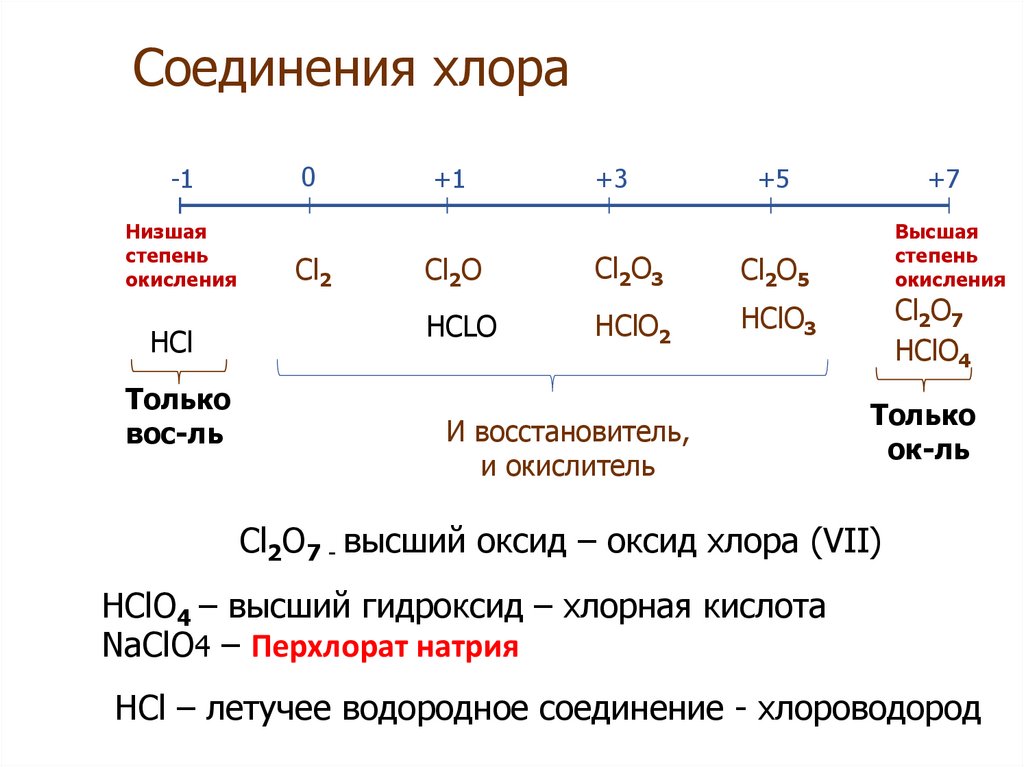
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются ионы натрия:
K(–): Na+ +1e → Na0
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза расплава хлорида натрия:
2Na+ + 2Cl− → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.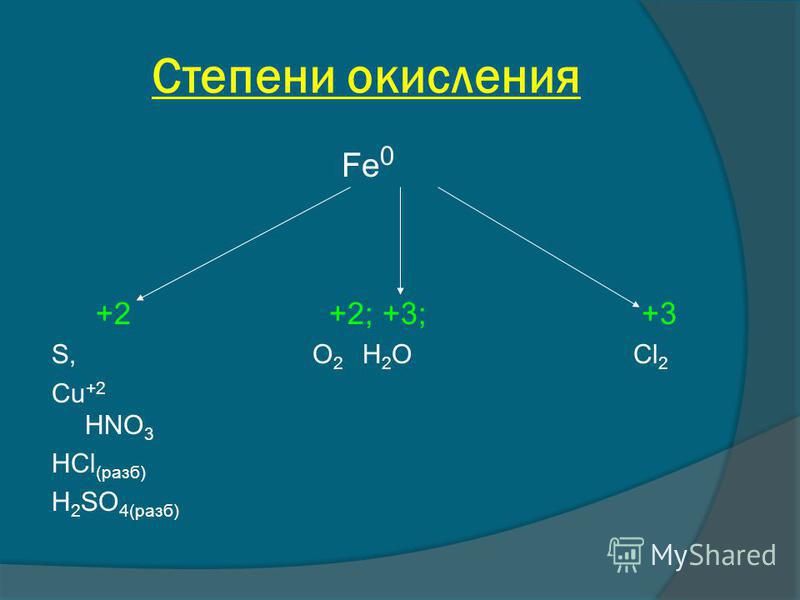
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na+ + Cl−
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH−
На аноде окисляются ионы хлора:
A(+): 2Cl− ̶ 2e → Cl20
Ионное уравнение электролиза раствора хлорида натрия:
2H2O + 2Cl− → H2°↑ + 2OH− + Cl2°↑
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например, взаимодействием соляной кислоты с оксидом марганца (IV)
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
2. Получение фтора.
Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
2KHF2 → 2K + H2 + 2F2
3. Получение брома.
Бром можно получить окислением ионов Br– сильными окислителями.
Например, бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например, оксид марганца (IV):
MnO2 + 4HBr → MnBr2 + Br2 + 2H2O
4. Получение йода.
Йод получают окислением ионов I– сильными окислителями.
Например, хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например, оксид марганца (IV) в кислой среде окисляет йодид калия:
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей. Галогены реагируют с металлами и неметаллами.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
2F2 + O2 → 2OF2
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1. 3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
2P + 5Cl2 → 2PCl5
2P + 3Cl2 → 2PCl3
2F2 + C → CF4
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например, железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
I2 + Fe → FeI2
Аналогичная ситуация с медью: фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
Cl2 + Cu → 2CuCl2
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример: алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
F2 + H2 → 2HF
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Cl2 + H2 → 2HCl
Бром также реагирует с водородом с образованием бромоводорода:
Br2 + H2 → 2HBr
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
I2 + H2 ↔ 2HI
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например, фтор окисляет хлор, бром и йод:
Cl2 + F2 → 2ClF
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например, хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлороватую кислоту:
Cl2 + 6H2O ↔ 5HCl + HClO3
Фтор реагирует с водой со взрывом:
2F2 + 2H2O → 4HF + O2
2. 2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например, хлор реагирует с холодным раствором гидроксидом натрия:
Сl2 + 2NaOH (хол.) → NaCl + NaClO + H2O
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
3Cl2 + 6NaOH (гор.) → 5NaCl + NaClO3 + 3H2O
Еще пример: хлор растворяется в холодном растворе гидроксида кальция:
2Сl2 + 2Са(OH)2(хол.) → СaCl2 + Сa(ClO)2 + 2H2O
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например, хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например, фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl+F–
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
Cl2 + I2 + H2O → HCl + HIO3
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например, хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Cl2 + H2O + Na2SO3 → 2HCl + Na2SO4
Также галогены окисляют пероксиды:
Cl2 + H2O2 → 2HCl + O2
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип. )
)
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например, действием концентрированной серной кислоты на хлорид натрия:
H2SO4(конц.) + NaCl(тверд.) → NaHSO4 + HCl↑
Галогеноводороды получают также прямым взаимодействием простых веществ:
Cl2 + H2 → 2HCl
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства. Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами. Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
В водном растворе галогеноводороды проявляют кислотные свойства. Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами. Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например, хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
6HCl + Al2O3 → 2AlCl3 + 3H2O
HCl + NaOH → NaCl + H2O
2HCl + Cu(OH)2 → CuCl2 + 2H2O
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
HCl + NH3 → NH4Cl
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами, расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
При этом образуются соль металла и водород.
Например, соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют, образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H+ + F–
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H+ + Cl–
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например, соляная кислота реагирует с карбонатом кальция:
2HCl + CaCO3 → CaCl2 + 2H2O + CO2
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами. При этом более активные галогены вытесняют менее активные.
Например, бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например: концентрированная соляная кислота окисляется оксидом марганца (IV):
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например, бромоводород окисляется концентрированной серной кислотой:
2HBr + H2SO4(конц. ) → Br2 + SO2 + 2H2O
) → Br2 + SO2 + 2H2O
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
14HBr + K2Cr2O7 → 2KBr + 2CrBr3 + 3Br2 + 7H2O
Или с оксидом марганца (IV):
4HBr + MnO2 → MnBr2 + Br2 + 2H2O
Пероксид водорода также окисляет бромоводород до молекулярного брома:
2HBr + H2O2 → Br2 + 2H2O
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например, йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
2HI + Fe2(SO4)3 → 2FeSO4 + I2 + H2SO4
Йодоводород легко окисляется соединениями азота, например, оксидом азота (IV):
2HI + NO2 → I2 + NO + H2O
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
SiO2 + 4HF → SiF4 + 2H2O
SiO2 + 6HF(изб) → H2[SiF6] + H2O
Галогениды металловГалогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами. При этом галогены проявляют свойства окислителя.
Например, хлор взаимодействует с магнием и кальцием:
Cl2 + Mg → MgCl2
Cl2 + Ca → CaCl2
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например, соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например, при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример: взаимодействие оксида алюминия с соляной кислотой:
6HCl + Al2O3 → 2AlCl3 + 3H2O
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например, при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
2HCl + Cu(OH)2 → CuCl2 + 2H2O
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например, гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями, если образуется осадок, газ или вода.
Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями, если образуется осадок, газ или вода.
Например, бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами. При этом более активные металлы вытесняют менее активные.
Например, магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например, натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например, при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
2KBr + 2H2O → H2↑ + 2KOH + Br2↑
4. Галогениды металлов проявляют восстановительные свойства. Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями.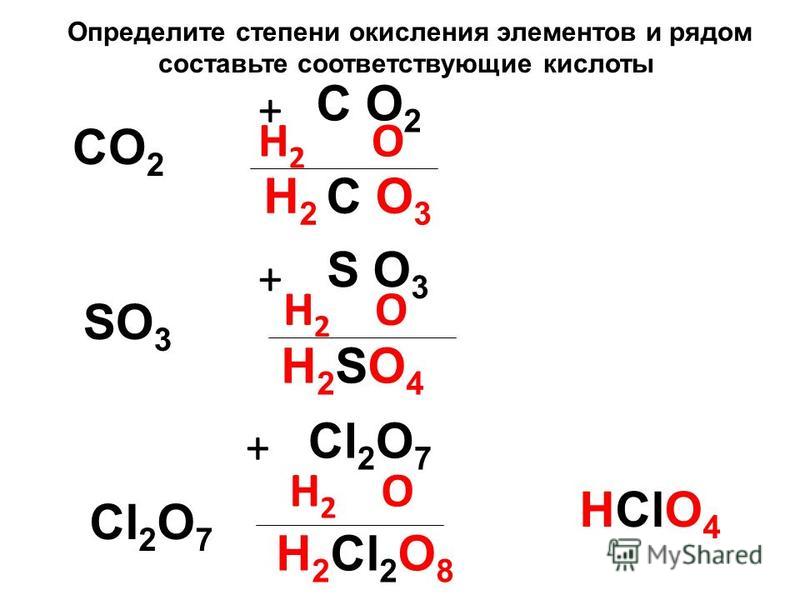 В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например, бромид калия окисляется концентрированной серной кислотой:
2KBr + 2H2SO4 (конц.) → 4K2SO4 + 4Br2 + SO2 + 2H2O
Еще пример: йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
8KI + 5H2SO4 (конц.) → 4K2SO4 + 4I2 + H2S + 4H2O или
8KI + 9H2SO4 (конц.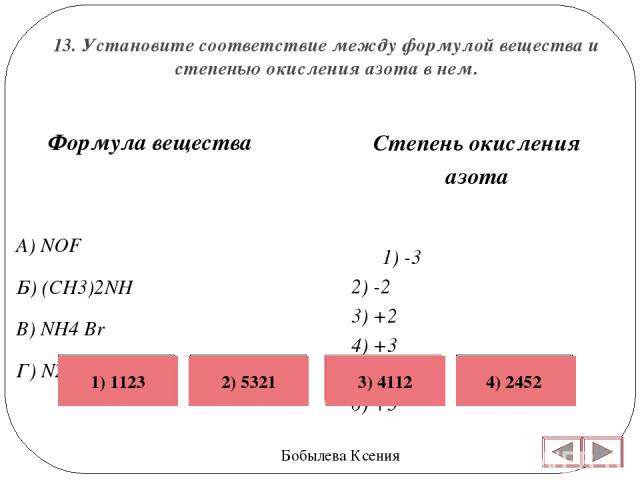 ) → 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
) → 4I2↓ + H2S↑ + 8KHSO4 + 4H2O
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
10KI + 8H2SO4 + 2KMnO4 → 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
6KI + 7H2SO4 + K2Cr2O7 → Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2KI + H2SO4 + H2O2 → I2 + K2SO4 + 2H2O
2KI + Fe2(SO4)3 → I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + H2O → 2CuI + 2K2SO4 + H2SO4
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака.
Например, хлорид серебра (I) растворяется под действием избытка раствора аммиака:
AgCl + NH3 → [Ag(NH3)2]Cl
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например, хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогеновРассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде:
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается:
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями.
Например, с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например, хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например, пероксид водорода:
HClO + H2O2 → HCl + H2O + O2
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например, соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Ca(ClO)2 + H2SO4 → CaSO4 + 2HCl + O2
Даже угольная кислота вытесняет гипохлориты:
Ca(ClO)2 + CO2 + H2O → CaCO3 + 2HClO
2. Гипохлориты вступают в обменные реакции с другими солями, если образуется слабый электролит.
Гипохлориты вступают в обменные реакции с другими солями, если образуется слабый электролит.
Например, гипохлорит кальция реагирует с растворимыми карбонатами:
Ca(ClO)2 + Na2CO3 → CaCO3 + 2NaClO
3. При нагревании гипохлориты разлагаются:
Ca(ClO)2 → CaCl2 + O2
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
2ClO2 + H2O2 → 2HClO2 + O2
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
Реагирует с щелочами с образованием хлоритов:
HClO2 + KOH → KClO2 + H2O
2. При длительном хранении разлагается:
4HClO2 → HCl + HClO3 + 2ClO2 + H2O
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например, из хлората бария под действием серной кислоты:
Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
HClO3 + KOH → KClO3 + H2O
2. Хлорноватая кислота – сильный окислитель.
Хлорноватая кислота – сильный окислитель.
Например, хлорноватая кислота окисляет фосфор:
6P + 5HClO3 → 3P2O5 + 5HCl
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например, хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример: хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
5KClO3 + 6P → 5KCl + 3P2O5
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например, из перхлората натрия под действием серной кислоты:
2NaClO4 + H2SO4 → 2HClO4 + Na2SO4
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
HClO4 + KOH → KClO4 + H2O
2. Хлорная кислота – сильный окислитель.
Например, хлорная кислота окисляет углерод:
8HClO4 + 14C → 14CO2 + 4Cl2 + 4H2O
3. При нагревании хлорная кислота разлагается:
4HClO4 → 4ClO2 + 3O2 + 2H2O
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Перхлораты – сильные окислители.
Например, перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
KClO4 → KCl + 2O2↑
Еще пример: перхлорат калия окисляет алюминий:
3KClO4 + 8Al → 3KCl + 4Al2O3
Понравилось это:
Нравится Загрузка…
Урок «Путешествие на остров оснований»
Цель урока:
- Образовательная: формирование у учащихся знаний о составе, классификации, названии оснований.
- Развивающая: развитие учебно-информационных умений – составление конспекта, схем; учебно-логических умений – осуществление качественного и количественного описания объекта.
- Воспитательная: воспитание
грамотности проведения химического
эксперимента, соблюдения определенных норм
поведения в процессе выполнения лабораторного
опыта.

Оборудование: таблица растворимости, таблица “Окраска индикаторов в различных средах”, инструктивные карточки по технике безопасности, штативы с пробирками, стеклянные трубки, растворы гидроксида натрия, фенолфталеина, метилового оранжевого, известковая вода, свежеприготовленные гидроксид меди, гидроксид железа.
Ход урока
Организационный момент.
Представление кроссворда, разгадав который, дети узнают, что отправятся в путешествие на остров оснований.
- Самый распространенный оксид на Земле.
- Вещества, состоящие из двух элементов, один из которых кислород со степенью окисления -2.
- Цифры, стоящие внизу справа от химического символа в формулах веществ.
- Положительно или отрицательно заряженные
частицы, образовавшиеся в результате отдачи или
принятия электронов.

- Одно из физических свойств металлов.
- Соединения, состоящие из двух элементов.
- Атом этого химического элемента содержит 30 электронов.
- Соединения металлов с водородом.
- Масса одного моля вещества.
Знакомство учащихся с этапами урока:
- Рифы домашнего задания
- Остров оснований
- Долина качественных реакций
- Родник знаний
- По дороге домой
- Результаты путешествия.
Рифы домашнего задания.
Поверка домашнего задания – упражнение № 1 страница 97 (Автор учебника О. С. Габриелян).
Работа по карточкам
Вариант 1.
- Дайте названия оксидам: Cao, SO3, K2O, N2O5.
- Составьте формулу — оксид хлора (5)
Вариант 2.
- Дайте названия оксидам: N2O, CuO, P2O3, SO2.

- Составьте формулу – оксид алюминия
Вариант 3.
- Дайте названия оксидам: CO, Cl2O5, Cu2O, AL2O3.
- Составьте формулу – оксид углерода (4)
Остров оснований.
Учащиеся самостоятельно работают с учебником с. 98-99 и составляют конспект.
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионов. —
Гидроксид-ион ОН — сложный ион, в состав которого входит кислород (степень окисления -2) и водород (степень окисления -1). Суммарный заряд иона 1-.
Названия оснований – гидроксид + наименование металла в родительном падеже
+1
NaOH – гидроксид натрия
+2
Ca(OH)2 –гидроксид кальция
+3
Fe(OH)3 – гидроксид железа (3)
Основания
| Растворимые в воде | Нерастворимые в воде |
| NaOH, KOH, Ca(OH)2 | Cu(OH)2,Fe(OH)3 |
Растворимые в воде основания называются щелочами
Проверка конспекта, отработка понятий
“основания”, “гидроксид-ион”, “щелочи”,
работа с таблицей растворимости, демонстрация
нерастворимых в воде оснований – гидроксидов
меди и железа.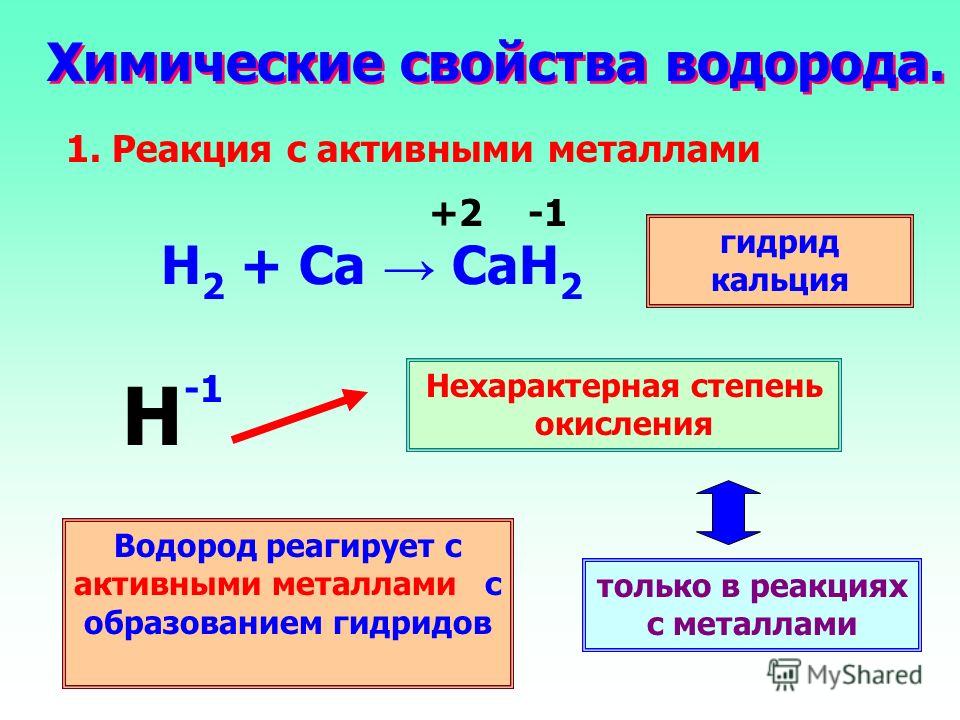
Интеллектуальная физминутка.
На доске записаны формулы веществ, нужно определить степени окисления элементов, подчеркнуть основания. Для каждого ряда свое задание, количество формул должно быть одинаковое. Если на первом и втором ряду по восемь человек, а на третьем 6, то все равно количество заданий должно быть 8. Разминка проходит в виде эстафеты, только эстафетной палочкой будет мел. Ученик, выполнивший задание, передает мел другому и только тогда тот может выйти к доске. Учитываются скорость и правильность выполнения заданий.
| 1 ряд | 2 ряд | 3 ряд |
| NaCl | CuO | Fe(OH)3 |
| Cah3 | LiOH | PCl5 |
| Ba(OH)2 | Ca3N2 | KOH |
| Fe2O3 | Fe(OH)2 | NaH |
| Al(OH)3 | Cl2O7 | FeO |
| CaO | KF | Zn(OH)2 |
| Li3N | Mg(OH)2 | Al2O3 |
| Ca(OH)2 | Na2O | CaCl2 |
Долина качественных реакций
Учитель рассказывает, что можно то или иное
вещество распознать при помощи качественных
реакций. Например, для распознавания углекислого
газа служит реакция помутнения известковой воды
(прозрачный раствор гидроксида кальция) –
рисунок 58 на странице 100.
Например, для распознавания углекислого
газа служит реакция помутнения известковой воды
(прозрачный раствор гидроксида кальция) –
рисунок 58 на странице 100.
Определение в тетрадь:
Качественные реакции – это те реакции, при помощи которых можно распознать определенные вещества.
Учащиеся знакомятся с правилами работы с едкими веществами и проводят опыт на распознавание углекислого газа.
Далее учитель сообщает, что растворы щелочей можно распознать при помощи индикаторов и знакомит учащихся с таблицей “Изменение окраски индикаторов в различных средах”.
Учащиеся самостоятельно проводят опыты по изменению окраски фенолфталеина и метилового оранжевого в щелочной среде.
Родник знаний
На этом этапе урока проводится закрепление знаний.
Составьте формулы оснований по названию
- гидроксид лития
- гидроксид бария.

- гидроксид алюминия
- гидроксид магния
Определите растворимые и нерастворимые основания по таблице растворимости
Mn(OH)2, LiOH, Al(OH)3, Ba(OH)2.
Тест
1 вариант
1. Степень окисления кислорода в гидроксид-ионе
а) +1
б) -1
в) +2
2. Выберите нерастворимое в воде основание
а) NaOH
б) LiOH
в) Fe(OH)2
3. Прозрачный раствор гидроксида кальция называют
а) известковая вода
б) негашеная известь
в) известковое молоко
4. Фенолфталеин в щелочной среде
а) бесцветный
б) малиновый
в) желтый
5. Заряд иона магния в гидроксиде
а) +2
б) +1
в) +3
2 вариант
1. Степень окисления водорода в гидроксид-ионе
Степень окисления водорода в гидроксид-ионе
а) +1
б) -1
в) -2
2. Выберите нерастворимое в воде основание
а) KOH
б) Ba(OH)2
в) Zn(OH)2
3. Щелочи – это
а) нерастворимые в воде основания
б) растворимые в воде основания
4. Метиловый оранжевый в щелочной среде
а) бесцветный
б) малиновый
в) желтый
5. Заряд иона алюминия в гидроксиде
а) +2
б) +1
в) +3
По дороге домой
Дома: параграф 19 – изучить, конспект в тетради выучить, упр. № 2, 5(а) – письменно,
№1 – устно
Результаты путешествия
Подведение итогов урока.
кальций | Определение, свойства и соединения
кальций
Посмотреть все СМИ
- Ключевые люди:
- сэр Хамфри Дэви Иоганн Вольфганг Доберейнер
- Похожие темы:
- химический элемент щелочноземельный металл дефицит кальция
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
кальций (Ca) , химический элемент, один из щелочноземельных металлов группы 2 (IIa) периодической таблицы. Это самый распространенный металлический элемент в организме человека и пятый по распространенности элемент в земной коре.
Это самый распространенный металлический элемент в организме человека и пятый по распространенности элемент в земной коре.
| атомный номер | 20 | ||
|---|---|---|---|
| атомный вес | 40,078 | точка плавления0035 | 842 °C (1,548 °F) |
| boiling point | 1,484 °C (2,703 °F) | ||
| specific gravity | 1.55 (20 °C, or 68 °F) | ||
| oxidation state | +2 | ||
| electron configuration | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 с 2 |
Кальций не встречается в природе в свободном состоянии, но соединения этого элемента широко распространены. Одно соединение кальция, известь (оксид кальция, CaO), широко использовалось древними. Сам серебристый, довольно мягкий, легкий металл был впервые выделен (1808 г.) сэром Хамфри Дэви после дистилляции ртути из амальгамы, образованной путем электролиза смеси извести и оксида ртути. Название элемента произошло от латинского слова «известь», calx 9.0074 .
Одно соединение кальция, известь (оксид кальция, CaO), широко использовалось древними. Сам серебристый, довольно мягкий, легкий металл был впервые выделен (1808 г.) сэром Хамфри Дэви после дистилляции ртути из амальгамы, образованной путем электролиза смеси извести и оксида ртути. Название элемента произошло от латинского слова «известь», calx 9.0074 .
Кальций составляет 3,64 процента земной коры и 8 процентов лунной коры, а его космическое содержание оценивается в 4,9 × 10 4 атомов (по шкале, где содержание кремния составляет 10 6 атомов). В виде кальцита (карбоната кальция) он встречается на Земле в известняке, меле, мраморе, доломите, яичной скорлупе, жемчуге, кораллах, сталактитах, сталагмитах и панцирях многих морских животных. Отложения карбоната кальция растворяются в воде, содержащей углекислый газ, с образованием бикарбоната кальция Ca(HCO 3 ) 2 . Этот процесс часто приводит к образованию пещер и может привести к отложению известняка в виде сталактитов и сталагмитов. В виде гидроксилфосфата кальция он является основным неорганическим компонентом зубов и костей и встречается в виде минерального апатита. Как фторид кальция, он встречается в виде флюорита или плавикового шпата. А в виде сульфата кальция он встречается в виде ангидрита. Кальций содержится во многих других минералах, таких как арагонит (разновидность карбоната кальция) и гипс (другая форма сульфата кальция), а также во многих полевых шпатах и цеолитах. Встречается также в большом количестве силикатов и алюмосиликатов, в солевых отложениях, в природных водах, в том числе морских.
В виде гидроксилфосфата кальция он является основным неорганическим компонентом зубов и костей и встречается в виде минерального апатита. Как фторид кальция, он встречается в виде флюорита или плавикового шпата. А в виде сульфата кальция он встречается в виде ангидрита. Кальций содержится во многих других минералах, таких как арагонит (разновидность карбоната кальция) и гипс (другая форма сульфата кальция), а также во многих полевых шпатах и цеолитах. Встречается также в большом количестве силикатов и алюмосиликатов, в солевых отложениях, в природных водах, в том числе морских.
Чистый металлический кальций, который раньше производился электролизом безводного хлорида кальция, теперь производится в промышленных масштабах путем нагревания извести с алюминием. Металл медленно реагирует с кислородом, водяным паром и азотом воздуха с образованием желтого покрытия из оксида, гидроксида и нитрида. Он сгорает на воздухе или в чистом кислороде с образованием оксида и быстро реагирует с теплой водой (и медленнее с холодной водой) с образованием газообразного водорода и гидроксида кальция. При нагревании кальций реагирует с водородом, галогенами, бором, серой, углеродом и фосфором. Хотя он выгодно отличается от натрия в качестве восстановителя, кальций дороже и менее реакционноспособен, чем последний. Однако во многих применениях для раскисления, восстановления и дегазации кальций предпочтительнее из-за его более низкой летучести и используется для получения хрома, тория, урана, циркония и других металлов из их оксидов.
При нагревании кальций реагирует с водородом, галогенами, бором, серой, углеродом и фосфором. Хотя он выгодно отличается от натрия в качестве восстановителя, кальций дороже и менее реакционноспособен, чем последний. Однако во многих применениях для раскисления, восстановления и дегазации кальций предпочтительнее из-за его более низкой летучести и используется для получения хрома, тория, урана, циркония и других металлов из их оксидов.
Britannica Викторина
118 Названий и символов периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Сам металл используется в качестве легирующего агента для алюминия, меди, свинца, магния и других недрагоценных металлов; как раскислитель для некоторых жаропрочных сплавов; и как газопоглотитель в электронных лампах. Небольшие проценты кальция используются во многих сплавах специального назначения. Легированный свинцом (0,04% кальция), например, используется в качестве оболочек для телефонных кабелей и в качестве сеток для аккумуляторных батарей стационарного типа. При добавлении к сплавам на основе магния в количестве от 0,4 до 1 процента он повышает устойчивость разлагаемых ортопедических имплантатов к биологическим жидкостям, позволяя тканям полностью заживать до того, как имплантаты потеряют свою структурную целостность.
Небольшие проценты кальция используются во многих сплавах специального назначения. Легированный свинцом (0,04% кальция), например, используется в качестве оболочек для телефонных кабелей и в качестве сеток для аккумуляторных батарей стационарного типа. При добавлении к сплавам на основе магния в количестве от 0,4 до 1 процента он повышает устойчивость разлагаемых ортопедических имплантатов к биологическим жидкостям, позволяя тканям полностью заживать до того, как имплантаты потеряют свою структурную целостность.
Встречающийся в природе кальций состоит из смеси шести изотопов: кальция-40 (96,94 процента), кальция-44 (2,09 процента), кальция-42 (0,65 процента) и, в меньших пропорциях, кальция-48, кальция-43, и кальций-46. Кальций-48 подвергается двойному бета-распаду с периодом полураспада примерно 4 × 10 19 лет, поэтому он стабилен для всех практических целей. Он особенно богат нейтронами и используется в синтезе новых тяжелых ядер в ускорителях частиц. Радиоактивный изотоп кальция-41 встречается на Земле в следовых количествах в результате естественной бомбардировки кальция-40 нейтронами космических лучей.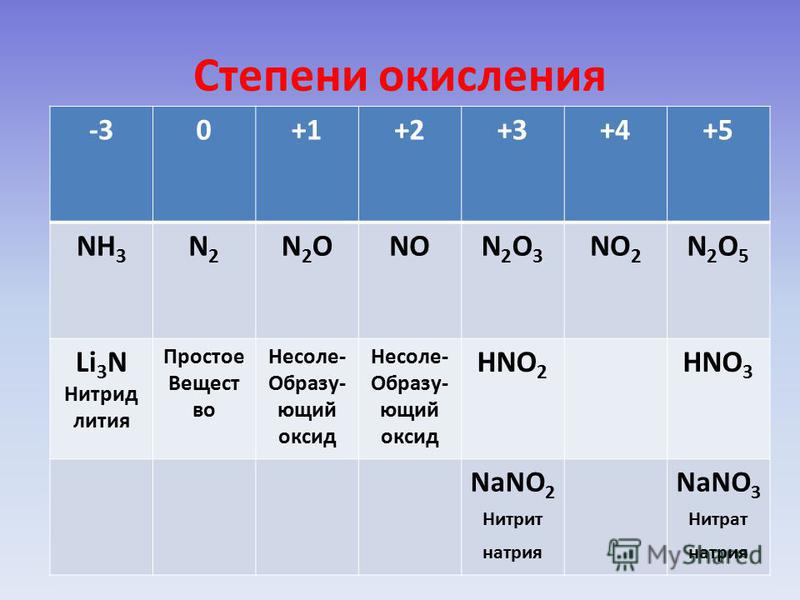
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Кальций необходим как для растений, так и для животных и широко используется в качестве преобразователя сигналов, ферментного кофактора и структурного элемента (например, клеточных мембран, костей и зубов). Большое количество живых организмов концентрирует кальций в своих панцирях или скелетах, а у высших животных кальций является наиболее распространенным неорганическим элементом. Многие важные месторождения карбонатов и фосфатов обязаны своим происхождением живым организмам.
Человеческое тело состоит из 2 процентов кальция. Основными источниками кальция в рационе человека являются молоко, молочные продукты, рыба и зеленые листовые овощи. Заболевание костей рахит возникает, когда недостаток витамина D ухудшает всасывание кальция из желудочно-кишечного тракта во внеклеточную жидкость. Заболевание особенно поражает младенцев и детей.
Двуокись хлора в качестве дезинфицирующего средства
Двуокись хлора
Двуокись хлора в основном используется в качестве отбеливателя.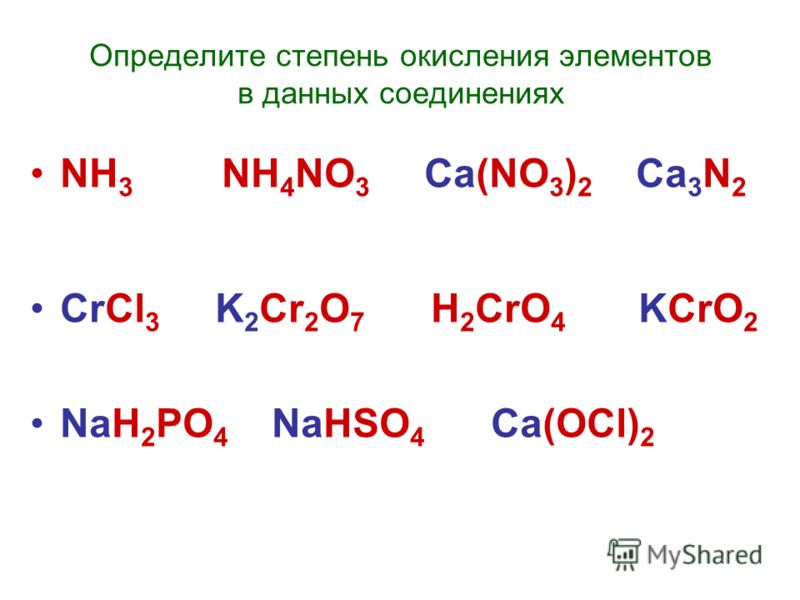 В качестве дезинфицирующего средства он эффективен даже при низких концентрациях благодаря своим уникальным свойствам.
В качестве дезинфицирующего средства он эффективен даже при низких концентрациях благодаря своим уникальным свойствам.
Рисунок 1: сэр Хамфри Дэй открыл диоксид хлора в 1814 году.
Когда был открыт диоксид хлора?
Диоксид хлора был открыт в 1814 году сэром Хамфри Дэви. Он произвел газ, выливая серную кислоту (H 2 SO 4 ) на хлорат калия (KClO 3 ). Затем он заменил серную кислоту на хлорноватистую кислоту (HOCl). В последние несколько лет эта реакция также использовалась для получения больших количеств диоксида хлора. Хлорат натрия (NaClO 3 ) вместо хлората калия.
2NaClO 3 + 4HCl® 2ClO 2 + Cl 2 + 2NaCl + 2H 2 O
Каковы характеристики диоксида хлора?
Диоксид хлора (ClO 2 ) представляет собой синтетический зелено-желтоватый газ с хлороподобным раздражающим запахом. Диоксид хлора является нейтральным соединением хлора. Диоксид хлора сильно отличается от элементарного хлора как по своей химической структуре, так и по своему поведению. Диоксид хлора представляет собой небольшую, летучую и очень прочную молекулу. В разбавленных водных растворах диоксид хлора является свободным радикалом. При высоких концентрациях сильно реагирует с восстановителями. Диоксид хлора — нестабильный газ, который диссоциирует на газообразный хлор (Cl 2 ), газообразный кислород (O 2 ) и тепло. Когда диоксид хлора фотоокисляется солнечным светом, он распадается. Конечными продуктами реакции диоксида хлора являются хлорид (Cl —), хлорит (ClO —) и хлорат (ClO 3 —).
Диоксид хлора сильно отличается от элементарного хлора как по своей химической структуре, так и по своему поведению. Диоксид хлора представляет собой небольшую, летучую и очень прочную молекулу. В разбавленных водных растворах диоксид хлора является свободным радикалом. При высоких концентрациях сильно реагирует с восстановителями. Диоксид хлора — нестабильный газ, который диссоциирует на газообразный хлор (Cl 2 ), газообразный кислород (O 2 ) и тепло. Когда диоксид хлора фотоокисляется солнечным светом, он распадается. Конечными продуктами реакции диоксида хлора являются хлорид (Cl —), хлорит (ClO —) и хлорат (ClO 3 —).
При температуре –59°C твердый диоксид хлора становится красноватой жидкостью. При 11°С диоксид хлора превращается в газ.
Двуокись хлора в 2,4 раза плотнее воздуха. Поскольку жидкий диоксид хлора имеет большую плотность, чем вода.
Может ли диоксид хлора растворяться в воде?
Одним из наиболее важных качеств диоксида хлора является его высокая растворимость в воде, особенно в холодной воде. Диоксид хлора не гидролизуется при попадании в воду; он остается растворенным газом в растворе. Диоксид хлора растворим в воде примерно в 10 раз лучше, чем хлор. Диоксид хлора можно удалить аэрацией или диоксидом углерода.
Диоксид хлора не гидролизуется при попадании в воду; он остается растворенным газом в растворе. Диоксид хлора растворим в воде примерно в 10 раз лучше, чем хлор. Диоксид хлора можно удалить аэрацией или диоксидом углерода.
Таблица 1: растворимость диоксида хлора в воде
| Температура (° C) | Давление (мм рт.| 1.82 | | |
| 25 | 22.1 | 1.13 | |
| 25 | 13.4 | 0.69 | |
| 40 | 8.4 | 2.63 | |
| 40 | 56.2 | 1.60 | |
| 40 | 18.8 | 0.83 | |
| 40 | 9.9 | 0.47 | |
| 60 | 106.9 | 2.65 | |
| 60 | 53,7 | 1,18 | |
| 60 | 21,3 | 0,58 | |
| 60 | 12,0 | 0,26 | 0,26 | 99999999999999999999999999999999999999999999999999999999999909а0,26 | 0,26 | . 0002 Как можно хранить диоксид хлора? 0002 Как можно хранить диоксид хлора? Диоксид хлора лучше всего хранить в жидком виде при температуре 4 ºC. В этом состоянии он достаточно стабилен. Диоксид хлора нельзя хранить слишком долго, потому что он медленно диссоциирует на хлор и кислород. Его редко хранят в виде газа, поскольку он взрывоопасен под давлением. При концентрации диоксида хлора в воздухе более 10 % возникает опасность взрыва. В водном растворе диоксид хлора остается стабильным и растворимым. Водные растворы, содержащие примерно 1% ClO 2 (10 г/л) можно безопасно хранить при условии, что они защищены от воздействия света и тепла. Диоксид хлора перевозится редко из-за его взрывоопасности и нестабильности. Обычно изготавливается на месте. Как производится диоксид хлора? К основным реакциям относятся: 2NaClO 2 + Cl 2 ® 2ClO 2 + 2NaCl And: Альтернативой является: 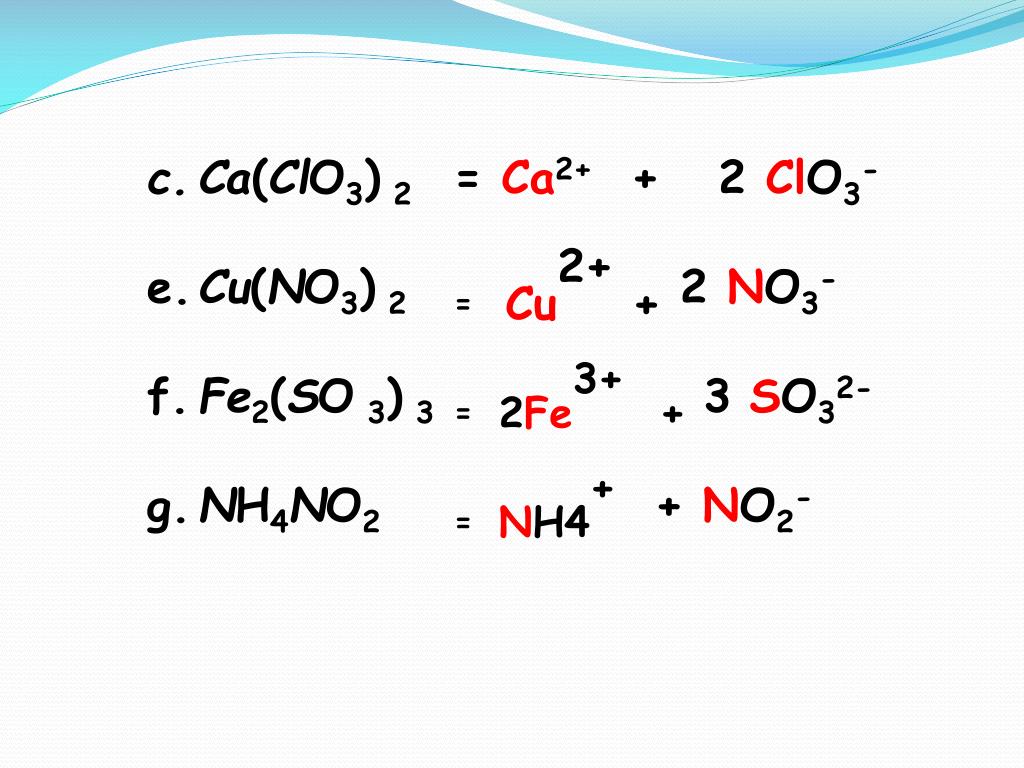 2 . также может быть получен реакцией гипохлорита натрия с соляной кислотой: 2 . также может быть получен реакцией гипохлорита натрия с соляной кислотой: HCl + NaOCl + 2NaClO 2 ® 2ClO 2 + 2NaCl + NaOH Количество образующегося диоксида хлора варьируется от 0 до 50 г/л. Каковы области применения диоксида хлора? Диоксид хлора как окислитель Рисунок 2: диоксид хлора является более селективным окислителем, чем хлор. При дозировании тех же концентраций остаточная концентрация диоксида хлора при сильном загрязнении намного выше, чем остаточная концентрация хлора. Сравнивая окислительную способность и окислительную способность различных дезинфицирующих средств, можно сделать вывод, что диоксид хлора эффективен при низких концентрациях. Диоксид хлора не так реактивен, как озон или хлор, и реагирует только с сернистыми веществами, аминами и некоторыми другими реактивными органическими веществами. По сравнению с хлором и озоном для получения активного остаточного дезинфицирующего средства требуется меньше диоксида хлора. Его также можно использовать при наличии большого количества органических веществ. Сила окисления показывает, насколько сильно окислитель реагирует с окисляемым веществом. Озон имеет самую высокую силу окисления и реагирует со всеми веществами, которые могут быть окислены. Диоксид хлора слаб, его потенциал ниже, чем у хлорноватистой или бромноватистой кислоты. Таблица 2: потенциалы окисления различных окислителей.
Следующие сравнения показывают, что происходит, когда вступает в реакцию диоксид хлора. Ион хлорита окисляется и становится ионом хлорида: Эти сравнения показывают, что хлор и диоксид 5 в ходе этой реакции восстанавливаются до хлорида, электроны. Атом хлора остается до тех пор, пока не образуется стабильный хлорид. Это объясняет, почему не образуются хлорированные вещества. Когда хлор реагирует, он не только принимает электроны; он также принимает участие в реакциях присоединения и замещения. В ходе этих реакций к инородному веществу присоединяются один или несколько атомов хлора. Таблица 3: Доступность хлора на моль
|

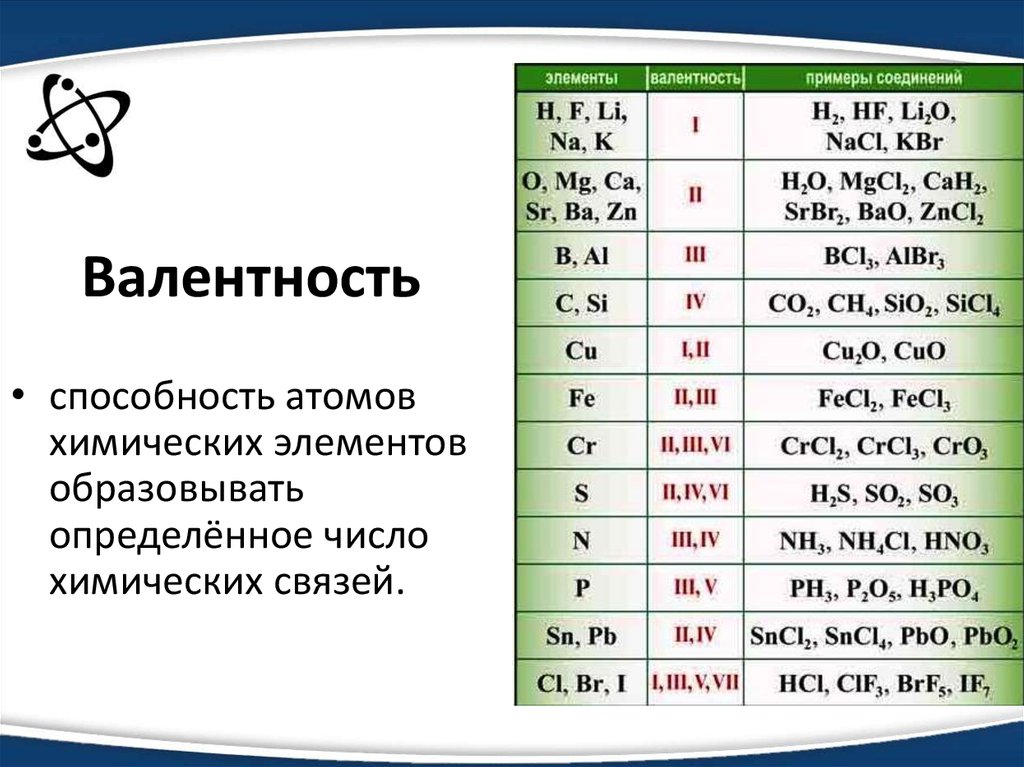 Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.
Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан.
 В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. Положительную реакцию в части долговечности при взаимодействии с хлорированной водой демонстрируют медные трубы.
В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. Положительную реакцию в части долговечности при взаимодействии с хлорированной водой демонстрируют медные трубы.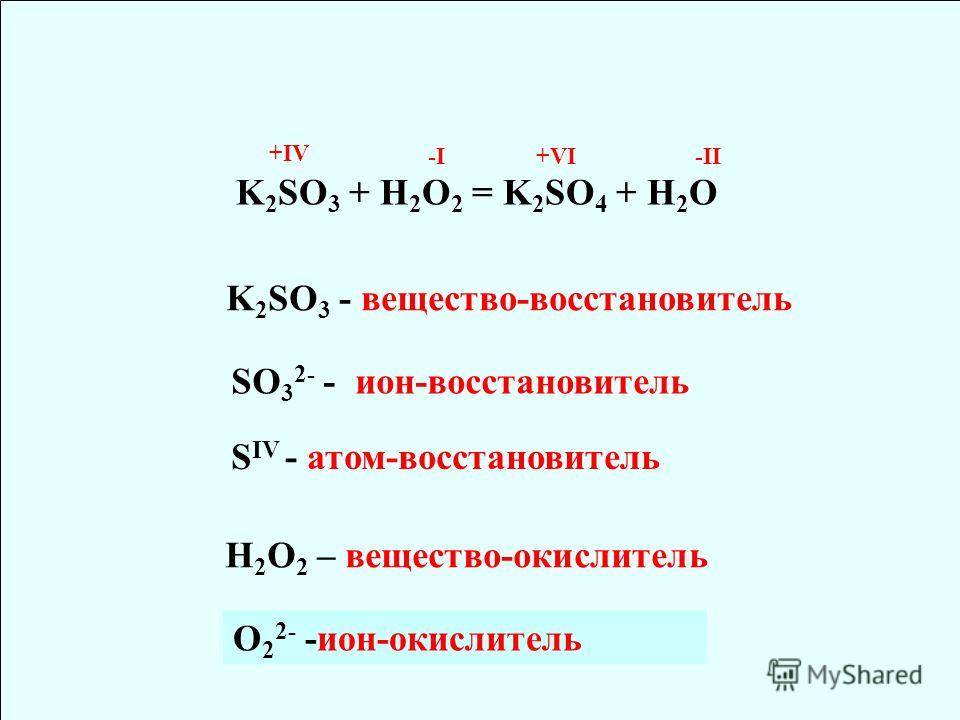


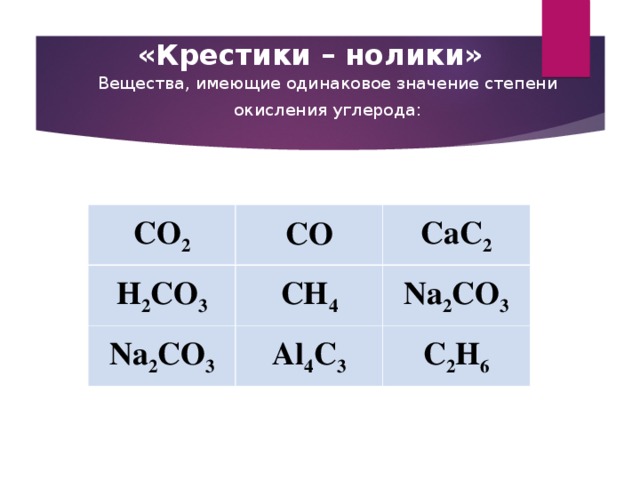
 В крупных установках для производства диоксида хлора на месте используются хлорит натрия, газообразный хлор (Cl 2 ), гидрохлорит натрия (NaHClO 2 ) и серная или водородная кислота.
В крупных установках для производства диоксида хлора на месте используются хлорит натрия, газообразный хлор (Cl 2 ), гидрохлорит натрия (NaHClO 2 ) и серная или водородная кислота. 

 По этой причине диоксид хлора при восстановлении до хлорида принимает 5 электронов. Когда мы смотрим на молекулярную массу, двуокись хлора содержит 263% «доступного хлора»; это более чем в 2,5 раза превышает окислительную способность хлора.
По этой причине диоксид хлора при восстановлении до хлорида принимает 5 электронов. Когда мы смотрим на молекулярную массу, двуокись хлора содержит 263% «доступного хлора»; это более чем в 2,5 раза превышает окислительную способность хлора. Сначала диоксид хлора поглощает электрон и восстанавливается до хлорита:
Сначала диоксид хлора поглощает электрон и восстанавливается до хлорита: 
 При нейтральном pH или при высоких значениях pH серная кислота (H 2 SO 4 ) восстанавливает диоксид хлора до ионов хлорита (ClO 2 — ). В щелочной среде диоксид хлора распадается на хлорит и хлорат (ClO 3 — ) :
При нейтральном pH или при высоких значениях pH серная кислота (H 2 SO 4 ) восстанавливает диоксид хлора до ионов хлорита (ClO 2 — ). В щелочной среде диоксид хлора распадается на хлорит и хлорат (ClO 3 — ) :  Кроме того, диоксид хлора не образует большого количества альдегидов, кетонов, кетоновых кислот или других побочных продуктов дезинфекции, возникающих при озонировании органических веществ.
Кроме того, диоксид хлора не образует большого количества альдегидов, кетонов, кетоновых кислот или других побочных продуктов дезинфекции, возникающих при озонировании органических веществ.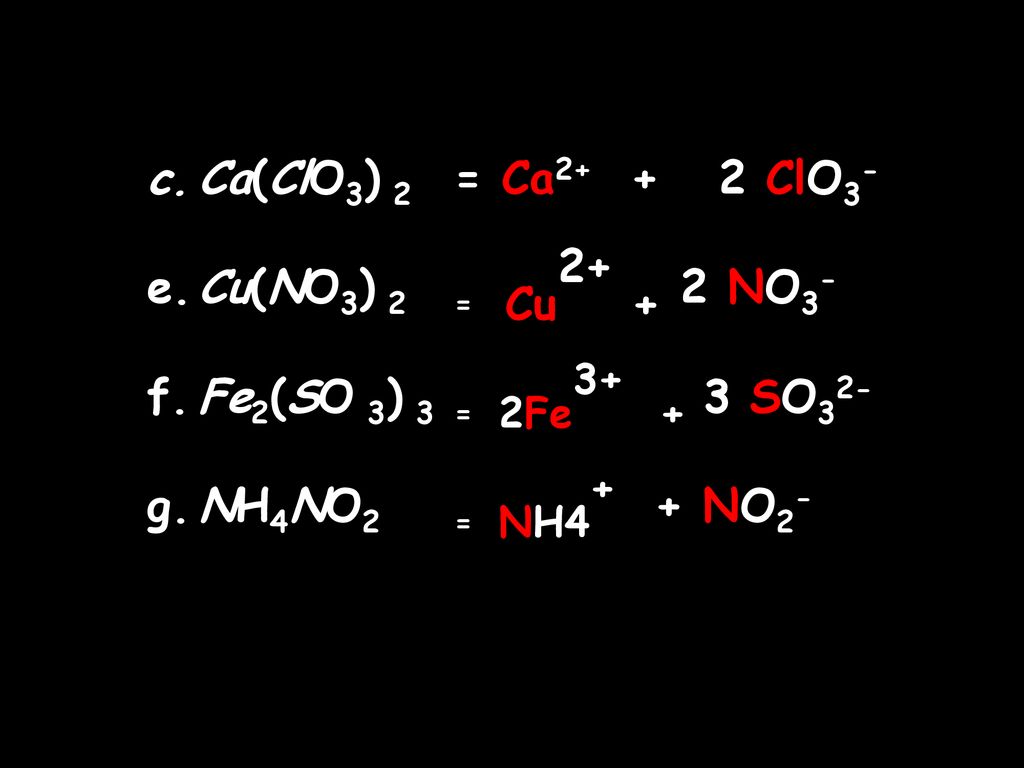 Диоксид хлора реагирует только с веществами, испускающими электрон. Хлор, напротив, присоединяет атом хлора или замещает атом хлора из вещества, с которым он реагирует.
Диоксид хлора реагирует только с веществами, испускающими электрон. Хлор, напротив, присоединяет атом хлора или замещает атом хлора из вещества, с которым он реагирует.
 Микроорганизмы не могут выработать устойчивость к диоксиду хлора.
Микроорганизмы не могут выработать устойчивость к диоксиду хлора. На первой стадии молекула диоксида хлора принимает электрон и образуется хлорит (ClO 3 ). На второй стадии диоксид хлора принимает 4 электрона и образует хлорид (Cl —). В воде немного хлората (ClO 3 ), который образуется при производстве диоксида хлора. И хлорат, и хлорит являются окислителями. Диоксид хлора, хлорат и хлорит диссоциируют на хлорид натрия (NaCl).
На первой стадии молекула диоксида хлора принимает электрон и образуется хлорит (ClO 3 ). На второй стадии диоксид хлора принимает 4 электрона и образует хлорид (Cl —). В воде немного хлората (ClO 3 ), который образуется при производстве диоксида хлора. И хлорат, и хлорит являются окислителями. Диоксид хлора, хлорат и хлорит диссоциируют на хлорид натрия (NaCl). Добавляя диоксид хлора на стадии предварительного окисления при очистке поверхностных вод, можно предотвратить рост водорослей и бактерий на следующих стадиях. Диоксид хлора окисляет плавающие частицы и способствует процессу коагуляции и удалению мути из воды.
Добавляя диоксид хлора на стадии предварительного окисления при очистке поверхностных вод, можно предотвратить рост водорослей и бактерий на следующих стадиях. Диоксид хлора окисляет плавающие частицы и способствует процессу коагуляции и удалению мути из воды.


 Диоксид хлора не реагирует с аммиачным азотом, аминами или другими окисляемыми органическими веществами. Диоксид хлора удаляет вещества, которые могут образовывать тригалометаны, и улучшает коагуляцию. Он не окисляет бромид в бром. Когда вода, содержащая бромид, обрабатывается хлором или озоном, бромид окисляется до брома и бромноватистой кислоты. После этого они реагируют с органическим материалом с образованием бромированных побочных продуктов дезинфекции, например бромоформа.
Диоксид хлора не реагирует с аммиачным азотом, аминами или другими окисляемыми органическими веществами. Диоксид хлора удаляет вещества, которые могут образовывать тригалометаны, и улучшает коагуляцию. Он не окисляет бромид в бром. Когда вода, содержащая бромид, обрабатывается хлором или озоном, бромид окисляется до брома и бромноватистой кислоты. После этого они реагируют с органическим материалом с образованием бромированных побочных продуктов дезинфекции, например бромоформа.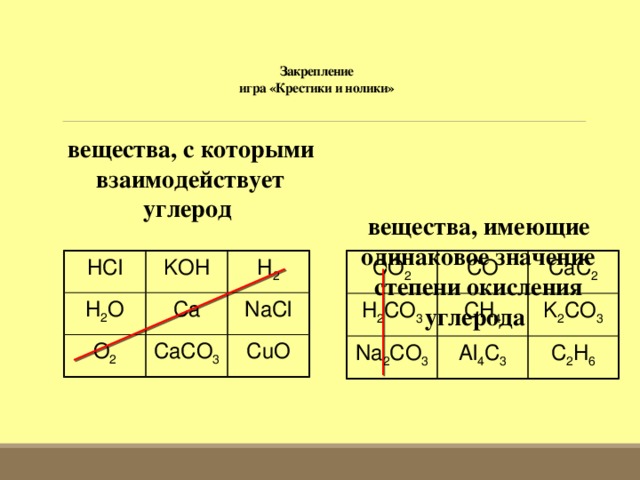 Эффективность возрастает при высоких значениях pH, в то время как активные формы хлора сильно зависят от pH. В нормальных условиях диоксид хлора не гидролизуется. Вот почему окислительный потенциал высок, а эффективность дезинфекции не зависит от pH. Ни температура, ни щелочность воды не влияют на эффективность. В концентрациях, необходимых для дезинфекции, диоксид хлора не вызывает коррозии. Диоксид хлора более растворим в воде, чем хлор. В последние несколько лет были разработаны более совершенные и безопасные методы производства диоксида хлора.
Эффективность возрастает при высоких значениях pH, в то время как активные формы хлора сильно зависят от pH. В нормальных условиях диоксид хлора не гидролизуется. Вот почему окислительный потенциал высок, а эффективность дезинфекции не зависит от pH. Ни температура, ни щелочность воды не влияют на эффективность. В концентрациях, необходимых для дезинфекции, диоксид хлора не вызывает коррозии. Диоксид хлора более растворим в воде, чем хлор. В последние несколько лет были разработаны более совершенные и безопасные методы производства диоксида хлора. Количество аммония в воде уменьшается. Хлор, который добавляется позже, окисляет хлорит в диоксид хлора или хлорат. Озон также можно использовать для окисления ионов хлорита в ионы хлората.
Количество аммония в воде уменьшается. Хлор, который добавляется позже, окисляет хлорит в диоксид хлора или хлорат. Озон также можно использовать для окисления ионов хлорита в ионы хлората.  Необходима достаточная вентиляция и противогазы. Газообразный диоксид хлора взрывоопасен.
Необходима достаточная вентиляция и противогазы. Газообразный диоксид хлора взрывоопасен.  Хроническое воздействие диоксида хлора вызывает бронхит. Санитарная норма диоксида хлора составляет 0,1 промилле.
Хроническое воздействие диоксида хлора вызывает бронхит. Санитарная норма диоксида хлора составляет 0,1 промилле. ст.
ст. Кальций является пятым наиболее распространенным элементом на Земле по весу. Он встречается в основном в виде \({\text{CaC}}{{\text{O}}_3},\) известняка, мела и мрамора. Некоторые другие минералы кальция, наряду с их химической формулой, следующие:
Кальций является пятым наиболее распространенным элементом на Земле по весу. Он встречается в основном в виде \({\text{CaC}}{{\text{O}}_3},\) известняка, мела и мрамора. Некоторые другие минералы кальция, наряду с их химической формулой, следующие:
 С водородом:
С водородом:  париж
париж
 Этот процесс называется гашением извести, а порошок, полученный в результате этого процесса, называется гашеной известью. моль}}\)
Этот процесс называется гашением извести, а порошок, полученный в результате этого процесса, называется гашеной известью. моль}}\)  Используется для осушки спиртов и некислых газов и при получении аммиака и натронной извести \(\left({{\text{CaO}} + {\text{NaOH}}} \right).\)
Используется для осушки спиртов и некислых газов и при получении аммиака и натронной извести \(\left({{\text{CaO}} + {\text{NaOH}}} \right).\)  С повышением температуры растворимость гидроксида кальция уменьшается.
С повышением температуры растворимость гидроксида кальция уменьшается.  Гидроксид кальция в виде раствора полезен в качестве строительного материала. Раствор готовится путем смешивания гашеной извести с песком, в 3–4 раза превышающим его вес. Приготовленную таким образом смесь медленно смешивают с водой с образованием пасты, называемой раствором.
Гидроксид кальция в виде раствора полезен в качестве строительного материала. Раствор готовится путем смешивания гашеной извести с песком, в 3–4 раза превышающим его вес. Приготовленную таким образом смесь медленно смешивают с водой с образованием пасты, называемой раствором.  Получение из хлорида кальция: Добавление водного раствора карбоната натрия к хлориду кальция дает карбонат кальция.
Получение из хлорида кальция: Добавление водного раствора карбоната натрия к хлориду кальция дает карбонат кальция. 
 При смешивании с водой (\(1/3\) своего веса) он образует твердую, переплетенную массу кристаллов в течение от \(5\) до \(15\) минут. Эта образованная штукатурка схватывается еще быстрее при добавлении поваренной соли. Закрепление происходит из-за регидратации гипса и его превращения в гипс. Процесс регидратации увеличивает объем на \(1\%,\), что приводит к приданию гипсу формы формы, на которую он устанавливается.
При смешивании с водой (\(1/3\) своего веса) он образует твердую, переплетенную массу кристаллов в течение от \(5\) до \(15\) минут. Эта образованная штукатурка схватывается еще быстрее при добавлении поваренной соли. Закрепление происходит из-за регидратации гипса и его превращения в гипс. Процесс регидратации увеличивает объем на \(1\%,\), что приводит к приданию гипсу формы формы, на которую он устанавливается.  Благодаря наличию двух s-электронов на своей конечной оболочке он предпочитает \(+2\) степень окисления, которая является его стабильной степенью окисления. Кальций образует несколько важных для промышленности соединений, таких как гипс, гашеная известь, негашеная известь и карбонат кальция. Он также используется в стоматологии для различных применений, связанных с формами.
Благодаря наличию двух s-электронов на своей конечной оболочке он предпочитает \(+2\) степень окисления, которая является его стабильной степенью окисления. Кальций образует несколько важных для промышленности соединений, таких как гипс, гашеная известь, негашеная известь и карбонат кальция. Он также используется в стоматологии для различных применений, связанных с формами.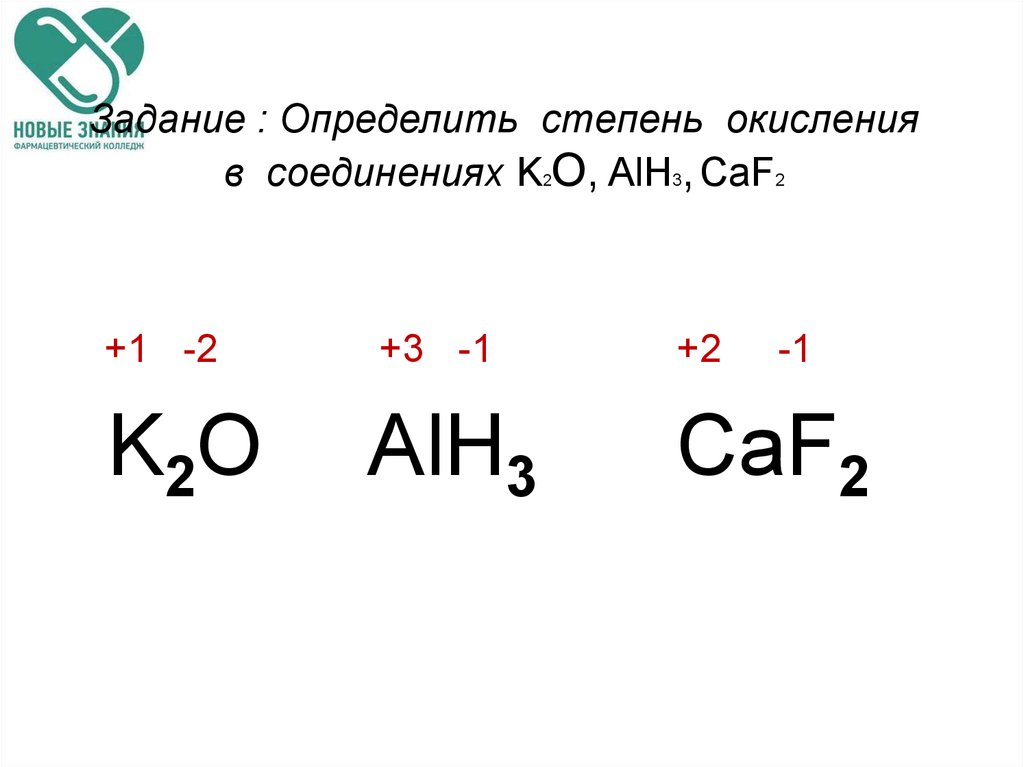
 Приятного обучения!
Приятного обучения!  Гидроксид кальция, или гашеная известь, уже нейтрализован, поэтому он не будет подвергаться окислению и может смешиваться с водой в нашей системе для контроля pH воды, добавления известкового шлама, смесей известкового шлама, восстановления почвы и многого другого.
Гидроксид кальция, или гашеная известь, уже нейтрализован, поэтому он не будет подвергаться окислению и может смешиваться с водой в нашей системе для контроля pH воды, добавления известкового шлама, смесей известкового шлама, восстановления почвы и многого другого.
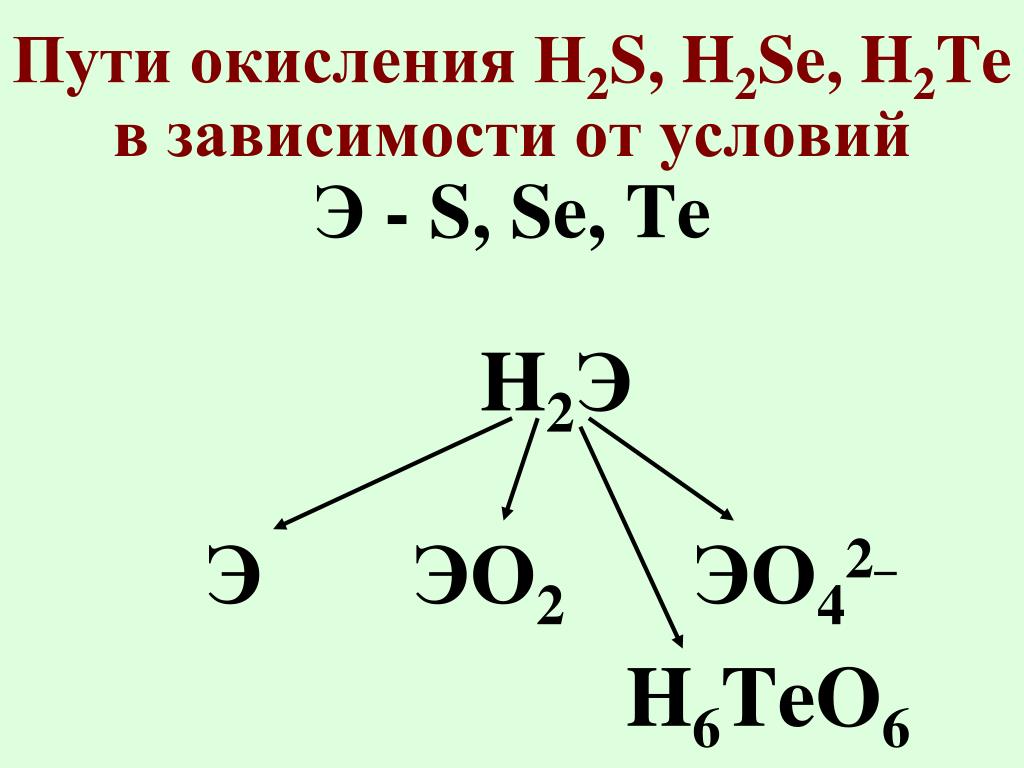 Гаситель извести имеет возможность контролировать экзотермическую реакцию во время превращения CaO в Ca(OH) 2 . В результате получается известковая суспензия, готовая к впрыскиванию в процесс.
Гаситель извести имеет возможность контролировать экзотермическую реакцию во время превращения CaO в Ca(OH) 2 . В результате получается известковая суспензия, готовая к впрыскиванию в процесс. Если известь необходимо преобразовать в известковую суспензию , можно заказать резервуар для известковой суспензии , оснащенный мешалкой и регулирующим клапаном подачи воды.
Если известь необходимо преобразовать в известковую суспензию , можно заказать резервуар для известковой суспензии , оснащенный мешалкой и регулирующим клапаном подачи воды. Кроме того, негашеная известь работает так же, как гашеная известь, включая хранение, дозирование и транспортировку.
Кроме того, негашеная известь работает так же, как гашеная известь, включая хранение, дозирование и транспортировку.
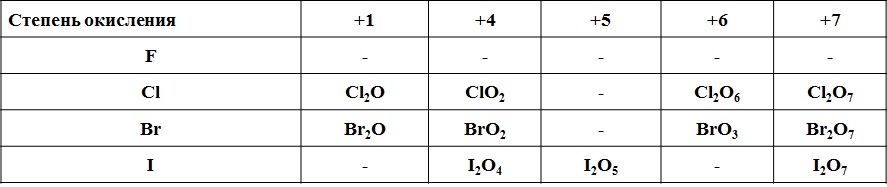
 Продукт изготовлен из натрия
плюс ионы. Мы даем ионам натрия плюс один
степени окисления, так как атомы натрия теряют электрон при образовании катиона Na+. Ионы кислорода имеют заряд
два минус, и мы назначаем степень окисления минус два, потому что каждый атом кислорода
получает два электрона, превращаясь в анион O2–.
Продукт изготовлен из натрия
плюс ионы. Мы даем ионам натрия плюс один
степени окисления, так как атомы натрия теряют электрон при образовании катиона Na+. Ионы кислорода имеют заряд
два минус, и мы назначаем степень окисления минус два, потому что каждый атом кислорода
получает два электрона, превращаясь в анион O2–.
