Учебные материалы по химии, ЗФ
Skip to main content
Sorry, the requested file could not be found
More information about this error
Jump to… Jump to…ОбъявленияЛекции по химии почвСвойства и особенности формирования почв Томской областиТемы рефератовВопросы для подготовки к зачетуХимический состав почвХимия. Сборник задач и упражнений. Часть 1
Skip Calendar| No events, Thursday, 1 September 1 | No events, Friday, 2 September 2 | No events, Saturday, 3 September 3 | No events, Sunday, 4 September 4 | |||
| No events, Monday, 5 September 5 | No events, Tuesday, 6 September 6 | No events, Wednesday, 7 September 7 | No events, Thursday, 8 September 8 | No events, Friday, 9 September 9 | No events, Saturday, 10 September 10 | No events, Sunday, 11 September 11 |
| No events, Monday, 12 September 12 | No events, Tuesday, 13 September 13 | No events, Wednesday, 14 September 14 | No events, Thursday, 15 September 15 | No events, Friday, 16 September 16 | No events, Saturday, 17 September 17 | No events, Sunday, 18 September 18 |
| No events, Monday, 19 September 19 | No events, Tuesday, 20 September 20 | No events, Wednesday, 21 September 21 | No events, Thursday, 22 September 22 | No events, Friday, 23 September 23 | No events, Saturday, 24 September 24 | No events, Sunday, 25 September 25 |
| No events, Monday, 26 September 26 | No events, Tuesday, 27 September 27 | No events, Wednesday, 28 September 28 | No events, Thursday, 29 September 29 | No events, Friday, 30 September 30 |
- Hide site events
- Hide category events
- Hide course events
- Hide group events
- Hide user events
- Hide other events
No online users (last 5 minutes)
Skip StatisticsПомощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.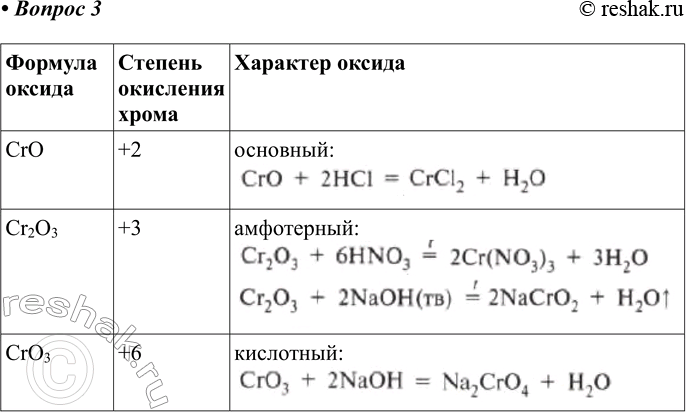
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню.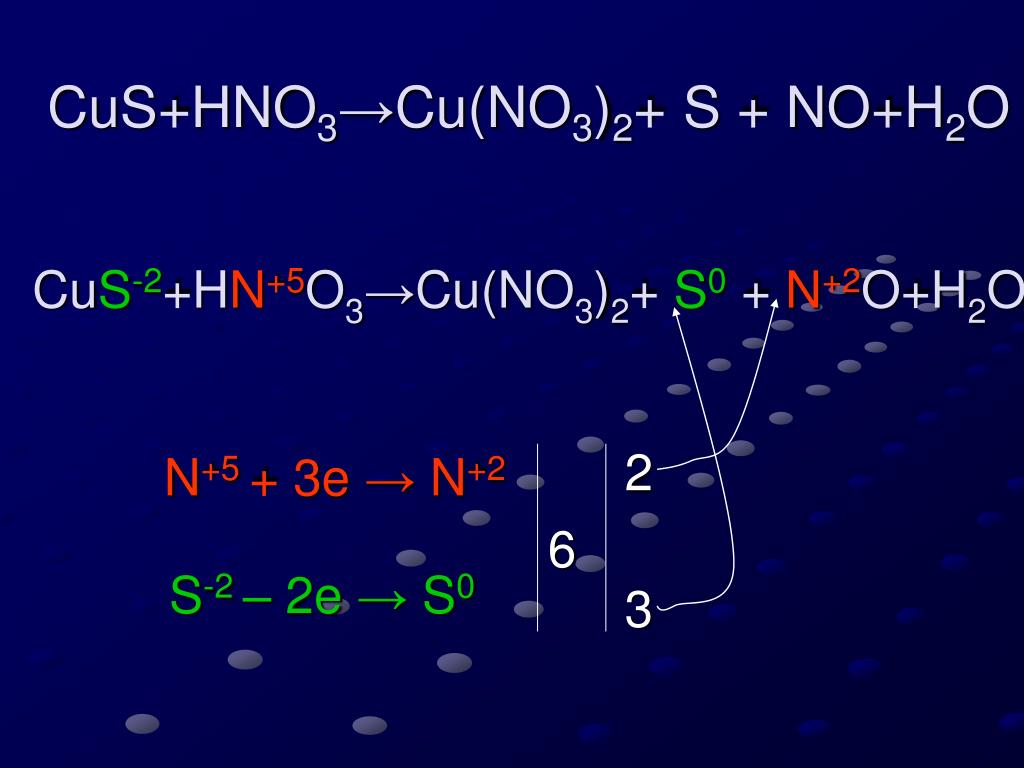 Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/vOuj6t2Zyeg» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ElMEic2MJ-U» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
404 Cтраница не найдена
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
1.
 2. Свойства меди
2. Свойства медиМедь (лат. Cuprum) – химический элемент I группы периодической системы Менделеева (атомный номер 29, атомная масса 63,546). В соединения медь обычно проявляет степени окисления плюс 1 и плюс 2, известны также немногочисленные соединения трехвалентной меди. Важнейшие соединения меди: оксиды Cu2O, CuO, Cu2O3; гидроксид Cu(OH)2, нитрат Cu(NO3)2·3h3O, сульфид CuS, сульфат (медный купорос) CuSO4·5h3O, карбонат CuCO3, Cu(OH)2, хлорид CuCl2·2h3O.
Медь – один из семи металлов, известных с глубокой древности. Переходный период от каменного к бронзовому веку (4-3 — е тысячелетие до н.э.) назывался медным веком или халколитом (от греческого chalkos – медь и lithos — камень) или энеолитом (от латинского aeneus – медный и греческого lithos — камень). В этот период появляются медные орудия. Известно, что при возведении пирамиды Хеопса использовались медные инструменты.
Чистая медь –
ковкий и мягкий металл красноватого, в
изломе розового цвета, местами с бурой
и пестрой побежалостью, тяжелый (плотность
8,93·103 кг/м3), отличный проводник тепла и
электричества, уступая в этом отношении
серебру (температура плавления 1083º С). Медь легко вытягивается в проволоку и
прокатывается в тонкие листы, но
сравнительно мало активна. В сухом
воздухе и кислороде при нормальных
условиях медь не окисляется. Но она
достаточно легко вступает в реакции:
уже при комнатной температуре с
галогенами, например с влажным хлором
образует хлорид CuCl2, при нагревании с
серой образует сульфид Cu2S, с серой, с
селеном. С водородом, углеродом и азотом
медь не взаимодействует даже при высоких
температурах. Кислоты, не обладающие
окислительными свойствами, на медь не
действуют, например, соляная и разбавленная
серная кислоты. Но в присутствии кислорода
воздуха медь растворяется в этих кислотах
с образованием соответствующих солей:
Медь легко вытягивается в проволоку и
прокатывается в тонкие листы, но
сравнительно мало активна. В сухом
воздухе и кислороде при нормальных
условиях медь не окисляется. Но она
достаточно легко вступает в реакции:
уже при комнатной температуре с
галогенами, например с влажным хлором
образует хлорид CuCl2, при нагревании с
серой образует сульфид Cu2S, с серой, с
селеном. С водородом, углеродом и азотом
медь не взаимодействует даже при высоких
температурах. Кислоты, не обладающие
окислительными свойствами, на медь не
действуют, например, соляная и разбавленная
серная кислоты. Но в присутствии кислорода
воздуха медь растворяется в этих кислотах
с образованием соответствующих солей:
2Cu + 4HCl + O2 = 2CuCl2 + 2h3O
В атмосфере, содержащей CO2, пары h3O и др., покрывается патиной – зеленоватой пленкой основного карбоната (Cu2(OH)2CO3), ядовитого вещества.
Медь входит более
чем в 170 минералов, из которых для
промышленности важны лишь 17, в том числе:
борнит (пестрая медная руда – Cu5FeS4),
халькопирит (медный колчедан – CuFeS2),
халькозин (медный блеск – Cu2S), ковеллин
(CuS), малахит (Cu2(OH)2CO3). Встречается также
самородная медь.
Встречается также
самородная медь.
Медь, ее соединения и сплавы находят широкое применение в различных отраслях промышленности.
В электротехнике медь используется в чистом виде: в производстве кабельных изделий, шин голого и контактного проводов, электрогенераторов, телефонного и телеграфного оборудования, вакуум-аппараты, трубопроводы. Более 30 % меди идет на сплавы. Сплавы меди с другими металлами используют в машиностроении, в автомобильной и тракторной промышленности (радиаторы, подшипники), для изготовления химической аппаратуры.
Высокая вязкость
и пластичность металла позволяют
применять медь для изготовления
разнообразных изделий с очень сложным
узором. Проволока из красной меди в
отожженном состоянии становиться
настолько мягкой и пластичной, что из
нее без труда можно вить всевозможные
шнуры и выгибать самые сложные элементы
орнамента. Кроме того, проволока из меди
легко спаивается сканым серебряным
припоем, хорошо серебрится и золотится. Эти свойства меди делают ее незаменимым
материалом при производстве филигранных
изделий.
Эти свойства меди делают ее незаменимым
материалом при производстве филигранных
изделий.
Коэффициент линейного и объемного расширения меди при нагревании приблизительно такой же, как у горячих эмалей, в связи с чем при остывании эмаль хорошо держится на медном изделии, не трескается, не отскакивает. Благодаря этому мастера для производства эмалевых изделий предпочитают медь всем другим металлам.
Как и некоторые другие металлы, медь входит в число жизненно важных микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву в виде пятиводного сульфата – медного купороса CuSO4·5h3O. В большом количестве он ядовит, как и многие другие соединения меди, особенно для низших организмов. В малых же дозах медь необходима всему живому [4].
1.2.1. Области использования и потребления меди
Электроника и электротехника – провода, кабели, обмотка электродвигателей, фольга, электропроводимые шины (45-25%)
Машиностроение
и транспорт – теплообменники, радиаторы,
детали и узлы автомобилей, самолетов,
судов, вагонов и т. д. (15-25%)
д. (15-25%)
Строительные материалы – кровельные материалы, декоративные украшения (8-10%)
Химическая промышленность – соли входят в состав красок, катализаторы (3-6%)
Изделия бытового назначения – посуда, часы, украшения (10%)
1.2.2. Физические и химические свойства меди
Цвет
меди красный, в изломе розовый, при
просвечивании в тонких слоях
зеленовато-голубой. Металл имеет
гранецентрированную кубическую решётку
с параметром а = 3,6074 ;
плотность 8,96 г/см3 (20 °С). Химическая
активность меди невелика. Компактный
металл при температурах ниже 185 °С с
сухим воздухом и кислородом не
взаимодействует. В присутствии влаги
и CO2 на поверхности меди образуется
зелёная плёнка основного карбоната.
При нагревании меди на воздухе идёт
поверхностное окисление; ниже 375 °С
образуется CuO, а в интервале 375—1100 °С
при неполном окислении меди . — двухслойная
окалина, в поверхностном слое которой
находится CuO, а во внутреннем — Cu2O. Влажный хлор взаимодействует с медью
уже при обычной температуре, образуя
хлорид CuCl2, хорошо растворимый в воде.
Особое сродство медь проявляет к сере
и селену; так, она горит в парах серы С
водородом, азотом и углеродом медь не
реагирует даже при высоких температурах.
Растворимость водорода в твёрдой меди
незначительна и при 400 °С составляет
0,06 мг в 100 г меди. Водород и другие горючие
газы (CO, Ch5), действуя при высокой
температуре на слитки меди, содержащие
Cu2O, восстановляют её до металла с
образованием CO2 и водяного пара. Эти
продукты, будучи нерастворимыми в меди,
выделяются из неё, вызывая появление
трещин, что резко ухудшает механические
свойства меди.
Влажный хлор взаимодействует с медью
уже при обычной температуре, образуя
хлорид CuCl2, хорошо растворимый в воде.
Особое сродство медь проявляет к сере
и селену; так, она горит в парах серы С
водородом, азотом и углеродом медь не
реагирует даже при высоких температурах.
Растворимость водорода в твёрдой меди
незначительна и при 400 °С составляет
0,06 мг в 100 г меди. Водород и другие горючие
газы (CO, Ch5), действуя при высокой
температуре на слитки меди, содержащие
Cu2O, восстановляют её до металла с
образованием CO2 и водяного пара. Эти
продукты, будучи нерастворимыми в меди,
выделяются из неё, вызывая появление
трещин, что резко ухудшает механические
свойства меди.
При
пропускании Nh4 над раскалённой медью
образуется Cu3N. Медь подвергается
воздействию окислов азота, а именно NO,
N2O (с образованием Cu2O) и NO2 (с образованием
CuO). Карбиды Cu2C2 и CuC2 могут быть получены
действием ацетилена на аммиачные
растворы солей М. Нормальный электродный
потенциал меди для реакции Cu2+ + 2e
Сu равен +0,337 в, а для реакции Cu+ + е
Сu равен +0,52 в. Поэтому медь вытесняется
из своих солей более электроотрицательными
элементами (в промышленности используется
железо) и не растворяется в
кислотах-неокислителях. В азотной
кислоте медь растворяется с образованием
Cu(NO3)2 и окислов азота, в горячей концентрации
h3SO4 — с образованием CuSO4 и SO2, в нагретой
разбавленной h3SO4 — при продувании через
раствор воздуха. Все соли меди ядовиты
Поэтому медь вытесняется
из своих солей более электроотрицательными
элементами (в промышленности используется
железо) и не растворяется в
кислотах-неокислителях. В азотной
кислоте медь растворяется с образованием
Cu(NO3)2 и окислов азота, в горячей концентрации
h3SO4 — с образованием CuSO4 и SO2, в нагретой
разбавленной h3SO4 — при продувании через
раствор воздуха. Все соли меди ядовиты
Медь в двух- и одновалентном состоянии образует многочисленные весьма устойчивые комплексные соединения. Примеры комплексных соединений одновалентной меди (Nh5)2CuBr3; K3Cu(CN)4 — комплексы типа двойных солей; [Сu {SC (Nh3)}2]CI и другие. Примеры комплексных соединений 2-валентной меди CsCuCI3, K2CuCl4 — тип двойных солей. Важное промышленное значение имеют аммиачные комплексные соединения меди [Сu (Nh4)4] SO4, [Сu (Nh4)2] SO4.
11.16: Числа окисления и окислительно-восстановительные реакции
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49538
- Эд Витц, Джон В.
 Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан - Цифровая библиотека химического образования (ChemEd DL)
Окислительно-восстановительные реакции могут включать перенос протонов и другие процессы разрыва и образования связей, а также переносы электронов, и поэтому с уравнениями, связанными с ними, гораздо труднее иметь дело, чем с уравнениями, описывающими кислотно-основные реакции. Чтобы иметь возможность распознавать окислительно-восстановительные реакции, нам нужен метод для тщательного учета всех электронов. Это делается путем присвоения степени окисления каждому атому до и после реакции.
Например, в NO 3 – азоту присвоена степень окисления +5, а каждому кислороду – степень окисления –2. Это произвольное присвоение соответствует тому, что азот потерял свои первоначальные пять валентных электронов из-за электроотрицательных атомов кислорода. С другой стороны, в NO 2 азот имеет степень окисления + 4 и может считаться имеющим один валентный электрон для себя, то есть на один электрон больше, чем в NO 3 9. 0036 – .
0036 – .
Это произвольно назначенное усиление на один электрон соответствует восстановлению атома азота при переходе от NO 3 – к NO 2 . Как правило, восстановлению соответствует понижение степени окисления некоторого атома. Окисление соответствует увеличению степени окисления некоторого атома. Применяя правила степени окисления к следующему уравнению, мы получаем

Хотя они полезны и необходимы для распознавания окислительно-восстановительных реакций, числа окисления являются в высшей степени искусственным средством. Атом азота в NO 3 – на самом деле не имеет заряда +5, который можно уменьшить до +4 в NO 9.0034 2 . Вместо этого у обоих видов существуют ковалентные связи и обмен электронными парами между азотом и кислородом, и азот, конечно, не полностью потерял свои валентные электроны в пользу кислорода. Даже несмотря на то, что это может (и должно) вызвать у вас подозрения в достоверности степеней окисления, они, несомненно, являются полезным инструментом для обнаружения процессов переноса электрона. До тех пор, пока они используются только для этой цели, а не означают, что атомы в ковалентных видах действительно имеют большие заряды, которые часто подразумевают степени окисления, их использование вполне правомерно.
Ниже приведены общие правила для степеней окисления, взятые со следующей страницы Основного учебника по аналитической химии: Степени окисления
.
Определение степеней окисления
Подсчет количества переданных электронов является неэффективным и трудоемким способом определения степеней окисления. Эти правила предлагают более простой метод:
- Степень окисления несвязанного элемента равна нулю. Это применимо независимо от структуры элемента: Xe, Cl 2 , S 8 , а также крупные структуры из углерода или кремния имеют нулевую степень окисления.
- Сумма степеней окисления всех атомов или ионов в нейтральном соединении равна нулю.
- Сумма степеней окисления всех атомов иона равна заряду иона.
- Более электроотрицательному элементу в веществе присваивается отрицательная степень окисления. Менее электроотрицательному элементу присваивается положительная степень окисления. Помните, что электроотрицательность максимальна в правом верхнем углу таблицы Менделеева и уменьшается в левом нижнем углу.
- Некоторые элементы почти всегда имеют одинаковые степени окисления в своих соединениях:
| Элемент | Обычная степень окисления | Исключения |
| Металлы группы 1 | Всегда +1 | |
| Металлы группы 2 | Всегда +2 | |
| Кислород | Обычно -2 | Пероксиды и F 2 O (см. ниже) ниже) |
| Водород | Обычно +1 | Гидриды металлов (-1) (см. ниже) |
| Фтор | Всегда -1 | |
| Хлор | обычно -1 | Соединения с O или F (см. ниже) |
Исключения:
Водород в гидридах металлов : Гидриды металлов включают такие соединения, как гидрид натрия, NaH. Здесь водород существует в виде иона гидрида, H —. Степень окисления простого иона, подобного гидриду, равна заряду иона, в данном случае -1.
В качестве альтернативы сумма степеней окисления в нейтральном соединении равна нулю. Поскольку металлы группы 1 в своих соединениях всегда имеют степень окисления +1, отсюда следует, что водород должен иметь степень окисления -1 (+1 -1 = 0).
Кислород в пероксидах : Пероксиды включают пероксид водорода, H 2 O 2 .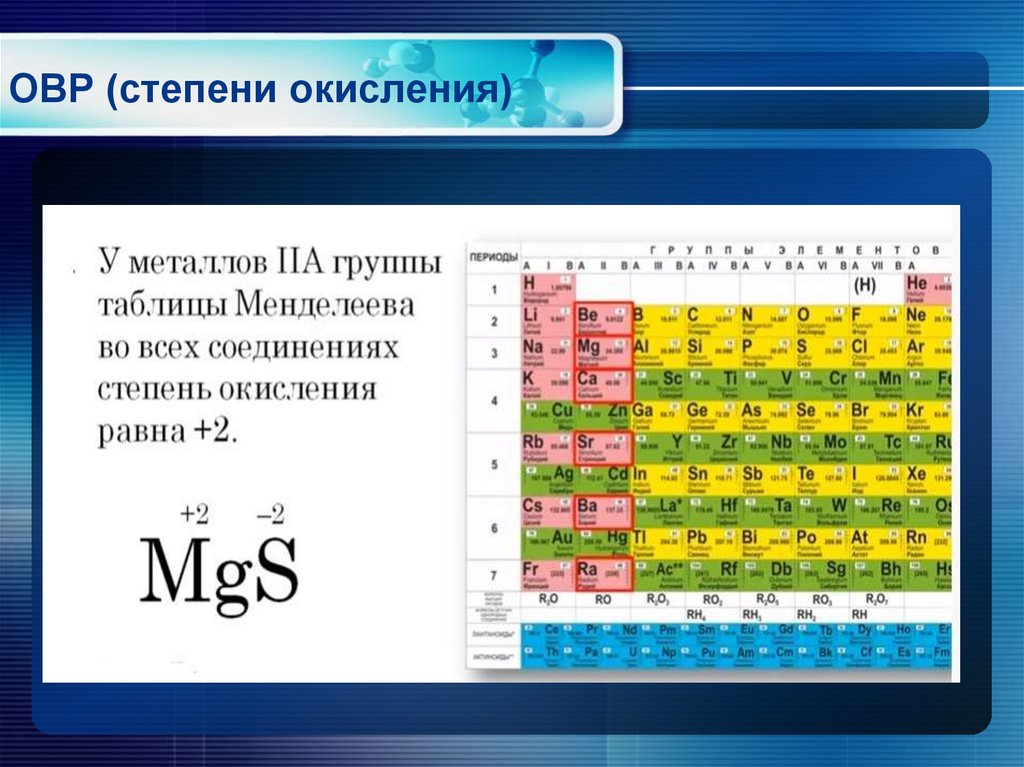 Это электрически нейтральное соединение, поэтому сумма степеней окисления водорода и кислорода должна быть равна нулю.
Это электрически нейтральное соединение, поэтому сумма степеней окисления водорода и кислорода должна быть равна нулю.
Поскольку каждый водород имеет степень окисления +1, каждый кислород должен иметь степень окисления -1, чтобы сбалансировать его.
Кислород в F 2 O : Отклонение здесь связано с тем, что кислород менее электроотрицателен, чем фтор; фтор имеет приоритет со степенью окисления -1. Поскольку соединение является нейтральным, кислород имеет степень окисления +2. 9{–} + S}\)
Решение:
a) Соответствующие степени окисления:
Единственные атомы, которые изменяются, это Mn, от +7 до +2, восстановление, и S, от +4 до +6, окисление. Реакция представляет собой окислительно-восстановительный процесс. SO 2 окисляется MnO 4 – , поэтому MnO 4 – является окислителем. MnO 4 – был восстановлен с помощью SO 2 , поэтому SO 2 является восстановителем.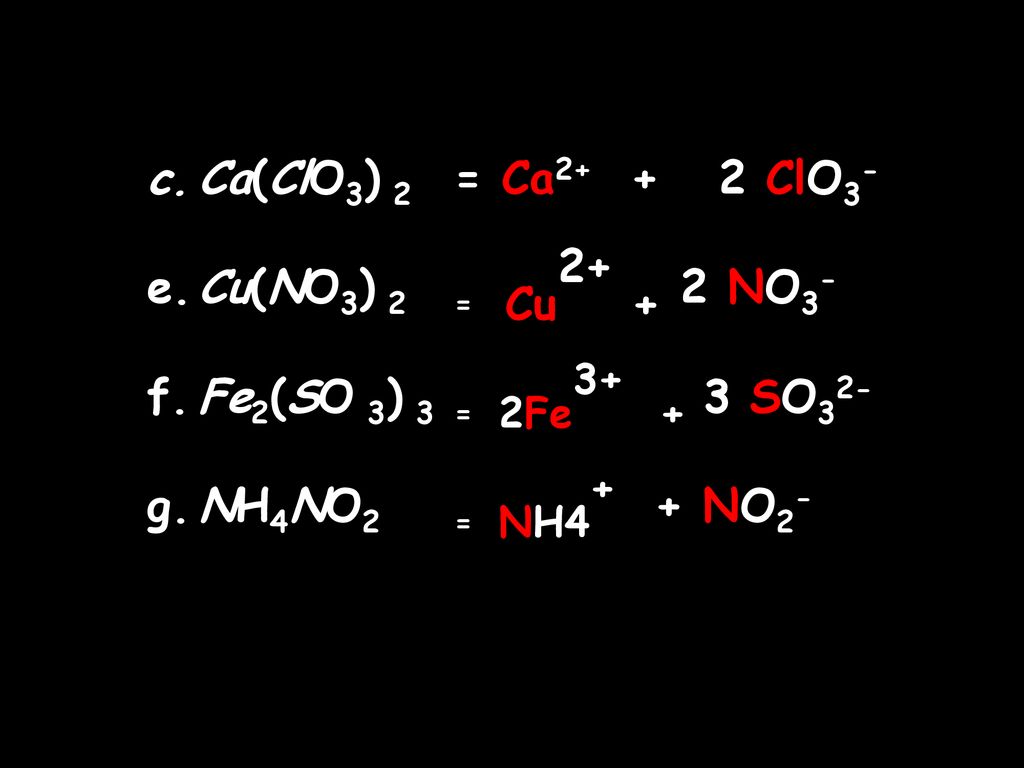
b) Цифры окисления
показывают, что окислительно-восстановительного потенциала не произошло. Это кислотно-щелочная реакция, потому что переносится протон, но не электроны.
c)
H 2 S окислился, потеряв два электрона с образованием элементарного S. Поскольку H 2 S отдает электроны, он является восстановителем. HClO принимает эти электроны и восстанавливается до Cl – . Поскольку он принимает электроны, HClO является окислителем.
Эта страница под названием 11.16: числа окисления и окислительно-восстановительные реакции распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована Эдом Витцем, Джоном В. Муром, Джастином Шорбом, Ксавьером Прат-Ресиной. , Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- степень окисления
- степень окисления
- окислительно-восстановительная реакция
Последовательность химических реакций
Превращение меди: последовательность химических реакций- Цели
- Реакции
- Процедура
Цели
- Укажите разнообразие веществ, частью которых может быть элемент:
металл —> синий раствор —> синее твердое вещество —> черное твердое вещество —> синий раствор (снова) —> металл (снова).
- Сохранение массы и кротов:
- Мы должны добыть столько меди, сколько начали.
- Одинаковое количество меди на каждой стадии: одинаковое количество молей.
- Опыт работы со стандартными химическими методами: фильтрация и количественные переносы.

Реакции
Cu(s) —> [Cu(H 2 O) 6 ] 2+ (водн.) —> Cu(OH) 2 (тв) —> CuO(тв) —> [Cu(H 2 O) 6 ] 2+ (водн.) —> Cu(s)- Металлическая медь «растворяется» в азотной кислоте (HNO 3 ). Фактически, ион нитрата окисляет металлическую медь до иона меди (II), в то время как сам превращается в газ NO 2 в процессе; затем ион меди (II) связывается с шестью молекулами воды. Физическое изменение, которое вы должны наблюдать, это исчезновение металла медного цвета по мере того, как раствор становится синим (от [Cu(H 2 O) 6 ] 2+ , гексааквамедный ион) и выделяется коричневый газ (NO 2 ).
Cu (т) + 4 H 3 O + (водн.) + 2 NO 3 — (водн.) —> [Cu(H 2 O) 6 ] 2
- 0 3 (водн.) + 2 NO 2 (г)
- Ион гидроксида (ОН — ) связывается с ионом меди (II) даже сильнее, чем вода.
 В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди Cu(OH) 2 , синий осадок.
В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди Cu(OH) 2 , синий осадок.[Cu(H 2 O) 6 ] 2+ (водн.) + 2 OH — —> Cu(OH) 2 (т) + 6 H 2 O (л)
- При нагревании гидроксида меди образуется оксид меди CuO, твердое вещество черного цвета.
Cu(OH) 2 (т) —> CuO (т) + H 2 O (ж)
- Оксид меди растворяется в кислоте, регенерируя ион меди (II), который снова связывается с вода.
CuO (т) + 2 H 3 O + (водн.) + 3 H 2 O (ж) —> [Cu(H 2 O) 6 ] 2+ (водн.)
9000 гидратированный ион меди (II) снова превращается в металлическую медь, в то время как сам он окисляется до ионов цинка (II). Мы видели эту реакцию раньше в лаборатории хлорида меди). - 4
- 4
- 4
- 4
[Cu(H 2 O) 6 ] 2+ (водн.) + Zn (тв.) —> Cu (тв.) + Zn 2+ (водн.) + 6 H 2 O ( тел.)
В то же время часть металлического цинка, находящегося в избытке, восстанавливает ионы гидроксония до H 2 .
Zn (т) + 2 H 3 O + (водн.) —> Zn 2+ (водн.) + H 2 (г) + 2 H 2 O (л)
Процедура
Я не буду подробно описывать процедуру шаг за шагом, но подчеркну некоторые аспекты безопасности и (выделено жирным шрифтом ) некоторые места, где наша процедура отличается от той, что в лабораторном пакете.- Преобразование Cu(s) в [Cu(H 2 O) 6 ] 2+ (водный)
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0,01 г . Кусочки проволоки ближе к 0,50 г, чем к 0,35 г. Это нормально: используйте детали, которые мы предоставляем.
- Используйте примерно 4-5 мл концентрированного раствора HNO 3 .

- Будьте осторожны с азотной кислотой: как и другие сильные кислоты, она вызывает жжение при попадании на кожу и может повредить одежду; в отличие от большинства других кислот, он также окрашивает пораженный участок в желтый цвет.
- Если некоторое количество меди останется нерастворенным к моменту окончания производства газа, поставьте химический стакан на горячие плиты в вытяжных шкафах, чтобы ускорить реакцию.
- Важно выполнять этот шаг в вытяжном шкафу, поскольку коричневый газ NO 2 является раздражителем. Держите смеси в вытяжном шкафу до тех пор, пока не добавите 10 мл дистиллированной воды после полного растворения меди.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водн.) в Cu(OH) 2 (s)
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое вызывает жжение при контакте с кожей. Добавьте по каплям раствор NaOH к раствору меди.
- После образования синего осадка периодически проверяйте кислотность раствора, опуская палочку для перемешивания в раствор и касаясь ею красной лакмусовой бумажки.
 Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, к ложному синему цвету на лакмусовой бумаге. Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавленные 0036 — идут на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим, чтобы вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, к ложному синему цвету на лакмусовой бумаге. Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавленные 0036 — идут на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим, чтобы вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
- Преобразование Cu(OH) 2 (т) в CuO(т)
- Добавить воду в реакционную смесь, полученную на предыдущем этапе, и добавьте также один или два кипящих камня .
- Содержимое стакана нагреть, но не кипятить .
 Кипячение делает черный CuO настолько мелким, что этап фильтрации становится чрезмерно долгим. Нагревайте химический стакан до тех пор, пока весь синий Cu(OH) 2 не исчезнет и не заменится черным CuO.
Кипячение делает черный CuO настолько мелким, что этап фильтрации становится чрезмерно долгим. Нагревайте химический стакан до тех пор, пока весь синий Cu(OH) 2 не исчезнет и не заменится черным CuO. - Отфильтруйте и промойте CuO, как описано в процедуре (часть C). Держите твердое вещество на фильтровальной бумаге, а фильтрат выбросьте.
- Преобразование CuO(s) обратно в [Cu(H 2 O) 6 ] 2+ (водн.)
- Растворите CuO на фильтровальной бумаге, как описано в процедуре (часть D).
- Раствор серной кислоты вызывает коррозию и вызывает жжение кожи при контакте с ней.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водн.) обратно в Cu(s)
- Добавьте около 1 г Zn к синему раствору, полученному на предыдущем шаге, и после того, как раствор полностью потеряет свой синий цвет, вам может понадобиться добавить немного серной кислоты, чтобы прореагировать избыток Zn.

- Металлическую медь трижды промыть дистиллированной водой и перенести в чашку для выпаривания, как описано в процедуре (часть Е), а затем трижды промыть изопропанолом порциями по 5 мл. Промывка изопропанолом сократит время, необходимое для этапа сушки.
- Высушите медь над стаканом с кипящей водой, как описано в процедуре (Е). Взвесьте сухую медь и запишите массу. Вычислите процент восстановленной меди.
- Добавьте около 1 г Zn к синему раствору, полученному на предыдущем шаге, и после того, как раствор полностью потеряет свой синий цвет, вам может понадобиться добавить немного серной кислоты, чтобы прореагировать избыток Zn.
Вернуться к расписанию лаборатории химических принципов.
Нитрат меди (II) Формула: Структура и свойства
Нитрат меди (II) — это название IUPAC, также известное как нитрат меди. Это неорганическая соль , которая используется в качестве катализатора для содействия в различных реакциях. Цвет неорганического гидрата синий. Нитрат меди также доступен в пяти различных формах гидратов, наиболее популярными из которых являются гемипентагидрат нитрата меди II и тригидрат нитрата меди II, который широко используется в лабораториях и фармацевтике.
Содержание
|
Ключевые слова: Кислота азотная безводная, нитрат меди, катализатор, окислительно-восстановительная реакция, гидраты, оксиды, неорганические соли.
Что такое нитрат меди (II)?
[Щелкните здесь, чтобы задать пример вопросов]
Нитрат меди(II) представляет собой тип неорганической соли, присутствующей в виде синего кристаллического твердого вещества.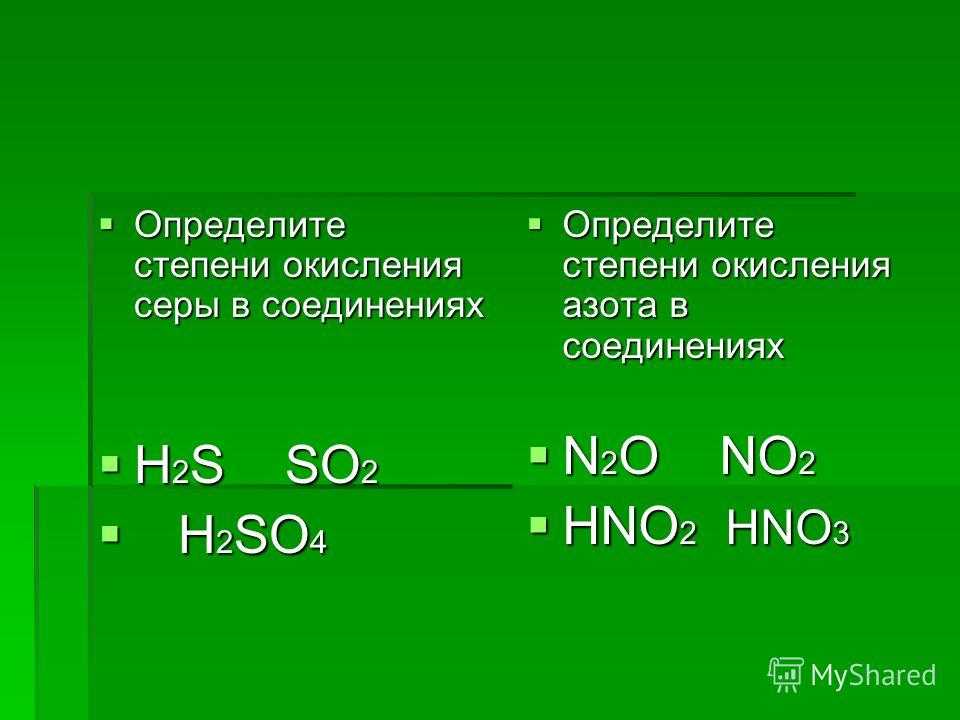 Химическая формула нитрата меди (II): Cu (NO 3 ) 2 . Кроме того, структура этого типа безводной соли состоит из 1 катион Cu 2+ и 2 анионы NO 3- .
Химическая формула нитрата меди (II): Cu (NO 3 ) 2 . Кроме того, структура этого типа безводной соли состоит из 1 катион Cu 2+ и 2 анионы NO 3- .
Нитрат меди (II)
Нитраты меди (II) и все другие нитраты меди существуют в природе в природе. Кроме того, он также частично обнаружен в некоторых 90–100 минералах 90–101, таких как герхардтит и руаит. Соединение также имеет 5 различных гидратных форм. Наиболее распространенными формами солей являются Cu (NO 3 ) 2 и Cu (NO 3 ) 2 .5H 2 O. Также молярная масса безводной формы нитрата меди 187,55 г моль?¹ и тригидратной формы того же 241,60 г моль — ¹.
Структура и формула нитрата меди (II)
[Нажмите здесь, чтобы просмотреть примеры вопросов]
Химическая формула нитрата меди (II) — Cu (NO 3 ) 2 .
Структура формулы нитрата меди (II)
Подробнее: Аморфные и кристаллические твердые вещества
[Нажмите здесь, чтобы задать пример вопросов]
Нитрат меди(II) различают соответственно на основе его физических и химических свойств:
Физические свойства- Нитрат меди (II) доступен в синем цвете и может легко удерживать влагу.
- Это кристаллическое твердое вещество во всех его гидратированных формах.
- Плотность нитрата меди (II) зависит от удержания в нем воды.
- Плотность составляет 3,05 г мл¹ для безводного, 2,32 г мл¹ для тригидратов и 2,07 г мл¹ для гексагидратов.
- Температура плавления его безводной формы составляет 256°C, а для тригидрата — 114,5°C, тогда как для всех его гексагидратов — 26,5°C. Большая часть его растворяется при высоких температурах.
- Они также хорошо растворяются в воде, этаноле и аммиаке .
 Однако эти 3 формы гидратов нерастворимы в органических растворителях, таких как этилацетат.
Однако эти 3 формы гидратов нерастворимы в органических растворителях, таких как этилацетат.
Существуют различные химические реакции , которые происходят в нитрате меди (II). Одной из таких реакций является получение оксида меди в процессе пиролиза выше 180 °C:
2 Cu(NO 3 ) 2 → 2 CuO + 4 NO 2 + O 2
Copper (II) nitrate также может реагировать с уксусным ангидридом для ускорения процесса нитрования ароматических соединений, таких как бензол .
Получение нитрата меди (II)
[Нажмите здесь, чтобы получить примеры вопросов]
Нитрат меди (II) можно получить из металлической меди, обработанной азотная кислота .
Cu + 4 HNO 3 → Cu(NO 3 ) 2 + 2 H 2 O + 2 NO 2
Это также может быть приготовлено путем обработки металлической меди с тетроксидом динитрогена:
Cu + 2 N 2 O 4 → CU (NO 144444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444414 4 (нет 4 . 0100 3 ) 2 + 2 NO
0100 3 ) 2 + 2 NO
[Нажмите здесь для образцов вопросов]
Медный (II). , синие цвета и пальто.
Нитрат меди (II) используется в процессе электролиза
- Нитрат меди (II) также используется для получения оксида меди (II).
- Нитрат меди доступен в двух формах: гексагидрат и тригидрат, которые широко используются в производстве лекарств, в химическом анализе или в качестве инсектицида.
- Материал, используемый для изготовления светочувствительной бумаги, также состоит из компонентов нитрата меди (II). Однако при сжигании соединения он образует токсичные оксиды азота .

Опасности для здоровья
[Нажмите здесь, чтобы просмотреть примеры вопросов]
Нитрат меди (II) может вызвать серьезные проблемы со здоровьем.
- Вызывает раздражение горла, легких, глаз и кожи.
- Несмотря на то, что это негорючее соединение, в сочетании с деревом, бумагой и другими взрывчатыми веществами это может привести к сильному возгоранию.
Что следует помнить
- Нитрат меди(II) представляет собой тип неорганической соли, присутствующей в твердой кристаллической форме синего цвета.
- Нитрат меди также в основном доступен в пяти различных формах гидратов. Гемипентагидрат нитрата меди II и тригидрат нитрата меди II являются наиболее популярными среди них.
- Нитрат меди (II) может быть получен из металлической меди, обработанной азотной кислотой, а также путем обработки металлической меди четырехокисью азота
- Нитрат меди (II) используется в производстве лекарств, в химическом анализе или в качестве инсектицида.

- Светочувствительная бумага изготовлена из соединений нитрата меди (II).
- С этим соединением следует обращаться крайне осторожно, так как оно может вызвать раздражение горла, легких, глаз и кожи.
Примеры вопросов
Вопросы: Каковы физические свойства нитрата меди [II]? [5 баллов]
Ответ : Физические свойства нитрата меди [II]:
- Нитрат меди (II) доступен в синем цвете и может легко удерживать влагу.
- Это кристаллическое твердое вещество во всех его гидратированных формах.
- Плотность нитрата меди (II) составляет 3,05 г мл-1 (безводный), 2,32 г мл-1 (тригидрат) или 2,07 г мл-1 (гексагидрат).
- Температура плавления его безводной формы составляет 256°C, а для тригидрата – 114,5°C, тогда как для всех его гексагидратов – 26,5°C.
- Большая часть безводной формы нитрата меди (II) растворяется при высоких температурах. Они также хорошо растворяются в воде, этаноле и аммиаке.
 Однако эти 3 формы гидратов нерастворимы в органических растворителях, таких как этилацетат.
Однако эти 3 формы гидратов нерастворимы в органических растворителях, таких как этилацетат.
Вопрос: Каковы химические свойства нитрата меди [II]? [2 балла]
Ответ : В нитрате меди (II) происходят различные химические реакции.
- One such reactions is the preparation of cupric oxide by the process of pyrolysis above 180 °C
2 Cu(NO 3 ) 2 → 2 CuO + 4 NO 2 + О 2
- Нитрат меди (II) также может реагировать с уксусным ангидридом, помогая в процессе нитрования ароматических соединений, таких как бензол.
Вопрос: Как получают нитрат меди(II)? [2 балла]
Ответ : Нитрат меди (II) может быть получен из металлической меди, обработанной азотной кислотой.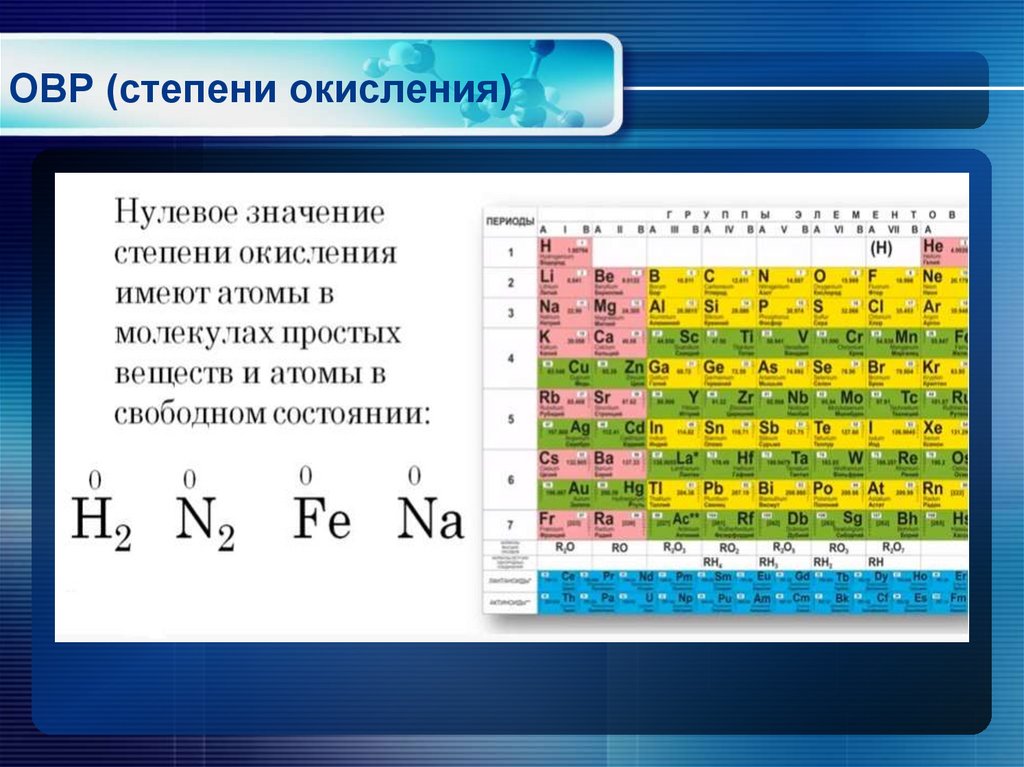
Cu + 4 HNO 3 → Cu(NO 3 ) 2 + 2 H 2O + 2 NO2
It can also be prepared by treating metallic copper with dinitrogen tetroxide:
Cu + 2 N 2 O 4 → Cu(NO3 ) 2 + 2 NO
Вопрос: Каковы различные области применения нитрата меди(II)? [5 баллов]
Ответ : Нитрат меди (II) используется по-разному:
- Может использоваться для производства пиротехники, синих красок и покрытий.
- Окислительно-восстановительная реакция между нитратом меди (II) и одним медным электродом также используется как популярное изображение гальванического элемента.
- Нитрат меди (II) также используется для получения оксида меди (II)
- Гидратная форма нитратов меди также используется в производстве лекарств, в химическом анализе или в качестве инсектицида.

- Светочувствительная бумага также изготавливается с использованием компонентов нитрата меди (II). Однако при сгорании выделяется токсичные оксиды азота.
Вопрос: Какие меры предосторожности следует соблюдать при работе с Cu(NO 3 ) 2? [2 балла]
Ответ : Меры безопасности Cu(NO3)2:
- Он может вызывать раздражение горла, легких, глаз и кожи.
- Однако, будучи негорючим составом, в сочетании с деревом, бумагой и другими взрывчатыми веществами может привести к серьезным пожарам.
Вопрос: Напишите сбалансированное уравнение, когда синий порошок нитрата меди нагревают в кипящей трубке, и подробно укажите тип реакции. [2 балла]
Ответ : Химическое уравнение представляет собой символическое изображение реагентов и продукта, которые понимаются в более простых химических формулах.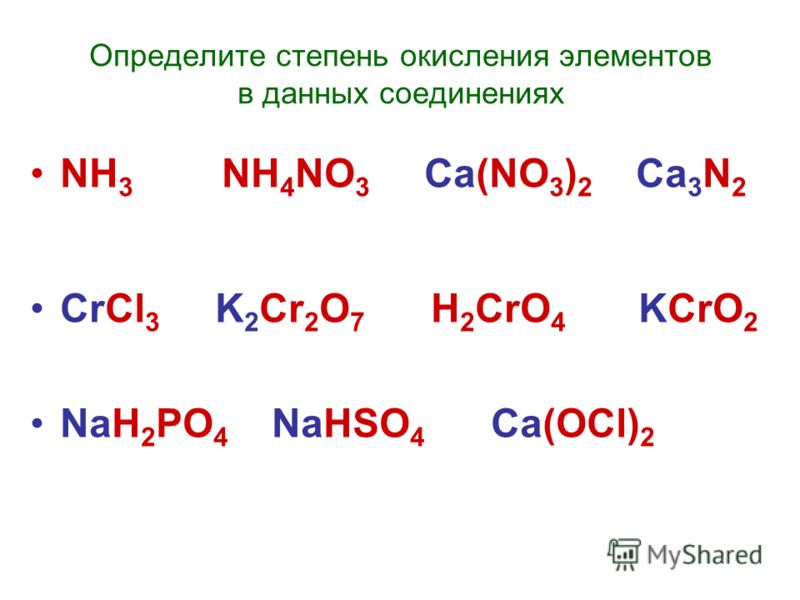
Сбалансированное химическое уравнение составляет
2CU (№ 3 ) 2 → 2CUO + 4NO 2 + O 100 2
Тип реакции – реакция термического разложения .
Вопрос: Какой тип реакции происходит ниже? [2 баллов]
2CU (№ 3 ) 2 → 2CUO + 4NO 2 + O 1100 2 100 2 10010011011101111011011011101113 гг. безводный нитрат меди (II) разлагается с выделением оксида меди, диоксида азота и газообразного кислорода.
Вопрос: Напишите сбалансированное уравнение реакции нитрата меди(II) с йодидом натрия. [2 балла]
Ответ: Иодид натрия (NaI) реагирует с нитратом меди (II) (Cu(NO3)2), что приводит к окислительно-восстановительной реакции, при которой Cu2+ окисляет I- до I2, что приводит к желтому осадку йодида меди(I) и раствора красного йода.
2Cu 2+ ( водный ) + 4I — ( aq ) ???? I 2 ( aq ) + 2CuI( s ) .
Вопрос: Что получится, если к нитрату меди(II) добавить аммиак. [2 балла]
Ответ : При добавлении аммиака (Nh4) к нитрату меди(II) (Cu(NO3)2) мы получаем бледно-голубой осадок, который представляет собой Cu(OH)2( с). ). Темно-синий цвет обусловлен Cu(Nh4)4 2+
Читайте также:
На cu в cu(no3)2?
Вопрос задан: Кейли Сванявски
Оценка: 4,1/5 (49 голосов)
Cu(NO3)2 является ионным соединением со степенью окисления
степенью окисления
Повышение степени окисления атома посредством химической реакции известно как окисление; уменьшение степени окисления известно как восстановление . Такие реакции включают формальный перенос электронов: чистый прирост электронов — это восстановление, а чистая потеря электронов — это окисление.
Такие реакции включают формальный перенос электронов: чистый прирост электронов — это восстановление, а чистая потеря электронов — это окисление.
https://en.wikipedia.org › wiki › Oxidation_state
Oxidation state — Wikipedia
«0» . Поэтому мы знаем, что сумма всех степеней окисления Cu, N и O равна 0. 1) заряды элементов, так как это ионная связь. Cu=+2, N=+5, O=-2.Каков заряд меди в Cu NO3 2?
Для нитрата меди(II), Cu(NO 3 ) 2 : Медь равна +2 , поскольку каждый из двух нитратов равен -1.
Какова степень окисления Cu в cu2s?
Сульфид меди(I) представляет собой сульфид меди, в котором металл находится в степени окисления +1 .
Является ли Cu NO3 2 катионом и анионом?
Формула и структура: Химическая формула нитрата меди (II): Cu(NO 3 ) 2 . Структура безводной соли образована одним катионом Cu 2 + и двумя анионами NO 3 — .
Что такое отрицательный ион Cu NO3 2?
Например, Cu(NO 3 ) 2 является нитратом меди (II), так как заряд двух ионов нитрата (NO 3 − 1 ) равен 2\cdot(-1) = -2 . Поскольку суммарный заряд ионного соединения должен быть равен нулю, ион Cu имеет заряд 2+. Таким образом, это соединение представляет собой нитрат меди (II).
Как найти степень окисления Cu в Cu(NO3)2
29 связанных вопросов найдено
Какова валентность Cu в cu2s?
валентность Cu=2 и валентность S=2 но почему химическая формула сульфида меди = Cu2S.
Какой элемент cu2s?
Сульфид меди(I) представляет собой сульфид меди, химическое соединение меди и серы. Он имеет химическое соединение Cu 2 S. Он встречается в природе в виде минерала халькоцита. Он имеет узкий диапазон стехиометрии от Cu 1,997 S до Cu 2,000 S.
Какова валентность меди в cu2s?
В Cu2S это 1 , а в CuO это 2.
Каков заряд cuno3?
Cu(NO3)2 представляет собой ионное соединение со степенью окисления « 0» . Поэтому мы знаем, что сумма всех степеней окисления Cu, N и O равна 0. 1) заряды элементов, так как это ионная связь. Cu=+2, N=+5, O=-2.
Сколько стоит NO3 2?
Это означает, что нитрат-ион имеет общий заряд -1 . Другими словами, каждый атом кислорода имеет 2 электрона на своей внутренней оболочке и 6 электронов на второй оболочке атома. У кислорода есть место для восьми электронов во второй оболочке. Три атома кислорода «хотят» иметь 6 электронов.
Как называется Cu2S?
Сульфид меди (Cu2S)
Как образуется Cu2S?
Cu2S образовался , когда медь подверглась воздействию газообразного сероводорода . Образовавшаяся сульфидная накипь была рыхлой и нелипкой. Особенности► Сера реагирует с медью с образованием CuS, Cu9{4}}$ т.е. имеют степень окисления -2, валентность меди можно рассчитать как: $2x-2=0$т.е. 1 , который показывает …
Как рассчитать валентность?
Математически мы можем сказать, что если самая внешняя оболочка атома содержит 4 или менее 4 электронов, то валентность элемента равна количеству электронов, находящихся на самой внешней оболочке, а если она больше 4, то валентность валентность элемента определяется как вычитание общего числа электронов …
Что такое CuOH?
Гидроксид меди(I) представляет собой гидроксид металлической меди с химической формулой CuOH.
Похожие вопросы
- 33Есть ли челка для штор?
- 26Выиграл ли ты национальный чемпионат?
- 44Какой заряд у.
 е.?
е.? - 19Есть ли в огурцах углеводы?
- 15Является ли cu элементом?
- 27 Какая валюта самая высокая?
- 32Какая валюта самая дорогая в Африке?
- 20Может ли культура стать гибридной?
- 21 Реагирует ли cu с hcl?
- 18Какая валюта самая низкая в мире?
Реклама
Популярные вопросы
- 15Получу ли я вторую проверку стимула?
- 28Это обновление или обновление?
- 21Был ли Станиславский реализмом или натурализмом?
- 18Насколько большим может быть куст вейгелы?
- 28Что происходит с шейном у соседей?
- 29Арагорн уничтожит кольцо?
- 16Используете ли горячие картофельные книги и наковальню?
- 41Можно ли провести психоанализ персонажа?
- 31Убьет ли борная кислота мышей?
- 17Шило 2020 уже началось?
Неорганическая химия 期刊最新论文, 化学/材料, 无机类期刊, — X-MOL
当前期刊: Неорганическая химия
Перейти к
текущий номер
加入关注
本刊介绍/投稿指南
催更
样式: 排序: 更新日由近到远
Свидание в пабе由近到远
ЕСЛИ:
—
ИДТИ
隐藏已读文章
全选
导出
标记为已读
开启中文模式
我的关注
我的收藏
您暂时未登录!
登录
Функционализация азота, опосредованная гетеробиметаллами: образование связи N–C в рениевой группе 9Диазенидные комплексы
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Эрик Т. Уэллетт, Джулиан С. Магдаленски, Роберт Г. Бергман, Джон Арнольд
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Эрик Т. Уэллетт, Джулиан С. Магдаленски, Роберт Г. Бергман, Джон Арнольд更新日期:2022-09-24
详情 收藏 取消收藏
Криогенно-сцинтилляционные свойства бессвинцовых монокристаллов Cs3Cu2I5
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Бо Лю, Юньхоу Сунь, Лян Чен, Бин Ляо, Цзиньлу Жуань, Лэйдан Чжоу, Ян Ли, Сяопин Оуян
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Бо Лю, Юньхоу Сунь, Лян Чен, Бин Ляо, Цзиньлу Жуань, Лэйдан Чжоу, Ян Ли, Сяопин Оуян更新日期:2022-09-24
详情 收藏 取消收藏
Металлоорганические каркасы@Композитные кристаллы кальцита
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Цзыцин Лю, Бяо Сюн, Инсян Дун, Инь Нин, Дэн Ли
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Цзыцин Лю, Бяо Сюн, Инсян Дун, Инь Нин, Дэн Ли更新日期:2022-09-24
详情 收藏 取消收藏
Повышение образования водорода путем селективного анодного электроокисления этанола на триметаллических наночастицах PdSbBi: состав имеет значение
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Qiuxia Wang, Tong Li, Suxia Yan, Wenjie Zhang, Guoai Lv, Hui Xu, Huaming Li, Yong Wang, Junfeng Liu
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Qiuxia Wang, Tong Li, Suxia Yan, Wenjie Zhang, Guoai Lv, Hui Xu, Huaming Li, Yong Wang, Junfeng Liu更新日期:2022-09-24
详情 收藏 取消收藏
Реакционная способность элементов группы 13 Tl и элемента 113, Nh, а также их гидроксидов по отношению к различным поверхностям кварца на основе периодических релятивистских расчетов DFT
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Мирослав Ильяш, Валерия Першина
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Мирослав Ильяш, Валерия Першина更新日期:2022-09-23
详情 收藏 取消收藏
Магические числа в октаэдрических лигированных сверхатомах металлов и халькогенидов
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Артур С. Ребер, Турбасу Сенгупта, Динеш Биста, Шив Н. Кханна
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Артур С. Ребер, Турбасу Сенгупта, Динеш Биста, Шив Н. Кханна更新日期:2022-09-23
详情 收藏 取消收藏
Моно-/дирутений и гетеротрехъядерные комплексы, полученные из индазола: переключаемый режим связывания, электронная форма и события восприятия анионов
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Майя Кумари, Кришненду Дей, Судип Кумар Бера, Гутам Кумар Лахири
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Майя Кумари, Кришненду Дей, Судип Кумар Бера, Гутам Кумар Лахири更新日期:2022-09-23
详情 收藏 取消收藏
Металлоорганический каркас на основе pH-стабильного TbIII в качестве сенсора флуоресценции включения и сдвига синего цвета в сторону бензальдегида и салицилового альдегида в водном растворе
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Ке Ван, Тен-Фей Чжэн, Цзин-Лин Чен, Хе-Руй Вен, Суй-Юнь Лю, Тонг-Лян Ху
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Ке Ван, Тен-Фей Чжэн, Цзин-Лин Чен, Хе-Руй Вен, Суй-Юнь Лю, Тонг-Лян Ху更新日期:2022-09-23
详情 收藏 取消收藏
Активация кислорода и механизм Nδ,Nε-дигидроксилирования, участвующий в формировании фармакофора N-нитрозомочевины в стрептозотоцине, катализируемый негемовым дижелезным ферментом SznF
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Ицзин Ван, Лихуа Дун, Хао Су, Юнцзюнь Лю
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Ицзин Ван, Лихуа Дун, Хао Су, Юнцзюнь Лю更新日期:2022-09-23
详情 收藏 取消收藏
Галогенная связь с участием нуклеофилов золота в различных степенях окисления
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Ирина Сергеевна Алиярова, Елена Ю. Тупикина, Наталья Сергеевна Солдатова, Даниил Михайлович Иванов, Павел Сергеевич Постников, Мехман Юсубов, Вадим Ю. Кукушкин
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Ирина Сергеевна Алиярова, Елена Ю. Тупикина, Наталья Сергеевна Солдатова, Даниил Михайлович Иванов, Павел Сергеевич Постников, Мехман Юсубов, Вадим Ю. Кукушкин更新日期:2022-09-23
详情 收藏 取消收藏
Конструирование биметаллических металлоорганических каркасов с иерархической полой структурой, собранной из нанолистов, для фиксации СО2
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Хуан Чен, Лэй Шао, Сюй Чжай, Юй Фу
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Хуан Чен, Лэй Шао, Сюй Чжай, Юй Фу更新日期:2022-09-23
详情 收藏 取消收藏
ГИДРАТАЦИЯ НИТРИЛОВ, КАТАЛИЗИРУЕМАЯ КОМПЛЕКСАМИ РУТЕНИЯ: РОЛЬ ВЗАИМОДЕЙСТВИЙ ДИВОДОРОДНЫХ СВЯЗЕЙ В АКТИВИЗАЦИИ БЕЗОСНОВНОГО КАТАЛИЗА
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Саманта Ядав, Раджив Гупта
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Саманта Ядав, Раджив Гупта更新日期:2022-09-23
详情 收藏 取消收藏
Катионный разлад в сегнетоэлектрических тетрагональных вольфрамовых бронзах Ba4M2Nb10O30 (M = Na, K, Rb)
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Ингер-Эмма Нилунд, Нора Статле Лёндал, Джулиан Уокер, Пер Эрик Вуллум, Мари-Энн Эйнарсруд, Тор Гранде
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Ингер-Эмма Нилунд, Нора Статле Лёндал, Джулиан Уокер, Пер Эрик Вуллум, Мари-Энн Эйнарсруд, Тор ГрандеКристаллическая структура тетрагональных вольфрамовых бронз с общей формулой A12A24C4B12B28O30 является гибкой как с химической, так и со структурной точки зрения, что приводит к множеству составов. Позиции решетки A1 и A2 с разным координационным окружением обычно считаются занятыми двумя разными катионами, например, в Ba4Na2Nb10O30, где Na+ и Ba2+ занимают позиции A1 и A2.
更新日期:2022-09-23
详情 收藏 取消收藏
Селективная по размеру реакция сочетания Сузуки-Мияуры на ультрадисперсных нанокатализаторах Pd в водостойкой индий-органической структуре
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Дандан Чен, Линьша Вэй, Ихан Юй, Лэй Чжао, Цюхун Сунь, Ченг Хань, Цзяньмей Лу, Хуагуй Ни, Ли-Сюн Шао, Цзиньцзе Цянь, Чжи Ян
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Дандан Чен, Линьша Вэй, Ихан Юй, Лэй Чжао, Цюхун Сунь, Ченг Хань, Цзяньмей Лу, Хуагуй Ни, Ли-Сюн Шао, Цзиньцзе Цянь, Чжи Ян更新日期:2022-09-23
详情 收藏 取消收藏
Серия одномолекулярных магнитов дикобальта (II) с бензохиноновым мостиком
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Бинлин Яо, И-Цюань Чжан, И-Фей Дэн, Тяньрань Ли, Юань-Чжу Чжан
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Бинлин Яо, И-Цюань Чжан, И-Фей Дэн, Тяньрань Ли, Юань-Чжу Чжан更新日期:2022-09-22
详情 收藏 取消收藏
3D/2D гетеропереход, изготовленный из наносфер RuS2, инкапсулированных в полимерные нанолисты нитрида углерода, для селективного фотокаталитического восстановления CO2 до CO
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Нан Су, Дацян Чжу, Пингфан Чжан, Юхай Фан, Юйсян Чен, Чжэнь Фан, Сянтун Чжоу, Чунмей Ли, Хунцзюнь Дун
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Нан Су, Дацян Чжу, Пингфан Чжан, Юхай Фан, Юйсян Чен, Чжэнь Фан, Сянтун Чжоу, Чунмей Ли, Хунцзюнь Дун更新日期:2022-09-22
详情 收藏 取消收藏
Применение подхода пары B/N Льюиса для доступа к хиральным аналогам на основе бинафтила, расширенным слиянием
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Гоцин Тянь, Цзинь-Фа Чен, Кай Чжан, Яфэй Ши, Чэнлун Ли, Сяодун Инь, Канглей Лю, Панкуан Чен
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Гоцин Тянь, Цзинь-Фа Чен, Кай Чжан, Яфэй Ши, Чэнлун Ли, Сяодун Инь, Канглей Лю, Панкуан Чен更新日期:2022-09-22
详情 收藏 取消收藏
Оксихалькогениды как перспективные ультрафиолетовые нелинейно-оптические кандидаты: экспериментальные и теоретические исследования AEGeOS2 (AE = Sr и Ba)
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Хэ-Ди Ян, Шэн-Хуа Чжоу, Мао-Инь Ран, Синь-Тао Ву, Хуа Линь, Ци-Лун Чжу
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Хэ-Ди Ян, Шэн-Хуа Чжоу, Мао-Инь Ран, Синь-Тао Ву, Хуа Линь, Ци-Лун Чжу更新日期:2022-09-22
详情 收藏 取消收藏
СТРУКТУРНОЕ РАЗНООБРАЗИЕ И РЕАКЦИОННОСТЬ МНОГОЭЛЕКТРОННОГО ВОССТАНОВЛЕНИЯ ИОДИДО-β-ДИКЕТИМИНАТНЫХ КОМПЛЕКСОВ САМАРИЯ(II) В ЗАВИСИМОСТИ ОТ СОДЕРЖАНИЯ ТЕТРАГИДРОФУРАНА
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Миронова Ольга Александровна, Сухих Таисия Сергеевна, Конченко Сергей Николаевич, Пушкаревский Николай Александрович
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Миронова Ольга Александровна, Сухих Таисия Сергеевна, Конченко Сергей Николаевич, Пушкаревский Николай Александрович更新日期:2022-09-22
详情 收藏 取消收藏
[Метилгидразиний]2PbCl4, двумерный перовскит с полярной и модулированной фазами
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Катажина Федорук, Давид Дроздовски, Мирослав Мачка, Ян К. Зареба, Дагмара Стефаньска, Анна Гагор, Адам Серадзки
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Катажина Федорук, Давид Дроздовски, Мирослав Мачка, Ян К. Зареба, Дагмара Стефаньска, Анна Гагор, Адам СерадзкиДвумерные (2D) галогениды свинца перовскиты представляют собой семейство материалов, лежащих в основе технологий солнечных элементов, светоизлучающих диодов и фотодетекторов. Эта точка зрения приводит к ряду синтетических усилий по созданию материалов этого класса, в том числе с заданной полярной архитектурой. Недавно предполагалось, что катион метилгидразиния (MHy+) обладает необычной способностью генерировать нецентросимметричные
更新日期:2022-09-22
详情 收藏 取消收藏
Структурные и электронные эффекты на кремниевых центрах, стабилизированных фосфинхалькогенидами, в четырехчленных гетероциклических катионах
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Александр Фальк, Джонатан О. Бауэр
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Александр Фальк, Джонатан О. Бауэр更新日期:2022-09-22
详情 收藏 取消收藏
Периодические тренды в нитратах актинила(VI) и их структурах, колебательных спектрах и электронных свойствах
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Матье Отилло, Ричард Э. Уилсон, Моника Василиу, Габриэль Ф. де Мело, Дэвид А. Диксон
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Матье Отилло, Ричард Э. Уилсон, Моника Василиу, Габриэль Ф. де Мело, Дэвид А. Диксон更新日期:2022-09-22
详情 收藏 取消收藏
Паровая конверсия центросимметричного органо-неорганического гибридного кристалла в протонпроводящий материал с активной генерацией второй гармоники
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Дзюнъити Янагисава, Кёсукэ Танака, Хидэаки Кано, Киёси Мията, Бенджамин Ле Оуэ, Рё Отани, Масааки Оба
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Дзюнъити Янагисава, Кёсукэ Танака, Хидэаки Кано, Киёси Мията, Бенджамин Ле Оуэ, Рё Отани, Масааки Оба更新日期:2022-09-22
详情 收藏 取消收藏
Индуцированный переносом электрона внутренней сферы обратимый резервуар электронов Особенность каркасов дирутения с азогетероареновыми мостиками
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Литон Сейх, Санчайта Дей, Суман Дхара, Адити Сингх, Гутам Кумар Лахири
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Литон Сейх, Санчайта Дей, Суман Дхара, Адити Сингх, Гутам Кумар Лахири更新日期:2022-09-22
详情 收藏 取消收藏
ОДНОМОЛЕКУЛЬНЫЙ МАГНИТИЗМ В ЛИНЕЙНЫХ КОМПЛЕКСАХ Fe(I) С ОСНОВНЫМИ ОБОЛОЧНЫМИ И НЕУФБАУ-СОСТОЯНИЯМИ
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Ришу Хурана, доктор медицины Эхесан Али
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Ришу Хурана, доктор медицины Эхесан Али更新日期:2022-09-21
详情 收藏 取消收藏
Иминофосфонамидоносные плюмбилены и плюмбилиумилидены: синтез и свойства
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Кадзуки Накая, Синтаро Такахаши, Акихико Исии, Норио Наката
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Кадзуки Накая, Синтаро Такахаши, Акихико Исии, Норио Наката更新日期:2022-09-21
详情 收藏 取消收藏
Синтез, структура и каталитическая активность двух полиоксометаллатов, декорированных мультирезусом.

Неорг. хим. (ЕСЛИ 5.436) Дата публикации : 21 сентября 2022 г. Чжэнь Лю, Вэнью Ван, Юцзе Чжао, Чжэнь Цзин, Ронг Ван, Хуафэн Ли, Пэнтао Ма, Цзинъян Ню, Цзинпин Ван
更新日期:2022-09-21
详情 收藏 取消收藏
Наночастицы сплава Ni–Cu, ограниченные физическим инкапсулированием с SiO2 и химическим взаимодействием металла с носителем с CeO2, для сухого риформинга метана
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Ю Ши, Кайхан Хань, Фаген Ван
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Ю Ши, Кайхан Хань, Фаген Ван更新日期:2022-09-21
详情 收藏 取消收藏
Термо-, механо- и вапохромные биядерные эмиссионные комплексы меди с переключаемой связью Ch4CN–Cu
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Цинь Хуан, Жуй Чжан, Ли-Хуа Хэ, Цзин-Лин Чен, Фэн Чжао, Суй-Цзюнь Лю, Хэ-Руй Вэнь
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Цинь Хуан, Жуй Чжан, Ли-Хуа Хэ, Цзин-Лин Чен, Фэн Чжао, Суй-Цзюнь Лю, Хэ-Руй Вэнь更新日期:2022-09-21
详情 收藏 取消收藏
Комплексный магнитный порядок в топохимически восстановленных фазах Rh(I)/Rh(III) LaM0,5Rh0,5O2,25 (M = Co, Ni)
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Чжэинг Сюй, Пардип К. Тхакур, Тиен-Лин Ли, Анна Регуц, Эммануэль Суар, Инес Пуэнте-Оренч, Майкл А. Хейворд
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Чжэинг Сюй, Пардип К. Тхакур, Тиен-Лин Ли, Анна Регуц, Эммануэль Суар, Инес Пуэнте-Оренч, Майкл А. ХейвордТопохимическое восстановление катионно-разупорядоченных оксидов перовскита LaCo0.5Rh0.5O3 и LaNi0.5Rh0.5O3 Zr приводит к частично анионно-вакансионно упорядоченным фазам LaCo0.5Rh0.5O2.25 и LaNi0.5Rh0.5O2.25 соответственно. Измерения с помощью нейтронной дифракции и фотоэлектронной спектроскопии жесткого рентгеновского излучения (HAXPES) показывают, что анион-дефицитные фазы содержат Co1+/Ni1+ и смесь катионов Rh2+ и Rh4+ в соотношении 1:1.
更新日期:2022-09-21
详情 收藏 取消收藏
Ag4SnGe2S7: нецентросимметричный халькогенид в системе I4–II–IV2–VI7 с неалмазоподобной структурой с 1D ∞[SnGe2S8]6– бесконечной цепью
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Пэн Ван, Майерхаба Абудурехеман, Кеванг Чжан, Хуанцзюань Чжэн, Чжаохуэй Чен, Ци Ву
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Пэн Ван, Майерхаба Абудурехеман, Кеванг Чжан, Хуанцзюань Чжэн, Чжаохуэй Чен, Ци Ву更新日期:2022-09-21
详情 收藏 取消收藏
Фазовый переход REF3 из орторомбического в гексагональный (RE = Sm в Lu и Y) под высоким давлением
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Чжилей Суй, Джунке Ван, Да Хуан, Сянци Ван, Ручэн Дай, Чжунпин Ван, Сяньсюй Чжэн, Цзэнмин Чжан, Цян Ву
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Чжилей Суй, Джунке Ван, Да Хуан, Сянци Ван, Ручэн Дай, Чжунпин Ван, Сяньсюй Чжэн, Цзэнмин Чжан, Цян Ву更新日期:2022-09-21
详情 收藏 取消收藏
Извлекаемые при атмосферном давлении полиазотные твердые вещества, собранные из пентазолатных колец с высокой плотностью энергии
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Шуи Линь, Мэйлин Сюй, Ивэй Лян, Сюаньхао Юань, Имин Чжан, Фэйлун Ван, Цзянь Хао, Иньвэй Ли
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Шуи Линь, Мэйлин Сюй, Ивэй Лян, Сюаньхао Юань, Имин Чжан, Фэйлун Ван, Цзянь Хао, Иньвэй Ли更新日期:2022-09-21
详情 收藏 取消收藏
Циклометаллированные спиробифлуоренимидазолилиденовые комплексы платины(II) с преобладающим характером излучения 3LC и высокими квантовыми выходами фотолюминесценции
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Тим Рисебек, Мария-Софи Бертрамс, Сергей Стипурин, Кай Коновски, Кристоф Керциг, Томас Штрасснер
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Тим Рисебек, Мария-Софи Бертрамс, Сергей Стипурин, Кай Коновски, Кристоф Керциг, Томас Штрасснер更新日期:2022-09-20
详情 收藏 取消收藏
Структурная перестройка домена цинкового пальца белка nsp13 SARS-CoV-2 с использованием ионов висмута (III): многоуровневое вычислительное исследование
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Иоганн Толбатов, Лориано Сторки, Алессандро Марроне
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Иоганн Толбатов, Лориано Сторки, Алессандро МарронеИдентификация новых терапевтических средств против пандемической инфекции SARS-CoV-2 является обязательным новым направлением текущих научных исследований. При поиске агентов против SARS-CoV-2 в качестве альтернативы вакцине или иммунным терапевтическим средствам, эффективность которых естественным образом снижается с появлением новых вариантов, было обнаружено, что соли Bi3+ снижают активность Zn2+-зависимых неструктурных
更新日期:2022-09-20
详情 收藏 取消收藏
Отрыв атома водорода от комплекса OsII(Nh4)2 с образованием комплекса OsIV(Nh3)2: экспериментальный и расчетный анализ свободных энергий и реакционной способности диссоциации связи N–H
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Питер Л. Данн, Мелисса Барона, Саманта И. Джонсон, Симона Раугей, Р. Моррис Буллок
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Питер Л. Данн, Мелисса Барона, Саманта И. Джонсон, Симона Раугей, Р. Моррис Буллок更新日期:2022-09-20
详情 收藏 取消收藏
Фтортритиофосфат Абстрагирование от дифторпентатиодифосфат дианиона: d8 и d6 комплексы [η2-S3PF]2–
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Квентин Гейдон, Дэвид Скотт Боле
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Квентин Гейдон, Дэвид Скотт Боле更新日期:2022-09-20
详情 收藏 取消收藏
Синтез с большой площадью поверхности CaTiO3, легированного железом, при низких температурах: новый взгляд на активацию кислорода, состояния железа и влияние на окисление метана
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Максим Дельпорт, Жюли Кавайес, Микаэль Мартин Ромо-и-Моралес, Николя Бион, Лука Нодари, Ксавье Куртуа, Фабьен Кан, Хелена Капер
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Максим Дельпорт, Жюли Кавайес, Микаэль Мартин Ромо-и-Моралес, Николя Бион, Лука Нодари, Ксавье Куртуа, Фабьен Кан, Хелена Капер更新日期:2022-09-20
详情 收藏 取消收藏
Химическое и окислительно-восстановительное соединение уранила с тремя экологически значимыми бифункциональными хелатами: мультиметодический подход в сочетании с теоретическими оценками
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ашутош Шривастава, Рама Мохана Рао Думпала, Пранав Кумар, Рави Кумар, Нитика Рават
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ашутош Шривастава, Рама Мохана Рао Думпала, Пранав Кумар, Рави Кумар, Нитика Рават更新日期:2022-09-20
详情 收藏 取消收藏
Структура, электронные и водородоаккумулирующие свойства гидридов магния-скандия
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ян Тан, Ли-Пин Дин, Си-Лун Доу, Пэн Шао, Го-Дун Вэй, И-Цзинь Го, Цзя-Хао Цзэн
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ян Тан, Ли-Пин Дин, Си-Лун Доу, Пэн Шао, Го-Дун Вэй, И-Цзинь Го, Цзя-Хао Цзэн更新日期:2022-09-20
详情 收藏 取消收藏
Полые нанокубы Cu2O, обогащенные кислородом и вакансиями, для реакции электровосстановления нитратов до аммиака в нейтральном электролите
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ван Сяо-Хуэй, Ван Чжэн-Мин, Хун Цин-Лин, Чжан Зе-Нонг, Фэн Ши, Ли Дун-Шэн, Шу-Ни Ли, Ю Чен
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ван Сяо-Хуэй, Ван Чжэн-Мин, Хун Цин-Лин, Чжан Зе-Нонг, Фэн Ши, Ли Дун-Шэн, Шу-Ни Ли, Ю Чен更新日期:2022-09-20
详情 收藏 取消收藏
Координационный полимер на основе Cu(II) как электрокатализатор в чистом виде, пригодный для использования в реакции восстановления кислорода: экспериментальная оценка и теоретические исследования биомиметических механистических аспектов
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.Бандхана Деви, Ахил Бхардвадж, Дикша Гамбхир, Бисваджит Рой, Анирбан Кармакар, Гураб Дей, Анудж Джайн, Бхаскар Мондал, Рик Рани Конер
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.Бандхана Деви, Ахил Бхардвадж, Дикша Гамбхир, Бисваджит Рой, Анирбан Кармакар, Гураб Дей, Анудж Джайн, Бхаскар Мондал, Рик Рани Конер更新日期:2022-09-20
详情 收藏 取消收藏
PbBi(SeO3)2F и Pb2Bi(SeO3)2Cl3: сосуществование трех видов стереохимически активных катионов с неподеленной парой, демонстрирующих превосходные нелинейные оптические свойства
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ин-Цзе Цзя, Синюй Чжан, И-Ган Чен, Синсин Цзян, Цзя-Нэн Сун, Чжешуай Линь, Сянь-Мин Чжан
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ин-Цзе Цзя, Синюй Чжан, И-Ган Чен, Синсин Цзян, Цзя-Нэн Сун, Чжешуай Линь, Сянь-Мин Чжан更新日期:2022-09-19
详情 收藏 取消收藏
Рост потока галлидов церия и никеля, изученный методом нейтронной дифракции in situ
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Джо В. Хэддок, Зак Дж. Бартон, Кеке Фенг, Райан Э. Баумбах, Цян Чжан, Сьюзен Э. Латтернер
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Джо В. Хэддок, Зак Дж. Бартон, Кеке Фенг, Райан Э. Баумбах, Цян Чжан, Сьюзен Э. Латтернер更新日期:2022-09-19
详情 收藏 取消收藏
Теоретические исследования лигандов на основе фенантролина для разделения Am(III)/Eu(III)
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 18 сентября 2022 г.
Яо Цзоу, Цзянь-Хуэй Лань, Ли-Юн Юань, Конг-Чжи Ван, Цюнь-Ян Ву, Чжи-Фан Чай, Пэн Жэнь, Вэй-Цюнь Ши
хим. (ЕСЛИ 5.436)
Дата публикации : 18 сентября 2022 г.
Яо Цзоу, Цзянь-Хуэй Лань, Ли-Юн Юань, Конг-Чжи Ван, Цюнь-Ян Ву, Чжи-Фан Чай, Пэн Жэнь, Вэй-Цюнь Ши更新日期:2022-09-19
详情 收藏 取消收藏
КРИСТАЛЛИЧЕСКИЕ МОЛЕКУЛЯРНЫЕ АССАМБЛЕИ КОМПЛЕКСОВ, ПРОЯВЛЯЮЩИХ ВОСЬМЕРНО-КООРДИНАЦИОННУЮ ДОДЕКАЭДРИЧЕСКУЮ ГЕОМЕТРИЮ НИОБИЯ(IV) В СИСТЕМЕ ПИРИДИН-ДИКАРБОНОВАЯ КИСЛОТА
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Деспоина Андриоту, Сильвен Дюваль, Кристоф Фолькрингер, Анхель М. Аревало-Лопес, Пардис Симон, Эрве Везен, Тьерри Луазо
хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Деспоина Андриоту, Сильвен Дюваль, Кристоф Фолькрингер, Анхель М. Аревало-Лопес, Пардис Симон, Эрве Везен, Тьерри Луазо更新日期:2022-09-17
详情 收藏 取消收藏
Многокомпонентная самосборка металлосупрамолекулярных прямоугольников марганца (I) с диаминобензохинонатными мостиками: взаимодействия хозяин-гость, противораковая активность и исследования высвобождения CO под действием видимого света
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-16
Дханарадж Дивья, Рамадос Говиндараджан, Рамамурти Нагараджапракаш, Роберт Р. Файзуллин, Питчавел Видхьяприя, Натараджан Сактхивел, Бала. Манимаран
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-16
Дханарадж Дивья, Рамадос Говиндараджан, Рамамурти Нагараджапракаш, Роберт Р. Файзуллин, Питчавел Видхьяприя, Натараджан Сактхивел, Бала. Манимаран更新日期:2022-09-17
详情 收藏 取消收藏
Белые светодиоды на основе одномерного органо-неорганического гибридного хлорида металла с двойным излучением
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Сяохуа Ченг, Сиджия Юэ, Рунан Чен, Цзюнь Инь, Бин-Бин Цуй
хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Сяохуа Ченг, Сиджия Юэ, Рунан Чен, Цзюнь Инь, Бин-Бин ЦуйИзлучающие белый свет органо-неорганические гибридные галогениды металлов (MH) показали многообещающие потенциальные применения в твердотельном освещении. Поскольку одномерные (1D) МГ для излучения белого света остаются редкостью, а ключевая роль регуляции галогена в 1D гибридных МГ для широкополосного излучения (BE) еще не установлена, здесь мы сообщаем о семействе 1D гибридных МГ TMGPbX3. (ТМГ = 1,1,3,3-тетраметилгуанидин
更新日期:2022-09-17
详情 收藏 取消收藏
Люминесценция лантанидов и термохромная эмиссия доноров мягких атомов дихалькогеноимидодифосфинатных лигандов
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Орландо С. Стюарт-младший, Александр С. Марвиц, Джоэл Суонсон, Джеффри А. Бертке, Тайлер Хартман, Хорхе Х.С.К. Монтейро, Ана де Беттанкур-Диас, Кара Э. Ноуп, Сара Л. Столл
хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Орландо С. Стюарт-младший, Александр С. Марвиц, Джоэл Суонсон, Джеффри А. Бертке, Тайлер Хартман, Хорхе Х.С.К. Монтейро, Ана де Беттанкур-Диас, Кара Э. Ноуп, Сара Л. Столл更新日期:2022-09-17
详情 收藏 取消收藏
Tb3+-Органический каркас на основе наноклеток для эффективного катализа реакции циклоприсоединения CO2 с эпоксидами и конденсации Кнёвенагеля
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Hongxiao Lv, Hongtai Chen, Liming Fan, Xiutang Zhang
хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Hongxiao Lv, Hongtai Chen, Liming Fan, Xiutang Zhang更新日期:2022-09-17
详情 收藏 取消收藏
Электронные структуры и необычное химическое связывание в димерах актинилпероксидов [An2O6]2+ и [(An2O6)(12-краун-4 эфир)2]2+ (An = U, Np и Pu)
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Шу-Сянь Ху, Сяо-Ся Ю, Вэнь-Ли Цзоу, Эрли Лу, Сян Гао, Пин Чжан
хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Шу-Сянь Ху, Сяо-Ся Ю, Вэнь-Ли Цзоу, Эрли Лу, Сян Гао, Пин ЧжанКак известно, пероксиды актинила играют важную роль в переносе актинидов в окружающей среде и имеют стратегическое значение в применении атомной промышленности. По сравнению с наиболее изученными пероксидами уранила исследования трансурановых аналогов все еще немногочисленны, и требуется больше информации об этих видах. В этой работе экспериментально индуцированные димеры пероксида актинила ([An2O6]2+, An = U,
更新日期:2022-09-17
详情 收藏 取消收藏
Активация наночастиц Pd на легированном кислородом g-C3N4 для термокаталитического окисления бензилового спирта под действием видимого света
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Шию Го, Дунцзе Цао, Пейжун Сяо, Гэнлэй Чжан, Ци Ван, Пэн Цуй
хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Шию Го, Дунцзе Цао, Пейжун Сяо, Гэнлэй Чжан, Ци Ван, Пэн Цуй更新日期:2022-09-17
详情 收藏 取消收藏
Карбаматы кремния путем фиксации CO2: лабильный предшественник суперкислоты Льюиса в кислоте Бренстеда
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Дебора Хартманн, Таддэус Струнден, Лутц Греб
хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Дебора Хартманн, Таддэус Струнден, Лутц Греб更新日期:2022-09-17
详情 收藏 取消收藏
Выяснение режимов координации состояния раствора мультидентатных нейтральных аминовых лигандов с катионами металлов группы 1: исследования ЯМР при переменной температуре
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Натан Дэвисон, Джеймс А. Квирк, Коринн Уиллс, Кейси Диксон, Пол Дж. Уодделл, Джеймс А. Доусон, Эрли Лу
хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Натан Дэвисон, Джеймс А. Квирк, Коринн Уиллс, Кейси Диксон, Пол Дж. Уодделл, Джеймс А. Доусон, Эрли ЛуМультидентатные нейтральные аминовые лиганды играют жизненно важную роль в координационной химии и катализе. В частности, эти лиганды используются для настройки реакционной способности реагентов металлов группы 1, таких как литийорганические реагенты. Большинство, если не все, из этих реакций, опосредованных металлическими реагентами группы 1, происходят в растворе. Однако координационное поведение этих лигандов с катионами металлов группы 1 в растворенном состоянии плохо изучено.
更新日期:2022-09-16
详情 收藏 取消收藏
Тетраэдрический разупорядочение смещения в оксиде типа шеелита RbReO4
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Фредерик П. Марлтон, Брайс Дж. Малленс, Филип А. Чейтер, Брендан Дж. Кеннеди
хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Фредерик П. Марлтон, Брайс Дж. Малленс, Филип А. Чейтер, Брендан Дж. Кеннеди更新日期:2022-09-16
详情 收藏 取消收藏
Функционализация углеродных нанотрубок комплексами бис(2,9-диалкил-1,10-фенантролин)меди(II) для реакции восстановления кислорода
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Дебора Браззолото, Янниг Неделлек, Кристиан Филуз, Майкл Хользингер, Фабрис Томас, Алан Ле Гофф
хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Дебора Браззолото, Янниг Неделлек, Кристиан Филуз, Майкл Хользингер, Фабрис Томас, Алан Ле Гофф更新日期:2022-09-15
详情 收藏 取消收藏
Анион-управляемая циркулярно-поляризованная инверсия люминесценции несимметричных комплексов европия (III) для обнаружения мишени, идентифицируемой
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Ёсинори Окаясу, Кота Вакабаяси, Дзюнпей Юаса
хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Ёсинори Окаясу, Кота Вакабаяси, Дзюнпей ЮасаАнион-чувствительная инверсия знака циркулярно поляризованной люминесценции (CPL) была успешно достигнута с помощью некоординированных комплексов европия (III) (Eu3+) типа N3O6 [(R)-1 и (S)-1], состоящих из менее затрудненного несимметричного N3-тридентатный лиганд (хиральный бис(оксазолиновый) лиганд) и три O2-хелатирующих (β-дикетонатных) лиганда. Здесь (R)-1 показал положительный сигнал CPL (IL – IR > 0) на переходе 5D0 → 7F1.
更新日期:2022-09-15
详情 收藏 取消收藏
Химия нитрозильного лиганда κ:η-мостикового дитольфрамового центра: реакции перегруппировки и разрыва связи N–O
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
М. Анхелес Альварес, М. Эстер Гарсия, Даниэль Гарсия-Виво, Ана М. Герра, Мигель А. Руис, Ларри Р. Фальвелло
хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
М. Анхелес Альварес, М. Эстер Гарсия, Даниэль Гарсия-Виво, Ана М. Герра, Мигель А. Руис, Ларри Р. ФальвеллоНовый комплекс с нитрозиловым мостиком [W2Cp2(μ-PtBu2)(μ-κ:η-NO)(CO)(NO)](BAr4) [Ar = 3,5-C6h4(CF3)2] был получен многостадийным процедура, начинающаяся с гидрида [W2Cp2(μ-H)(μ-PtBu2)(CO)4] и включающая новые комплексы [W2Cp2(μ-PtBu2)(CO)4](BF4), [W2Cp2(μ-PtBu2) (CO)2(NO)2](BAr4) и [W2(μ-κ:η5-C5h5)Cp(μ-PtBu2)(CO)(NO)2] в качестве интермедиатов, которые следуют из реакций с HBF4·OEt2 , NO и Me3NO·2h3O
更新日期:2022-09-15
详情 收藏 取消收藏
Прямое восстановление NO до N2O мононуклеарным негемовым тиолат-лигированным комплексом железа(II) через образование метастабильного комплекса {FeNO}7
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Анируддха Дей, Тереза Альберт, Ричард Ю. Конг, Саманта Н. Макмиллан, Пьер Монн-Локкоз, Кайл М. Ланкастер, Дэвид П. Голдберг
хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Анируддха Дей, Тереза Альберт, Ричард Ю. Конг, Саманта Н. Макмиллан, Пьер Монн-Локкоз, Кайл М. Ланкастер, Дэвид П. Голдберг更新日期:2022-09-15
详情 收藏 取消收藏
НИЗКОТЕМПЕРАТУРНОЕ ОКИСЛЕНИЕ ТОЛУОЛА НА КОМПОЗИТАХ MnOx–CeO2 НАНОПОРТЫ С ВЫСОКОЙ СПЕКАЕМОСТЬЮ: ДВОЙНОЙ ЭФФЕКТ СИНЕРГЕТИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ НА АДСОРБЦИЮ УГЛЕВОДОРОДОВ И АКТИВАЦИЯ КИСЛОРОДА
Неорг.
 хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Ицзя Цао, Чи Чжан, Дэхуа Сюй, Сянь Оуян, Е Ван, Ли Лв, Тао Чжан, Шэнвэй Тан, Вэньсян Тан
хим. (ЕСЛИ 5.436)
Дата публикации : 15 сентября 2022 г.
Ицзя Цао, Чи Чжан, Дэхуа Сюй, Сянь Оуян, Е Ван, Ли Лв, Тао Чжан, Шэнвэй Тан, Вэньсян Тан更新日期:2022-09-15
详情 收藏 取消收藏
2022功能更新(3):手机上只搜索OA期刊;搜索框支持多个中文词的OR和AND关系
Содержание воспроизведено с разрешения издателей.
全选 导出 标记为已读
Решения Бальбхарати для науки и техники, часть 1 10-й стандарт SSC Maharashtra State Board, глава 3. Химические реакции и уравнения [Последнее издание]
Balbharati Solutions for Science and Technology Part 1 10-й стандарт SSC Maharashtra State Board, глава 3 Химические реакции и уравнения Упражнения [Страницы 45 — 46]
Упражнения | Вопрос 1.1 | Страница 45
Выберите правильный вариант ответа из скобок и объясните утверждение с указанием причины.
(Окисление, вытеснение, электролиз, восстановление, цинк, медь, двойное вытеснение, разложение)
Для предотвращения коррозии на железные листы наносится слой ______ металла.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 1.2 | Страница 45
Выберите правильный вариант ответа из скобок и объясните утверждение с указанием причины.
(Окисление, замещение, электролиз, восстановление, цинк, медь, двойное замещение, разложение)
Превращение сульфата железа в сульфат железа представляет собой ______ реакцию.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 1.3 | Страница 45
Выберите правильный вариант из предложенных вариантов и объясните утверждение, указав причину.
При пропускании электрического тока через подкисленную _________ воды происходит.
Окисление
Смещение
Электролиз
РЕЗУКЦИЯ
ZINC
Справление
Двойное смещение
Разложение
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 1. 4 | Страница 45
4 | Страница 45
Выберите правильный вариант ответа из скобок и объясните утверждение, указав причину.
(Окисление, замещение, электролиз, восстановление, цинк, медь, двойное замещение, разложение)
Добавление водного раствора ZnSO 4 к водному раствору BaCl 2 является примером ______ реакции.
ПОСМОТРЕТЬ РЕШЕНИЕ
Напишите ответ на следующее.
Упражнения | Вопрос 2.1 | Страница 45
Как называется реакция, когда окисление и восстановление происходят одновременно? Объясните на одном примере.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 2.2 | Страница 45
Напишите ответ на следующие вопросы.
Как можно увеличить скорость химической реакции, а именно разложения перекиси водорода?
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 2.3 | Страница 45
Напишите ответ на следующие вопросы.
Объясните термин реагент и продукт, приведя примеры.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 2.4 | Страница 45
Напишите ответ на следующие вопросы.
Объясните типы реакций применительно к кислороду и водороду. Иллюстрация с примерами.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 2.5 | Страница 45
Напишите ответ на следующее.
Объясните сходство и различие двух событий, а именно добавление NaOH в воду и добавление CaO в воду.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 3.1 | Страница 45
Объясните термины примерами.
Эндотермическая реакция
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 3.2 | Страница 45
Объясните термины примерами.
Комбинированная реакция
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 3.3 | Страница 45
Объясните термины примерами.
Сбалансированное уравнение
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 3. 4 | Страница 45
4 | Страница 45
Объясните термины примерами.
Реакция смещения
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 4.1 | Страница 45
Дайте научное обоснование.
Когда газ, образующийся при нагревании известняка, пропускают через свежеприготовленную известковую воду, известковая вода становится молочной.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 4.2 | Страница 45
Дайте научное обоснование.
Требуется время, чтобы кусочки шахабадской плитки растворились в соляной кислоте, но ее порошок исчезает быстро.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 4.3 | Страница 45
Дайте научное обоснование.
При приготовлении разбавленной серной кислоты из концентрированной серной кислоты в лаборатории концентрированную серную кислоту медленно добавляют в воду при постоянном перемешивании.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 4. 4 | Страница 45
4 | Страница 45
Дайте научное обоснование.
Для длительного хранения масла рекомендуется использовать герметичную тару.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 5 | Страница 45
Посмотрите на следующую картинку и запишите химическую реакцию с объяснением.
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 6.1 | Страница 46
Определите по реакции реагенты, которые претерпевают окисление и восстановление.
Fe + S → FeS
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 6.2 | Страница 46
Из приведенной ниже реакции определите, какие реагенты подвергаются окислению и восстановлению.
2Ag 2 O → 4 Ag + O 2 ↑
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 6.3 | Страница 46
Определите по реакции реагенты, которые претерпевают окисление и восстановление.
2Mg + O 2 → 2MgO
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 6. 4 | Страница 46
4 | Страница 46
Определите по реакции реагенты, которые претерпевают окисление и восстановление.
\[\ce{NiO + h3 -> Ni + h3O}\]
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 7.1 | Страница 46
Сбалансируйте уравнение пошагово.
H 2 S 2 O 7 (l) + H 2 O(l) → H 2 SO 4 (l)
VIEW | Вопрос 7.2 | Страница 46
Сбалансируйте уравнение пошагово. 2 O(l) Вопрос 7.3 | Страница 46
Сбалансируйте уравнение пошагово.
Ag(s) + HCl(водн.) → AgCl ↓+ H 2 ↑
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 7.4 | Страница 46
Сбалансируйте уравнение пошагово.
NaOH(водн.) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + H 2 O(л)
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 8. 1 | Страница 46
1 | Страница 46
Определите эндотермическую и экзотермическую реакцию.
HCl + NaOH → NaCl + H 2 O + тепло
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 8.2 | Страница 46
Определите эндотермическую и экзотермическую реакцию.
\[\ce{2KClO_{3(s)}->[\Delta] 2KCl_{(s)} + 3O2}\]
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 8.3 | Страница 46
Определите эндотермическую и экзотермическую реакцию.
\[\ce{CaO + h3O -> Ca(OH)2 + Heat}\]
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 8.4 | Страница 46
Определите эндотермическую и экзотермическую реакцию.
\[\ce{CaCO_{3(s)}->[\Delta] CaO_{(s)} + CO2}\]
ПОСМОТРЕТЬ РЕШЕНИЕ
Упражнения | Вопрос 9 | Страница 46
| Реагенты | Продукты | Тип химической реакции |
| BaCl 2 ( a q) + ZnSO 4 ( a q) | H 2 CO 3 (водный) | Рабочий объем |
| 2AgCl(s) | FeSO 4 (водн. |

 ru
ru Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
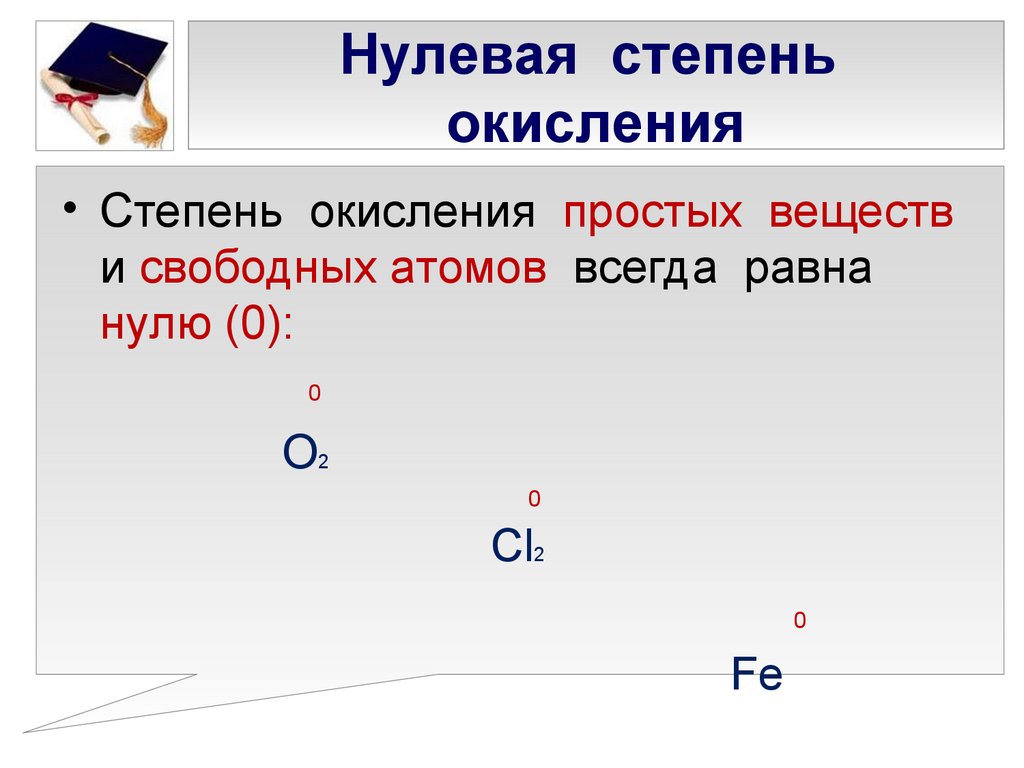
 В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди Cu(OH) 2 , синий осадок.
В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди Cu(OH) 2 , синий осадок. ) + Zn (тв.) —> Cu (тв.) + Zn 2+ (водн.) + 6 H 2 O ( тел.)
) + Zn (тв.) —> Cu (тв.) + Zn 2+ (водн.) + 6 H 2 O ( тел.)
 Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, к ложному синему цвету на лакмусовой бумаге. Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавленные 0036 — идут на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим, чтобы вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, к ложному синему цвету на лакмусовой бумаге. Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавленные 0036 — идут на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим, чтобы вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет. Кипячение делает черный CuO настолько мелким, что этап фильтрации становится чрезмерно долгим. Нагревайте химический стакан до тех пор, пока весь синий Cu(OH) 2 не исчезнет и не заменится черным CuO.
Кипячение делает черный CuO настолько мелким, что этап фильтрации становится чрезмерно долгим. Нагревайте химический стакан до тех пор, пока весь синий Cu(OH) 2 не исчезнет и не заменится черным CuO.
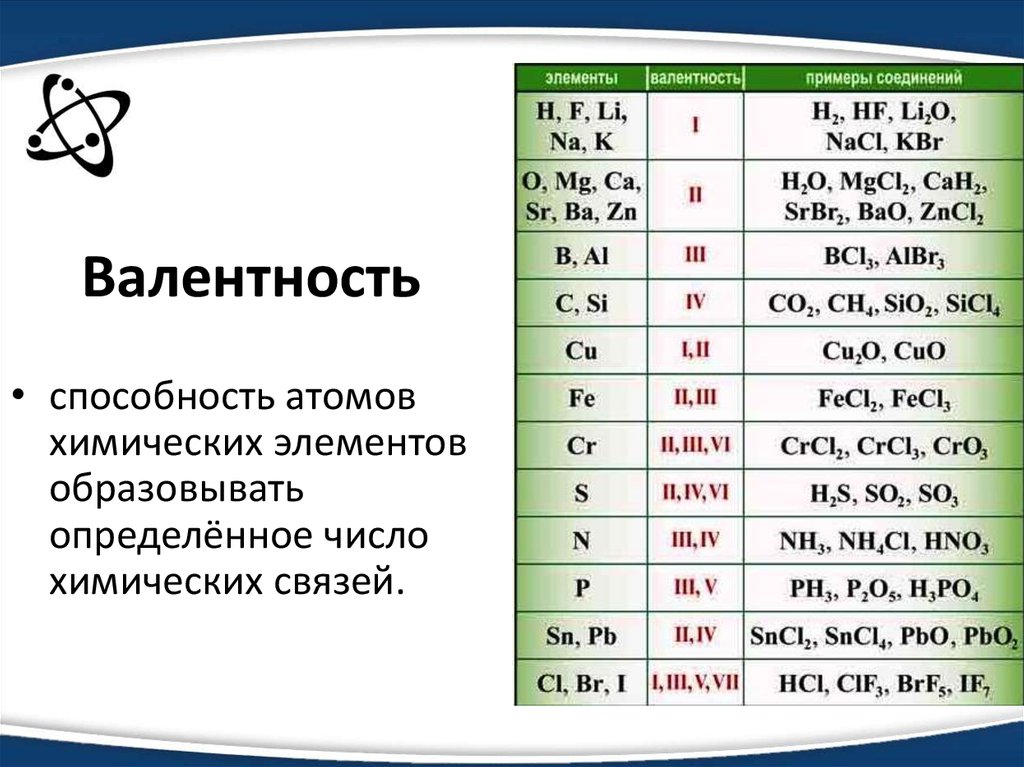 Однако эти 3 формы гидратов нерастворимы в органических растворителях, таких как этилацетат.
Однако эти 3 формы гидратов нерастворимы в органических растворителях, таких как этилацетат.

 Однако эти 3 формы гидратов нерастворимы в органических растворителях, таких как этилацетат.
Однако эти 3 формы гидратов нерастворимы в органических растворителях, таких как этилацетат.
 е.?
е.? хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Эрик Т. Уэллетт, Джулиан С. Магдаленски, Роберт Г. Бергман, Джон Арнольд
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Эрик Т. Уэллетт, Джулиан С. Магдаленски, Роберт Г. Бергман, Джон Арнольд хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Бо Лю, Юньхоу Сунь, Лян Чен, Бин Ляо, Цзиньлу Жуань, Лэйдан Чжоу, Ян Ли, Сяопин Оуян
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Бо Лю, Юньхоу Сунь, Лян Чен, Бин Ляо, Цзиньлу Жуань, Лэйдан Чжоу, Ян Ли, Сяопин Оуян хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Цзыцин Лю, Бяо Сюн, Инсян Дун, Инь Нин, Дэн Ли
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Цзыцин Лю, Бяо Сюн, Инсян Дун, Инь Нин, Дэн Ли хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Qiuxia Wang, Tong Li, Suxia Yan, Wenjie Zhang, Guoai Lv, Hui Xu, Huaming Li, Yong Wang, Junfeng Liu
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Qiuxia Wang, Tong Li, Suxia Yan, Wenjie Zhang, Guoai Lv, Hui Xu, Huaming Li, Yong Wang, Junfeng Liu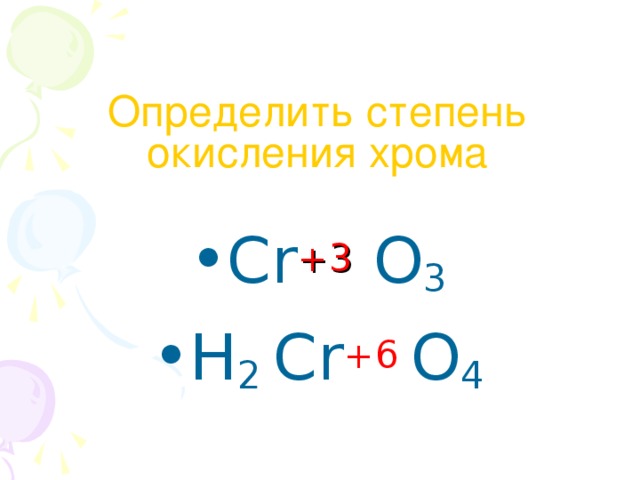 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Мирослав Ильяш, Валерия Першина
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Мирослав Ильяш, Валерия Першина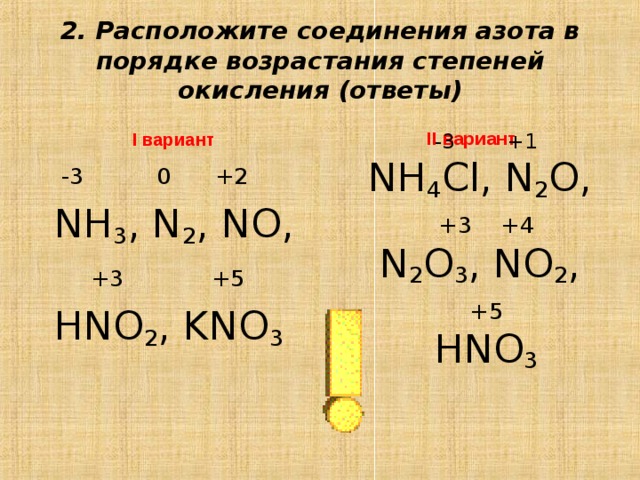 хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Артур С. Ребер, Турбасу Сенгупта, Динеш Биста, Шив Н. Кханна
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Артур С. Ребер, Турбасу Сенгупта, Динеш Биста, Шив Н. Кханна хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Майя Кумари, Кришненду Дей, Судип Кумар Бера, Гутам Кумар Лахири
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Майя Кумари, Кришненду Дей, Судип Кумар Бера, Гутам Кумар Лахири хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Ке Ван, Тен-Фей Чжэн, Цзин-Лин Чен, Хе-Руй Вен, Суй-Юнь Лю, Тонг-Лян Ху
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Ке Ван, Тен-Фей Чжэн, Цзин-Лин Чен, Хе-Руй Вен, Суй-Юнь Лю, Тонг-Лян Ху хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Ицзин Ван, Лихуа Дун, Хао Су, Юнцзюнь Лю
хим. (ЕСЛИ 5.436)
Дата публикации : 23 сентября 2022 г.
Ицзин Ван, Лихуа Дун, Хао Су, Юнцзюнь Лю хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Ирина Сергеевна Алиярова, Елена Ю. Тупикина, Наталья Сергеевна Солдатова, Даниил Михайлович Иванов, Павел Сергеевич Постников, Мехман Юсубов, Вадим Ю. Кукушкин
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Ирина Сергеевна Алиярова, Елена Ю. Тупикина, Наталья Сергеевна Солдатова, Даниил Михайлович Иванов, Павел Сергеевич Постников, Мехман Юсубов, Вадим Ю. Кукушкин хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Хуан Чен, Лэй Шао, Сюй Чжай, Юй Фу
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Хуан Чен, Лэй Шао, Сюй Чжай, Юй Фу хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Саманта Ядав, Раджив Гупта
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Саманта Ядав, Раджив Гупта хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Ингер-Эмма Нилунд, Нора Статле Лёндал, Джулиан Уокер, Пер Эрик Вуллум, Мари-Энн Эйнарсруд, Тор Гранде
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Ингер-Эмма Нилунд, Нора Статле Лёндал, Джулиан Уокер, Пер Эрик Вуллум, Мари-Энн Эйнарсруд, Тор Гранде хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Дандан Чен, Линьша Вэй, Ихан Юй, Лэй Чжао, Цюхун Сунь, Ченг Хань, Цзяньмей Лу, Хуагуй Ни, Ли-Сюн Шао, Цзиньцзе Цянь, Чжи Ян
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Дандан Чен, Линьша Вэй, Ихан Юй, Лэй Чжао, Цюхун Сунь, Ченг Хань, Цзяньмей Лу, Хуагуй Ни, Ли-Сюн Шао, Цзиньцзе Цянь, Чжи Ян хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Бинлин Яо, И-Цюань Чжан, И-Фей Дэн, Тяньрань Ли, Юань-Чжу Чжан
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Бинлин Яо, И-Цюань Чжан, И-Фей Дэн, Тяньрань Ли, Юань-Чжу Чжан хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Нан Су, Дацян Чжу, Пингфан Чжан, Юхай Фан, Юйсян Чен, Чжэнь Фан, Сянтун Чжоу, Чунмей Ли, Хунцзюнь Дун
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Нан Су, Дацян Чжу, Пингфан Чжан, Юхай Фан, Юйсян Чен, Чжэнь Фан, Сянтун Чжоу, Чунмей Ли, Хунцзюнь Дун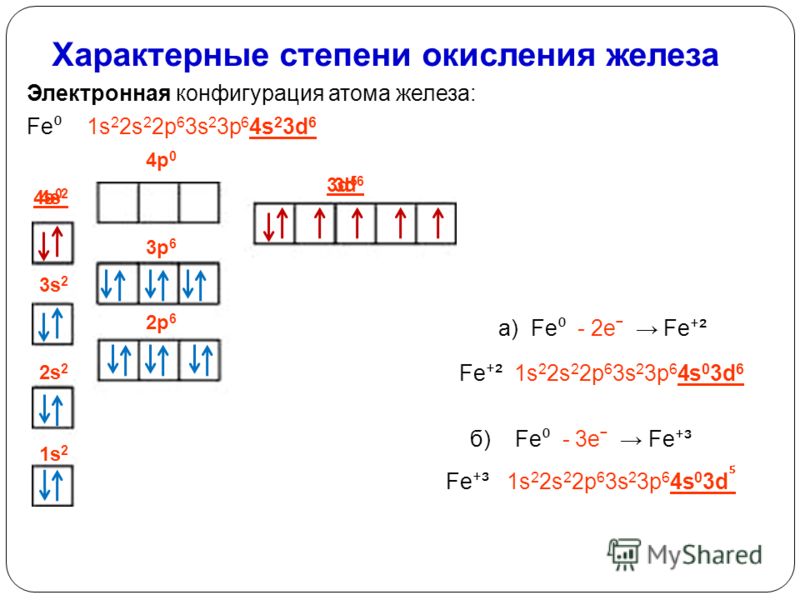 хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Гоцин Тянь, Цзинь-Фа Чен, Кай Чжан, Яфэй Ши, Чэнлун Ли, Сяодун Инь, Канглей Лю, Панкуан Чен
хим. (ЕСЛИ 5.436)
Дата публикации : 2022-09-22
Гоцин Тянь, Цзинь-Фа Чен, Кай Чжан, Яфэй Ши, Чэнлун Ли, Сяодун Инь, Канглей Лю, Панкуан Чен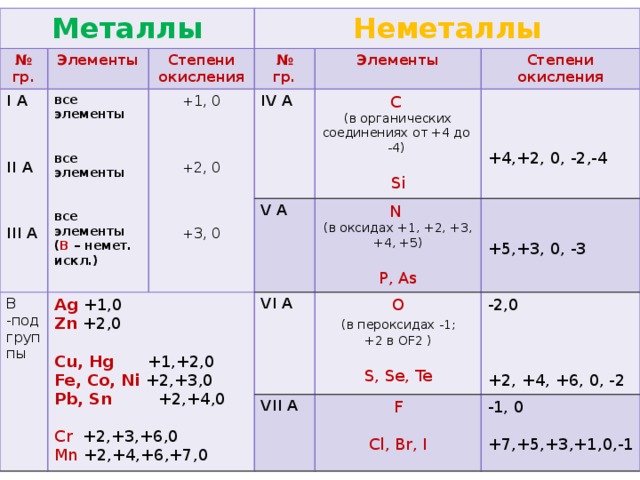 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Хэ-Ди Ян, Шэн-Хуа Чжоу, Мао-Инь Ран, Синь-Тао Ву, Хуа Линь, Ци-Лун Чжу
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Хэ-Ди Ян, Шэн-Хуа Чжоу, Мао-Инь Ран, Синь-Тао Ву, Хуа Линь, Ци-Лун Чжу хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Миронова Ольга Александровна, Сухих Таисия Сергеевна, Конченко Сергей Николаевич, Пушкаревский Николай Александрович
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Миронова Ольга Александровна, Сухих Таисия Сергеевна, Конченко Сергей Николаевич, Пушкаревский Николай Александрович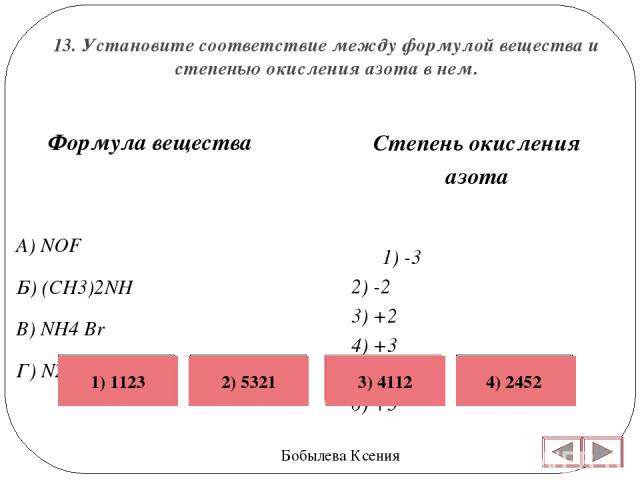 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Катажина Федорук, Давид Дроздовски, Мирослав Мачка, Ян К. Зареба, Дагмара Стефаньска, Анна Гагор, Адам Серадзки
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Катажина Федорук, Давид Дроздовски, Мирослав Мачка, Ян К. Зареба, Дагмара Стефаньска, Анна Гагор, Адам Серадзки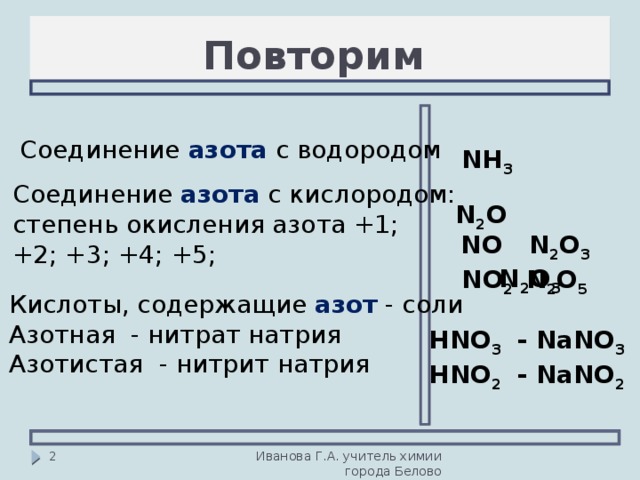 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Александр Фальк, Джонатан О. Бауэр
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Александр Фальк, Джонатан О. Бауэр хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Матье Отилло, Ричард Э. Уилсон, Моника Василиу, Габриэль Ф. де Мело, Дэвид А. Диксон
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Матье Отилло, Ричард Э. Уилсон, Моника Василиу, Габриэль Ф. де Мело, Дэвид А. Диксон хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Дзюнъити Янагисава, Кёсукэ Танака, Хидэаки Кано, Киёси Мията, Бенджамин Ле Оуэ, Рё Отани, Масааки Оба
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Дзюнъити Янагисава, Кёсукэ Танака, Хидэаки Кано, Киёси Мията, Бенджамин Ле Оуэ, Рё Отани, Масааки Оба хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Литон Сейх, Санчайта Дей, Суман Дхара, Адити Сингх, Гутам Кумар Лахири
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Литон Сейх, Санчайта Дей, Суман Дхара, Адити Сингх, Гутам Кумар Лахири хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Ришу Хурана, доктор медицины Эхесан Али
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Ришу Хурана, доктор медицины Эхесан Али хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Кадзуки Накая, Синтаро Такахаши, Акихико Исии, Норио Наката
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Кадзуки Накая, Синтаро Такахаши, Акихико Исии, Норио Наката
 хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Ю Ши, Кайхан Хань, Фаген Ван
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Ю Ши, Кайхан Хань, Фаген Ван хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Цинь Хуан, Жуй Чжан, Ли-Хуа Хэ, Цзин-Лин Чен, Фэн Чжао, Суй-Цзюнь Лю, Хэ-Руй Вэнь
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Цинь Хуан, Жуй Чжан, Ли-Хуа Хэ, Цзин-Лин Чен, Фэн Чжао, Суй-Цзюнь Лю, Хэ-Руй Вэнь хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Чжэинг Сюй, Пардип К. Тхакур, Тиен-Лин Ли, Анна Регуц, Эммануэль Суар, Инес Пуэнте-Оренч, Майкл А. Хейворд
хим. (ЕСЛИ 5.436)
Дата публикации : 21 сентября 2022 г.
Чжэинг Сюй, Пардип К. Тхакур, Тиен-Лин Ли, Анна Регуц, Эммануэль Суар, Инес Пуэнте-Оренч, Майкл А. Хейворд хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Пэн Ван, Майерхаба Абудурехеман, Кеванг Чжан, Хуанцзюань Чжэн, Чжаохуэй Чен, Ци Ву
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Пэн Ван, Майерхаба Абудурехеман, Кеванг Чжан, Хуанцзюань Чжэн, Чжаохуэй Чен, Ци Ву хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Чжилей Суй, Джунке Ван, Да Хуан, Сянци Ван, Ручэн Дай, Чжунпин Ван, Сяньсюй Чжэн, Цзэнмин Чжан, Цян Ву
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Чжилей Суй, Джунке Ван, Да Хуан, Сянци Ван, Ручэн Дай, Чжунпин Ван, Сяньсюй Чжэн, Цзэнмин Чжан, Цян Ву хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Шуи Линь, Мэйлин Сюй, Ивэй Лян, Сюаньхао Юань, Имин Чжан, Фэйлун Ван, Цзянь Хао, Иньвэй Ли
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Шуи Линь, Мэйлин Сюй, Ивэй Лян, Сюаньхао Юань, Имин Чжан, Фэйлун Ван, Цзянь Хао, Иньвэй Ли хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Тим Рисебек, Мария-Софи Бертрамс, Сергей Стипурин, Кай Коновски, Кристоф Керциг, Томас Штрасснер
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Тим Рисебек, Мария-Софи Бертрамс, Сергей Стипурин, Кай Коновски, Кристоф Керциг, Томас Штрасснер хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Иоганн Толбатов, Лориано Сторки, Алессандро Марроне
хим. (ЕСЛИ 5.436)
Дата публикации : 20 сентября 2022 г.
Иоганн Толбатов, Лориано Сторки, Алессандро Марроне хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Питер Л. Данн, Мелисса Барона, Саманта И. Джонсон, Симона Раугей, Р. Моррис Буллок
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Питер Л. Данн, Мелисса Барона, Саманта И. Джонсон, Симона Раугей, Р. Моррис Буллок хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Квентин Гейдон, Дэвид Скотт Боле
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Квентин Гейдон, Дэвид Скотт Боле хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Максим Дельпорт, Жюли Кавайес, Микаэль Мартин Ромо-и-Моралес, Николя Бион, Лука Нодари, Ксавье Куртуа, Фабьен Кан, Хелена Капер
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Максим Дельпорт, Жюли Кавайес, Микаэль Мартин Ромо-и-Моралес, Николя Бион, Лука Нодари, Ксавье Куртуа, Фабьен Кан, Хелена Капер хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ашутош Шривастава, Рама Мохана Рао Думпала, Пранав Кумар, Рави Кумар, Нитика Рават
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ашутош Шривастава, Рама Мохана Рао Думпала, Пранав Кумар, Рави Кумар, Нитика Рават хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ян Тан, Ли-Пин Дин, Си-Лун Доу, Пэн Шао, Го-Дун Вэй, И-Цзинь Го, Цзя-Хао Цзэн
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ян Тан, Ли-Пин Дин, Си-Лун Доу, Пэн Шао, Го-Дун Вэй, И-Цзинь Го, Цзя-Хао Цзэн хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ван Сяо-Хуэй, Ван Чжэн-Мин, Хун Цин-Лин, Чжан Зе-Нонг, Фэн Ши, Ли Дун-Шэн, Шу-Ни Ли, Ю Чен
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ван Сяо-Хуэй, Ван Чжэн-Мин, Хун Цин-Лин, Чжан Зе-Нонг, Фэн Ши, Ли Дун-Шэн, Шу-Ни Ли, Ю Чен хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.Бандхана Деви, Ахил Бхардвадж, Дикша Гамбхир, Бисваджит Рой, Анирбан Кармакар, Гураб Дей, Анудж Джайн, Бхаскар Мондал, Рик Рани Конер
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.Бандхана Деви, Ахил Бхардвадж, Дикша Гамбхир, Бисваджит Рой, Анирбан Кармакар, Гураб Дей, Анудж Джайн, Бхаскар Мондал, Рик Рани Конер хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ин-Цзе Цзя, Синюй Чжан, И-Ган Чен, Синсин Цзян, Цзя-Нэн Сун, Чжешуай Линь, Сянь-Мин Чжан
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Ин-Цзе Цзя, Синюй Чжан, И-Ган Чен, Синсин Цзян, Цзя-Нэн Сун, Чжешуай Линь, Сянь-Мин Чжан хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Джо В. Хэддок, Зак Дж. Бартон, Кеке Фенг, Райан Э. Баумбах, Цян Чжан, Сьюзен Э. Латтернер
хим. (ЕСЛИ 5.436)
Дата публикации : 19 сентября 2022 г.
Джо В. Хэддок, Зак Дж. Бартон, Кеке Фенг, Райан Э. Баумбах, Цян Чжан, Сьюзен Э. Латтернер хим. (ЕСЛИ 5.436)
Дата публикации : 18 сентября 2022 г.
Яо Цзоу, Цзянь-Хуэй Лань, Ли-Юн Юань, Конг-Чжи Ван, Цюнь-Ян Ву, Чжи-Фан Чай, Пэн Жэнь, Вэй-Цюнь Ши
хим. (ЕСЛИ 5.436)
Дата публикации : 18 сентября 2022 г.
Яо Цзоу, Цзянь-Хуэй Лань, Ли-Юн Юань, Конг-Чжи Ван, Цюнь-Ян Ву, Чжи-Фан Чай, Пэн Жэнь, Вэй-Цюнь Ши хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Деспоина Андриоту, Сильвен Дюваль, Кристоф Фолькрингер, Анхель М. Аревало-Лопес, Пардис Симон, Эрве Везен, Тьерри Луазо
хим. (ЕСЛИ 5.436)
Дата публикации : 16 сентября 2022 г.
Деспоина Андриоту, Сильвен Дюваль, Кристоф Фолькрингер, Анхель М. Аревало-Лопес, Пардис Симон, Эрве Везен, Тьерри Луазо