Как рассчитывается степень окисления h4po4? с объяснением пожалуйста(что на что умножать/делить) , буду крайне благодарен — Школьные Знания.net
Все предметы
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Информатика
Українська література
Қазақ тiлi
Экономика
Музыка
Беларуская мова
Французский язык
Немецкий язык
Психология
Оʻzbek tili
Кыргыз тили
Астрономия
Физкультура и спорт
Ответ дан
dedinsaid48
Объяснение:
ну смотри у водорода (H) степень окисления всегда +1 а в этой кислоте у тебя 3 водорода следовательно у водорода степень окисления +3;
у кислорода (О) степень окисления -2 а в этой формуле его, 4 значит степень окисления кислорода -8 остаётся посчитать фосфор очень простым способом что бы в сумме этой кислоты степень фосфора была равна +5.
Ответ дан
gorbov1998
молекула в сумме нейтральна
в этой молекуле три H, один P и четыре O.
у некоторых элементов есть постоянные степени окисления, их нужно выучить — они на фото в прикрепленных
то есть у H всегда заряд +1
у O заряд всегда -2
в этой молекуле три H, один P и четыре O, заряд P мы не знаем и обозначим за х, а молекула нейтральна поэтому к нулю приравниваем
3*(+1) + 1*(х) + 4*(-2)=0
решаем уравнение
3+х-8=0
х=+5
то есть заряд (=степень окисления) P в этой формуле +5.
Белорусский государственный университет транспорта — БелГУТ (БИИЖТ)
Как поступить в БелГУТ
Как получить место
в общежитии БелГУТа
Как поступить иностранному гражданину
События
Все события
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
1 | ||||||
2 | 3 | 4 | 5 Дата : 2023-01-05 | 6 | 7 | 8 |
9 | 10 | 11 | 12 | 13 | 14 | 15 |
16 | 17 | 18 | 19 | 20 | 21 | 22 |
23 | 24 | 25 | 26 | 27 | 28 | 29 |
30 | 31 | |||||
Все анонсы
- 2023 год объявлен Годом мира и созидания.

- Поздравление Президента Республики Беларусь…
- Поздравление с Новым годом Председателя Совета Рес…
- С Новым годом и Рождеством!
- Студсовет поздравляет с Новым Годом!…
- Выпуск магистров заочной формы обучения…
- 2-й этап репетиционного тестирования…
- V Международная научно-практическая конференция «Н…
- IX Международная научно-техническая конференция ма…
- Смотр-конкурс на лучшее праздничное Новогоднее и Р…
Анонсы
Университет
Абитуриентам
Студентам
Конференции
Приглашения
2023 год объявлен Годом мира и созидания…
Поздравление Президента Республики Беларусь…
Поздравление с Новым годом Председателя Совета Рес…
С Новым годом и Рождеством!
Новости
Университет
Международные связи
Спорт
Воспитательная работа
Жизнь студентов
Новости подразделений
- Воспитательная работа
Волшебство на Рождество в центре дневного пребывания инвалидов «Майски.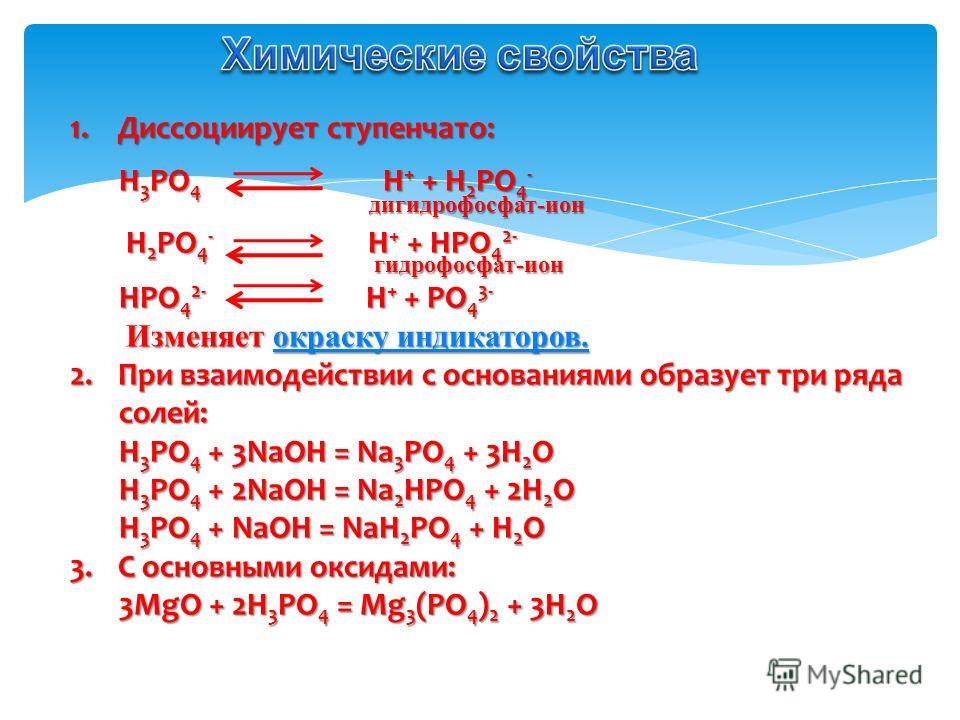 ..
..
06 января 2023
- Воспитательная работа
Встреча с иностранными студентами в студенческом городке…
06 января 2023
- Университет
Торжественный выпуск магистров 2023
05 января 2023
- Воспитательная работа
Предрождественский снег и «Чистый четверг»…
- Студенческая жизнь
Новогодняя программа на площади Ленина от БРСМ БелГУТа…
04 января 2023
- Воспитательная работа
«Чудеса на Рождество» от БРСМ БелГУТа
04 января 2023
- Университет
Олимпиада на лучшее знание «Правил технической эксплуатации железной д. ..
..
04 января 2023
- Воспитательная работа
В день рождения ветерана
03 января 2023
- Университет
Совершенствование технологии работы железнодорожной станции один из сп…
03 января 2023
Другие новости
- Победители конкурса к 160-летию Белорусской железной дороги…
- Конкурс стартап-проектов по альтернативной энергетике 2022…
- Диалоговая площадка «100 лет со Дня образования СССР: история, создани…
- Время подвести итоги года…
- Итоги смотра-конкурса на лучшее праздничное оформление помещений струк…
- С наступающим! Творчество наших сотрудников…
- Участие в олимпиаде по бухгалтерскому учету с творческим уклоном…
- Новый номер газеты «Вести БелГУТа»
- GR Studio поздравляет с Новым годом
- Итоги олимпиады на знание экономики студентами технических специальнос.
 ..
.. - Проект «Молодежная смена 2022»
КУДА ПОСТУПАТЬ
Все факультеты
БелГУТ на Доске почета
Достижения университета
Предложения
Все предложения
Видеотека
Все видео
Фотогалерея
Все фото
Выявление роли фосфорной кислоты в полностью ванадиевых окислительно-восстановительных батареях с помощью расчетов DFT и анализа на месте
Выявление роли фосфорной кислоты в полностью ванадиевых окислительно-восстановительных батареях с помощью расчетов DFT и анализа
in situ † Фабио Йонас
Ольденбург, ‡ и Марта
Бон, § б Даниэле
Перего, и Даниэла
Полино, с Теодоро
Лайно, д Лоренц
Гублер
* и и
Томас Дж. Шмидт аб
Шмидт аб
Принадлежности автора
* Соответствующие авторы
и Лаборатория электрохимии, Институт Пауля Шеррера, 5232 Villigen PSI, Швейцария
Электронная почта: [email protected]
б Лаборатория физической химии, Цюрих, 8093 Цюрих, Швейцария
с Кафедра химии и прикладных биологических наук, ETH Zurich, c/o USI Campus, Via Giuseppe Buffi 13, 6900 Лугано, Швейцария
д IBM Research-Zurich, Saumerstrasse, 8, 8803 Rueschlikon, Швейцария
Аннотация
rsc.org/schema/rscart38″> В настоящей работе предлагается использование смешанного электролита на водной основе, содержащего серную и фосфорную кислоты, как для отрицательного, так и для положительного электролитов проточной ванадиевой окислительно-восстановительной батареи. Расчетные и экспериментальные исследования позволяют понять возможные взаимодействия между ионами ванадия во всех степенях окисления и ионами сульфата, бисульфата, дигидрофосфата и фосфорной кислоты. На месте циклические эксперименты и измерения ион-специфического электрохимического импеданса подтвердили значительное снижение сопротивления переносу заряда для восстановления ионов V( III ) и, следовательно, увеличение гальванической эффективности, связанное с отрицательной стороной батареи. Это увеличение производительности связано с комплексообразованием этой степени окисления фосфорной кислотой. До сих пор смешанные кислоты в основном обсуждались с акцентом на растворимость V( V ). В этой работе мы рационализируем влияние смешанных кислот на электрохимическую эффективность, открывая новые стратегии улучшения характеристик циклирования с помощью ионных добавок.
В этой работе мы рационализируем влияние смешанных кислот на электрохимическую эффективность, открывая новые стратегии улучшения характеристик циклирования с помощью ионных добавок.электрохимия — Почему HNO3 более сильный окислитель, чем h4PO4?
спросил
Изменено 1 год, 7 месяцев назад
Просмотрено 20 тысяч раз
$\begingroup$
Почему $\ce{HNO3}$ является более сильным окислителем, чем $\ce{h4PO4}$? $\ce{N}$ и $\ce{P}$ имеют одинаковую степень окисления. Это разница в электроотрицательности между $\ce{N}$ и $\ce{P}$?
- электрохимия
- редокс
- пниктоген
$\endgroup$
3
$\begingroup$
Сначала я создам фон.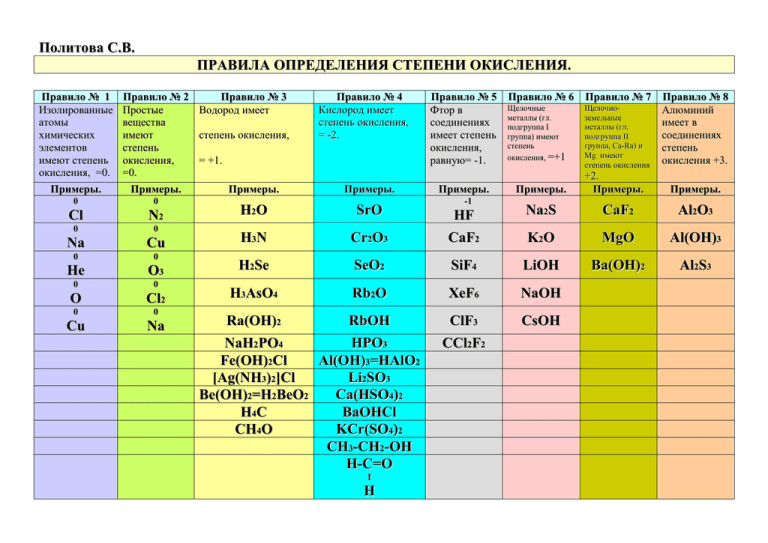 Окислители — это химические вещества, которые помогают чему-то другому окисляться и сами восстанавливаются (уменьшение заряда) 9.0035
Окислители — это химические вещества, которые помогают чему-то другому окисляться и сами восстанавливаются (уменьшение заряда) 9.0035
$\ce{N}$ в $\ce{HNO3}$ находится в степени окисления +5 — откуда мы это знаем? $\ce{H}$ равно +1, $\ce{O}$ равно -2, а суммарный заряд $\ce{HNO3}$ равен нулю. То же самое касается $\ce{h4PO4}$, что приводит к степени окисления +5 $\ce{P}$.
Что +5 является самой высокой распространенной степенью окисления для $\ce{N}$. Если $\ce{N}$ уменьшить до +4, как в $\ce{NO2}$, или +2 в $\ce{NO}$, его заряд уменьшится, и поэтому $\ce{N}$ станет окислитель для этой конкретной реакции
Таким образом, $\ce{HNO3}$ является сильным окислителем, поскольку $\ce{N}$ легко восстанавливается.
Но $\ce{h4PO4}$ — плохой окислитель. Вот две основные причины:
Азот не имеет $d$-орбиталей в валентной оболочке, поэтому его ковалентность ограничена 4. Однако $\ce{N}$ может достигать формальной степени окисления +5, как в ион $\ce{NO3-}$.
 Неспособность $\ce{N}$ распарывать и продвигать свой $2s$-электрон приводит к тому, что $\ce{N(+5)}$ менее стабилен, чем $\ce{N(+3)}$. Однако $\ce{P(+5)}$ более стабилен, чем $\ce{P(+3)}$, а фосфорная кислота проявляет меньшие окислительные свойства.
Неспособность $\ce{N}$ распарывать и продвигать свой $2s$-электрон приводит к тому, что $\ce{N(+5)}$ менее стабилен, чем $\ce{N(+3)}$. Однако $\ce{P(+5)}$ более стабилен, чем $\ce{P(+3)}$, а фосфорная кислота проявляет меньшие окислительные свойства.Сродство фосфора к кислороду больше, чем азота; в результате фосфоновая кислота ($\ce{h4PO3}$) является хорошим восстановителем.
$\ce{h4PO4 + 2H+ + 2e-> h4PO3 + h3O}$; $E=-0,276 \ce{V}$
$\endgroup$
2
$\begingroup$
Frost Diagrams также очень хорошо объясняют это. Посмотрите на соотношение G/F = zE/V, очень положительное для HNO3, что делает его сильным окислителем (гораздо менее стабильным). h4PO4 в основном полная противоположность.
$\endgroup$
$\begingroup$
Самое простое объяснение заключается в электроотрицательности. N более электроотрицательный, чем P. И общая тенденция такова, что чем более электроотрицательным является элемент, тем более нестабильным он является в высоких степенях окисления. А поскольку сильные окислители обычно нестабильны, можно предположить, что азотная кислота является более сильным окислителем, чем фосфорная кислота.
N более электроотрицательный, чем P. И общая тенденция такова, что чем более электроотрицательным является элемент, тем более нестабильным он является в высоких степенях окисления. А поскольку сильные окислители обычно нестабильны, можно предположить, что азотная кислота является более сильным окислителем, чем фосфорная кислота.
Однако, чтобы правильно ответить на ваш вопрос, необходимо учитывать относительную стабильность окисленного и восстановленного состояния агента. И тогда может вступить в игру множество различных соображений. Например, азотная кислота выделяет газ NO, что дает энтропийный вклад, которого нет у фосфорной кислоты.
Хотя спорить с электроотрицательностью просто, это может быть полезно во многих случаях. Например, материалы высоковольтных катодов для литий-ионных аккумуляторов зависят от электроотрицательных d-металлов, таких как Ni и Co. Это связано с тем, что хороший литий-ионный катод должен быть сильным окислителем.
$\endgroup$
$\begingroup$
Проще говоря, в структуре Льюиса азотной кислоты атом азота имеет формальный заряд +1, тогда как в случае ортофосфорной кислоты формальный заряд фосфора отсутствует.
Азот, будучи электроотрицательным элементом, не может нести положительный заряд и поэтому притягивает электроны от другого вещества, с которым он реагирует.
Также обратите внимание, что азот азотной кислоты гибридизуется sp2, а фосфор ортофосфорной кислоты гибридизуется sp3, что означает, что азот более электроотрицательный (плотность заряда, притягивающего электроны, увеличивается с увеличением участия s-орбиты), таким образом, из-за положительного заряда и sp2-гибрида. Природа HNO3 является более сильным окислителем, чем h4PO4, несмотря на то, что они оба имеют одинаковую степень окисления. По моему личному мнению, если кто-то просто говорит, что HNO3 является более сильным окислителем, просто потому, что азот более электроотрицательный, чем фосфор — это не очень хороший ответ на том основании, что азотистая кислота (HNO2) не является более сильным окислителем, чем h4PO4, несмотря на то, что азот более электроотрицателен, чем фосфор; здесь, принимая во внимание структуру Льюиса HNO2, мы находим, что N не несет формального заряда с sp2-гибридизацией, более того, он проявляет меньшую степень окисления, чем P h4PO4.


 ..
.. Неспособность $\ce{N}$ распарывать и продвигать свой $2s$-электрон приводит к тому, что $\ce{N(+5)}$ менее стабилен, чем $\ce{N(+3)}$. Однако $\ce{P(+5)}$ более стабилен, чем $\ce{P(+3)}$, а фосфорная кислота проявляет меньшие окислительные свойства.
Неспособность $\ce{N}$ распарывать и продвигать свой $2s$-электрон приводит к тому, что $\ce{N(+5)}$ менее стабилен, чем $\ce{N(+3)}$. Однако $\ce{P(+5)}$ более стабилен, чем $\ce{P(+3)}$, а фосфорная кислота проявляет меньшие окислительные свойства.